Karbon - Carbon
 Grafit (solda) ve elmas (sağda), iki karbon allotropu | ||||||||||||||||||||||||||
| Karbon | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allotroplar | grafit, elmas, diğerleri | |||||||||||||||||||||||||
| Görünüm |
| |||||||||||||||||||||||||
| Standart atom ağırlığı Birr, std(C) | [12.0096, 12.0116] Konvansiyonel:12.011 | |||||||||||||||||||||||||
| İçindeki karbon periyodik tablo | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Atomik numara (Z) | 6 | |||||||||||||||||||||||||
| Grup | grup 14 (karbon grubu) | |||||||||||||||||||||||||
| Periyot | dönem 2 | |||||||||||||||||||||||||
| Blok | p bloğu | |||||||||||||||||||||||||
| Eleman kategorisi | Reaktif ametal, bazen bir metaloid | |||||||||||||||||||||||||
| Elektron konfigürasyonu | [O ] 2s2 2p2 | |||||||||||||||||||||||||
| Kabuk başına elektron | 2, 4 | |||||||||||||||||||||||||
| Fiziki ozellikleri | ||||||||||||||||||||||||||
| Evre -deSTP | katı | |||||||||||||||||||||||||
| Süblimasyon noktası | 3915 K (3642 ° C, 6588 ° F) | |||||||||||||||||||||||||
| Yoğunluk (yakınr.t.) | amorf: 1,8–2,1 g / cm3[1] grafit: 2.267 g / cm3 elmas: 3.515 g / cm3 | |||||||||||||||||||||||||
| Üçlü nokta | 4600 K, 10.800 kPa[2][3] | |||||||||||||||||||||||||
| Füzyon ısısı | grafit: 117kJ / mol | |||||||||||||||||||||||||
| Molar ısı kapasitesi | grafit: 8.517 J / (mol · K) elmas: 6.155 J / (mol · K) | |||||||||||||||||||||||||
| Atomik özellikler | ||||||||||||||||||||||||||
| Oksidasyon durumları | −4, −3, −2, −1, 0, +1,[4] +2, +3,[5] +4[6] (hafif asidik oksit) | |||||||||||||||||||||||||
| Elektronegatiflik | Pauling ölçeği: 2.55 | |||||||||||||||||||||||||
| İyonlaşma enerjileri |
| |||||||||||||||||||||||||
| Kovalent yarıçap | sp3: 77 pm sp2: 73 pm sp: 69öğleden sonra | |||||||||||||||||||||||||
| Van der Waals yarıçapı | 170 pm | |||||||||||||||||||||||||
| Diğer özellikler | ||||||||||||||||||||||||||
| Doğal olay | ilkel | |||||||||||||||||||||||||
| Kristal yapı | grafit:basit altıgen (siyah) | |||||||||||||||||||||||||
| Kristal yapı | elmas:yüz merkezli elmas kübik (açık) | |||||||||||||||||||||||||
| Sesin hızı ince çubuk | elmas: 18,350 m / s (20 ° C'de) | |||||||||||||||||||||||||
| Termal Genleşme | elmas: 0,8 µm / (m · K) (25 ° C'de)[7] | |||||||||||||||||||||||||
| Termal iletkenlik | grafit: 119–165 W / (m · K) elmas: 900–2300 W / (m · K) | |||||||||||||||||||||||||
| Elektriksel direnç | grafit: 7,837 µΩ · m[8] | |||||||||||||||||||||||||
| Manyetik sıralama | diyamanyetik[9] | |||||||||||||||||||||||||
| Manyetik alınganlık | −5.9·10−6 (grafik) cm3/ mol[10] | |||||||||||||||||||||||||
| Gencin modülü | elmas: 1050 GPa[7] | |||||||||||||||||||||||||
| Kayma modülü | elmas: 478 GPa[7] | |||||||||||||||||||||||||
| Toplu modül | elmas: 442 GPa[7] | |||||||||||||||||||||||||
| Poisson oranı | elmas: 0.1[7] | |||||||||||||||||||||||||
| Mohs sertliği | grafit: 1–2 elmas: 10 | |||||||||||||||||||||||||
| CAS numarası |
| |||||||||||||||||||||||||
| Tarih | ||||||||||||||||||||||||||
| Keşif | Mısırlılar ve Sümerler[11] (MÖ 3750) | |||||||||||||||||||||||||
| Tarafından bir unsur olarak tanındı | Antoine Lavoisier[12] (1789) | |||||||||||||||||||||||||
| Ana karbon izotopları | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
Karbon (kimden Latince: karbonhidrat "kömür") bir kimyasal element ile sembol C ve atomik numara 6. Öyle metal olmayan ve dört değerlikli - dört yapmak elektronlar form için uygun kovalent Kimyasal bağlar. Periyodik tablonun 14. grubuna aittir.[13] Karbon, Dünya'nın kabuğunun yalnızca yüzde 0,025'ini oluşturur.[14] Üç izotoplar doğal yollarla oluşan, 12C ve 13C kararlı olmak 14C bir radyonüklid, ile çürüyen yarı ömür yaklaşık 5,730 yıldır.[15] Karbon, Antik çağlardan beri bilinen birkaç unsur.[16]
Karbon 15. sırada yerkabuğunda en bol bulunan element, ve Kütlece evrendeki en bol dördüncü element sonra hidrojen, helyum, ve oksijen. Karbonun bolluğu, benzersiz çeşitliliği organik bileşikler ve alışılmadık şekil verme yeteneği polimerler yaygın olarak karşılaşılan sıcaklıklarda Dünya bu öğenin ortak bir öğe olarak hizmet etmesini sağlar bilinen tüm hayat. En çok bulunan ikinci unsurdur. insan vücudu oksijenden sonra kütlece (yaklaşık% 18.5).[17]
Karbon atomları çeşitli şekillerde birbirine bağlanabilir ve sonuçta çeşitli karbon allotropları. En iyi bilinen allotroplar grafit, elmas, ve Buckminsterfullerene.[18] fiziki ozellikleri karbon miktarı, allotropik forma göre büyük ölçüde değişir. Örneğin grafit, opak ve siyah elmas ise çok şeffaf. Grafit, kağıt üzerinde bir çizgi oluşturacak kadar yumuşaktır (dolayısıyla adı, Yunan "yazmak" anlamına gelen "γράφειν" fiili), elmas ise en zor doğal olarak oluşan malzeme bilinmektedir. Grafit iyi bir elektrik iletkeni elmas düşükken elektiriksel iletkenlik. Normal şartlar altında elmas, karbon nanotüpler, ve grafen en yüksek olana sahip termal iletkenlikler nın-nin bilinen tüm malzemeler. Tüm karbon allotropları, normal koşullar altında katıdır, en çok grafittir. termodinamik olarak kararlı standart sıcaklık ve basınçta oluşur. Kimyasal olarak dirençlidirler ve oksijenle bile reaksiyona girmeleri için yüksek sıcaklık gerektirirler.
En genel paslanma durumu içindeki karbon inorganik bileşikler +4, +2 ise karbonmonoksit ve Geçiş metali karbonil kompleksler. En büyük inorganik karbon kaynakları şunlardır: kireçtaşları, dolomitler ve karbon dioksit, ancak önemli miktarlarda kömür, turba, sıvı yağ, ve metan klatratlar. Karbon çok sayıda Bileşikler, bugüne kadar açıklanan neredeyse on milyon bileşik ile diğer tüm elementlerden daha fazla,[19] ve yine de bu sayı, standart koşullar altında teorik olarak olası bileşiklerin sayısının sadece bir kısmıdır. Bu nedenle, karbon genellikle "elementlerin kralı" olarak anılır.[20]
Özellikler

karbon allotropları Dahil etmek grafit bilinen en yumuşak maddelerden biri ve elmas, doğal olarak oluşan en zor madde. O tahviller diğer küçüklerle kolayca atomlar, diğer karbon atomları dahil ve birden fazla kararlı oluşturabilir kovalent uygun multivalent atomlarla bağlar. Karbonun neredeyse on milyon bileşik oluşturduğu biliniyor, bunların büyük çoğunluğu kimyasal bileşikler.[19] Karbon aynı zamanda en yüksek süblimasyon tüm unsurların noktası. Şurada: atmosferik basınç erime noktası yoktur, çünkü üçlü nokta şurada 10.8±0,2 MPa ve 4,600 ± 300 K (4,330 ± 300 ° C; 7,820 ± 540 ° F),[2][3] bu nedenle yaklaşık 3,900 K (3,630 ° C; 6,560 ° F) 'de süblimleşir.[21][22] Grafit, delokalize olduğu için termodinamik olarak daha kararlı olmasına rağmen, standart koşullarda elmastan çok daha reaktiftir. pi sistemi saldırıya karşı çok daha savunmasızdır. Örneğin, grafit sıcak konsantre ile oksitlenebilir Nitrik asit standart koşullarda mellitik asit, C6(CO2H)6Daha büyük yapıyı parçalarken altıgen grafit birimlerini koruyan.[23]
Yaklaşık 5800 K (5.530 ° C veya 9.980 ° F) sıcaklığa sahip bir karbon arkında karbon süblimleşir. Bu nedenle, allotropik formuna bakılmaksızın, karbon, en yüksek erime noktalı metallerden daha yüksek sıcaklıklarda katı kalır. tungsten veya renyum. Termodinamik olarak eğilimli olmasına rağmen oksidasyon karbon, oksidasyona aşağıdaki gibi elementlerden daha etkili bir şekilde direnir Demir ve bakır, oda sıcaklığında daha zayıf indirgeyici maddelerdir.
Karbon, temel durumu olan altıncı elementtir elektron konfigürasyonu 1s22s22p2bunlardan dört dış elektron değerlik elektronları. İlk dört iyonlaşma enerjisi olan 1086.5, 2352.6, 4620.5 ve 6222.7 kJ / mol, daha ağır grup-14 elementlerinden çok daha yüksektir. Karbonun elektronegatifliği 2.5'tir, daha ağır grup-14 elementlerinden (1.8-1.9) önemli ölçüde daha yüksektir, ancak yakındaki ametallerin çoğuna ve ayrıca ikinci ve üçüncü sıraların bir kısmına yakındır. geçiş metalleri. Karbon kovalent yarıçaplar normalde 77,2 pm (C − C), 66,7 pm (C = C) ve 60,3 pm (C≡C) olarak alınır, ancak bunlar koordinasyon sayısına ve karbonun neye bağlı olduğuna bağlı olarak değişebilir. Genel olarak, kovalent yarıçap, daha düşük koordinasyon numarası ve daha yüksek bağ sırası ile azalır.[24]
Karbon bileşikleri, bilinen tüm yaşamın temelini oluşturur Dünya, ve karbon-nitrojen döngüsü tarafından üretilen enerjinin bir kısmını sağlar Güneş ve diğeri yıldızlar. Olağanüstü bir bileşik çeşitliliği oluşturmasına rağmen, çoğu karbon biçimi normal koşullar altında nispeten tepkisizdir. Standart sıcaklık ve basınçta, en güçlü oksitleyiciler hariç hepsine direnir. Tepki vermiyor sülfürik asit, hidroklorik asit, klor veya herhangi biri alkaliler. Yüksek sıcaklıklarda karbon, oksijen oluşturmak üzere karbon oksitler ve elemental metali bırakmak için metal oksitlerden oksijeni çalacaktır. Bu egzotermik reaksiyon demir ve çelik endüstrisinde eritmek demir ve karbon içeriğini kontrol etmek çelik:
- Fe
3Ö
4 + 4 C(s) → 3 Fe(s) + 4 CO(g)
Karbon monoksit, daha fazla demiri eritmek için geri dönüştürülebilir:
- Fe
3Ö
4 + 4 CO(g) → 3 Fe(s) + 4 CO
2(g)
ile kükürt oluşturmak üzere karbon disülfid ve kömür-gaz reaksiyonunda buharla:
- C(s) + H2Ö(g) → CO(g) + H2 (g).
Karbon, demir karbür gibi metalik karbürler oluşturmak için yüksek sıcaklıklarda bazı metallerle birleşir sementit çelik ve tungsten karbür, yaygın olarak kullanılan aşındırıcı ve kesici aletler için sert ipuçları yapmak için.
Karbon allotropları sistemi bir dizi ekstrem noktayı kapsar:
| Grafit, bilinen en yumuşak malzemelerden biridir. | Sentetik nanokristalin elmas bilinen en zor malzemedir.[25] |
| Grafit çok iyi kayganlaştırıcı, görüntüleniyor süper yağlanma.[26] | Elmas nihai aşındırıcı. |
| Grafit bir orkestra şefi elektrik.[27] | Elmas mükemmel bir elektrik yalıtkan,[28] ve bilinen herhangi bir malzeme arasında en yüksek kırılma elektrik alanına sahiptir. |
| Bazı grafit türleri ısı yalıtımı (ör. ateş kırıcılar ve ısı kalkanları), ancak bazıları diğer formlar iyi termal iletkenlerdir. | Elmas, doğal olarak meydana gelen en iyi bilinen termal iletken |
| Grafit opak. | Elmas oldukça şeffaftır. |
| Grafit, altıgen sistem.[29] | Elmas kristalleşir kübik sistem. |
| Amorf karbon tamamen izotropik. | Karbon nanotüpler en çok anizotropik bilinen malzemeler. |
Allotroplar
Atomik karbon çok kısa ömürlü bir türdür ve bu nedenle karbon, adı verilen çeşitli moleküler konfigürasyonlara sahip çeşitli çok atomlu yapılarda stabilize edilir. allotroplar. Nispeten iyi bilinen üç karbon allotropu amorf karbon, grafit, ve elmas. Bir zamanlar egzotik sayılır, Fullerenler günümüzde yaygın olarak sentezlenmekte ve araştırmada kullanılmaktadır; onlar içerir Buckyballs,[30][31] karbon nanotüpler,[32] karbon nanobudları[33] ve nanofiber.[34][35] Aşağıdakiler gibi birkaç başka egzotik allotrop da keşfedilmiştir. lonsdaleit,[36] camsı karbon,[37] karbon nano-köpük[38] ve doğrusal asetilenik karbon (carbyne).[39]
Grafen atomları altıgen bir kafes şeklinde düzenlenmiş iki boyutlu bir karbon tabakasıdır. 2009 itibariyle, grafen şimdiye kadar test edilen en güçlü malzeme olarak görünmektedir.[40] Onu ayırma süreci grafit endüstriyel süreçler için ekonomik hale gelmeden önce biraz daha teknolojik gelişme gerektirecektir.[41] Başarılı olursa, grafen bir inşaatın yapımında kullanılabilir. uzay asansörü. Ayrıca, arabalarda hidrojen bazlı bir motorda kullanılmak üzere hidrojeni güvenli bir şekilde depolamak için de kullanılabilir.[42]

amorf form, kristalin bir makro yapıda tutulmayan, kristalin olmayan, düzensiz, camsı bir durumda bulunan bir karbon atomları grubudur. Toz halinde bulunur ve aşağıdaki gibi maddelerin temel bileşenidir. odun kömürü, lâmba isi (is ) ve aktif karbon. Normal basınçlarda, karbon, her bir atomun erimiş halden oluşan bir düzlemde üç diğerine trigonal olarak bağlandığı grafit şeklini alır. altıgen halkalar, tıpkı içindekiler gibi aromatik hidrokarbonlar.[43] Ortaya çıkan ağ 2 boyutludur ve ortaya çıkan düz tabakalar istiflenir ve zayıf bir şekilde gevşek bir şekilde bağlanır van der Waals kuvvetleri. Bu grafite yumuşaklığını ve yarılma özellikler (sayfalar kolayca birbirini geçerek kayar). Bir atomu oluşturmak için her atomun dış elektronlarından birinin yer değiştirmesi nedeniyle π-bulut grafit iletkenler elektrik, ancak yalnızca her birinin düzleminde kovalent bağlı levha. Bu, daha düşük bir yığınla sonuçlanır elektiriksel iletkenlik çoğu için olduğundan karbon için metaller. Yer değiştirme aynı zamanda grafitin oda sıcaklığında elmas üzerindeki enerjik kararlılığını da hesaba katar.

Çok yüksek basınçlarda, karbon daha kompakt allotropu oluşturur, elmas grafitin neredeyse iki katı yoğunluğa sahip. Burada her atom bağlı dört yüzlü diğer dörde kadar, 3 boyutlu bir buruşuk altı üyeli atom halkaları ağı oluşturur. Elmas aynı kübik yapı gibi silikon ve germanyum ve karbon-karbonun gücü nedeniyle tahviller tarafından ölçülen en zor doğal olarak oluşan maddedir. çizilmeye karşı direnç. Yaygın inanışın aksine "elmaslar sonsuzdur"termodinamik olarak kararsızdırlar (ΔfG° (elmas, 298 K) = 2,9 kJ / mol[44]) normal koşullar altında (298 K, 105 Pa) ve dönüştürün grafit.[18] Yüksek aktivasyon enerjisi bariyeri nedeniyle, grafite geçiş normal sıcaklıkta o kadar yavaştır ki farkedilemez. Karbon faz diyagramının sol alt köşesi deneysel olarak incelenmemiştir. Ancak, yeni bir hesaplamalı çalışma Yoğunluk fonksiyonel teorisi yöntemler şu sonuca varmıştır: T → 0 K ve p → 0 Pa, elmas olur daha kararlı grafite göre yaklaşık 1.1 kJ / mol.[45] Bazı koşullar altında, karbon şu şekilde kristalleşir: lonsdaleit, bir altıgen kristal Tüm atomların kovalent olarak bağlanmış olduğu ve elmasınkilere benzer özelliklere sahip olduğu kafes.[36]
Fullerenler grafit benzeri bir yapıya sahip, ancak düz yerine sentetik bir kristal oluşumdur altıgen hücreler sadece, fullerenlerin oluştuğu hücrelerin bazıları beşgenler, düzlemsel olmayan altıgenler veya hatta karbon atomlarının yedgenleri olabilir. Böylece tabakalar küreler, elipsler veya silindirler halinde bükülür. Fullerenlerin özellikleri (buckyballs, buckytubes ve nanobud'lara bölünmüş) henüz tam olarak analiz edilmemiştir ve yoğun bir araştırma alanını temsil etmektedir. nanomalzemeler. İsimler Fullerene ve Buckyball sonra verilir Richard Buckminster Fuller, popülerleştiren jeodezik kubbeler fullerenes yapısına benzeyen. Buckyballs, trigonal olarak bağlı tamamen karbondan oluşan oldukça büyük moleküllerdir. küremsi (en iyi bilinen ve en basit olanı futbol topu şeklindeki C60 Buckminsterfullerene ).[30] Karbon nanotüpler (buckytubes) yapısal olarak buckyball'lara benzer, tek fark, her atomun bir boşluk oluşturan kavisli bir tabakada trigonal olarak bağlanmasıdır. silindir.[31][32] Nanobudlar ilk olarak 2007'de rapor edildi ve her ikisinin özelliklerini tek bir yapıda birleştiren hibrit buckytube / buckyball malzemeleridir (buckyball'lar bir nanotüpün dış duvarına kovalent olarak bağlanır).[33]

Keşfedilen diğer allotroplardan, karbon nano-köpük bir ferromanyetik allotrop 1997'de keşfedildi. Bu, atomların altı ve yedi üyeli halkalarda üçgen olarak bağlandığı gevşek bir üç boyutlu ağda birbirine dizilmiş düşük yoğunluklu bir karbon atomları kümelenmesinden oluşur. Yaklaşık 2 kg / m yoğunluğuyla bilinen en hafif katılar arasındadır.3.[46] Benzer şekilde, camsı karbon yüksek oranda kapalı gözeneklilik,[37] ancak normal grafitin aksine, grafitik katmanlar bir kitaptaki sayfalar gibi istiflenmez, ancak daha rastgele bir düzenlemeye sahiptir. Doğrusal asetilenik karbon[39] kimyasal yapıya sahiptir[39] - (C ::: C)n-. Bu modifikasyondaki karbon, sp yörünge hibridizasyonu ve bir polimer dönüşümlü tek ve üçlü bağlarla. Bu carbyne büyük ilgi görüyor nanoteknoloji onun gibi Gencin modülü bilinen en sert malzemenin 40 katıdır - elmas.[47]
2015'te bir ekip Kuzey Karolina Eyalet Üniversitesi adını verdikleri başka bir allotropun geliştirildiğini duyurdu Q-karbon, amorf karbon tozu üzerinde yüksek enerjili, düşük süreli bir lazer darbesiyle oluşturulur. Q-karbonun ferromanyetizma sergilediği bildirildi, floresan ve elmastan daha üstün bir sertlik.[48]
Buhar fazında karbonun bir kısmı şu şekildedir: dikarbon (C
2). Heyecanlandığında bu gaz yeşil renkte yanar.
Oluşum


Karbon, dördüncü en bol kimyasal element içinde Gözlemlenebilir evren hidrojen, helyum ve oksijenden sonra kütlece. Temmuz 2020'de gökbilimciler karbonun esas olarak beyaz cüce yıldızlar, özellikle iki güneş kütlesinden büyük olanlar.[49][50] Karbon bol miktarda bulunur Güneş, yıldızlar, kuyruklu yıldızlar, Ve içinde atmosferler çoğunun gezegenler.[51] Biraz göktaşları mikroskobik elmaslar içerir. Güneş Sistemi hala bir gezegensel disk.[52] Mikroskobik elmaslar, göktaşı çarpma yerlerinde yoğun basınç ve yüksek sıcaklıktan da oluşabilir.[53]
2014 yılında NASA duyurdu büyük ölçüde yükseltilmiş veritabanı izleme için polisiklik aromatik hidrokarbonlar (PAH'lar) Evren. Evrendeki karbonun% 20'den fazlası, PAH'lar, kompleks karbon bileşikleri ve oksijensiz hidrojen ile ilişkilendirilebilir.[54] Bu bileşikler, PAH dünya hipotezi bir rolleri olduğu varsayıldığı yerde abiyogenez ve oluşumu hayat. PAH'ların "birkaç milyar yıl" sonra oluştuğu görülüyor. Büyük patlama, evrende yaygındır ve yeni yıldızlar ve dış gezegenler.[51]
Katı toprağın bir bütün olarak 730 içerdiği tahmin edilmektedir. ppm çekirdekte 2000 ppm ve birleşik manto ve kabukta 120 ppm ile karbon.[55] Dünyanın kütlesi olduğu için 5.972×1024 kilogrambu 4360 milyon anlamına gelir gigatonnes karbon. Bu, okyanuslardaki veya atmosferdeki (aşağıda) karbon miktarından çok daha fazladır.
İle bütünlüğünde oksijen içinde karbon dioksit karbon, Dünya atmosferinde bulunur (yaklaşık 900 gigaton karbon - her ppm 2.13 Gt'ye karşılık gelir) ve tüm su kütlelerinde (yaklaşık 36.000 gigaton karbon) çözünür. İçindeki karbon biyosfer 550 gigaton olarak tahmin edilmiştir, ancak büyük bir belirsizlikle, çoğunlukla karasal derinlik miktarındaki büyük belirsizlik nedeniyle yeraltı bakterileri.[56] Hidrokarbonlar (gibi kömür, petrol, ve doğal gaz ) karbon içerir. Kömür "rezervler" ("kaynaklar" değil) belki 18.000 Gt kaynakla yaklaşık 900 gigatondur.[57] Petrol rezervleri 150 gigaton civarındadır. Kanıtlanmış doğal gaz kaynakları hakkında 175×1012 metreküp (yaklaşık 105 gigaton karbon içerir), ancak çalışmalar başka bir 900×1012 metreküp "geleneksel olmayan" tortuların Kaya gazı, yaklaşık 540 gigaton karbonu temsil eder.[58]
Karbon ayrıca metan hidratlar kutup bölgelerinde ve denizlerin altında. Çeşitli tahminler bu karbonu 500, 2500 Gt,[59] veya 3.000 Gt.[60]
Geçmişte hidrokarbon miktarları daha fazlaydı. Bir kaynağa göre, 1751'den 2008'e kadar olan dönemde yaklaşık 347 gigaton karbon, fosil yakıtların yakılmasıyla atmosfere karbondioksit olarak salındı.[61] Başka bir kaynak, 1750'den beri atmosfere eklenen miktarı 879 Gt olarak ve toplamın atmosfere, denize ve karaya (örneğin turba bataklıkları ) neredeyse 2.000 Gt'de.[62]
Karbon, çok büyük kütlelerin bir bileşenidir (kütlece yaklaşık% 12) karbonat Kaya (kireçtaşı, dolomit, mermer ve benzeri). Kömür karbon açısından çok zengindir (antrasit % 92–98 içerir)[63] 4.000 gigatonu veya% 80'ini oluşturan en büyük ticari mineral karbon kaynağıdır. fosil yakıt.[64]
Tek tek karbon allotroplarına gelince, grafit büyük miktarlarda bulunur. Amerika Birleşik Devletleri (çoğunlukla New York ve Teksas ), Rusya, Meksika, Grönland, ve Hindistan. Kayada doğal elmaslar oluşur kimberlit, antik olarak bulundu volkanik "boyunlar" veya "borular". Çoğu elmas yatakları Afrika özellikle de Güney Afrika, Namibya, Botsvana, Kongo Cumhuriyeti, ve Sierra Leone. Elmas yatakları da bulundu Arkansas, Kanada, Rus Arktik, Brezilya ve Kuzey ve Batı'da Avustralya. Elmaslar şimdi de okyanus tabanından çıkarılıyor. Ümit Burnu. Elmaslar doğal olarak bulunur, ancak ABD'de kullanılan tüm endüstriyel elmasların yaklaşık% 30'u artık üretilmektedir.
Karbon-14, troposferin üst katmanlarında ve stratosferde 9-15 km rakımlarda, kozmik ışınlar.[65] Termal nötronlar nitrojen-14'ün çekirdekleriyle çarpışarak karbon-14 ve bir proton oluşturan üretilir. Gibi, 1.5%×10−10 Atmosferik karbondioksitin% 50'si karbon-14 içerir.[66]
Karbon bakımından zengin asteroitler, denizin dış kısımlarında nispeten baskındır. asteroit kuşağı bizim içinde Güneş Sistemi. Bu asteroitler henüz bilim adamları tarafından doğrudan örneklenmemiştir. Asteroitler varsayımsal olarak kullanılabilir uzay tabanlı karbon madenciliği, gelecekte mümkün olabilir, ancak şu anda teknolojik olarak imkansızdır.[67]
İzotoplar
İzotoplar karbon atom çekirdeği altı içeren protonlar artı bir dizi nötronlar (2 ile 16 arasında değişir). Karbonun doğal olarak oluşan iki kararlı izotoplar.[15] İzotop karbon-12 (12C) Dünya'daki karbonun% 98.93'ünü oluştururken karbon-13 (13C) kalan% 1.07'yi oluşturur.[15] Konsantrasyonu 12Biyokimyasal reaksiyonlar ayrımcılık yaptığından biyolojik materyallerde C daha da artar. 13C.[68] 1961'de Uluslararası Temel ve Uygulamalı Kimya Birliği (IUPAC) izotopu benimsedi karbon-12 temeli olarak atom ağırlıkları.[69] İçindeki karbonun tanımlanması nükleer manyetik rezonans (NMR) deneyleri izotop ile yapılır 13C.
Karbon-14 (14C) doğal olarak meydana gelen radyoizotop, içinde yaratıldı üst atmosfer (daha düşük stratosfer ve üstü troposfer ) etkileşimi ile azot ile kozmik ışınlar.[70] Dünyada eser miktarlarda 1 parça başına bulunur. trilyon (% 0.0000000001) veya daha fazla, çoğunlukla atmosferle ve yüzeysel tortularla sınırlı, özellikle turba ve diğer organik malzemeler.[71] Bu izotop 0.158 MeV kadar bozulur. β− emisyon. Nispeten kısa olması nedeniyle yarı ömür 5730 yıllık, 14Antik kayalarda C neredeyse yoktur. Miktarı 14C içinde atmosfer ve canlı organizmalarda neredeyse sabittir, ancak ölümden sonra vücutlarında tahmin edilebileceği gibi azalır. Bu ilke, radyokarbon yaş tayini, 1949'da icat edildi ve yaklaşık 40.000 yıla kadar olan karbonlu malzemelerin yaşını belirlemek için yaygın olarak kullanıldı.[72][73]
Bilinen 15 karbon izotopu vardır ve bunların en kısa ömürlü olanı 8Çürüyen C proton emisyonu ve alfa bozunması ve 1.98739 × 10 yarılanma ömrüne sahiptir−21 s.[74] Egzotik 19C, bir nükleer hale yani onun yarıçap beklenenden çok daha büyüktür. çekirdek bir küre sabit yoğunluk.[75]
Yıldızlarda oluşum
Karbon atom çekirdeğinin oluşumu bir dev veya üstdev içinden yıldız üçlü alfa süreci. Bu, neredeyse aynı anda üç çarpışmayı gerektirir. alfa parçacıkları (helyum çekirdekler), daha ileri ürünler olarak nükleer füzyon helyumun hidrojen veya başka bir helyum çekirdeği ile reaksiyonu lityum-5 ve berilyum-8 sırasıyla, her ikisi de oldukça kararsızdır ve neredeyse anında daha küçük çekirdeklere bozunur.[76] Üçlü alfa süreci, 100 megakelvin'i aşan sıcaklıklarda ve erken evrenin hızlı genişlemesini ve soğumasını yasaklayan helyum konsantrasyonu koşullarında gerçekleşir ve bu nedenle, Büyük patlama.
Mevcut fiziksel kozmoloji teorisine göre, karbon, yıldızların iç kısımlarında oluşur. yatay dal.[77] Büyük yıldızlar süpernova olarak öldüğünde, karbon uzaya toz olarak saçılır. Bu toz, yeni nesil yıldız toplanmış gezegenlere sahip sistemler.[51][78] Güneş Sistemi bol miktarda karbon içeren böyle bir yıldız sistemidir ve bildiğimiz şekliyle yaşamın varlığını sağlar.
CNO döngüsü yıldızlara güç veren ek bir hidrojen füzyon mekanizmasıdır, burada karbon bir katalizör.
Çeşitli izotopik karbon monoksit formlarının rotasyonel geçişleri (örneğin, 12CO, 13CO ve 18CO) tespit edilebilir milimetre altı dalga boyu aralığı ve çalışmasında kullanılır yeni oluşan yıldızlar içinde moleküler bulutlar.[79]
Karbon döngüsü
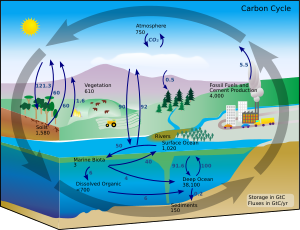
Karasal koşullar altında, bir elementin diğerine dönüşümü çok nadirdir. Bu nedenle, Dünya'daki karbon miktarı etkin bir şekilde sabittir. Bu nedenle, karbon kullanan süreçler onu bir yerden almalı ve başka bir yere atmalıdır. Ortamdaki karbon yolları, karbon döngüsü. Örneğin, fotosentetik bitkiler çizmek karbon dioksit atmosferden (veya deniz suyundan) ve onu biyokütle haline getirin. Calvin döngüsü, bir süreç karbon fiksasyonu. Bu biyokütlenin bir kısmı hayvanlar tarafından yenilirken, bir kısmı da hayvanlar tarafından karbondioksit olarak dışarı atılır. Karbon döngüsü, bu kısa döngüden önemli ölçüde daha karmaşıktır; örneğin, okyanuslarda bir miktar karbondioksit çözülür; bakteriler onu tüketmezse, ölü bitki veya hayvansal madde haline gelebilir petrol veya kömür, yakıldığında karbon açığa çıkarır.[80][81]
Bileşikler
Organik bileşikler


Karbon çok uzun birbirine bağlı zincirler oluşturabilir karbon-karbon bağları denen bir mülk katenasyon. Karbon-karbon bağları güçlü ve istikrarlıdır. Katenasyon yoluyla, karbon sayısız sayıda bileşik oluşturur. Benzersiz bileşiklerin toplamı, içermeyenlerden daha fazla karbon içerdiğini göstermektedir.[82] Hidrojen için de benzer bir iddia yapılabilir çünkü çoğu organik bileşik, karbona kimyasal olarak bağlı hidrojen veya oksijen veya nitrojen gibi başka bir ortak element içerir.
Organik bir molekülün en basit şekli, hidrokarbon - büyük bir aile organik moleküller oluşan hidrojen bir karbon atomu zincirine bağlı atomlar. Bir hidrokarbon omurgası, diğer atomlarla ikame edilebilir. heteroatomlar. Organik bileşiklerde görülen yaygın heteroatomlar arasında oksijen, nitrojen, sülfür, fosfor ve radyoaktif olmayan halojenlerin yanı sıra metaller lityum ve magnezyum bulunur. Metale bağ içeren organik bileşikler, organometalik bileşikler olarak bilinir (aşağıya bakınız). Genellikle heteroatomları içeren belirli atom grupları, çok sayıda organik bileşikte tekrar eder. Bu koleksiyonlar olarak bilinir fonksiyonel gruplar, ortak reaktivite modelleri verir ve organik bileşiklerin sistematik çalışmasına ve sınıflandırılmasına izin verir. Zincir uzunluğu, şekli ve fonksiyonel grupların tümü organik moleküllerin özelliklerini etkiler.
En kararlı karbon bileşiklerinde (ve neredeyse tamamı kararlı organik bileşikler), karbon, sekizli kuralı ve bir dört değerlikliBu, bir karbon atomunun toplam dört kovalent bağ oluşturduğu anlamına gelir (çift ve üçlü bağları içerebilir). İstisnalar arasında az sayıda stabilize karbokatyonlar (üç bağ, pozitif yük), radikaller (üç bağ, nötr), karbanyonlar (üç bağ, negatif yük) ve karben (iki bağ, nötr), ancak bu türlerin kararsız, reaktif ara ürünler olarak karşılaşılma olasılığı çok daha yüksektir.
Karbon, bilinenlerin hepsinde oluşur organik hayat ve temeli organik Kimya. İle birleştiğinde hidrojen endüstri için önemli olan çeşitli hidrokarbonları oluşturur. soğutucular, yağlayıcılar, çözücüler üretimi için kimyasal hammadde olarak plastik ve petrokimyasallar, ve benzeri fosil yakıtlar.
Oksijen ve hidrojen ile birleştiğinde karbon, aşağıdakiler de dahil olmak üzere birçok önemli biyolojik bileşik grubu oluşturabilir. şeker, lignanlar, Chitins, alkoller, yağlar ve aromatik esterler, karotenoidler ve terpenler. İle azot oluşturuyor alkaloidler ve kükürt ilavesiyle de oluşur antibiyotikler, amino asitler, ve silgi Ürün:% s. Bu diğer elementlere fosfor ilavesi ile oluşur DNA ve RNA, hayatın kimyasal kod taşıyıcıları ve adenozin trifosfat (ATP), tüm canlı hücrelerdeki en önemli enerji transfer molekülü.
İnorganik bileşikler
Minerallerle ilişkili olan veya diğer karbon atomlarına, halojenlere veya hidrojene bağ içermeyen yaygın olarak karbon içeren bileşikler, klasik organik bileşikler; tanım katı değildir ve bazı bileşiklerin sınıflandırması yazardan yazara değişebilir (yukarıdaki referans makalelerine bakın). Bunlar arasında basit karbon oksitleri vardır. En göze çarpan oksit karbon dioksit (CO
2). Bu bir zamanlar ana unsuruydu Paleoatmosfer, ancak küçük bir bileşenidir Dünya atmosferi bugün.[83] Çözüldü Su, oluşturuyor karbonik asit (H
2CO
3), ancak tek bir karbon üzerinde birden fazla tek bağlı oksijen içeren çoğu bileşik gibi kararsızdır.[84] Bu ara yoluyla, yine de, rezonans stabilize karbonat iyonlar üretilmektedir. Bazı önemli mineraller, özellikle karbonatlardır kalsit. Karbon disülfid (CS
2) benzer.[23] Bununla birlikte, fiziksel özellikleri ve organik sentezle ilişkisi nedeniyle, karbon disülfür bazen bir organik çözücü.
Diğer yaygın oksit karbonmonoksit (CO). Eksik yanma sonucu oluşur ve renksiz, kokusuz bir gazdır. Moleküllerin her biri üçlü bir bağ içerir ve oldukça kutup daha düşük bir bağlanma afinitesine sahip olan oksijenin yerini alarak hemoglobin moleküllerine kalıcı olarak bağlanma eğilimiyle sonuçlanır.[85][86] Siyanür (CN−), benzer bir yapıya sahiptir, ancak daha çok bir Halide iyon (sözde halojen ). Örneğin, nitrürü oluşturabilir siyanojen molekül ((CN)2), diatomik halojenürlere benzer. Aynı şekilde siyanürün daha ağır analoğu, cyaphide (CP−), aynı zamanda inorganik olarak kabul edilir, ancak çoğu basit türev oldukça kararsızdır. Diğer yaygın olmayan oksitler karbon suboksit (C
3Ö
2),[87] kararsız dikarbon monoksit (C2Ö),[88][89] karbon trioksit (CO3),[90][91] siklopentanepenton (C5Ö5),[92] siklohekzanhekson (C6Ö6),[92] ve mellitik anhidrit (C12Ö9). Bununla birlikte, mellitik anhidrit, mellitik asidin üçlü asil anhidritidir; dahası, bir benzen halkası içerir. Bu nedenle, birçok kimyager bunun organik olduğunu düşünüyor.
Reaktif ile metaller, gibi tungsten, ya karbon oluşur karbürler (C4−) veya asetilitler (C2−
2) yüksek erime noktalarına sahip alaşımlar oluşturmak için. Bu anyonlar ayrıca metan ve asetilen ikisi de çok zayıf asitler. 2.5 elektronegatiflik ile,[93] karbon oluşturmayı tercih eder kovalent bağlar. Birkaç karbür kovalent kafeslerdir, örneğin korindon (SiC) benzeyen elmas. Bununla birlikte, en polar ve en tuz benzeri karbürler bile tamamen iyonik bileşikler değildir.[94]
Organometalik bileşikler
Organometalik bileşikler tanım gereği en az bir karbon-metal kovalent bağ içerir. Çok çeşitli bu tür bileşikler mevcuttur; ana sınıflar, basit alkil-metal bileşiklerini içerir (örneğin, tetraetil kurşun ), η2-alken bileşikleri (örneğin, Zeise tuzu ) ve η3-alil bileşikleri (örneğin, alilpalladyum klorür dimer ); metalosenler siklopentadienil ligandlar içeren (örneğin, ferrosen ); ve geçiş metali karben kompleksleri. Birçok metal karboniller ve metal siyanürler var (örneğin, tetrakarbonilnikel ve potasyum ferrisiyanür ); bazı çalışanlar, diğer karbon ligandları olmayan metal karbonil ve siyanür komplekslerinin tamamen inorganik olduğunu ve organometalik olmadığını düşünüyor. Bununla birlikte, çoğu organometalik kimyager, herhangi bir karbon ligandı ile metal komplekslerinin, hatta "inorganik karbon" (örneğin, karboniller, siyanidler ve bazı karbür ve asetilid türleri) doğasında organometalik olduğunu düşünür. Karbon-metal kovalent bağ içermeyen organik ligandlar içeren metal kompleksleri (örneğin, metal karboksilatlar) olarak adlandırılır. metal organik Bileşikler.
Karbonun dört kovalent bağ oluşumunu kuvvetle tercih ettiği anlaşılırken, diğer egzotik bağlanma şemaları da bilinmektedir. Carboranlar [B'nin oldukça kararlı dodekahedral türevleridir.12H12]2- birimi, bir BH, bir CH ile değiştirilmiş+. Böylece, karbon beş bor atomuna ve bir hidrojen atomuna bağlanır. Katyon [(Ph3PAu)6C]2+ altı fosfin-altın parçasına bağlı bir oktahedral karbon içerir. Bu fenomen, aurofilisite aksi takdirde kararsız bir türün ek stabilizasyonunu sağlayan altın ligandların[95] Doğada demir-molibden kofaktörü (FeMoco ) mikrobiyal sorumlu nitrojen fiksasyonu aynı şekilde altı demir atomuna bağlı bir oktahedral karbon merkezine (resmi olarak bir karbür, C (-IV)) sahiptir. 2016 yılında, daha önceki teorik tahminler doğrultusunda, heksametilbenzen dikasyonu altı bağlı bir karbon atomu içerir. Daha spesifik olarak, dikasyon yapısal olarak formülasyon [MeC (η5-C5Ben mi5)]2+, "organik" yapmak metalosen "içinde bir MeC3+ parça bir η'ya bağlıdır5-C5Ben mi5− halkanın beş karbonunun da parçalanması.[96]
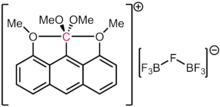
Yukarıdaki durumlarda, karbona olan bağların her birinin ikiden az formal elektron çifti içerdiğine dikkat etmek önemlidir. Bu nedenle, bu türlerin biçimsel elektron sayısı bir sekizliyi geçmez. Bu onları hiper koordine yapar, ancak hipervalent yapmaz. Akiba ve meslektaşları tarafından bildirildiği üzere, iddia edilen 10-C-5 türleri (yani, beş ligandlı bir karbon ve on resmi elektron sayısı) vakalarında bile,[97] elektronik yapı hesaplamaları, dört elektron içeren diğer bileşikler için geçerli olduğu gibi, karbon etrafındaki elektron popülasyonunun hala sekizden az olduğu sonucuna varmıştır. üç merkezli yapıştırma.
Tarih ve etimoloji

ingilizce isim karbon dan geliyor Latince karbonhidrat kömür ve odun kömürü için[98] buradan da geliyor Fransızca kömür, kömür anlamına gelir. İçinde Almanca, Flemenkçe ve Danimarka dili karbon için isimler Kohlenstoff, Koolstof ve Kulstof sırasıyla, kelimenin tam anlamıyla anlamı kömür -madde.
Karbon, tarihöncesinde keşfedildi ve şu şekillerde biliniyordu: is ve odun kömürü en erken insan medeniyetler. Elmaslar, Çin'de muhtemelen MÖ 2500 kadar erken bir tarihte biliniyordu. odun kömürü Roma dönemlerinde, bugün olduğu gibi aynı kimya kullanılarak, odun bir piramit ile kaplı kil havayı dışlamak için.[99][100]
1722'de, René Antoine Ferchault de Réaumur demirin şu anda karbon olduğu bilinen bir maddenin emilmesi yoluyla çeliğe dönüştüğünü gösterdi.[101] 1772'de, Antoine Lavoisier elmasların bir tür karbon olduğunu gösterdi; kömür ve elmas örneklerini yaktığında ve hiçbirinin su üretmediğini ve her ikisinin de aynı miktarda karbon dioksit başına gram. 1779'da[102] Carl Wilhelm Scheele bir form olarak düşünülen grafiti gösterdi. öncülük etmek, bunun yerine odun kömürü ile özdeşti, ancak küçük bir demir karışımına sahipti ve nitrik asit ile oksitlendiğinde "hava asidi" (karbon dioksit için onun adı) verdi.[103] 1786'da Fransız bilim adamları Claude Louis Berthollet, Gaspard Monge ve C. A. Vandermonde, grafitin, Lavoisier'in elmasla yaptığı gibi, onu oksijende oksitleyerek çoğunlukla karbon olduğunu doğruladı.[104] Fransız bilim adamlarının grafit yapısı için gerekli olduğunu düşündüğü bir miktar demir yine kaldı. Yayınlarında adı önerdiler karbonhidrat (Latince Carbonum) grafitin yanması üzerine gaz olarak açığa çıkan grafit içindeki element için. Antoine Lavoisier daha sonra karbonu bir element 1789 ders kitabında.[105]
Yeni allotrop karbon Fullerene 1985'te keşfedildi[106] içerir nano yapılı gibi formlar Buckyballs ve nanotüpler.[30] Kaşifleri - Robert Curl, Harold Kroto ve Richard Smalley - alınan Nobel Ödülü Kimya'da 1996 yılında.[107] Ortaya çıkan yeni formlara olan yenilenmiş ilgi, aşağıdakiler de dahil olmak üzere başka egzotik allotropların keşfedilmesine yol açar. camsı karbon ve bunun farkına varma "amorf karbon "kesinlikle değil amorf.[37]
Üretim
Grafit
Ticari olarak uygun doğal grafit yatakları dünyanın birçok yerinde bulunur, ancak ekonomik olarak en önemli kaynaklar Çin, Hindistan, Brezilya ve Kuzey Kore. Grafit yatakları metamorfik köken, ile ilişkili bulundu kuvars, mika ve Feldispatlar şistlerde gnays ve başkalaşmış kumtaşları ve kireçtaşı gibi lensler veya damarlar bazen bir metre veya daha fazla kalınlıktadır. İçindeki grafit birikintileri Borrowdale, Cumberland, İngiltere başlangıçta yeterli boyut ve saflığa sahipti ki, 19. yüzyıla kadar, kalemler basitçe, şeritleri ahşapla kaplamadan önce doğal grafit bloklarının şeritler halinde kesilmesiyle yapılmıştır. Bugün, ana kayayı ezmek ve daha hafif grafiti su üzerinde yüzdürmek suretiyle daha küçük grafit birikintileri elde edilmektedir.[108]
Üç tür doğal grafit vardır - amorf, pul veya kristal pul ve damar veya yumru. Amorf grafit en düşük kalite ve en bol olanıdır. Bilimin tersine, endüstride "amorf", kristal yapının tamamen eksikliğinden ziyade çok küçük kristal boyutuna atıfta bulunur. Amorf, daha düşük değerli grafit ürünleri için kullanılır ve en düşük fiyatlı grafittir. Büyük amorf grafit yatakları Çin, Avrupa, Meksika ve Amerika Birleşik Devletleri'nde bulunur. Pul grafit daha az yaygındır ve amorf grafitten daha kalitelidir; metamorfik kayaçta kristalleşen ayrı plakalar olarak oluşur. Pul grafit, amorfun fiyatının dört katı olabilir. Kaliteli pullar işlenebilir genişletilebilir grafit gibi birçok kullanım için alev geciktiriciler. En önemli yataklar Avusturya, Brezilya, Kanada, Çin, Almanya ve Madagaskar'da bulunmaktadır. Damar veya topak grafit, en nadir, en değerli ve en kaliteli doğal grafit türüdür. Katı topaklardaki müdahaleci temaslar boyunca damarlarda görülür ve yalnızca Sri Lanka'da ticari olarak çıkarılır.[108]
Göre USGS 2010 yılında dünya doğal grafit üretimi 1,1 milyon ton olup, buna Çin 800,000 ton, Hindistan 130,000 ton, Brezilya 76,000 ton, Kuzey Kore 30,000 ton ve Kanada 25,000 ton katkıda bulunmuştur. Amerika Birleşik Devletleri'nde hiç doğal grafit çıkarılmadığı bildirildi, ancak 2009'da tahmini değeri 998 milyon dolar olan 118.000 ton sentetik grafit üretildi.[108]
Elmas

Elmas tedarik zinciri, sınırlı sayıda güçlü işletme tarafından kontrol edilmektedir ve aynı zamanda dünya çapında az sayıda yerde yoğunlaşmıştır (şekle bakınız).
Elmas cevherinin sadece çok küçük bir kısmı gerçek elmaslardan oluşur. Cevher kırılır, bu sırada daha büyük elmasların bu işlemde parçalanmasını önlemek için özen gösterilmesi gerekir ve ardından parçacıklar yoğunluğa göre sınıflandırılır. Günümüzde elmaslar, elmas açısından zengin yoğunluk fraksiyonunda yer almaktadır. X-ışını floresansı daha sonra son ayırma adımları elle yapılır. Kullanmadan önce X ışınları sıradan hale geldi, ayırma gres kayışları ile yapıldı; Elmaslar, cevherdeki diğer minerallere göre grese daha güçlü yapışma eğilimindedir.[109]
Tarihsel olarak elmasların yalnızca alüvyal yataklarda bulunduğu biliniyordu. güney Hindistan.[110] Hindistan, yaklaşık olarak MÖ 9. yüzyılda keşfedildikleri zamandan elmas üretiminde dünyaya liderlik etti.[111] MS 18. yüzyılın ortalarına kadar, ancak bu kaynakların ticari potansiyeli 18. yüzyılın sonlarında tükenmişti ve o sırada Hindistan, 1725'te ilk Hint olmayan elmasların bulunduğu Brezilya tarafından gölgede bırakıldı.[112]
Birincil yatakların (kimberlitler ve lamproitler) elmas üretimi ancak 1870'lerde Güney Afrika'daki elmas tarlalarının keşfedilmesinden sonra başladı. Üretim zamanla arttı ve şimdi o tarihten bu yana toplamda 4,5 milyar karat çıkarıldı.[113] Bu miktarın yaklaşık% 20'si yalnızca son 5 yılda çıkarıldı ve son on yılda 9 yeni maden üretime başlanırken, 4 tane daha yakında açılmayı bekliyor. Bu madenlerin çoğu Kanada, Zimbabve, Angola'da ve biri Rusya'da bulunuyor.[113]
Amerika Birleşik Devletleri'nde elmaslar bulundu Arkansas, Colorado ve Montana.[114][115] 2004'te Amerika Birleşik Devletleri'nde mikroskobik bir elmasın şaşırtıcı keşfi[116] Ocak 2008'de toplu örneklemeye yol açtı. kimberlit borular uzak bir bölümünde Montana.[117]
Bugün, ticari olarak uygun olan elmas yataklarının çoğu, Rusya, Botsvana, Avustralya ve Kongo Demokratik Cumhuriyeti.[118] In 2005, Russia produced almost one-fifth of the global diamond output, reports the İngiliz Jeolojik Araştırması. Australia has the richest diamantiferous pipe with production reaching peak levels of 42 metric tons (41 long tons; 46 short tons) per year in the 1990s.[114] There are also commercial deposits being actively mined in the Kuzeybatı bölgesi nın-nin Kanada, Sibirya (çoğunlukla Yakutia territory; Örneğin, Mir pipe ve Udachnaya borusu ), Brazil, and in Northern and Western Avustralya.
Başvurular




Carbon is essential to all known living systems, and without it life as we know it could not exist (see alternative biochemistry ). The major economic use of carbon other than food and wood is in the form of hydrocarbons, most notably the fosil yakıt metan gaz ve ham petrol (petrol). Ham petrol dır-dir damıtılmış içinde rafineriler tarafından Petrokimya endüstrisi üretmek için benzin, gazyağı ve diğer ürünler. Selüloz is a natural, carbon-containing polymer produced by plants in the form of Odun, pamuk, keten, ve kenevir. Selüloz is used primarily for maintaining structure in plants. Commercially valuable carbon polymers of animal origin include yün, kaşmir ve ipek. Plastikler are made from synthetic carbon polymers, often with oxygen and nitrogen atoms included at regular intervals in the main polymer chain. The raw materials for many of these synthetic substances come from crude oil.
The uses of carbon and its compounds are extremely varied. It can form alaşımlar ile Demir, of which the most common is karbon çelik. Grafit ile birleştirilir killer to form the 'lead' used in kalemler için kullanılır yazı ve drawing. Aynı zamanda bir kayganlaştırıcı ve bir pigment, as a molding material in bardak manufacture, in elektrotlar kuru için piller ve galvanik ve elektro şekillendirme, içinde fırçalar için elektrik motorları ve bir nötron moderatörü içinde nükleer reaktörler.
Odun kömürü is used as a drawing material in sanat eseri, barbecue ızgara, demir eritme, and in many other applications. Wood, coal and oil are used as yakıt for production of energy and ısıtma. Gem quality elmas is used in jewelry, and industrial diamonds are used in drilling, cutting and polishing tools for machining metals and stone. Plastics are made from fossil hydrocarbons, and karbon fiber, yapan piroliz sentetik polyester lifler is used to reinforce plastics to form advanced, lightweight kompozit malzemeler.
Karbon fiber is made by pyrolysis of extruded and stretched filaments of poliakrilonitril (PAN) and other organic substances. The crystallographic structure and mechanical properties of the fiber depend on the type of starting material, and on the subsequent processing. Carbon fibers made from PAN have structure resembling narrow filaments of graphite, but thermal processing may re-order the structure into a continuous rolled sheet. The result is fibers with higher specific tensile strength than steel.[119]
Karbon siyahı is used as the black pigment içinde baskı mürekkep, artist's oil paint and water colours, karbon kağıdı, automotive finishes, Hint mürekkebi ve lazer yazıcı toner. Karbon siyahı olarak da kullanılır dolgu maddesi içinde silgi products such as tyres and in plastik Bileşikler. Aktifleştirilmiş odun kömürü olarak kullanılır emici ve adsorban içinde filtre material in applications as diverse as gaz maskeleri, su arıtma, ve mutfak extractor hoods, and in medicine to emmek toxins, poisons, or gases from the sindirim sistemi. Carbon is used in chemical reduction yüksek sıcaklıklarda. Kola is used to reduce iron ore into iron (smelting). Kasa sertleştirme of steel is achieved by heating finished steel components in carbon powder. Karbürler nın-nin silikon, tungsten, bor ve titanyum, are among the hardest known materials, and are used as aşındırıcılar in cutting and grinding tools. Carbon compounds make up most of the materials used in clothing, such as natural and synthetic tekstil ve deri, and almost all of the interior surfaces in the yapılı çevre other than glass, stone and metal.
Elmaslar
elmas industry falls into two categories: one dealing with gem-grade diamonds and the other, with industrial-grade diamonds. While a large trade in both types of diamonds exists, the two markets function dramatically differently.
Aksine değerli metaller gibi altın veya platin, gem diamonds do not trade as a emtia: there is a substantial mark-up in the sale of diamonds, and there is not a very active market for resale of diamonds.
Industrial diamonds are valued mostly for their hardness and heat conductivity, with the gemological qualities of clarity and color being mostly irrelevant. About 80% of mined diamonds (equal to about 100 million carats or 20 tonnes annually) are unsuitable for use as gemstones are relegated for industrial use (known as bort ).[120] sentetik elmaslar, invented in the 1950s, found almost immediate industrial applications; 3 billion carats (600 ton ) of synthetic diamond is produced annually.[121]
The dominant industrial use of diamond is in cutting, drilling, grinding, and polishing. Most of these applications do not require large diamonds; in fact, most diamonds of gem-quality except for their small size can be used industrially. Diamonds are embedded in drill tips or saw blades, or ground into a powder for use in grinding and polishing applications.[122] Specialized applications include use in laboratories as containment for high pressure experiments (görmek elmas örs hücresi ), high-performance rulmanlar, and limited use in specialized pencereler.[123][124] With the continuing advances in the production of synthetic diamonds, new applications are becoming feasible. Garnering much excitement is the possible use of diamond as a yarı iletken için uygun mikroçipler, and because of its exceptional heat conductance property, as a soğutucu içinde elektronik.[125]
Önlemler

Pure carbon has extremely low toksisite to humans and can be handled safely in the form of graphite or charcoal. It is resistant to dissolution or chemical attack, even in the acidic contents of the digestive tract. Consequently, once it enters into the body's tissues it is likely to remain there indefinitely. Karbon siyahı was probably one of the first pigments to be used for dövme, ve Buz Adam Ötzi was found to have carbon tattoos that survived during his life and for 5200 years after his death.[126] Inhalation of coal dust or soot (carbon black) in large quantities can be dangerous, irritating lung tissues and causing the congestive akciğer hastalık, kömür işçisi pnömokonyozu. Diamond dust used as an abrasive can be harmful if ingested or inhaled. Microparticles of carbon are produced in diesel engine exhaust fumes, and may accumulate in the lungs.[127] In these examples, the harm may result from contaminants (e.g., organic chemicals, heavy metals) rather than from the carbon itself.
Carbon generally has low toxicity to Dünyadaki yaşam; but carbon nanoparticles are deadly to Meyve sineği.[128]
Carbon may burn vigorously and brightly in the presence of air at high temperatures. Large accumulations of coal, which have remained inert for hundreds of millions of years in the absence of oxygen, may kendiliğinden yanma when exposed to air in coal mine waste tips, ship cargo holds and coal bunkers,[129][130] and storage dumps.
İçinde nuclear applications where graphite is used as a nötron moderatörü, accumulation of Wigner enerji followed by a sudden, spontaneous release may occur. Tavlama to at least 250 °C can release the energy safely, although in the Rüzgar ölçeği ateşi the procedure went wrong, causing other reactor materials to combust.
The great variety of carbon compounds include such lethal poisons as tetrodotoksin, lektin Ricin from seeds of the castor oil plant Ricinus communis, siyanür (CN−), ve karbonmonoksit; and such essentials to life as glikoz ve protein.
Ayrıca bakınız
Referanslar
- ^ Lide, D. R., ed. (2005). CRC El Kitabı Kimya ve Fizik (86. baskı). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ a b Haaland, D (1976). "Graphite-liquid-vapor triple point pressure and the density of liquid carbon". Karbon. 14 (6): 357–361. doi:10.1016/0008-6223(76)90010-5.
- ^ a b Savvatimskiy, A (2005). "Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)". Karbon. 43 (6): 1115–1142. doi:10.1016/j.carbon.2004.12.027.
- ^ "Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical" (PDF). Alındı 2007-12-06.
- ^ "Fourier Transform Spectroscopy of the System of CP" (PDF). Alındı 2007-12-06.
- ^ "Carbon: Binary compounds". Alındı 2007-12-06.
- ^ a b c d e Properties of diamond, Ioffe Institute Database
- ^ "Material Properties- Misc Materials". www.nde-ed.org. Alındı 12 Kasım 2016.
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ Weast, Robert (1984). CRC, Kimya ve Fizik El Kitabı. Boca Raton, Florida: Chemical Rubber Company Publishing. s. E110. ISBN 978-0-8493-0464-4.
- ^ "History of Carbon and Carbon Materials - Center for Applied Energy Research - University of Kentucky". Caer.uky.edu. Alındı 2008-09-12.
- ^ Senese, Fred (2000-09-09). "Who discovered carbon?". Frostburg Eyalet Üniversitesi. Alındı 2007-11-24.
- ^ "carbon | Facts, Uses, & Properties". britanika Ansiklopedisi. Arşivlendi from the original on 2017-10-24.
- ^ "carbon". Britannica encyclopedia.
- ^ a b c "Carbon – Naturally occurring isotopes". WebElements Periodic Table. Arşivlendi 2008-09-08 tarihinde orjinalinden. Alındı 2008-10-09.
- ^ "History of Carbon". Arşivlenen orijinal 2012-11-01 tarihinde. Alındı 2013-01-10.
- ^ Reece, Jane B. (31 October 2013). Campbell Biyoloji (10 ed.). Pearson. ISBN 9780321775658.
- ^ a b "World of Carbon – Interactive Nano-visulisation in Science & Engineering Education (IN-VSEE)". Arşivlenen orijinal on 2001-05-31. Alındı 2008-10-09.
- ^ a b Kimya İşlemleri (15 Aralık 2003). "Karbon". Los Alamos Ulusal Laboratuvarı. Arşivlenen orijinal 2008-09-13 tarihinde. Alındı 2008-10-09.
- ^ Deming, Anna (2010). "King of the elements?". Nanoteknoloji. 21 (30): 300201. Bibcode:2010Nanot..21D0201D. doi:10.1088/0957-4484/21/30/300201. PMID 20664156.
- ^ Greenville Whittaker, A. (1978). "The controversial carbon solid−liquid−vapour triple point". Doğa. 276 (5689): 695–696. Bibcode:1978Natur.276..695W. doi:10.1038/276695a0. S2CID 4362313.
- ^ Zazula, J. M. (1997). "On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam" (PDF). CERN. Arşivlendi (PDF) 2009-03-25 tarihinde orjinalinden. Alındı 2009-06-06.
- ^ a b Greenwood and Earnshaw, pp. 289–292.
- ^ Greenwood and Earnshaw, pp. 276–8.
- ^ Irifune, Tetsuo; Kurio, Ayako; Sakamoto, Shizue; Inoue, Toru; Sumiya, Hitoshi (2003). "Materials: Ultrahard polycrystalline diamond from graphite". Doğa. 421 (6923): 599–600. Bibcode:2003Natur.421..599I. doi:10.1038/421599b. PMID 12571587. S2CID 52856300.
- ^ Dienwiebel, Martin; Verhoeven, Gertjan; Pradeep, Namboodiri; Frenken, Joost; Heimberg, Jennifer; Zandbergen, Henny (2004). "Superlubricity of Graphite" (PDF). Fiziksel İnceleme Mektupları. 92 (12): 126101. Bibcode:2004PhRvL..92l6101D. doi:10.1103/PhysRevLett.92.126101. PMID 15089689. Arşivlendi (PDF) from the original on 2011-09-17.
- ^ Deprez, N.; McLachan, D. S. (1988). "The analysis of the electrical conductivity of graphite conductivity of graphite powders during compaction". Journal of Physics D: Uygulamalı Fizik. 21 (1): 101–107. Bibcode:1988JPhD...21..101D. doi:10.1088/0022-3727/21/1/015.
- ^ Collins, A. T. (1993). "The Optical and Electronic Properties of Semiconducting Diamond". Kraliyet Derneği'nin Felsefi İşlemleri A. 342 (1664): 233–244. Bibcode:1993RSPTA.342..233C. doi:10.1098/rsta.1993.0017. S2CID 202574625.
- ^ Delhaes, P. (2001). Grafit ve Öncüler. CRC Basın. ISBN 978-90-5699-228-6.
- ^ a b c Unwin, Peter. "Fullerenes(An Overview)". Arşivlendi from the original on 2007-12-01. Alındı 2007-12-08.
- ^ a b Ebbesen, T. W., ed. (1997). Carbon nanotubes—preparation and properties. Boca Raton, Florida: CRC Press. ISBN 978-0-8493-9602-1.
- ^ a b Dresselhaus, M. S.; Dresselhaus, G.; Avouris, Ph., eds. (2001). Carbon nanotubes: synthesis, structures, properties and applications. Uygulamalı Fizikte Konular. 80. Berlin. ISBN 978-3-540-41086-7.
- ^ a b Nasibulin, Albert G.; Pikhitsa, P. V.; Jiang, H.; Brown, D. P.; Krasheninnikov, A. V .; Anisimov, A. S.; Queipo, P.; Moisala, A.; et al. (2007). "A novel hybrid carbon material". Doğa Nanoteknolojisi. 2 (3): 156–161. Bibcode:2007NatNa...2..156N. doi:10.1038/nnano.2007.37. PMID 18654245. S2CID 6447122.
- ^ Nasibulin, A.; Anisimov, Anton S.; Pikhitsa, Peter V.; Jiang, Hua; Brown, David P.; Choi, Mansoo; Kauppinen, Esko I. (2007). "Investigations of NanoBud formation". Kimyasal Fizik Mektupları. 446 (1): 109–114. Bibcode:2007CPL...446..109N. doi:10.1016/j.cplett.2007.08.050.
- ^ Vieira, R; Ledoux, Marc-Jacques; Pham-Huu, Cuong (2004). "Synthesis and characterisation of carbon nanofibers with macroscopic shaping formed by catalytic decomposition of C2H6/ H2 over nickel catalyst". Applied Catalysis A: General. 274 (1–2): 1–8. doi:10.1016/j.apcata.2004.04.008.
- ^ a b Clifford, Frondel; Marvin, Ursula B. (1967). "Lonsdaleite, a new hexagonal polymorph of diamond". Doğa. 214 (5088): 587–589. Bibcode:1967Natur.214..587F. doi:10.1038 / 214587a0. S2CID 4184812.
- ^ a b c Harris, PJF (2004). "Fullerene-related structure of commercial glassy carbons" (PDF). Felsefi Dergisi. 84 (29): 3159–3167. Bibcode:2004PMag...84.3159H. CiteSeerX 10.1.1.359.5715. doi:10.1080/14786430410001720363. Arşivlenen orijinal (PDF) 2012-03-19 tarihinde. Alındı 2011-07-06.
- ^ Rode, A. V .; Hyde, S. T .; Gamaly, E. G .; Elliman, R. G .; McKenzie, D. R.; Bulcock, S. (1999). "Yüksek nabız hızlı lazer ablasyonu ile oluşturulan karbon köpüğün yapısal analizi". Uygulamalı Fizik A: Malzeme Bilimi ve İşleme. 69 (7): S755 – S758. Bibcode:1999ApPhA..69S.755R. doi:10.1007 / s003390051522. S2CID 96050247.
- ^ a b c Heimann, Robert Bertram; Evsyukov, Sergey E. & Kavan, Ladislav (28 February 1999). Carbyne and carbynoid structures. Springer. s. 1–. ISBN 978-0-7923-5323-2. Arşivlendi from the original on 23 November 2012. Alındı 2011-06-06.
- ^ Lee, C .; Wei, X .; Kysar, J. W .; Hone, J. (2008). "Tek Tabakalı Grafenin Elastik Özelliklerinin ve İç Mukavemetinin Ölçülmesi". Bilim. 321 (5887): 385–8. Bibcode:2008Sci ... 321..385L. doi:10.1126 / science.1157996. PMID 18635798. S2CID 206512830. Lay özeti.
- ^ Sanderson, Bill (2008-08-25). "Toughest Stuff Known to Man : Discovery Opens Door to Space Elevator". nypost.com. Arşivlendi from the original on 2008-09-06. Alındı 2008-10-09.
- ^ Jin, Zhong; Lu, Wei; O’Neill, Kevin J.; Parilla, Philip A.; Simpson, Lin J.; Kittrell, Carter; Tour, James M. (2011-02-22). "Nano-Engineered Spacing in Graphene Sheets for Hydrogen Storage". Malzemelerin Kimyası. 23 (4): 923–925. doi:10.1021/cm1025188. ISSN 0897-4756.
- ^ Jenkins, Edgar (1973). The polymorphism of elements and compounds. Taylor ve Francis. s. 30. ISBN 978-0-423-87500-3. Arşivlendi 2012-11-23 tarihinde orjinalinden. Alındı 2011-05-01.
- ^ Rossini, F. D.; Jessup, R. S. (1938). "Heat and Free Energy of Formation of Carbon Dioxide and of the Transition Between Graphite and Diamond". Ulusal Standartlar Bürosu Araştırma Dergisi. 21 (4): 491. doi:10.6028/jres.021.028.
- ^ Grochala, Wojciech (2014-04-01). "Diamond: Electronic Ground State of Carbon at Temperatures Approaching 0 K". Angewandte Chemie Uluslararası Sürümü. 53 (14): 3680–3683. doi:10.1002/anie.201400131. ISSN 1521-3773. PMID 24615828. S2CID 13359849.
- ^ Schewe, Phil & Stein, Ben (March 26, 2004). "Carbon Nanofoam is the World's First Pure Carbon Magnet". Fizik Haberleri Güncellemesi. 678 (1). Arşivlendi from the original on March 7, 2012.
- ^ Itzhaki, Lior; Altus, Eli; Basch, Harold; Hoz, Shmaryahu (2005). "Harder than Diamond: Determining the Cross-Sectional Area and Young's Modulus of Molecular Rods". Angew. Chem. Int. Ed. 44 (45): 7432–5. doi:10.1002/anie.200502448. PMID 16240306.
- ^ "Researchers Find New Phase of Carbon, Make Diamond at Room Temperature". news.ncsu.edu. 2015-11-30. Arşivlendi 2016-04-06 tarihinde orjinalinden. Alındı 2016-04-06.
- ^ Rabie, Passant (6 Temmuz 2020). "Gökbilimciler Evrendeki Yaşamın Kaynağını Buldu". Ters. Alındı 7 Temmuz 2020.
- ^ Marigo, Paola; et al. (6 Temmuz 2020). "Tekdüze olmayan ilk-son kütle ilişkisi üzerinden görüldüğü şekliyle karbon yıldızı oluşumu". Doğa Astronomi. 152. arXiv:2007.04163. doi:10.1038 / s41550-020-1132-1. S2CID 220403402. Alındı 7 Temmuz 2020.
- ^ a b c Hoover, Rachel (21 Şubat 2014). "Evrendeki Organik Nano-Parçacıkların İzlenmesi Gerekiyor mu? NASA'nın Bunun İçin Bir Uygulaması Var". NASA. Arşivlendi 6 Eylül 2015 tarihinde orjinalinden. Alındı 2014-02-22.
- ^ Lauretta, D.S .; McSween, H.Y. (2006). Meteorites and the Early Solar System II. Space science series. Arizona Üniversitesi Yayınları. s. 199. ISBN 978-0-8165-2562-1. Arşivlendi 2017-11-22 tarihinde orjinalinden. Alındı 2017-05-07.
- ^ Mark, Kathleen (1987). Göktaşı Kraterleri. Arizona Üniversitesi Yayınları. ISBN 978-0-8165-0902-7.
- ^ "Online Database Tracks Organic Nano-Particles Across the Universe". Sci Tech Daily. 24 Şubat 2014. Arşivlendi 18 Mart 2015 tarihli orjinalinden. Alındı 2015-03-10.
- ^ William F McDonough Dünyanın bileşimi Arşivlendi 2011-09-28 de Wayback Makinesi içinde Majewski, Eugeniusz (2000). Earthquake Thermodynamics and Phase Transformation in the Earth's Interior. ISBN 978-0126851854.
- ^ Yinon Bar-On; et al. (Jun 19, 2018). "Dünyadaki biyokütle dağılımı". PNAS. 115 (25): 6506–6511. doi:10.1073 / pnas.1711842115. PMC 6016768. PMID 29784790.
- ^ Fred Pearce (2014-02-15). "Fire in the hole: After fracking comes coal". Yeni Bilim Adamı. 221 (2956): 36–41. Bibcode:2014NewSc.221...36P. doi:10.1016/S0262-4079(14)60331-6. Arşivlendi from the original on 2015-03-16.
- ^ "Wonderfuel: Welcome to the age of unconventional gas" Arşivlendi 2014-12-09 at Wayback Makinesi by Helen Knight, Yeni Bilim Adamı, 12 June 2010, pp. 44–7.
- ^ Ocean methane stocks 'overstated' Arşivlendi 2013-04-25 de Wayback Makinesi, BBC, 17 Feb. 2004.
- ^ "Ice on fire: The next fossil fuel" Arşivlendi 2015-02-22 at the Wayback Makinesi tarafından Fred Pearce, Yeni Bilim Adamı, 27 June 2009, pp. 30–33.
- ^ Calculated from file global.1751_2008.csv in "Index of /ftp/ndp030/CSV-FILES". Arşivlenen orijinal 2011-10-22 tarihinde. Alındı 2011-11-06. -den Karbondioksit Bilgi Analiz Merkezi.
- ^ Rachel Gross (Sep 21, 2013). "Deep, and dank mysterious". Yeni Bilim Adamı: 40–43. Arşivlendi 2013-09-21 tarihinde orjinalinden.
- ^ Stefanenko, R. (1983). Coal Mining Technology: Theory and Practice. Madencilik Metalurji Derneği. ISBN 978-0-89520-404-2.
- ^ Kasting, James (1998). "The Carbon Cycle, Climate, and the Long-Term Effects of Fossil Fuel Burning". Consequences: The Nature and Implication of Environmental Change. 4 (1). Arşivlendi from the original on 2008-10-24.
- ^ "Carbon-14 formation". Arşivlendi 1 Ağustos 2015 tarihinde orjinalinden. Alındı 13 Ekim 2014.
- ^ Aitken, M.J. (1990). Science-based Dating in Archaeology. sayfa 56–58. ISBN 978-0-582-49309-4.
- ^ Nichols, Charles R. "Voltatile Products from Carbonaceous Asteroids" (PDF). UAPress.Arizona.edu. Arşivlenen orijinal (PDF) 2 Temmuz 2016'da. Alındı 12 Kasım 2016.
- ^ Gannes, Leonard Z.; Del Rio, Carlos Martı́nez; Koch, Paul (1998). "Natural Abundance Variations in Stable Isotopes and their Potential Uses in Animal Physiological Ecology". Comparative Biochemistry and Physiology – Part A: Molecular & Integrative Physiology. 119 (3): 725–737. doi:10.1016/S1095-6433(98)01016-2. PMID 9683412.
- ^ "Official SI Unit definitions". Arşivlendi 2007-10-14 tarihinde orjinalinden. Alındı 2007-12-21.
- ^ Bowman, S. (1990). Interpreting the past: Radiocarbon dating. British Museum Press. ISBN 978-0-7141-2047-8.
- ^ Brown, Tom (March 1, 2006). "Carbon Goes Full Circle in the Amazon". Lawrence Livermore Ulusal Laboratuvarı. Arşivlendi orjinalinden 22 Eylül 2008. Alındı 2007-11-25.
- ^ Libby, W. F. (1952). Radyokarbon yaş tayini. Chicago University Press and references therein.
- ^ Westgren, A. (1960). "The Nobel Prize in Chemistry 1960". Nobel Vakfı. Arşivlendi 2007-10-25 tarihinde orjinalinden. Alındı 2007-11-25.
- ^ "Use query for carbon-8". barwinski.net. Arşivlendi 2005-02-07 tarihinde orjinalinden. Alındı 2007-12-21.
- ^ Watson, A. (1999). "Beaming Into the Dark Corners of the Nuclear Kitchen". Bilim. 286 (5437): 28–31. doi:10.1126/science.286.5437.28. S2CID 117737493.
- ^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (1997). "SonraUBASE nükleer ve bozunma özelliklerinin değerlendirilmesi " (PDF). Nükleer Fizik A. 624 (1): 1–124. Bibcode:1997NuPhA.624 .... 1A. doi:10.1016 / S0375-9474 (97) 00482-X. Arşivlenen orijinal (PDF) 2008-09-23 tarihinde.
- ^ Ostlie, Dale A. & Carroll, Bradley W. (2007). Modern Yıldız Astrofiziğine Giriş. San Francisco (CA): Addison Wesley. ISBN 978-0-8053-0348-3.
- ^ Whittet, Douglas C. B. (2003). Dust in the Galactic Environment. CRC Basın. s. 45–46. ISBN 978-0-7503-0624-9.
- ^ Pikelʹner, Solomon Borisovich (1977). Yıldız Oluşumu. Springer. s. 38. ISBN 978-90-277-0796-3. Arşivlendi 2012-11-23 tarihinde orjinalinden. Alındı 2011-06-06.
- ^ Falkowski, P .; Scholes, R. J.; Boyle, E .; Canadell, J .; Canfield, D .; Elser, J .; Gruber, N.; Hibbard, K .; et al. (2000). "Küresel Karbon Döngüsü: Bir Sistem Olarak Dünya hakkındaki Bilgilerimizin Testi". Bilim. 290 (5490): 291–296. Bibcode:2000Sci ... 290..291F. doi:10.1126 / science.290.5490.291. PMID 11030643. S2CID 1779934.
- ^ Smith, T. M .; Cramer, W. P.; Dixon, R. K.; Leemans, R.; Neilson, R. P.; Solomon, A. M. (1993)."Küresel karasal karbon döngüsü". Su, Hava ve Toprak Kirliliği. 70 (1–4): 19–37. Bibcode:1993WASP ... 70 ... 19S. doi:10.1007 / BF01104986. S2CID 97265068.
- ^ Burrows, A .; Holman, J .; Parsons, A .; Boncuklanma, G .; Fiyat, G. (2017). Kimya3: İnorganik, Organik ve Fiziksel Kimyaya Giriş. Oxford University Press. s. 70. ISBN 978-0-19-873380-5. Arşivlendi 2017-11-22 tarihinde orjinalinden. Alındı 2017-05-07.
- ^ Levine, Joel S .; Augustsson, Tommy R .; Natarajan, Murali (1982). "Prebiyolojik paleoatmosfer: kararlılık ve bileşim". Yaşamın Kökenleri ve Biyosferlerin Evrimi. 12 (3): 245–259. Bibcode:1982OrLi ... 12..245L. doi:10.1007 / BF00926894. PMID 7162799. S2CID 20097153.
- ^ Loerting, T .; et al. (2001). "Karbonik Asidin Şaşırtıcı Kinetik Kararlılığı Üzerine". Angew. Chem. Int. Ed. 39 (5): 891–895. doi:10.1002 / (SICI) 1521-3773 (20000303) 39: 5 <891 :: AID-ANIE891> 3.0.CO; 2-E. PMID 10760883.
- ^ Haldane J. (1895). "Karbonik oksidin insan üzerindeki etkisi". Journal of Physiology. 18 (5–6): 430–462. doi:10.1113 / jphysiol.1895.sp000578. PMC 1514663. PMID 16992272.
- ^ Gorman, D .; Drewry, A .; Huang, Y. L .; Aynılar, C. (2003). "Karbon monoksitin klinik toksikolojisi". Toksikoloji. 187 (1): 25–38. doi:10.1016 / S0300-483X (03) 00005-2. PMID 12679050.
- ^ "Karbon bileşikleri: karbon suboksit". Arşivlendi 2007-12-07 tarihinde orjinalinden. Alındı 2007-12-03.
- ^ Bayes, K. (1961). "Karbon Suboksitin Fotolizi". Amerikan Kimya Derneği Dergisi. 83 (17): 3712–3713. doi:10.1021 / ja01478a033.
- ^ Anderson D. J .; Rosenfeld, R.N. (1991). "Karbon Suboksitin Fotodisosiasyonu". Kimyasal Fizik Dergisi. 94 (12): 7852–7867. Bibcode:1991JChPh..94.7857A. doi:10.1063/1.460121.
- ^ Sabin, J. R .; Kim, H. (1971). "Karbon trioksitin yapısı ve özellikleri üzerine teorik bir çalışma". Kimyasal Fizik Mektupları. 11 (5): 593–597. Bibcode:1971CPL .... 11..593S. doi:10.1016/0009-2614(71)87010-0.
- ^ Moll N. G .; Clutter D. R .; Thompson W. E. (1966). "Karbon Trioksit: Üretimi, Kızılötesi Spektrumu ve Katı CO Matrisinde İncelenen Yapısı2". Kimyasal Fizik Dergisi. 45 (12): 4469–4481. Bibcode:1966JChPh..45.4469M. doi:10.1063/1.1727526.
- ^ a b Fatiadi, Alexander J .; Isbell, Horace S .; Sager William F. (1963). "Siklik Polihidroksi Ketonlar. I. Hekzahidroksibenzenin (Benzeneheksol) Oksidasyon Ürünleri" (PDF). Ulusal Standartlar Bürosu Araştırma Dergisi Bölüm A. 67A (2): 153–162. doi:10.6028 / jres.067A.015. PMC 6640573. PMID 31580622. Arşivlenen orijinal (PDF) 2009-03-25 tarihinde. Alındı 2009-03-21.
- ^ Pauling, L. (1960). Kimyasal Bağın Doğası (3. baskı). Ithaca, NY: Cornell University Press. s.93. ISBN 978-0-8014-0333-0.
- ^ Greenwood ve Earnshaw, s. 297–301
- ^ Scherbaum, Franz; et al. (1988). ""Göreli Etkilerin bir sonucu olarak "Aurofiliklik": Hexakis (trihenylphosphaneaurio) metan Dikasyonu [(Ph3PAu)6C]2+". Angew. Chem. Int. Ed. Engl. 27 (11): 1544–1546. doi:10.1002 / anie.198815441.
- ^ Ritter, Stephen K. "Karbona altı bağ: Onaylandı". Kimya ve Mühendislik Haberleri. Arşivlendi 2017-01-09 tarihinde orjinalinden.
- ^ Yamashita, Makoto; Yamamoto, Yohsuke; Akiba, Kin-ya; Hashizume, Daisuke; Iwasaki, Fujiko; Takagi, Nozomi; Nagase, Shigeru (2005-03-01). "Antrasen İskeleti Taşıyan Hipervalent Pentacoordinate Karbon ve Bor Bileşiklerinin Sentezleri ve Yapıları - X-ışını Analizi ve DFT Hesaplamasına Dayalı Hipervalent Etkileşiminin Açıklanması". Amerikan Kimya Derneği Dergisi. 127 (12): 4354–4371. doi:10.1021 / ja0438011. ISSN 0002-7863. PMID 15783218.
- ^ Daha kısa Oxford İngilizce Sözlüğü, Oxford University Press
- ^ "Çinliler ilk elması kullandı". BBC haberleri. 17 Mayıs 2005. Arşivlendi 20 Mart 2007'deki orjinalinden. Alındı 2007-03-21.
- ^ van der Krogt, Peter. "Elementymology & Elements Multidict'te Carbonium / Carbon". Arşivlendi 2010-01-23 tarihinde orjinalinden. Alındı 2010-01-06.
- ^ Ferchault de Réaumur, R.-A. (1722). L'art de convert le fer forgé en acier, et l'art d'adoucir le fer fondu, ou de faire des ouvrages de fer fondu aussi finis que le fer forgé (1956'dan İngilizce çevirisi). Paris, Chicago.
- ^ "Karbon". Kanada Bağlanıyor. Arşivlenen orijinal 2010-10-27 tarihinde. Alındı 2010-12-07.
- ^ Senese, Fred. "Karbonu kim keşfetti?". Frostburg Eyalet Üniversitesi. Arşivlendi 2007-12-07 tarihinde orjinalinden. Alındı 2007-11-24.
- ^ Giolitti, Federico (1914). Demir ve Çeliğin Sementasyonu. McGraw-Hill Book Company, inc.
- ^ Senese, Fred (2000-09-09). "Karbonu kim keşfetti". Frostburg Eyalet Üniversitesi. Arşivlendi 2007-12-07 tarihinde orjinalinden. Alındı 2007-11-24.
- ^ Kroto, H. W .; Heath, J. R .; O'Brien, S. C .; Curl, R. F .; Smalley, R. E. (1985). "C60: Buckminsterfullerene ". Doğa. 318 (6042): 162–163. Bibcode:1985Natur.318..162K. doi:10.1038 / 318162a0. S2CID 4314237.
- ^ Fullerenleri keşfettikleri için "1996 Nobel Kimya Ödülü""". Arşivlendi 2007-10-11 tarihinde orjinalinden. Alındı 2007-12-21.
- ^ a b c USGS Mineraller Yıllığı: Grafit, 2009 Arşivlendi 2008-09-16 Wayback Makinesi ve Grafit: Mineral Emtia Özetleri 2011
- ^ Harlow, G.E. (1998). Elmasların doğası. Cambridge University Press. s. 223. ISBN 978-0-521-62935-5.
- ^ Catelle, W. R. (1911). Elmas. John Lane Şirketi. s. 159. Hindistan ve diğer yerlerdeki alüvyonlu elmaslar ile ilk buluntuların tartışılması
- ^ Ball, V. (1881). Hindistan'ın Elmasları, Altınları ve Kömürü. Londra, Truebner & Co. Ball, İngiliz hizmetinde bir Jeologdu. Bölüm I, Sayfa 1
- ^ Hershey, J.W. (1940). Elmaslar Kitabı: Meraklı Bilgileri, Özellikleri, Testleri ve Sentetik Üretimi. Kessinger Pub Co. s. 28. ISBN 978-1-4179-7715-4.
- ^ a b Janse, A.J.A. (2007). "1870'den Beri Küresel Kaba Elmas Üretimi". Değerli Taşlar ve Gemoloji. XLIII (Yaz 2007): 98–119. doi:10.5741 / GEMS.43.2.98.
- ^ a b Lorenz, V. (2007). "Batı Avustralya'da Argyle: Dünyanın en zengin çaplı borusu; geçmişi ve geleceği". Gemmologie, Zeitschrift der Deutschen Gemmologischen Gesellschaft. 56 (1/2): 35–40.
- ^ "Montana'da mikroskobik elmas bulundu". Montana Standardı. 2004-10-17. Arşivlenen orijinal 2005-01-21 tarihinde. Alındı 2008-10-10.
- ^ Cooke, Sarah (2004-10-19). "Montana'da Mikroskobik Elmas Bulundu". Livescience.com. Arşivlenen orijinal 2008-07-05 tarihinde. Alındı 2008-09-12.
- ^ "Delta Haberleri / Basın Bültenleri / Yayınları". Deltamine.com. Arşivlenen orijinal 2008-05-26 tarihinde. Alındı 2008-09-12.
- ^ Marshall, Stephen; Shore, Josh (2004-10-22). "Elmas Yaşam". Gerilla Haber Ağı. Arşivlenen orijinal 2008-06-09 tarihinde. Alındı 2008-10-10.
- ^ Cantwell, W. J .; Morton, J. (1991). "Kompozit malzemelerin darbe direnci - bir inceleme". Kompozitler. 22 (5): 347–62. doi:10.1016 / 0010-4361 (91) 90549-V.
- ^ Holtzapffel, Böl. (1856). Tornalama ve Mekanik Manipülasyon. Charles Holtzapffel. İnternet Arşivi Arşivlendi 2016-03-26 da Wayback Makinesi
- ^ "Endüstriyel Elmas İstatistikleri ve Bilgileri". Amerika Birleşik Devletleri Jeolojik Araştırması. Arşivlendi 2009-05-06 tarihinde orjinalinden. Alındı 2009-05-05.
- ^ Coelho, R. T .; Yamada, S .; Aspinwall, D. K .; Bilge, M.L.H. (1995). "MMC dahil alüminyum esaslı alaşımları delerken ve raybalarken polikristalin elmas (PCD) alet malzemelerinin uygulanması". International Journal of Machine Tools and Manufacture. 35 (5): 761–774. doi:10.1016/0890-6955(95)93044-7.
- ^ Harris, D. C. (1999). Kızılötesi pencereler ve kubbeler için malzemeler: özellikler ve performans. SPIE Basın. s. 303–334. ISBN 978-0-8194-3482-1.
- ^ Nusinovich, G.S. (2004). Gyrotronların fiziğine giriş. JHU Basın. s. 229. ISBN 978-0-8018-7921-0.
- ^ Sakamoto, M .; Endriz, J. G .; Scifres, D.R. (1992). "Elmas soğutucu üzerine monte edilmiş monolitik AlGaA'lardan (800 nm) lazer diyot dizisinden 120 W CW çıkış gücü". Elektronik Harfler. 28 (2): 197–199. Bibcode:1992ElL .... 28..197S. doi:10.1049 / el: 19920123.
- ^ Dorfer, Leopold; Moser, M .; Spindler, K .; Bahr, F .; Egarter-Vigl, E .; Dohr, G. (1998). "Orta Avrupa'da 5200 yıllık akupunktur mu?" Bilim. 282 (5387): 242–243. Bibcode:1998Sci ... 282..239D. doi:10.1126 / science.282.5387.239f. PMID 9841386. S2CID 42284618.
- ^ Donaldson, K .; Stone, V .; Bulanık, A .; Renwick, L .; MacNee, W. (2001). "Ultra ince parçacıklar". Mesleki ve Çevresel Tıp. 58 (3): 211–216. doi:10.1136 / oem.58.3.211. PMC 1740105. PMID 11171936.
- ^ Yetişkin Meyve Sineklerine Zehirli, Gençlere İyi Huylu Karbon Nanopartiküller Arşivlendi 2011-11-02 de Wayback Makinesi ScienceDaily (17 Ağustos 2009)
- ^ "Basın Bülteni - Titanik Afet: Yeni Teori Parmak Kömür Yangını". www.geosociety.org. Arşivlendi 2016-04-14 tarihinde orjinalinden. Alındı 2016-04-06.
- ^ McSherry, Patrick. "Kömür sığınağı Yangını". www.spanamwar.com. Arşivlendi 2016-03-23 tarihinde orjinalinden. Alındı 2016-04-06.
Kaynakça
- Greenwood, Norman N.; Earnshaw, Alan (1997). Elementlerin Kimyası (2. baskı). Butterworth-Heinemann. ISBN 978-0-08-037941-8.



