Fosfatidik asit - Phosphatidic acid
Fosfatidik asitler hücre sinyallemesi ve doğrudan aktivasyonu için önemli olan anyonik fosfolipidlerdir. lipit kapılı iyon kanalları. Fosfatidik asidin hidrolizi, her biri gliserol ve fosforik asitten oluşan bir molekül ve iki yağ asidi molekülüne yol açar. Çift tabakadaki fosfolipitlerin yaklaşık% 0.25'ini oluştururlar.[1]
Yapısı

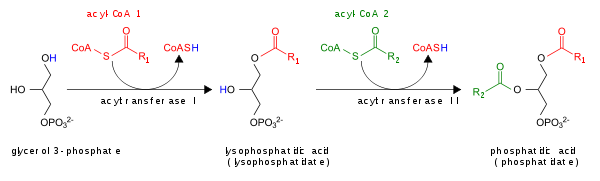
Fosfatidik asit aşağıdakilerden oluşur: gliserol omurga, genel olarak doymuş yağ asidi bağlı karbon -1, doymamış yağ asidi bağlı karbon -2 ve a fosfat bağlı grup karbon -3.[2][3]
Oluşum ve bozulma
De novo sentezin yanı sıra, PA üç şekilde oluşturulabilir:
- Tarafından fosfolipaz D (PLD), P-O bağının hidrolizi yoluyla fosfatidilkolin (PC) PA üretmek ve kolin.[4]
- Fosforilasyonu ile diaçilgliserol (DAG) tarafından DAG kinaz (DAGK)
- Asilasyonu ile lizofosfatidik asit lizoPA-asiltransferaz (LPAAT) ile; bu en yaygın olanı patika.[5]
PA, DAG'ye dönüştürülerek bozulur. lipid fosfat fosfohidrolazlar (LPP'ler)[6][7] veya fosfolipaz A (PLA) ile lizo-PA'ya.
PA'nın hücre içindeki rolü
PA'nın hücredeki rolü üç kategoriye ayrılabilir:
- PA, diğer birçok lipitin biyosentezinin öncüsüdür.
- PA'nın fiziksel özellikleri membran eğriliğini etkiler.
- PA, sitozolik proteinleri uygun membranlara (örn. sfingosin kinaz 1[8]).
- PA çok önemli bir rol oynar fototransdüksiyon içinde Meyve sineği[9]
- PA, iyon kanallarını açan bir lipit ligandıdır.[10] Ayrıca bakınız lipit kapılı iyon kanalları.
İlk üç rol birbirini dışlamaz. Örneğin PA, zar eğriliğini teşvik ederek ve çok daha enerjik olarak olumsuz boyun oluşumu ve kıstırma görevini gerçekleştirmek için proteinleri görevlendirerek vezikül oluşumuna dahil edilebilir.
Biyosentetik bir öncü olarak PA
PA, hücredeki tüm açilgliserol lipidlerinin oluşumu için (doğrudan veya dolaylı olarak) biyosentetik bir öncü görevi gören hayati bir hücre lipididir.[11]
Memelilerde ve Maya PA'nın de novo sentezi için iki farklı yol, gliserol 3-fosfat yolu veya dihidroksiaseton fosfat yolu bilinmektedir. Bakterilerde sadece eski yol mevcuttur ve bu yolu tıkayan mutasyonlar öldürücüdür ve PA'nın önemini gösterir. Bu yollardaki enzimlerin fazlalık olduğu memeli ve maya hücrelerinde, herhangi bir enzimin mutasyonu öldürücü değildir. Ancak şunu belirtmekte fayda var laboratuvar ortamındaçeşitli açiltransferazlar, PA'ya dahil edilen asil-CoA'lara göre farklı substrat spesifiklikleri sergiler. Farklı asiltransferazlar ayrıca farklı hücre içi dağılımlara sahiptir, örneğin endoplazmik retikulum (ER), mitokondri veya peroksizomlar ve aktive edilmiş yağ asitlerinin lokal konsantrasyonları. Bu, memeli ve maya hücrelerinde bulunan çeşitli asiltransferazların, farklı PA havuzlarının üretilmesinden sorumlu olabileceğini gösterir.[11]
PA'nın dönüştürülmesi diaçilgliserol LPPs tarafından (DAG), üretim için taahhüt adımıdır. fosfatidilkolin (PC), fosfatidiletanolamin (PE) ve fosfatidilserin (PS). Ek olarak, DAG ayrıca bir öncü olan CDP-DAG'ye dönüştürülür. fosfatidilgliserol (PG), fosfatidilinositol (PI) ve fosfoinositidler (PIP, PIP2, PIP3).[11]
PA konsantrasyonları, güçlü LPP'lerin aktivitesiyle hücrede son derece düşük seviyelerde tutulur.[6] Bunlar, PA'yı çok hızlı bir şekilde DAG'ye dönüştürür ve DAG, diğer pek çok lipidin öncüsü olduğundan, kısa sürede diğer membran lipidlerine metabolize olur. Bu, PA üretimindeki herhangi bir yukarı regülasyonun zaman içinde LPP'lerde ve DAG metabolize edici enzimlerde karşılık gelen bir yukarı regülasyonla eşleştirilebileceği anlamına gelir.
Bu nedenle PA, lipid sentezi ve hücre hayatta kalması için gereklidir, ancak normal koşullar altında hücre içinde çok düşük seviyelerde tutulur.
PA'nın biyofiziksel özellikleri
PA, gliserol omurgasına çok yakın, küçük, yüksek yüklü bir baş grubuna sahip olması bakımından benzersiz bir fosfolipiddir. PA'nın her ikisinde de rol oynadığı bilinmektedir. kesecik bölünme[12] ve füzyon,[13] ve bu roller PA'nın biyofiziksel özellikleriyle ilgili olabilir.
Membran tomurcuklanma veya füzyon bölgelerinde, membran oldukça kıvrımlı hale gelir veya kıvrılır. Veziküllerin tomurcuklanmasında önemli bir olay, örneğin Golgi, zar boynunun oluşturulması ve ardından daralmasıdır. Çalışmalar, bu sürecin lipit kaynaklı olabileceğini ve benzer şekilde benzersiz moleküler şekli nedeniyle DAG için merkezi bir rol olduğunu öne sürdü. İki açil zincirinin varlığı, ancak baş grubunun olmaması, membranlarda büyük bir negatif eğrilikle sonuçlanır.[14]
LPAAT BARS-50, Golgi'den tomurcuklanmada da rol oynadı.[12] Bu, lysoPA'nın PA'ya dönüşümünün membran eğriliğini etkileyebileceğini göstermektedir. LPAAT aktivitesi, asil zincirlerinin sayısını ikiye katlayarak, yüzey baş grubu değişmeden kalırken, zarın "içinde" bulunan lipidin enine kesit alanını büyük ölçüde arttırır. Bu, daha negatif bir zar eğriliği ile sonuçlanabilir. Araştırmacılar Utrecht Üniversitesi lisoPA'ya karşı PA'nın membran eğriliği üzerindeki etkisine, bunların PE'nin lipit çift tabakalarından lamellar olmayan fazlara geçiş sıcaklığı üzerindeki etkisini ölçerek incelemişlerdir. 31P-NMR.[15] Bu lipidler tarafından indüklenen eğriliğin sadece lizoPA'nın PA'ya karşı yapısına değil, aynı zamanda baş gruplarının hidrasyonu ve moleküller arası ve moleküller arası etkileşimler gibi dinamik özelliklere de bağlı olduğu gösterilmiştir. Örneğin, Ca2+ nötr fakat oldukça eğimli bir kompleks oluşturmak için iki PA ile etkileşime girebilir. Baş grupların aksi takdirde itici suçlamalarının etkisiz hale getirilmesi ve herhangi bir sterik engel asil zincirleri arasında güçlü moleküller arası etkileşimleri mümkün kılarak PA açısından zengin mikro bölgeler oluşturur. Böylece laboratuvar ortamındapH, sıcaklık ve katyon konsantrasyonlarındaki fizyolojik değişiklikler, PA ve lysoPA tarafından indüklenen membran eğriliği üzerinde güçlü etkilere sahiptir.[15] LysoPA, PA ve DAG'nin birlikte dönüştürülmesi - ve pH ve katyon konsantrasyonundaki değişiklikler - zarın bükülmesine ve kararsızlaşmasına neden olabilir ve sadece biyofiziksel özelliklerinden dolayı zar bölünmesinde doğrudan bir rol oynayabilir. Bununla birlikte, PA ve lysoPA'nın membran eğriliğini etkilediği gösterilmiştir. laboratuvar ortamında; rolleri in vivo belirsizdir.
LysoPA, PA ve DAG'nin membran eğriliğini arttırmadaki rolleri, proteinlerin membrana alınmasında bir rolü engellemez. Örneğin, Ca2+ karmaşık lipozomların füzyon gereksinimi, PLD ile azalmasına rağmen, anneksin I ilavesinden büyük ölçüde etkilenmez. Ancak, ek I ile ve PLD, füzyonun kapsamı büyük ölçüde artmıştır ve Ca2+ gereksinim neredeyse 1000 kat azaltılarak fizyolojik seviyelere yakın seviyelere indirildi.[13]
Bu nedenle PA'nın metabolik, biyofiziksel, işe alım ve sinyal verme rolleri birbiriyle ilişkili olabilir.
PA üretiminin ölçülmesi
PA hızla DAG'ye dönüştüğü için hücrede çok kısa ömürlüdür. Bu, PA üretimini ölçmenin ve dolayısıyla hücrede PA'nın rolünü incelemenin zor olduğu anlamına gelir. Bununla birlikte, PLD aktivitesi, hücreye birincil alkollerin eklenmesiyle ölçülebilir.[16] PLD daha sonra hidroliz yerine bir transfosfatidilasyon reaksiyonu gerçekleştirerek PA yerine fosfatidil alkoller üretir. Fosfatidil alkoller metabolik çıkmazlardır ve kolaylıkla ekstrakte edilebilir ve ölçülebilir. Böylece, PLD aktivitesi ve PA üretimi (PA'nın kendisi değilse) ölçülebilir ve PA oluşumunu bloke ederek PA'nın hücresel süreçlerdeki rolü çıkarılabilir.
Bir sinyal lipidi olarak PA
PA, geçici olarak patlama ve yüksek konsantrasyonda yerel olarak sinyal vermek için membranın büyük bölümünde düşük tutulur.[17] Örneğin TREK-1 kanalları, PLD ile yerel ortaklık ve PA üretimi ile etkinleştirilir.[18] PA'nın TREK-1 için ayrışma sabiti yaklaşık 10 mikromolardır[19]. Nispeten zayıf bağlama, membrandaki düşük PA konsantrasyonu ile birleştiğinde kanalın kapanmasına izin verir. Aktivasyon için yerel yüksek konsantrasyon, lokal lipid difüzyonunda en azından bazı kısıtlamalara işaret eder. Yüksek yerel patlamalarla birleştirilmiş düşük PA konsantrasyonu, PIP2 sinyallemesinin tersidir. PIP2, membranda nispeten yüksek tutulur ve daha sonra PIP2 sinyallemesini geçici olarak azaltmak için bir proteinin yakınında geçici olarak hidrolize edilir.[20] PA sinyal iletimi, sinyal veren lipidin yığın konsantrasyonunun, bir hedef protein üzerinde güçlü bir yerel etki uygulamak için değişmesi gerekmediğinden, PIP2 sinyalini yansıtır.
Yukarıda tanımlandığı gibi, PLD hidrolizler PC PA oluşturmak ve kolin. Kolin hücrede çok bol olduğu için, PLD aktivitesi kolin seviyelerini önemli ölçüde etkilemez; ve kolinin sinyal vermede herhangi bir rol oynaması olası değildir.[kaynak belirtilmeli ]
PLD aktivasyonunun çeşitli sinyalleme bağlamlarındaki rolü, kolinin rolünün olmaması ile birleştiğinde, PA'nın sinyallemede önemli olduğunu düşündürür. Bununla birlikte, PA hızla DAG'ye dönüştürülür ve DAG ayrıca bir sinyal molekülü olarak bilinir. Bu, PA'nın sinyallemede herhangi bir doğrudan rolü olup olmadığı veya sadece DAG üretimi için bir öncü olarak mı hareket ettiği sorusunu gündeme getirir.[21][22] PA'nın yalnızca bir DAG öncüsü olarak görev yaptığı tespit edilirse, hücrelerin neden iki enzim kullanarak DAG üretmesi gerektiği sorusu sorulabilir. PLC tek bir adımda DAG üretebilen.
PLD veya DAGK tarafından üretilen PA, [γ- eklenmesi ile ayırt edilebilir.32P] ATP. Bu, fosfat grubunun kinaz aktivitesinden yeni mi türetildiğini veya PC'den mi kaynaklandığını gösterecektir.[23]
PA ve DAG birbirine dönüştürülebilir olmalarına rağmen, aynı yollarda hareket etmezler. PLD'yi aktive eden uyaranlar, DAG'nin aşağı akışındaki enzimleri aktive etmez ve bunun tersi de geçerlidir. Örneğin, membranlara PLD ilavesinin [32P] etiketli PA ve [32P] etiketli fosfoinositidler.[24] DAGK inhibitörlerinin eklenmesi, [32P] etiketli PA, ancak PLD ile uyarılan fosfoinositid üretimi değil.
PA ve DAG birbirine dönüştürülebilir olmasına rağmen, sinyal veren ve sinyal vermeyen lipidlerin ayrı havuzlarının muhafaza edilebilmesi mümkündür. Çalışmalar, DAG sinyallemesine çoklu doymamış DAG aracılık ederken, PLD'den türetilmiş PA'nın tekli doymamış veya doymuş olduğunu ileri sürmüştür. Dolayısıyla, işlevsel doymuş / tekli doymamış PA, işlevsel olmayan doymuş / tekli doymamış DAG oluşturmak üzere hidrolize edilerek bozunabilirken, işlevsel çoklu doymamış DAG, işlevsel olmayan çoklu doymamış PA'ya dönüştürülerek bozunabilir.[21][25]
Bu model, PA ve DAG efektörlerinin aynı ana gruplara, ancak farklı asil zincirlerine sahip lipitleri ayırt edebilmesi gerektiğini ileri sürer. Bazı lipit bağlayıcı proteinler kendilerini membranlara yerleştirebilmelerine ve hipotetik olarak asil zincirinin tipini veya zarın ortaya çıkan özelliklerini tanıyabilmesine rağmen, birçok lipid bağlayıcı protein sitosoliktir ve yalnızca lipidlerin ana gruplarını bağlayarak membrana lokalize olur. Belki de farklı açil zincirleri, zardaki baş grubunun açısını etkileyebilir. Durum böyleyse, bir PA bağlayıcı alanın sadece PA'yı spesifik olarak bağlayabilmesi gerektiğini değil, aynı zamanda doğru açıda olan baş gruplarını da tanımlayabilmesi gerektiğini önerir. Mekanizma ne olursa olsun, böyle bir özgüllük mümkündür. Çoklu doymamış DAG'ye özgü domuz testisleri DAGK'da görülür.[26] ve farklı aktivitelerle farklı PA türlerini defosforile eden iki sıçan hepatosit LPP'si.[27] Ayrıca, PS tarafından SK1 aktivitesinin uyarılması laboratuvar ortamında PS'nin dioleoil (C18: 1), distearoil (C18: 0) veya 1-stearoil, 2-oleoil türlerinin kullanılmasına bağlı olarak büyük ölçüde değiştiği gösterilmiştir.[28] Bu nedenle, PA ve DAG birbirine dönüştürülebilir olmasına rağmen, farklı lipid türlerinin farklı biyolojik aktivitelere sahip olabileceği görülmektedir; ve bu, iki lipidin ayrı sinyal yollarını korumasını sağlayabilir.
Proteinler PA ile etkileştiği bilinen
Referanslar
- ^ Welti, R; Li, W; Li, M; Sang, Y; Biesiada, H; Zhou, HE; Rajashekar, CB; Williams, TD; Wang, X (30 Ağustos 2002). "Bitki stres yanıtlarında membran lipidlerinin profili. Arabidopsis'te donmaya bağlı lipid değişikliklerinde fosfolipaz D alfanın rolü". Biyolojik Kimya Dergisi. 277 (35): 31994–2002. doi:10.1074 / jbc.M205375200. PMID 12077151.
- ^ William W. Christie (4/10/2009). "Fosfatidik Asit, Lizofosfatidik Asit ve İlgili Lipitler". Arşivlenen orijinal 23 Ekim 2004. Alındı 5 Kasım 2009. Tarih değerlerini kontrol edin:
| tarih =(Yardım) - ^ Schroeder, R .; Londra, E .; Brown, D. (Aralık 1994). "Doymuş asil zincirleri arasındaki etkileşimler, lipidler ve glikosilfosfatidilinozitol (GPI) -a bağlı proteinler üzerinde deterjan direnci sağlar: lipozomlarda ve hücrelerde GPI bağlantılı proteinler benzer davranış gösterir". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 91 (25): 12130–12134. Bibcode:1994PNAS ... 9112130S. doi:10.1073 / pnas.91.25.12130. PMC 45390. PMID 7991596.
- ^ Liscovitch M, Czarny M, Fiucci G, Tang X (Şubat 2000). "Fosfolipaz D: yeni bir gen ailesinin moleküler ve hücre biyolojisi". Biochem. J. 345 (3): 401–15. doi:10.1042/0264-6021:3450401. PMC 1220771. PMID 10642495.
- ^ Devlin, T.M. 2004. Bioquímica, 4ª edición. Reverté, Barselona. ISBN 84-291-7208-4
- ^ a b Brindley DN, Wagoner DW (Mayıs 1996). "Fosfatidat fosfohidrolaz ve sinyal iletimi". Chem. Phys. Lipidler. 80 (1–2): 45–57. doi:10.1016/0009-3084(96)02545-5. PMID 8681429.
- ^ Brindley DN, Wagoner DW (Eylül 1998). "Memeli lipid fosfat fosfohidrolazları". J. Biol. Kimya. 273 (38): 24281–4. doi:10.1074 / jbc.273.38.24281. PMID 9733709.
- ^ Delon C, Manifava M, Wood E, vd. (Ekim 2004). "Sfingosin kinaz 1, fosfatidik asidin hücre içi bir efektörüdür". J. Biol. Kimya. 279 (43): 44763–74. doi:10.1074 / jbc.M405771200. PMID 15310762.
- ^ P, Raghu (Ağustos 2012). "Drosophila fotoreseptörlerinde lipid sinyali". Biochim Biophys Açta. 1821 (8): 1154–1165. doi:10.1016 / j.bbalip.2012.03.008. PMID 22487656.
- ^ Robinson, CV; Rohacs, T; Hansen, SB (Eylül 2019). "İyon Kanallarının Nano Ölçekli Lipid Düzenlemesini Anlamak İçin Araçlar". Biyokimyasal Bilimlerdeki Eğilimler. 44 (9): 795–806. doi:10.1016 / j.tibs.2019.04.001. PMC 6729126. PMID 31060927.
- ^ a b c Athenstaedt K, Daum G (Kasım 1999). "Fosfatidik asit, lipit metabolizmasında önemli bir ara ürün". Avro. J. Biochem. 266 (1): 1–16. doi:10.1046 / j.1432-1327.1999.00822.x. PMID 10542045.
- ^ a b Weigert R, Silletta MG, Spanò S, vd. (Kasım 1999). "CtBP / BARS, lizofosfatidik asidi asile ederek Golgi membranlarının fisyonunu indükler". Doğa. 402 (6760): 429–33. Bibcode:1999Natur.402..429W. doi:10.1038/46587. PMID 10586885.
- ^ a b Blackwood RA, Smolen JE, Transue A, vd. (Nisan 1997). "Fosfolipaz D aktivitesi, kompleks lipozomların Ca2 + ile indüklenen agregasyonunu ve füzyonunu kolaylaştırır". Am. J. Physiol. 272 (4 Pt 1): C1279–85. doi:10.1152 / ajpcell.1997.272.4.C1279. PMID 9142853.
- ^ Shemesh T, Luini A, Malhotra V, Burger KN, Kozlov MM (Aralık 2003). "Yerel Lipid Metabolizması Tarafından Harekete Geçirilen Golgi Tübüler Taşıyıcıların Önleme Daraltması: Teorik Bir Model". Biophys. J. 85 (6): 3813–27. Bibcode:2003BpJ .... 85.3813S. doi:10.1016 / S0006-3495 (03) 74796-1. PMC 1303683. PMID 14645071. Arşivlenen orijinal 2008-05-07 tarihinde.
- ^ a b Kooijman EE, Chupin V, de Kruijff B, Burger KN (Mart 2003). "Fosfatidik asit ve lisofosfatidik asit ile membran eğriliğinin modülasyonu". Trafik. 4 (3): 162–74. doi:10.1034 / j.1600-0854.2003.00086.x. PMID 12656989.
- ^ Morris AJ, Frohman MA, Engebrecht J (Ekim 1997). "Fosfolipaz D aktivitesinin ölçülmesi". Anal. Biyokimya. 252 (1): 1–9. doi:10.1006 / abio.1997.2299. PMID 9324933.
- ^ Robinson, CV; Rohacs, T; Hansen, SB (Eylül 2019). "İyon Kanallarının Nano Ölçekli Lipid Düzenlemesini Anlamak İçin Araçlar". Biyokimyasal Bilimlerdeki Eğilimler. 44 (9): 795–806. doi:10.1016 / j.tibs.2019.04.001. PMC 6729126. PMID 31060927.
- ^ Comoglio, Y; Levitz, J; Kienzler, MA; Lesage, F; Isacoff, EY; Sandoz, G (16 Eylül 2014). "Fosfolipaz D2, doğrudan etkileşim ve yerel fosfatidik asit üretimi yoluyla TREK potasyum kanallarını özellikle düzenler". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 111 (37): 13547–52. Bibcode:2014PNAS..11113547C. doi:10.1073 / pnas.1407160111. PMC 4169921. PMID 25197053.
- ^ Cabanos, C; Wang, M; Han, X; Hansen, SB (8 Ağustos 2017). "Çözünür Floresan Bağlanma Testi PIP'yi Ortaya Çıkarıyor2 TREK-1 Kanallarının Karşıtlığı ". Hücre Raporları. 20 (6): 1287–1294. doi:10.1016 / j.celrep.2017.07.034. PMC 5586213. PMID 28793254.
- ^ Pavel, MA; Chung, HW; Petersen, EN; Hansen, SB (Ekim 2019). "Lokal Anestezik ile TWIK-İlişkili K + Kanal İnhibisyonu için Polimodal Mekanizma". Anestezi ve Analjezi. 129 (4): 973–982. doi:10.1213 / ANE.0000000000004216. PMID 31124840.
- ^ a b Hodgkin MN, Pettitt TR, Martin A, Michell RH, Pemberton AJ, Wakelam MJ (Haziran 1998). "Diaçilgliseroller ve fosfatidatlar: hangi moleküler türler hücre içi habercilerdir?". Trends Biochem. Sci. 23 (6): 200–4. doi:10.1016 / S0968-0004 (98) 01200-6. PMID 9644971.
- ^ Wakelam MJ (Aralık 1998). "Diaçilgliserol - ne zaman hücre içi bir haberci olur?". Biochim. Biophys. Açta. 1436 (1–2): 117–26. doi:10.1016 / S0005-2760 (98) 00123-4. PMID 9838074.
- ^ Cockcroft S, Baldwin JM, Allan D (Temmuz 1984). "İnsan ve tavşan nötrofil membranlarının Ca2 + ile aktifleştirilmiş polifosfoinositid fosfodiesterazı". Biochem. J. 221 (2): 477–82. doi:10.1042 / bj2210477. PMC 1144062. PMID 6089740.
- ^ Moritz A, De Graan PN, Gispen WH, Wirtz KW (Nisan 1992). "Fosfatidik asit, fosfatidilinositol-4-fosfat kinazın spesifik bir aktivatörüdür". J. Biol. Kimya. 267 (11): 7207–10. PMID 1313792.
- ^ Bocckino SB, Blackmore PF, Wilson PB, Exton JH (Kasım 1987). "Hormonla işlenmiş hepatositlerde fosfolipaz D mekanizması yoluyla fosfatidat birikimi". J. Biol. Kimya. 262 (31): 15309–15. PMID 3117799.
- ^ Hodgkin MN, Gardner SD, Rose S, Paterson A, Martin A, Wakelam MJ (Mart 1997). "Sn-1-stearoil-2-araşidonoilgliserol kinazın domuz testislerinden saflaştırılması ve karakterizasyonu". Biochem. J. 322 (Pt 2): 529–34. doi:10.1042 / bj3220529. PMC 1218222. PMID 9065773.
- ^ Fleming IN, Yeaman SJ (Haziran 1995). "Sıçan karaciğerinden N-etilmaleimide duyarsız fosfatidik asit fosfohidrolazın (PAP2) saflaştırılması ve karakterizasyonu". Biochem. J. 308 (Pt 3): 983–9. doi:10.1042 / bj3080983. PMC 1136819. PMID 8948459.
- ^ Olivera A, Rosenthal J, Spiegel S (Mart 1996). "Asidik fosfolipidlerin sfingosin kinaz üzerindeki etkisi". J. Cell. Biyokimya. 60 (4): 529–37. doi:10.1002 / (SICI) 1097-4644 (19960315) 60: 4 <529 :: AID-JCB9> 3.0.CO; 2-U. PMID 8707892.
- ^ Wiczer, Brian M; Thomas, George (27 Mart 2012). "Fosfolipaz D ve mTORC1: Besinler Onları Bir Araya Getiren Şeydir". Sci. Sinyal. 5 (217): pe13. doi:10.1126 / scisignal.2003019. PMID 22457329.
- ^ Cabanos, C; Wang, M; Han, X; Hansen, SB (8 Ağustos 2017). "Çözünür Floresan Bağlanma Testi PIP'yi Ortaya Çıkarıyor2 TREK-1 Kanallarının Karşıtlığı ". Hücre Raporları. 20 (6): 1287–1294. doi:10.1016 / j.celrep.2017.07.034. PMC 5586213. PMID 28793254.
- ^ Hite, RK; Butterwick, JA; MacKinnon, R (6 Ekim 2014). "Kv kanalı voltaj sensörü fonksiyonunun fosfatidik asit modülasyonu". eLife. 3. doi:10.7554 / eLife.04366. PMC 4212207. PMID 25285449.
- ^ Hansen, SB; Tao, X; MacKinnon, R (28 Ağustos 2011). "Klasik içe doğru doğrultucu K + kanal Kir2.2'nin PIP2 aktivasyonunun yapısal temeli". Doğa. 477 (7365): 495–8. Bibcode:2011Natur.477..495H. doi:10.1038 / nature10370. PMC 3324908. PMID 21874019.
