Fotosistem I - Photosystem I

| Fotosistem I | |||||||||
|---|---|---|---|---|---|---|---|---|---|
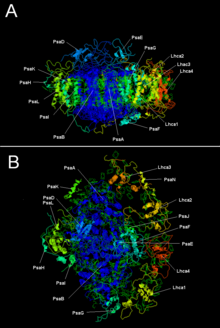 LHC I ile bitki fotosistem I | |||||||||
| Tanımlayıcılar | |||||||||
| EC numarası | 1.97.1.12 | ||||||||
| Veritabanları | |||||||||
| IntEnz | IntEnz görünümü | ||||||||
| BRENDA | BRENDA girişi | ||||||||
| ExPASy | NiceZyme görünümü | ||||||||
| KEGG | KEGG girişi | ||||||||
| MetaCyc | metabolik yol | ||||||||
| PRIAM | profil | ||||||||
| PDB yapılar | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||

Fotosistem I (PSIveya plastosiyanin-ferredoksin oksidoredüktaz) ikisinden biridir fotosistemler içinde fotosentetik ışık reaksiyonları nın-nin yosun, bitkiler, ve siyanobakteriler. Fotosistem ben [1] bir integral membran proteini karmaşık o kullanır ışık enerji katalize etmek elektron transferi karşısında tilakoid zar plastosiyanin -e ferredoksin. Sonuçta, Photosystem I tarafından transfer edilen elektronlar, yüksek enerjili taşıyıcıyı üretmek için kullanılır. NADPH.[2] Tüm fotosentetik elektron taşıma zincirinin birleşik eylemi aynı zamanda bir proton güdü kuvveti üretmek için kullanılan ATP. PSI, 110'dan fazla kofaktörler, önemli ölçüde daha fazla Fotosistem II.[3]
Tarih
Bu fotosistem PSI olarak bilinir çünkü daha önce keşfedilmiştir. Fotosistem II, gelecekteki deneyler gösterdi ki Fotosistem II aslında fotosentetik elektron taşıma zincirinin ilk enzimidir. PSI'ın yönleri 1950'lerde keşfedildi, ancak bu keşiflerin önemi henüz bilinmiyordu.[4] Louis Duysens ilk olarak 1960 yılında Fotosistemler I ve II kavramlarını önerdi ve aynı yıl Fay Bendall ve Robert Hill'in önerisi, önceki keşifleri uyumlu bir seri fotosentetik reaksiyonlar.[4] Hill ve Bendall'ın hipotezi daha sonra 1961'de Duysens ve Witt grupları tarafından yapılan deneylerde gerekçelendirildi.[4]
Bileşenler ve eylem
PSI, PsaA ve PsaB'nin iki ana alt birimi, yakından ilişkili proteinlerdir. bağlayıcı hayati elektron transfer kofaktörlerinin P700, Acc, A0, Bir1ve Fx. PsaA ve PsaB'nin ikisi de integral membran proteinleri 730 ile 750 arasında amino asitler 11 içeren zar ötesi segmentler. A [4Fe-4S] demir-kükürt kümesi F olarak adlandırıldıx dır-dir koordine dörde sisteinler; iki sistein, her biri PsaA ve PsaB tarafından sağlanır. Her birinde bulunan iki sistein proksimaldir ve bir döngü dokuzuncu ile onuncu arasında zar ötesi segmentler. Bir lösin fermuar motif mevcut gibi görünüyor [5] akıntı yönünde ve PsaA / PsaB'nin dimerizasyonuna katkıda bulunabilir. Terminal elektron alıcıları FBir ve FB, ayrıca [4Fe-4S] demir-kükürt kümeleri, F yakınındaki PsaA / PsaB çekirdeğine bağlanan PsaC adlı 9 kDa proteininde bulunurX.[6][7]
| Protein alt birimleri | Açıklama |
|---|---|
| PsaA | P700, A0, A1 ve Fx'in bağlanmasında rol oynayan ilgili büyük transmembran proteinleri. Bir bölümü fotosentetik reaksiyon merkezi protein ailesi. |
| PsaB | |
| PsaC | Demir-kükürt merkezi; F için apoproteina ve Fb |
| PsaD | Montaj için gereklidir, ferredoksinin bağlanmasına yardımcı olur. InterPro: IPR003685 |
| PsaE | InterPro: IPR003375 |
| PsaI | PsaL'yi stabilize edebilir. Stabilize eder hafif hasat kompleksi II bağlayıcı.[9] InterPro: IPR001302 |
| PsaJ | InterPro: IPR002615 |
| PsaK | InterPro: IPR035982 |
| PsaL | InterPro: IPR036592 |
| PsaM | InterPro: IPR010010 |
| PsaX | InterPro: IPR012986 |
| sitokrom b6f karmaşık | Çözünür protein |
| Fa | PsaC'den; İçinde elektron taşıma zinciri (VB) |
| Fb | PsaC'den; ETC'de |
| Fx | PsaAB'den; ETC'de |
| Ferredoksin | ETC'de elektron taşıyıcı |
| Plastosiyanin | Çözünür protein |
| Lipidler | Açıklama |
| MGDG II | Monogalactosyldiglyceride lipid |
| PG I | Fosfatidilgliserol fosfolipid |
| PG III | Fosfatidilgliserol fosfolipid |
| PG IV | Fosfatidilgliserol fosfolipid |
| Pigmentler | Açıklama |
| Klorofil a | 90 pigment anten sistemindeki moleküller |
| Klorofil a | ETC'de 5 pigment molekülü |
| Klorofil a0 | ETC'de modifiye edilmiş klorofilin erken elektron alıcısı |
| Klorofil a′ | ETC'de 1 pigment molekülü |
| β-Karoten | 22 karotenoid pigment molekülleri |
| Koenzimler ve kofaktörler | Açıklama |
| QK-A | Erken elektron alıcısı K vitamini1 filokinon ETC'de |
| QK-B | Erken elektron alıcısı K vitamini1 ETC'de filokinon |
| FNR | FerredoksinNADP+ oksidoredüktaz enzimi |
| CA2+ | Kalsiyum iyon |
| Mg2+ | Magnezyum iyon |
Foton
Foto heyecan Anten kompleksindeki pigment molekülleri elektron transferini indükler.[10]
Anten kompleksi
Anten kompleksi şu moleküllerden oluşur: klorofil ve karotenoidler iki protein üzerine monte edilmiştir.[11] Bu pigment molekülleri, rezonans enerjisi fotonlardan foto heyecanlandıklarında. Anten molekülleri hepsini emebilir dalga boyları içindeki ışık görünür spektrum.[12] Bu pigment moleküllerinin sayısı organizmadan organizmaya değişir. Örneğin, siyanobakteri Synechococcus elongatus (Thermosynechococcus elongatus) yaklaşık 100 klorofil ve 20 karotenoid içerirken ıspanak kloroplastlarda yaklaşık 200 klorofil ve 50 karotenoid bulunur.[12][3] PSI'ın anten kompleksi içinde yer alan klorofil molekülleri bulunur. P700 reaksiyon merkezleri. Anten moleküllerinin etrafından geçirdiği enerji, reaksiyon merkezine yönlendirilir. P700 başına 120 veya 25 klorofil molekülü olabilir.[13]
P700 reaksiyon merkezi
P700 reaksiyon merkezi, 700 dalga boyunda ışığı en iyi emen modifiye edilmiş klorofilden oluşur.nm daha yüksek dalga boyları ağartmaya neden olur.[14] P700, anten moleküllerinden enerji alır ve bir elektronu daha yüksek bir enerji seviyesine yükseltmek için her bir fotonun enerjisini kullanır. Bu elektronlar çiftler halinde bir oksidasyon redüksiyon P700'den elektron alıcılarına süreç. P700'de bir elektrik potansiyeli yaklaşık −1,2 volt. Reaksiyon merkezi iki klorofil molekülünden yapılmıştır ve bu nedenle dimer.[11] Dimerin bir klorofilden oluştuğu düşünülmektedir. a molekül ve bir klorofil a′ Molekül (P700, webber). Bununla birlikte, P700 diğer anten molekülleri ile bir kompleks oluşturuyorsa, artık bir dimer olamaz.[13]
Modifiye edilmiş klorofil A0 ve A1
İki modifiye edilmiş klorofil molekülü, PSI'daki erken elektron alıcılarıdır. PsaA / PsaB tarafı başına bir tane bulunurlar ve elektronların F'ye ulaşmak için alabileceği iki dal oluştururlar.x. Bir0 P700'den elektronları kabul eder, onu A'ya geçirir1 daha sonra elektronu aynı taraftaki kinona geçirir. Farklı türlerin her iki A / B dalı için farklı tercihleri olduğu görülmektedir.[15]
Filokinon
Filokinon PSI'daki bir sonraki erken elektron alıcısıdır. Phylloquinone ayrıca bazen K vitamini olarak da adlandırılır.1.[16] Filokinon A'yı okside eder1 elektronu almak ve sırayla F'yi düşürmek içinx elektronu F'ye geçirmek içinb ve Fa.[16][17] F'nin azaltılmasıx hız sınırlayıcı adım gibi görünüyor.[15]
Demir-kükürt kompleksi
Üç proteinli demir-kükürt reaksiyon merkezleri PSI'da bulunur. F etiketlix, Fave Fb, elektron rölesi görevi görürler.[18] Fa ve Fb bağlı protein alt birimleri PSI kompleksinin ve Fx PSI kompleksine bağlıdır.[18] Çeşitli deneyler, demir-kükürt kofaktör yönelimi teorileri ile işlem sırası arasında bir miktar eşitsizlik olduğunu göstermiştir.[18] Bir model bu Fx F'ye bir elektron geçira, onu F'ye geçirirb ferredoksine ulaşmak için.[15]
Ferredoksin
Ferredoksin (Fd) bir çözünür azalmasını kolaylaştıran protein NADP+
NADPH'ye.[19] Fd, bir elektronu ya yalnız bir tilakoid'e ya da enzim azalır NADP+
.[19] Thylakoid membranlar, Fd'nin her bir fonksiyonu için bir bağlanma bölgesine sahiptir.[19] Fd'nin temel işlevi, demir-kükürt kompleksinden enzime bir elektron taşımaktır. ferredoksin–NADP+
redüktaz.[19]
Ferredoksin–NADP+
redüktaz (FNR)
Bu enzim elektronu indirgenmiş ferredoksinden NADP+
NADPH'ye indirgemeyi tamamlamak için.[20] FNR ayrıca bağlanarak NADPH'den bir elektron kabul edebilir.[20]
Plastosiyanin
Plastosiyanin elektronu sitokrom b6f'den PSI'nın P700 kofaktörüne aktaran bir elektron taşıyıcısıdır.[10][21]
Ycf4 protein alanı
Ycf4 protein alanı tilakoid membran üzerinde bulunur ve fotosistem I için hayati önem taşır. Bu tilakoid transmembran proteini, fotosistem I bileşenlerinin bir araya getirilmesine yardımcı olur, onsuz fotosentez etkisiz olur.[22]
Evrim
Moleküler veriler, PSI'nın muhtemelen yeşil kükürt bakterileri. Yeşil kükürt bakterilerinin fotosistemleri ve siyanobakteriler, yosun ve daha yüksek bitkiler aynı değildir, ancak birçok benzer işlev ve benzer yapı vardır. Farklı fotosistemler arasında üç ana özellik benzerdir.[23] Birincisi, redoks potansiyeli, ferredoksini azaltacak kadar negatiftir.[23] Daha sonra, elektron kabul eden reaksiyon merkezleri demir-sülfür proteinlerini içerir.[23] Son olarak, her iki fotosistemin komplekslerindeki redoks merkezleri, bir protein alt birimi dimerinde inşa edilir.[23] Yeşil kükürt bakterilerinin fotosistemi, aynı kofaktörlerin tümünü bile içerir. elektron taşıma zinciri PSI'da.[23] İki fotosistem arasındaki benzerliklerin sayısı ve derecesi, PSI'nın yeşil sülfür bakterilerinin analog fotosisteminden türetildiğini güçlü bir şekilde gösterir.
Ayrıca bakınız
Referanslar
- ^ Golbeck JH (1987). "Photosystem I reaksiyon merkezi kompleksinin yapısı, işlevi ve organizasyonu". Biochimica et Biophysica Açta (BBA) - Bioenergetics üzerine incelemeler. 895 (3): 167–204. doi:10.1016 / s0304-4173 (87) 80002-2. PMID 3333014.
- ^ Yamori W, Shikanai T (Nisan 2016). "Fotosentez ve Bitki Büyümesinin Sürdürülmesinde Fotosistem I Çevresinde Döngüsel Elektron Taşınmasının Fizyolojik İşlevleri". Bitki Biyolojisinin Yıllık İncelemesi. 67: 81–106. doi:10.1146 / annurev-arplant-043015-112002. PMID 26927905.
- ^ a b Nelson N, Yocum CF (2006). "Fotosistem I ve II'nin yapısı ve işlevi". Bitki Biyolojisinin Yıllık İncelemesi. 57: 521–65. doi:10.1146 / annurev.arplant.57.032905.105350. PMID 16669773.
- ^ a b c Fromme P, Mathis P (2004). "Fotosistemi çözme I tepki merkezi: bir tarih veya birçok çabanın toplamı". Fotosentez Araştırması. 80 (1–3): 109–24. doi:10.1023 / B: PRES.0000030657.88242.e1. PMID 16328814. S2CID 13832448.
- ^ Webber AN, Malkin R (Mayıs 1990). "Fotosistem I reaksiyon merkezi proteinleri, lösin fermuar motiflerini içerir. Dimer oluşumunda önerilen bir rol". FEBS Mektupları. 264 (1): 1–4. doi:10.1016/0014-5793(90)80749-9. PMID 2186925. S2CID 42294700.
- ^ Jagannathan B, Golbeck JH (Nisan 2009). "Zar proteinlerinde biyolojik simetriyi kırma: PsaC'nin sözde C2 simetrik Fotosistem I çekirdeği üzerindeki asimetrik yönelimi". Hücresel ve Moleküler Yaşam Bilimleri. 66 (7): 1257–70. doi:10.1007 / s00018-009-8673-x. PMID 19132290. S2CID 32418758.
- ^ Jagannathan B, Golbeck JH (Haziran 2009). "Fotosistem I'deki PsaC ve PsaA / PsaB heterodimer arasındaki bağlanma arayüzünün anlaşılması". Biyokimya. 48 (23): 5405–16. doi:10.1021 / bi900243f. PMID 19432395.
- ^ Saenger W, Jordan P, Krauss N (Nisan 2002). "Fotosistem I'deki protein alt birimlerinin ve kofaktörlerin birleşimi". Yapısal Biyolojide Güncel Görüş. 12 (2): 244–54. doi:10.1016 / S0959-440X (02) 00317-2. PMID 11959504.
- ^ Plöchinger, Magdalena; Torabi, Salar; Rantala, Marjaana; Tikkanen, Mikko; Suorsa, Marjaana; Jensen, Poul-Erik; Aro, Eva Mari; Meurer, Jörg (Eylül 2016). "Düşük Moleküler Ağırlıklı Protein PsaI, Fotosistem I'in Hafif Hasat Kompleksi II Yerleştirme Alanını Stabilize Ediyor". Bitki Fizyolojisi. 172 (1): 450–463. doi:10.1104 / sayfa 16.00647. PMC 5074619. PMID 27406169.
- ^ a b Kuzgun PH, Evert RF, Eichhorn SE (2005). "Fotosentez, Işık ve Yaşam". Bitki Biyolojisi (7. baskı). New York: W. H. Freeman. pp.121–127. ISBN 978-0-7167-1007-3.
- ^ a b Zeiger E, Taiz L (2006). "Bölüm 7: Konu 7.8: Fotosistem I". Bitki Fizyolojisi (4. baskı). Sunderland, MA: Sinauer Associates. ISBN 0-87893-856-7.
- ^ a b "Fotosentetik İşlem". Arşivlenen orijinal 2009-02-19 tarihinde.
- ^ a b Shubin VV, Karapetyan NV, Krasnovsky AA (Ocak 1986). "Fotosistem 1'in pigment-protein kompleksinin moleküler düzeni". Fotosentez Araştırması. 9 (1–2): 3–12. doi:10.1007 / BF00029726. PMID 24442279. S2CID 26158482.
- ^ Rutherford AW, Heathcote P (Aralık 1985). "Fotosistem-I'de birincil fotokimya". Fotosentez Araştırması. 6 (4): 295–316. doi:10.1007 / BF00054105. PMID 24442951. S2CID 21845584.
- ^ a b c Grotjohann, ben; Fromme, P (2013). "Fotosistem I". Biyolojik kimya ansiklopedisi (İkinci baskı). Londra. s. 503–507. doi:10.1016 / B978-0-12-378630-2.00287-5. ISBN 978-0-12-378630-2.
- ^ a b Itoh S, Iwaki M (1989). "K vitamini1 (Phylloquinone) Eter ile ekstrakte edilmiş Ispanak PSI Parçacıklarının FeS merkezlerinin Devirini Geri Kazandırır ". FEBS Mektupları. 243 (1): 47–52. doi:10.1016/0014-5793(89)81215-3. S2CID 84602152.
- ^ Palace GP, Franke JE, Warden JT (Mayıs 1987). "Filokinon, fotosistem I'deki zorunlu bir elektron taşıyıcısı mıdır?". FEBS Mektupları. 215 (1): 58–62. doi:10.1016/0014-5793(87)80113-8. PMID 3552735. S2CID 42983611.
- ^ a b c Vassiliev IR, Antonkine ML, Golbeck JH (Ekim 2001). "Tip I reaksiyon merkezlerinde demir-kükürt kümeleri". Biochimica et Biophysica Açta (BBA) - Bioenergetics. 1507 (1–3): 139–60. doi:10.1016 / S0005-2728 (01) 00197-9. PMID 11687212.
- ^ a b c d Forti G, Maria P, Grubas G (1985). "Ferredoksinin tilakoidlerle İki Etkileşim Yeri". FEBS Mektupları. 186 (2): 149–152. doi:10.1016/0014-5793(85)80698-0. S2CID 83495051.
- ^ a b Madoz J, Fernández Recio J, Gómez Moreno C, Fernández VM (Kasım 1998). "Ferredoksinin Diyaforaz Reaksiyonunun Araştırılması -NADP+
Elektrokimyasal Yöntemlerle Redüktaz " (PDF). Biyoelektrokimya ve Biyoenerjetik. 47 (1): 179–183. doi:10.1016 / S0302-4598 (98) 00175-5. - ^ Hope AB (Ocak 2000). "Sitokrom f, plastosiyanin ve fotosistem I arasındaki elektron transferleri: kinetik ve mekanizmalar". Biochimica et Biophysica Açta (BBA) - Bioenergetics. 1456 (1): 5–26. doi:10.1016 / S0005-2728 (99) 00101-2. PMID 10611452.
- ^ Boudreau E, Takahashi Y, Lemieux C, Turmel M, Rochaix JD (Ekim 1997). "Chlamydomonas reinhardtii'nin kloroplast ycf3 ve ycf4 açık okuma çerçeveleri, fotosistem I kompleksinin birikimi için gereklidir.". EMBO Dergisi. 16 (20): 6095–104. doi:10.1093 / emboj / 16.20.6095. PMC 1326293. PMID 9321389.
- ^ a b c d e Lockau W, Nitschke W (1993). "Fotosistem I ve Bakteriyel Benzerleri". Fizyoloji Plantarum. 88 (2): 372–381. doi:10.1111 / j.1399-3054.1993.tb05512.x.
