Senil plaklar - Senile plaques
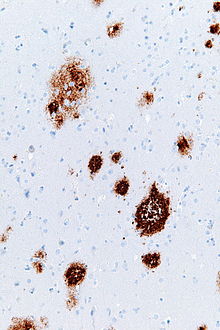
Senil plaklar (Ayrıca şöyle bilinir nöritik plaklarveya amiloid plaklar) hücre dışı mevduatları amiloid beta içinde akıl beynin.[1][2] Dejeneratif sinirsel yapılar ve bol miktarda mikroglia ve astrositler senil plak birikintileri ile ilişkilendirilebilir. Bu tortular ayrıca bir yan ürünü olabilir yaşlanma (yaşlanma). Bununla birlikte, çok sayıda senil plak ve nörofibrillerin karakteristik özellikleridir Alzheimer hastalığı.[3] Anormal nöritler yaşlılık plaklarında birincil olarak nörofibriler yumakların bir bileşeni olan çift sarmal filamentlerden oluşur.[4] Plakların şekli ve boyutu değişkendir, ancak ortalama 50 μm boyutunda.[5] Alzheimer hastalığında bunlar öncelikle şunlardan oluşur: amiloid beta peptidler. Bu polipeptitler toplanma eğilimindedir ve nörotoksik.
Tarih
1892'de Paul Blocq ve Gheorghe Marinescu ilk önce gri maddede plak birikintilerinin varlığını tanımladı.[6][7] Benzerliklerinin bir sonucu olarak aktinomiçes uykular denirdi druse nekroz tarafından Oskar Fischer 20. yüzyılın başlarında. Plaklar arasındaki bağlantı ve demans tarafından keşfedildi Alois Alzheimer 1906'da.[8] 1911'e kadar Max Bielschowsky plak birikintilerinin amiloid yapısını önerdi. Aynı yıl Teofil Simchowicz senil plaklar terimini tanıttı.[9] Wisniewski, nöritik plaklar terimini 1973'te icat etti. 20. yüzyılın ikinci yarısında plak oluşumunda immünolojik ve genetik faktörlerin önerilen teorileri gördü.[10] İstatistiksel araştırmalar J.A.N. Corsellis ve M. Franke 1970'lerde. M. Franke, frontal korteksteki senil plakların sayısı 200 / mm'den fazla olduğunda demans hastalığının ortaya çıkma olasılığının yüksek olduğunu gösterdi.3. 1985'e kadar beta amiloid oluşumlar, biyokimyasal tekniklerle başarıyla tanımlandı, ancak senil plakların önemi ve oluşumu hakkında birçok çözülmemiş soru kaldı.
Oluşum ve açıklama
Konsantre sinaps nöronların amiloid öncü protein (APP) plazma zarı boyunca uzanır. Bu proteinin bir kısmı bir Aβ peptid sıra. Bu bölge, proteinleri kodlayan APP'yi kapsayan DNA segmentinin bir parçasını içerir.[11]
Senil plakların oluşumunda, Ap, amiloid öncü proteinden ayrılır. Üç enzimin APP'yi işleyebilmesine rağmen, sadece-(beta) ve γ- (gama) sekretazı senil plakların oluşumunda doğrudan rol oynar. β-sekretaz (BACE), proteinleri ve peptitleri parçalayan bir proteaz enzimidir. Bu proteaz Ap'nın karboksil terminal fragmanlarını daha da ortaya çıkarmak için APP'yi böler. APP'nin büyük kısmı bu işlemle serbest bırakıldıktan sonra,-sekretaz kalan karboksil fragmanlarını ayırır. zar ötesi alan adı. BACE aktivitesini izleyen γ-sekretazın ardışık eylemleri, hücre dışı boşluğa salınan Ap protein fragmanları (amiloid beta) ile sonuçlanır.[11] Sonunda, nöronal sinapsların dışında amiloid beta birikimi, beyin hücrelerinin ince dallarını ve bağlantılarını bir kenara iten toplu bir plak kütlesi oluşturur.
Oluşumu amiloid beta fragmanlar insan vücudunda normal bir olaydır. Bununla birlikte, plak birikintilerinin oluşumuna yol açan Aβ birikimi alışılmadık bir fenomendir. Bu anormalliğin nedeni büyük ölçüde bilinmemekle birlikte, araştırmalar, birkaç amino asit uzunluğunda farklılık gösteren ve kolaylıkla plaklarda biriken belirli amiloid beta türlerini ortaya çıkarmıştır. Bu türler daha patojeniktir.[12]
Kimlik

Senil plaklar görülebilir ışık mikroskobu boyama tekniklerini kullanarak gümüş, Kongo kırmızısı, Tiyoflavin, kresil menekşe, ve PAS reaksiyonu. Plak birikintileri ayrıca floresan yoluyla görülebilir ve immünofloresans mikroskopi.[4][13] Bielschowsky gümüş boyama, yaşlılık plaklarını görselleştirmenin en az etkili yolu olarak bulundu, oysa Campbell ve Gallyas gümüş boyama teknikleri gelişmiş tanımlama ve doğruluk gösterdi. Kongo kırmızısı kullanılarak, mevcut yaşlılık plaklarının sadece dörtte biri gözle görülür şekilde boyandı.[12] Senil plaklar, aynı zamanda, beta amiloid. Yukarıdaki boyama yöntemleriyle ilgili temel sorun, yaşlılık plaklarını doğru bir şekilde tanımlamak için nöral doku bölümlerinin beyinden kesilip çıkarılması gerektiğidir. Bu sorunludur çünkü sinir dokusunu çıkarmak, gerçek plakların kendisi kadar zararlı olabilir.
Hastalık
Alzheimer hastalığının nöropatolojik-histolojik doğrulamasının önemli bir kriteri senil plakların oluşumudur. Senil plaklarla ilişkili beta amiloid peptitlerinin, Alzheimer hastalığının riski, başlangıcı ve ilerlemesinde de merkezi bir rol oynadığı bulunmuştur. Beta amiloid 42 olarak bilinen daha uzun beta amiloid türleri özellikle önemlidir. Yüksek beta amiloid seviyeleri ve beta amiloid 42'nin beta amiloid 40'ın daha kısa ana türlerine oranındaki yükselmenin önemli olduğu tespit edilmiştir. Alzheimer Hastalığının patogenezindeki erken olaylar.[14]
Alzheimer hastalığı doğrulamasındaki diğer faktörler arasında patolojik nörofibriler, düğümler ve hidrosefali olan atrofik beyin bulunur. Patolojik nörofibriler oluşumunun ve dağılımının bir düzenliliği vardır.[15] ve hastalığın evresinin belirlenmesine izin verir. Çok sayıda plağın ortaya çıkmasıyla birlikte, Alzheimer hastalığı yüksek olasılıkla teşhis edilebilir. Senil plakların varlığı ile Down Sendromu ayrıca doğrulandı.[1]
Oluşum
Senil plaklar insan ve hayvan beyinlerinde (örneğin memeliler ve kuşlar) bulunabilir. 60 yaşından (% 10) 80 yaşına (% 60) kadar, senil plakları olan kişilerin oranı doğrusal olarak artar. Oluşan plakların küçük bir kısmı yaşlanmanın fizyolojik sürecinden kaynaklanıyor olabilir. Kadınların plaklara sahip olma olasılığı erkeklerden biraz daha yüksektir.[5] Plaklar genellikle amigdaloid çekirdeğinde ve beyin korteksinin sulkusunda görülür.
Araştırma
Beta amiloid seviyelerini düşüren artan çeşitli bileşikler tanımlanmaktadır. Bu bileşiklerin birçoğu beta amiloid 42 seçiciliğine sahipken diğerleri amiloid öncü proteini modüle etmeye çalışır. Bu tür bileşikler şimdi Alzheimer hastalığının tedavisinde nasıl faydalı olabileceklerini belirlemek için klinik değerlendirmeye ulaşmaktadır.[14]
Ayrıca bakınız
Referanslar
- ^ a b Cras P; Kawai M; Lowery D; Gonzalez-DeWhitt P; Greenberg B; Perry G (Eylül 1991). "Alzheimer hastalığında yaşlılık plak nöritleri, amiloid öncü protein biriktirir". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 88 (17): 7552–6. doi:10.1073 / pnas.88.17.7552. PMC 52339. PMID 1652752.
- ^ Purves, Dale; Augustine, George J .; Fitzpatrick, David; Hall, William C .; LaManita, Anthony-Samuel; Beyaz, Leonard E .; Mooney, Richard D .; Platt, Michael L. (2012). Sinirbilim (5. baskı). Sunderland, MA: Sinauer Associates. s. 713. ISBN 978-0-87893-695-3.
- ^ Ballard, C; Gauthier, S; Corbett, A; Brayne, C; Aarsland, D; Jones, E (19 Mart 2011). "Alzheimer hastalığı". Lancet. 377 (9770): 1019–31. doi:10.1016 / S0140-6736 (10) 61349-9. PMID 21371747.
- ^ a b Ksiezak-Reding H, Morgan K, Mattiace LA, vd. (Aralık 1994). "Kortikobazal dejenerasyonda eşleştirilmiş sarmal filamanların ultra yapısı ve biyokimyasal bileşimi". Amerikan Patoloji Dergisi. 145 (6): 1496–508. PMC 1887493. PMID 7992852.
- ^ a b Franke, M (1976). "Statistische Untersuchungen über die senilen Drusen im menschlichen Gehirn / Thesen". Berlin, Almanya: Neuropathologische Abteilung. Arşivlenen orijinal 2011-07-19 tarihinde.
- ^ Blocq, Paul; Marinesco, Georges (1892). Sur lesions et la pathogenie de l'epilepsie dite essentielle. sayfa 445–6. OCLC 492619936.
- ^ Buda O; Arsene D; Ceausu M; Dermengiu D; Curca GC (Ocak 2009). "Georges Marinesco ve nöropatolojide erken araştırma". Nöroloji. 72 (1): 88–91. doi:10.1212 / 01.wnl.0000338626.93425.74. PMID 19122036.
- ^ Alzheimer, A (1907). "Uber einen eigenartige Erkranung der Hirnrinde". Allgemeine Zeitschrift für Psychiatrie und Psychisch-Gerichtlich Medizin. 64: 146–8.
- ^ Simchowicz T .: Histologische Studien über die senile Demenz. in: Nissl F., Alzheimer A. (Hrsg.): Histologische und histopathologische Arbeiten über die Grosshirnrinde mit besonderer Berücksichtigung der patologischen Anatomie der Geisteskrankheiten. Jena: G. Fischer, 1911, s. 267–444.
- ^ Op den Velde W; Stam FC (Ocak 1976). "Alzheimer presenile ve senil demansta bazı serebral proteinler ve enzim sistemleri". Amerikan Geriatri Derneği Dergisi. 24 (1): 12–6. doi:10.1111 / j.1532-5415.1976.tb03247.x. PMID 1244383.
- ^ a b Suh YH; Checler F (Eylül 2002). "Amiloid öncü protein, presenilinler ve alfa-sinüklein: Alzheimer hastalığında moleküler patogenez ve farmakolojik uygulamalar". Farmakolojik İncelemeler. 54 (3): 469–525. doi:10.1124 / pr.54.3.469. PMID 12223532.
- ^ a b Mavrogiorgou P; Gertz HJ; Ferszt R; Wolf R; Bär KJ; Juckel G (Aralık 2011). "Rutin yöntemler, demanslı hastaların farklı beyin bölgelerindeki senil plakları ve nörofibriler yumakları boyamak için yeterince iyi mi?" (PDF). Psychiatria Danubina. 23 (4): 334–9. PMID 22075733.
- ^ Lamy C, Duyckaerts C, Delaere P, vd. (1989). "15 yaşlı hastadan oluşan prospektif bir seride senil plaklar ve nörofibriler yumaklar için yedi boyama yönteminin karşılaştırılması". Nöropatoloji ve Uygulamalı Nörobiyoloji. 15 (6): 563–78. doi:10.1111 / j.1365-2990.1989.tb01255.x. PMID 2482455.
- ^ a b Findeis MA (Kasım 2007). "Alzheimer hastalığında amiloid beta peptid 42'nin rolü". Farmakoloji ve Terapötikler. 116 (2): 266–86. doi:10.1016 / j.pharmthera.2007.06.006. PMID 17716740.
- ^ Braak H; Braak E; Bohl J (1993). "Alzheimer ile ilişkili kortikal yıkımın evrelendirilmesi". Avrupa Nörolojisi. 33 (6): 403–8. doi:10.1159/000116984. PMID 8307060.
daha fazla okuma
- Jellinger KA. Nörodejeneratif Erkrankungen (ZNS) - Eine aktuelle Übersicht. Journal für Neurologie, Neurochirurgie und Psychiatrie. 2005;6(1):9-18.
- Cruz L, Urbanc B, Buldyrev SV, vd. (Temmuz 1997). "Alzheimer hastalığında senil plakların toplanması ve ayrıştırılması". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 94 (14): 7612–6. doi:10.1073 / pnas.94.14.7612. PMC 23870. PMID 9207140.
