Spliceozom - Spliceosome
Bir ek yeri büyük ve karmaşık moleküler RNA kimliği öncelikle içinde bulundu çekirdek nın-nin ökaryotik hücreler. Spliceozom, küçük nükleer RNA'lar (snRNA ) ve yaklaşık 80 protein. Spliceozom kaldırılır intronlar bir yazılı pre-mRNA, bir tür birincil transkript. Bu işlem genellikle şu şekilde anılır: ekleme.[1] Bir benzetme, alakasız veya yanlış materyali seçici olarak çıkaran bir film editörüdür ( intronlar ) ve temizlenmiş versiyonu son kesim için yönetmene gönderir.

Tarih
1977'de Keskin ve Roberts laboratuvarlar, daha yüksek organizmaların genlerinin "bölündüğünü" veya DNA molekülü boyunca birkaç farklı segmentte mevcut olduğunu ortaya çıkardı.[2][3] Genin kodlama bölgeleri, protein ekspresyonunda yer almayan kodlayıcı olmayan DNA ile ayrılır. Bölünmüş gen yapısı, adenoviral mRNA'lar, tek sarmallı viral DNA'nın endonükleaz klevaj fragmanlarına hibridize edildiğinde bulundu.[2] MRNA-DNA hibritlerinin mRNA'larının içerdiği gözlendi 5' ve 3' hidrojen bağlı olmayan bölgelerin kuyrukları. Daha büyük viral DNA fragmanları kullanıldığında, viral mRNA'lara hibridize edildiğinde ilmekli DNA'nın çatallı yapıları gözlemlendi. Döngülü bölgelerin, intronlar, Sharp adlı "ekleme" adlı bir işlemde öncü mRNA'lardan eksize edilir. Bölünmüş gen yapısının daha sonra çoğu kişi için ortak olduğu bulundu. ökaryotik genler. Phillip Sharp ve Richard J. Roberts 1993 ile ödüllendirildi Nobel Fizyoloji veya Tıp Ödülü intronların keşfi ve ekleme işlemi için.
Kompozisyon
Her bir spliceozom beşten oluşur küçük nükleer RNA'lar (snRNA) ve bir dizi ilişkili protein faktörü. Bu küçük RNA'lar protein faktörleri ile birleştiklerinde, RNA-protein kompleksleri adı verilen snRNP'ler (salışveriş Merkezi nuclear ribonucleo proteinler, "snurps" olarak telaffuz edilir). Ana spliceozomu oluşturan snRNA'lar, U1, U2, U4, U5, ve U6 sözde çünkü zenginler üridin ve çeşitli RNA-RNA ve RNA-protein etkileşimlerine katılır.[1]
Spliceozomun kanonik montajı, her birinde yeniden meydana gelir. pre-mRNA (heterojen nükleer RNA olarak da bilinir). Pre-mRNA, spliceosome montajı sırasında tanınan ve kullanılan spesifik sekans elemanlarını içerir. Bunlar arasında 5 'uç ekleme bölgesi, dallanma noktası sekansı, polipirimidin yolu ve 3' uç ekleme bölgesi bulunur. Spliceozom, intronların uzaklaştırılmasını ve çevreleyen eksonların ligasyonunu katalize eder.
İntronlar tipik olarak 5 'uç birleşme yerinde bir GU nükleotid dizisine ve 3' uç birleşme yerinde bir AG'ye sahiptir. 3 'ek yeri, ayrıca değişken uzunluktaki polipirimidin ile tanımlanabilir. polipirimidin yolu (PPT), faktörleri 3 'birleştirme bölgesine toplama ve muhtemelen dallanma noktası dizisi (BPS). BPS, korunan adenozin eklemenin ilk adımı için gereklidir.
Pek çok protein, ekleme mekanizmasında çinkonun öneminin altını çizen bir çinko bağlama motifi sergiler.[4][5][6] U4 / U6.U5 üçlü küçük nükleer ribonükleoprotein (tri-snRNP) kompleksinin ilk moleküler çözünürlüklü rekonstrüksiyonu 2016'da bildirildi.[7]
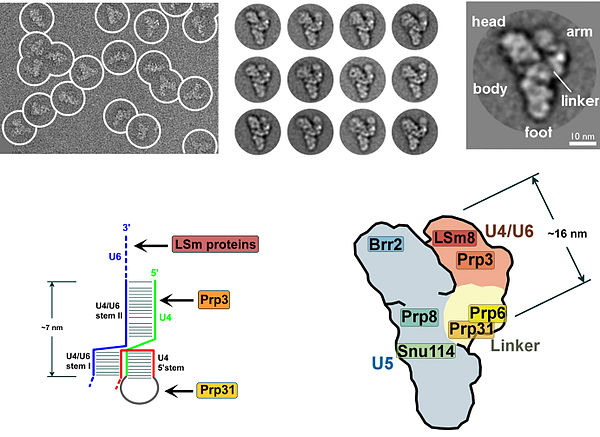
Cryo-EM, her iki mayadaki spliceozomun yakın / atomik yapısını aydınlatmak için Shi ve arkadaşları tarafından kapsamlı bir şekilde uygulanmıştır.[9] ve insanlar.[10] Neredeyse atomik çözünürlükte spliceozomun moleküler çerçevesi, U5 snRNP'nin Spp42 bileşeninin merkezi bir iskele oluşturduğunu ve mayadaki katalitik merkezin demirlediğini gösterir. İnsan spliceozomunun atomik yapısı, adım II bileşeninin Slu7'nin 3'-ekleme bölgesinin seçimi için hazırlanmış genişletilmiş bir yapıyı benimsediğini gösterir. Maya kompleksindeki beş metalin tümü (Mg2 + olarak atanır) insan kompleksinde korunur.
Alternatif ekleme
Alternatif ekleme (farklı Eksonlar ) önemli bir kaynaktır genetik çeşitlilik ökaryotlarda. Ek varyantları nispeten az sayıdaki protein kodlamasını hesaba katmak için kullanılmıştır genler içinde insan genomu şu anda 20.000 civarında olduğu tahmin ediliyor. Belirli bir Meyve sineği gen, Dscam, alternatif olarak 38.000 farklı mRNA'lar tüm eksonlarının birbirinden bağımsız olarak birleşebileceğini varsayarsak.[11]
Montaj
Spliceozom aktif sitenin oluşum modeli, pre-mRNA substratı üzerinde ayrı snRNP partiküllerinin sıralı, aşamalı olarak birleştirilmesini içerir. Pre-mRNA'ların ilk tanınması, U1 snRNP'nin pre-mRNA'nın 5 'uç ekleme bölgesine bağlanmasını ve bağlanma kompleksini veya memelilerde erken (E) kompleksi oluşturmak için diğer snRNP ile ilişkili olmayan faktörleri içerir.[12][13] Taahhüt kompleksi, pre-mRNA'yı ekleme yoluna işleyen ATP'den bağımsız bir komplekstir.[14] U2 snRNP, E kompleksi bileşeniyle etkileşimler yoluyla şube bölgesine alınır U2AF (U2 snRNP yardımcı faktör) ve muhtemelen U1 snRNP. ATP'ye bağımlı bir reaksiyonda, U2 snRNP, kompleks A oluşturmak için dallanma noktası sekansı (BPS) ile sıkı bir şekilde ilişkilendirilir. U2 snRNP ve pre-mRNA dal bölgesi arasında oluşan bir dubleks, dal adenozini dışarı çıkarır ve bunu, bunun için nükleofil olarak belirtir. ilk transesterifikasyon.[15]
Varlığı psödoüridin Dal bölgesinin neredeyse tersi olan U2 snRNA'daki kalıntı, U2 snRNP bağlanması üzerine RNA-RNA dupleksinin değiştirilmiş bir konformasyonuna neden olur. Spesifik olarak, pseudouridin tarafından indüklenen dubleksin değiştirilmiş yapısı, çıkıntılı adenosinin 2 'OH'sini, eklemenin ilk adımı için uygun bir konuma yerleştirir.[16] U4 / U5 / U6 tri-snRNP (bkz. Şekil 1), kompleks B'yi oluşturmak için birleştirici spliceozomda görevlendirilir ve birkaç yeniden düzenlemenin ardından, kompleks C, kataliz için aktive edilir.[17][18] Tri-snRNP'nin kompleks A'ya nasıl dahil edildiği açık değildir, ancak bu sürece U2 snRNA ve U6 snRNA arasındaki protein-protein etkileşimleri ve / veya baz eşleştirme etkileşimleri aracılığıyla aracılık edilebilir.
U5 snRNP, U5 snRNA'nın değişmez döngüsü aracılığıyla 5 've 3' ekleme bölgelerindeki dizilerle etkileşime girer.[19] ve U5 protein bileşenleri, 3 'ek yeri bölgesi ile etkileşime girer.[20]
Tri-snRNP'nin görevlendirilmesinin ardından, birkaç RNA-RNA yeniden düzenlemesi, ilk katalitik aşamadan önce gelir ve katalitik olarak aktif spliceozomda başka yeniden düzenlemeler meydana gelir. RNA-RNA etkileşimlerinin birkaçı birbirini dışlar; ancak bu etkileşimleri neyin tetiklediği veya bu yeniden düzenlemelerin sırası bilinmemektedir. İlk yeniden düzenleme muhtemelen U1 snRNP'nin 5 'ek yerinden yer değiştirmesi ve bir U6 snRNA etkileşiminin oluşmasıdır. U1 snRNP'nin sadece tam olarak oluşturulmuş spliceozomlarla zayıf bir şekilde ilişkili olduğu bilinmektedir,[21] ve U1 snRNP, kısa bir 5 'ekson ve 5' birleştirme bölgesi içeren bir substrat oligonükleotit modeli üzerinde bir U6-5 'birleştirme bölgesi etkileşiminin oluşumunu inhibe eder.[22] U2 snRNP'nin dallanma noktası dizisine (BPS) bağlanması, bir protein-RNA etkileşiminin yerini alan bir RNA-RNA etkileşiminin bir örneğidir. U2 snRNP'nin görevlendirilmesi üzerine, U2 snRNA ve SF1'in bağlanma sahası birbirini dışlayan olaylar olduğundan, taahhüt kompleksindeki dal bağlama proteini SF1'in yeri değiştirilir.
U2 snRNA içinde, rekabet halindeki konformasyonlar arasında meydana gelen, birbirini dışlayan başka yeniden düzenlemeler vardır. Örneğin aktif formda gövde ilmeği IIa tercih edilir; inaktif formda, döngü ve bir aşağı akış dizisi arasında karşılıklı olarak dışlayıcı bir etkileşim hakimdir.[18] RNA, spliceozom montajında rol oynamasına rağmen, U4'ün U6 snRNA'dan nasıl yer değiştirdiği açık değildir ve U4 / U6'yı çözme ve bir U2 / U6 snRNA etkileşiminin oluşumunu teşvik etme işlevi görebilir. U4 / U6 gövde ilmekleri I ve II'nin etkileşimleri ayrışır ve molekül içi bir gövde halkası oluşturmak için U6 kıvrımlarının serbest kalan gövde halkası II bölgesi ve U4'ün daha fazla spliceozom montajında artık gerekli değildir. U6 bazının serbest kök ilmek I bölgesi, U2 / U6 sarmalını oluşturan U2 snRNA ile çiftleşir. Bununla birlikte, sarmal I yapısı, U2 snRNA'nın bir dahili 5 'gövde ilmek bölgesinin 3' yarısı ile karşılıklı olarak dışlanır.
Küçük ek yeri
Biraz ökaryotlar sözde ikinci bir ek yeri var küçük ek yeri.[23]Daha az miktarda bulunan bir grup snRNA, U11, U12, U4atac, ve U6atac, U5 ile birlikte, U12-tipi olarak adlandırılan nadir bir pre-mRNA intron sınıfını birleştiren küçük spliceozomun alt birimleridir. Küçük spliceozom, ana muadili gibi çekirdekte bulunur,[24] anükleat trombositler dahil bazı özelleşmiş hücrelerde istisnalar olsa da[25] ve dendroplazma (dendrit nöronal hücrelerin sitoplazması).[26]
Referanslar
- ^ a b Will CL, Lührmann R (Temmuz 2011). "Spliceozom yapısı ve işlevi". Biyolojide Cold Spring Harbor Perspektifleri. 3 (7): a003707. doi:10.1101 / cshperspect.a003707. PMC 3119917. PMID 21441581.
- ^ a b Berget SM, Moore C, Sharp PA (Ağustos 1977). "Adenovirüs 2 geç mRNA'nın 5 'terminalinde eklenmiş segmentler". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 74 (8): 3171–5. Bibcode:1977PNAS ... 74.3171B. doi:10.1073 / pnas.74.8.3171. PMC 431482. PMID 269380.
- ^ Chow LT, Roberts JM, Lewis JB, Broker TR (Ağustos 1977). "Litik adenovirüs tip 2'den alınan sitoplazmik RNA transkriptlerinin bir haritası, RNA'nın elektron mikroskobu: DNA hibritleri". Hücre. 11 (4): 819–36. doi:10.1016 / 0092-8674 (77) 90294-X. PMID 890740.
- ^ Agafonov DE, Deckert J, Wolf E, Odenwälder P, Bessonov S, Will CL, Urlaub H, Lührmann R (Temmuz 2011). "Yeni bir iki boyutlu jel elektroforez yöntemi aracılığıyla insan spliceozomunun yarı niceliksel proteomik analizi". Moleküler ve Hücresel Biyoloji. 31 (13): 2667–82. doi:10.1128 / mcb.05266-11. PMC 3133382. PMID 21536652.
- ^ Kuhn AN, van Santen MA, Schwienhorst A, Urlaub H, Lührmann R (Ocak 2009). "Küçük moleküllü protein asetilasyon ve deasetilasyon inhibitörleri tarafından farklı aşamalarda spliceozom birleşiminin durması". RNA. 15 (1): 153–75. doi:10.1261 / rna.1332609. PMC 2612777. PMID 19029308.
- ^ Patil V, Canzoneri JC, Samatov TR, Lührmann R, Oyelere AK (Eylül 2012). "Erken bir aşamada spliceozom birleşmesini engelleyen küçük molekülleri kenetleyen çinkonun moleküler mimarisi". RNA. 18 (9): 1605–11. doi:10.1261 / rna.034819.112. PMC 3425776. PMID 22832025.
- ^ Cate JH (Mart 2016). "STRUCTURE. A Big Bang in spliceosome yapısal biyolojisinde". Bilim. 351 (6280): 1390–2. doi:10.1126 / science.aaf4465. PMID 27013712.
- ^ Häcker I, Sander B, Golas MM, Wolf E, Karagöz E, Kastner B, Stark H, Fabrizio P, Lührmann R (Kasım 2008). "Maya tri-snRNP'de Prp8, Brr2, Snu114 ve U4 / U6 proteinlerinin elektron mikroskobu ile lokalizasyonu". Doğa Yapısal ve Moleküler Biyoloji. 15 (11): 1206–12. doi:10.1038 / nsmb.1506. PMID 18953335.
- ^ Yan C, Hang J, Wan R, Huang M, Wong CC, Shi Y (Eylül 2015). "3.6 angstrom çözünürlükte bir maya spliceozomunun yapısı". Bilim. 349 (6253): 1182–91. Bibcode:2015Sci ... 349.1182Y. doi:10.1126 / science.aac7629. PMID 26292707.
- ^ Zhang X, Yan C, Hang J, Finci LI, Lei J, Shi Y (Mayıs 2017). "İnsan Spliceozomunun Atomik Yapısı". Hücre. 169 (5): 918–929.e14. doi:10.1016 / j.cell.2017.04.033. PMID 28502770.
- ^ Schmucker D, Clemens JC, Shu H, Worby CA, Xiao J, Muda M, Dixon JE, Zipursky SL (Haziran 2000). "Drosophila Dscam, olağanüstü moleküler çeşitlilik sergileyen bir akson kılavuz reseptörüdür". Hücre. 101 (6): 671–84. doi:10.1016 / S0092-8674 (00) 80878-8. PMID 10892653.
- ^ Jamison SF, Crow A, Garcia-Blanco MA (Ekim 1992). "Memeli ekstraktlarında spliceozom birleşme yolu". Moleküler ve Hücresel Biyoloji. 12 (10): 4279–87. doi:10.1128 / MCB.12.10.4279. PMC 360351. PMID 1383687.
- ^ Seraphin B, Rosbash M (Ekim 1989). "Spliceosome montajına ve splicing'e adanmış fonksiyonel U1 snRNA-pre-mRNA komplekslerinin tanımlanması". Hücre. 59 (2): 349–58. doi:10.1016/0092-8674(89)90296-1. PMID 2529976.
- ^ Legrain P, Seraphin B, Rosbash M (Eylül 1988). "Maya pre-mRNA'sının spliceozom yoluna erken bağlanması". Moleküler ve Hücresel Biyoloji. 8 (9): 3755–60. doi:10.1128 / MCB.8.9.3755. PMC 365433. PMID 3065622.
- ^ Sorgu CC, Moore MJ, Sharp PA (Mart 1994). "Pre-mRNA eklemede dal nükleofil seçimi: çıkıntılı dupleks model için kanıt". Genler ve Gelişim. 8 (5): 587–97. doi:10.1101 / gad.8.5.587. PMID 7926752.
- ^ Newby MI, Greenbaum NL (Aralık 2002). "Eklemozomal dal bölgesi tanıma motifinin korunmuş bir psödoüridin ile şekillendirilmesi". Doğa Yapısal Biyoloji. 9 (12): 958–65. doi:10.1038 / nsb873. PMID 12426583.
- ^ Burge CB, vd. (1999). "Spliceozomlar tarafından mRNA'lara ekleme öncüleri". Gesteland RF, Cech TR, Atkins JF (editörler). RNA Dünyası. Cold Spring Harbor Lab. Basın. s. 525–60. ISBN 978-0-87969-380-0.
- ^ a b Staley JP, Guthrie C (Şubat 1998). "Spliceozomun mekanik cihazları: motorlar, saatler, yaylar ve şeyler". Hücre. 92 (3): 315–26. doi:10.1016 / S0092-8674 (00) 80925-3. PMID 9476892.
- ^ Newman AJ, Teigelkamp S, Beggs JD (Kasım 1995). "5 've 3' ekleme bölgelerindeki snRNA etkileşimleri, maya spliceozomlarında fotoaktive çapraz bağlanma ile izlenir". RNA. 1 (9): 968–80. PMC 1369345. PMID 8548661.
- ^ Chiara MD, Palandjian L, Feld Kramer R, Reed R (Ağustos 1997). "U5 snRNP'nin memelilerde katalitik aşama II için 3 'ekleme bölgesini tanıdığına dair kanıt". EMBO Dergisi. 16 (15): 4746–59. doi:10.1093 / emboj / 16.15.4746. PMC 1170101. PMID 9303319.
- ^ Moore MJ, Sharp PA (Eylül 1993). "Ön mRNA eklemenin stereokimyası tarafından sağlanan, spliceozomdaki iki aktif bölge için kanıt". Doğa. 365 (6444): 364–8. Bibcode:1993Natur.365..364M. doi:10.1038 / 365364a0. PMID 8397340.
- ^ Konforti BB, Koziolkiewicz MJ, Konarska MM (Aralık 1993). "Spliceozom montajı için 5 'ek yeri ile U1 snRNA'nın 5' ucu arasındaki baz eşleşmesinin bozulması gerekir". Hücre. 75 (5): 863–73. doi:10.1016 / 0092-8674 (93) 90531-T. PMID 8252623.
- ^ Patel AA, Steitz JA (Aralık 2003). "Çift ekleme: ikinci spliceozomdan içgörüler". Doğa Yorumları. Moleküler Hücre Biyolojisi. 4 (12): 960–70. doi:10.1038 / nrm1259. PMID 14685174.
- ^ Pessa HK, Will CL, Meng X, Schneider C, Watkins NJ, Perälä N, Nymark M, Turunen JJ, Lührmann R, Frilander MJ (Haziran 2008). "Küçük spliceozom bileşenleri ağırlıklı olarak çekirdekte lokalizedir". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 105 (25): 8655–60. doi:10.1073 / pnas.0803646105. PMC 2438382. PMID 18559850.
- ^ Denis MM, Tolley ND, Bunting M, Schwertz H, Jiang H, Lindemann S, Yost CC, Rubner FJ, Albertine KH, Swoboda KJ, Fratto CM, Tolley E, Kraiss LW, McIntyre TM, Zimmerman GA, Weyrich AS (Ağustos 2005 ). "Nükleer sınırlardan kaçmak: anükleat trombositlerde sinyale bağımlı pre-mRNA ekleme". Hücre. 122 (3): 379–91. doi:10.1016 / j.cell.2005.06.015. PMC 4401993. PMID 16096058.
- ^ Glanzer J, Miyashiro KY, Sul JY, Barrett L, Belt B, Haydon P, Eberwine J (Kasım 2005). "Canlı nöronal dendritlerin RNA ekleme yeteneği". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 102 (46): 16859–64. Bibcode:2005PNAS..10216859G. doi:10.1073 / pnas.0503783102. PMC 1277967. PMID 16275927.
daha fazla okuma
- Kasap SE (2011). "Bölüm 8. Spliceozom ve Metal İyonları". Sigel A, Sigel H, Sigel RK (editörler). RNA'da metal iyonlarının yapısal ve katalitik rolleri. Yaşam Bilimlerinde Metal İyonları. 9. RSC Yayınları. s. 235–51. doi:10.1039/9781849732512-00235. ISBN 978-1-84973-094-5.
- Nilsen TW (Aralık 2003). "Spliceozom: Hücredeki en karmaşık makromoleküler makine mi?" BioEssays. 25 (12): 1147–9. doi:10.1002 / bies.10394. PMID 14635248.
Dış bağlantılar
- EM Veri Bankasından (EMDB) Spliceozomların 3D makromoleküler yapıları
- Spliceozomlar ABD Ulusal Tıp Kütüphanesinde Tıbbi Konu Başlıkları (MeSH)
