Tiyolaz - Thiolase
| Tiyolaz, N-terminal alanı | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Tanımlayıcılar | |||||||||
| Sembol | Thiolase_N | ||||||||
| Pfam | PF00108 | ||||||||
| InterPro | IPR002155 | ||||||||
| PROSITE | PDOC00092 | ||||||||
| SCOP2 | 1pxt / Dürbün / SUPFAM | ||||||||
| CDD | cd00751 | ||||||||
| |||||||||
| Tiyolaz, C-terminal alanı | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Tanımlayıcılar | |||||||||
| Sembol | Tiyolaz_C | ||||||||
| Pfam | PF02803 | ||||||||
| InterPro | IPR002155 | ||||||||
| PROSITE | PDOC00092 | ||||||||
| SCOP2 | 1pxt / Dürbün / SUPFAM | ||||||||
| |||||||||

Tiyolazlar, Ayrıca şöyle bilinir asetil-koenzim A asetiltransferazlar (BİR KEDİ), iki birimi dönüştüren enzimlerdir. asetil-CoA -e asetoasetil CoA içinde mevalonat yolu.
Tiyolazlar her yerde bulunur enzimler birçok hayati biyokimyasal yolda kilit rollere sahip olanlar beta oksidasyon yağ asidi bozunma yolu ve çeşitli biyosentetik yollar.[1] Tiyolaz ailesinin üyeleri iki geniş kategoriye ayrılabilir: degradatif tiyolazlar (EC 2.3.1.16) ve biyosentetik tiyolazlar (EC 2.3.1.9). Bu iki farklı tiyolaz türü, her ikisinde de bulunur. ökaryotlar ve prokaryotlar: asetoasetil-CoA tiyolaz (EC: 2.3.1.9) ve 3-ketoasil-CoA tiyolaz (EC: 2.3.1.16). 3-ketoasil-CoA tiolaz (tiyolaz I olarak da adlandırılır), substratları için geniş bir zincir uzunluğu özgüllüğüne sahiptir ve yağ asidi beta oksidasyonu gibi bozunma yollarında rol oynar. Asetoasetil-CoA tiyolaz (tiyolaz II olarak da adlandırılır), asetoasetil-CoA'nın tiyolizine spesifiktir ve aşağıdakiler gibi biyosentetik yollarda rol oynar. beta-hidroksibütirik asit sentez veya steroid biyogenez.
Bir karbon-karbon bağının oluşumu, biyosentetik yollarda önemli bir adımdır. yağ asitleri ve poliketid yapıldı. Tiolaz üst ailesi enzimler karbon-karbon-bağı oluşumunu tioestere bağımlı bir yolla katalize edin Claisen yoğunlaşması[2] reaksiyon mekanizması.[3]
Fonksiyon
Tiyolazlar vardır Bir aile evrimsel olarak ilişkili enzimler. İki farklı tiyolaz türü[4][5][6] hem ökaryotlarda hem de prokaryotlarda bulunur: asetoasetil-CoA tiyolaz (EC 2.3.1.9 ) ve 3-ketoasil-CoA tiyolaz (EC 2.3.1.16 ). 3-ketoasil-CoA tiyolaz (tiyolaz I olarak da adlandırılır), substratları için geniş bir zincir uzunluğu spesifikliğine sahiptir ve yağ asidi beta oksidasyonu gibi bozunma yollarında rol oynar. Asetoasetil-CoA tiyolaz (tiyolaz II olarak da adlandırılır), asetoasetil-CoA'nın tiyolizine spesifiktir ve poli beta-hidroksibütirat sentezi veya steroid biyojenez gibi biyosentetik yollarda rol oynar.
Ökaryotlarda, 3-ketoasil-CoA tiyolazın iki formu vardır: biri mitokondride, diğeri peroksizomlarda bulunur.
Tiyolaz aktivitesi için önemli iki korunmuş sistein kalıntısı vardır. Birincisi, enzimlerin N-terminal bölümünde yer alan bir asil-enzim ara maddesinin oluşumunda rol oynar; C-terminal ucunda bulunan ikincisi, yoğunlaşma reaksiyonunda protonsuzlaşmada yer alan aktif bölge bazdır.
İzozimler
| EC numarası | İsim | Alternatif isim | İzozimler | Hücre altı dağılımı |
|---|---|---|---|---|
| EC 2.3.1.9 | Asetil-CoA C-asetiltransferaz | tiolaz II; Asetoasetil-CoA tiyolaz | ACAT1 | mitokondriyal |
| ACAT2 | sitozolik | |||
| EC 2.3.1.16 | Asetil-CoA C-asiltransferaz | tiolaz I; 3-Ketoasil-CoA tiyolaz; β-Ketotiyolaz | ACAA1 | peroksizomal |
| ACAA2 | mitokondriyal | |||
| HADHB | mitokondriyal | |||
| EC 2.3.1.154 | Propiyonil-CoA C2-trimetiltridekanoiltransferaz | 3-Oksopristanoil-CoA tiyolaz | ||
| EC 2.3.1.174 | 3-Oksoadipil-CoA tiyolaz | β-Ketoadipil-CoA tiyolaz | ||
| EC 2.3.1.176 | Propanoil-CoA C-asiltransferaz | Peroksizomal tiyolaz 2 | SCP2 | peroksizomal / sitozolik |
Memeli spesifik olmayan lipid transfer proteini (nsL-TP) (ayrıca sterol taşıyıcı protein 2 ) iki farklı biçimde var olduğu görülen bir proteindir: 14 Kd protein (SCP-2) ve daha büyük 58 Kd protein (SCP-x). İlki sitoplazmada veya mitokondride bulunur ve lipid taşınmasında rol oynar; ikincisi bulunur peroksizomlar. SCP-x'in C-terminal kısmı SCP-2 ile aynıdır, N-terminal kısmı ise tiolazlarla evrimsel olarak ilişkilidir.[6]
Mekanizma

Tiyoesterler oksijen esterlerinden daha reaktiftir ve yağ asidi metabolizmasında yaygın ara maddelerdir.[7] Bu tiyoesterler, yağ asidinin serbest SH grubu ile konjuge edilmesiyle yapılır. pantetheine ikisinden birinin parçası koenzim A (CoA) veya asil taşıyıcı protein (ACP).
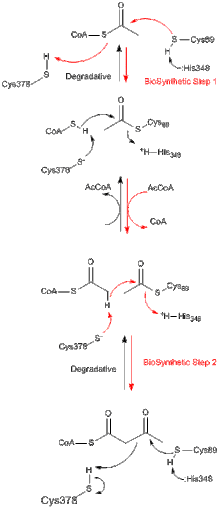
Tüm tiyolazlar, ister biyosentetik ister in vivo bozunur olsun, tercihen asetil-CoA ve kısaltılmış bir açil-CoA türü oluşturmak için 3-ketoasil-CoA'nın degradasyonunu katalize eder, ancak aynı zamanda tersini de katalize edebilir. Claisen yoğunlaşması reaksiyon. Z. ramigera'dan biyosentetik tiyolaz üzerine yapılan çalışmalardan, tiyolaz reaksiyonunun iki aşamada meydana geldiği ve pinpon kinetiğini izlediği iyi anlaşılmıştır.[8] Hem parçalayıcı hem de biyosentetik reaksiyonların ilk aşamasında, nükleofilik Cys89 (veya eşdeğeri), asil-CoA (veya 3-ketoasil-CoA) substratına saldırarak kovalent bir asil-CoA ara maddesinin oluşumuna yol açar.[9] İkinci aşamada, asil-enzim ara ürününe CoA (bozunma reaksiyonunda) veya asetil-CoA (biyosentetik reaksiyonda) ilavesi, ürünün enzimden salınmasını tetikler.[10] Sırasıyla bir asetil grubunun nükleofilik sisteine ve buradan nükleofilik sisteine transferi sırasında meydana gelen dört yüzlü reaksiyon ara maddelerinin her biri, A. fumigatus'tan biyosentetik tiyolazın X-ışını kristal yapılarında gözlenmiştir.[11]
Yapısı
Tiolaz süper ailesinin çoğu enzimi dimerler. Bununla birlikte, monomerler gözlemlenmemiştir. Tetrametreler sadece tiyolaz alt ailesinde gözlenir ve bu durumlarda dimer, tetramerler haline gelmek üzere dimerize edilir. Zoogloea ramigera'dan tetramerik biyosentetik tiolazın kristal yapısı 2.0 A çözünürlükte belirlenmiştir. Yapı, birbirine göre iki sıkı dimerin bir miktar menteşe hareketine izin veren çarpıcı ve "kafes benzeri" bir tetramerizasyon motifi içerir. Enzim tetramer, Cys89'da asetillenmiştir ve aktif bölge ceplerinin her birine bağlı bir CoA molekülüne sahiptir.[12]
Biyolojik fonksiyon
İçinde ökaryotik hücreler, özellikle memeli hücrelerinde, tiolazlar, metabolik işlevleriyle ilişkili hücre içi lokalizasyonunun yanı sıra substrat özgüllüğünde çeşitlilik sergiler. Örneğin, yağ asidi β-oksidasyonuna katkıda bulunurlar. peroksizomlar ve mitokondri, keton gövdesi mitokondride metabolizma,[13] ve peroksizomlarda mevalonat yolunun ilk adımları ve sitoplazma.[14] Biyokimyasal araştırmalara ek olarak, genetik bozuklukların analizleri, işlevlerinin temelini açıklığa kavuşturmuştur.[15] Genetik çalışmalar ayrıca Saccharomyces cerevisiae mayasındaki tiolazların fizyolojik işlevlerini açıklamaya başlamıştır.[16] Tiyolaz, yağ asidi, steroid ve poliketid sentezi gibi anahtar enzimatik yollarda merkezi öneme sahiptir. Yapısal biyolojisinin ayrıntılı anlaşılması, örneğin, bu enzimlerin genetik eksikliklerinin neden olduğu hastalıkların daha iyi anlaşılması ve yeni antibiyotiklerin geliştirilmesi için tıbbi açıdan büyük önem taşır.[17] Biyolojik ve tıbbi olarak ilgili doğal ürünlerin sentezi için poliketid sentazların karmaşık katalitik çok yönlülüğünden yararlanmak, bu üst ailenin enzimlerinin çalışmalarının önemli bir gelecek perspektifidir.[18]
Hastalık alaka düzeyi
Daha önce bilinen mitokondriyal asetoasetil-CoA tiyolaz eksikliği β-ketotiyolaz eksikliği,[19] bir doğuştan metabolizma hatası izolösin katabolizması ve keton cisimciği metabolizmasını içerir. Bu bozukluğun başlıca klinik belirtileri aralıklıdır ketoasidoz fakat görünüşte iyi huylu uzun vadeli klinik sonuçlar iyi belgelenmemiştir. Mitokondriyal asetoasetil-CoA tiyolaz eksikliği, üriner organik asit analizi ile kolayca teşhis edilir ve kültürlenmiş deri fibroblastlarının veya kan lökositlerinin enzimatik analizi ile doğrulanabilir.[20]
β-Ketotiyolaz Eksikliğinin değişken bir görünümü vardır. Etkilenen hastaların çoğu 5 ila 24 ay arasında şiddetli ketoasidoz semptomları ile başvurur. Semptomlar diyetteki protein yükü, enfeksiyon veya ateşle başlayabilir. Semptomlar kusmadan dehidrasyona ve ketoasidoza ilerler.[21] Orta derecede hiperamonyeminin yanı sıra nötropeni ve trombositopeni mevcut olabilir. Kan şekeri tipik olarak normaldir ancak akut ataklarda düşük veya yüksek olabilir.[22] Gelişimsel gecikme, ilk akut ataktan önce bile ortaya çıkabilir ve bilateral striatal nekroz of Bazal ganglion beyinde görüldü MR.
Referanslar
- ^ Thompson S, Mayerl F, Peoples OP, Masamune S, Sinskey AJ, Walsh CT (Temmuz 1989). "Zoogloea ramigera'dan beta-ketoasil tiyolaz üzerine mekanik çalışmalar: aktif alan nükleofilinin Cys89 olarak belirlenmesi, Ser89'a mutasyonu ve vahşi tip ve mutant enzimlerin kinetik ve termodinamik karakterizasyonu". Biyokimya. 28 (14): 5735–42. doi:10.1021 / bi00440a006. PMID 2775734.
- ^ Heath RJ, Rock CO (Ekim 2002). Biyolojide "Claisen Yoğunlaşması". Nat Prod Rep. 19 (5): 581–96. doi:10.1039 / b110221b. PMID 12430724.
- ^ Haapalainen AM, Meriläinen G, Wierenga RK (Ocak 2006). "Tiyolaz üst ailesi: çeşitli reaksiyon özgüllüklerine sahip yoğunlaştırıcı enzimler". Trends Biochem. Sci. 31 (1): 64–71. doi:10.1016 / j.tibs.2005.11.011. PMID 16356722.
- ^ Baker ME, Billheimer JT, Strauss JF (Kasım 1991). "Memeli 58-kD sterol taşıyıcı proteininin (SCPx) amino terminal kısmı ile Escherichia coli asetil-CoA asiltransferaz arasındaki benzerlik: SCPx'te bir gen füzyonu için kanıt". DNA Hücresi Biol. 10 (9): 695–8. doi:10.1089 / dna.1991.10.695. PMID 1755959.
- ^ Yang SY, Yang XY, Healy-Louie G, Schulz H, Elzinga M (Haziran 1990). "FadA geninin nükleotid dizisi. 3-ketoasil-koenzim Escherichia coli'den bir tiolazın birincil yapısı ve fadAB operonunun yapısal organizasyonu". J. Biol. Kimya. 265 (18): 10424–9. PMID 2191949.
- ^ a b Igual JC, González-Bosch C, Dopazo J, Pérez-Ortín JE (Ağustos 1992). "Tiyolaz ailesinin filogenetik analizi. Peroksizomların evrimsel kökeni için çıkarımlar". J. Mol. Evol. 35 (2): 147–55. doi:10.1007 / BF00183226. PMID 1354266. S2CID 39746646.
- ^ Enzimatik reaksiyon mekanizmaları. San Francisco: W. H. Freeman. 1979. ISBN 978-0-7167-0070-8.
- ^ Masamune, Satoru; Walsh, Christopher T .; Gamboni, Remo; Thompson, Stuart; Davis, Jeffrey T .; Williams, Simon F .; Peoples, Oliver P .; Sinskey, Anthony J .; Walsh, Christopher T. (1989). "Zoogloea ramigera'dan tiyolaz ile katalize edilen Bio-Claisen yoğunlaşması. Aktif bölge sistein kalıntıları". J. Am. Chem. Soc. 111 (5): 1879, 1991. doi:10.1021 / ja00187a053.
- ^ Gilbert HF, Lennox BJ, Mossman CD, Carle WC (Temmuz 1981). "Asil transferinin domuz kalbinden tiyolaz I'in genel reaksiyonuyla ilişkisi". J. Biol. Kimya. 256 (14): 7371–7. PMID 6114098.
- ^ Mathieu M, Modis Y, Zeelen JP, vd. (Ekim 1997). "Saccharomyces cerevisiae'nin dimerik peroksizomal 3-ketoasil-CoA tiyolazının 1.8 A kristal yapısı: substrat bağlama ve reaksiyon mekanizması için çıkarımlar". J. Mol. Biol. 273 (3): 714–28. doi:10.1006 / jmbi.1997.1331. PMID 9402066.
- ^ Marshall, Andrew C .; Bond, Charles S .; Bruning, John B. (25 Ocak 2018). "Aspergillus fumigatus Sitosolik Tiyolazın Yapısı: Hapsedilmiş Tetrahedral Reaksiyon Ara Maddeleri ve Tek Değerlikli Katyonlarla Aktivasyon". ACS Katalizi. 8 (3): 1973–1989. doi:10.1021 / acscatal.7b02873. hdl:2440/113865.
- ^ Modis Y, Wierenga RK (Ekim 1999). "Bir reaksiyon ara ürünü ile kompleks halinde bir biyosentetik tiyolaz: kristal yapı, katalitik mekanizmaya yeni bakış açıları sağlar". Yapısı. 7 (10): 1279–90. doi:10.1016 / S0969-2126 (00) 80061-1. PMID 10545327.
- ^ Middleton B (Nisan 1973). "Oksoasil-koenzim A Hayvan dokularının tiyolazları". Biochem. J. 132 (4): 717–30. doi:10.1042 / bj1320717. PMC 1177647. PMID 4721607.
- ^ Hovik R, Brodal B, Bartlett K, Osmundsen H (Haziran 1991). "İzole edilmiş peroksizomal fraksiyonlarla asetil-CoA metabolizması: asetat ve asetoasetil-CoA oluşumu". J. Lipid Res. 32 (6): 993–9. PMID 1682408.
- ^ Middleton B, Bartlett K (Mart 1983). "2-metilasetoasetil koenzim A'nın sentezi ve karakterizasyonu ve 2-metilasetoasetik ve 2-metil-3-hidroksibütirik asidüride kusurun yerinin belirlenmesinde kullanımı". Clin. Chim. Açta. 128 (2–3): 291–305. doi:10.1016/0009-8981(83)90329-7. PMID 6133656.
- ^ Kanayama N, Ueda M, Atomi H, Tanaka A (Şubat 1998). "N-alkalanı asimile eden maya Candida tropicalis'te tiyolaz izoenzimlerinin fizyolojik işlevlerinin genetik değerlendirmesi". J. Bacteriol. 180 (3): 690–8. doi:10.1128 / JB.180.3.690-698.1998. PMC 106940. PMID 9457876.
- ^ Fiyat AC, Choi KH, Heath RJ, Li Z, Beyaz SW, Rock CO (Mart 2001). "Beta-ketoasil-asil taşıyıcı protein sentazlarının tiolaktomisin ve serulenin tarafından inhibisyonu. Yapı ve mekanizma". J. Biol. Kimya. 276 (9): 6551–9. doi:10.1074 / jbc.M007101200. PMID 11050088.
- ^ Keatinge-Clay AT, Maltby DA, Medzihradszky KF, Khosla C, Stroud RM (Eylül 2004). "Bir antibiyotik fabrikası harekete geçti". Nat. Struct. Mol. Biol. 11 (9): 888–93. doi:10.1038 / nsmb808. PMID 15286722. S2CID 12394083.
- ^ Daum RS, Lamm PH, Mamer OA, Scriver CR (Aralık 1971). "Yeni" bir izolösin katabolizması bozukluğu ". Lancet. 2 (7737): 1289–90. doi:10.1016 / S0140-6736 (71) 90605-2. PMID 4143539.
- ^ Mitchell GA, Fukao T (2001). "Keton vücut metabolizmasının doğuştan hataları". Scriver CR, Beaudet AL, Sly WS, Valle D'de (editörler). Kalıtsal hastalığın metabolik ve moleküler temelleri. New York: McGraw-Hill. sayfa 2326–2356. ISBN 978-0-07-913035-8.
- ^ Hillman RE, Keating JP (Şubat 1974). Ketotik hiperglisinemi sendromunun bir nedeni olarak "Beta-ketotiolaz eksikliği""". Pediatri. 53 (2): 221–5. PMID 4812006.
- ^ Robinson BH, Sherwood WG, Taylor J, Balfe JW, Mamer OA (Ağustos 1979). "Asetoasetil CoA tiolaz eksikliği: bebeklik döneminde salisilizmi simüle eden şiddetli ketoasidozun bir nedeni". J. Pediatr. 95 (2): 228–33. doi:10.1016 / S0022-3476 (79) 80658-7. PMID 36452.
Dış bağlantılar
- Asetil-CoA + C-Asetiltransferaz ABD Ulusal Tıp Kütüphanesinde Tıbbi Konu Başlıkları (MeSH)
- Mevcut tüm yapısal bilgilere genel bakış PDB için UniProt: P28790 (3-ketoasil-CoA tiyolaz) PDBe-KB.
- Mevcut tüm yapısal bilgilere genel bakış PDB için UniProt: Q56WD9 (3-ketoasil-CoA tiyolaz 2, peroksizomal) PDBe-KB.
