Geniş dinamik aralıklı nöron - Wide dynamic range neuron

geniş dinamik alan (WDR) nöron ilk olarak 1966'da Mendell tarafından keşfedildi.[1] Bunun erken çalışmaları nöron olarak bilinen şeyi kurdu ağrı kapısı kontrol teorisi. Temel kavram, ağrısız uyaranların ağrılı uyaranlara giden yolları tıkayarak, olası ağrılı tepkileri engellemesidir.[2] Bu teori, WDR nöronlarının hem ağrılı hem de ağrısız uyaranlara verilen yanıtlardan sorumlu olması ve bu nöronların bu yanıtlardan birden fazlasını aynı anda üretemeyeceği fikriyle desteklenmiştir. WDR nöronları her türlü somatosensoriyel uyaranlar, içinde bulunan nöronların çoğunu oluşturur arka gri sütun ve ağrı ve kaşıntıdan sorumlu olanlar da dahil olmak üzere uzun menzilli yanıtlar üretme yeteneğine sahip.
Anatomi ve psikoloji
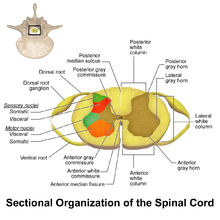
WDR nöronları, arka gri sütun of omurilik. Omuriliğin bu bölgesi, ağrı sürecine dahil olan iki farklı nöron türünü barındırır: WDR nöronları ve nosiseptif spesifik nöronlar (NS).[3] Adından da anlaşılacağı gibi, NS nöronları belirli kısa menzilli yanıtlar verir.[4] WDR nöronları, çok çeşitli uyaranlara uzun menzilli yanıtlar verebilir ve onlara ağrılı uyarının yerini ve yoğunluğunu belirlemeye yardımcı olma yeteneği verir (duyusal ayrımcılık).[3][5]
WDR nöronları, 'rüzgar' denen şeyi deneyimlemek üzere teorileştirilmeleri bakımından diğer nöronların çoğundan farklıdır. Bu, tepkilerinin yoğunluğunun artan bir uyarıcı frekansı ile artmasına izin verir.[6] Diğer nöronların çoğu tekrarlandı aksiyon potansiyalleri uyaran yoğunluğundaki artışa tepki ile aynı büyüklükte. Uyaranın yoğunluğu, büyüklüklerini değil, yalnızca aksiyon potansiyellerinin sıklığını artıracaktır. Bununla birlikte, WDR nöronları, daha fazla uyaran sunumu ile artan aksiyon potansiyeli yoğunluğu sergiler.[6] Bu izin verir plastisite nın-nin sinapslar[6] ve nöronal yanıtta esneklik yaratır. Bu organizma için bir miktar fayda sağlasa da, bu nöronların aşırı uyarılmasına neden olabilir. kronik ağrı.[3]
Ağrı yanıtlarında rol
Ağrılı bir uyaran olduğunda alınabilecek iki yol vardır. nosiseptif lamina 1'deki nöronlar tehlikeye girer veya WDR nöronları tehlikeye girer.[7] WDR nöronları elektriksel, mekanik ve termal uyarıma yanıt verebilir.[8] Sırt kordonu hatalı plastisiteye sahiptir ve bu da nöropatik ağrı bir sinirin yaralanmasından sonra. Bu, daha önce tartışılan aşırı uyarıma izin vererek kronik ağrıya neden olur.[9] WDR nöronlarının benzersiz ağrı yolu, duyusal ayrımcılık yoluyla ağrının yoğunluğunu haritalamak için uyaran hakkında bilgi kullanımına izin verir.
Vücudumuzda yaşadığımız iki ana ağrı türü vardır: vücut dokusunun zarar görmesinden kaynaklanan ağrı ve sinir hasarının neden olduğu ağrı. Nosiseptif ağrı, doku hasarı için bir uyarı veya sinyal görevi görür ve vücudun dengesini ve işlevselliğini korumaya çalışır. Bu acı, her ikisinin birlikte çalışmasıyla belirtilir. Çevresel ve merkezi sinir sistemleri.[10] Nöropatik ağrı olarak bilinen başka bir ağrı türü, merkezi sinir sistemindeki sinirleri etkileyen doğrudan bir problem veya hastalıktan kaynaklanır.[10]

Kronik nöropatik ağrı olarak bilinen bu nöropatik ağrının bir alt kümesi, uzun süreli ve yüksek ağrı yoğunluğu ile karakterizedir. Bu kronik ağrının doğrudan nedeni hakkında hala bilinmeyen çok şey olmasına rağmen, WDR nöronlarıyla ilişkilendirilmiştir. Bu nöronlar sempatik uyarı ile önemli aktivasyon gösterirken NS nöronları gibi nöronlar aynı seviyede aktivasyon göstermez.[11] Engellenmesi sempatik yollar ağrıyı azaltıyor gibiydi ve bir kez engellenmediğinde ağrı semptomları devam etti. Bu, bu nöropatik kronik ağrıya katkıda bulunan birçok karmaşık mekanizmadan birinin, WDR nöronlarının sempatik uyarımla aşırı uyarılması olduğunu gösterir.[10]
Nöropatik ağrıda rol oynayan başka bir özellik, adı verilen geçici reseptör kanalıdır. TRPA1. Bu kanalın kronik ağrı yaralanmalarını ve iltihaplanma, şeker hastalığı gibi hastalıkları etkilediği bilinmektedir. fibromiyalji, bronşit ve amfizem.[12] WDR nöronları, vücuttaki duyusal değişikliklere bağlı olarak sinyal göndermeye ve almaya yardımcı olan somatosensör sistemin büyük bir parçasıdır. TRPA1 kanalı, sıcaklık ve ağrı hissi ile yakından ilişkilendirilmiştir. birincil afferent duyusal nöronlar ve büyük ölçüde nosiseptif duyusal nöronlarda bulunur. sırt kök gangliyonu.[13] TRPA1'in inhibisyonunun ağrı ve aşırı duyarlılığı artırarak farklı enflamatuar ve nöropatik hastalıklara katkıda bulunduğu bilinmektedir.[12] Bu, WDR nöronlarının rol oynadığı duyusal yanıtlarda yer alan kronik enflamatuar ve nöropatik hastalıkların yönlerini incelemeye ve kontrol etmeye devam etmek için yararlı olan bir çalışma alanıdır.
Kaşıntı yanıtlarında rol
Ek olarak, kaşıntı yolu da WDR nöronlarıyla bağlantılıdır çünkü kaşıntı ve ağrı yolları yakından ilişkilidir. Ağrı yolunda geçici reseptör kanalları bulunduğundan, bunlar kaşıntı yolunda da mevcuttur. Kaşıntı yolunda, geçici reseptör kanalları aktive edildiğinde bir kaşıntı yanıtı ortaya çıkarılabilir. Kaşıntı tepkileri, ağrı gibi, sıcaklık değişiklikleri (çok yüksek veya çok düşük) tarafından da kontrol edilebilir. Bu kontrol mekanizması, bir uyaran aşırı derecede düşük veya çok yüksek bir sıcaklıkta olduğunda ortaya çıkar. Organizmanın uyarana duyarlılığı artar, yani ortaya çıkan ağrı veya kaşıntı bu sıcaklıklarda oda sıcaklığındakinden daha büyük olacaktır.[14] Bu yollar birçok benzerlik gösterse de, sinir büyüme faktörü ve P maddesi gibi, kaşıntı duyumlarının kontrol edilebileceği başka mekanizmalar da vardır.[15]
Beyin görüntüleme, beynin prefrontal, tamamlayıcı motor alanları gibi birçok bölgesinde benzer aktiviteyi gösterir. motor öncesi korteks, anterior insular korteks ve kaşıntı ve ağrı bölgeleri aktive olduğunda diğerleri.[13] Bu iki yolun daha iyi anlaşılması, WDR nöronlarının daha iyi anlaşılmasını sağlayacaktır.
Referanslar
- ^ Mendell, L.M. (1966-11-01). "Omuriliğe miyelinsiz lif projeksiyonunun fizyolojik özellikleri". Deneysel Nöroloji. 16 (3): 316–332. doi:10.1016/0014-4886(66)90068-9. ISSN 0014-4886. PMID 5928985.
- ^ Meyerson, Björn A .; Linderoth, Bengt (2006-04-01). "Nöropatik ağrıda omurilik stimülasyonunun etki şekli". Journal of Pain and Symptom Management. 31 (4 Ek): S6–12. doi:10.1016 / j.jpainsymman.2005.12.009. ISSN 0885-3924. PMID 16647596.
- ^ a b c Zhang, Tianhe (20 Haziran 2014). "Nöropatik Ağrının Tedavisi için Omurilik Stimülasyonunun Mekanizmaları ve Modelleri". Beyin Araştırması. 1569: 19–31. doi:10.1016 / j.brainres.2014.04.039. PMID 24802658.
- ^ West, S.J. (6 Ağustos 2015). "Dorsal Boynuzun Devresi ve Plastisitesi - Nöropatik Ağrının Daha İyi Anlaşılmasına Doğru". Sinirbilim. 300: 254–275. doi:10.1016 / j.neuroscience.2015.05.020. PMID 25987204.
- ^ Craig, A.D. (6 Mart 2017). "Ağrı Mekanizmaları: Merkezi İşlemede Yakınsamaya Karşı Etiketli Çizgiler". Yıllık Nörobilim İncelemesi. 26: 1–30. doi:10.1146 / annurev.neuro.26.041002.131022. PMID 12651967.
- ^ a b c D'Mello, R .; Dickenson, A.H. (2008-07-01). "Omurilik ağrı mekanizmaları". İngiliz Anestezi Dergisi. 101 (1): 8–16. doi:10.1093 / bja / aen088. ISSN 0007-0912. PMID 18417503.
- ^ Inui, Koji (2012-11-01). "[Ağrı yolu]". Beyin ve Sinir = Shinkei Kenkyu No Shinpo. 64 (11): 1215–1224. ISSN 1881-6096. PMID 23131731.
- ^ Lynn, R.B. (1992-05-27). "Yemek borusu ağrısının mekanizmaları". Amerikan Tıp Dergisi. 92 (5A): 11S-19S. doi:10.1016 / 0002-9343 (92) 80051-z. ISSN 0002-9343. PMID 1595755.
- ^ West, S. J .; Bannister, K .; Dickenson, A. H .; Bennett, D.L. (2015-08-06). "Sırt boynuzunun devresi ve plastisitesi - nöropatik ağrının daha iyi anlaşılmasına doğru". Sinirbilim. 300: 254–275. doi:10.1016 / j.neuroscience.2015.05.020. ISSN 1873-7544. PMID 25987204.
- ^ a b c Nickel, Florian T .; Seifert, Frank; Lanz, Stefan; Maihöfner, Christian (2012/02/01). "Nöropatik ağrı mekanizmaları". Avrupa Nöropsikofarmakoloji. 22 (2): 81–91. doi:10.1016 / j.euroneuro.2011.05.005. ISSN 0924-977X. PMID 21672666.
- ^ Roberts, W. J .; Foglesong, M.E. (1988-09-01). "Omurga kayıtları, geniş dinamik aralıklı nöronların sempatik olarak sürdürülen ağrıya aracılık ettiğini göstermektedir". Ağrı. 34 (3): 289–304. doi:10.1016 / 0304-3959 (88) 90125-x. ISSN 0304-3959. PMID 3186277.
- ^ a b Garrison, Sheldon R .; Stucky, Cheryl L. (2017/04/09). "Dinamik TRPA1 Kanalı: Uygun Bir Farmakolojik Ağrı Hedefi mi?". Güncel Farmasötik Biyoteknoloji. 12 (10): 1689–1697. doi:10.2174/138920111798357302. ISSN 1389-2010. PMC 3884818. PMID 21466445.
- ^ a b Akiyama, Tasuku; Carstens, E. (2013-10-10). "Kaşıntının sinirsel işlenmesi". Sinirbilim. 250: 697–714. doi:10.1016 / j.neuroscience.2013.07.035. ISSN 0306-4522. PMC 3772667. PMID 23891755.
- ^ Patapoutain, Ardem (8 Ocak 2009). "Geçici Reseptör Potansiyel Kanalları: Ağrıyı Kaynağa Hedefleme". Nat Rev Drug Discov. 8 (1): 55–68. doi:10.1038 / nrd2757. PMC 2755576. PMID 19116627.
- ^ Lucaciu, Octavian C .; Connell, Gaelan P. (2013-07-01). "Geçici reseptör potansiyel kanalları aracılığıyla kaşıntı hissi: sistematik bir inceleme ve manuel tedaviye uygunluk". Manipülatif ve Fizyolojik Terapötikler Dergisi. 36 (6): 385–393. doi:10.1016 / j.jmpt.2013.05.018. ISSN 1532-6586. PMID 23896168.
