Gelişmiş glikasyon son ürünü - Advanced glycation end-product - Wikipedia
Gelişmiş glikasyon son ürünleri (Yaşlar) olan proteinler veya lipitlerdir glikozlu şekerlere maruz kalmanın bir sonucu olarak.[1] Yaşlanmada ve birçok kişinin gelişiminde veya kötüleşmesinde rol oynayan bir biyo-belirteçtirler. Dejeneratif hastalıklar, gibi diyabet, ateroskleroz, kronik böbrek hastalığı, ve Alzheimer hastalığı.[2]
Diyet kaynakları
Yağ ve protein içeriği yüksek olan hayvansal kaynaklı gıdalar genellikle AGE açısından zengindir ve pişirme sırasında daha fazla AGE oluşumuna eğilimlidir.[3] Bununla birlikte, sadece düşük moleküler ağırlıklı AGE'ler diyet yoluyla emilir ve vejeteryanların vejetaryen olmayanlara kıyasla daha yüksek toplam AGE konsantrasyonlarına sahip oldukları bulunmuştur.[4] Bu nedenle, diyetteki AGE'lerin hastalığa ve yaşlanmaya katkıda bulunup bulunmadığı veya yalnızca endojen AGE'lerin (vücutta üretilenler) olup olmadığı açık değildir.[5] Bu, diyetin AGE'yi potansiyel olarak olumsuz etkilemesini sağlamaz, ancak potansiyel olarak diyetteki AGE'nin, diyetin yükselmesine neden olan diğer yönlerden daha az dikkati hak edebileceğini ima eder. kan şekeri AGE seviyeleri ve oluşumu.[4][5]
Etkileri

AGE'ler vücuttaki hemen hemen her hücre ve molekülü etkiler ve yaşlanmada bir faktör olduğu düşünülmektedir.[6] ve bazı yaşa bağlı kronik hastalıklar.[7][8][9] Ayrıca bunların vasküler komplikasyonlarında nedensel bir rol oynadıklarına inanılıyor. şeker hastalığı.[10]
AGE'ler belirli patolojik koşullar altında ortaya çıkar, örneğin oksidatif stres Nedeniyle hiperglisemi olan hastalarda diyabet.[11] AGE'ler proinflamatuar aracılar olarak rol oynar. gestasyonel diyabet yanı sıra.[12]
Kardiyovasküler hastalık bağlamında AGE'ler, kollajenin çapraz bağlanmasına neden olabilir, bu da vasküler sertleşmeye ve arter duvarlarında düşük yoğunluklu lipoprotein partiküllerinin (LDL) tutulmasına neden olabilir. AGE'ler ayrıca oksidasyonunu artırabilen LDL'nin glikasyonuna da neden olabilir.[13] Okside LDL, ateroskleroz gelişimindeki ana faktörlerden biridir.[14] Son olarak, AGE'ler aşağıdakilere bağlanabilir: RAGE (gelişmiş glikasyon son ürünleri için reseptör) ve oksidatif strese ve ayrıca vasküler endotelyal hücrelerde inflamatuar yolların aktivasyonuna neden olur.[13][14]
Diğer hastalıklarda
AGE'ler Alzheimer Hastalığına dahil edilmiştir,[15] kalp-damar hastalığı,[16] ve felç.[17] AGE'lerin hasara neden olduğu mekanizma adı verilen bir süreçtir. çapraz bağlama hücre içi hasara ve apoptoza neden olur.[18] Kristalin mercekte ışığa duyarlılaştırıcılar oluştururlar,[19] katarakt gelişimi için etkileri olan.[20] Azalmış kas fonksiyonu da AGE'lerle ilişkilidir.[21]
Patoloji
AGE'lerin bir aralığı vardır patolojik etkiler, gibi:[22][23]
- Arttı Vasküler geçirgenlik.
- Arttı arter sertliği
- İnhibisyonu vasküler genişleme müdahale ederek nitrik oksit.
- Oksitleyici LDL.
- Bağlayıcı hücreler - dahil makrofaj, endotel, ve mezanjiyal - çeşitli salgıların salgılanmasını sağlamak için sitokinler.
- Geliştirilmiş oksidatif stres.
- Hemoglobin-AGE seviyeleri diyabetik bireylerde yükselir[24] ve diğer AGE proteinlerinin, diyabetik sıçanların retina, lens ve renal korteksinde 5-20 haftalık periyotlarda 5-50 kat artarak zamanla biriktiği deneysel modellerde gösterilmiştir. AGE oluşumunun inhibisyonu, diyabetik sıçanlarda nefropatinin derecesini azalttı.[25] Bu nedenle, AGE oluşumunu inhibe eden maddeler, hastalığın ilerlemesini sınırlayabilir ve AGE aracılı hastalığın tedavisinde terapötik müdahaleler için yeni araçlar sunabilir.[26][27]
- AGE'lerin spesifik hücresel reseptörleri vardır; en iyi karakterize edilenler Öfke. Hücresel RAGE'nin endotel, mononükleer fagositler ve lenfositler üzerindeki aktivasyonu, serbest radikallerin oluşumunu ve inflamatuar gen aracılarının ekspresyonunu tetikler.[28] Oksidatif stresteki bu tür artışlar, transkripsiyon faktörü NF-B'nin aktivasyonuna yol açar ve ateroskleroz ile bağlantılı olan NF-κB tarafından düzenlenen genlerin ekspresyonunu destekler.[26]
Reaktivite
Proteinler genellikle glikolize olurlar. lizin kalıntılar.[29] İnsanlarda, histonlar içinde hücre çekirdeği lizin açısından en zengindir ve bu nedenle glikozlu proteini oluşturur N (6) -Karboksimetillizin (CML).[29]
Bir reseptör takma adlı RAGE, receptor için adans etti glikör end ürünler, dahil olmak üzere birçok hücrede bulunur endotel hücreleri, düz kas, hücreleri bağışıklık sistemi[hangi? ] akciğer, karaciğer ve böbrek gibi dokulardan.[açıklama gerekli ][hangi? ] Bu reseptör, AGE'leri bağlarken yaşa ve diyabete bağlı kronik iltihaplı gibi hastalıklar ateroskleroz, astım, artrit, miyokardiyal enfarktüs, nefropati, retinopati, periodontitis ve nöropati.[30] patogenez bu sürecin aktivasyonuna hipotez edildi. nükleer faktör kappa B (NF-κB ) AGE bağlanmasının ardından. NF-κB birkaç genler dahil olan iltihap.[kaynak belirtilmeli ]
Boşluk
İçinde Boşluk veya bir maddenin vücuttan atılma hızı veya vücuttan atılma hızı, hücresel proteoliz AGE'lerin oranı - proteinlerin parçalanması - AGE üretir peptidler ve "YAŞ içermez eklentiler "(AGE eklentileri tek amino asitler ). Bunlar, plazma, içinde atılabilir idrar.[31]
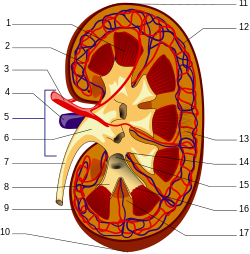
Bununla birlikte, direniş hücre dışı matris proteinlerin proteolize dönüşmesi, gelişmiş glikasyon son ürünlerini elimine edilmeye daha az elverişli hale getirir.[31] AGE içermeyen eklentiler doğrudan idrara salınırken, AGE peptidleri endositozlu tarafından epitel hücreleri of Proksimal tübül ve sonra endolizozomal sistem AGE amino asitleri üretmek için. Bu asitlerin daha sonra böbreğin iç boşluğuna geri döndüğü veya lümen, için boşaltım.[22] AGE içermeyen eklentiler, AGE'lerin idrarla atıldığı ana formdur ve AGE peptidleri daha az ölçüde oluşur.[22] ancak kronik böbrek yetmezliği olan hastaların plazmasında birikiyor.[31]
Daha büyük, hücre dışı olarak türetilen AGE proteinleri, hücrenin temel zarından geçemez. böbrek korpüskülü ve ilk olarak AGE peptidlerine ve AGE içermeyen eklentilere indirgenmelidir. Çevresel makrofaj[22] yanı sıra karaciğer sinüzoidal endotel hücreleri ve Kupffer hücreleri[32] Karaciğerin gerçek hayattaki rolü tartışılmış olsa da, bu sürece dahil edilmiştir.[33]

İçeri giremeyen büyük YAŞ proteinleri Bowman'ın kapsülü reseptörlere bağlanabilir endotel ve mezanjiyal hücreler ve mezanjiyal matris.[22] RAGE'nin aktivasyonu, çeşitli sitokinler, dahil olmak üzere TNFβ, bu bir engellemeye aracılık eder metaloproteinaz mezanjiyal matris üretimini artırarak glomerüloskleroz[23] ve alışılmadık derecede yüksek AGE seviyelerine sahip hastalarda böbrek fonksiyonunun azaltılması.
İdrarla atılım için uygun tek form olmasına rağmen, AGE'nin parçalanma ürünleri - yani peptidler ve serbest adduktlar - türetildikleri AGE proteinlerinden daha agresiftir ve diyabetik hastalarda sonradan bile ilgili patolojiyi devam ettirebilirler. hiperglisemi kontrol altına alındı.[22]
Bazı AGE'ler, doğal katalitik oksidatif kapasiteye sahipken, NAD (P) H oksidaz RAGE'nin aktivasyonu ve mitokondriyal proteinlere verilen hasar, mitokondriyal disfonksiyona yol açarak da oksidatif strese neden olabilir. Bir 2007 laboratuvar ortamında çalışma, AGE'lerin oksidatif stresi artırarak NRK-49F hücrelerinde TGF-β1, CTGF, Fn mRNA ekspresyonunu önemli ölçüde artırabildiğini buldu ve oksidatif stresin inhibisyonunun, diyabetik nefropatide ginkgo biloba ekstresinin etkisinin altında yatabileceğini öne sürdü. Yazarlar, antioksidan tedavinin AGE'lerin birikmesini ve hasarı önlemeye yardımcı olabileceğini öne sürdü.[23] Sonunda, etkili klirens gereklidir ve böbrek disfonksiyonu nedeniyle AGE'den muzdarip olanlar böbrek nakli gerektirebilir.[22]
Artmış bir AGE üretimine sahip şeker hastalarında, böbrek hasarı, AGE'lerin daha sonra idrarla alınmasını azaltır ve hasar oranını artıran pozitif bir geri bildirim döngüsü oluşturur. 1997 yılında yapılan bir çalışmada, diyabetik ve sağlıklı deneklere, 100 g fruktozla veya fruktozsuz pişirilmiş tek öğün yumurta akı (56 g protein) verildi; fruktozlu yemekten AGE immünoreaktivitesinde 200 kattan fazla artış oldu.[34]
Potansiyel tedavi

AGE'ler devam eden araştırmaların konusudur. Üç terapötik yaklaşım vardır: AGE oluşumunu önlemek, çapraz bağları oluşturduktan sonra kırmak ve olumsuz etkilerini önlemek.
Bu makale çok güveniyor Referanslar -e birincil kaynaklar. (Ağustos 2019) (Bu şablon mesajını nasıl ve ne zaman kaldıracağınızı öğrenin) |
Laboratuvarda AGE oluşumunu engellediği bulunan bileşikler şunları içerir: C vitamini, Agmatin, benfotiamin, piridoksamin, alfa-lipoik asit,[35][36] taurin,[37] pimagedine,[38] aspirin,[39][40] karnozin,[41] metformin,[42] pioglitazon,[42] ve pentoksifilin.[42] TRPA-1 reseptörünün lipoik asit veya podokarpik asit ile aktivasyonunun, birkaç AGE'nin başlıca öncüsü olan metilglioksalın detoksifikasyonunu arttırarak AGES seviyelerini düşürdüğü gösterilmiştir.[43]
Sıçanlar ve fareler üzerinde yapılan araştırmalar şunu buldu: doğal fenoller gibi Resveratrol ve kurkumin AGE'lerin olumsuz etkilerini önleyebilir.[44][45]
Bazı mevcut AGE çapraz bağlarını kırdığı düşünülen bileşikler şunları içerir: Alagebrium (ve ilgili ALT-462, ALT-486 ve ALT-946)[46] ve N-fenasil tiyazolyum bromür.[47] Bir in vitro çalışma, rosmarinik asidin ALT-711'in YAŞ kırma potansiyelini gerçekleştirdiğini göstermektedir.[48]

Bununla birlikte, en yaygın AGE'yi parçalayabilecek bilinen hiçbir ajan yoktur. glukosepan insan dokusunda diğer çapraz bağlanan AGE'lerden 10 ila 1.000 kat daha yaygın görünen.[49][50]
Öte yandan bazı kimyasallar aminoguanidin ile reaksiyona girerek AGE'lerin oluşumunu sınırlayabilir 3-deoksiglukozon.[30]
Ayrıca bakınız
Referanslar
- ^ Goldin, Alison; Beckman, Joshua A .; Schmidt, Ann Marie; Oluşturucu, Mark A. (2006). "Amerikan kalp derneği". Dolaşım. 114 (6): 597–605. doi:10.1161 / SİRKÜLASYONAHA.106.621854. PMID 16894049.
- ^ Vistoli, G; De Maddis, D; Cipak, A; Zarkovic, N; Carini, M; Aldini, G (Ağu 2013). "Gelişmiş glikoksidasyon ve lipoksidasyon son ürünleri (AGE'ler ve ALE'ler): oluşum mekanizmalarına genel bir bakış" (PDF). Ücretsiz Radic Res. 47: Özel Sayı 1: 3–27. doi:10.3109/10715762.2013.815348. PMID 23767955.
- ^ Uribarri, Jaime; Woodruff, Sandra; Goodman, Susan; Cai, Weijing; Chen, Xue; Pyzik, Renata; Yong, Angie; Forvet, Gary E .; Vlassara, Helen (Haziran 2010). "Gıdalarda Gelişmiş Glikasyon Son Ürünleri ve Diyette Azaltılması İçin Pratik Bir Kılavuz". Amerikan Diyetisyenler Derneği Dergisi. 110 (6): 911–916.e12. doi:10.1016 / j.jada.2010.03.018. PMC 3704564. PMID 20497781.
- ^ a b Poulsen, Malene W .; Hedegaard, Rikke V .; Andersen, Jeanette M .; de Courten, Barbora; Bügel, Susanne; Nielsen, John; Skibsted, Leif H .; Dragsted, Lars O. (Ekim 2013). "Gıdalarda gelişmiş glikasyon son ürünleri ve sağlık üzerindeki etkileri". Gıda ve Kimyasal Toksikoloji. 60: 10–37. doi:10.1016 / j.fct.2013.06.052. PMID 23867544.
- ^ a b Luevano-Contreras, Claudia; Chapman-Novakofski, Karen (13 Aralık 2010). "Diyet Gelişmiş Glikasyon Son Ürünleri ve Yaşlanma". Besinler. 2 (12): 1247–1265. doi:10.3390 / nu2121247. PMC 3257625. PMID 22254007.
- ^ Chaudhuri, Jyotiska; Bains, Yasmin; Guha, Sanjib; Kahn, Arnold; Hall, David; Bose, Neelanjan; Gugliucci, Alejandro; Kapahi, Pankaj (4 Eylül 2018). "İleri glikasyon son ürünlerinin yaşlanma ve metabolik hastalıklardaki rolü: ilişki ve nedensellik arasında köprü kurma". Hücre Metabolizması. 28 (3): 337–352. doi:10.1016 / j.cmet.2018.08.014. PMC 6355252. PMID 30184484.
- ^ Glenn, J .; Stitt, A. (2009). "İleri glikasyon son ürünlerinin retina yaşlanmasında ve hastalıkta rolü". Biochimica et Biophysica Açta (BBA) - Genel Konular. 1790 (10): 1109–1116. doi:10.1016 / j.bbagen.2009.04.016. PMID 19409449.
- ^ Semba, R. D .; Ferrucci, L .; Sun, K .; Beck, J .; Dalal, M .; Varadhan, R .; Walston, J .; Güralnik, J. M .; Fried, L.P. (2009). "Gelişmiş glikasyon son ürünleri ve bunların dolaşımdaki reseptörleri, toplumda yaşayan yaşlı kadınlarda kardiyovasküler hastalık mortalitesini öngörüyor". Yaşlanma Klinik ve Deneysel Araştırma. 21 (2): 182–190. doi:10.1007 / BF03325227. PMC 2684987. PMID 19448391.
- ^ Semba, R .; Najjar, S .; Sun, K .; Lakatta, E .; Ferrucci, L. (2009). "Gelişmiş bir glikasyon son ürünü olan serum karboksimetil-lizin, yetişkinlerde artmış aortik nabız dalga hızı ile ilişkilidir". Amerikan Hipertansiyon Dergisi. 22 (1): 74–79. doi:10.1038 / ajh.2008.320. PMC 2637811. PMID 19023277.
- ^ Yan, S. F .; D'Agati, V .; Schmidt, A. M .; Ramasamy, R. (2007). "İleri Glikasyon Son Ürünleri için Reseptör (RAGE): diyabet ve yaşlanmanın kardiyovasküler komplikasyonlarının patogenezinde müthiş bir güç". Güncel Moleküler Tıp. 7 (8): 699–710. doi:10.2174/156652407783220732. PMID 18331228.
- ^ Brownlee, M (Haziran 2005). "Diyabetik komplikasyonların patobiyolojisi: birleştirici bir mekanizma". Diyabet. 54 (6): 1615–25. doi:10.2337 / diyabet.54.6.1615. PMID 15919781.
- ^ Pertyńska-Marczewska, Magdalena; Głowacka, Ewa; Sobczak, Małgorzata; Cypryk, Katarzyna; Wilczyński, Ocak (11 Ocak 2009). "Glikasyon Son Ürünleri, Diyabetik ve Diyabetik Olmayan Gebeliklerde İleri Glikasyon Son Ürünleri ve Sitokinler için Çözünür Reseptör". American Journal of Reproductive Immunology. 61 (2): 175–182. doi:10.1111 / j.1600-0897.2008.00679.x. PMID 19143681.
- ^ a b Prasad, Anand; Bekker, Peter; Tsimikas, Sotirios (2012). "Gelişmiş Glikasyon Son Ürünleri ve Diyabetik Kardiyovasküler Hastalık". Gözden Geçirilmiş Kardiyoloji. 20 (4): 177–183. doi:10.1097 / CRD.0b013e318244e57c. PMID 22314141.
- ^ a b Di Marco, Elyse; Gray, Stephen P .; Jandeleit-Dahm, Karin (2013). "Diyabet, Vaskülatürdeki Pro ve Antiinflamatuar Sinyal Yollarının Aktivasyonunu ve Bastırılmasını Değiştirir". Endokrinolojide Sınırlar. 4: 68. doi:10.3389 / fendo.2013.00068. PMC 3672854. PMID 23761786.
- ^ Srikanth, Velandai; Maczurek, Annette; Phan, Thanh; Steele, Megan; Westcott, Bernadette; Juskiw, Damian; Münch, Gerald (Mayıs 2011). "Gelişmiş glikasyon son ürünleri ve Alzheimer hastalığında reseptör RAGE". Yaşlanmanın Nörobiyolojisi. 32 (5): 763–777. doi:10.1016 / j.neurobiolaging.2009.04.016. PMID 19464758.
- ^ Simm, A .; Wagner, J .; Gürsinsky, T .; Nass, N .; Friedrich, I .; Schinzel, R .; Czeslik, E .; Silber, R.E .; Scheubel, R.J. (Temmuz 2007). "Gelişmiş glikasyon son ürünleri: Kalp cerrahisinden sonra bir sonuç belirleyicisi olarak yaş için bir biyobelirteç mi?". Deneysel Gerontoloji. 42 (7): 668–675. doi:10.1016 / j.exger.2007.03.006. PMID 17482402.
- ^ Zimmerman, GA; Meistrell, M; Bloom, O; Hamamböceği, K M; Bianchi, M; Risucci, D; Broome, J; Çiftçi, P; Cerami, A; Vlassara, H (25 Nisan 1995). "Fokal inme sırasında ileri glikasyon son ürünlerinin nörotoksisitesi ve aminoguanidinin nöroprotektif etkileri". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 92 (9): 3744–3748. Bibcode:1995PNAS ... 92.3744Z. doi:10.1073 / pnas.92.9.3744. PMC 42038. PMID 7731977.
- ^ Shaikh, Shamim; Nicholson, Louise F.B. (Temmuz 2008). "Gelişmiş glikasyon son ürünleri, α ‐ sinükleinin in vitro çapraz bağlanmasını indükler ve hücre içi inklüzyon cismi oluşumu sürecini hızlandırır". Sinirbilim Araştırmaları Dergisi. 86 (9): 2071–2082. doi:10.1002 / jnr.21644. PMID 18335520.
- ^ Fuentealba, Denis; Friguet, Bertrand; Silva, Eduardo (Ocak 2009). "Gelişmiş Glikasyon Son Ürünleri, Bovin Lens Proteinlerinin Tip-I Mekanizması ile Fotocrosslinking ve Oksidasyonunu İndükler". Fotokimya ve Fotobiyoloji. 85 (1): 185–194. doi:10.1111 / j.1751-1097.2008.00415.x. PMID 18673320.
- ^ Gül, Anjuman; Rahman, M. Ataur; Hasnain, Syed Nazrul (6 Şubat 2009). "Senil diyabetik ve diyabetik olmayan hastalarda kataraktogenezde fruktoz konsantrasyonunun rolü". Graefe'nin Klinik ve Deneysel Oftalmoloji Arşivi. 247 (6): 809–814. doi:10.1007 / s00417-008-1027-9. PMID 19198870.
- ^ Haus, Jacob M .; Carrithers, John A .; Trappe, Scott W .; Trappe, Todd A. (Aralık 2007). "Yaşlanan insan iskelet kasında kolajen, çapraz bağlama ve gelişmiş glikasyon son ürünleri". Uygulamalı Fizyoloji Dergisi. 103 (6): 2068–2076. doi:10.1152 / japplphysiol.00670.2007. PMID 17901242.
- ^ a b c d e f g Gugliucci A, Bendayan M (1996). "Dolaşımdaki ileri glikozatlı son ürünlerin (AGE) böbrek akıbeti: AGE peptitlerinin renal proksimal tübüler hücreler tarafından yeniden absorpsiyonu ve katabolizması için kanıt". Diyabetoloji. 39 (2): 149–60. doi:10.1007 / BF00403957. PMID 8635666.
- ^ a b c Yan, Hai-dong; Li, Xue-zhu; Xie, Jun-mei; Li, Man (Mayıs 2007). "Gelişmiş glikasyon son ürünlerinin, kültürlenmiş NRK-49F hücrelerinde renal fibroz ve oksidatif stres üzerindeki etkileri". Çin Tıp Dergisi. 120 (9): 787–793. doi:10.1097/00029330-200705010-00010. PMID 17531120.
- ^ Kostolanská J, Jakus V, Barák L (Mayıs 2009). "Tip 1 diabetes mellituslu zayıf ve iyi kontrol edilen çocuklarda ve ergenlerde ileri glikasyon ve oksidasyon protein ürünlerinin HbA1c ve serum seviyeleri". Pediatrik Endokrinoloji ve Metabolizma Dergisi. 22 (5): 433–42. doi:10.1515 / JPEM.2009.22.5.433. PMID 19618662.
- ^ Ninomiya, T .; et al. (2001). "Yeni bir AGE üretim inhibitörü, STZ ile indüklenen sıçanlarda diyabetik nefropatinin ilerlemesini önler". Diyabet. 50 Ek (2): A178–179.
- ^ a b Bierhaus A, Hofmann MA, Ziegler R, Nawroth PP (Mart 1998). "AGE'ler ve bunların vasküler hastalık ve diabetes mellitusta AGE reseptörleri ile etkileşimleri. I. AGE kavramı". Kardiyovasküler Araştırma. 37 (3): 586–600. doi:10.1016 / S0008-6363 (97) 00233-2. PMID 9659442.
- ^ Thornalley, P.J. (1996). "İleri glikasyon ve diyabetik komplikasyonların gelişimi. Glikoz, metilglioksal ve oksidatif stresin katılımını birleştirmek". Endocrinol. Metab. 3: 149–166.
- ^ Hofmann MA, Drury S, Fu C, Qu W, Taguchi A, Lu Y, Avila C, Kambham N, Bierhaus A, Nawroth P, Neurath MF, Slattery T, Beach D, McClary J, Nagashima M, Morser J, Stern D Schmidt AM (Haziran 1999). "RAGE, yeni bir proinflamatuar eksene aracılık eder: S100 / calgranulin polipeptidleri için bir merkezi hücre yüzeyi reseptörü". Hücre. 97 (7): 889–901. doi:10.1016 / S0092-8674 (00) 80801-6. PMID 10399917.
- ^ a b Ansari NA, Moinuddin, Ali R (2011). "Glisinlenmiş lizin kalıntıları: yaşa bağlı hastalıklarda enzimatik olmayan protein glikasyonu için bir belirteç". Hastalık Belirteçleri. 30 (6): 317–324. doi:10.1155/2011/718694. PMC 3825483. PMID 21725160.
- ^ a b Wells-Knecht KJ, Zyzak DV, Litchfield JE, Thorpe SR, Baynes JW (1995). "Otoksidatif glikosilasyon mekanizması: glikoz ile proteinlerin otoksidatif modifikasyonunda ara ürünler olarak glikoksal ve arabinozun belirlenmesi". Biyokimya. 34 (11): 3702–9. doi:10.1021 / bi00011a027. PMID 7893666.
- ^ a b c Gugliucci A, Mehlhaff K, Kinugasa E, vd. (2007). "Son dönem böbrek hastalığı olan hastalarda paraoksonaz-1 konsantrasyonları hemodiyalizden sonra artar: düşük moleküler AGE eklenti klirensi ile korelasyon". Clin. Chim. Açta. 377 (1–2): 213–20. doi:10.1016 / j.cca.2006.09.028. PMID 17118352.
- ^ Smedsrød B, Melkko J, Araki N, Sano H, Horiuchi S (1997). "Gelişmiş glikasyon son ürünleri, hepatik sinüzoidal Kupffer ve endotelyal hücrelerde çöpçü reseptör aracılı endositozla elimine edilir". Biochem. J. 322 (Pt 2): 567–73. doi:10.1042 / bj3220567. PMC 1218227. PMID 9065778.
- ^ Svistounov D, Smedsrød B (2004). "İleri glikasyon son ürünlerinin (AGE'ler) hepatik klirensi - efsane mi yoksa gerçek mi?". J. Hepatol. 41 (6): 1038–40. doi:10.1016 / j.jhep.2004.10.004. PMID 15582139.
- ^ Koschinsky, Theodore; O, Ci-Jiang; Mitsuhashi, Tomoko; Bucala, Richard; Liu, Cecilia; Buenting, Christina; Heitmann, Kirsten; Vlassara, Helen (10 Haziran 1997). "Ağızdan emilen reaktif glikasyon ürünleri (glikotoksinler): Diyabetik nefropatide çevresel bir risk faktörü". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 94 (12): 6474–6479. Bibcode:1997PNAS ... 94.6474K. doi:10.1073 / pnas.94.12.6474. PMC 21074. PMID 9177242.
- ^ Chaudhuri, Jyotiska; Bose, Neelanjan; Gong, Jianke; Hall, David; Rifkind, Alexander; Bhaumik, Dipa; Peiris, T. Harshani; Chamoli, Manish; Le, Catherine H .; Liu, Jianfeng; Lithgow, Gordon J .; Ramanathan, Arvind; Shawn Xu, X. Z .; Kapahi, Pankaj (21 Kasım 2016). "Bir Caenorhabditis elegans Modeli, Reaktif Alfa-dikarbonil Detoksifikasyonunda TRPA1-Nrf Sinyali için Korunan Bir Rolü Açıklıyor". Güncel Biyoloji. 26 (22): 3014–3025. doi:10.1016 / j.cub.2016.09.024. PMC 5135008. PMID 27773573.
- ^ Mohmmad Abdul, Hafız; Butterfield, D. Allan (Şubat 2007). "HNE aracılı oksidatif stres ve nörotoksisiteye karşı asetil-L-karnitin ve α-lipoik asidin birlikte tedavisiyle korumayı tetiklemek için kortikal nöronlarda PI3K / PKG / ERK1 / 2 sinyal yollarının dahil edilmesi: Alzheimer hastalığı için çıkarımlar". Ücretsiz Radikal Biyoloji ve Tıp. 42 (3): 371–384. doi:10.1016 / j.freeradbiomed.2006.11.006. PMC 1808543. PMID 17210450.
- ^ Nandhini AT, Thirunavukkarasu V, Anuradha CV (Ağustos 2005). "Taurin, yüksek fruktozla beslenen sıçanlarda kolajen anormalliklerini önler" (PDF). Indian J. Med. Res. 122 (2): 171–7. PMID 16177476. Arşivlenen orijinal (PDF) 2009-04-17 tarihinde. Alındı 2009-04-16.
- ^ A. Gugliucci, "Şekerin Ekşi Tarafı, Bir Glikasyon Web Sayfası Arşivlendi 1 Temmuz 2007, Wayback Makinesi
- ^ Urios, P .; Grigorova-Borsos, A.-M .; Sternberg, M. (2007). "Aspirin önizleme ve ilgili bilgilerin oluşumunu engeller". Diyabet Araştırması ve Klinik Uygulama. 77 (2): 337–340. doi:10.1016 / j.diabres.2006.12.024. PMID 17383766. Alındı 2013-11-13.
- ^ Bucala, Richard; Cerami, Anthony (1992). Gelişmiş Glikosilasyon: Diyabet ve Yaşlanma için Kimya, Biyoloji ve Çıkarımlar. Farmakolojideki Gelişmeler. 23. s. 1–34. doi:10.1016 / S1054-3589 (08) 60961-8. ISBN 978-0-12-032923-6. PMID 1540533.
- ^ Guiotto, Andrea; Calderan, Andrea; Ruzza, Paolo; Borin, Gianfranco (1 Eylül 2005). "Karnosin ve Karnosinle İlgili Antioksidanlar: Bir Gözden Geçirme". Güncel Tıbbi Kimya. 12 (20): 2293–2315. doi:10.2174/0929867054864796. PMID 16181134.
- ^ a b c Rahbar, S; Figarola, JL (2013-03-25). "Gelişmiş glikasyon son ürünlerinin yeni inhibitörleri". Arch. Biochem. Biophys. 419 (1): 63–79. doi:10.1016 / j.abb.2003.08.009. PMID 14568010.
- ^ Chaudhuri, Jyotiska; Bose, Neelanjan; Gong, Jianke; Hall, David; Rifkind, Alexander; Bhaumik, Dipa; Peiris, T. Harshani; Chamoli, Manish; Le, Catherine H .; Liu, Jianfeng; Lithgow, Gordon J .; Ramanathan, Arvind; Shawn Xu, X. Z .; Kapahi, Pankaj (21 Kasım 2016). "Bir Caenorhabditis elegans Modeli, Reaktif Alfa-dikarbonil Detoksifikasyonunda TRPA1-Nrf Sinyali için Korunan Bir Rolü Açıklıyor". Güncel Biyoloji. 26 (22): 3014–3025. doi:10.1016 / j.cub.2016.09.024. PMC 5135008. PMID 27773573.
- ^ Mizutani, Kenichi; Ikeda, Katsumi; Yamori, Yukio (Temmuz 2000). "Resveratrol, İnme Eğilimli Spontane Hipertansif Sıçanlardan Alınan Vasküler Düz Kas Hücrelerinde AGE'lere Bağlı Proliferasyonu ve Kolajen Sentez Aktivitesini Engeller". Biyokimyasal ve Biyofiziksel Araştırma İletişimi. 274 (1): 61–67. doi:10.1006 / bbrc.2000.3097. PMID 10903896.
- ^ Tang, Youcai; Chen, Anping (10 Mart 2014). "Kurkumin, leptin sinyallemesini kesintiye uğratarak AGE reseptörlerinin gen ekspresyonunun farklı düzenlenmesi üzerindeki gelişmiş glikasyon son ürünlerinin (AGE'ler) etkisini ortadan kaldırır". Laboratuvar İncelemesi. 94 (5): 503–516. doi:10.1038 / labinvest.2014.42. PMC 4006284. PMID 24614199.
- ^ Bakris, George L .; Banka, Alan J .; Kass, David A .; Neutel, Joel M .; Preston, Richard A .; Oparil, Suzanne (1 Aralık 2004). "Gelişmiş glikasyon son ürün çapraz bağlantı kırıcılarYaşlanma süreciyle ilgili kardiyovasküler patolojilere yeni bir yaklaşım". Amerikan Hipertansiyon Dergisi. 17 (S3): 23S-30S. doi:10.1016 / j.amjhyper.2004.08.022. PMID 15607432.
- ^ Vasan, Sara; Zhang, Xin; Zhang, Xini; Kapurniotu, Afrodit; Bernhagen, Jürgen; Teichberg, Saul; Basgen, John; Wagle, Dilip; Shih, David; Terlecky, Ihor; Bucala, Richard; Cerami, Anthony; Egan, John; Ulrich, Peter (Temmuz 1996). "Glikozdan türetilmiş protein çapraz bağlarını in vitro ve in vivo olarak bölen bir ajan". Doğa. 382 (6588): 275–278. Bibcode:1996Natur.382..275V. doi:10.1038 / 382275a0. PMID 8717046.
- ^ Jean, Daniel; Pouligon, Maryse; Dalle, Claude (2015). "Rosmarinik asidin AGE-çapraz bağlarını kırma yeteneğinin in vitro değerlendirilmesi". Glisatif Stres Araştırması. 2 (4): 204–207. doi:10.24659 / gsr.2.4_204.
- ^ Monnier, Vincent M .; Mustata, Gürcü T .; Biemel, Klaus L .; Reihl, Oliver; Lederer, Marcus O .; Zhenyu, Dai; Sat, David R. (Haziran 2005). "Yaşlanma ve Diyabette Maillard Reaksiyonu ile Hücre Dışı Matrisin Çapraz Bağlantısı: 'Bir Bulmacaya Yaklaşan Çözüm' Üzerine Bir Güncelleme'". New York Bilimler Akademisi Yıllıkları. 1043 (1): 533–544. Bibcode:2005NYASA1043..533M. doi:10.1196 / annals.1333.061. PMID 16037276.
- ^ Furber, John D. (Haziran 2006). "Hücre Dışı Glikasyon Çapraz Bağları: Çıkarma Beklentileri". Gençleştirme Araştırması. 9 (2): 274–278. doi:10.1089 / rej.2006.9.274. PMID 16706655.
