Doğrudan Xa inhibitörlerinin keşfi ve geliştirilmesi - Discovery and development of direct Xa inhibitors - Wikipedia
Doğrudan Xa inhibitörleri sınıfından dört ilaç dünya çapında pazarlanmaktadır. Rivaroxaban (Xarelto), 2008 yılında Avrupa ve Kanada'da ticari olarak satışa sunulan ilk onaylanmış FXa inhibitörüdür.[1] İkincisi apixaban (Eliquis), 2011'de Avrupa'da onaylandı[2] ve 2012'de Amerika Birleşik Devletleri'nde.[3] Üçüncü olan edoksaban (Lixiana, Savaysa) 2011'de Japonya'da ve 2015'te Avrupa'da ve ABD'de onaylandı.[4] Betrixaban (Bevyxxa) ABD'de 2017'de onaylandı.
Tarih
Heparin
Heparin tarafından keşfedildi Jay McLean ve William Henry Howell 1916'da ilk olarak bir köpek karaciğerinden izole edildi ki bu, Yunanca'da şu anlama gelir: Hepar. Heparin, kan pıhtılaşma kademesinde, biri FXa olan birden fazla faktörü hedefler. İlk başta birçok yan etkisi oldu, ancak sonraki yirmi yıl boyunca araştırmacılar onu daha iyi ve daha güvenli hale getirmek için heparin üzerinde çalıştı. Girdi klinik denemeler 1935'te ve ilk ilaç 1936'da piyasaya sürüldü. Doğal heparin zincirleri 5.000 ila 40.000 Dalton arasında değişebilir. 1980'lerde Düşük moleküler ağırlıklı heparin (LMWH) geliştirilmiştir ve yalnızca ortalama moleküler ağırlığı 8.000 Da'dan az olan zincirler içerirler.[5]
Warfarin

1920'lerde Kanada ve Kuzey Amerika Birleşik Devletleri'nde gizemli bir hemorajik sığır hastalığı salgını oldu. Hastalığa tatlı yonca hastalığı adı verildi çünkü sığırlar tatlı yonca samanında otladı. Salgından on yıl sonrasına kadar yerel bir araştırmacı, Karl P. Link ve öğrencisi Wilhelm Schoeffel, buna neden olan maddeyi bulmak için yoğun bir araştırma başlattı. iç kanama. Keşfetmeleri 6 yıl sürdü dikumarol neden olan ajan.[5] Maddenin hakkını patentlediler ve 1945'te Link bir kumarin türevini satmaya başladı. kemirgen öldürücü. O ve meslektaşları birkaç varyasyon üzerinde çalıştılar ve adını verdikleri bir maddeyle sonuçlandı. warfarin 1954 yılına kadar insanlarda tıbbi kullanım için onaylanarak warfarini ilk oral antikoagülan ilaç.[6]
Daha yeni ve daha iyi oral ilaçlara ihtiyaç
Warfarin tedavisi, darlığı nedeniyle düzenli olarak kan takibi ve doz ayarlaması gerektirir. tedavi penceresi. Eğer denetim yeterli değilse, warfarin çok sık, hemorajik olaylara ve yiyecek ve diğer ilaçlarla çoklu etkileşime neden olma konusunda bir tehdit oluşturur. Şu anda, düşük moleküler ağırlıklı heparin (LMWH) ile ilgili temel sorun, verilmesi gerektiği için uygulama yoludur. deri altına.[7] Bu dezavantajlar nedeniyle, daha iyi antikoagülan ilaçlara acil bir ihtiyaç vardır. Modern bir toplum için, uygun ve hızlı ilaç yönetimi, iyi bir ilaç uyumu. 2008'de ilk doğrudan Xa inhibitörü klinik kullanım için onaylandı.[8] Doğrudan Xa inhibitörleri, LMWH ve varfarin kadar etkilidir, ancak oral yoldan verilir ve sıkı bir izleme gerektirmez.[7] Diğer Xa inhibitörlerinin avantajları hızlı başlangıç / dengeleme, az ilaç etkileşimi ve öngörülebilirdir. farmakokinetik. Hızlı başlangıç / dengeleme etkisi, ameliyatlardan sonra parenteral antikoagülanlarla “köprü kurma” ihtiyacını büyük ölçüde azaltır.[9] Bugün pazarlanan dört faktörlü Xa inhibitörü bulunmaktadır: Rivaroksaban, apixaban, edoksaban ve Betrixaban.[7]
Antistasin ve kene antikoagülan peptidi (TAP)
Faktör Xa, 1980'lerin başlarında yeni antikoagülanların geliştirilmesi için umut verici bir hedef olarak tanımlandı. 1987'de, doğal olarak oluşan bileşik antistasin olan ilk faktör Xa inhibitörü, Tükürük bezleri Meksikalı sülük Haementeria officinalis. Antistasin bir polipeptit ve güçlü bir Xa inhibitörüdür. 1990 yılında, doğal olarak oluşan başka bir Xa inhibitörü izole edildi, kenenin özlerinden kene antikoagülan peptidi (TAP) Ornithodoros moubata. Bir ilaç hedefi olarak faktör Xa'yı tahmin etmek için TAP ve antistasin kullanıldı.[8]
Hareket mekanizması
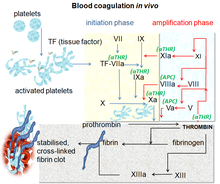
Kan pıhtılaşması kanın pıhtı oluşturduğu karmaşık bir süreçtir. Önemli bir parçasıdır hemostaz ve hasarlı kan damarlarından kan kaybını durdurarak çalışır.[10] Yaralanma bölgesinde, kanın altında kanın maruz kalması endotel trombositler toplanır ve hemen bir tıkaç oluşturur. Bu sürece birincil hemostaz denir. Aynı zamanda ikincil bir hemostaz meydana gelir. Çözülmeyen oluşum olarak tanımlanır fibrin aktive pıhtılaşma faktörleri, özellikle trombin tarafından.[11] Bu faktörler birbirini, içsel ve dışsal yollarla etkileşime giren iki ayrı yoldan meydana gelen bir kan pıhtılaşma kademesinde aktive eder.[12] Çeşitli proenzimleri aktive ettikten sonra, kaskadın son adımlarında trombin oluşur ve daha sonra dönüştürülür. fibrinojen pıhtı oluşumuna yol açan fibrine.[10] Faktör Xa, protrombini trombine dönüştürerek kan pıhtılaşma yolunda önemli bir rol oynayan aktive edilmiş bir serin proteazdır. Faktör Xa'nın inhibisyonu, trombin miktarını azaltarak antitrombotik etkilere yol açar. Faktör Xa'yı doğrudan hedeflemenin, antikoagülasyona etkili bir yaklaşım olduğu ileri sürülmektedir.[8]
Geliştirme
1987'de antistasin, ilk doğrudan Xa inhibitörü olarak test edildi. Antistasin, 20'si, 119 amino asit kalıntısından oluşan bir proteindir. sisteinler 10'da yer alıyor Disülfür bağları.[13] Yavaş, sıkı bağlama görevi görür inhibitör Xa faktörünün bir Ki değeri 0,3-0,6 nM'dir ancak aynı zamanda inhibe eder tripsin.[8] Rekombinant Antistasin, genetiği değiştirilmiş maya ile üretilebilir, sAccharomyces cerevisiae.[14] Doğal olarak oluşan bir başka doğrudan Xa inhibitörü olan kene antikoagülan peptidi (TAP) 1990 yılında keşfedilmiştir. Tek zincirli, 60 amino asitlik bir peptiddir ve benzer bir antistasindir, benzer bir Ki değerine ( ~ 0.6 nM).
Bu iki protein çoğunlukla faktör Xa'yı bir uyuşturucu hedefi. Hayvan çalışmaları, doğrudan Xa inhibisyonunun, doğrudan trombin inhibitörlerine kıyasla antikoagülasyona daha etkili bir yaklaşım olduğunu, özellikle daha geniş bir tedavi penceresi ve geri tepme riskini azaltmak tromboz, (artması tromboembolik olaylar doğrudan ve dolaylı ile karşılaştırıldığında bir antitrombotik ilacın kesilmesinden kısa bir süre sonra meydana gelen trombin inhibitörleri.[8]
1990'larda DX-9065a gibi düşük moleküler ağırlıklı maddeler geliştirildi.[15] ve YM-60828.[16]

DX-9065a, trombini inhibe etmeden FXa'yı inhibe eden ilk sentetik bileşiktir. Bu, bir karboksil grubu FXa'ya seçici bir bağlanma için en önemli kısım gibi görünüyordu.[8] Erken gelişmiş olanlar küçük moleküller henüz vardı amidin -gruplar veya hatta daha yüksek temel işlevler, bir taklit için gerekli olduğu düşünülür. arginin kalıntı protrombin, doğal substrat faktör Xa. Bununla birlikte, bu temel işlevler aynı zamanda çok zayıf bir sözlü biyoyararlanım (ör. DX-9065a için% 2-3).
1998 yılında Bayer Healthcare bir ilaç şirketi, daha yüksek oral biyoyararlanımı olan düşük moleküler ağırlıklı doğrudan faktör Xa inhibitörlerini aramaya başladı. Yüksek verimli tarama ve ilk başta daha fazla optimizasyon, izoindolinonlar sınıfından birkaç maddeye yol açarak, çok daha az bazik maddelerin aynı zamanda güçlü Xa inhibitörleri olarak da hareket edebildiğini göstermektedir. IC50 2 nM'ye kadar değer. İzoindolinonlar, orijinal bileşiklerden daha iyi bir oral biyoyararlanıma sahip olmasına rağmen, yeterli değildi. Bununla birlikte, proje daha sonra sınıfına yol açar n-ariloksazolidinonlar hem yüksek potensli faktör Xa hem de yüksek biyoyararlanıma sahip maddeler sağlar.[8] Bu sınıfın bir bileşeni, Rivaroxaban (IC50 = 0,7 nM, biyoyararlanım:% 60), önlenmesi için pazarlama izni verildi. venöz tromboembolizm Eylül 2008'de Avrupa ve Kanada'da.[1][17]
Kimya
Faktör Xa: Yapı ve bağlayıcı siteler

Faktör IIa, Xa, VIIa, IXa ve XIa, pıhtılaşma kademesinde spesifik bir role sahip olan proteolitik enzimlerdir. Faktör Xa (FXa), içsel ve dışsal yolun kesişme noktasındaki konumu ve her Xa molekülü için yaklaşık 1000 trombin molekülü oluşturması nedeniyle en umut verici olanıdır ve bu da güçlü bir antikoagülan etkiye neden olur. FXa, faktör Xa'daki "a", aktif hale getirildiği anlamına geldiğinden, 52 amino asit aktivasyon peptidinin bölünmesiyle FX'den üretilir. FXa, 254 amino asit katalitik alandan oluşur ve ayrıca 142 amino asitli bir hafif zincire bağlıdır. Zincir her ikisini de içerir GLA alanı ve iki Epidermal büyüme faktörü alanlar (EGF benzeri alanlar).[18]
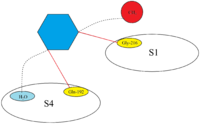
FXa'nın aktif bölgesi, fizyolojik substratların bölünmesini katalize etmek için yapılandırılmıştır ve protrombindeki PhePheAsnProArg-ThrPhe ve TyrIleAspGlyArg-IleVal'i ayırır. FXa, alt tabakaların faktör Xa'ya bağlanması için hedef olan dört sözde cebe sahiptir. Bu cepler farklı amino asitlerle sıralanmıştır ve Xa inhibitörleri faktör Xa'ya bağlanırken bu cebi hedef alır. Xa inhibitörleri için afinite ve seçicilikle ilgili en ilgili iki cep S1 ve S4'tür.[18]
S1: S1 cebi, hidrofobik bir ceptir ve bir bazik grup için bir tanıma bölgesi olarak hizmet edebilen bir aspartik asit kalıntısı (Asp-189) içerir. FXa, S1 cebinde bir artık boşluğa sahiptir ve kalıntılarla kaplıdır Tyr -228, Asp -189 ve Ser-195.[18]
S2: S2 cebi, küçük ve sığ bir ceptir. S4 cebi ile birleşir ve küçük amino asitler için yer vardır. Tyr-99 bu cebe erişimi engelliyor gibi görünüyor, bu nedenle bu cep S1 ve S4 kadar önemli değil.[19]
S3: S3 cebi, S1 cebinin kenarına yerleştirilmiştir ve düzdür ve solvente maruz kalır. Bu cep S1 ve S4 kadar önemli değil.
S4: S4 cebi hidrofobiktir ve cebin tabanı Trp-215 kalıntısından oluşur. FXa'nın Phe-174 ve Tyr-99 kalıntıları, alifatik, aromatik ve pozitif yüklü parçaları bağlayabilen aromatik bir kutu oluşturmak için Trp-215'i birleştirir. Pozitif yüklü varlıklara bağlanması nedeniyle, bir katyon deliği olarak tanımlanabilir.[18]
Doğrudan Xa inhibitörlerinin kimyasal yapısı ve özellikleri
| Rivaroxaban | Apixaban | Edoksaban | |
|---|---|---|---|
| MW (g / mol) | 436 | 460 | 548 |
| Moleküler formül | C19H18ClN3Ö5S | C25H25N5Ö4 | C24H30ClN7Ö4S |
| Şekil | L | L | L |
| Kben | 0,4 nM | 0,08 nM | 0,561 nM |
| IC50 | 0.7 nM | Yok | Yok |
| Oral biyoyararlanım (%) | 66–100 (doza bağlı) | 50 | 62 |

Xa inhibitörlerinin faktör Xa'ya bağlanması
Xa inhibitörlerinin tümü, Xa faktörünün aktif bölgesi içinde L-şeklinde adlandırılan bir tarzda bağlanır. Xa faktörünün temel bileşenleri, S1 ve S4 bağlanma bölgeleridir. İlk olarak, oldukça polar ve bu nedenle yüklü bileşenlere sahip olan doğal bileşikler, antistasin ve TAP'ın hedefe bir miktar spesifiklikle bağlandığı kaydedildi. Bu nedenle yeni ilaçlar pozitif yüklü gruplarla tasarlandı, ancak bunlar zayıf biyoyararlanımla sonuçlandı. Günümüzde pazarlanan Xa inhibitörleri, bu nedenle S1 ve S4 bağlanma bölgeleri ile farklı etkileşimler için eklenmiş çeşitli kısımlara sahip aromatik bir halka içerir. Bu aynı zamanda iyi biyoyararlanımın yanı sıra sıkı bağlanma gücünü muhafaza eder. Şu anda piyasada bulunan Xa inhibitörleri, bu nedenle yüksek polar etkileşimler yerine hidrofobik ve hidrojen bağına güveniyor.[20]
Faktör Xa'ya antistasin bağlanması
Antistasin, amino asit sekanslarında ~% 40 özdeşlik ve ~% 56 benzerlik gösteren bir N- ve bir C-terminal alanı içerir. homoloji. Her biri kısa bir β-yaprak yapısı ve 5 Disülfür bağları. Sadece N terminali alan, Xa'yı engellemek için gereklidir. C terminali etki alanı, 3 boyutlu yapıdaki farklılıklardan ötürü engelleyici özelliklere katkıda bulunmaz, ancak C-terminal etki alanı, fiili aktif siteye güçlü bir şekilde benzer bir modele sahiptir.[13]
Antistasinin FXa ile etkileşimi hem aktif bölgeyi hem de FXa'nın inaktif yüzeyini içerir. N-terminal alanında Arg-34 ve Val-35 tarafından oluşturulan antistasinin reaktif bölgesi, büyük olasılıkla S1 cebi olan FXa'nın bağlanma bölgesine uygundur. Aynı zamanda, antistasinin reaktif bölgesinin dışında bulunan Glu-15, FXa'nın yüzeyindeki pozitif yüklü kalıntılara uyar. Çoklu bağlanma termodinamik olarak avantajlıdır ve sub-nanomolar inhibisyona (Ki = 0,3–0,6 nM[8]).[13]
DX-9065a faktör Xa'ya bağlanma
İlk küçük moleküllü doğrudan Xa inhibitörü olan DX-9065a, 571.07 g / mol moleküler ağırlığa sahip bir amidinoaril türevidir.[21] Pozitif yüklü amidinonaftalen grubu ile bir tuz köprüsü oluşturur. Asp FXa'nın S1 cebinde -189 kalıntı. Pirolidin halkası, FXa'nın S4 cebinde Tyr-99, Phe-174 ve Trp-215 arasına sığar.[22]
Eski ilaçların aksine, ör. heparin, DX-9065a, FXa ve trombin yapıları bakımından benzer olmasına rağmen trombine kıyasla FXa için seçicidir. Bunun nedeni, homolog pozisyon 192'deki amino asit tortusundaki bir farktır. FXa, bu pozisyonda bir glutamin tortusuna sahipken, trombin, DX-9065a'nın karboksil grubu ile elektrostatik itmeye neden olan bir glutamik aside sahiptir. Ek olarak, trombinin Glu-97'si ile DX-9065a'nın pirolidin halkasında sabitlenmiş amidin grubu arasındaki bir tuz köprüsü, artık elektrostatik çarpışmayı önlemek için yeterince dönemeyen DX-9065a molekülünün esnekliğini azaltır. Bu yüzden IC50 değer trombin> 1000μM iken IC50 FXa için değer 0,16µM'dir.[22]

Rivaroxaban'ın faktör Xa'ya bağlanması
Rivaroxaban'ın FXa'ya bağlanmasına, amino asit Gly-219'a iki hidrojen bağı aracılık eder. Bu iki hidrojen bağı, ilacı FXa'nın S1 ve S4 alt sitelerine yönlendirmede önemli bir rol oynar. İlk hidrojen bağı, rivaroksabanın oksazolidinon çekirdeğinin karbonil oksijeninden gelen güçlü bir etkileşimdir. İkinci hidrojen bağı, daha zayıf bir etkileşimdir ve klorotiyofen karboksamid kısmının amino grubundan gelir.
Bu iki hidrojen bağı, ilacın bir L şekli oluşturmasına ve S1 ve S4 ceplerine sığmasına neden olur. Amino asit kalıntıları Phe-174, Tyr-99 ve Trp-215, S4 bağlama cebi olan dar bir hidrofobik kanal oluşturur. Rivaroksabanın morfolinon kısmı, Tyr-99 ve Phe-174 amino asitleri arasında "sıkıştırılır" ve rivaroksabanın aril halkası yönlendirilir dik olarak Trp-215 boyunca. Morfolinon karbonil grubu, FXa omurgasıyla doğrudan bir etkileşime sahip değildir, bunun yerine, morfolinon halkasının düzlemselleşmesine katkıda bulunur ve bu nedenle rivaroksabanın iki amino asit arasında sıkıştırılmasını destekler.
Tiofen kısmının klor ikame edicisi ile S1'in altında bulunan Tyr-228 aromatik halkası arasındaki etkileşim, yüksek afinite için güçlü baz gruplara olan ihtiyacı ortadan kaldırması nedeniyle çok önemlidir. FXa. Bu, bazik olmayan rivaroksabanın iyi bir oral biyoyararlanım ve potens elde etmesini sağlar.[8]
Apixaban faktör Xa'ya bağlanma
Apixaban, rivaroksaban ile benzer bir bağlanma modu gösterir ve FXa'ya bağlandığında sıkı bir inhibitör-enzim kompleksi oluşturur. Apiksabanın p-metoksi grubu, FXa'nın S1 cebine bağlanır, ancak FXa'nın bu bölgesindeki herhangi bir kalıntı ile herhangi bir etkileşime sahip görünmemektedir. pirazol N-2 azot atom apixaban, Gln-192 ve karbonil oksijen, Gly-216 ile etkileşime girer. Apiksabanın fenil laktam grubu, Tyr-99 ve Phe-174 arasında konumlandırılır ve oryantasyonu nedeniyle S4 cebinin Trp-215'i ile etkileşime girebilir. Laktam kısmının karbonil oksijen grubu, bir su molekülü ile etkileşime girer ve S4 cebindeki herhangi bir kalıntı ile etkileşime girmez.[23]

Yapı-aktivite-ilişkisi (SAR)
Belirli bir hedef için ideal bir inhibitör olan bir bileşiği tasarlamanın önemli bir kısmı, bileşiğin bağlanması için hedef bölgenin amino asit dizisini anlamaktır. Hem protrombin hem de FXa'nın modellenmesi, farkı çıkarmayı ve her bağlanma sahasındaki amino asitleri tanımlamayı mümkün kılar. FXa üzerindeki S1 cebinin dibinde bağlayıcı amino asit, amidin parçalarının bağlanabildiği Asp-189'dur. FXa'nın bağlanma bölgesinin röntgeni çekildikten sonra, S1 cebinin düzlemsel bir şekle sahip olduğu, yani düz bir amidinoaril grubunun sterik engel olmaksızın ona bağlanması gerektiği ortaya çıktı.[8]
Modern doğrudan Xa inhibitörleri, uçları S1 ve S4 ceplerine mükemmel şekilde uyan L-şekilli moleküllerdir. L şeklinin uzun kenarı, aktif hedef bölge içinde oldukça spesifik bir tünele uymalıdır. Bunu başarmak için moleküllerin bu kısmı, o bölgede FXa ile çok az resmi etkileşime sahip olacak şekilde tasarlanmıştır. Spesifik bir bağlanma olmadığından, bu ajanların FXa cepleri arasına oturması, ilaçların FXa molekülüne toplam spesifikliğini arttırır. FXa'nın S1 cebi ile inhibitör arasındaki etkileşim, hem iyonik hem de noniyonik olabilir; bu, parçanın tasarımının oral biyoyararlanımı arttıracak şekilde ayarlanmasına izin verdiği için önemlidir. Önceden tasarlanmış bileşikler, gastrointestinal sistemde iyi absorbe edilmeyen ve bu nedenle yüksek serum konsantrasyonlarına ulaşmayan yüklü moleküllerdi. Yeni ilaçlar, yüklü olmadıklarından ve S1 cebiyle iyonik olmayan bir etkileşime sahip olduklarından daha iyi bir biyoyararlanıma sahiptir.[20]
Rivaroxaban
Rivaroksabanın SAR gelişimi sırasında araştırmacılar, oksazolidonin çekirdeğine bir 5-klorotiyofen-2-karboksamid grubu eklemenin, daha önce tıbbi kullanım için çok zayıf olan gücü 200 kat artırabileceğini fark ettiler. Bu keşfin yanı sıra, (S) yapılandırması için açık bir tercih doğrulandı. Bu bileşiğin ümit verici bir farmakokinetik profili vardı ve oldukça bazik bir amidin grubu içermiyordu, ancak daha önce S1 cebi ile etkileşim için önemli olduğu düşünülüyordu. Bu bulgular kapsamlı SAR'a (yapı-etkinlik ilişkisi ) araştırır. SAR testi sırasında, R1 potens için en önemli grup olarak tanımlandı. Pirolidinon, potensi önemli ölçüde artıran ilk R1 fonksiyonel grubuydu, ancak daha ileri araştırmalar, bunun yerine bir morfolinon grubu ile daha da yüksek potens ortaya çıkardı. R2 ve R3 gruplarına hidrojen veya florin eklenmişti ve hidrojene sahip olmanın en yüksek potansiyele sahip olduğu hızla değerlendirildi. Daha sonra R2 ve R3 grupları, hidrojenden daha az etkili olan çeşitli gruplar için ikame edildi, bu nedenle nihai sonuç hidrojen oldu. Klorotiyofen kısmı yetersiz bir suda çözünürlüğe sahip olduğundan, onu başka bir grup ile ikame etmeye çalışıldı, ancak başarısız oldu. Klorotiyofen kısmı, S1 cebinin altındaki Tyr-228'e bağlanarak onu FXa'ya bağlanma ile ilgili önemli bir faktör haline getirir. Rivaroxaban hem yüksek afiniteye hem de iyi biyoyararlanıma sahiptir.[24]
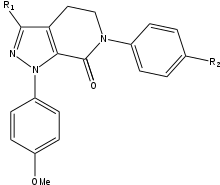
Apixaban
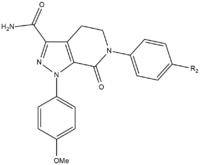
Apixabanın SAR gelişimi sırasında, maksimum potens ve biyoyararlanıma ulaşmak için test edilmesi gereken üç grup vardı. Test edilecek ilk grup, p-metoksifenil grubu (S1 bağlanma parçası) üzerinde SAR testinden önce stabilize edilmesi gerektiğinden aktif olmayan bölgeydi. Çoğunlukla bileşiğin gücünü artıran birkaç grup vardır. amidler, aminler ve tetrazoller ama aynı zamanda metilsülfonil ve triflorometil grupları. Bu gruplardan karboksamid en büyük bağlanmaya sahiptir ve bileşiklerle benzer pıhtılaşma aktivitesine sahiptir.[25]
Köpek testinde, 13F adı verilen bir karboksamid grubuna sahip bu bileşik, harika bir farmakokinetik profil, düşük bir klirens ve yeterli yarı ömür ve dağıtım hacmi. Stabilize edici bir grup bulmanın başarısı nedeniyle, S1 bağlanma parçası (p-metoksifenil) için SAR araştırması durduruldu. S4 bağlanma grubunda, N-metilasetil ve laktam analoglarının FXa için çok yüksek bir bağlanma afinitesine sahip olduğu kanıtlandı, diğer proteazlara karşı büyük pıhtılaşma ve seçicilik gösterdi. Yönelim, N-metil asetil kadar önemli olduğu ortaya çıktı. asetamit, S4 bölgesi bağlanma sahasına yakın elverişsiz düzlemsellik nedeniyle FXa'ya 300 kat daha düşük bağlanma kabiliyetine sahipti.[25]
Sentez
Rivaroxaban
Rivaroxaban kimyasal olarak şu gruba aittir: n-ariloksazolidinonlar. Bu grubun diğer ilaçları linezolid ve tedizolid ikisi de antibiyotikler. Bir n-ariloksazolidinonların bir sentezi ile başlayan O-silil korumalı etil (2,3-dihidroksipropil) -karbamat 2016 yılında yayınlandı. Tek kaplık bir reaksiyonda karbamat Hafif bazik koşullar altında bir 2-oksazolidon halkasına siklize olurken, aynı anda oksazolidon nitrojen arylize tarafından bakır -katalizasyon. Rivaroksaban için özellikle 3-morfolinon, iyot p konumunda benzen tarafından çal bakır -katalizasyon. Daha sonra silil koruma grubu kaldırılır ve ortaya çıkan alkol ile değiştirilir amino grubu hangisi o zaman asillenmiş son adımda.[26]
Rivaroksabanın endüstriyel bir preparatı, patent tarafından Bayer Healthcare 2005 yılında.[27] N- (4-aminofenol) -morfolinondan başlar. alkillenmiş tarafından propilen oksit aynı zamanda bir birincil amin içeren bir türev ftalimid koruma grubu. Sonra, a fosgen eşdeğerini oluşturmak için eklenir 2-oksazolidon halka ve ftalimid çıkarılır. Serbest amin artık asillenebilir ve bu da rivaroksabana yol açar.
Bununla birlikte, patente göre sentezin "reaksiyon yönetiminde, özellikle hazırlık için olumsuz etkilere sahip çeşitli dezavantajları" vardır. Patent ayrıca bir klorodan başlayan başka bir sentezi açıklıyor.tiyofen endüstriyel süreç için daha uygun olan ancak zehirli olduğuna işaret eden türev çözücüler veya reaktiflerin nihai üründen çıkarılması gerekir. Bu nedenle, bu yol bir alternatif değildir.[27]
Rivaroksabanın çeşitli başka sentez yolları tarif edilmiştir.[28][29]
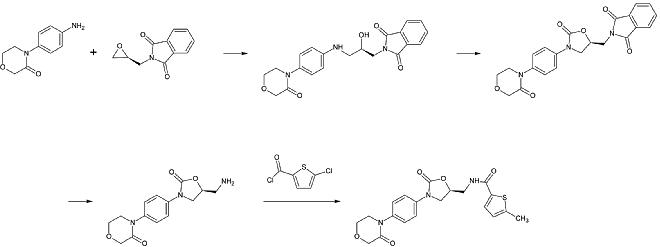
1. adım: Birincil aromatik aminin alkilasyonu
2. adım: Bir fosgen eşdeğeri kullanılarak 2-oksazolinidon halkasının oluşturulması
3. adım: Ftalimid koruma grubunun kaldırılması
4. adım: Birincil aminin asilasyonu
Apixaban
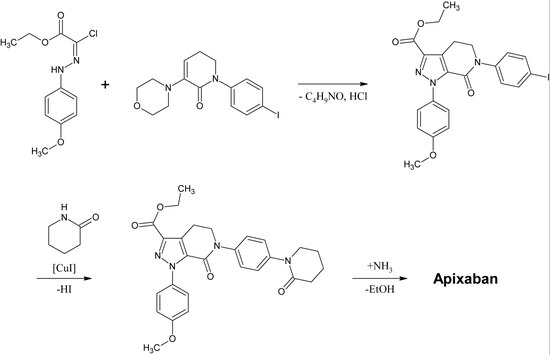
Apixabanın ilk tam sentezi 2007'de yayınlandı.[30] Bu reaksiyonun anahtar adımı (3 + 2)siklokasyon bir p-metoksifenilklorohidrazon türevi ve bir p-iyodofenil-morfolin-dihidropiridin türevi. Aşağıdakilerden sonra eliminasyon nın-nin HCl ve morfolin, iyot ile ikame edilir 2-piperidinon tarafından bakır -katalizasyon ve etil ester bir amide dönüştürülür (Aminoliz ). Bu reaksiyon 2009 yılında patent olarak tescil edildi.[31]
Klinik kullanım
Direkt faktör Xa inhibitörleri klinik olarak kullanılmakta ve kullanımları sürekli artmaktadır. Yavaş yavaş devralıyorlar warfarin kullanım ve düşük molekül ağırlıklı heparinler (LMWH ).[8] Xa inhibitörleri için endikasyon önlüyor derin ven trombozu (DVT) yol açabilir pulmoner emboli. Aynı zamanda tedavi etmek için de kullanılır atriyal fibrilasyon kan pıhtılaşmasının neden olduğu felç riskini azaltmak için. Diğer bir endikasyon, kanın pıhtılaşması için profilaktik bir tedavidir (tromboz ) Nedeniyle ateroskleroz. Rivaroxaban, piyasadaki ilk FXa inhibitörüdür ve ardından apixaban, edoksaban ve Betrixaban.
| Rivaroxaban | Apixaban | Edoksaban | Betrixaban | |
|---|---|---|---|---|
| Marka adı | Xarelto | Eliquis | Savaysa, Lixiana | Bevyxxa |
| Geliştirici ve yapımcı | Bayer | Pfizer | Daiichi Sankyo | Portola İlaç |
Farmakokinetik
| Rivaroxaban | Apixaban | Edoksaban | |
|---|---|---|---|
| Metabolizma | CYP3A4 / 5 (majör), CYP2J2 (minör) | CYP3A4 (majör), CYP1A2, 2C8, 2C19, 2J2 (tümü minör) | CYP34A (ana) |
| Protein bağlanması (%) | 92–95 | 87 | 55 |
| Yarı ömür (saat) | 5–9 | 6–12 | 5–11 |
| Eliminasyon | Böbrek (% 66; değişmemiş ilaç olarak% 36) | Böbrek (% 27), dışkı | Böbrek (% 35) |
| Soğurma (Tmax) | 2-4 saat | 3-4 saat | 1-2 saat |
| Dağıtım (L) | 50 | 21–61 | 107 |
| Böbrek temizliği (L / saat) | 2.4 | 7.5 | 11 |
Gelecek perspektifleri
Klinik çalışmalarda doğrudan Xa inhibitörleri
Rivaroxaban, apixaban, edoxaban ve betrixaban zaten piyasada. Ekim 2016 itibariyle, birkaç yeni doğrudan Xa inhibitörü klinik denemelere girmiştir. Bunlar Takeda'dan letaxaban ve Pfizer'den eribaxaban.[34]
Panzehirler
Gelen Andexxa Portola İlaç bir rekombinant protein verilen intravenöz olarak. Olarak çalışır panzehir tüm doğrudan ve dolaylı FXa inhibitörlerine. Andexxa bir tuzak reseptörü Xa inhibitörleri için.
Referanslar
- ^ a b "Avrupa İlaç Ajansı. 2016. Xarelto". www.ema.europa.eu. Alındı 2016-10-03.
- ^ "Avrupa İlaç Ajansı. 2016. Eliquis". www.ema.europa.eu. Alındı 2016-10-03.
- ^ Bhanwra, Sangeeta; Ahluwalia, Kaza (2014/01/01). "Yeni faktör Xa inhibitörü: Apixaban". Journal of Pharmacology and Pharmacotherapeutics. 5 (1): 12–4. doi:10.4103 / 0976-500x.124409. PMC 3917159. PMID 24554904.
- ^ Chan, Lewey; Pisano, Michele (2016-10-03). "Edoksaban (Savaysa): Bir Faktör Xa İnhibitörü". Eczacılık ve Terapötikler. 40 (10): 651–95. ISSN 1052-1372. PMC 4606855. PMID 26535021.
- ^ a b Wardrop, D .; Keeling, D. (2008). "Heparin ve warfarinin keşfinin hikayesi". İngiliz Hematoloji Dergisi. 141 (6): 757–63. doi:10.1111 / j.1365-2141.2008.07119.x. PMID 18355382.
- ^ Francis, CW. (2008). "Warfarin: Tarihsel Bir Perspektif". Hematoloji. 2008: 251. doi:10.1182 / asheducation-2008.1.251. PMID 19074091.
- ^ a b c Massimo, F .; Mannucci, P.M (2016). "Doğrudan oral antikoagülanlar ve venöz tromboembolizm". Avrupa Solunum İncelemesi. 25 (141): 295–302. doi:10.1183/16000617.0025-2016. PMID 27581829.
- ^ a b c d e f g h ben j k Perzborn, E .; Roehrig, S .; Straub, A .; Kubitza, D .; Misselwitz, F. (2011). "Bir oral, doğrudan faktör Xa inhibitörü olan rivaroksabanın keşfi ve geliştirilmesi". Doğa İncelemeleri İlaç Keşfi. 10 (1): 61–75. doi:10.1038 / nrd3185. PMID 21164526.
- ^ Bauer, K.A. (2013). "Yeni oral antikoaglanların artıları ve eksileri". Hematoloji. 2013: 464–70. doi:10.1182 / asheducation-2013.1.464. PMID 24319220.
- ^ a b Furie, B; Furie, B.C. (2008). "Trombüs oluşum mekanizmaları". New England Tıp Dergisi. 359 (9): 938–49. doi:10.1056 / nejmra0801082. PMID 18753650.
- ^ Davie, E.W .; Fujikawa, K; Kisiel, W (1991). "Pıhtılaşma kaskadı: başlatma, bakım ve düzenleme". Biyokimya. 30 (43): 10363–70. doi:10.1021 / bi00107a001. PMID 1931959.
- ^ Mackman, N; Tilley, R.E .; Anahtar, N.S. (2007). "Hemostaz ve Trombozda Kan Pıhtılaşmasının Ekstrinsik Yolunun Rolü". Arterioskleroz, Tromboz ve Vasküler Biyoloji. 27 (8): 1687–93. doi:10.1161 / atvbaha.107.141911. PMID 17556654.
- ^ a b c Lapatto, R .; Krengel, U .; Schreuder, H. A .; Arkema, A .; de Boer, B .; Kalk, K. H .; Hol, W. G .; Grootenhuis, P. D .; Mulders, J.W. (1997-09-01). "1,9 A çözünürlükte antistasinin X ışını yapısı ve kan pıhtılaşma faktörü Xa ile modellenmiş kompleks". EMBO Dergisi. 16 (17): 5151–61. doi:10.1093 / emboj / 16.17.5151. ISSN 0261-4189. PMC 1170148. PMID 9311976.
- ^ Schultz, Loren D .; Markus, Henry Z .; Hofmann, Kathryn J .; Montgomery, Donna L .; Dunwiddie, Christopher T .; Kniskern, Peter J .; Freedman, Robert B .; Ellis, Ronald W .; Tuite, Michael F. (1994-06-01). "Maya Saccharomyces cerevisiae Tarafından Rekombinant Protein Üretimini Geliştirmek İçin Moleküler Genetiğin Kullanılması". New York Bilimler Akademisi Yıllıkları. 721 (1): 148–57. doi:10.1111 / j.1749-6632.1994.tb47387.x. ISSN 1749-6632. PMID 8010665.
- ^ Nagahara, Takayasu; Yokoyama, Yukio; Inamura, Kazue; Katakura, Shin-ichi; Komoriya, Satoshi; Yamaguchi, Hitoshi; Hara, Tsuyoshi; Iwamoto, Masahiro (1994-04-01). "Yeni Kan Pıhtılaşma Faktörü Xa İnhibitörleri Olarak Dibazik (Amidinoaril) propanoik Asit Türevleri". Tıbbi Kimya Dergisi. 37 (8): 1200–07. doi:10.1021 / jm00034a018. ISSN 0022-2623. PMID 8164262. S2CID 19381209.
- ^ Sato, Kazuo; Kawasaki, Tomihisa; Taniuchi, Yuta; Hirayama, Fukushi; Koshio, Hiroyuki; Matsumoto, Yuzo (1997-11-27). "YM-60828, yeni bir faktör Xa inhibitörü: Kanama süresini uzatmasından antitrombotik etkilerinin ayrılması". Avrupa Farmakoloji Dergisi. 339 (2–3): 141–46. doi:10.1016 / S0014-2999 (97) 01389-7. PMID 9473127.
- ^ "PrXARELTO için Kararın Özet Temeli (SBD)". Kanada Sağlık. 2009-02-13. Arşivlenen orijinal 2016-10-09 tarihinde. Alındı 2016-10-03.
- ^ a b c d Nar Herbert (2012). "Doğrudan trombin ve faktör Xa inhibitörlerinin keşfinde yapısal bilginin rolü". Farmakolojik Bilimlerdeki Eğilimler. 33 (5): 279–88. doi:10.1016 / j.tips.2012.03.004. PMID 22503439.
- ^ Brandstetter, Bland (1996). "Aktif Bölgeyle Engellenen Pıhtılaşma Faktörü Xa'nın X-ray Yapısı". Biyolojik Kimya Dergisi. 271 (47): 29988–92. doi:10.1074 / jbc.271.47.29988. PMID 8939944.
- ^ a b c Steinberg Benjamin A. (2014). "Faktör Xa inhibitörlerinin yapı-fonksiyon ilişkileri: pratisyen hekim için çıkarımlar". Tromboz ve Tromboliz Dergisi. 37 (2): 234–41. doi:10.1007 / s11239-013-0991-z. PMID 23996500.
- ^ Becker, Richard C .; Alexander, John; Dyke, Christopher K .; Harrington, Robert A. (2004-12-01). "Kardiyovasküler hastalıkta yeni bir doğrudan faktör Xa antagonisti olan DX-9065a'nın geliştirilmesi". Tromboz ve Hemostaz. 92 (6): 1182–93. doi:10.1160 / TH04-05-0289. ISSN 0340-6245. PMID 15583722. S2CID 953689.
- ^ a b Katakura, S .; Hara, T .; Nagahara, T .; Kunitada, S .; Iwamoto, M. (1995-05-01). "Faktör Xa ile yeni bir faktör Xa inhibitörü olan DX-9065a arasındaki bir etkileşimin moleküler modeli: İnhibitörün asetimidoilpirrolidin yarımının serin proteazlar için potens ve seçiciliğe katkısı". Avrupa Tıbbi Kimya Dergisi. 30 (5): 387–94. doi:10.1016/0223-5234(96)88248-1.
- ^ Pinto, Orwat, Koch, Donald J.P. Michael J. Stephanie (2007). "1- (4-Metoksifenil) -7-okso-6- (4- (2-oksopiperidin-1-il) fenil) -4,5,6,7-tetrahidro-1H-pirazolo [3,4- keşfi c] piridin-3-karboksamid (Apixaban, BMS-562247), Kan Pıhtılaşma Faktörü Xa'nın Oldukça Güçlü, Seçici, Etkili ve Ağızdan Biyoyararlı İnhibitörü ". Tıbbi Kimya Dergisi. 50 (22): 5339–56. doi:10.1021 / jm070245n. PMID 17914785.CS1 bakım: birden çok isim: yazarlar listesi (bağlantı)
- ^ Roehrig Susanne (2005). "Yeni Antitrombotik Maddenin Keşfi 5-Kloro-N - ({(5 S) -2-okso-3- [4- (3-oksomorfolin-4-il) fenil] -1,3-oksazolidin-5-il ". Tıbbi Kimya Dergisi. 48 (19): 5900–5908. doi:10.1021 / jm050101d. PMID 16161994.
- ^ a b Pinto, D. J .; Orwat, M. J .; Koch, S .; Rossi, K. A .; Alexander, R. S .; Smallwood, A .; Lam, P. Y. (2007). "1- (4-metoksifenil) -7-okso-6- (4- (2-oksopiperidin-1-il) fenil) -4,5,6,7-tetrahidro-1H-pirazolo [3,4- keşfi c] piridin-3-karboksamid (apiksaban, BMS-562247), kan pıhtılaşma faktörü Xa'nın oldukça güçlü, seçici, etkili ve oral yoldan biyolojik olarak elde edilebilir bir inhibitörü ". J Med Chem. 50 (22): 5339–56. doi:10.1021 / jm070245n. PMID 17914785.
- ^ Mahy, William; Leitch, Jamie A .; Frost, Christopher G. (2016-03-01). "N-Ariloksazolidinonların Bakır Katalize Edilmiş Montajı: Linezolid, Tedizolid ve Rivaroksaban Sentezi". Avrupa Organik Kimya Dergisi. 2016 (7): 1305–13. doi:10.1002 / ejoc.201600033. ISSN 1099-0690.
- ^ a b c ABD patenti US7351823 Mathias Berwe, Christian Thomas, Joachim Rehse, Dirk Grotjohann, "Hazırlık süreci", 2008-04-D01'de yayınlandı, 2005-01-10'da yayınlandı
- ^ Li, Chao; Liu, Yingshuai; Zhang, Yongjun; Zhang, Xingxian (2011-07-01). "Antikoagülan ajan rivaroksabana, MgI2 eterat tarafından teşvik edilen bir izosiyanat-oksiran siklo ilave yoluyla bir yaklaşım". Kimyasal Araştırma Dergisi. 35 (7): 400–01. doi:10.3184 / 174751911X13098778358582.
- ^ Yuan, Jianyong; Liu, Kai; Li, Lun; Yuan, Yong; Liu, Xuelei; Li, Yanwu (2014-09-18). "Oksazolidinon Antitrombotik Ajan Rivaroxaban'ın Yeni Bir Sentezi". Moleküller. 19 (9): 14999–15004. doi:10.3390 / molecules190914999. PMC 6271174. PMID 25237754.
- ^ a b Pinto, Donald J. P .; Orwat, Michael J .; Koch, Stephanie; Rossi, Karen A .; Alexander, Richard S .; Smallwood, Angela; Wong, Pancras C .; Rendina, Alan R .; Luettgen, Joseph M. (2007-11-01). "1- (4-Metoksifenil) -7-okso-6- (4- (2-oksopiperidin-1-il) fenil) -4,5,6,7-tetrahidro-1H-pirazolo [3,4- keşfi c] piridin-3-karboksamid (Apixaban, BMS-562247), Kan Pıhtılaşma Faktörü Xa'nın Oldukça Güçlü, Seçici, Etkili ve Ağızdan Biyoyararlı İnhibitörü ". Tıbbi Kimya Dergisi. 50 (22): 5339–56. doi:10.1021 / jm070245n. ISSN 0022-2623. PMID 17914785.
- ^ ABD patenti US 20100130543 A1, Thomas G. Gant, Manoucherhr M. Shahbaz, "Pyrazole carboxamide inhibitors of factor xa", yayınlanmış 2010-05-27, yayın tarihi 2009-09-14
- ^ Frost, C .; Şarkı, Y .; Barret, Y.C .; Wang, J .; Pursley, J. (2014). "ELIQUIS ve rivaroksabanın farmakokinetiği ve farmakodinamiğinin rastgele bir doğrudan karşılaştırması". Klinik Farmakoloji. 6: 179–87. doi:10.2147 / CPAA.S61131. PMC 4235474. PMID 25419161.
- ^ Parasrampuriam, D.A .; Truitt, K. (2016). "Pıhtılaşma Faktörü Xa'yı Engelleyen K Vitamini Olmayan Bir Oral Antikoagülan olan Edoksabanın Farmakokinetiği ve Farmakodinamiği". Klinik Farmakokinetik. 55 (6): 641–55. doi:10.1007 / s40262-015-0342-7. PMC 4875962. PMID 26620048.
- ^ Ahrens, I; Karlheinz, P .; Lip, GYH .; Bode, C. (Haziran 2012). "Yeni Oral Antikoagülanların Geliştirilmesi ve Klinik Uygulamaları. Bölüm II. Klinik Araştırma Altındaki İlaçlar". Keşif Meidisin. 13 (73): 445–50. PMID 22742650.
