İyon taşıyıcı - Ion transporter
Biyolojide bir taşıyıcı bir transmembran protein iyonları (veya diğer küçük molekülleri) bir biyolojik zar Hücresel iletişim, homeostazın sürdürülmesi, enerji üretimi vb. dahil olmak üzere birçok farklı biyolojik işlevi yerine getirmek.[1] Pompalar, uniporters, antiporters ve symporters dahil olmak üzere farklı taşıyıcı türleri vardır. Aktif taşıyıcılar veya iyon pompaları enerjiyi çeşitli kaynaklardan dönüştüren taşıyıcılardır. adenozin trifosfat (ATP), güneş ışığı ve diğerleri redoks reaksiyonlar - konsantrasyon gradyanına kadar bir iyon pompalayarak potansiyel enerjiye.[2][3] Bu potansiyel enerji daha sonra iyon taşıyıcılar ve iyon kanalları dahil olmak üzere ikincil taşıyıcılar tarafından hayati hücresel süreçleri yürütmek için kullanılabilir. ATP sentezi.[4]
Bu sayfa esas olarak pompa görevi gören iyon taşıyıcılara odaklanmıştır, ancak taşıyıcılar da molekülleri içinden Kolaylaştırılmış difüzyon. Kolaylaştırılmış difüzyon ATP gerektirmez ve zar boyunca hızla yayılamayan moleküllere izin verir (pasif difüzyon ), konsantrasyon gradyanlarını bu protein taşıyıcıları aracılığıyla yaymak için.[5]
İyon taşıyıcıları, uygun hücre işlevi için gereklidir ve bu nedenle, hücre tarafından büyük ölçüde düzenlenir ve araştırmacılar tarafından çeşitli yöntemler kullanılarak incelenir. Bazı hücre düzenlemeleri ve araştırma yöntemleri örnekleri verilecektir.

Sınıflandırma ve belirsizliği giderme
İyon taşıyıcılar bir süper aile nın-nin taşıyıcılar 12 taşıyıcı ailesi içeren.[6] Bu aileler, cihaz tarafından kullanılan Taşıma Sınıflandırması (TC) sisteminin bir parçasıdır. Uluslararası Biyokimya ve Moleküler Biyoloji Birliği (IUBMB) ve taşınan substratlar, taşıma mekanizması, kullanılan enerji kaynağı gibi özelliklere göre ve ayrıca her proteini oluşturan DNA dizilerini karşılaştırarak gruplandırılır. En önemli birleştirici faktör, nötr bir tür değil, bir iyonun taşınmasını gösteren substratın yüklü doğasıdır.[6]İyon taşıyıcılar, iyon kanalları. Kanallar, zardan geçen gözeneklerdir, oysa nakiller, zarın hangi tarafına açık olduğunu değiştirmek için şekil değiştirmesi gereken proteinlerdir, çünkü bu taşıyıcılar, hareket eden moleküllerde kanallardan çok daha yavaştır.
Bir elektrokimyasal gradyan veya konsantrasyon gradyanı, iki ayrı alandaki kimyasal bir molekül veya iyon konsantrasyonundaki bir farktır.[7] Dengede, her iki alandaki iyon konsantrasyonları eşit olacaktır, bu nedenle konsantrasyonda bir fark varsa, iyonlar konsantrasyon gradyanını "aşağıya" veya yüksek konsantrasyondan düşük konsantrasyona doğru akmaya çalışacaktır. İyon kanalları Kanala sığacak spesifik iyonların, hücre zarının her iki tarafındaki konsantrasyonları eşitleyerek, konsantrasyon gradyanlarını aşağı akmasına izin verir. İyon kanalları ve iyon taşıyıcılar bunu Kolaylaştırılmış difüzyon hangisi bir tür pasif ulaşım. Bununla birlikte, yalnızca iyon taşıyıcıları, iyonları konsantrasyon gradyanına karşı hareket ettirmeyi içeren aktif taşıma gerçekleştirebilir.[8] ATP gibi enerji kaynaklarını kullanarak iyon taşıyıcıları, iyonları konsantrasyon gradyanlarına karşı hareket ettirebilir ve bu daha sonra ikincil taşıyıcılar veya diğer proteinler tarafından bir enerji kaynağı olarak kullanılabilir.[7]
Enerji kaynağı
Birincil taşıyıcı

Birincil taşıyıcılar, Na gibi iyonları taşımak için enerji kullanır +, K+ve Ca2+ bir hücre zarı boyunca ve konsantrasyon gradyanları oluşturabilir.[7] Bu taşıma ATP'yi enerji kaynağı olarak kullanabilir veya bitkilerdeki elektron taşıma zinciri gibi yöntemlerle ATP üretmek için kullanılabilir.[8][7]
Aktif taşıyıcı
ATP kullanan taşıyıcılar, ATP'deki enerjiyi bir konsantrasyon gradyanı şeklinde potansiyel enerjiye dönüştürür. ATP'yi bir iyonu düşük konsantrasyondan daha yüksek konsantrasyona taşımak için kullanırlar. ATP kullanan proteinlere örnekler: P tipi ATPazlar bu transfer Na +, K+ve Ca2+ fosforilasyon yoluyla iyonlar, anyonları aktaran A-tipi ATPazlar ve ABC taşıyıcıları (ATP bağlayıcı kaset taşıyıcıları) geniş bir molekül grubunu taşır.[7] P-tipi ATPase örnekleri şunları içerir: Na+/ K+-ATPase [8][9][10] Janus Kinase-2 tarafından düzenlenir[11] Hem de CA2+ ATPase ADP ve ATP konsantrasyonlarına duyarlılık gösteren[4] P-glikoprotein insan vücudundaki bir ABC nakil bağlayıcı protein örneğidir.
ATP üreten taşıyıcı
ATP üreten taşıyıcılar, ATP kullanan taşıyıcıların tersi yönde çalışır. Bu proteinler iyonları gradyan ile yüksek konsantrasyondan düşük konsantrasyona taşır, ancak bu süreçte ATP oluşur. ATP oluşturmak için konsantrasyon gradyanı biçimindeki potansiyel enerji kullanılır.[7] Hayvanlarda, bu ATP sentezi mitokondride gerçekleşir. F tipi ATPase aksi takdirde olarak bilinir ATP sentaz. Bu süreç, elektron taşıma zinciri denilen bir süreçte oksidatif fosforilasyon.[12][2] V tipi ATPase F-tipi ATPase olarak zıt işlevi görür ve bitkilerde bir proton gradyanı oluşturmak için ATP'yi hidrolize etmek için kullanılır. Bunun örnekleri, kullanan lizozomlardır. V tipi ATPase kloroplastlarda fotosentez işlemi sırasında vezikülleri veya bitki boşluklarını asitleştirin.[8] Bu süreç, pH gibi çeşitli yöntemlerle düzenlenebilir.[13]
İkincil taşıyıcı

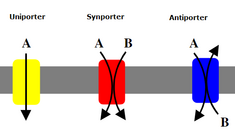
İkincil taşıyıcılar aynı zamanda konsantrasyon gradyanına karşı iyonları (veya küçük molekülleri) taşır - düşük konsantrasyondan yüksek konsantrasyona - ancak konsantrasyon gradyanı oluşturmak için ATP kullanan birincil taşıyıcıların aksine, ikincil taşıyıcılar birincil taşıyıcılar tarafından oluşturulan konsantrasyon gradyanından gelen potansiyel enerjiyi kullanır. iyonları taşımak için.[7] Örneğin, sodyuma bağımlı glikoz taşıyıcı İnce bağırsakta ve böbrekte bulunan, glikozun hücreye taşınmasına yardımcı olmak için sodyum potasyum pompası (yukarıda belirtildiği gibi) tarafından hücrede oluşturulan sodyum gradyanını kullanır.[14] Bu, sodyum konsantrasyon gradyanından aşağı akarken, glikozu konsantrasyon gradyanını hücreye geri itmek için yeterli enerji sağlar. Bu, ince bağırsakta ve böbrekte glikoz kaybetmelerini önlemek için önemlidir. Symporters sodyum-glikoz simporter gibi konsantrasyon gradyanı ile bir iyon taşır ve ikinci bir molekülün taşınmasını aynı yönde birleştirirler. Antiporters ayrıca bir molekülün konsantrasyon gradyanını konsantrasyon gradyanını yukarı hareket ettirmek için kullanır, ancak bağlı molekül ters yönde taşınır.[7]
Yönetmelik
İyon taşıyıcılar, fosforilasyon, allosterik inhibisyon veya aktivasyon ve iyon konsantrasyonuna duyarlılık gibi çeşitli farklı yollarla düzenlenebilir. Protein kullanmak kinazlar bir fosfat grubu eklemek için veya fosfatazlar -e defosforilat protein, taşıyıcının aktivitesini değiştirebilir.[15] Fosfat grubunun eklenmesiyle proteinin aktive olup olmadığı veya inhibe edilip edilmediği, spesifik proteine bağlıdır. Allosterik inhibisyon ile, düzenleyici ligand, düzenleyici bölgeye bağlanabilir ve taşıyıcıyı inhibe edebilir veya etkinleştirebilir. İyon taşıyıcıları, çözeltideki bir iyonun (aktardığı iyon olması gerekmez) konsantrasyonu ile de düzenlenebilir. Örneğin, elektron taşıma zinciri, H'nin varlığı ile düzenlenir.+ çözelti içinde iyonlar (pH).[7]
İyon Taşıyıcıları incelemek için teknikler [değiştir]
Yama kelepçe [Düzenle]
Yama kelepçesi, hücrelerdeki kanalları ve taşıyıcıları, içinden geçen akımı takip ederek incelemek için kullanılan bir elektrofizyoloji tekniğidir. Bu teknik, kanalların ve taşıyıcıların varlığı bilinmeden önce Hodgkin ve Huxley tarafından icat edildi.[12] Yama bağlama mirasının çığır açan çalışmalarının yanı sıra, halen araştırmacılar tarafından iyon taşıyıcılarını ve ortamların ve ligandların taşıyıcının işlevini nasıl etkilediğini incelemek için yaygın olarak kullanılmaktadır.[1][16]
X-ışını kristalografisi [Düzenle]
X-ışını kristalografisi, proteinlerin yapısının görselleştirilmesine izin veren inanılmaz bir araçtır, ancak yalnızca bir protein yapısının anlık görüntüsüdür. Taşıma proteinlerinin yapısı, araştırmacıların, molekülleri zar boyunca hareket ettirmek için taşıyıcının nasıl ve ne yaptığını daha iyi anlamalarını sağlar.[17][18]
SIKI BAĞLAMAK [Düzenle]
Foto ağartmadan sonra floresans (FRAP), bir zardaki lipidlerin veya proteinlerin difüzyonunu izlemek için kullanılan bir tekniktir. Bu teknik, hücredeki taşıyıcıların hareketliliğini ve hücre zarındaki lipit alanları ve lipit salları ile etkileşimlerini daha iyi anlamak için kullanılır.
FRET [Düzenle]
Förster rezonans enerji transferi (FRET), iki proteinin birbirine ne kadar yakın olduğunu izlemek için floresans kullanan bir tekniktir. Bu, diğer hücresel proteinlerle nasıl etkileşime girdiklerini görmek için taşıyıcıların incelenmesinde kullanılmıştır.[1]
İyon taşıyıcılar tablosu
Ayrıca bakınız
- Aktif taşımacılık
- İyon taşıma numarası
- İyon taşıyıcı üst ailesi
- Membran taşıma proteini
- Taşıma proteini
- Wikipedia: MeSH D12.776 § MeSH D12.776.157.530.450 - iyon pompaları
Referanslar
- ^ a b c Maffeo, Christopher; Bhattacharya, Swati; Yoo, Jejoong; Wells, David; Aksimentiev, Aleksei (2012-12-12). "İyon Kanallarının Modellenmesi ve Simülasyonu". Kimyasal İncelemeler. 112 (12): 6250–6284. doi:10.1021 / cr3002609. ISSN 0009-2665. PMC 3633640. PMID 23035940.
- ^ a b Alloway, Kevin D. (Aralık 2001). "Sinirbilim. Dale Purves, George J. Augustine, David Fitzpatrick, Lawrence C. Katz, Anthony-Samuel LaMantia, James O. McNamara, S. Mark Williams". Biyolojinin Üç Aylık İncelemesi. 76 (4): 526. doi:10.1086/420640. ISSN 0033-5770.
- ^ Purves, Dale; Augustine, George J .; Fitzpatrick, David; Katz, Lawrence C .; LaMantia, Anthony-Samuel; McNamara, James O .; Williams, S. Mark (2001). "Kanallar ve Taşıyıcılar". Sinirbilim. 2. Baskı.
- ^ a b Haumann, Johan (2010). "Mitokondriyal İçermeyen [Ca2 +] ATP / ADP Antiport ve ADP Fosforilasyon sırasında Artışlar: Mekanizmaların Keşfi". Biyofiziksel. 99 (4): 997–1006. Bibcode:2010BpJ .... 99..997H. doi:10.1016 / j.bpj.2010.04.069. PMC 2920628. PMID 20712982.
- ^ Gadsby, David C. (2009-04-02). "İyon kanalları ile iyon pompaları: prensipte temel fark". Doğa İncelemeleri Moleküler Hücre Biyolojisi. 10 (5): 344–352. doi:10.1038 / nrm2668. ISSN 1471-0072. PMC 2742554. PMID 19339978.
- ^ a b Prakash, Shraddha (2003). "İyon taşıyıcı süper ailesi". Biochimica et Biophysica Açta (BBA) - Biyomembranlar. 1618 (1): 79–92. doi:10.1016 / j.bbamem.2003.10.010. PMID 14643936 - Elsevier Science Direct aracılığıyla.
- ^ a b c d e f g h ben G., Voet, Judith; W., Pratt, Charlotte (2016/02/29). Biyokimyanın temelleri: moleküler düzeyde yaşam. ISBN 9781118918401. OCLC 910538334.
- ^ a b c d T., Scheer, Bradley (2014-01-01). "İyon taşıma". AccessScience. doi:10.1036/1097-8542.352000.
- ^ Morth, J. Preben; Pedersen, Bjørn P .; Buch-Pedersen, Morten J .; Andersen, Jens Peter; Vilsen, Bente; Palmgren, Michael G .; Nissen, Poul (Ocak 2011). "Na +, K + -ATPase ve H + -ATPase iyon pompalarının plazma membranına yapısal bir genel bakış". Doğa İncelemeleri Moleküler Hücre Biyolojisi. 12 (1): 60–70. doi:10.1038 / nrm3031. ISSN 1471-0072. PMID 21179061. S2CID 9734181.
- ^ Takeuchi, Ayako; Reyes, Nicolás; Artigas, Pablo; Gadsby, David C. (2009-11-15). "Na, K-ATPase pompası boyunca haritalanmış iyon yolunu görselleştirme". Kanallar. 3 (6): 383–386. doi:10.4161 / kanal.3.6.9775. ISSN 1933-6950. PMC 2889157. PMID 19806033.
- ^ Hosseinzadeh, Zohreh (2014). "Epitel Na + Kanalı ENaC'nin Janus kinaz 2 ile Aşağı Düzenlenmesi". Membran Biyolojisi Dergisi. 247 (4): 331–338. doi:10.1007 / s00232-014-9636-1. PMID 24562791. S2CID 16015149.
- ^ a b Prebble, John N. (Eylül 2010). "Oksidatif fosforilasyonun keşfi: glikoliz çalışmasından kavramsal bir çıkış". Bilim Tarihi ve Felsefesinde Çalışmalar Bölüm C: Biyolojik ve Biyomedikal Bilimler Tarih ve Felsefesinde Çalışmalar. 41 (3): 253–262. doi:10.1016 / j.shpsc.2010.07.014. PMID 20934646.
- ^ Tikhonov, Alexander N. (2013-05-22). "Kloroplastlarda elektron taşınmasının ve ATP sentezinin pH'a bağlı düzenlenmesi". Fotosentez Araştırması. 116 (2–3): 511–534. doi:10.1007 / s11120-013-9845-y. ISSN 0166-8595. PMID 23695653. S2CID 12903551.
- ^ Crane, Robert; Miller, D .; Bihler, I. (1961). "Şekerlerin bağırsaktan taşınmasının olası mekanizmaları üzerindeki kısıtlamalar". Membran Taşınması ve Metabolizma: 439–449.
- ^ Marshall, William S .; Watters, Kaitlyn D .; Hovdestad, Leah R .; Cozzi, Regina R. F .; Katoh, Fumi (2009/08/01). "Osmosensitif iyon taşıyan euryhaline killifish'in mitokondri bakımından zengin hücrelerinde tirozin 407'de fokal adhezyon kinazın fosforilasyonuyla CFTR Cl- kanal fonksiyonel düzenlemesi". Deneysel Biyoloji Dergisi. 212 (Pt 15): 2365–2377. doi:10.1242 / jeb.030015. ISSN 0022-0949. PMC 2712415. PMID 19617429.
- ^ Swant, Jarod; Goodwin, J. Shawn; Kuzey, Ashley; Ali, Ahmed Abdul; Gamble-George, Joyonna; Chirwa, Sanika; Khoshbouei, Habibeh (2011-12-23). "α-Sinüklein, Dopamin Taşıyıcıya Bağlı Klorür Akımını Uyarır ve Taşıyıcının Aktivitesini Modüle Eder". Biyolojik Kimya Dergisi. 286 (51): 43933–43943. doi:10.1074 / jbc.M111.241232. ISSN 0021-9258. PMC 3243541. PMID 21990355.
- ^ Morth, J. Preben; Pedersen, Bjørn P .; Toustrup-Jensen, Mads S .; Sørensen, Thomas L.-M .; Petersen, Janne; Andersen, Jens Peter; Vilsen, Bente; Nissen, Poul (Aralık 2007). "Sodyum-potasyum pompasının kristal yapısı". Doğa. 450 (7172): 1043–1049. Bibcode:2007Natur.450.1043M. doi:10.1038 / nature06419. ISSN 0028-0836. PMID 18075585. S2CID 4344526.
- ^ Shinoda, Takehiro; Ogawa, Haruo; Cornelius, Flemming; Toyoshima, Chikashi (Mayıs 2009). "2,4 Å çözünürlükte sodyum-potasyum pompasının kristal yapısı". Doğa. 459 (7245): 446–450. Bibcode:2009Natur.459..446S. doi:10.1038 / nature07939. ISSN 0028-0836. PMID 19458722. S2CID 205216514.
Dış bağlantılar
- İyon + pompalar ABD Ulusal Tıp Kütüphanesinde Tıbbi Konu Başlıkları (MeSH)
- Transporter substrat veritabanı (TSdb)
