Dopamin taşıyıcı - Dopamine transporter
dopamin taşıyıcı (Ayrıca dopamin aktif taşıyıcı, DAT, SLC6A3), zarları kapsayan bir proteindir. nörotransmiter dopamin dışında sinaptik yarık geri dönmek sitozol. Sitozolde, diğer taşıyıcılar dopamini ayırır. veziküller depolama ve daha sonra sürüm için. DAT yoluyla dopamin geri alımı, dopaminin vücuttan atıldığı birincil mekanizmayı sağlar. sinapslar prefrontal kortekste bir istisna olabilir, ancak kanıtların muhtemelen daha büyük bir rolüne işaret ettiği norepinefrin taşıyıcı.[5]
DAT, aşağıdakiler de dahil olmak üzere bir dizi dopaminle ilişkili bozuklukta rol oynamaktadır: Dikkat eksikliği hiperaktivite bozukluğu, bipolar bozukluk, klinik depresyon, alkolizm, ve madde kullanım bozukluğu. gen DAT proteinini kodlayan insan kromozomu 5 üzerinde bulunur, 15 kodlamadan oluşur Eksonlar ve kabaca 64 kbp uzun. DAT ve dopaminle ilişkili bozukluklar arasındaki ilişkilere dair kanıt, bir tür genetik polimorfizm, olarak bilinir VNTR, DAT geninde (DAT1 ), ifade edilen protein miktarını etkiler.[6]
Fonksiyon
DAT bir integral membran proteini dopamini sinaptik yarık ve onu çevreleyen hücrelere biriktirir, böylece nörotransmiterin sinyalini sonlandırır. Dopamin Ödül dahil olmak üzere bilişin çeşitli yönlerinin temelini oluşturur ve DAT bu sinyalin düzenlenmesini kolaylaştırır.[7]
Mekanizma
DAT bir simporter Yüksek konsantrasyondan düşük konsantrasyona hücre içine hareket eden sodyum iyonlarının enerjik olarak elverişli hareketine hareketi birleştirerek dopamini hücre zarı boyunca hareket ettirir. DAT işlevi, sıralı bağlamayı gerektirir ve birlikte taşıma iki Na+ iyonlar ve bir Cl− dopamin substrat ile iyon. DAT aracılı dopamin geri alımının itici gücü, plazma membranı tarafından üretilen iyon konsantrasyonu gradyanıdır. Na+/ K+ ATPase.[8]
En yaygın kabul gören modelde monoamin taşıyıcı Dopaminin bağlanabilmesi için sodyum iyonlarının taşıyıcının hücre dışı alanına bağlanması gerekir. Dopamin bağlandığında, protein, hem sodyum hem de dopaminin membranın hücre içi tarafında çözülmesine izin veren konformasyonel bir değişikliğe uğrar.[9]
Kullanan çalışmalar elektrofizyoloji ve radyoaktif etiketli dopamin, dopamin taşıyıcısının diğer monoamin taşıyıcılarına benzer olduğunu doğrulamıştır, çünkü bir nörotransmiter molekülü zar boyunca bir veya iki sodyum iyonu ile taşınabilir. Pozitif yük oluşumunu önlemek için klorür iyonlarına da ihtiyaç vardır. Bu çalışmalar ayrıca taşıma hızının ve yönünün tamamen sodyum gradyanına bağlı olduğunu göstermiştir.[10]
Sıkı bağlantı nedeniyle membran potansiyeli ve sodyum gradyanı, membran polaritesindeki aktivitenin neden olduğu değişiklikler, taşıma hızlarını önemli ölçüde etkileyebilir. Ek olarak, taşıyıcı, nöron depolarize olduğunda dopamin salınımına katkıda bulunabilir.[10]
DAT – Cav bağlantı
Ön kanıt, dopamin taşıyıcısının L tipi ile eşleştiğini göstermektedir. voltaj kapılı kalsiyum kanalları (özellikle CAv1.2 ve CAv1.3 ), hemen hemen tüm dopamin nöronlarında ifade edilir.[11] DAT – Ca sonucundav birleştirme, üreten DAT substratları depolarize edici Taşıyıcıdan geçen akımlar, taşıyıcıya bağlanan kalsiyum kanallarını açabilir ve bu da dopamin nöronlarında bir kalsiyum akışı ile sonuçlanır.[11] Bu kalsiyum akışının, CAMKII aracılı fosforilasyon aşağı yönde bir etki olarak dopamin taşıyıcısının;[11] CAMKII ile DAT fosforilasyonu dopamin dışa akımıyla sonuçlandığından in vivo taşıyıcıya bağlı kalsiyum kanallarının aktivasyonu, bazı ilaçların (örneğin amfetamin) nörotransmiter salımını tetiklediği potansiyel bir mekanizmadır.[11]
Protein yapısı
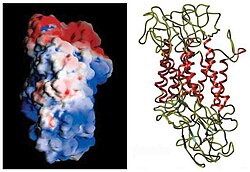
DAT'ın membran topolojisinin ilk tespiti, hidrofobik dizi analizi ve GABA taşıyıcısı ile dizi benzerlikleri. Bu yöntemler on iki öngördü transmembran alanları (TMD) üçüncü ve dördüncü TMD'ler arasında büyük bir hücre dışı döngü ile.[12] Kullanılan bu proteinin daha fazla karakterizasyonu proteazlar proteinleri daha küçük parçalara sindiren ve yalnızca hücre dışı döngüler üzerinde meydana gelen glikosilasyon ve membran topolojisinin ilk tahminlerini büyük ölçüde doğrulayan.[13] Tam yapısı Drosophila melanogaster dopamin taşıyıcı (dDAT), 2013 yılında X-ışını kristalografisi.[14]
Yer ve dağıtım
Bir dopamin nöronundaki amfetaminin farmakodinamiği |
DAT'ın bölgesel dağılımı, aşağıdakileri içeren yerleşik dopaminerjik devre ile beyin bölgelerinde bulunmuştur: nigrostriatal, mezolimbik, ve mezokortikal yollar.[22] çekirdek bu yolları oluşturan, farklı ifade kalıplarına sahiptir. Yetişkin farelerdeki gen ifade desenleri, Substantia nigra pars compacta.[23]
DAT mezokortikal yol radyoaktif antikorlarla etiketlenmiş, dendritlerde ve nöronların hücre gövdelerinde zengin olduğu bulunmuştur. Substantia nigra pars compacta ve ventral tegmental alan. Bu model, sinapstaki dopamin seviyelerini düzenleyen bir protein için mantıklıdır.
Boyama striatum ve çekirdek ödül mezolimbik yolun% 100'ü yoğun ve heterojendi. Striatumda DAT, akson terminallerinin plazma membranında lokalizedir. Çift immünositokimya DAT colocalization diğer iki belirteci ile gösterdi nigrostriatal terminaller, tirozin hidroksilaz ve D2 dopamin reseptörleri. İkincisi böylece bir otomatik alıcı dopamin salgılayan hücreler üzerinde. TAAR1 aynı zamanda bir presinaptik hücre içi reseptördür ortak yerelleştirilmiş DAT ile ve etkinleştirildiğinde D2 otoreseptörünün zıt etkisine sahip olan;[15][24] yani, dopamin taşıyıcılarını içselleştirir ve tersine çevrilmiş taşıyıcı işlevi aracılığıyla dışarı akışı tetikler. PKA ve PKC sinyalleşme.
Şaşırtıcı bir şekilde, DAT herhangi bir sinaptik aktif bölge içinde tanımlanmadı. Bu sonuçlar, striatal dopamin geri alımının, dopamin sinaptik yarıktan yayıldıktan sonra sinaptik uzmanlıkların dışında gerçekleşebileceğini göstermektedir.
İçinde Substantia nigra DAT, aksonal ve dendritik (yani sinaptik öncesi ve sonrası) lokalizedir plazma membranları.[25]
İçinde Perikarya nın-nin pars compacta nöronlar, DAT öncelikle pürüzlü ve pürüzsüz endoplazmik retikuluma lokalize edildi, Golgi kompleksi olası sentez, modifikasyon, taşıma ve bozunma bölgelerini tanımlayan çok biçimli cisimler.[26]
Genetik ve düzenleme
gen DAT için DAT1, kromozom 5p15 üzerinde bulunur.[6] Genin protein kodlama bölgesi 64 kb'nin üzerindedir ve 15 kodlama bölümü içerir veya Eksonlar.[27] Bu gen bir değişken numaralı ardışık tekrar (VNTR) 3’ün sonunda (rs28363170 ) ve başka intron 8 bölge.[28] VNTR'deki farklılıkların, taşıyıcının ekspresyonunun bazal seviyesini etkilediği gösterilmiştir; sonuç olarak, araştırmacılar dopamin ile ilgili bozukluklarla ilişkiler aradılar.[29]
Nurr1, bir nükleer reseptör dopamin ile ilgili birçok geni düzenleyen, organizatör bu genin bölgesi ve ekspresyonu indüklemek.[30] Bu destekleyici, aynı zamanda transkripsiyon faktörü Sp-1.
Transkripsiyon faktörleri hangi hücrelerin DAT'yi ifade ettiğini kontrol ederken, bu proteinin fonksiyonel düzenlenmesi büyük ölçüde kinazlar. HARİTA,[31] CAMKII,[20][21] PKA,[15] ve PKC[21][32] Taşıyıcının dopamini hareket ettirme hızını değiştirebilir veya DAT'ın içselleştirilmesine neden olabilir. Ortak yerelleştirilmiş TAAR1 aktive edildiğinde DAT'ı fosforile eden dopamin taşıyıcısının önemli bir düzenleyicisidir. protein kinaz A (PKA) ve protein kinaz C (PKC) sinyali.[15][33] Fosforilasyon herhangi bir protein kinaz tarafından DAT ile sonuçlanabilir içselleştirme (rekabetçi olmayan geri alım inhibisyonu), ancak PKC aracılı tek başına fosforilasyon, ters taşıyıcı işlevi (dopamin akma ).[15][34] Dopamin oto alıcıları ayrıca TAAR1 aktivasyonunun etkisine doğrudan karşı çıkarak DAT'ı düzenler.[15]
İnsan dopamin taşıyıcısı (hDAT), yüksek afinite hücre dışı çinko bağlayıcı site çinko bağlanması üzerine dopamini inhibe eder geri alma ve güçlendirir amfetamin teşvikli dopamin akışı laboratuvar ortamında.[35][36][37] Aksine, insan serotonin taşıyıcısı (hSERT) ve insan norepinefrin taşıyıcı (hNET) çinko bağlama siteleri içermez.[37] Çinko takviyesi minimumu azaltabilir etkili doz tedavisi için kullanıldığında amfetamin Dikkat eksikliği hiperaktivite bozukluğu.[38]
Biyolojik rol ve bozukluklar
DAT'nin sinapstan dopamini uzaklaştırma hızı, hücredeki dopamin miktarı üzerinde derin bir etkiye sahip olabilir. Bu, en iyi, dopamin taşıyıcıları olmayan farelerin şiddetli bilişsel eksiklikleri, motor anormallikleri ve hiperaktivitesiyle kanıtlanır.[39] Bu özelliklerin semptomları ile çarpıcı benzerlikleri vardır. DEHB.
İşlevsel farklılıklar VNTR bipolar bozukluk için risk faktörleri olarak tanımlanmıştır[40] ve DEHB.[41] Daha güçlü bir ilişki olduğunu gösteren veriler ortaya çıktı. para çekme semptomlar alkolizm Bu bir tartışma konusu olsa da.[42][43] Bir alel Normal protein seviyelerine sahip DAT geninin, sigara içmeme davranışı ve bırakma kolaylığı ile ilişkilidir.[44] Ek olarak, 10-allel VNTR tekrarını taşıyan, özellikle yüksek riskli ailelerde (bağlanmayan bir anne ile işaretlenen ve anne sevgisinin olmadığı) erkek ergenler, antisosyal akranlar için istatistiksel olarak anlamlı bir afinite göstermektedir.[45][46]
DAT'nin artan aktivitesi, aşağıdakiler dahil birçok farklı bozuklukla ilişkilidir: klinik depresyon.[47]
DAT'deki mutasyonların neden olduğu gösterilmiştir dopamin taşıyıcı eksikliği sendromu, bir otozomal resesif hareket bozukluğu giderek kötüleşen distoni ve Parkinsonizm.[48]
Farmakoloji
Dopamin taşıyıcısı, substratlar, dopamin salıcılar, taşıma inhibitörleri ve allosterik modülatörler.[49][50]
Kokain, doğrudan taşıyıcıya bağlanarak ve taşıma oranını azaltarak DAT'ı bloke eder.[12] Aksine, amfetamin presinaptik nörona doğrudan nöronal membrandan veya DAT yoluyla girer ve dopamin ile geri alım için rekabet eder. İçeri girdikten sonra bağlanır TAAR1 veya sinaptik veziküllere girer VMAT2. Amfetamin TAAR1'e bağlandığında, postsinaptik nöronun ateşleme oranını düşürür ve tetikler protein kinaz A ve protein kinaz C sinyalleşme, DAT fosforilasyonuyla sonuçlanır. Fosforile DAT daha sonra ters yönde çalışır veya presinaptik nörona geri çekilir ve taşınmayı durdurur. Amfetamin sinaptik veziküllere VMAT2 aracılığıyla girdiğinde, dopamin sitozole salınır.[15][16] Amfetamin ayrıca, ikinci bir TAAR1'den bağımsız mekanizma yoluyla dopamin akışı üretir. CAMKIIα - taşıyıcının aracılı fosforilasyonu, ki bu, varsayılan olarak aktivasyonundan ortaya çıkar. DAT-bağlı L-tipi kalsiyum kanalları amfetamin tarafından.[11]
Her bir ilacın dopaminerjik mekanizmalarının, bu maddelerin ortaya çıkardığı zevkli duyguların temelinde yattığına inanılmaktadır.[7]
Etkileşimler
Dopamin taşıyıcısının etkileşim ile:
Bu doğal protein-protein etkileşimlerinden ayrı olarak, son çalışmalar, HIV-1 Tat protein DAT ile etkileşime girer[55][56] ve bu bağlanma, HIV pozitif bireylerde dopamin homeostazını değiştirebilir ve bu da hastalık için katkıda bulunan bir faktördür. HIV ile ilişkili nörobilişsel bozukluklar.[57]
Ayrıca bakınız
Referanslar
- ^ a b c ENSG00000276996 GRCh38: Topluluk sürümü 89: ENSG00000142319, ENSG00000276996 - Topluluk, Mayıs 2017
- ^ a b c GRCm38: Topluluk sürümü 89: ENSMUSG00000021609 - Topluluk, Mayıs 2017
- ^ "İnsan PubMed Referansı:". Ulusal Biyoteknoloji Bilgi Merkezi, ABD Ulusal Tıp Kütüphanesi.
- ^ "Mouse PubMed Referansı:". Ulusal Biyoteknoloji Bilgi Merkezi, ABD Ulusal Tıp Kütüphanesi.
- ^ Carboni E, Tanda GL, Frau R, Di Chiara G (Eylül 1990). "Noradrenalin taşıyıcısının bloke edilmesi, prefrontal kortekste hücre dışı dopamin konsantrasyonlarını arttırır: dopaminin noradrenerjik terminaller tarafından in vivo alındığına dair kanıt". Nörokimya Dergisi. 55 (3): 1067–70. doi:10.1111 / j.1471-4159.1990.tb04599.x. PMID 2117046. S2CID 23682303.
- ^ a b Vandenbergh DJ, Persico AM, Hawkins AL, Griffin CA, Li X, Jabs EW, Uhl GR (Aralık 1992). "İnsan dopamin taşıyıcı geni (DAT1), kromozom 5p15.3 ile eşleşir ve bir VNTR gösterir". Genomik. 14 (4): 1104–6. doi:10.1016 / S0888-7543 (05) 80138-7. PMID 1478653.
- ^ a b Schultz W (Temmuz 1998). "Dopamin nöronlarının tahmini ödül sinyali". Nörofizyoloji Dergisi. 80 (1): 1–27. doi:10.1152 / jn.1998.80.1.1. PMID 9658025.
- ^ Torres GE, Gainetdinov RR, Caron MG (Ocak 2003). "Plazma zarı monoamin taşıyıcıları: yapı, düzenleme ve işlev". Doğa Yorumları. Sinirbilim. 4 (1): 13–25. doi:10.1038 / nrn1008. PMID 12511858. S2CID 21545649.
- ^ Sonders MS, Zhu SJ, Zahniser NR, Kavanaugh MP, Amara SG (Şubat 1997). "İnsan dopamin taşıyıcısının çoklu iyonik iletkenlikleri: dopamin ve psikostimülanların eylemleri". Nörobilim Dergisi. 17 (3): 960–74. doi:10.1523 / JNEUROSCI.17-03-00960.1997. PMC 6573182. PMID 8994051.
- ^ a b Wheeler DD, Edwards AM, Chapman BM, Ondo JG (Ağustos 1993). "Fare striatal sinaptozomlarında dopamin alımının sodyum bağımlılığının bir modeli". Nörokimyasal Araştırma. 18 (8): 927–36. doi:10.1007 / BF00998279. PMID 8371835. S2CID 42196576.
- ^ a b c d e Cameron KN, Solis E, Ruchala I, De Felice LJ, Eltit JM (Kasım 2015). "Amfetamin, dopamin taşıyıcısı aracılı depolarizasyon yoluyla kalsiyum kanallarını aktive eder". Hücre Kalsiyum. 58 (5): 457–66. doi:10.1016 / j.ceca.2015.06.013. PMC 4631700. PMID 26162812.
İlgilenilen bir örnek, L-tipi Ca2 + kanallarının akış aşağısındaki Ca2 + akımlarının bir efektörü olarak iyi karakterize edilmiş olan CaMKII'dir [21,22]. İlginç bir şekilde, DAT bir CaMKII substratıdır ve fosforile DAT, elektriksel aktivitenin ve L-tipi Ca2 + kanallarının DAT durumlarını ve dopamin salınımını modüle edebileceği olası bir mekanizmayı oluşturan dopaminin ters taşınmasını destekler [48,49]. ... Özetle, sonuçlarımız farmakolojik olarak S (+) AMPH'nin hDAT aracılı depolarize akımları aktive etmede DA'dan daha güçlü olduğunu, L-tipi Ca2 + kanal aktivasyonuna yol açtığını ve S (+) AMPH kaynaklı akımın L tipi Ca2 + kanallarını açmak için DA'dan daha sıkı bağlanmıştır.
- ^ a b Kilty JE, Lorang D, Amara SG (Ekim 1991). "Kokaine duyarlı fare dopamin taşıyıcısının klonlanması ve ifadesi". Bilim. 254 (5031): 578–9. Bibcode:1991Sci ... 254..578K. doi:10.1126 / science.1948035. PMID 1948035.
- ^ Vaughan RA, Kuhar MJ (Ağustos 1996). "Dopamin taşıyıcı ligand bağlanma alanları. Sınırlı proteoliz ile ortaya çıkan yapısal ve fonksiyonel özellikler". Biyolojik Kimya Dergisi. 271 (35): 21672–80. doi:10.1074 / jbc.271.35.21672. PMID 8702957.
- ^ Penmatsa A, Wang KH, Gouaux E (Kasım 2013). "Dopamin taşıyıcının X ışını yapısı antidepresan mekanizmayı aydınlatır". Doğa. 503 (7474): 85–90. Bibcode:2013Natur.503 ... 85P. doi:10.1038 / nature12533. PMC 3904663. PMID 24037379.
- ^ a b c d e f g h ben j k Miller GM (Ocak 2011). "Eser amin ile ilişkili reseptör 1'in, monoamin taşıyıcılarının fonksiyonel düzenlenmesinde ve dopaminerjik aktivitede ortaya çıkan rolü". Nörokimya Dergisi. 116 (2): 164–76. doi:10.1111 / j.1471-4159.2010.07109.x. PMC 3005101. PMID 21073468.
- ^ a b c Eiden LE, Weihe E (Ocak 2011). "VMAT2: kötüye kullanım ilaçlarıyla etkileşime giren beyin monoaminerjik nöronal fonksiyonunun dinamik bir düzenleyicisi". New York Bilimler Akademisi Yıllıkları. 1216 (1): 86–98. Bibcode:2011NYASA1216 ... 86E. doi:10.1111 / j.1749-6632.2010.05906.x. PMC 4183197. PMID 21272013.
- ^ Sulzer D, Cragg SJ, Rice ME (Ağustos 2016). "Striatal dopamin nörotransmisyonu: salım ve alımın düzenlenmesi". Bazal ganglion. 6 (3): 123–148. doi:10.1016 / j.baga.2016.02.001. PMC 4850498. PMID 27141430.
Sinaptik vezikül pH'ının belirlenmesindeki zorluklara rağmen, kesecik membranındaki proton gradyanı, işlevi için temel öneme sahiptir. İzole edilmiş katekolamin veziküllerinin protonoforlara maruz kalması pH gradyanını çökertir ve vericiyi vezikülün içinden dışarıya hızla yeniden dağıtır. ... Amfetamin ve metamfetamin gibi türevleri, ekzositik olmayan bir mekanizma ile transmiter salımını ortaya çıkardığı bilinen, yaygın olarak kullanılan tek ilaç sınıfı olan zayıf baz bileşiklerdir. Hem DAT hem de VMAT için substratlar olarak, amfetaminler sitozole alınabilir ve daha sonra veziküler pH gradyanını çökertmek üzere hareket ettikleri veziküllerde sekestre edilebilir.
- ^ Ledonne A, Berretta N, Davoli A, Rizzo GR, Bernardi G, Mercuri NB (Temmuz 2011). "Eser aminlerin mezensefalik dopaminerjik nöronlar üzerindeki elektrofizyolojik etkileri". Ön. Syst. Neurosci. 5: 56. doi:10.3389 / fnsys.2011.00056. PMC 3131148. PMID 21772817.
Son zamanlarda TA eyleminin üç önemli yeni yönü ortaya çıkmıştır: (a) dopamin salınımının artması nedeniyle ateşlemenin engellenmesi; (b) D2 ve GABAB reseptör aracılı inhibe edici yanıtların azaltılması (disinhibisyona bağlı uyarıcı etkiler); ve (c) hücre zarı hiperpolarizasyonunu üreten GIRK kanallarının doğrudan TA1 reseptörü aracılı aktivasyonu.
- ^ "TAAR1". GenAtlas. Paris Üniversitesi. 28 Ocak 2012. Alındı 29 Mayıs 2014.
• ventral tegmental alandaki (VTA) dopamin (DA) nöronlarının bazal ateşleme frekansını azaltan, içe doğru rektifiye edici K (+) kanallarını tonik olarak etkinleştirir
- ^ a b Underhill SM, Wheeler DS, Li M, Watts SD, Ingram SL, Amara SG (Temmuz 2014). "Amfetamin, dopamin nöronlarında glutamat taşıyıcı EAAT3'ün endositozu yoluyla uyarıcı nörotransmisyonu modüle eder". Nöron. 83 (2): 404–416. doi:10.1016 / j.neuron.2014.05.043. PMC 4159050. PMID 25033183.
AMPH ayrıca kalmodulin / CamKII aktivasyonu (Wei ve diğerleri, 2007) ve DAT'ın modülasyonu ve trafiği (Fog ve diğerleri, 2006; Sakrikar ve diğerleri, 2012) ile ilişkili hücre içi kalsiyumu (Gnegy ve diğerleri, 2004) arttırır. ).
- ^ a b c Vaughan RA, Foster JD (Eylül 2013). "Normal ve hastalık durumlarında dopamin taşıyıcı düzenleme mekanizmaları". Farmakolojik Bilimlerdeki Eğilimler. 34 (9): 489–96. doi:10.1016 / j.tips.2013.07.005. PMC 3831354. PMID 23968642.
AMPH ve METH ayrıca, her ilaç için mekanizmalar aynı görünmese de [81] bağımlılık yapıcı özelliklerinde önemli bir unsur olduğu düşünülen [80] DA akışını uyarır. Bu süreçler PKCβ– ve CaMK'ye bağlıdır [72, 82] ve PKCβ knock-out fareler, azalmış AMPH ile indüklenen hareket ile ilişkili olan azalmış AMPH kaynaklı dışa akım sergiler [72].
- ^ Ciliax BJ, Drash GW, Staley JK, Haber S, Mobley CJ, Miller GW, Mufson EJ, Mash DC, Levey AI (Haziran 1999). "İnsan beynindeki dopamin taşıyıcının immünositokimyasal lokalizasyonu". Karşılaştırmalı Nöroloji Dergisi. 409 (1): 38–56. doi:10.1002 / (SICI) 1096-9861 (19990621) 409: 1 <38 :: AID-CNE4> 3.0.CO; 2-1. PMID 10363710.
- ^ Liu Z, Yan SF, Walker JR, Zwingman TA, Jiang T, Li J, Zhou Y (Nisan 2007). "Yüksek çözünürlüklü bir fare beyin atlasında uzamsal ortak ifadeye dayalı gen işlevi çalışması". BMC Sistemleri Biyolojisi. 1: 19. doi:10.1186/1752-0509-1-19. PMC 1863433. PMID 17437647.
- ^ Maguire JJ, Davenport AP (19 Temmuz 2016). "Eser amin reseptörü: TA1 reseptör ". IUPHAR / BPS FARMAKOLOJİ KILAVUZU. Uluslararası Temel ve Klinik Farmakoloji Birliği. Alındı 22 Eylül 2016.
- ^ Nirenberg MJ, Vaughan RA, Uhl GR, Kuhar MJ, Pickel VM (Ocak 1996). "Dopamin taşıyıcı, nigrostriatal dopaminerjik nöronların dendritik ve aksonal plazma membranlarında lokalizedir". Nörobilim Dergisi. 16 (2): 436–47. doi:10.1523 / JNEUROSCI.16-02-00436.1996. PMC 6578661. PMID 8551328.
- ^ Hersch SM, Yi H, Heilman CJ, Edwards RH, Levey AI (Kasım 1997). "Striatum ve substantia nigradaki dopamin taşıyıcısının hücre altı lokalizasyonu ve moleküler topolojisi". Karşılaştırmalı Nöroloji Dergisi. 388 (2): 211–27. doi:10.1002 / (SICI) 1096-9861 (19971117) 388: 2 <211 :: AID-CNE3> 3.0.CO; 2-4. PMID 9368838.
- ^ Kawarai T, Kawakami H, Yamamura Y, Nakamura S (Ağustos 1997). "İnsan dopamin taşıyıcısını kodlayan genin yapısı ve organizasyonu". Gen. 195 (1): 11–8. doi:10.1016 / S0378-1119 (97) 00131-5. PMID 9300814.
- ^ Sano A, Kondoh K, Kakimoto Y, Kondo I (Mayıs 1993). "İnsan dopamin taşıyıcı geninde 40 nükleotidlik tekrar polimorfizmi". İnsan Genetiği. 91 (4): 405–6. doi:10.1007 / BF00217369. PMID 8500798. S2CID 39416578.
- ^ Miller GM, Madras BK (2002). "İnsan ve maymun dopamin taşıyıcı genlerinin 3'-çevrilmemiş bölgesindeki polimorfizmler haberci gen ekspresyonunu etkiler". Moleküler Psikiyatri. 7 (1): 44–55. doi:10.1038 / sj / mp / 4000921. PMID 11803445.
- ^ Sacchetti P, Mitchell TR, Granneman JG, Bannon MJ (Mart 2001). "Nurr1, yeni bir mekanizma yoluyla insan dopamin taşıyıcı geninin transkripsiyonunu güçlendirir". Nörokimya Dergisi. 76 (5): 1565–72. doi:10.1046 / j.1471-4159.2001.00181.x. PMID 11238740. S2CID 19410051.
- ^ Morón JA, Zakharova I, Ferrer JV, Merrill GA, Hope B, Lafer EM, Lin ZC, Wang JB, Javitch JA, Galli A, Shippenberg TS (Eylül 2003). "Mitojenle aktive olan protein kinaz, dopamin taşıyıcı yüzey ekspresyonunu ve dopamin taşıma kapasitesini düzenler". Nörobilim Dergisi. 23 (24): 8480–8. doi:10.1523 / JNEUROSCI.23-24-08480.2003. PMC 6740378. PMID 13679416.
- ^ Pristupa ZB, McConkey F, Liu F, Man HY, Lee FJ, Wang YT, Niznik HB (Eylül 1998). "Protein kinaz aracılı çift yönlü kaçakçılık ve insan dopamin taşıyıcısının fonksiyonel düzenlenmesi". Sinaps. 30 (1): 79–87. doi:10.1002 / (SICI) 1098-2396 (199809) 30: 1 <79 :: AID-SYN10> 3.0.CO; 2-K. PMID 9704884.
- ^ Lindemann L, Ebeling M, Kratochwil NA, Bunzow JR, Grandy DK, Hoener MC (Mart 2005). "Eser aminle ilişkili reseptörler, yeni G proteinine bağlı reseptörlerin yapısal ve işlevsel olarak farklı alt ailelerini oluşturur". Genomik. 85 (3): 372–85. doi:10.1016 / j.ygeno.2004.11.010. PMID 15718104.
- ^ Maguire JJ, Parker WA, Foord SM, Bonner TI, Neubig RR, Davenport AP (Mart 2009). "Uluslararası Farmakoloji Birliği. LXXII. Eser amin reseptörü terminolojisi için öneriler". Farmakolojik İncelemeler. 61 (1): 1–8. doi:10.1124 / pr.109.001107. PMC 2830119. PMID 19325074.
- ^ Krause J (Nisan 2008). "Dikkat eksikliği / hiperaktivite bozukluğunda dopamin taşıyıcısının SPECT ve PET'i". Nöroterapötiklerin Uzman Değerlendirmesi. 8 (4): 611–25. doi:10.1586/14737175.8.4.611. PMID 18416663. S2CID 24589993.
Çinko, DAT'nin hücre dışı bölgelerine bağlanır [103], bir DAT inhibitörü olarak hizmet eder. Bu bağlamda, çinkonun [takviyesinin] DEHB semptomları üzerindeki olumlu etkilerini gösteren çocuklarda kontrollü çift kör çalışmalar ilgi çekicidir [105,106]. Şu anda çinko ile [takviyenin] herhangi bir DEHB tedavi algoritmasına entegre edilmediği belirtilmelidir.
- ^ Sulzer D (Şubat 2011). "Bağımlılık yapan ilaçlar presinaptik dopamin nörotransmisyonunu nasıl bozar?". Nöron. 69 (4): 628–49. doi:10.1016 / j.neuron.2011.02.010. PMC 3065181. PMID 21338876.
Alım ve salım arasındaki tahmin edilen doğrudan ilişkiyi doğrulamadılar, bunun yerine AMPH dahil bazı bileşiklerin alım için substratlardan daha iyi salgılayıcılar olduğunu doğruladılar. Ayrıca çinko, eşzamanlı alım inhibisyonuna rağmen hücre içi [3H] DA'nın dışarı akışını uyarır (Scholze ve diğerleri, 2002).
- ^ a b Scholze P, Nørregaard L, Şarkıcı EA, Freissmuth M, Gether U, Sitte HH (Haziran 2002). "Monoamin taşıyıcılarının aracılık ettiği ters taşınmada çinko iyonlarının rolü". Biyolojik Kimya Dergisi. 277 (24): 21505–13. doi:10.1074 / jbc.M112265200. PMID 11940571.
İnsan dopamin taşıyıcısı (hDAT), endojen yüksek afiniteli bir Zn içerir.2+ hücre dışı yüzünde üç koordinasyon kalıntısı bulunan bağlanma bölgesi (His193, His375 ve Glu396). ... Zn olmasına rağmen2+ inhibe edilmiş alım, Zn2+ özellikle hDAT'de amfetamin, MPP + veya K + ile indüklenen depolarizasyonla indüklenen kolaylaştırılmış [3H] MPP + salımı, ancak insan serotonininde ve norepinefrin taşıyıcıda (hNET) değil.
- ^ Scassellati C, Bonvicini C, Faraone SV, Gennarelli M (Ekim 2012). "Biyobelirteçler ve dikkat eksikliği / hiperaktivite bozukluğu: sistematik bir inceleme ve meta-analizler". Amerikan Çocuk ve Ergen Psikiyatrisi Akademisi Dergisi. 51 (10): 1003–1019.e20. doi:10.1016 / j.jaac.2012.08.015. PMID 23021477.
Çinko takviyesi ile ilgili olarak, plasebo kontrollü bir çalışma, 30 mg / gün'e kadar çinko dozlarının en az 8 hafta boyunca güvenli olduğunu bildirdi, ancak klinik etki, amfetamin optimal dozunda% 37'lik bir azalma bulgusu dışında 30 ile belirsizdi. günde mg çinko.110
- ^ Gainetdinov RR, Wetsel WC, Jones SR, Levin ED, Jaber M, Caron MG (Ocak 1999). "Psikostimülanların hiperaktivite üzerindeki paradoksal sakinleştirici etkisinde serotoninin rolü". Bilim. 283 (5400): 397–401. Bibcode:1999Sci ... 283..397G. doi:10.1126 / science.283.5400.397. PMID 9888856. S2CID 9629915.
- ^ Greenwood TA, Alexander M, Keck PE, McElroy S, Sadovnick AD, Remick RA, Kelsoe JR (Mart 2001). "Dopamin taşıyıcısı ile bipolar bozukluk arasındaki bağlantı dengesizliğinin kanıtı". Amerikan Tıbbi Genetik Dergisi. 105 (2): 145–51. doi:10.1002 / 1096-8628 (2001) 9999: 9999 <:: AID-AJMG1161> 3.0.CO; 2-8. PMID 11304827.
- ^ Yang B, Chan RC, Jing J, Li T, Sham P, Chen RY (Haziran 2007). "Dopamin taşıyıcı genin 3'-UTR'sindeki bir VNTR polimorfizminin 10 tekrarlı aleli ile dikkat eksikliği hiperaktivite bozukluğu arasındaki ilişki çalışmalarının bir meta-analizi". Amerikan Tıbbi Genetik Dergisi. Bölüm B, Nöropsikiyatrik Genetik. 144B (4): 541–50. doi:10.1002 / ajmg.b.30453. PMID 17440978. S2CID 22881996.
- ^ Sander T, Harms H, Podschus J, Finckh U, Nickel B, Rolfs A, Rommelspacher H, Schmidt LG (Şubat 1997). "Alkol bağımlılığında dopamin taşıyıcı gen polimorfizminin yoksunluk nöbetleri veya deliryum ile alelik ilişkisi". Biyolojik Psikiyatri. 41 (3): 299–304. doi:10.1016 / S0006-3223 (96) 00044-3. PMID 9024952. S2CID 42947314.
- ^ Ueno S, Nakamura M, Mikami M, Kondoh K, Ishiguro H, Arinami T, Komiyama T, Mitsushio H, Sano A, Tanabe H (Kasım 1999). "İnsan dopamin taşıyıcısı (DAT1) geninin yeni bir polimorfizminin ve alkolizm ile önemli ilişkisinin tanımlanması". Moleküler Psikiyatri. 4 (6): 552–7. doi:10.1038 / sj.mp.4000562. PMID 10578237.
- ^ Ueno S (Şubat 2003). "Ruhsal bozukluklarda serotonin ve dopamin taşıyıcılarının genetik polimorfizmleri". Tıbbi Araştırma Dergisi. 50 (1–2): 25–31. PMID 12630565.
- ^ Beaver KM, Wright JP, DeLisi M (Eylül 2008). "Suçlu akran grubu oluşumu: bir gen x ortam korelasyonunun kanıtı". Genetik Psikoloji Dergisi. 169 (3): 227–44. doi:10.3200 / GNTP.169.3.227-244. PMID 18788325. S2CID 46592146.
- ^ Florida Eyalet Üniversitesi (2 Ekim 2008). "Akranları Suçlu Olan Ergen Erkeklerde Bulunan Spesifik Gen". Günlük Bilim. Alındı 8 Ekim 2008.
- ^ Laasonen-Balk T, Kuikka J, Viinamäki H, Husso-Saastamoinen M, Lehtonen J, Tiihonen J (Haziran 1999). "Büyük depresyonda striatal dopamin taşıyıcı yoğunluğu". Psikofarmakoloji. 144 (3): 282–5. doi:10.1007 / s002130051005. PMID 10435396. S2CID 32882588.
- ^ Ng J, Zhen J, Meyer E, Erreger K, Li Y, Kakar N, Ahmad J, Thiele H, Kubisch C, Rider NL, Morton DH, Strauss KA, Puffenberger EG, D'Agnano D, Anikster Y, Carducci C, Hyland K, Rotstein M, Leuzzi V, Borck G, Reith ME, Kurian MA (Nisan 2014). "Dopamin taşıyıcı eksikliği sendromu: bebeklikten yetişkinliğe kadar fenotipik spektrum". Beyin. 137 (Pt 4): 1107–19. doi:10.1093 / beyin / awu022. PMC 3959557. PMID 24613933.
- ^ Rothman RB, Ananthan S, Partilla JS, Saini SK, Moukha-Chafiq O, Pathak V, Baumann MH (Haziran 2015). "Biyojenik amin taşıyıcılarla ilgili çalışmalar 15. Nanomolar potensli yeni allosterik dopamin taşıyıcı ligandlarının belirlenmesi". The Journal of Pharmacology and Experimental Therapeutics. 353 (3): 529–38. doi:10.1124 / jpet.114.222299. PMC 4429677. PMID 25788711.
- ^ Aggarwal S, Liu X, Rice C, Menell P, Clark PJ, Paparoidamis N, Xiao YC, Salvino JM, Fontana AC, España RA, Kortagere S, Mortensen OV (2019). "İnsan Dopamin Taşıyıcısının Yeni Bir Allosterik Modülatörünün Tanımlanması". ACS Chem Neurosci. 10 (8): 3718–3730. doi:10.1021 / acschemneuro.9b00262. PMC 6703927. PMID 31184115.
- ^ Wersinger C, Sidhu A (Nisan 2003). "Alfa-sinüklein ile dopamin taşıyıcı aktivitesinin zayıflatılması". Sinirbilim Mektupları. 340 (3): 189–92. doi:10.1016 / S0304-3940 (03) 00097-1. PMID 12672538. S2CID 54381509.
- ^ Lee FJ, Liu F, Pristupa ZB, Niznik HB (Nisan 2001). "Alfa-sinükleinin dopamin taşıyıcılarına doğrudan bağlanması ve fonksiyonel bağlanması, dopamin kaynaklı apoptozu hızlandırır". FASEB Dergisi. 15 (6): 916–26. doi:10.1096 / fj.00-0334com. PMID 11292651.
- ^ Torres GE, Yao WD, Mohn AR, Quan H, Kim KM, Levey AI, Staudinger J, Caron MG (Nisan 2001). "Monoamin plazma membran taşıyıcıları ile sinaptik PDZ alanı içeren protein PICK1 arasındaki fonksiyonel etkileşim". Nöron. 30 (1): 121–34. doi:10.1016 / S0896-6273 (01) 00267-7. PMID 11343649. S2CID 17318937.
- ^ Carneiro AM, Ingram SL, Beaulieu JM, Sweeney A, Amara SG, Thomas SM, Caron MG, Torres GE (Ağustos 2002). "Birden fazla LIM alanı içeren adaptör protein Hic-5, dopamin taşıyıcısı ile sinaptik olarak ortak lokalize olur ve etkileşime girer". Nörobilim Dergisi. 22 (16): 7045–54. doi:10.1523 / JNEUROSCI.22-16-07045.2002. PMC 6757888. PMID 12177201.
- ^ Midde NM, Yuan Y, Quizon PM, Sun WL, Huang X, Zhan CG, Zhu J (Mart 2015). "İnsan dopamin taşıyıcısının tirozin 88, lisin 92 ve tirozin 470'deki mutasyonlar, dopamin taşınmasının HIV-1 Tat ile indüklenen inhibisyonunda bir zayıflama ile sonuçlanır". Nöroimmün Farmakoloji Dergisi. 10 (1): 122–35. doi:10.1007 / s11481-015-9583-3. PMC 4388869. PMID 25604666.
- ^ Midde NM, Huang X, Gomez AM, Booze RM, Zhan CG, Zhu J (Eylül 2013). "İnsan dopamin taşıyıcısının tirozin 470 mutasyonu, dopamin taşınmasının ve taşıyıcı konformasyonal geçişlerinin HIV-1 Tat ile indüklenen inhibisyonu için kritiktir". Nöroimmün Farmakoloji Dergisi. 8 (4): 975–87. doi:10.1007 / s11481-013-9464-6. PMC 3740080. PMID 23645138.
- ^ Purohit V, Rapaka R, Shurtleff D (Ağustos 2011). "Kötüye kullanım ilaçları, dopamin ve HIV ile ilişkili nörobilişsel bozukluklar / HIV ile ilişkili bunama". Moleküler Nörobiyoloji. 44 (1): 102–10. doi:10.1007 / s12035-011-8195-z. PMID 21717292. S2CID 13319355.
Dış bağlantılar
- Dopamin taşıyıcı ile ilgili Dernekler, Deneyler, Yayınlar ve Klinik Araştırmalar
- Dopamin + Taşıyıcı ABD Ulusal Tıp Kütüphanesinde Tıbbi Konu Başlıkları (MeSH)
- Mevcut tüm yapısal bilgilere genel bakış PDB için UniProt: Q7K4Y6 (Drosophila melanogaster Sodyum bağımlı dopamin taşıyıcı) PDBe-KB.