Nivalenol - Nivalenol - Wikipedia
 | |
| İsimler | |
|---|---|
| Diğer isimler (3α, 4β, 7α) -12,13-epoksi-3,4,7,15-tetrahidroksi-trikotec-9-en-8-on[1] | |
| Tanımlayıcılar | |
3 boyutlu model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| ECHA Bilgi Kartı | 100.150.573 |
| KEGG | |
PubChem Müşteri Kimliği | |
| UNII | |
CompTox Kontrol Paneli (EPA) | |
| |
| |
| Özellikleri | |
| C15H20Ö7 | |
| Molar kütle | 312.318 g · mol−1 |
| Görünüm | katı |
| Yoğunluk | 1,6 ± 0,1 g / cm³ |
| Erime noktası | 222–223 ° C |
| Kaynama noktası | 585.1 ± 50 ° C |
| 25 ° C'de 3,54 * 10 ^ 5 mg / L | |
| Çözünürlük | polar organik çözücülerde çözünür |
| Asitlik (pKa) | 11.78 |
| Tehlikeler | |
| GHS piktogramları |    [2][3] [2][3] |
| GHS Sinyal kelimesi | Tehlike[2] |
| H225, H300, H302, H312, H332, H310, H319, H330 [2][3] | |
| P210, P241, P260, P262, P264, P270, P271, P280, P284, P301 + 310, P302 + 350, P304 + 340, P310, P320, P321, P322, P330, P361, P363, P403 + 233, P405, P501[2][3] | |
| NFPA 704 (ateş elması) | |
| Alevlenme noktası | 5 ° C (41 ° F; 278 K)[3] |
| 525 ° C (977 ° F; 798 K)[3] | |
Eşik sınır değeri (TLV) | 20 ppm (34 mg / m23) Cilt [3] |
| Ölümcül doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz ) | 19.5 mg / kg (sıçanlar, oral), 38.9 mg / kg (fare, oral) |
| NIOSH (ABD sağlık maruziyet sınırları): | |
PEL (İzin verilebilir) | 40 ppm (70 mg / m2)3) [3] |
REL (Önerilen) | 20 ppm (34 mg / m23) [3] |
Aksi belirtilmedikçe, veriler kendi içlerindeki malzemeler için verilmiştir. standart durum (25 ° C'de [77 ° F], 100 kPa). | |
| Bilgi kutusu referansları | |
Nivalenol (NIV) bir mikotoksin of trikotesen grubu. Doğada esas olarak mantarlarda bulunur. Fusarium Türler. Fusarium türler en yaygın olanlara aittir mikotoksin Kuzey yarımkürenin ılıman bölgelerinde mantar üretmek, bu nedenle onları gıda mahsulü üretim endüstrisi için önemli bir risk haline getiriyor.[4]
Mantarlar, çeşitli tarım ürünlerinde (tahıl mahsulleri) ve bunların ileri işlenmiş ürünlerinde (malt, bira ve ekmek) bol miktarda bulunur. " Fusarium türler ekinleri istila eder ve üzerinde büyür ve nivalenol nemli ve serin koşullarda üretebilir ".[4]
Nivalenol ile etkilendikten sonra görülen semptomlar "yem reddi, kusma, mide-bağırsak ve cilt tahrişi veya nekroz ve immünolojik işlev bozukluğu ",[5] Hem de hematotoksisite düşük lökosit sayısıyla sonuçlanır.[5]
Tarih
1946-1963 döneminde, yutulması nedeniyle birkaç zehirlenme vakası Fusarium Japonya, Kore ve Hindistan'da enfekte tahıllar (Scrabby tahıl hastalığı) rapor edilmiştir. Ölümcül vakalara dair herhangi bir rapor yok ve sadece mide bulantısı kusma ishal ve karın Ağrı. Bu olaylarda F. graminaerum izole edilebilir ki bu bir nivalenol veya deoksinivalenol bulaşma.
Aynı dönemde, Hindistan ve Çin'de 100'den fazla vakayı içeren iki salgın rapor edildi. Bu salgınlar da ölümcül değildi.
1987'de Hindistan'da iyi belgelenmiş ve akut bir salgın yaklaşık 50.000 bin kişiyi etkiledi. Birkaç Fusarium altında nivalenol bulunan toksinler (24 örnekten 2'sinde 0.03-0.1 mg / kg), deoksinivalenol (24 örneğin 11'inde 0.34–8.4 mg / kg) ve asetildeoksinivalenol (24 örneğin 4'ünde 0.6–2.4 mg / kg) ekmek üretimi için kullanılan yağmur hasarlı buğdayda bulunmuştur. Yine ölümcül vaka olmadı ve bildirilen semptomlar karın Ağrı, ishal, kanlı dışkı ve kusma. Bu vakalar, ortaya çıkan ana nivalenol tehlikesinin Fusarium enfekte tahıllar ve daha çok işlenen veya başka bir yoldan gıda zincirine giren kontrolsüz buğday veya diğer tahılların sindirim yoludur.[6]
Waeponization ve diğer Nivalenol zehirlenmesi örnekleri
Nivalenol yanı sıra deoksinivalenol ve T-2 toksin Afganistan'ın yanı sıra Laos ve Kamboçya'da biyolojik savaş ajanı olarak kullanılmıştır. Sovyetler Birliği'nin mikotoksinler ve onları Afganistan'da kendileri kullandılar. Her üç bileşik de etkilenen bölgelerde bitki örtüsünde tanımlanabilirken T-2 toksin kurbanların idrar ve kan örneklerinde de bulunabilir.[7]
Savaşta trichothecenes'in en iyi belgelenmiş kullanımı sarı yağmur tartışmasıdır. Bu, Güneydoğu Asya'nın yanı sıra Laos ve Afganistan'daki bir dizi saldırıyı tanımlamaktadır.sarı yağmur "Tanıkların anlattığı gibi. Toksinler, sarı toz veya damlacık bulutu olarak tanımlandı. 1984'te Chemical Engineering News'de yayınlanan L.R. Ember'in bir makalesi, trikotesen mikotoksinler Güneydoğu Asya'da biyolojik silahlar olarak çok detaylı bir şekilde.[8] Kitapta, savaş esirlerinin ve sovyet muhbirlerinin yanı sıra hayatta kalanların ve görgü tanıklarının raporları, sovyet teknisyenlerinin ve laboratuvarlarının varlığına ilişkin bilgilerle birlikte bulunabilir. Bu, bu toksinlerin Güneydoğu Asya ve Afganistan'da kullanıldığı sonucuna götürdü. Ancak Rus hükümeti bu kanıtlar hakkında açıklama yapmayı reddediyor. Ayrıca, saldırı yerinden alınan numunelerin bu toksinleri içerdiği, saldırıya uğramayan sitelerin ise içlerinde herhangi bir toksin belirtisi göstermediği gösterilmiştir.
Tüm tanık raporlarının güvenilir kanıt kaynakları olup olmadığı şüpheli olmaya devam etse de, kaydedilen semptomlar tipik olarak trikotesenler.
Bir dizi yol vardı trikotesenler aerosol, duman, damlacıklar veya uçaklardan, füzelerden, el cihazlarından veya toplardan gelen tozlar gibi silah haline getirilmiş olanlar.[9]
Gıda endüstrisindeki güvenlik yönergeleri
2000 yılında, nivalenol hakkında bilimsel bir görüş yayınlandı. Gıda Bilimsel Komitesi (SCF). Geçici tolere edilebilir günlük alım (t-TDI) Genel toksisitenin yanı sıra, günde 0-0,7 µg / kg vücut ağırlığı hematoksisite ve immünotoksisite. Bu t-TDI 2002 yılında SCF tarafından yeniden onaylandı.
2010 yılında Japon Gıda Güvenliği Komisyonu (FSCJ) bir t-TDI günlük 0.4 μg / kg canlı ağırlık.
2001 ve 2011 yılları arasında Avrupa Gıda Güvenliği Otoritesi (EFSA) Değerlendirilmek üzere 18 Avrupa ülkesinde 15774 nivalenol oluşumundan veri toplandı. Bu, günde 1,2 µg / kg bw'lik bir TDI oluşturulmasına yol açtı. Nivalenol, bu çalışmalarda genotoksik bulunmadı, ancak iyi hematotoksik ve immünotoksik.[4]
Yapı ve tepkime
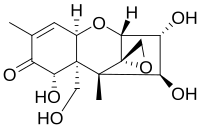
Nivalenol ailesinin bir parçası olarak mikotoksinler bu toksin ailesinin tüm üyelerinin sahip olduğu ortak yapıya sahiptir. Bu, bir sikloheksen ve bir tetrahidropiran halka C6 ve C11'e bağlı. Ek olarak bir etil grubu tetrahidropiran C2 ve C5 ve a'da keto grup eklenmiştir sikloheksen C8'de. epoksit Çoğu parçanın reaktivitesinden sorumlu olan grup, C12 ve C13'e eklenir. tetrahidropiran. Sadece C3, C4, C7, C15 pozisyonlarında kalan gruplar farklı mikotoksinler. Nivalenol durumunda, kalan dört grubun her biri, polar özellikleri sayesinde hidrofilik bileşiklerin veya alt grupların mevcudiyetinde reaktiviteye eklenen ikame edilmiş bir hidroksil grubudur. Asidik ortamda keto grup, polariteyi ve reaktiviteyi teşvik eden bir protonla reaksiyona girebilir. Ama tamamen epoksit grup, molekülün reaktivitesi için çok önemlidir.[10]
Mevcut formlar
Nivalenol, deoksinivalenol ve T2 toksini üç yapısal ve benzer sentezlenmiş mikotoksinler mantarlarda doğal olarak görünen (ör. Fusarium ).[10]
Sentez
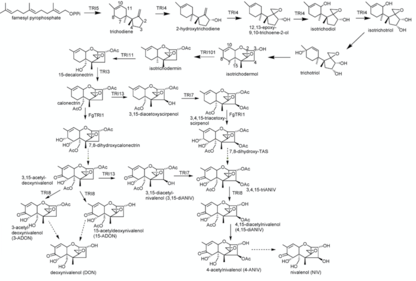
Nivalenol sentezi 16 aşamalı bir işlemdir. Tepkimeyi kontrol etme sırasına bağlı olarak adım 11 ila adım 14 arasında farklılık gösterebilir. trikodien sentazlar TRI1, TRI13 ve TRI7 katalize ediyor. Famesyl pirofosfat nivalenol sentezi için başlangıç bileşiği olarak kullanılır. Trichodiene karşı halkalaşma reaksiyonu şu şekilde katalize edilir: terpen siklaz trikodien sentaz (Tri5). Bu reaksiyonu, katalizlenen birkaç oksidasyon reaksiyonu izler. sitokrom P450 monooksijenaz (TRI4 tarafından kodlanmıştır). Böylelikle C2, C3 ve C11 karbon atomlarına hidroksil grupları ikame edildi ve C12 ve C13'e bir oksijen eklendi epoksit grubu. Bu, ara izotrikotriol ile sonuçlanır.
Diğer bir reaksiyonda, trikotriol, izotrikotriolün C11 hidroksil grubunun C9'a kaymasıyla elde edildi, benzer şekilde C9 = C10'dan C10 = C11'e kaymıştır. Trichotriol, enzimatik olmayan bir siklizasyon reaksiyonunda reaksiyona girer. izomer izotrichodermol. Reaksiyonda, C2 üzerindeki hidroksil grubu siklopentan C11'e bağlanır sikloheksen oluşturmak tetrahidropiran yüzük. Reaksiyon sırasında C9'daki kaydırılmış OH grubu kaybolur. Bir asetiltransferaz (TRI101 tarafından kodlanmıştır) izotrikodermol oluşturan izotrikdermin C3 OH grubunun asetilasyonunu katalize eder.
İzotrichodermin, bir hidrojenin C15'te bir hidroksil ile ikamesi (TRI11 tarafından kodlanan) nedeniyle 15-dekalonekitrine dönüştürülür ve bu daha sonra TRI3 yardımıyla asetillenir. Aynı ikame ve ardından gelen asetilasyon reaksiyonları, TRI13 ve TRI7'nin kontrolü altında C4'te tekrar meydana gelir. TRI1 inç F.sporotrichiodies ayrıca C8'de dördüncü bir OH grubunun ve C7'de beşinci bir OH grubunun eklenmesini katalize eder, bu durumda hidrojenin elimine edilir ve bir keto grubu oluşur.
Son bir aşamada, TRI8 tarafından kontrol edilen bir esteraz, deasetilasyon C3, C4 ve C15'te son ürün nivalenol ile sonuçlanır. TRI1 ve TRI13, TRI7 katalizörleri ters sırada kullanıldığında kısmen alternatif bir sentez meydana gelebilir. Daha sonra TRI1 tarafından kontrol edilen C7 ve C8'deki hidroksil gruplarının eklenmesi, reaktan olarak kalonektrin ile gerçekleşir. Bu reaksiyonda 7,8-dihidroksikalonektrin oluşur. Ayrıca, 3,15-asetil-deoksinivalenole, bir hidrojenin ortadan kaldırılması ve bir oluşumun oluşumu yoluyla kendiliğinden reaksiyona girer. keto C8'deki grup. C4'te TRI13 tarafından kontrol edilen bir hidroksil grubunun eklenmesi gerçekleşir ve TRI7'nin yardımı altında asetillenir. Bu, 3,4,15-triasetilnivalenol (3,4,15-triANIV) verir ve buradan yine yukarıda tarif edilenle aynı sentezdir.[9]
Hareket mekanizması
Nivalenol, bir dizi farklı biyolojik yolda bir değişikliğe neden olur. En iyi bilinen ve muhtemelen en önemlisi, NF-κB patika. NF-κB bir transkripsiyon faktörü hemen hemen tüm insan hücrelerinde bulunabilen ve düzenleyici elemanlar üzerindeki genomik DNA üzerindeki spesifik motiflere bağlanarak hedef genlerinin ekspresyonunu düzenler. Laboratuvar ortamında testler, nivalenolün ifadesini değiştirebileceğini göstermiştir. sitokinler Bağışıklık sisteminin önemli kontrol molekülleri olan. Nivalenol, bir aracı olan IL-8'in salgılanmasını indükledi. iltihap. İle tedavi edildiğinde NF-κB inhibitörü, IL-8 salgılanması düşürüldü. Nivalenolün etkilediği bir diğer önemli faktör ise MCP-1 /CCL2 bu sitokin, mononükleer lökosit hücrelerinin hareketliliğinin düzenlenmesinde rol oynar. Nivalenol nedenleri CCL2 salgının düşürülmesi ve böylece monositlerin hareketliliğinin azaltılması. Bu, nivalenolün immünosupresif doğasının bir kısmını açıklar. Yine, bu etki azaltılır NF-κB nivalenol ve NF-κB hücreyi etkilemek için etkileşim.[11][12]
O sırada gösterildi deoksinivalenol salgılanmasına neden olur kemokinler Nivalenol, aynı zamanda immünolojik haberci moleküllerdir, nivalenol bunların salgılanmasını engeller.[13][14] Nivalenol ayrıca, makrofajlarda proinflamatuar genlerin ekspresyonunu düzenler ve farklı hücre tipleri üzerinde karışık bir etki gösterir. Bunu sitotoksik seviyelerde bile yapar.[15]
Nivalenolün diğer bir sitotoksisite mekanizması, nivalenolün sıklıkla birlikte meydana gelen olandan daha toksik olduğunu gösteren apoptotik sitotoksisitedir. mikotoksin ortak deoksinivalenol ve bunu DNA hasarına neden olarak yapar ve apoptoz.[16] Nivalenolün ayrıca insan lökosit proliferasyonunu etkilediği bilinmektedir. Nivalenolün insan lökositlerinin proliferasyon oranlarını doza bağımlı bir şekilde değiştirebileceği gösterilmiştir. Daha düşük konsantrasyonların lökosit proliferasyonunu arttırdığı, daha yüksek konsantrasyonların ise doza bağlı bir şekilde proliferasyonu azalttığı bilinmektedir.[17]
Metabolizma

Farelerde Nivalenol sadece karaciğer yoluyla değil, aynı zamanda daha az bir kısmı için bağırsaklardaki mikrobiyal detoksifikasyon yoluyla metabolize edilir. Dolayısıyla özellikle epoksit molekülün en toksik kısmı olarak grubu bozulur. Bu, oksijeni ortadan kaldırarak olur. epoksit grubu, C12 ve C13 arasında bir çift karbon-karbon bağı ile sonuçlanır. Bu çift bağ polar değildir ve çok kararlıdır ve de-epoxynivalenol adı verilen daha az reaktif bir nivalenol formuna yol açar. Elde edilen epoksin giderilmiş nivalenol bu nedenle çok daha az toksiktir; trichodiene ve artık çok fazla toksik etkiye sahip olmadan (neredeyse toksik değildir) idrarla ayrılabilir.
Test edilen farelerin ve domuzların idrarında epoksidasyonu giderilmiş bileşiğin% 80'i ve gerçek nivalenolün yalnızca% 7'si, yüksek metabolizma oranını gösteren bulundu. Trichodienes.[5] Böylece düşük proteinlerde ve ürede düşük bir nitrojen konsantrasyonu gözlenirken, kolesterol konsantrasyonunun normalden daha yüksek olduğu gözlendi. Bu, nivalenolün var olduğunu ve daha sonra karaciğerin kolesterolün kan dolaşımına ayrışmasından sorumlu olduğu için karaciğerde parçalandığını göstermektedir. Kandaki daha yüksek kolesterol miktarı böbrekler tarafından daha yüksek miktarda filtrelenmiş kolesterole ve sonunda üre konsantrasyonunun artmasına neden olur.[10][18]
Azalan amid konsantrasyonunun, reaktif maddenin bozunma sürecinde neden olduğu varsayılır. epoksit grubu. bu yüzden epoksitler sıklıkla, bir birincil veya ikincil amine bir hidroksil grubu ekleyerek amidler veya amid grupları ile reaksiyona girdiği bulunmuştur. Sonuç olarak, epoksit grubu bozulur ve proteinlerin veya üre sentezi için daha az nitrojen bulunur.
Yan etkiler
Nivalenol henüz tıbbi tedavilerde kullanım bulamamıştır ve bu nedenle tarif edilen toksik etkilerin yanı sıra bilinen yan etkileri yoktur. Bununla birlikte, immünosupresif etkileri nedeniyle araştırma için ilginç olabileceğini belirtmekte fayda var.
Hayvanlar Üzerindeki Etkiler ve Etkinlik
Nivalenol, belirli bir mikotoksik ürün olduğundan Fusarium türler genellikle enfekte buğday ve tahılda bulunur. İşlenmemiş buğday ve tahıl ürünü genellikle çiftlik hayvanları için yem olarak kullanıldığından, bunlar daha yüksek nivalenol alım riski altındadır.
Günde iki kez 0.05 mg nivalenol / kg vücut ağırlığı dozu alan domuzlarda yapılan toksisite çalışmaları, ölümcül etki göstermedi. Nivalenolün çoğu dışkı ile salgılanmıştır ve 16 saatlik beslenmeden sonra hala bağırsaklarda nivalenol bulunmasına rağmen kan dolaşımına ulaşmamıştır. Ayrıca ilk üç gün içinde dışkıda veya idrarda nivalenol metabolitleri bulunmamıştır.[19] Günde iki kez 2.5 veya 5 mg nivalenol kg vücut ağırlığı ile bir hafta maruz kaldıktan sonra, dışkıda ve idrarda nivalenol metabolitleri (de-epokside nivalenol) bulunabildiğinden mikrobiyolojik bir adaptasyon görülmüştür.
Sıçanlarda ve farelerde, nivalenolün toksik olduğu gösterilmiştir. büyüme geriliği ve lökopeni halihazırda günde en düşük 0.7 mg / kg vücut ağırlığı dozlarında fark edilmiştir. Ölümcül dozlar, nivalenolün uygulama / alım yoluna bağlıydı. Nivalenol normalde yemle birlikte alındığı için LD50 Farelerde günde 38.9 mg / kg canlı ağırlık ve günde 19.5 mg / kg canlı ağırlık olan oral uygulama standart olarak kullanılabilir. LD50 intravenöz, intraperitoneal ve deri altı (SC) günde 7 ile 7.5 mg / kg canlı ağırlık arasındadır.[20]
Toksisite, endikasyonlar ve yan etkiler
Nivalenolün insanlarda toksisitesi henüz bilinmeyen çoğu kısım içindir, ancak farelerde, sıçanlarda ve hamster hücrelerinde araştırılmıştır. Böylelikle toksisite şu başlıklara ayrılmıştır: akut / subakut, subkronik, kronik ve kanserojenite, genotoksisite, gelişimsel toksisite çalışmaları ve üreme, immünotoksisite / hematotoksisite ve sinir sistemi üzerindeki etkiler üzerine çalışmalar.
Akut / subakut toksisite
Sözlü LD50 Nivalenolün farelerde 38.9 mg / kg canlı ağırlıkta olduğu bulunurken, intraperitonal, subkutanöz ve intravenöz maruziyet yolları LD50 değerler 5-10 mg / kg bw. Farelerde zaten 3 gün içinde ölümlerin çoğu, belirgin tıkanıklık yoluyla oral maruziyetten sonra meydana geldi ve kanama bağırsakta, akut toksisitede lenfoid organlar da dahildir. Daha düşük dozlarda (yaklaşık 3,5 mg / kg canlı ağırlık) 24 günlük zaman aralıklarında verilen nivalenol, anlamlı eritropeni ve hafif lökopeni.[20]
Subkronik toksisite
Subkronik toksisite, fareleri 4 veya 12 hafta boyunca günlük 0 ila 3.5 mg nivalenol / kg vücut ağırlığı dozu ile besleyerek test edilmiştir. 4 hafta sonra yapılan gözlemler, vücut ağırlığı ve gıda tüketiminde azalma oldu. Vücut ağırlığındaki azalma, timüs, dalak ve böbreklerde organ ağırlığındaki istatistiksel azalma ile açıklanabilir. Dişi farelerde erkek farelere göre tüketim süresi daha kısadır. 12 hafta sonra toksin tüketimi, hem erkeklerde hem de kadınlarda nispi organ ağırlığının azalmasına neden oldu. Böylelikle sadece karaciğer etkilenmiştir ve histopatolojik değişiklikler gözlendi.[20]
Kronik toksisite ve kanserojenlik
Dişi fareler, nivalenolün kronik toksik ve / veya kanserojen olup olmadığını araştırmak için bir veya iki yıl boyunca farklı dozlarda nivalenol (0, 0.7, 1.4 veya 3.5 mg nivalenol / kg vücut ağırlığı) ile beslendi. Ayrıca bu çalışma sırasında canlı ağırlık ve yem tüketiminde azalma gözlemlendi. Hem karaciğerin hem de böbreğin mutlak ağırlığı, en yüksek iki dozla azaltıldı. Bir yıl boyunca nivalenol (ayrıca daha düşük dozlarla) ile beslenen fareler şiddetli lökopeni ile etkilenirken, iki yıl boyunca beslenen farelerde beyaz kan hücrelerinin sayısında hiçbir fark yoktu. Ayrıca "karaciğer, timus, dalak, böbrekler, mide, adrenal bezler, hipofiz bezleri, yumurtalıklar, kemik iliği, lenf düğümü, beyin ve ince bağırsaklarda tümörler dahil olmak üzere hiçbir histopatolojik değişiklik bulunmadı. Peyer yaması ".[20] En düşük dozlar (0.7 mg nivalenol / kg vücut ağırlığı) büyümeyi inhibe etti ve lökopeniye neden oldu. "Gözlenemeyen olumsuz etki düzeyi (NOAEL ) bu çalışmalardan türetilememiştir. IARC (1993), deney hayvanlarında nivalenolün karsinojenisitesine dair yetersiz kanıt olduğu sonucuna varmıştır. Hiçbir insan verisi mevcut değildi. Genel sonuç, kanserojenliğin sınıflandırılamayacağıdır (3. grup) ".[20]
Genotoksisite
Nivalenolün, Çin hamsteri V79 (CHO) hücrelerinin genlerini, kromozomal anormalliklerin ve kardeş kromatid değişiminin biraz daha yüksek frekansları ile etkilediği bulundu. DNA, CHO hücrelerinde ve farelerde hasar gördü. Farelerde (oral yoldan 20 mg nivalenol / kg canlı ağırlık veya 3,7 mg / kg canlı ağırlık ip olarak verilir) böbrek, kemik iliği, mide, jejunum ve kolon hasar gördü. Timus ve karaciğerin DNA'sı etkilenmedi. DNA hasarı olan organlarda hayır nekrotik histopatolojik incelemede değişiklikler bulundu. Mevcut verilere göre genotoksisitenin yeterli bir değerlendirmesine izin verilmediği sonucuna varılabilir.[20]
Gelişimsel toksisite ve üreme üzerine çalışmalar
Gelişim ve üreme çalışmaları için gebe farelere, gebeliğin 7-15. Günlerinde farklı miktarlarda saflaştırılmış nivalenol enjekte edildi ve ek bir çalışma için nivalenol içeren küflü pirinç kullanıldı. Çalışmalar, toksinin farelerde embriyotoksik olduğunu gösterdi. Kanıtı yok teratojenite verilmişti. " LOAEL oral maruziyetle verilen nivalenol ile yapılan üreme çalışmalarında, gebelik boyunca yemde verilen 1.4 mg / kg canlı ağırlık ve 7-15. günlerde gavaj yoluyla verildiğinde 5 mg / kg canlı ağırlık olduğu belirtilmiştir ".[20] Diğer türlerden ve yetişkin erkek ve dişilerde üreme etkilerine ilişkin veriler henüz sağlanmamaktadır.[20]
İmmünotoksisite / hematotoksisite
Nivalenolün akut toksisitesi, kemik iliği toksisitesine ve lenfoid organların toksisitesine neden olur. Uzun süreli maruz kalma, eritropeni ve / veya lökopeni. Farelerde nivalenolün serum varlığını arttırdığı da gözlendi. IgA, "insana benzer şekilde böbreklerde immünopatolojik değişiklikler eşliğinde IgA nefropati ".[20] Blastogenez kültürlenmiş insan lenfositlerinde, insan erkek ve dişi lenfositlerinin proliferasyonu, fitoheamagglutin ve Pokeweed ve pokeweed tarafından indüklenen immünoglobulin üretimi, nivalenol tarafından inhibe edilir. Nivalenolün etkileri, aynı dozlar ile aynı aralıktadır. deoksinivalenol oysa T-2 toksin 100 kat daha zehirlidir. Nivalenol ile kombine edilerek ilave bir etki elde edilir. T-2 toksin 4,15 diasetoksyscirpenol veya deoksinivalenol.[20]
Sinir sistemi üzerindeki etkiler
Sinir sistemi hakkında henüz hiçbir veri sağlanmadı.[20]
Referanslar
- ^ a b "Nivalenol". Cayman Kimyasal. Alındı 28 Mart 2018.
- ^ a b c d "Nivalenol". PubChem. Alındı 28 Mart 2018.
- ^ a b c d e f g h "Nivalenol" (PDF). Güvenlik Bilgi Formu. Alındı 28 Mart 2018.
- ^ a b c "Nivalenolün gıda ve yemlerde bulunması ile ilgili hayvan ve halk sağlığı riskleri üzerine Bilimsel Görüş". Avrupa Gıda Güvenliği Kurumu (EFSA) Dergisi. 11 (6): 1–5. 2013.
- ^ a b c Hedman, R .; Pettersson, H .; Lindberg, J.E. (2009). "Domuzlarda nivalenolün absorpsiyonu ve metabolizması". Archiv für Tierernaehrung. 50–1 (1): 13–24. doi:10.1080/17450399709386115. PMID 9205733.
- ^ EFSA CONTAM Paneli (EFSA Gıda Zincirindeki Kirleticiler Paneli) (2013). "Nivalenolün gıda ve yemdeki varlığıyla ilgili hayvan ve halk sağlığı risklerine ilişkin Bilimsel Görüş". EFSA Dergisi. 11 (6): 3262–119. doi:10.2903 / j.efsa.2013.3262.
- ^ Gupta, R. C., ed. (2015). Kimyasal Savaş Ajanlarının Toksikoloji El Kitabı. Akademik Basın. s. 353–369. ISBN 9780128001592.
- ^ Venkataramana, M .; Chandranayaka, S .; Prakash, H. S .; Niranja, R. (2014). "na, S. (2014). Biyolojik Savaşla İlgili Mikotoksinler ve Tespiti". Biyolojik Toksinler ve Biyoterörizm: 22. doi:10.1007/978-94-007-6645-7_32-1.
- ^ a b c McCormick, S. P .; Stanley, A. M .; Stover, N. A .; Alexander, N.J. (2011). "Trikotesenler: Basitten Karmaşık Mikotoksinlere". Toksinler. 3 (7): 802–814. doi:10.3390 / toksinler3070802. PMC 3202860. PMID 22069741.
- ^ a b c d Sidell, F. R .; Takafuji, E. T .; Franz, D.R. (1997). Kimyasal ve Biyolojik Savaşın Tıbbi Yönleri. Amerika Birleşik Devletleri Hükümeti Baskısı. pp. 662–664. ISBN 978-9997320919.
- ^ ABD Ulusal Tıp Kütüphanesi. "HSDB: Tehlikeli Maddeler Veri Bankası". Alındı 2018-03-23.
- ^ Deshmaneand, S. L .; Kremlev, S .; Amini, S .; Sawaya, B. E. (2009). "Monosit Kemoatraktan Protein-1 (MCP-1): Genel Bakış". İnterferon ve Sitokin Araştırmaları Dergisi. 29 (6): 313–326. doi:10.1089 / jir.2008.0027. PMC 2755091. PMID 19441883.
- ^ Nagashima, H .; et al. (2012). "Environ Toxicol Pharmacol". Çevresel Toksikoloji ve Farmakoloji. 34 (3): 1014–7. doi:10.1016 / j.etap.2012.07.008. PMID 22964157.
- ^ Deshmane, S. L .; et al. (2009). "Monosit kemoatraktan protein-1 (MCP-1): genel bakış". İnterferon ve Sitokin Araştırmaları Dergisi. 29 (6): 313–326. doi:10.1089 / jir.2008.0027. PMC 2755091. PMID 19441883.
- ^ Sugita-Konishi, Y .; Pestka, J. J. (2001). "Bir insan makrofaj modelinde deoksinivalenol (vomitoksin) ve diğer 8-ketotrikotekenler tarafından TNF-alfa, IL-6 ve IL-8 üretiminin diferansiyel yukarı regülasyonu". Toxicol Çevre Sağlığı A. 64 (8): 619–36. doi:10.1080/152873901753246223. PMID 11766169.
- ^ Minervini, F .; et al. (2004). "Bir insan eritrolösemi hücre hattında mikotoksinler nivalenol, deoksinivalenol ve fumonisin B1 tarafından indüklenen toksisite ve apoptoz". Vitro'da Toksikol. 18 (1): 21–8. doi:10.1016 / S0887-2333 (03) 00130-9. PMID 14630058.
- ^ Taranu, I .; et al. (2010). "Mikotoksinlere maruz kalan insan ve domuz lenfositlerinin in vitro proliferasyonunun karşılaştırmalı yönleri". Arch Anim Nutr. 64 (5): 383–93. doi:10.1080 / 1745039X.2010.492140. PMID 21114234. S2CID 20521758.
- ^ Sundstol Eriksen, G .; Pettersson, H .; Lundh, T. (2004). "Deoksinivalenol, nivalenol, bunların asetillenmiş türevleri ve de-epoksi metabolitlerinin karşılaştırmalı sitotoksisitesi". Gıda ve Kimyasal Toksikoloji. 42 (4): 619–624. doi:10.1016 / j.fct.2003.11.006. PMID 15019186.
- ^ Pettersson, H .; Hedman, R. (1997). "Çiftlik hayvanlarında nivalenolün toksisitesi ve metabolizması". Tahıl Araştırma İletişimi. Akadémiai Kiadó. 25–3 (3): 423–427. doi:10.1007 / BF03543746.
- ^ a b c d e f g h ben j k "Fusarium Toksinlerine İlişkin Gıda Bilimsel Komitesinin Görüşü Bölüm 41: Nivalenol" (PDF). Gıda Bilimsel Komitesi: 2–6. 2000.

