Oksaziridin - Oxaziridine - Wikipedia
 | |
 | |
 | |
| İsimler | |
|---|---|
| Tercih edilen IUPAC adı Oksaziridin | |
| Sistematik IUPAC adı 1-Oxa-2-azasiklopropan | |
| Diğer isimler Oksaaziridin[1] Oksazasiklopropan | |
| Tanımlayıcılar | |
3 boyutlu model (JSmol ) | |
| ChemSpider | |
PubChem Müşteri Kimliği | |
CompTox Kontrol Paneli (EPA) | |
| |
| |
| Özellikleri | |
| CH3NÖ | |
| Molar kütle | 45.041 g · mol−1 |
Aksi belirtilmedikçe, veriler kendi içlerindeki malzemeler için verilmiştir. standart durum (25 ° C'de [77 ° F], 100 kPa). | |
| Bilgi kutusu referansları | |

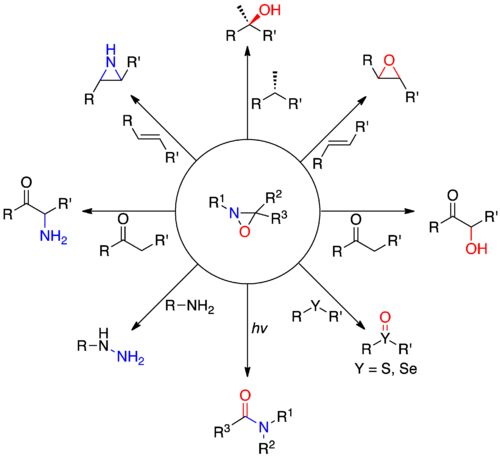
Bir oksaziridin bir organik molekül üç üyeli bir heterosikl oksijen, nitrojen ve karbon içerir. En büyük uygulamalarında oksaziridinler, endüstriyel üretimde ara ürünlerdir. hidrazin. Oksaziridin türevleri ayrıca organik kimyada, enolatların alfa hidroksilasyonu, olefinlerin epoksidasyonu ve aziridinasyonu ve diğer heteroatom transfer reaksiyonları dahil olmak üzere çeşitli oksidasyonlar için özel reaktifler olarak kullanılır. Oksaziridinler ayrıca amidlerin öncüleri olarak görev yaparlar ve ikame edilmiş beş üyeli heterosikller oluşturmak için çeşitli heterokümülenler ile [3 + 2] siklo-eklemelere katılırlar. Kiral oksaziridin türevleri, prokiral enolatlara ve diğer substratlara asimetrik oksijen transferini etkiler. Bazı oksaziridinler ayrıca nitrojenin ters çevrilmesine karşı yüksek bir bariyer özelliğine sahiptir ve nitrojen merkezinde kiralite olasılığına izin verir.
Tarih
Oksaziridin türevleri ilk olarak 1950'lerin ortalarında Emmons[2] ve daha sonra Krimm tarafından[3] ve Horner ve Jürgens.[4] Oksijen ve nitrojen tipik olarak nükleofiller yükseklerinden dolayı elektronegatiflik oksaziridinler izin verir elektrofilik her iki heteroatomun transferi. Bu olağandışı reaktivite, oldukça gerilmiş üç üyeli halkanın ve nispeten zayıf N-O bağının varlığından kaynaklanmaktadır. Nükleofiller, nitrojen ikame edicisi küçük olduğunda aziridin nitrojenine saldırmaya meyillidir (R1= H) ve oksijen atomunda, nitrojen ikame edicisi daha büyük olduğunda sterik yığın. Oksaziridin sisteminin olağandışı elektroniği, aşağıdakileri içeren ancak bunlarla sınırlı olmayan bir dizi oksijen ve nitrojen transfer reaksiyonunu gerçekleştirmek için kullanılabilir: a-hidroksilasyon enolates, epoksidasyon alkenlerin seçici oksidasyonu sülfitler ve Selenidler, aminasyon nın-nin N-nükleofiller ve N-asilamidasyon.
peroksit süreci endüstriyel üretim için hidrazin oksidasyon yoluyla amonyak ile hidrojen peroksit Ketonların varlığında 1970'lerin başında geliştirildi.[5][6]
Kiral kamforsülfoniloksaziridinlerin, bir kemoterapi ajanı olarak pazarlanan taksol gibi karmaşık ürünlerin sentezinde yararlı olduğu kanıtlanmıştır. İkisi de Holton Taxol toplam sentezi ve Wender Taxol toplam sentezi kamforsülfoniloksaziridin ile asimetrik a-hidroksilasyon özelliğine sahiptir.
Sentez
N-H, N-alkil, N-ariloksaziridinler
N-H, N-alkil ve N-ariloksaziridinlerin sentezine yönelik iki ana yaklaşım, iminler ile perasitler (A) ve aminasyonu karboniller (B).

Ek olarak, kiral iminlerin oksidasyonu ve iminlerin kiral perasitlerle oksidasyonu, enantiyopür oksaziridinleri verebilir. Bazı oksaziridinler, 100 ila 130 kJ / mol'lük bir inversiyon bariyeri nedeniyle oda sıcaklığında konfigürasyonel olarak kararlı nitrojen atomlarının benzersiz özelliğine sahiptir. Stereokimyanın tamamen konfigürasyonel olarak kararlı nitrojene bağlı olduğu enantiyopür oksaziridinler rapor edilir.[7]
Nsülfoniloksaziridinler
1970'lerin sonu ve 1980'lerin başında Franklin A. Davis ilkini sentezledi N-sülfoniloksaziridinler, yalnızca oksijen transfer reaktifleri olarak hareket eder ve günümüzde en baskın olarak kullanılan oksaziridin sınıfıdır.[8] Orijinal olarak sentezlenirken mCPBA ve faz transfer katalizörü benziltrimetilamonyum klorür, kullanılarak geliştirilmiş bir sentez okson oksidan şu anda en yaygın olanıdır.[9]
Günümüzde her biri biraz farklı özelliklere ve reaktiviteye sahip birçok N-sülfoniloksaziridin kullanılmaktadır. Bu reaktifler aşağıdaki tabloda özetlenmiştir.[10][11][12][13][14][15][16][17][18]

Perflorlu oksaziridinler
Yüksek elektron çekme ile perfloroalkil ikame edicileri oksaziridinler, reaktivite sergiler. dioksiranlar tipik oksaziridinlere göre.[19] Özellikle, perfloroalkiloksaziridinler, yüksek seçicilikle belirli C-H bağlarını hidroksile eder. Perflorlu oksaziridinler, perflorlu bir iminin, bir HF süpürücü olarak işlev görmesi için perflorometil florokarbonil peroksite ve bir metal florüre tabi tutulmasıyla sentezlenebilir.[19]

Tepkiler
Hidrazin üretimi
Oksaziridinler, peroksit süreci üretimi için hidrazin. Amonyağın varlığında oksitlendiği bir adımı içeren bu yöntemle yılda milyonlarca kilogram hidrazin üretilir. metil etil keton oksaziridin vermek için:[20]
- Ben (Et) C = O + NH3 + H2Ö2 → Ben (Et) CONH + H2Ö
Sonraki aşamalarda oksaziridin hidrazona dönüştürülür ve bu da hidrazin yolunda hemen ortaya çıkar:
- Ben (Et) CONH + NH3 → Ben (Et) C = NNH2 + H2Ö
Oksijen transferi
enolatların α-Hidroksilasyonu
α-Hidroksiketonlar veya asilinler, birçok doğal üründe bulunan önemli bir sentetik motiftir. a-Hidroksiketonlar, a-diketonların indirgenmesi, bir ayrılan grup için bir hidroksilin ikame edilmesi ve bir enolatın doğrudan oksidasyonu dahil olmak üzere birçok yolla sentezlenmiştir. Oksodiperoksimolibden (piridin) - (heksametilfosforik triamid) (MoOPH) ve N-sülfoniloksaziridinler, bu işlemde uygulanan en yaygın elektrofilik oksijen kaynaklarıdır. Kullanmanın bir avantajı N-sülfoniloksaziridinler, daha yüksek kiral indüksiyonun MoOPH ve diğer oksidanlara göre neredeyse değişmez bir şekilde gözlenmesidir.[21] Yüksek verim (% 77–91) ve dr (95: 5 - 99: 1) ile α-hidroksilasyon için rapor edilmiştir. Evans'ın kiral yardımcısı ile Nelektrofil olarak sülfoniloksaziridin.[21] Kiral indüksiyon, diğer birçok kiral keton ve keton ile gösterilmiştir. kiral yardımcı maddeler, dahil olmak üzere SAMP ve RAMP.[10]

Prokiral enolatların kamforsülfoniloksaziridin türevleri ile asimetrik hidroksilasyonu üzerine, orta ila yüksek seviyeye ulaşan kapsamlı çalışma bildirilmiştir. enantiyomerik fazlalık.[13] Bu stereokimyasal sonucu haklı çıkaran yaygın olarak kabul edilen önerilen geçiş durumu, R'nin sterik kütlesinin olduğu bir açık geçiş durumunu içerir.1 yaklaşımın yüzünü belirler.[10]

Bazı hidroksilasyonların seçiciliği, oksaziridin olarak oksaziridin halkasına alfa koordinasyon gruplarının eklenmesi ile bazı durumlarda büyük ölçüde iyileştirilebilir. 3b ve 3c yukarıdaki tabloda.[16] Bu durumlarda, reaksiyonun, metal oksianyonunun şu şekilde stabilize edildiği kapalı bir geçiş durumunda ilerlemesi önerilmektedir. şelasyon kafur iskeletindeki sülfat ve koordinasyon gruplarından.[10]

Oksaziridinlerle a-Hidroksilasyon, toplam sentezde geniş çapta uygulanmıştır. Her ikisinde de önemli bir adımdır. Holton Taxol toplam sentezi ve Wender Taxol toplam sentezi. Ek olarak, Forsyth dönüşümü C3-C14 (ikame edilmiş 1,7-Dioksaspiro [5.5] undec-3-ene) Sisteminin sentezinde gerçekleştirdi. okadaik asit.[22]

Alkenlerin epoksidasyonu
Epoksidasyon Alkenler, yaygın bir reaksiyondur çünkü epoksitler, birçok faydalı yolla türetilebilir. Klasik olarak laboratuar epoksidasyonu mCPBA veya diğer perasitler ile yapılır. Oksaziridinlerin, oldukça aside duyarlı epoksitlerin oluşumunda faydalı olduğu bulunmuştur.[7] (-) - Chaetominine, aşağıda görüldüğü gibi geç aşama dönüşümü olarak oksaziridin epoksidasyonu yoluyla sentezlenmiştir.[23]

Yüksek sentetik kullanımın bir başka dönüşümü, asimetrik epoksidasyon. Bir dizi asimetrik epoksidasyon mevcuttur: Keskin olmayan epoksidasyon, Jacobsen-Katsuki epoksidasyonu, ve Juliá-Colonna epoksidasyonu. Bu yöntemler, seçiciliği sağlamak için özel işlevsellik gerektirir. Sharpless epoksidasyon alilik alkollere özeldir, Jacobsen epoksidasyonu cis- ikame edilmiş aril alkenler ve Julia epoksidasyonu, α-β doymamış ketonlar. Kiral oksaziridinler yasası stereospesifik olarak birçok işlevsiz alken üzerinde.[7] Hatta stereospesifik epoksidasyonu katalitik olarak oksaziridin kiral biriminde etkilemek mümkündür. Enantiyometrik fazlalık seviyeleri büyük ölçekli sentez için pratik hale gelmeden önce bu reaksiyonlarla ilgili daha fazla araştırma yapılması gerekebilir. Lusinichi vd. aşağıda görülen stoikiometrik oksidan olarak okson kullanılarak kiral oksaziridinyum tuzu ile asimetrik epoksidasyonu araştırmışlardır.[24]

Aktifleştirilmemiş hidrokarbonların hidroksilasyonu
Perflorlu oksaziridinlerin, kayda değer bölgesel ve diastereospesifiklik ile aktive edilmemiş hidrokarbonları hidroksile ettiği bilinmektedir.[19] Bu oldukça göze çarpan bir dönüşümdür ve benzer reaktivite ve özgüllük nadiren rakip olur, özellikle oksidanın metalik olmayan doğası dikkate alındığında. Perflorlu oksaziridinler yüksek seçicilik gösterir. üçüncül hidrojenler. Birincil karbonların hidroksilasyonu ve iki oksitlenebilir bölge ile bir bileşiğin dihidroksilasyonu hiçbir zaman gözlenmemiştir. Stereokimyanın tutulması çok yüksektir, genellikle% 95 - 98'dir. (stereokimyanın retentonu, bir florür tuzunun eklenmesiyle daha da güçlendirilebilir).[25]

Azot transferi
Sübstitüe edilmemiş veya asillenmiş nitrojenlere sahip oksaziridinler, nitrojen atomu transferi yapabilir, ancak bu reaktivite önemli ölçüde daha az dikkat çekmiştir.[26]
Aminasyon Nnükleofiller
Nükleofillerin aminasyonu N- ikame edilmemiş oksaziridinler, olası nükleofiller ve karşılık gelen ürünler genişliğinde oldukça çok yönlüdür. Hidrazinler ikincil veya üçüncül aminlerin aminasyonundan türetilebilir, hidroksilamin ve tiyohidroksaminler karşılık gelenlerinden oluşturulabilir. alkoller ve tioller sülfimidler şunlardan oluşabilir: tiyoeterler ve a-aminoketonlar, karşılık gelen enolatların saldırısıyla oluşturulabilir.[27]

N-asilamidasyon
Asillenmiş aminlerin transferi, ikame edilmemiş aminlerden daha zordur, ancak oksaziridinlerle amin transferinden farklı olarak, asillenmiş aminleri doğrudan transfer eden alternatif yöntemler yoktur.[27] Asilamin transferi esas olarak nükleofiller olarak aminler ve hidrazinler kullanılarak gerçekleştirilmiştir. Literatürde bazıları mevcut olmasına rağmen, asillenmiş nitrojenlerin karbon nükleofillere çok az transferi başarıyla gerçekleştirilmiştir.[27]

Yeniden düzenlemeler
Oksaziridinlerin, bir yolla yeniden düzenleme reaksiyonlarına girdiği bulunmuştur. radikal mekanizma UV ışığı ile ışınlandığında veya Cu gibi tek bir elektron transfer reaktifi varlığındaben. spirositik oksaziridinler, karşılık gelen halka genişlemelerine maruz kalır. laktam.[28] Geçiş yapan ikame, bir stereoelektronik etki nitrojen üzerindeki yalnız çifte geçiş yapan grup her zaman baskın göç ürünü olacaktır.[29] Bu etkinin ışığında, yeniden düzenlemeyi yönlendirmek için yüksek inversiyon bariyerinden dolayı kiral nitrojenden yararlanmak mümkündür. Bu fenomen, aşağıdaki yeniden düzenlemelerde gözlemlenen seçiciliklerle gösterilmiştir. Soldaki yeniden düzenlemede termodinamik olarak Yalnızca istenmeyen ürün gözlenirken, sağdaki reaksiyonda daha az kararlı radikal ara maddeden türetilen ürün tercih edilir.[28]

Aubé, (+) - sentezinde anahtar adım olarak bu yeniden düzenlemeden yararlanır.yohimbin,[28] tarafından sınıflandırılan doğal bir ilaç NIH tedavisinde muhtemelen etkili erektil disfonksiyon ve neden olduğu cinsel sorunlar seçici serotonin geri alım inhibitörleri.[30]

Oksaziridinlerin termal olarak yeniden düzenleneceği de dikkate değerdir. nitronlar. Cis-trans Ortaya çıkan nitronun seçiciliği zayıftır, ancak verimler iyi ila mükemmeldir. Bazı oksaziridinlerin bir nitron ara ürünü yoluyla zamanla rasemize olduğu düşünülmektedir.[7]

Heterokümülenlerle döngüsel koşullar
Oksaziridinler geçirilir siklokasyon hetero ile reaksiyonlarkümülenler aşağıdaki şekilde gösterildiği gibi bir dizi benzersiz beş üyeli heterosikli sağlamak için. Bu reaktivite, gergin üç üyeli halka ve zayıf N-O bağından kaynaklanmaktadır.[7]

Referanslar
- ^ "CID 15817734 - PubChem Public Chemical Database". PubChem Projesi. ABD: Ulusal Biyoteknoloji Bilgi Merkezi.
- ^ Emmons, W.D. (1956). "Oksaziranların Sentezi". J. Am. Chem. Soc. 78 (23): 6208. doi:10.1021 / ja01604a072.
- ^ Krimm, Heinrich (1958). "Über Isonitrone". Chemische Berichte (Almanca'da). 91 (5): 1057–1068. doi:10.1002 / cber.19580910532. ISSN 0009-2940.
- ^ Horner, L .; Jürgens, E. (1957). "Notiz Über Darstellung und Eigenschaften Einiger Isonitrone (Oxazirane)". Chemische Berichte. 90 (10): 2184. doi:10.1002 / cber.19570901010.
- ^ BİZE 3972878 Schirmann, Jean-Pierre; Jean Combroux & Serge Yvon Delavarenne, "Azinler ve hidrazonları hazırlama yöntemi", 1976-08-03'te yayınlanan, Produits Chimiques Ugine Kuhlmann'a atandı. BİZE 3978049 Schirmann, Jean-Pierre; Pierre Tellier & Henri Mathais ve diğerleri, 1976-08-31'de yayınlanan "hidrazin bileşiklerinin hazırlanması için işlem", Produits Chimiques Ugine Kuhlmann'a verilmiştir..
- ^ BİZE 4724133 Schirmann, Jean-Pierre; Jean Combroux & Serge Y. Delavarenne, "Konsantre sulu hidrazin hidrat çözeltisinin hazırlanması", 1988-02-09 tarihinde Atochem'e devredilmiştir..
- ^ a b c d e Davis, F.A .; Sheppard, A.C. (1989). "Oksaziridinlerin organik sentezdeki uygulamaları". Tetrahedron. 45 (18): 5703. doi:10.1016 / s0040-4020 (01) 89102-x.
- ^ Davis, F.A .; Stringer, O. D. (1982). "Oksaziridinlerin kimyası. 2. 2-sülfoniloksaziridinlerin geliştirilmiş sentezi". Organik Kimya Dergisi. 47 (9): 1774. doi:10.1021 / jo00348a039.
- ^ Davis, F.A .; Chattopadhyay, S .; Towson, J. C .; Lal, S .; Reddy, T. (1988). "Oksaziridinlerin kimyası. 9. 2-sülfonil- ve 2-sülfamiloksaziridinlerin potasyum peroksimonosülfat (okson) kullanılarak sentezi". Organik Kimya Dergisi. 53 (9): 2087. doi:10.1021 / jo00244a043.
- ^ a b c d Davis, F.A .; Chen, B.C. (1992). "Enolatların N-sülfoniloksaziridinlerle asimetrik hidroksilasyonu". Chem. Rev. 92 (5): 919. doi:10.1021 / cr00013a008.
- ^ Davis, F.A .; Jenkins, R. H .; Awad, S. B .; Stringer, O. D .; Watson, W. H .; Galloy, J. (1982). "Oksaziridinlerin kimyası. 3. Organosülfür bileşiklerinin kiral 2-sülfoniloksaziridinler kullanılarak asimetrik oksidasyonu". Amerikan Kimya Derneği Dergisi. 104 (20): 5412. doi:10.1021 / ja00384a028.
- ^ Davis, F.A .; Reddy, R. T .; McCauley, J. P .; Przeslawski, R. M .; Harakal, M. E .; Carroll, P.J. (1991). "Oksaziridinlerin kimyası. 15. 3-ikameli 1,2-benzizotiyazol 1,1-dioksit oksitlerin kullanıldığı asimetrik oksidasyonlar". Organik Kimya Dergisi. 56 (2): 809. doi:10.1021 / jo00002a056.
- ^ a b Towson, J. C .; Weismiller, M. C .; Lal, S. G .; Sheppard, A. C .; Davis, F.A. (1990). "(+) - (2R, 8aS) -10- (KAMPHORİLSÜLFONİL) OKSAZİRİDİN". Org. Synth. 69: 158. doi:10.15227 / orgsyn.069.0158.
- ^ Davis, F.A .; Towson, J. C .; Weismiller, M. C .; Lal, S .; Carroll, P.J. (1988). "Oksaziridinlerin kimyası. 11. (Kafurilsülfonil) oksaziridin: sentez ve özellikler". Amerikan Kimya Derneği Dergisi. 110 (25): 8477. doi:10.1021 / ja00233a025.
- ^ Bach, R. D .; Coddens, B. A .; McDouall, J. J. W .; Schlegel, H.B .; Davis, F.A. (1990). "Oksaziridinden bir sülfite ve bir sülfoksite oksijen transferinin mekanizması: teorik bir çalışma". Organik Kimya Dergisi. 55 (10): 3325. doi:10.1021 / jo00297a062.
- ^ a b Davis, F.A .; Kumar, A .; Chen, B.C. (1991). "Oksaziridinlerin kimyası. 16. (+) - [(8,8-dimetoksikamforil) sülfonil] oksaziridin kullanılarak .gamma.-rodomycionone ve a-sitromisinonun AB-halka segmentlerinin kısa, yüksek oranda enantiyoselektif bir sentezi". Organik Kimya Dergisi. 56 (3): 1143. doi:10.1021 / jo00003a042.
- ^ Davis, F.A .; Weismiller, M. C .; Lal, G. S .; Chen, B. C .; Przeslawski, R.M. (1989). "Yeni optik olarak saf (kamforilsülfonil) oksaziridin türevlerinin sentezinde (Kafurilsülfonil) imin dianyonu". Tetrahedron Mektupları. 30 (13): 1613. doi:10.1016 / s0040-4039 (00) 99534-0.
- ^ Chen, B. C .; Weismiller, M. C .; Davis, F.A .; Boschelli, D .; Empfield, J. R .; Smith, A.B. (1991). "(+) - kjellmanianonun enantiyoselektif sentezi". Tetrahedron. 47 (2): 173–82. doi:10.1016 / S0040-4020 (01) 80914-5.
- ^ a b c Petrov VA, Resnati, G (1996). "Poliflorlu Oksaziridinler: Sentez ve Reaktivite". Kimyasal İncelemeler. 96 (5): 1809. doi:10.1021 / cr941146h.
- ^ Jean-Pierre Schirmann, Paul Bourdauducq "Hydrazine" Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. doi:10.1002 / 14356007.a13_177.
- ^ a b Evans, D. A .; Morrissey, M. M .; Dorow, R.L. (1985). "Şiral imid enolatların asimetrik oksijenasyonu. Enantiyomerik olarak saf a-hidroksi karboksilik asit sintonlarının sentezine genel bir yaklaşım". Amerikan Kimya Derneği Dergisi. 107 (14): 4346. doi:10.1021 / ja00300a054.
- ^ Dounay, Amy B .; Forsyth, Craig J. (1999). "Okadaik Asitin C3 − C14 (ikame edilmiş 1,7-Dioksaspiro [5.5] undec-3-ene) Sisteminin Kısaltılmış Sentezi". Org. Lett. 1 (3): 451. doi:10.1021 / ol9906615.
- ^ Malgesini, Beatrice; Forte, Barbara; Borghi, Daniela; Quartieri, Francesca; Gennari, Cesare; Papeo Gianluca (2009). "(-) - Chaetomininin Basit Toplam Sentezi". Chem. Avro. J. 15 (32): 7922. doi:10.1002 / chem.200900793.
- ^ Bohé, Luis; Hanquet, Gilles; Lusinchi, Marie; Lusinchi, Xavier (1993). "Yeni bir kiral oksaziridinyum tuzunun stereospesifik sentezi". Tetrahedron Mektupları. 34 (45): 7271. doi:10.1016 / S0040-4039 (00) 79306-3.
- ^ Arnone, Alberto; Foletto, Stefania; Metrangolo, Pierangelo; Pregnolato, Massimo; Resnati, Giuseppe (1999). "Aktive Edilmemiş Hidrokarbon Sitelerinin Perfloro-cis-2-n-butil-3-n-propiloksaziridin ile Yüksek Derecede Enantiospesifik Oksifonksiyonelleştirilmesi". Org. Lett. 1 (2): 281. doi:10.1021 / ol990594e.
- ^ Schmitz, E .; Ohme, R. (1964). "Isomere Oxime mit Dreiringstruktur". Chem. Ber. 97 (9): 2521. doi:10.1002 / cber.19640970916.
- ^ a b c Andreae, S .; Schmitz, E. (1991). "ChemInform Özet: Oksaziridinlerle Elektrofilik Aminasyonlar". ChemInform. 22 (46): 327. doi:10.1002 / chin.199146339.
- ^ a b c Aubé, Jeffrey (1997). "Asimetrik sentezde oksiziridin yeniden düzenlemeleri". Chemical Society Yorumları. 26 (4): 269. doi:10.1039 / CS9972600269.
- ^ Lattes, Armand; Oliveros, Esther; Riviere, Monique; Belzeck, Czeslaw; Mostowicz, Danuta; Abramskj, Wojciech; Piccinni-Leopardi, Carla; Germain, Gabriel; Van Meerssche Maurice (1982). "Oksaziridinlerin fotokimyasal ve termal yeniden düzenlenmesi. Stereoelektronik kontrol teorisini destekleyen deneysel kanıtlar". Amerikan Kimya Derneği Dergisi. 104 (14): 3929. doi:10.1021 / ja00378a024.
- ^ "Yohimbe: MedlinePlus Takviyeler". nlm.nih.gov. 19 Kasım 2010. Alındı 13 Aralık, 2010.