Lityum peroksit - Lithium peroxide
 | |
 | |
| İsimler | |
|---|---|
| Diğer isimler Dilithium peroksit, Lityum (I) peroksit | |
| Tanımlayıcılar | |
3 boyutlu model (JSmol ) | |
| ChemSpider | |
| ECHA Bilgi Kartı | 100.031.585 |
PubChem Müşteri Kimliği | |
| UNII | |
CompTox Kontrol Paneli (EPA) | |
| |
| |
| Özellikleri | |
| Li2Ö2 | |
| Molar kütle | 45.881 g / mol |
| Görünüm | ince, beyaz toz |
| Koku | kokusuz |
| Yoğunluk | 2,31 g / cm3[1][2] |
| Erime noktası | Ayrışır Li2Ö ~ 340 ° C'de [3] |
| Kaynama noktası | NA |
| çözünür | |
| Çözünürlük | içinde çözülmez alkol |
| Yapısı | |
| altıgen | |
| Termokimya | |
Std entalpisi oluşum (ΔfH⦵298) | -13,82 kJ / g |
| Tehlikeler | |
| listelenmemiş | |
| NFPA 704 (ateş elması) | |
Aksi belirtilmedikçe, veriler kendi içlerindeki malzemeler için verilmiştir. standart durum (25 ° C'de [77 ° F], 100 kPa). | |
| Bilgi kutusu referansları | |
Lityum peroksit ... inorganik bileşik ile formül Li2Ö2. Bu bir beyaz higroskopik olmayan katı. Yüksek oksijen: kütle ve oksijen: hacim oranları nedeniyle, katı CO 'yu gidermek için kullanılmıştır.2 atmosferden uzay aracı.[4]
Hazırlık
Reaksiyonu ile hazırlanır hidrojen peroksit ve lityum hidroksit. Bu reaksiyon başlangıçta lityum üretir hidroperoksit:[4][5]
- LiOH + H2Ö2 → LiOOH + 2 H2Ö
Bu lityum hidroperoksit ayrıca lityum peroksit monoperoksohidrat trihidrat (Li2Ö2· H2Ö2· 3H2O) Bu malzemenin dehidrasyonu susuz peroksit tuzunu verir:
- 2 LiOOH → Li2Ö2 + H2Ö2 + 2 H2Ö
Li2Ö2 vermek için yaklaşık 450 ° C'de ayrışır lityum oksit:
- 2 Li2Ö2 → 2 Li2O + O2
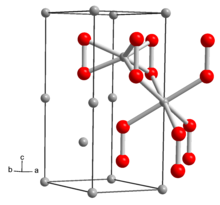
Katı Li'nin yapısı2Ö2 tarafından belirlendi X-ışını kristalografisi ve Yoğunluk fonksiyonel teorisi. Katı, tutulmuş "etan benzeri" bir Li'ye sahiptir.6Ö2 O-O mesafesi yaklaşık 1,5 Å olan alt birimler.[6]
Kullanımlar
Ağırlığın önemli olduğu hava temizleyicilerde, örneğin, karbondioksiti absorbe etmek ve reaksiyonda oksijeni serbest bırakmak için uzay aracı:[4]
- 2 Li2Ö2 + 2 CO2 → 2 Li2CO3 + O2
Daha fazla CO emer2 aynı ağırlıkta olduğundan lityum hidroksit ve oksijen salma bonusu sunar.[7] Ayrıca, diğer çoğu alkali metal peroksitin aksine, higroskopik.
Tersinir lityum peroksit reaksiyonu bir prototipin temelidir lityum havalı pil. Atmosferdeki oksijenin kullanılması, pilin reaksiyonu için oksijen depolanmasını ortadan kaldırarak pilin ağırlığını ve boyutunu azaltır.[8]
Bir lityum hava pilinin başarılı kombinasyonu, hava geçirgen bir ağ ile örtülür Güneş pili Ohio Eyalet Üniversitesi tarafından 2014 yılında ilan edildi.[9] Bir cihazda iki fonksiyonun (bir "güneş pili") kombinasyonunun, şu anda kullanılan ayrı cihazlara ve kontrol cihazlarına kıyasla maliyetleri önemli ölçüde azaltması beklenmektedir.
Ayrıca bakınız
Referanslar
- ^ "İnorganik Bileşiklerin Fiziksel Sabitleri" CRC Handbook of Chemistry and Physics, 91. Baskı (İnternet Versiyonu 2011), W. M. Haynes, ed., CRC Press / Taylor ve Francis, Boca Raton, Florida. (s: 4-72).
- ^ Speight, James G. (2005). Lange's Handbook of Chemistry (16. Baskı). (s: 1.40). McGraw-Hill. Çevrimiçi versiyon şu adreste mevcuttur: http://www.knovel.com/web/portal/browse/display?_EXT_KNOVEL_DISPLAY_bookid=1347&VerticalID=0
- ^ Phys.Chem.Chem.Phys., 2013, 15, 11025. doi:10.1039 / c3cp51056e
- ^ a b c Greenwood, Norman N.; Earnshaw, Alan (1984). Elementlerin Kimyası. Oxford: Pergamon Basın. s. 98. ISBN 978-0-08-022057-4.
- ^ E. Dönges "Lityum ve Sodyum Peroksitler" Handbook of Preparative Inorganic Chemistry, 2. Baskı. G. Brauer, Academic Press, 1963, NY tarafından düzenlenmiştir. Cilt 1. s. 979.
- ^ L. G. Cota ve P. de la Mora "Lityum peroksitin yapısı hakkında, Li2Ö2"Açta Crystallogr. 2005, cilt B61, sayfalar 133-136. doi:10.1107 / S0108768105003629
- ^ Ulrich Wietelmann, Richard J. Bauer "Lityum ve Lityum Bileşikleri" Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH: Weinheim. doi:10.1002 / 14356007.a15_393.pub2
- ^ Girishkumar, G .; B. McCloskey; AC Luntz; S. Swanson; W. Wilcke (2 Temmuz 2010). "Lityum hava pil: Vaatler ve zorluklar". Fiziksel Kimya Mektupları Dergisi. 1 (14): 2193–2203. doi:10.1021 / jz1005384.
- ^ [1] The Ohio State University'de icat edilen patenti beklemede olan cihaz: dünyanın ilk güneş pili.

