Subventriküler bölge - Subventricular zone
| Subventriküler bölge | |
|---|---|
| Tanımlayıcılar | |
| NeuroLex İD | nlx_144262 |
| Nöroanatominin anatomik terimleri | |
subventriküler bölge (SVZ) her birinin dış duvarında yer alan bir bölgedir. Lateral ventrikül of omurgalı beyin.[2] Hem embriyonik hem de yetişkin beyinde bulunur. Embriyonik yaşamda, SVZ, nöral içeren ikincil bir proliferatif bölgeyi ifade eder. Öncü hücreler üretmek için bölünen nöronlar sürecinde nörojenez.[3] Birincil sinir kök hücreler beyin ve omurilik radyal glial hücreler yerine ventriküler bölge (VZ) (sözde çünkü VZ gelişmekte olan ventriküller ).[4]
Gelişmekte olan beyin zarı dorsalde bulunan telensefalon SVZ ve VZ, erişkinde bulunmayan geçici dokulardır.[4] Bununla birlikte, ventral telensefalonun SVZ'si yaşam boyunca devam eder. Yetişkin SVZ, dört farklı katmandan oluşur[5] değişken kalınlık ve hücre yoğunluğunun yanı sıra hücresel kompozisyon. İle birlikte dentat girus of hipokamp SVZ, şu iki yerden biridir: nörojenez yetişkin memeli beyninde meydana geldiği bulunmuştur.[6] Yetişkin SVZ nörojenezi şeklini alır nöroblast öncülleri internöronlar göç eden koku soğanı içinden rostral göçmen akışı. SVZ, aynı zamanda astrositler beyin hasarının ardından.[7]
Yapısı
Katman I
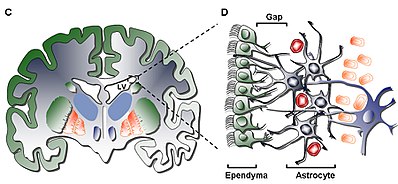
En içteki katman (Katman I), tek bir katman (tek katman) içerir. ependimal ventriküler boşluğu kaplayan hücreler; bu hücreler apikal kirpikler ve ventriküler yüzeye paralel veya dik durabilen birkaç bazal genişlemeye sahiptir. Bu genişletmeler, astrositik hiposelüler katmanla (Katman II) birbirine bağlı süreçler.[5]
Katman II
İkincil katman (Katman II), öncekine bitişik bir hiposelüler boşluk sağlar ve fonksiyonel olarak ilişkilendirilmiş bir Glial Fibriler Asit Proteini (GFAP ) -birleşme komplekslerine bağlı pozitif astrositik süreçler, ancak nadir nöronal somata dışında hücre gövdelerinden yoksundur. Bu katmanın işlevi henüz insanlarda bilinmemekle birlikte, astrositik ve ependimal Katman I ve II'nin ara bağlantıları, nöronal fonksiyonları düzenlemek, metabolik homeostaz ve / veya kontrol nöronal kök hücre çoğalma ve farklılaşma geliştirme sırasında. Potansiyel olarak, katmanın bu tür özellikleri, erken gelişimsel yaşamın geri kalanı veya hücresel göç için bir yol olarak hareket edebilir. homolog Sığır SVZ'deki katman, yalnızca üst düzey memelilerde ortak olan göçmen hücrelere sahip olduğu gösterilmiştir.[5]
Katman III
Üçüncü katman (Katman III) bir şerit oluşturur astrosit in vivo çoğalabilen ve multipotent oluşturabilen bir astrosit alt popülasyonunu sürdürdüğüne inanılan hücre gövdeleri nöroosferler in vitro kendini yenileme yetenekleri ile. Bazıları oligodendrositler ve ependimal şerit içinde hücreler bulunmuştur, sadece bilinmeyen bir işleve hizmet etmekle kalmaz, aynı zamanda popülasyonuna kıyasla nadirdir. astrositler katmanda bulunan. astrositler Katman III'te bulunanlar, üç popülasyona ayrılabilir. elektron mikroskobu henüz tanınabilir benzersiz işlevleri olmayan; ilk tip, çoğunlukla II. Tabaka'da bulunan uzun, yatay, teğetsel projeksiyonlardan oluşan küçük bir astrosittir; ikinci tür, II. ve III. Katmanlar arasında ve ayrıca büyük boyutu ve birçok organeliyle karakterize olan astrosit şeridinde bulunur; üçüncü tip tipik olarak lateral ventriküllerde bulunur. hipokamp ve boyut olarak ikinci türe benzer, ancak çok az organel içerir.[5]
Katman IV
Dördüncü ve son katman (Katman IV), katmanı ile Katman III arasında bir geçiş bölgesi olarak hizmet eder. astrositler ve beyin parankim. Yüksek mevcudiyetiyle tanımlanır miyelin bölgede.[5]
Hücre türleri
SVZ'de dört hücre türü açıklanmaktadır:[8]
1. Kirpikli Ependimal Hücreler (Tip E): ventrikülün lümenine bakacak şekilde konumlandırılırlar ve Beyin omurilik sıvısı.
2. Çoğalan Nöroblastlar (Tip A): PSA-NCAM (NCAM1 ), Tuj1 (TUBB3 ) ve Hu ve satır sırasına göre Olfaktör Ampul
3. Yavaş Çoğalan Hücreler (B Tipi): ekspres Nestin ve GFAP ve göç eden Tip A'yı örtme işlevi Nöroblastlar[9]
4. Aktif Olarak Çoğalan Hücreler veya Transit Güçlendirici Atalar (Tip C): Nestin'i ifade eder ve bölge boyunca zincirler arasında aralıklarla kümeler oluşturur[10]
Fonksiyon
SVZ, bilinen bir sitedir nörojenez ve kendini yenileyen nöronlar yetişkinde beyin,[11] etkileşen hücre tipleri, hücre dışı moleküller ve lokalize olması nedeniyle hizmet veriyor epigenetik düzenleme bu tür hücresel çoğalmayı teşvik etmek. İle birlikte yeraltı bölgesi of dentat girus, subventriküler bölge bir kaynak olarak hizmet eder nöral kök hücreler (NSC'ler) yetişkin sürecinde nörojenez. Kemirgenlerin, maymunların ve insanların yetişkin beynindeki en büyük çoğalan hücre popülasyonunu barındırır.[12] 2010 yılında, sinir sistemi arasındaki dengenin kök hücreler ve sinirsel Öncü hücreler (NPC'ler) arasındaki bir etkileşim ile sürdürülür. Epidermal büyüme faktörü reseptör sinyal yolu ve Notch sinyali patika.[13]
Henüz insan beyninde derinlemesine çalışılmamış olsa da, kemirgen beynindeki SVZ işlevi, yetenekleri açısından bir dereceye kadar incelenmiş ve tanımlanmıştır. Böyle bir araştırmayla, ikili işleyişin astrosit kemirgen SVZ'sindeki baskın hücredir; bu astrosit sadece nöronal bir kök hücre olarak değil, aynı zamanda destekleyici bir hücre olarak da işlev görür. nörojenez diğer hücrelerle etkileşim yoluyla.[8] Bu fonksiyon aynı zamanda mikroglia ve endotelyal in vitro nörojenezi desteklemek için nöronal kök hücrelerle işbirliği içinde etkileşime giren hücreler ve tenasin-C gibi hücre dışı matris bileşenleri (etkileşim için sınırların tanımlanmasına yardımcı olur) ve Lewis X (büyüme ve sinyal faktörlerini nöral öncüllere bağlar).[14] Bununla birlikte, insan SVZ'si, kemirgen SVZ'sinden iki farklı şekilde farklıdır; birincisi, insanların astrositlerinin astrositlerle yakın yan yana olmadıklarıdır. ependimal hücre gövdesinden yoksun bir katmanla ayrılmış katman; ikincisi, insan SVZ'sinin göç etme zincirlerinden yoksun olmasıdır. nöroblastlar kemirgen SVZ'de görülen, sırayla insanda kemirgenden daha az sayıda nöron hücresi sağlar.[2] Bu nedenle, kemirgen SVZ, SVZ ve onun yapı-işlev ilişkisi ile ilgili değerli bir bilgi kaynağı olduğunu kanıtlarken, insan modeli önemli ölçüde farklı olacaktır.
Epigenetik DNA değişikliklerin düzenlenmesinde merkezi bir rolü vardır gen ifadesi farklılaşması sırasında nöral kök hücreler. Dönüşümü sitozin -e 5-metilsitozin (5mC) DNA'da DNA metiltransferaz DNMT3A, SVZ'de meydana gelen önemli bir epigenetik modifikasyon türü gibi görünmektedir.[15]
Ek olarak, bazı güncel teoriler, SVZ'nin beyin tümörü kök hücreleri (BTSC'ler) için bir proliferasyon bölgesi olarak da hizmet edebileceğini öne sürmektedir.[16] yapıları ve farklılaşma yetenekleri bakımından nöral kök hücrelere benzeyen nöronlar, astrositler, ve oligodendrositler. Çalışmalar, küçük bir BTSC popülasyonunun sadece tümör üretemeyeceğini, aynı zamanda doğuştan gelen kendini yenileme ve çok potansiyelli yetenekleri. Bu, BTSC'lerin nöral kök hücrelerden kaynaklandığına dair bir çıkarıma izin vermezken, kendi hücrelerimizden bu kadar çok hasara neden olabilecek hücreler ile var olan ilişki konusunda ilginç bir soru ortaya çıkarıyor.[kaynak belirtilmeli ]
Güncel araştırma
Şu anda kamu ve özel sektördeki bireyler tarafından araştırılan SVZ'nin birçok farklı yönü vardır. Bu tür araştırma ilgi alanları, SVZ'nin nörojenez, daha önce bahsedilen nöronal göçü yönlendirdi tümörijenez ve diğerleri gibi. Aşağıda, esas olarak SVZ'nin bir yönüne odaklanan üç farklı laboratuvar grubunun çalışmalarının özetleri bulunmaktadır; bunlara beyin hasarından sonra hücre replasmanında SVZ'nin rolü, NSC proliferasyonunun simülasyonu ve çeşitli tümörijenik kanserlerde rol dahildir.
Beyin hasarından sonra hücre değişimindeki rol
İncelemelerinde Romanko et al. akut beyin hasarının SVZ üzerindeki etkisini karakterize etti. Genel olarak yazarlar, SVZ'ye orta derecede hakaretlerin iyileşmeye izin verirken, daha ciddi yaralanmaların bölgede kalıcı hasara neden olduğunu belirlediler. Ek olarak, SVZ içindeki nöral kök hücre popülasyonu muhtemelen bu yaralanma tepkisinden sorumludur.[17]
Etkileri ışınlama Verilebilecek radyasyon miktarının veya dozunun tanınması için sağlanan SVZ'de, çoğunlukla radyasyonun yakınındaki normal hücrelerin toleransı tarafından belirlenir. tümör. Açıklandığı gibi, artan radyasyon dozu ve yaş, SVZ'nin üç hücre tipinde azalmaya yol açtı, ancak SVZ'nin onarım kapasitesi eksikliğine rağmen gözlendi. Beyaz madde nekroz; bu büyük olasılıkla SVZ'nin nöroglia beynin. Kemoterapötikler Ayrıca, şu anda birçok hastalık için kullanılmalarına rağmen, Merkezi sinir sistemi. Böyle yaparak, metotreksat (MTX), SVZ'nin toplam nükleer yoğunluğunun yaklaşık% 70'inin tükendiğini, ancak yine de kayıp olduğunu bulmak için tek başına ve radyasyonla birlikte kullanıldı. nöroblast hücreler (öncü hücreler), SVZ NSC'lerinin hala nöroosferler böyle bir tedavi görmeyen deneklere benzer. Beyne kan tedarikinin kesintiye uğraması ile ilgili olarak, beyin hipoksi /iskemi (H / I) 'nin ayrıca SVZ'nin hücre sayısını% 50 azalttığı bulunmuştur. nöronlar içinde striatum ve neokorteks yok edildi, ancak öldürülen SVZ'nin hücre tipleri, bölgenin kendisi kadar tek tip değildi. Sonraki testin ardından, her hücrenin farklı bir kısmının elimine edildiği, ancak orta SVZ hücre popülasyonunun çoğunlukla canlı kaldığı bulundu. Bu, bu tür hücrelerin belirli bir esnekliğini sağlayabilir; taahhüt edilmemiş progenitör hücreler, aşağıdaki proliferasyon popülasyonu olarak işlev görür. iskemi. Mekanik beyin hasarı ayrıca kemirgenlerde gözlemlendiği gibi hücre göçünü ve proliferasyonunu da tetikler ve ayrıca hücre sayısını artırarak, yeni nöronal hücrelerin üretilemeyeceği şeklindeki daha önce kabul edilen fikri geçersiz kılar.[kaynak belirtilmeli ]
Sonuç olarak, bu grup SVZ'deki hücrelerin yeni hücreler üretebildiğini belirleyebildi. nöronlar ve glia herhangi bir zararlı etkiye duyarlı olduğu için ömür boyu zarar görmez. Bu nedenle, SVZ, hafif yaralanmanın ardından kendi kendine iyileşebilir ve potansiyel olarak beynin diğer etkilenen bölgelerine replasman hücre tedavisi sağlayabilir.[kaynak belirtilmeli ]
Nörojenezde nöropeptid Y'nin rolü
Subventriküler bölgedeki nöronal hücrelerin proliferasyonu ile ilgili mekanizmayı karakterize etme ve analiz etme girişiminde, Decressac et al. fare subventriküler bölgesinde nöral öncülerin proliferasyonunu nöropeptid Y (NPY).[18] NPY, daha önce nöronal hücrelerin proliferasyonunu uyardığı gösterilen merkezi sinir sisteminin yaygın olarak ifade edilen bir proteinidir. koku alma epitel ve hipokamp. peptid 'Nin etkileri aracılığıyla gözlemlendi BrdU etiketleme ve hücre fenotipleme göçü için kanıt sağlayan nöroblastlar içinden rostral göçmen akışı için koku soğanı (önceki deneyleri doğrulayan) ve striatum. Bu tür veriler yazarın hipotezini destekler: nörojenez böyle bir peptid.[kaynak belirtilmeli ]
NPY 36 olduğu için amino asit peptid birçok fizyolojik ve patolojik durumla ilişkili, birden fazla reseptörler gelişmekte olan ve olgun kemirgen beyninde geniş bir şekilde ifade edilen. Ancak verilen in vivo Bu grup tarafından yapılan çalışmalarda, Y1 reseptörü, subventriküler bölgede artan ekspresyon ile NPY'nin indüksiyonu yoluyla spesifik olarak aracılık edilen nöroproliferatif etkiler gösterdi. Y1 reseptörünün tanımlanması, bu tür mitotik olaylardan ifade edilen hücrelerin fenotipinin aslında DCX + (nöroblastlar doğrudan göç eden striatum ) yazın. NPY enjeksiyonunun striatal üzerindeki etkileri ile birlikte dopamin, GABA ve glutamat düzenlenecek parametreler nörojenez subventriküler bölgede (önceki çalışma), bu bulgu yukarıda belirtilen ikincil modülatör olabileceği için hala dikkate alınmaktadır. nörotransmiterler.[kaynak belirtilmeli ]
Tüm araştırmalar için gerekli olduğu üzere, bu grup deneylerini, subventriküler bölge nöral kök hücre çoğalmasının uyarılması yoluyla potansiyel olarak endojen beyin onarımı için potansiyel adaylara fayda sağlayabileceğini iddia ettikleri bulgularının uygulanmasına geniş bir perspektifle yürüttü. Yetişkin nörojenezinin bu doğal moleküler düzenlemesi, test edilen NPY ve Y1 reseptörü gibi uygun moleküllerin tedavilerine ek olarak yardımcı olacaktır. farmakolojik yönetilebilir formları sağlamada türevler nörodejeneratif striatal bölgenin bozuklukları.[kaynak belirtilmeli ]
Beyin tümörlerinin potansiyel bir kaynağı olarak
Subventriküler bölgenin potansiyeldeki rolünü karakterize etme girişiminde tümörijenez, Kinonlar-Hinojosa et al. beyin tümörü kök hücrelerinin (BTSC'ler) kök hücreler nöronal kök hücreler için kullanılan benzer deneyler ile beyin tümörlerinden izole edilebilir.[5] Benzer klonal küreler oluşturmada nöroosferler nöronal kök hücrelerden oluşan bu BTSC'ler farklılaşabildiler. nöronlar, astrositler ve oligodendrositler laboratuvar ortamında ama daha da önemlisi tümörler düşük hücre konsantrasyonlarında kendi kendini yenileme kapasitesi sağlar. Bu nedenle, bu tür kendini yenileme yeteneklerine sahip küçük bir BTSC popülasyonunun, tümörler gibi hastalıklarda lösemi ve meme kanseri.[kaynak belirtilmeli ]
Birkaç karakterizasyon faktörü, çeşitli özellikleri paylaştıkları için, nöronal kök hücrelerin (NSC'ler) BTSC'lerin kaynağı olduğu fikrine götürür. Bu özellikler şekilde gösterilmiştir.
Bu grup, SVZ'nin tümörijenez Mitojenik reseptörlere sahip olmanın ve bunların mitojenik uyarıma yanıtlarının gösterdiği gibi, özellikle de C tipi hücreler Epidermal büyüme faktörü reseptörü (EGFR), onları oldukça proliferatif ve invaziv hale getirir. Ek olarak, varlığı mikroglia ve endotelyal SVZ içindeki hücrelerin nörojenez yanı sıra, bazı yönsel hareketleri sağlamanın yanı sıra nöroblastlar SVZ'den.[kaynak belirtilmeli ]
Son zamanlarda, insan SVZ'si beyin tümörü hastalarında fenotipik ve genetik düzeyde karakterize edilmiştir. Bu veriler, hastaların yarısında SVZ'nin tam olarak tümörijenez diğer hastalarda ise infiltre bir bölgeyi temsil eder.[19] Bu nedenle, insanlarda, bölgenin NSC üretimi ile birincil tümörlerin sürekli olarak kendini yenileyen hücreleri arasında bir ilişki olması, çıkarıldığında veya ışınlandığında ikincil tümörlere yol açması açıkça mümkündür.[kaynak belirtilmeli ]
SVZ kök hücrelerinin, gliomalar gibi beyin tümörleri için kaynak hücre olup olmadığı kesin olarak kanıtlanmayı sürdürürken, yüksek dereceli gliomları SVZ'ye sızan veya temas eden hastalarda tümör saldırganlığının ve ölüm oranının arttığını gösteren güçlü kanıtlar vardır.[20][21]
Prostat kanserinde, tümör kaynaklı nörojenez, nöral progenitör hücrelerin (NPC) SVZ'den alınmasıyla karakterize edilir. NPC'ler, tümör büyümesini uyaran otonom nöronlara (esas olarak adrenerjik nöronlar) farklılaştıkları tümöre sızarlar.[22]
Ayrıca bakınız
Referanslar
- ^ Popp A, Urbach A, Witte OW, Frahm C (2009). Reh TA (ed.). "Yetişkin ve Embriyonik YAB Transkriptleri, Sıçan Beyninde Doğum Sonrası Gelişim Sırasında Uzamsal Olarak Düzenlenir". PLoS ONE. 4 (2): e4371. doi:10.1371 / journal.pone.0004371. PMC 2629816. PMID 19190758.
- ^ a b Quiñones-Hinojosa, A; Sanai, N; Soriano-Navarro, M; Gonzalez-Perez, O; Mirzadeh, Z; Gil-Perotin, S; Romero-Rodriguez, R; Berger, MS; Garcia-Verdugo, JM; Alvarez-Buylla, A (20 Ocak 2006). "Yetişkin insan subventriküler bölgesinin hücresel bileşimi ve hücre yapısı: nöral kök hücrelerden oluşan bir niş". Karşılaştırmalı Nöroloji Dergisi. 494 (3): 415–34. doi:10.1002 / cne.20798. PMID 16320258.
- ^ Noctor, SC; Martínez-Cerdeño, V; Ivic, L; Kriegstein, AR (Şubat 2004). "Kortikal nöronlar simetrik ve asimetrik bölünme bölgelerinde ortaya çıkar ve belirli aşamalardan geçerler". Doğa Sinirbilim. 7 (2): 136–44. doi:10.1038 / nn1172. PMID 14703572.
- ^ a b Rakiç, P (Ekim 2009). "Neokorteksin evrimi: gelişimsel biyolojiden bir bakış açısı". Doğa Yorumları. Sinirbilim. 10 (10): 724–35. doi:10.1038 / nrn2719. PMC 2913577. PMID 19763105.
- ^ a b c d e f Quiñones-Hinojosa, A; Chaichana, K (Haziran 2007). "İnsan subventriküler bölgesi: yeni hücrelerin kaynağı ve potansiyel beyin tümörleri kaynağı". Deneysel Nöroloji. 205 (2): 313–24. doi:10.1016 / j.expneurol.2007.03.016. PMID 17459377.
- ^ Ming, GL; Song, H (26 Mayıs 2011). "Memeli beyninde yetişkin nörojenezi: önemli cevaplar ve önemli sorular". Nöron. 70 (4): 687–702. doi:10.1016 / j.neuron.2011.05.001. PMC 3106107. PMID 21609825.
- ^ Lim, Daniel A .; Alvarez-Buylla, Arturo (Mayıs 2016). "Yetişkin Ventriküler-Subventriküler Bölge (V-SVZ) ve Olfaktör Bulb (OB) Nörogenez". Biyolojide Cold Spring Harbor Perspektifleri. 8 (5): a018820. doi:10.1101 / cshperspect.a018820. ISSN 1943-0264. PMC 4852803. PMID 27048191.
- ^ a b Doetsch, F; García-Verdugo, JM; Alvarez-Buylla, A (1 Tem 1997). "Yetişkin memeli beynindeki subventriküler germinal bölgenin hücresel bileşimi ve üç boyutlu organizasyonu". Nörobilim Dergisi. 17 (13): 5046–61. doi:10.1523 / JNEUROSCI.17-13-05046.1997. PMC 6573289. PMID 9185542.
- ^ Luskin, MB (Temmuz 1993). "Ön beyin subventriküler bölgeden türetilen doğum sonrası üretilen nöronların sınırlı çoğalması ve göçü". Nöron. 11 (1): 173–89. doi:10.1016 / 0896-6273 (93) 90281-U. PMID 8338665.
- ^ Doetsch, F; Caillé, ben; Lim, DA; García-Verdugo, JM; Alvarez-Buylla, A (11 Haziran 1999). "Subventriküler bölge astrositleri, yetişkin memeli beynindeki nöral kök hücrelerdir". Hücre. 97 (6): 703–16. doi:10.1016 / S0092-8674 (00) 80783-7. PMID 10380923.
- ^ Lim, DA; Alvarez-Buylla, A (22 Haziran 1999). "Astrositler ve yetişkin subventriküler bölge öncüleri arasındaki etkileşim nörojenezi uyarır". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 96 (13): 7526–31. doi:10.1073 / pnas.96.13.7526. PMC 22119. PMID 10377448.
- ^ Gates, MA; Thomas, LB; Howard, EM; Laywell, ED; Sajin, B; Faissner, A; Götz, B; Gümüş, J; Steindler, DA (16 Ekim 1995). "Serebral hemisferlerin gelişen ve yetişkin fare subventriküler bölgesinin hücre ve moleküler analizi". Karşılaştırmalı Nöroloji Dergisi. 361 (2): 249–66. doi:10.1002 / cne.903610205. PMID 8543661.
- ^ Aguirre A, Rubio ME, Gallo V (Eylül 1998). "Notch ve EGFR yolağı etkileşimi, nöral kök hücre sayısını ve kendini yenilemeyi düzenler". Doğa. 467 (7313): 323–7. doi:10.1038 / nature09347. PMC 2941915. PMID 20844536.
- ^ Bernier, PJ; Vinet, J; Cossette, M; Ebeveyn, A (Mayıs 2000). "Yetişkin insan beyninin subventriküler bölgesinin karakterizasyonu: Bcl-2'nin katılımına dair kanıt". Nörobilim Araştırmaları. 37 (1): 67–78. doi:10.1016 / S0168-0102 (00) 00102-4. PMID 10802345.
- ^ Wang Z, Tang B, He Y, Jin P. Nörogenezde DNA metilasyon dinamikleri. Epigenomik. 2016 Mart; 8 (3): 401-14. doi: 10.2217 / epi.15.119. Epub 2016 Mar 7. İnceleme. PMID 26950681
- ^ Ana JM, von dem Bussche N, Lowenstein DH (2006). "Uzun süreli nöbetler, kaudal subventriküler bölge glial progenitörlerini yaralı hipokampa taşır" (PDF). Hipokamp. 16 (3): 321–8. doi:10.1002 / hipo.20166. hdl:2027.42/49285. PMID 16435310.
- ^ Romanko, MJ; Rola, R; Fike, JR; Szele, FG; Dizon, ML; Devrilme, RJ; Brazel, CY; Levison, SW (Ekim 2004). "Memeli subventriküler bölgenin beyin hasarından sonra hücre değişimindeki rolleri". Nörobiyolojide İlerleme. 74 (2): 77–99. doi:10.1016 / j.pneurobio.2004.07.001. PMID 15518954.
- ^ Decressac, M; Prestoz, L; Veran, J; Cantereau, A; Jaber, M; Gaillard, A (Haz 2009). "Nöropeptid Y, yetişkin farelerde subventriküler bölgeden nöral öncülerin çoğalmasını, göçünü ve farklılaşmasını uyarır". Hastalığın Nörobiyolojisi. 34 (3): 441–9. doi:10.1016 / j.nbd.2009.02.017. PMID 19285132.
- ^ Piccirillo, Sara G. M .; Spiteri, Inmaculada; Sottoriva, Andrea; Touloumis, Anestis; Ber, Suzan; Price, Stephen J .; Heywood, Richard; Francis, Nicola-Jane; Howarth, Karen D. (2015/01/01). "Alt Ependimal Zondaki Malign Hücrelerden Türetilen Glioblastom'da İlaç Direncine Katkılar". Kanser araştırması. 75 (1): 194–202. doi:10.1158 / 0008-5472.CAN-13-3131. ISSN 0008-5472. PMC 4286248. PMID 25406193.
- ^ Mistry, A .; et al. (2016). "Glioblastoma temasının lateral ventrikül ile sağkalıma etkisi: bir meta-analiz". Nöro-Onkoloji Dergisi. 131 (1): 125–133. doi:10.1007 / s11060-016-2278-7. PMC 5262526. PMID 27644688.
- ^ Mistry, A .; et al. (2017). "Glioblastomlarda azalan sağkalım, subgranüler bölge veya korpus kallozum değil, ventriküler-subventriküler bölge ile temasa özgüdür". Nöro-Onkoloji Dergisi. 132 (2): 341–349. doi:10.1007 / s11060-017-2374-3. PMC 5771712. PMID 28074322.
- ^ Cervantes-Villagrana RD, Albores-García D, Cervantes-Villagrana AR, García-Acevez SJ (18 Haziran 2020). "Yenilikçi Anti-Kanser Tedavilerinin Hedefleri Olarak Tümör Kaynaklı Nörogenez ve Bağışıklıktan Kaçınma". Sinyal İletimi Hedef Ther. 5 (1): 99. doi:10.1038 / s41392-020-0205-z. PMC 7303203. PMID 32555170.

