Dopamin - Dopamine
 | |
 | |
| Klinik veriler | |
|---|---|
| Diğer isimler |
|
| Fizyolojik veri | |
| Kaynak Dokular | Substantia nigra; ventral tegmental alan; diğerleri |
| Hedef dokular | Geniş sistem |
| Reseptörler | D1, D2, D3, D4, D5, TAAR1[1] |
| Agonistler | Doğrudan: apomorfin, bromokriptin Dolaylı: kokain, amfetamin |
| Antagonistler | Nöroleptikler, metoklopramid, domperidon |
| Öncül | Fenilalanin, tirozin, ve L-DOPA |
| Biyosentez | DOPA dekarboksilaz |
| Metabolizma | MAO, COMT[1] |
| Tanımlayıcılar | |
| |
| CAS numarası | |
| PubChem Müşteri Kimliği | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CompTox Kontrol Paneli (EPA) | |
| ECHA Bilgi Kartı | 100.000.101 |
| Kimyasal ve fiziksel veriler | |
| Formül | C8H11NÖ2 |
| Molar kütle | 153.181 g · mol−1 |
| 3 boyutlu model (JSmol ) | |
| |
| |
Dopamin (DAbir kasılma 3,4-dihydrÖxypheteretilamin) bir hormon ve bir nörotransmiter beyinde ve vücutta birkaç önemli rol oynar. O bir organik kimyasal of katekolamin ve fenetilamin aileler. Dopamin, beyindeki katekolamin içeriğinin yaklaşık% 80'ini oluşturur. O bir amin kaldırılarak sentezlendi karboksil grubu bir molekülünden öncü kimyasal L-DOPA, hangisi sentezlenmiş beyin ve böbreklerde. Dopamin ayrıca bitkilerde ve çoğu hayvanda sentezlenir. Beyinde dopamin bir nörotransmiter - tarafından salınan bir kimyasal nöronlar (sinir hücreleri) diğer sinir hücrelerine sinyal göndermek için. Beyin birkaç farklı dopamin yolları biri motivasyon bileşeninde önemli bir rol oynar ödül amaçlı davranış. Çoğu ödül türünün beklentisi beyindeki dopamin düzeyini artırır,[2] ve birçok bağımlılık yapan ilaçlar dopamin salınımını artırın veya engelleyin geri alma serbest bırakıldıktan sonra nöronlara. Diğer beyin dopamin yolları motor kontrolü ve çeşitli hormonların salınımını kontrol etmede. Bu yollar ve hücre grupları bir dopamin sistemi oluşturmak nöromodülatör.[kaynak belirtilmeli ]
Popüler kültür ve medyada, dopamin genellikle hazzın ana kimyasalı olarak görülür, ancak farmakolojideki mevcut görüş, dopaminin bunun yerine motivasyonel belirginlik;[3][4][5] başka bir deyişle, dopamin, bir sonucun algılanan motivasyonel önemini (yani arzu edilirliği veya caydırıcılığı) işaret eder, bu da organizmanın davranışını o sonuca ulaşmaya doğru veya bu sonuca ulaşmaktan uzaklaştırır.[5][6]
Merkezi sinir sistemi dışında, dopamin öncelikle yerel olarak işlev görür. parakrin haberci. Kan damarlarında inhibe eder norepinefrin serbest bırak ve bir vazodilatör (normal konsantrasyonlarda); böbreklerde sodyum atılımını ve idrar çıkışını artırır; pankreasta insülin üretimini azaltır; sindirim sisteminde azalır gastrointestinal hareketlilik ve korur Bağırsak mukozası; ve bağışıklık sisteminde, aktivitesini azaltır lenfositler. Kan damarları haricinde, bu periferik sistemlerin her birinde bulunan dopamin, yerel olarak sentezlenir ve etkilerini onu salan hücrelerin yakınında gösterir.
Sinir sisteminin bazı önemli hastalıkları, dopamin sistemindeki işlev bozuklukları ile ilişkilidir ve bunları tedavi etmek için kullanılan bazı temel ilaçlar, dopaminin etkilerini değiştirerek çalışır. Parkinson hastalığı dejeneratif bir durum neden titreme ve motor bozukluk, bir bölgede dopamin salgılayan nöronların kaybından kaynaklanır. orta beyin aradı Substantia nigra. Metabolik öncüsü L-DOPA üretilebilir; Levodopasaf bir L-DOPA formu, Parkinson için en yaygın kullanılan tedavi yöntemidir. Kanıt var şizofreni değiştirilmiş dopamin aktivitesi seviyelerini içerir ve çoğu antipsikotik ilaçlar bunu tedavi etmek için kullanılan dopamin antagonistleri dopamin aktivitesini azaltan.[7] Benzer dopamin antagonisti ilaçlar da en etkili ilaçlardan bazılarıdır. bulantı önleyici ajanlar. Huzursuz bacak sendromu ve Dikkat eksikliği hiperaktivite bozukluğu (DEHB), azalmış dopamin aktivitesi ile ilişkilidir.[8] Dopaminerjik uyarıcılar yüksek dozlarda bağımlılık yapabilir, ancak bazıları DEHB'yi tedavi etmek için daha düşük dozlarda kullanılır. Dopamin kendisi için üretilmiş bir ilaç olarak mevcuttur damara enjekte etmek: ona rağmen beyne kan dolaşımından ulaşamıyor periferik etkileri, tedavide faydalı olmasını sağlar. kalp yetmezliği veya şok özellikle yeni doğan bebeklerde.
Yapısı
Bir dopamin molekülü aşağıdakilerden oluşur: katekol yapı (a benzen iki yüzük hidroksil yan gruplar) ile amin bir aracılığıyla eklenen grup etil Zincir.[9] Bu nedenle, dopamin mümkün olan en basitidir katekolamin, şunları da içeren bir aile nörotransmiterler norepinefrin ve epinefrin.[10] Bu amin eki ile bir benzen halkasının varlığı, onu bir ikame edilmiş fenetilamin çok sayıda içeren bir aile psikoaktif ilaçlar.[11]
Çoğu amin gibi dopamin de bir organik baz.[12] Olarak temel, genelde protonlanmış içinde asidik ortamlar (bir asit-baz reaksiyonu ).[12] Protonlanmış form, suda çözünürlüğü yüksektir ve nispeten kararlıdır, ancak oksitlenmiş oksijene veya diğerine maruz kalırsa oksidanlar.[12] Temel ortamlarda dopamin protonlanmamaktadır.[12] Bunda serbest üs form, daha az suda çözünür ve ayrıca daha yüksek reaktiftir.[12] Protonlanmış formun artan stabilitesi ve suda çözünürlüğü nedeniyle, dopamin kimyasal veya farmasötik kullanım için dopamin olarak sağlanır. hidroklorür - yani hidroklorür tuz bu, dopamin ile birleştirildiğinde oluşturulur hidroklorik asit.[12] Kuru formda, dopamin hidroklorür beyaz ila sarı renkte ince bir tozdur.[13]
Biyokimya
Sentez
Dopamin sentezlenmiş sınırlı bir hücre tipi kümesinde, özellikle de nöronlar ve hücrelerde medulla of adrenal bezler.[17] Birincil ve küçük metabolik yollar sırasıyla şunlardır:
- Birincil: L-Fenilalanin → LTirozin → L-DOPA → Dopamin[14][15]
- Minör: L-Fenilalanin → LTirozin → pTiramin → Dopamin[14][15][16]
- Minör: L-Fenilalanin → mTirozin → mTiramin → Dopamin[16][18][19]
Dopaminin doğrudan öncüsü, L-DOPA, dolaylı olarak sentezlenebilir esansiyel amino asit fenilalanin veya doğrudan gerekli olmayan amino asitten tirozin.[20] Bunlar amino asitler Neredeyse her proteinde bulunur ve bu nedenle gıdalarda kolayca bulunur, en yaygın olanı tirozindir. Dopamin pek çok gıda türünde de bulunmasına rağmen, Kan beyin bariyeri beyni çevreleyen ve koruyan.[21] Bu nedenle, beynin içinde sentezlenmesi gerekir. nöronal aktivite.[21]
L-Fenilalanin, L- tirozin enzim fenilalanin hidroksilaz, ile moleküler oksijen (Ö2) ve tetrahidrobiopterin gibi kofaktörler. LTirozin, LEnzim tarafından DOPA tirozin hidroksilaz, tetrahidrobiopterin ile, O2ve demir (Fe2+) kofaktör olarak.[20] L-DOPA enzim tarafından dopamine dönüştürülür aromatik L-amino asit dekarboksilaz (DOPA dekarboksilaz olarak da bilinir) piridoksal fosfat kofaktör olarak.[20]
Dopaminin kendisi, nörotransmiterler norepinefrin ve epinefrinin sentezinde öncü olarak kullanılır.[20] Dopamin enzim tarafından norepinefrine dönüştürülür dopamin β-hidroksilaz, O ile2 ve L-askorbik asit kofaktör olarak.[20] Norepinefrin enzim tarafından epinefrine dönüştürülür. feniletanolamin N-metiltransferaz ile S-adenosil-Lmetiyonin kofaktör olarak.[20]
Bazı kofaktörler de kendi sentezlerini gerektirir.[20] Gerekli herhangi bir amino asit veya kofaktördeki eksiklik, dopamin, norepinefrin ve epinefrin sentezini bozabilir.[20]
Bozulma
Dopamin inaktif olarak parçalanır metabolitler bir dizi enzimle—monoamin oksidaz (MAO), katekolÖ-metil transferaz (COMT) ve aldehit dehidrojenaz (ALDH), sırayla hareket ediyor.[22] Her ikisi de izoformlar monoamin oksidaz, MAO-A ve MAO-B, dopamini etkili bir şekilde metabolize eder.[20] Farklı arıza yolları mevcuttur, ancak ana son ürün homovanillic asit (HVA), bilinen biyolojik aktivitesi yoktur.[22] Kan dolaşımından homovanillik asit böbrekler tarafından filtrelenir ve daha sonra idrarla atılır.[22] Dopamini HVA'ya dönüştüren iki ana metabolik yol şunlardır:
- Dopamin → DOPAL → DOPAC → HVA - sırasıyla MAO, ALDH ve COMT tarafından katalize edilir
- Dopamin → 3-Metoksitiramin → HVA - sırasıyla COMT ve MAO + ALDH tarafından katalize edilir
Şizofreni üzerine klinik araştırmada, homovanillik asit ölçümleri plazma beyindeki dopamin aktivite seviyelerini tahmin etmek için kullanılmıştır. Bununla birlikte, bu yaklaşımdaki bir zorluk, norepinefrin metabolizmasının katkıda bulunduğu yüksek plazma homovanillik asit seviyesinin ayrılmasıdır.[23][24]
Dopamin normalde bir oksidoredüktaz enzim, aynı zamanda oksijen ile doğrudan reaksiyona girerek oksidasyona duyarlıdır. Kinonlar artı çeşitli serbest radikaller ürünler olarak.[25] Oksidasyon hızı, varlığı ile artırılabilir. demirli demir veya diğer faktörler. Dopaminin otoksidasyonu ile üretilen kinonlar ve serbest radikaller zehirli hücreler ve bu mekanizmanın, hücrede meydana gelen hücre kaybına katkıda bulunabileceğine dair kanıtlar vardır. Parkinson hastalığı ve diğer koşullar.[26]
Fonksiyonlar
Hücresel etkiler
| Aile | Reseptör | Gen | Tür | Mekanizma |
|---|---|---|---|---|
| D1 benzeri | D1 | DRD1 | Gs çiftli. | Hücre içi seviyelerini artırın kamp aktive ederek adenilat siklaz. |
| D5 | DRD5 | |||
| D2 benzeri | D2 | DRD2 | Gben çiftli. | Hücre içi düzeylerini azaltın kamp engelleyerek adenilat siklaz. |
| D3 | DRD3 | |||
| D4 | DRD4 | |||
| TAAR | TAAR1 | TAAR1 | Gs çiftli. Gq çiftli. | Hücre içi seviyelerini artırın kamp ve hücre içi kalsiyum konsantrasyonu. |
Dopamin etkilerini bağlayarak ve aktive ederek gösterir. hücre yüzeyi reseptörleri.[17] İnsanlarda dopamin yüksek Bağlanma afinitesi -de dopamin reseptörleri ve insan eser amin ile ilişkili reseptör 1 (hTAAR1).[1][27] Memelilerde, beş alt tip dopamin reseptörleri D1'den D5'e kadar etiketlenmiş olarak tanımlanmıştır.[17] Hepsi şu şekilde işlev görür metabotropik, G proteinine bağlı reseptörler, etkilerini karmaşık bir yolla uyguladıkları anlamına gelir. ikinci haberci sistemi.[28] Bu reseptörler olarak bilinen iki aileye ayrılabilir: D1 benzeri ve D2 benzeri.[17] Sinir sistemindeki nöronlar üzerinde bulunan reseptörler için, D1 benzeri aktivasyonun (D1 ve D5) nihai etkisi uyarılma olabilir ( sodyum kanalları ) veya engelleme (açılması yoluyla potasyum kanalları ); D2 benzeri aktivasyonun (D2, D3 ve D4) nihai etkisi genellikle hedef nöronun inhibisyonudur.[28] Sonuç olarak, dopaminin kendisini uyarıcı veya inhibe edici olarak tanımlamak yanlıştır: bir hedef nöron üzerindeki etkisi, o nöronun zarında hangi reseptör türlerinin mevcut olduğuna ve bu nöronun ikinci haberciye verdiği iç yanıtlara bağlıdır. kamp.[28] D1 reseptörleri, insan sinir sistemindeki en çok sayıda dopamin reseptörüdür; Sırada D2 reseptörleri var; D3, D4 ve D5 reseptörleri, önemli ölçüde daha düşük seviyelerde mevcuttur.[28]
Depolama, serbest bırakma ve yeniden alma
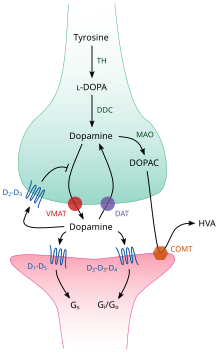
TH: tirozin hidroksilaz
DOPA: L-DOPA
DAT: dopamin taşıyıcı
DDC: DOPA dekarboksilaz
VMAT: veziküler monoamin taşıyıcı 2
MAO: Monoamin oksidaz
COMT: Katekol-O-metil transferaz
HVA: Homovanillic asit
Beynin içinde dopamin bir nörotransmiter olarak işlev görür ve nöromodülatör ve herkes için ortak olan bir dizi mekanizma tarafından kontrol edilir monoamin nörotransmiterler.[17] Sentezden sonra dopamin, sitozol içine Sinaptik veziküller tarafından çözünen taşıyıcı —A veziküler monoamin taşıyıcı, VMAT2.[29] Dopamin, bu keseciklerde depolanır. sinaptik yarık. Çoğu durumda, dopamin salınımı adı verilen bir süreçle gerçekleşir. ekzositoz neden olduğu aksiyon potansiyalleri ancak hücre içi aktiviteden de kaynaklanabilir. eser amin ile ilişkili reseptör, TAAR1.[27] TAAR1, dopamin için yüksek afiniteli bir reseptördür, eser aminler ve kesin ikame edilmiş amfetaminler presinaptik hücrenin hücre içi ortamında zarlar boyunca yer alır;[27] Reseptörün aktivasyonu, dopamini indükleyerek dopamin sinyalini düzenleyebilir geri alım engellemesi ve akma yanı sıra çeşitli mekanizmalar aracılığıyla nöronal ateşlemeyi engelleyerek.[27][30]
Sinapsta dopamin, dopamin reseptörlerine bağlanır ve onları aktive eder.[31] Bunlar olabilir sinaptik sonrası üzerinde bulunan dopamin reseptörleri dendritler (postsinaptik nöron) veya presinaptik otomatik alıcılar (ör. D2sh ve presinaptik D3 reseptörler), bir zarın üzerinde bulunan akson terminali (presinaptik nöron).[17][31] Postsinaptik nöron bir aksiyon potansiyeli ortaya çıkardıktan sonra, dopamin molekülleri hızlı bir şekilde reseptörlerinden ayrılır. Daha sonra presinaptik hücreye geri emilirler. yeniden alım arabulucu dopamin taşıyıcı veya tarafından plazma membranı monoamin taşıyıcı.[32] Sitozole geri döndüğünde, dopamin ya bir monoamin oksidaz veya VMAT2 tarafından veziküllere yeniden paketlenerek gelecekteki sürümler için kullanılabilir hale getirir.[29]
Beyinde hücre dışı dopamin seviyesi iki mekanizma tarafından düzenlenir: fazik ve tonik iletim.[33] Sinir sistemindeki çoğu nörotransmiter salımı gibi, fazik dopamin salımı, doğrudan dopamin içeren hücrelerdeki aksiyon potansiyelleri tarafından yönlendirilir.[33] Tonik dopamin iletimi, öncesinde presinaptik aksiyon potansiyelleri olmadan az miktarda dopamin salındığında meydana gelir.[33] Tonik iletim, diğer nöronların aktivitesi ve nörotransmiter geri alımı dahil olmak üzere çeşitli faktörlerle düzenlenir.[33]
Gergin sistem

Dopamin beynin içinde önemli roller oynar. yönetici işlevler, motor kontrolü, motivasyon, uyarılma, güçlendirme, ve ödül ve dahil daha düşük seviyeli fonksiyonlar emzirme, cinsel tatmin, ve mide bulantısı. dopaminerjik hücre grupları ve yollar dopamin sistemini oluşturan nöromodülatör.
Dopaminerjik nöronlar (dopamin üreten sinir hücreleri) nispeten az sayıdadır - insan beyninde toplam 400.000 civarında[34]-ve onların hücre gövdeleri Gruplar halinde birkaç nispeten küçük beyin alanıyla sınırlıdır.[35] Ancak onların aksonlar diğer beyin bölgelerine projeksiyon yaparlar ve hedefleri üzerinde güçlü etkiler yaratırlar.[35] Bu dopaminerjik hücre grupları ilk olarak 1964'te Annica Dahlström ve onlara "A" harfiyle ("aminerjik" için) başlayan etiketler atayan Kjell Fuxe.[36] Planlarında A1 ila A7, nörotransmiter norepinefrin içerirken, A8 ila A14 dopamin içerir. Tanımladıkları dopaminerjik alanlar, substantia nigra (8. ve 9. gruplar); ventral tegmental alan (grup 10); arka hipotalamus (grup 11); kavisli çekirdek (grup 12); Zona incerta (grup 13) ve periventriküler çekirdek (grup 14).[36]
Substantia nigra, bir bileşeni oluşturan küçük bir orta beyin alanıdır. Bazal ganglion. Bunun iki bölümü vardır - giriş alanı olarak adlandırılan pars compacta ve bir çıktı alanı pars retikulata. Dopaminerjik nöronlar esas olarak pars compacta'da (hücre grubu A8) ve yakınında (grup A9) bulunur.[35] İnsanlarda, dopaminerjik nöronların substantia nigra pars compacta'dan dorsal striatuma projeksiyonu, nigrostriatal yol, motor fonksiyonun kontrolünde ve yeni öğrenmede önemli bir rol oynar. motor becerileri.[37] Bu nöronlar özellikle hasara karşı savunmasızdır ve büyük bir kısmı öldüğünde sonuç bir parkinson sendromu.[38]
ventral tegmental alan (VTA) başka bir orta beyin alanıdır. En önde gelen VTA dopaminerjik nöron grubu, prefrontal kortekse, mezokortikal yol ve başka bir küçük grup, ödül merkezlerine mezolimbik yol. Birlikte, bu iki yola toplu olarak mezokortikolimbik projeksiyon.[35][37] VTA ayrıca dopaminerjik projeksiyonları da amigdala, singulat girus, hipokamp, ve koku soğanı.[35][37] Mezokortikolimbik nöronlar, ödülde ve motivasyonun diğer yönlerinde merkezi bir rol oynar.[37] Biriken literatür, dopaminin bir dizi beyin bölgesi üzerindeki etkileri yoluyla caydırıcı öğrenmede de önemli bir rol oynadığını göstermektedir.[39][40][41]
Posterior hipotalamusta omuriliğe yansıyan dopamin nöronları vardır, ancak işlevleri tam olarak belirlenmemiştir.[42] Bu bölgedeki patolojinin, insanların, özellikle bacakları olmak üzere vücudun bölümlerini sürekli hareket ettirme zorunluluğu nedeniyle uyumakta zorluk çektiği bir durum olan huzursuz bacak sendromunda rol oynadığına dair bazı kanıtlar vardır.[42]
Hipotalamusun kavisli çekirdek ve periventriküler çekirdeği, önemli bir projeksiyon oluşturan dopamin nöronlarına sahiptir. tuberoinfundibular yol hangisine gider hipofiz bezi, hormonun salgılanmasını etkilediği yerde prolaktin.[43] Dopamin birincildir nöroendokrin salgısının inhibitörü prolaktin -den Ön hipofiz bezi bezi.[43] Kavisli çekirdekte nöronlar tarafından üretilen dopamin, hipofiz portal sistemi of medyan üstünlük sağlayan hipofiz bezi.[43] prolaktin hücreleri dopamin yokluğunda prolaktin üreten, sürekli olarak prolaktin salgılayan; dopamin bu salgıyı engeller.[43] Prolaktin sekresyonunun düzenlenmesi bağlamında, dopamine bazen prolaktin inhibe edici faktör, prolaktin inhibe edici hormon veya prolaktostatin olarak adlandırılır.[43]
Kavisli ve periventriküler çekirdekler arasında gruplanan zona incerta, hipotalamusun çeşitli bölgelerine uzanır ve kontrolünde yer alır. gonadotropin salgılayan hormon gelişimini etkinleştirmek için gerekli olan erkek ve dişi üreme sistemleri, ergenlikten sonra.[43]
Ek bir dopamin salgılayan nöron grubu bulunur. retina gözün.[44] Bu nöronlar amacrin hücreleri yani aksonları yok.[44] Dopamini hücre dışı ortama salarlar ve özellikle gündüz saatlerinde aktiftirler ve geceleri sessizleşirler.[44] Bu retinal dopamin, koni hücreleri bastırırken retinada çubuk hücreleri —Sonuç, ışık loşken azaltılmış hassasiyet pahasına parlak ışık koşullarında renk ve kontrasta duyarlılığı artırmaktır.[44]
Bazal ganglion

Omurgalı beynindeki en büyük ve en önemli dopamin kaynakları, substantia nigra ve ventral tegmental alandır.[35] Bu yapılar birbirleriyle yakından ilişkilidir ve birçok yönden işlevsel olarak benzerdir.[35] Her ikisi de orta beynin bileşenleridir.[35] Bazal gangliyonun en büyük bileşeni striatumdur.[45] Substantia nigra, dopaminerjik bir projeksiyon gönderir. sırt striatum ventral tegmental alan benzer tipte bir dopaminerjik projeksiyon gönderirken ventral striatum.[35]
Bazal gangliyonların işlevlerini anlamada ilerleme yavaş olmuştur.[45] Genel olarak ifade edilen en popüler hipotezler, bazal gangliyonların eylem seçimi.[46] En basit şekliyle eylem seçimi teorisi, bir kişi veya hayvan birkaç davranışın mümkün olduğu bir durumda olduğunda, bazal gangliyonlardaki aktivitenin, diğer motor sistemlerini inhibe etmeye devam ederken bu yanıtı inhibisyondan salarak hangisinin yürütüldüğünü belirlediğini ileri sürer. eğer etkinleştirilirse, rakip davranışlar oluşturacaktır.[47] Dolayısıyla, bu kavramda bazal gangliyonlar davranışları başlatmaktan sorumludur, ancak nasıl gerçekleştirildiklerinin ayrıntılarını belirlemekten sorumlu değildir. Başka bir deyişle, esasen bir karar alma sistemi oluştururlar.[47]
Bazal gangliya birkaç sektöre ayrılabilir ve her biri belirli türdeki eylemlerin kontrolünde yer alır.[48] Bazal gangliyonun ventral sektörü (ventral striatum ve ventral tegmental alanı içerir), tüm organizma seviyesindeki eylemleri seçerek hiyerarşinin en yüksek seviyesinde çalışır.[47] Sırt sektörleri (dorsal striatum ve substantia nigra içerir), belirli bir davranış modelini uygulamak için kullanılan belirli kasları ve hareketleri seçerek daha düşük seviyelerde çalışır.[48]
Dopamin, eylem seçim sürecine en az iki önemli yoldan katkıda bulunur. İlk olarak, eylemleri başlatmak için "eşik" belirler.[46] Dopamin aktivitesi seviyesi ne kadar yüksekse, belirli bir davranışı uyandırmak için gereken hız o kadar düşük olur.[46] Sonuç olarak, yüksek dopamin seviyeleri, yüksek motor aktivite seviyelerine ve dürtüsel davranış; düşük dopamin seviyeleri uyuşukluk ve yavaşlayan reaksiyonlar.[46] Substantia nigra devresindeki dopamin seviyelerinin büyük ölçüde azaldığı Parkinson hastalığı, sertlik ve hareketi başlatmada zorluk ile karakterizedir; ancak, hastalığı olan kişiler ciddi bir tehdit gibi güçlü uyaranlarla karşı karşıya kaldıklarında, tepkileri şu kadar şiddetli olabilir: sağlıklı bir insanınki.[49] Ters yönde, kokain veya amfetamin gibi dopamin salınımını artıran ilaçlar, en uçta, psikomotor ajitasyon ve basmakalıp hareketler.[50]
Dopaminin ikinci önemli etkisi, "öğretme" sinyalidir.[46] Bir eylemi dopamin aktivitesinde bir artış izlediğinde, bazal gangliya devresi, gelecekte benzer durumlar ortaya çıktığında aynı tepkiyi uyandırmayı kolaylaştıracak şekilde değiştirilir.[46] Bu bir biçimdir edimsel koşullanma dopaminin bir ödül sinyali rolü oynadığı.[47]
Ödül

Ödül sistemini tartışmak için kullanılan dilde, ödül bir uyarıcının çekici ve motivasyonel özelliğidir. iştah açıcı davranış (yaklaşım davranışı olarak da bilinir) ve tüketim davranışı.[51] Ödüllendirici bir uyarıcı, organizmayı ona yaklaşmaya ve onu tüketmeyi seçmeye teşvik edebilen bir uyarıcıdır.[51] Zevk, öğrenme (Örneğin., klasik ve edimsel koşullanma ) ve yaklaşım davranışı ödülün üç ana işlevidir.[51] Ödülün bir yönü olarak, Zevk ödülün bir tanımını sağlar;[51] ancak, tüm zevk veren uyarıcılar ödüllendirici olsa da, ödüllendirici uyarıcıların tümü zevkli değildir (örneğin, para gibi dışsal ödüller).[51][52] Ödüllendirici uyaranların motivasyonel veya arzu edilen yönü, uyandırdıkları yaklaşım davranışıyla yansıtılırken, içsel ödüllerden elde edilen haz, onları aldıktan sonra tüketmekten kaynaklanır.[51] Özünde ödüllendirici bir uyaranın bu iki bileşenini ayıran nöropsikolojik bir model, teşvik edici belirginlik model, burada "istemek" veya arzu (daha az yaygın olarak "aramak"[53]) iştah açıcı veya yaklaşma davranışına karşılık gelirken, "beğenme" veya zevk tüketim davranışına karşılık gelir.[51][3][54] İnsanda Uyuşturucu bağımlıları Bağımlılık yapan bir ilacı kullanma isteği arttıkça "istemek", "beğenmek" ile ilişkisiz hale gelirken, tüketmekten elde edilen zevk nedeniyle azalır. ilaç toleransı.[3]
Beyinde, dopamin kısmen küresel bir ödül sinyali olarak işlev görür. Ödüllendirici bir uyarana verilen ilk dopamin yanıtı, belirginlik, değer ve ödül bağlamı.[51] Ödülle ilgili öğrenme bağlamında, dopamin aynı zamanda bir ödül tahmin hatası sinyal, yani bir ödülün değerinin beklenmedik olma derecesi.[51] Bu hipoteze göre Wolfram Schultz Beklenen ödüller, belirli dopaminerjik hücrelerde ikinci bir fazik dopamin tepkisi üretmez, ancak beklenmedik veya beklenenden daha büyük olan ödüller, sinaptik dopaminde kısa süreli bir artış sağlarken, beklenen bir ödülün ihmal edilmesi aslında dopamin salınımına neden olur. arka plan seviyesinin altına düşmek için.[51] "Tahmin hatası" hipotezi, hesaplamalı sinirbilimcilerin özellikle ilgisini çekmiştir, çünkü etkili bir hesaplamalı öğrenme yöntemi zamansal fark öğrenme tahmin hatasını kodlayan bir sinyali yoğun şekilde kullanır.[51] Bu teori ve verilerin birleşmesi, nörobilimciler ve ilgilenen bilgisayar bilimcileri arasında verimli bir etkileşime yol açtı. makine öğrenme.[51]
Kanıt mikroelektrot Hayvanların beyinlerinden alınan kayıtlar, ventral tegmental alandaki (VTA) ve substantia nigra'daki dopamin nöronlarının çok çeşitli ödüllendirici olaylarla güçlü bir şekilde aktive edildiğini göstermektedir.[51] VTA ve substantia nigra'daki bu ödüle duyarlı dopamin nöronları, ödülle ilgili biliş için çok önemlidir ve ödül sisteminin merkezi bileşeni olarak hizmet eder.[3][55][56] Dopaminin işlevi her birinde değişir aksonal izdüşüm VTA ve substantia nigra'dan;[3] örneğin, VTA–coreus accumbens kabuğu projeksiyon, ödüllendirici uyaranlara ve bununla ilişkili teşvik edici önemi ("istek") atar ipuçları, VTA–orbitofrontal korteks projeksiyon, farklı hedeflerin değerini teşvik edici önemine göre günceller; VTA-amigdala ve VTA-hipokampus projeksiyonları, ödülle ilgili hatıraların birleştirilmesine aracılık eder ve hem VTA–çekirdek ödül çekirdeği ve maddi nigra-dorsal striatum yolları, ödüllendirici uyaranların edinimini kolaylaştıran motor tepkilerin öğrenilmesinde rol oynar.[3][57] VTA dopaminerjik projeksiyonları içindeki bazı faaliyetler de ödül tahmini ile ilişkili görünmektedir.[3][57]
Zevk
Dopamin, ödüllendirici uyaranlara iştah açıcı veya yaklaşım davranışsal tepkilerle ilişkili "isteme" ye neden olmada merkezi bir role sahipken, ayrıntılı çalışmalar, dopaminin, tüketici davranış tepkisinde yansıtıldığı gibi basitçe hedonik "beğenme" veya zevk ile eşitlenemeyeceğini göstermiştir.[52] Dopamin nörotransmisyonu, zevkle ilgili bilişin bazı yönlerinde değil, bazı yönlerinde yer alır, çünkü zevk merkezleri hem dopamin sistemi içinde (yani çekirdek akumbens kabuğu) hem de dopamin sistemi dışında (yani, ventral pallidum ve parabrakiyal çekirdek ).[52][54][58] Örneğin, doğrudan elektriksel uyarım Beyne implante edilen elektrotların kullanıldığı dopamin yolları zevkli olarak deneyimlenir ve birçok hayvan türü bunu elde etmek için çalışmaya isteklidir.[59] Antipsikotik ilaçlar dopamin seviyelerini azaltın ve neden olma eğiliminde Anhedonia, zevki deneyimlemede azalmış bir yetenek.[60] Seks, yemek yeme ve video oyunları oynama gibi pek çok zevk verici deneyim, dopamin salınımını artırır.[61] Bağımlılık yaratan tüm ilaçlar doğrudan veya dolaylı olarak akümbens çekirdeğindeki dopamin nörotransmisyonunu etkiler;[3][59] bu ilaçlar, muhtemelen yüksek dozlarda tekrar tekrar alındıklarında, kompülsif uyuşturucu kullanımına yol açarak, uyuşturucu "isteğini" arttırır. Teşvik edici belirginliğin hassaslaştırılması.[54] Sinaptik dopamin konsantrasyonlarını artıran ilaçlar şunları içerir: psikostimülanlar metamfetamin ve kokain gibi. Bunlar "isteme" davranışlarında artışlara neden olur, ancak zevk ifadelerini büyük ölçüde değiştirmez veya doygunluk düzeylerini değiştirmez.[54][59] Ancak, afyon eroin ve morfin gibi uyuşturucular, "beğenme" ve "isteme" davranışlarında artışa neden olur.[54] Dahası, ventral tegmental dopamin sisteminin etkisiz hale getirildiği hayvanlar yiyecek aramazlar ve kendilerine bırakılırsa açlıktan ölecekler, ancak yiyecek ağızlarına konulursa onu tüketecekler ve zevke işaret eden ifadeler göstereceklerdir.[62]
Ocak 2019'da bir dopamin öncüsünün etkisini değerlendiren bir klinik çalışma (levodopa ), dopamin antagonisti (risperidon ) ve müziğe verilen ödül tepkileriyle ilgili bir plasebo - sırasında yaşanan zevk derecesi de dahil müzikal titreme, değişikliklerle ölçüldüğü gibi elektrodermal aktivite öznel derecelendirmelerin yanı sıra - dopamin nörotransmisyonunun manipülasyonunun iki yönlü olarak zevk bilişini düzenlediğini buldu (özellikle, müziğin hedonik etkisi ) insan deneklerde.[63][64] Bu araştırma, artan dopamin nörotransmisyonunun bir olmazsa olmaz insanlarda müziğe karşı zevkli hedonik reaksiyonların koşulu.[63][64]
Sinir sisteminin dışında
Dopamin kan-beyin bariyerini geçmez, bu nedenle sentezi ve periferal bölgelerdeki işlevleri, beyindeki sentezinden ve işlevlerinden büyük ölçüde bağımsızdır.[21] Kan dolaşımında önemli miktarda dopamin dolaşır, ancak oradaki işlevleri tam olarak net değildir.[22] Dopamin, kan plazmasında epinefrin ile karşılaştırılabilir seviyelerde bulunur, ancak insanlarda plazmadaki dopaminin% 95'inden fazlası dopamin formundadır. sülfat enzim tarafından üretilen bir konjugat sülfotransferaz 1A3 / 1A4 serbest dopamin üzerinde etkili.[22] Bu dopamin sülfatın büyük kısmı, mezenter sindirim sisteminin bölümlerini çevreleyen.[22] Dopamin sülfat üretiminin, gıda olarak alınan veya sindirim süreci tarafından üretilen dopamini detoksifiye etmek için bir mekanizma olduğu düşünülmektedir - plazmadaki seviyeler, tipik olarak bir yemekten sonra elli kattan fazla yükselir.[22] Dopamin sülfatın bilinen hiçbir biyolojik işlevi yoktur ve idrarla atılır.[22]
Kan dolaşımındaki nispeten küçük miktarda konjuge olmayan dopamin, sempatik sinir sistemi, sindirim sistemi veya muhtemelen diğer organlar.[22] Periferik dokulardaki dopamin reseptörleri üzerinde etkili olabilir veya metabolize olabilir veya enzim tarafından norepinefrine dönüştürülebilir. dopamin beta hidroksilaz, adrenal medulla tarafından kan dolaşımına salınır.[22] Bazı dopamin reseptörleri, atardamarların duvarlarında bulunur ve burada bir vazodilatör ve bir norepinefrin salımı inhibitörü.[65] Bu yanıtlar, karotis gövdesi düşük oksijen koşulları altında, ancak arteriyel dopamin reseptörlerinin biyolojik olarak yararlı diğer işlevleri yerine getirip getirmediği bilinmemektedir.[65]
Kan akışını modüle etme rolünün ötesinde, dopaminin sınırlı bir alanda dolaştığı ve bir ekzokrin veya parakrin işlevi.[22] Dopaminin önemli bir rol oynadığı çevresel sistemler şunları içerir: bağışıklık sistemi, böbrekler ve pankreas.
Bağışıklık sisteminde dopamin, özellikle bağışıklık hücrelerinde bulunan reseptörlere etki eder. lenfositler.[66] Dopamin aynı zamanda bağışıklık hücrelerini de etkileyebilir. dalak, kemik iliği, ve kan dolaşım sistemi.[67] Ek olarak, dopamin, bağışıklık hücreleri tarafından sentezlenebilir ve serbest bırakılabilir.[66] Dopaminin lenfositler üzerindeki ana etkisi, aktivasyon seviyelerini düşürmektir. Bu sistemin işlevsel önemi belirsizdir, ancak sinir sistemi ile bağışıklık sistemi arasındaki etkileşimler için olası bir yol sağlar ve bazı otoimmün bozukluklarla ilgili olabilir.[67]
Renal dopaminerjik sistem, kanın hücrelerinde bulunur. nefron dopamin reseptörlerinin tüm alt tiplerinin bulunduğu böbrekte.[68] Dopamin de orada sentezlenir. tüp hücrelere boşaltılır ve tübüler sıvı. Eylemleri arasında böbreklere giden kan akışını arttırmak, glomerüler filtrasyon hızı ve idrarda sodyum atılımını artırmak. Bu nedenle, renal dopamin fonksiyonundaki bozukluklar, sodyum atılımının azalmasına ve sonuç olarak yüksek tansiyon. Dopamin üretiminde veya reseptörlerde meydana gelen hataların bir dizi patolojiye neden olabileceğine dair güçlü kanıtlar vardır: oksidatif stres, ödem ve ya genetik ya da esansiyel hipertansiyon. Oksidatif stresin kendisi hipertansiyona neden olabilir.[69] Sistemdeki kusurlara genetik faktörler veya yüksek tansiyon da neden olabilir.[70]
Pankreasta dopaminin rolü biraz karmaşıktır. Pankreas iki kısımdan oluşur: ekzokrin ve bir endokrin bileşen. Ekzokrin kısım sentezler ve salgılar sindirim enzimleri ve dopamin dahil olmak üzere diğer maddeler ince bağırsağa girer.[71] Bu salgılanan dopaminin ince bağırsağa girdikten sonra işlevi tam olarak belirlenmemiştir - olasılıklar bağırsak mukozasını hasardan korumak ve azaltmayı içerir. gastrointestinal hareketlilik (içeriğin sindirim sisteminden geçme hızı).[71]
Pankreas adacıkları, pankreasın endokrin kısmını oluşturur ve aşağıdakiler dahil hormonları sentezler ve salgılar: insülin kan dolaşımına.[71] Kanıt var beta hücreleri İnsülin sentezleyen adacıklarda dopamin reseptörleri bulunur ve bu dopamin, salgıladığı insülin miktarını azaltma görevi görür.[71] Dopamin girdilerinin kaynağı net olarak belirlenmemiştir - kan dolaşımında dolaşan ve sempatik sinir sisteminden türeyen dopaminden gelebilir veya diğer pankreas hücreleri türleri tarafından lokal olarak sentezlenebilir.[71]
Tıbbi kullanımlar

Dopamin imal edilmiş olarak ilaç tedavisi diğerlerinin yanı sıra Intropin, Dopastat ve Revimine ticari isimleri altında satılmaktadır. Üstünde Dünya Sağlık Örgütü'nün Temel İlaç Listesi.[72] En çok şiddetli hastalıkların tedavisinde uyarıcı bir ilaç olarak kullanılır. düşük kan basıncı, yavaş kalp atış hızı, ve kalp DURMASI. Bunları tedavi etmede özellikle önemlidir yeni doğan bebekler.[73] Damar yoluyla verilir. Plazmadaki dopaminin yarılanma ömrü çok kısa olduğu için - yetişkinlerde yaklaşık bir dakika, yeni doğan bebeklerde iki dakika ve erken doğmuş bebeklerde beş dakikaya kadar - genellikle tek bir enjeksiyon yerine sürekli intravenöz damla şeklinde verilir.[74]
Its effects, depending on dosage, include an increase in sodium excretion by the kidneys, an increase in urine output, an increase in kalp atış hızı, and an increase in tansiyon.[74] At low doses it acts through the sympathetic nervous system to increase heart muscle contraction force and heart rate, thereby increasing kardiyak çıkışı and blood pressure.[75] Higher doses also cause vazokonstriksiyon that further increases blood pressure.[75][76] Older literature also describes very low doses thought to improve kidney function without other consequences, but recent reviews have concluded that doses at such low levels are not effective and may sometimes be harmful.[77] While some effects result from stimulation of dopamine receptors, the prominent cardiovascular effects result from dopamine acting at α1, β1, ve β2 adrenerjik reseptörler.[78][79]
Yan etkiler of dopamine include negative effects on kidney function and irregular heartbeats.[75] LD50, or lethal dose which is expected to prove fatal in 50% of the population, has been found to be: 59 mg/kg (mouse; administered intravenöz olarak ); 95 mg/kg (mouse; administered intraperitoneally ); 163 mg/kg (rat; administered intraperitoneally); 79 mg/kg (dog; administered intravenously).[80]
Bir florlanmış form of L-DOPA known as fluorodopa is available for use in Pozitron emisyon tomografi to assess the function of the nigrostriatal pathway.[81]
Disease, disorders, and pharmacology
The dopamine system plays a central role in several significant medical conditions, including Parkinson's disease, attention deficit hyperactivity disorder, Tourette sendromu, şizofreni, bipolar disorder, and addiction. Aside from dopamine itself, there are many other important drugs that act on dopamine systems in various parts of the brain or body. Some are used for medical or recreational purposes, but neurochemists have also developed a variety of research drugs, some of which bind with high affinity to specific types of dopamine receptors and either agonize veya düşmanlaştırmak their effects, and many that affect other aspects of dopamine physiology,[82] dahil olmak üzere dopamine transporter inhibitors, VMAT inhibitors, and enzyme inhibitors.
Aging brain
A number of studies have reported an age-related decline in dopamine synthesis and dopamine receptor density (i.e., the number of receptors) in the brain.[83] This decline has been shown to occur in the striatum and extrastriatal bölgeler.[84] Decreases in the D1, D2, ve D3 receptors are well documented.[85][86][87] The reduction of dopamine with aging is thought to be responsible for many neurological symptoms that increase in frequency with age, such as decreased arm swing and increased rigidity.[88] Changes in dopamine levels may also cause age-related changes in cognitive flexibility.[88]
Other neurotransmitters, such as serotonin ve glutamat also show a decline in output with aging.[87][89]
Multipl Skleroz
Studies reported that dopamine imbalance influence the fatigue in multiple sclerosis.[90] Patients with multiple sclerosis dopamine inhibits production of IL-17 and IFN-γ by peripheral blood mononuclear cells.[91]
Parkinson hastalığı
Parkinson's disease is an age-related disorder characterized by movement disorders such as stiffness of the body, slowing of movement, and trembling of limbs when they are not in use.[49] In advanced stages it progresses to demans and eventually death.[49] The main symptoms are caused by the loss of dopamine-secreting cells in the substantia nigra.[92] These dopamine cells are especially vulnerable to damage, and a variety of insults, including ensefalit (as depicted in the book and movie "Awakenings "), repeated sports-related sarsıntılar, and some forms of chemical poisoning such as MPTP, can lead to substantial cell loss, producing a parkinsonian syndrome that is similar in its main features to Parkinson's disease.[93] Most cases of Parkinson's disease, however, are idiyopatik, meaning that the cause of cell death cannot be identified.[93]
The most widely used treatment for parkinsonism is administration of L-DOPA, the metabolic precursor for dopamine.[21] L-DOPA is converted to dopamine in the brain and various parts of the body by the enzyme DOPA decarboxylase.[20] L-DOPA is used rather than dopamine itself because, unlike dopamine, it is capable of crossing the Kan beyin bariyeri.[21] It is often co-administered with an enzyme inhibitor of peripheral decarboxylation gibi carbidopa veya benserazide, to reduce the amount converted to dopamine in the periphery and thereby increase the amount of L-DOPA that enters the brain.[21] When L-DOPA is administered regularly over a long time period, a variety of unpleasant side effects such as dyskinesia often begin to appear; even so, it is considered the best available long-term treatment option for most cases of Parkinson's disease.[21]
L-DOPA treatment cannot restore the dopamine cells that have been lost, but it causes the remaining cells to produce more dopamine, thereby compensating for the loss to at least some degree.[21] In advanced stages the treatment begins to fail because the cell loss is so severe that the remaining ones cannot produce enough dopamine regardless of L-DOPA levels.[21] Other drugs that enhance dopamine function, such as bromokriptin ve pergolid, are also sometimes used to treat Parkinsonism, but in most cases L-DOPA appears to give the best trade-off between positive effects and negative side-effects.[21]
Dopaminergic medications that are used to treat Parkinson's disease are sometimes associated with the development of a dopamine dysregulation syndrome, which involves the overuse of dopaminergic medication and medication-induced compulsive engagement in natural rewards like gambling and sexual activity.[94][95] The latter behaviors are similar to those observed in individuals with a behavioral addiction.[94]
Drug addiction and psychostimulants

Kokain, substituted amphetamines (including metamfetamin ), Adderall, metilfenidat (marketed as Ritalin veya Concerta ), and other psychostimulants exert their effects primarily or partly by increasing dopamine levels in the brain by a variety of mechanisms.[96] Cocaine and methylphenidate are dopamine transporter blockers or geri alım inhibitörleri; onlar non-competitively inhibit dopamine reuptake, resulting in increased dopamine concentrations in the synaptic cleft.[97][98]:54–58 Like cocaine, substituted amphetamines and amphetamine also increase the concentration of dopamine in the synaptic cleft, but by different mechanisms.[30][98]:147–150
The effects of psychostimulants include increases in heart rate, body temperature, and sweating; improvements in alertness, attention, and endurance; increases in pleasure produced by rewarding events; but at higher doses agitation, anxiety, or even loss of contact with reality.[96] Drugs in this group can have a high addiction potential, due to their activating effects on the dopamine-mediated reward system in the brain.[96] However some can also be useful, at lower doses, for treating attention deficit hyperactivity disorder (ADHD) and narcolepsy.[99][100] An important differentiating factor is the onset and duration of action.[96] Cocaine can take effect in seconds if it is injected or inhaled in free base form; the effects last from 5 to 90 minutes.[101] This rapid and brief action makes its effects easily perceived and consequently gives it high addiction potential.[96] Methylphenidate taken in pill form, in contrast, can take two hours to reach peak levels in the bloodstream,[99] and depending on formulation the effects can last for up to 12 hours.[102] These longer acting formulations have the benefit of reducing the potential for abuse, and improving adherence for treatment by using more convenient dosage regimens.[103]

A variety of addictive drugs produce an increase in reward-related dopamine activity.[96] Stimulants such as nikotin, cocaine and methamphetamine promote increased levels of dopamine which appear to be the primary factor in causing addiction. For other addictive drugs such as the opioid heroin, the increased levels of dopamine in the reward system may only play a minor role in addiction.[104] When people addicted to stimulants go through withdrawal, they do not experience the physical suffering associated with alcohol withdrawal veya para çekme from opiates; instead they experience craving, an intense desire for the drug characterized by irritability, restlessness, and other arousal symptoms,[105] brought about by psikolojik bağımlılık.
The dopamine system plays a crucial role in several aspects of addiction. At the earliest stage, genetic differences that alter the expression of dopamine receptors in the brain can predict whether a person will find stimulants appealing or aversive.[106] Consumption of stimulants produces increases in brain dopamine levels that last from minutes to hours.[96] Finally, the chronic elevation in dopamine that comes with repetitive high-dose stimulant consumption triggers a wide-ranging set of structural changes in the brain that are responsible for the behavioral abnormalities which characterize an addiction.[107] Treatment of stimulant addiction is very difficult, because even if consumption ceases, the craving that comes with psychological withdrawal does not.[105] Even when the craving seems to be extinct, it may re-emerge when faced with stimuli that are associated with the drug, such as friends, locations and situations.[105] Association networks in the brain are greatly interlinked.[108]
Psychosis and antipsychotic drugs
Psychiatrists in the early 1950s discovered that a class of drugs known as typical antipsychotics (also known as major sakinleştiriciler ), were often effective at reducing the psikotik symptoms of schizophrenia.[109] The introduction of the first widely used antipsychotic, klorpromazin (Thorazine), in the 1950s, led to the release of many patients with schizophrenia from institutions in the years that followed.[109] By the 1970s researchers understood that these typical antipsychotics worked as antagonistler on the D2 receptors.[109][110] This realization led to the so-called dopamine hypothesis of schizophrenia, which postulates that schizophrenia is largely caused by hyperactivity of brain dopamine systems.[111] The dopamine hypothesis drew additional support from the observation that psychotic symptoms were often intensified by dopamine-enhancing stimulants such as methamphetamine, and that these drugs could also produce psychosis in healthy people if taken in large enough doses.[111] In the following decades other atypical antipsychotics that had fewer serious side effects were developed.[109] Many of these newer drugs do not act directly on dopamine receptors, but instead produce alterations in dopamine activity indirectly.[112] These drugs were also used to treat other psychoses.[109] Antipsychotic drugs have a broadly suppressive effect on most types of active behavior, and particularly reduce the delusional and agitated behavior characteristic of overt psychosis.[110]
Later observations, however, have caused the dopamine hypothesis to lose popularity, at least in its simple original form.[111] For one thing, patients with schizophrenia do not typically show measurably increased levels of brain dopamine activity.[111] Even so, many psychiatrists and neuroscientists continue to believe that schizophrenia involves some sort of dopamine system dysfunction.[109] As the "dopamine hypothesis" has evolved over time, however, the sorts of dysfunctions it postulates have tended to become increasingly subtle and complex.[109]
Psychopharmacologist Stephen M. Stahl suggested in a review of 2018 that in many cases of psychosis, including schizophrenia, three interconnected networks based on dopamine, serotonin, and glutamate - each on its own or in various combinations - contributed to an overexcitation of dopamine D2 receptors in the ventral striatum.[113]
Dikkat eksikliği hiperaktivite bozukluğu
Altered dopamine neurotransmission is implicated in attention deficit hyperactivity disorder (ADHD), a condition associated with impaired cognitive control, in turn leading to problems with regulating attention (attentional control ), inhibiting behaviors (inhibitory control ), and forgetting things or missing details (working memory ), among other problems.[114] There are genetic links between dopamine receptors, the dopamine transporter, and ADHD, in addition to links to other neurotransmitter receptors and transporters.[115] The most important relationship between dopamine and ADHD involves the drugs that are used to treat ADHD.[116] Some of the most effective therapeutic agents for ADHD are psychostimulants such as methylphenidate (Ritalin, Concerta) and amfetamin (Evekeo, Adderall, Dexedrine), drugs that increase both dopamine and norepinephrine levels in the brain.[116] The clinical effects of these psychostimulants in treating ADHD are mediated through the indirect activation of dopamine and norepinephrine receptors, specifically dopamine receptor D1 ve adrenoceptor α2, in the prefrontal cortex.[114][117][118]
Ağrı
Dopamine plays a role in Ağrı processing in multiple levels of the central nervous system including the spinal cord, periaqueductal gray, talamus, basal ganglia, and cingulate cortex.[119] Decreased levels of dopamine have been associated with painful symptoms that frequently occur in Parkinson's disease.[119] Abnormalities in dopaminergic neurotransmission also occur in several painful clinical conditions, including burning mouth syndrome, fibromyalgia, and restless legs syndrome.[119]
Mide bulantısı
Nausea and kusma are largely determined by activity in the alan postrema içinde medulla of brainstem, in a region known as the chemoreceptor trigger zone.[120] This area contains a large population of type D2 dopamine receptors.[120] Consequently, drugs that activate D2 receptors have a high potential to cause nausea.[120] This group includes some medications that are administered for Parkinson's disease, as well as other dopamine agonists gibi apomorphine.[121] In some cases, D2-receptor antagonists such as metoklopramid are useful as anti-nausea drugs.[120]
Comparative biology and evolution
Mikroorganizmalar
There are no reports of dopamine in Archaea, but it has been detected in some types of bakteri Ve içinde tek hücreli aranan Tetrahymena.[122] Perhaps more importantly, there are types of bacteria that contain homologlar of all the enzymes that animals use to synthesize dopamine.[123] It has been proposed that animals derived their dopamine-synthesizing machinery from bacteria, via yatay gen transferi that may have occurred relatively late in evolutionary time, perhaps as a result of the simbiyotik incorporation of bacteria into ökaryotik cells that gave rise to mitokondri.[123]
Hayvanlar
Dopamine is used as a neurotransmitter in most multicellular animals.[124] İçinde süngerler there is only a single report of the presence of dopamine, with no indication of its function;[125] however, dopamine has been reported in the nervous systems of many other radially symmetric species, including the cnidarian Deniz anası, hydra ve bazı mercanlar.[126] This dates the emergence of dopamine as a neurotransmitter back to the earliest appearance of the nervous system, over 500 million years ago in the Kambriyen Dönem. Dopamine functions as a neurotransmitter in omurgalılar, ekinodermler, eklembacaklılar, yumuşakçalar, and several types of solucan.[127][128]
In every type of animal that has been examined, dopamine has been seen to modify motor behavior.[124] İçinde model organizma, nematode Caenorhabditis elegans, it reduces locomotion and increases food-exploratory movements; içinde yassı kurtlar it produces "screw-like" movements; içinde sülükler it inhibits swimming and promotes crawling. Across a wide range of vertebrates, dopamine has an "activating" effect on behavior-switching and response selection, comparable to its effect in mammals.[124][129]
Dopamine has also consistently been shown to play a role in reward learning, in all animal groups.[124] As in all vertebrates – omurgasızlar gibi yuvarlak kurtlar, yassı kurtlar, yumuşakçalar ve common fruit flies can all be trained to repeat an action if it is consistently followed by an increase in dopamine levels.[124] İçinde meyve sinekleri, distinct elements for reward learning suggest a modular structure to the insect reward processing system that broadly parallels that the mammalian one.[130] For example, dopamine regulates short- and long-term learning in monkeys;[131] in fruit flies, different groups of dopamine neurons mediate reward signals for short- and long-term memories.[132]
It had long been believed that arthropods were an exception to this with dopamine being seen as having an adverse effect. Reward was seen to be mediated instead by octopamine, a neurotransmitter closely related to norepinephrine.[133] More recent studies, however, have shown that dopamine does play a part in reward learning in fruit flies. It has also been found that the rewarding effect of octopamine is due to its activating a set of dopaminergic neurons not previously accessed in the research.[133]
Bitkiler
Many plants, including a variety of food plants, synthesize dopamine to varying degrees.[134] The highest concentrations have been observed in bananas—the fruit pulp of kırmızı ve yellow bananas contains dopamine at levels of 40 to 50 parts per million by weight.[134] Potatoes, avocados, broccoli, and Brussels sprouts may also contain dopamine at levels of 1 part per million or more; oranges, tomatoes, spinach, beans, and other plants contain measurable concentrations less than 1 part per million.[134] The dopamine in plants is synthesized from the amino acid tyrosine, by biochemical mechanisms similar to those that animals use.[134] It can be metabolized in a variety of ways, producing melanin and a variety of alkaloidler as byproducts.[134] The functions of plant catecholamines have not been clearly established, but there is evidence that they play a role in the response to stressors such as bacterial infection, act as growth-promoting factors in some situations, and modify the way that sugars are metabolized. The receptors that mediate these actions have not yet been identified, nor have the intracellular mechanisms that they activate.[134]
Dopamine consumed in food cannot act on the brain, because it cannot cross the blood–brain barrier.[21] However, there are also a variety of plants that contain L-DOPA, the metabolic precursor of dopamine.[135] The highest concentrations are found in the leaves and bean pods of plants of the genus Mucuna özellikle Mucuna pruriens (velvet beans), which have been used as a source for L-DOPA as a drug.[136] Another plant containing substantial amounts of L-DOPA is Vicia faba, the plant that produces fava beans (also known as "broad beans"). The level of L-DOPA in the beans, however, is much lower than in the pod shells and other parts of the plant.[137] The seeds of Cassia ve Bauhinia trees also contain substantial amounts of L-DOPA.[135]
In a species of deniz yeşil alg Ulvaria obscura, a major component of some algal blooms, dopamine is present in very high concentrations, estimated at 4.4% of dry weight. There is evidence that this dopamine functions as an anti-herbivore defense, reducing consumption by snails and izopodlar.[138]
As a precursor for melanin
Melanins are a family of dark-pigmented substances found in a wide range of organisms.[139] Chemically they are closely related to dopamine, and there is a type of melanin, known as dopamine-melanin, that can be synthesized by oxidation of dopamine via the enzyme tyrosinase.[139] The melanin that darkens human skin is not of this type: it is synthesized by a pathway that uses L-DOPA as a precursor but not dopamine.[139] However, there is substantial evidence that the neuromelanin that gives a dark color to the brain's substantia nigra is at least in part dopamine-melanin.[140]
Dopamine-derived melanin probably appears in at least some other biological systems as well. Some of the dopamine in plants is likely to be used as a precursor for dopamine-melanin.[141] The complex patterns that appear on butterfly wings, as well as black-and-white stripes on the bodies of insect larvae, are also thought to be caused by spatially structured accumulations of dopamine-melanin.[142]
Tarih ve gelişme
Dopamine was first synthesized in 1910 by George Barger and James Ewens at Wellcome Laboratories in London, England[143] and first identified in the human brain by Kathleen Montagu in 1957. It was named dopamine because it is a monoamine whose precursor in the Barger-Ewens synthesis is 3,4-dihydrÖxyphenylalanine (levodopa or L-DOPA). Dopamine's function as a neurotransmitter was first recognized in 1958 by Arvid Carlsson ve Nils-Åke Hillarp at the Laboratory for Chemical Pharmacology of the National Heart Institute of İsveç.[144] Carlsson was awarded the 2000 Nobel Fizyoloji veya Tıp Ödülü for showing that dopamine is not only a precursor of norepinephrine (noradrenaline) and epinephrine (adrenaline), but is also itself a neurotransmitter.[145]
Polydopamine
Research motivated by adhesive polyphenolic proteins içinde Midye led to the discovery in 2007 that a wide variety of materials, if placed in a solution of dopamine at slightly basic pH, will become coated with a layer of polymerized dopamine, often referred to as polydopamine.[146][147] This polymerized dopamine forms by a spontaneous oxidation reaction, and is formally a type of melanin.[148] Synthesis usually involves reaction of dopamine hydrochloride with Tris as a base in water. The structure of polydopamine is unknown.[147]
Polydopamine coatings can form on objects ranging in size from nanopartiküller to large surfaces.[148] Polydopamine layers have chemical properties that have the potential to be extremely useful, and numerous studies have examined their possible applications.[148] At the simplest level, they can be used for protection against damage by light, or to form capsules for drug delivery.[148] At a more sophisticated level, their adhesive properties may make them useful as substrates for biosensors or other biologically active macromolecules.[148]
Ayrıca bakınız
Referanslar
- ^ a b c d "Dopamine: Biological activity". IUPHAR/BPS guide to pharmacology. International Union of Basic and Clinical Pharmacology. Alındı 29 Ocak 2016.
- ^ Berridge, Kent C. (April 2007). "The debate over dopamine's role in reward: the case for incentive salience". Psikofarmakoloji. 191 (3): 391–431. doi:10.1007/s00213-006-0578-x. ISSN 0033-3158. PMID 17072591. S2CID 468204.
- ^ a b c d e f g h Malenka RC, Nestler EJ, Hyman SE (2009). Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2. baskı). New York: McGraw-Hill Medical. pp. 147–48, 366–67, 375–76. ISBN 978-0-07-148127-4.
- ^ Baliki MN, Mansour A, Baria AT, Huang L, Berger SE, Fields HL, Apkarian AV (October 2013). "Parceling human accumbens into putative core and shell dissociates encoding of values for reward and pain". Nörobilim Dergisi. 33 (41): 16383–93. doi:10.1523/JNEUROSCI.1731-13.2013. PMC 3792469. PMID 24107968.
- ^ a b Wenzel JM, Rauscher NA, Cheer JF, Oleson EB (January 2015). "A role for phasic dopamine release within the nucleus accumbens in encoding aversion: a review of the neurochemical literature". ACS Chemical Neuroscience. 6 (1): 16–26. doi:10.1021/cn500255p. PMC 5820768. PMID 25491156.
Thus, fear-evoking stimuli are capable of differentially altering phasic dopamine transmission across NAcc subregions. The authors propose that the observed enhancement in NAcc shell dopamine likely reflects general motivational salience, perhaps due to relief from a CS-induced fear state when the US (foot shock) is not delivered. This reasoning is supported by a report from Budygin and colleagues112 showing that, in anesthetized rats, the termination of tail pinch results in augmented dopamine release in the shell.
- ^ Puglisi-Allegra S, Ventura R (June 2012). "Prefrontal/accumbal catecholamine system processes high motivational salience". Ön. Behav. Neurosci. 6: 31. doi:10.3389/fnbeh.2012.00031. PMC 3384081. PMID 22754514.
- ^ Moncrieff J (2008). The myth of the chemical cure. A critique of psychiatric drug treatment. Basingstoke, UK: Palgrave MacMillan. ISBN 978-0-230-57432-8.
- ^ Volkow ND, Wang GJ, Kollins SH, Wigal TL, Newcorn JH, Telang F, Fowler JS, Zhu W, Logan J, Ma Y, Pradhan K, Wong C, Swanson JM (September 2009). "Evaluating dopamine reward pathway in ADHD: clinical implications". JAMA. 302 (10): 1084–91. doi:10.1001/jama.2009.1308. PMC 2958516. PMID 19738093.
- ^ "Dopamine". PubChem. Alındı 21 Eylül 2015.
- ^ "Catecholamine". Britannica. Alındı 21 Eylül 2015.
- ^ "Phenylethylamine". ChemicalLand21.com. Alındı 21 Eylül 2015.
- ^ a b c d e f Carter JE, Johnson JH, Baaske DM (1982). "Dopamine Hydrochloride". Analytical Profiles of Drug Substances. 11: 257–72. doi:10.1016/S0099-5428(08)60266-X. ISBN 9780122608117.
- ^ "Specification Sheet". www.sigmaaldrich.com. Alındı 13 Eylül 2019.
- ^ a b c Broadley KJ (March 2010). "The vascular effects of trace amines and amphetamines". Farmakoloji ve Terapötikler. 125 (3): 363–375. doi:10.1016/j.pharmthera.2009.11.005. PMID 19948186.
- ^ a b c Lindemann L, Hoener MC (May 2005). "A renaissance in trace amines inspired by a novel GPCR family". Trends in Pharmacological Sciences. 26 (5): 274–281. doi:10.1016/j.tips.2005.03.007. PMID 15860375.
- ^ a b c d Wang X, Li J, Dong G, Yue J (February 2014). "The endogenous substrates of brain CYP2D". Avrupa Farmakoloji Dergisi. 724: 211–218. doi:10.1016/j.ejphar.2013.12.025. PMID 24374199.
- ^ a b c d e f Seeman P (2009). "Chapter 1: Historical overview: Introduction to the dopamine receptors". In Neve K (ed.). The Dopamine Receptors. Springer. pp. 1–22. ISBN 978-1-60327-333-6.
- ^ "EC 1.14.16.2 – Tyrosine 3-monooxygenase (Homo sapiens)". BRENDA. Technische Universität Braunschweig. 2016 Temmuz. Alındı 7 Ekim 2016.
Substrate: L-phenylalanine + tetrahydrobiopterin + O2
Product: L-tyrosine + 3-hydroxyphenylalanine [(aka m-tyrosine)] + dihydropteridine + H2O
Organism: Homo sapiens
Reaction diagram - ^ "EC 4.1.1.28 – Aromatic-L-amino-acid decarboxylase (Homo sapiens)". BRENDA. Technische Universität Braunschweig. 2016 Temmuz. Alındı 7 Ekim 2016.
Substrate: m-tyrosine
Product: m-tyramine + CO2
Organism: Homo sapiens
Reaction diagram - ^ a b c d e f g h ben j Musacchio JM (2013). "Chapter 1: Enzymes involved in the biosynthesis and degradation of catecholamines". In Iverson L (ed.). Biochemistry of Biogenic Amines. Springer. pp. 1–35. ISBN 978-1-4684-3171-1.
- ^ a b c d e f g h ben j k The National Collaborating Centre for Chronic Conditions, ed. (2006). "Symptomatic pharmacological therapy in Parkinson's disease". Parkinson's Disease. London: Royal College of Physicians. pp. 59–100. ISBN 978-1-86016-283-1. Alındı 24 Eylül 2015.
- ^ a b c d e f g h ben j k Eisenhofer G, Kopin IJ, Goldstein DS (September 2004). "Catecholamine metabolism: a contemporary view with implications for physiology and medicine". Pharmacological Reviews. 56 (3): 331–49. doi:10.1124/pr.56.3.1. PMID 15317907. S2CID 12825309.
- ^ Amin F, Davidson M, Davis KL (1992). "Homovanillic acid measurement in clinical research: a review of methodology". Şizofreni Bülteni. 18 (1): 123–48. doi:10.1093/schbul/18.1.123. PMID 1553492.
- ^ Amin F, Davidson M, Kahn RS, Schmeidler J, Stern R, Knott PJ, Apter S (1995). "Assessment of the central dopaminergic index of plasma HVA in schizophrenia". Şizofreni Bülteni. 21 (1): 53–66. doi:10.1093/schbul/21.1.53. PMID 7770741.
- ^ Sulzer D, Zecca L (February 2000). "Intraneuronal dopamine-quinone synthesis: a review". Neurotoxicity Research. 1 (3): 181–95. doi:10.1007/BF03033289. PMID 12835101. S2CID 21892355.
- ^ Miyazaki I, Asanuma M (June 2008). "Dopaminergic neuron-specific oxidative stress caused by dopamine itself" (PDF). Acta Medica Okayama. 62 (3): 141–50. doi:10.18926/AMO/30942. PMID 18596830.
- ^ a b c d e Grandy DK, Miller GM, Li JX (February 2016). ""TAARgeting Addiction" – The Alamo Bears Witness to Another Revolution: An Overview of the Plenary Symposium of the 2015 Behavior, Biology and Chemistry Conference". Drug and Alcohol Dependence. 159: 9–16. doi:10.1016/j.drugalcdep.2015.11.014. PMC 4724540. PMID 26644139.
TAAR1 is a high-affinity receptor for METH/AMPH and DA
- ^ a b c d Romanelli RJ, Williams JT, Neve KA (2009). "Chapter 6: Dopamine receptor signalling: intracellular pathways to behavior". In Neve KA (ed.). The Dopamine Receptors. Springer. pp. 137–74. ISBN 978-1-60327-333-6.
- ^ a b Eiden LE, Schäfer MK, Weihe E, Schütz B (February 2004). "The vesicular amine transporter family (SLC18): amine/proton antiporters required for vesicular accumulation and regulated exocytotic secretion of monoamines and acetylcholine". Pflügers Archiv. 447 (5): 636–40. doi:10.1007/s00424-003-1100-5. PMID 12827358. S2CID 20764857.
- ^ a b Miller GM (January 2011). "The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity". Journal of Neurochemistry. 116 (2): 164–76. doi:10.1111/j.1471-4159.2010.07109.x. PMC 3005101. PMID 21073468.
- ^ a b Beaulieu JM, Gainetdinov RR (March 2011). "The physiology, signaling, and pharmacology of dopamine receptors". Pharmacological Reviews. 63 (1): 182–217. doi:10.1124/pr.110.002642. PMID 21303898. S2CID 2545878.
- ^ Torres GE, Gainetdinov RR, Caron MG (January 2003). "Plasma membrane monoamine transporters: structure, regulation and function". Doğa Yorumları. Sinirbilim. 4 (1): 13–25. doi:10.1038/nrn1008. PMID 12511858. S2CID 21545649.
- ^ a b c d Rice ME, Patel JC, Cragg SJ (December 2011). "Dopamine release in the basal ganglia". Sinirbilim. 198: 112–37. doi:10.1016/j.neuroscience.2011.08.066. PMC 3357127. PMID 21939738.
- ^ Schultz W (2007). "Multiple dopamine functions at different time courses". Annual Review of Neuroscience. 30: 259–88. doi:10.1146/annurev.neuro.28.061604.135722. PMID 17600522. S2CID 13503219.
- ^ a b c d e f g h ben Björklund A, Dunnett SB (May 2007). "Dopamine neuron systems in the brain: an update". Trends in Neurosciences. 30 (5): 194–202. doi:10.1016/j.tins.2007.03.006. PMID 17408759. S2CID 14239716.
- ^ a b Dahlstroem A, Fuxe K (1964). "Evidence for the existence of monoamine-containing neurons in the central nervous system. I. Demonstration of monoamines in the cell bodies of brain stem neurons". Acta Physiologica Scandinavica. Ek. 232: SUPPL 232:1–55. PMID 14229500.
- ^ a b c d Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2. baskı). New York: McGraw-Hill Medical. pp. 147–48, 154–57. ISBN 978-0-07-148127-4.
- ^ Christine CW, Aminoff MJ (September 2004). "Clinical differentiation of parkinsonian syndromes: prognostic and therapeutic relevance". Amerikan Tıp Dergisi. 117 (6): 412–19. doi:10.1016/j.amjmed.2004.03.032. PMID 15380498.
- ^ Fadok JP, Dickerson TM, Palmiter RD (September 2009). "Dopamine is necessary for cue-dependent fear conditioning". Nörobilim Dergisi. 29 (36): 11089–97. doi:10.1523/JNEUROSCI.1616-09.2009. PMC 2759996. PMID 19741115.
- ^ Tang W, Kochubey O, Kintscher M, Schneggenburger R (April 2020). "A VTA to basal amygdala dopamine projection contributes to signal salient somatosensory events during fear learning". Nörobilim Dergisi. 40 (20): JN–RM–1796-19. doi:10.1523/JNEUROSCI.1796-19.2020. PMC 7219297. PMID 32277045.
- ^ Jo YS, Heymann G, Zweifel LS (November 2018). "Dopamine Neurons Reflect the Uncertainty in Fear Generalization". Nöron. 100 (4): 916–925.e3. doi:10.1016/j.neuron.2018.09.028. PMC 6226002. PMID 30318411.
- ^ a b Paulus W, Schomburg ED (June 2006). "Dopamine and the spinal cord in restless legs syndrome: does spinal cord physiology reveal a basis for augmentation?". Sleep Medicine Reviews. 10 (3): 185–96. doi:10.1016/j.smrv.2006.01.004. PMID 16762808.
- ^ a b c d e f Ben-Jonathan N, Hnasko R (December 2001). "Dopamine as a prolactin (PRL) inhibitor". Endocrine Reviews. 22 (6): 724–63. doi:10.1210/er.22.6.724. PMID 11739329.
- ^ a b c d Witkovsky P (January 2004). "Dopamine and retinal function". Documenta Ophthalmologica. Advances in Ophthalmology. 108 (1): 17–40. doi:10.1023/B:DOOP.0000019487.88486.0a. PMID 15104164. S2CID 10354133.
- ^ a b Fix JD (2008). "Basal Ganglia and the Striatal Motor System". Neuroanatomy (Board Review Series) (4. baskı). Baltimore: Wulters Kluwer & Lippincott Wiliams & Wilkins. pp. 274–81. ISBN 978-0-7817-7245-7.
- ^ a b c d e f Chakravarthy VS, Joseph D, Bapi RS (September 2010). "What do the basal ganglia do? A modeling perspective". Biological Cybernetics. 103 (3): 237–53. doi:10.1007/s00422-010-0401-y. PMID 20644953. S2CID 853119.
- ^ a b c d Floresco SB (January 2015). "The nucleus accumbens: an interface between cognition, emotion, and action". Yıllık Psikoloji İncelemesi. 66: 25–52. doi:10.1146/annurev-psych-010213-115159. PMID 25251489.
- ^ a b Balleine BW, Dezfouli A, Ito M, Doya K (2015). "Hierarchical control of goal-directed action in the cortical–basal ganglia network". Current Opinion in Behavioral Sciences. 5: 1–7. doi:10.1016/j.cobeha.2015.06.001. S2CID 53148662.
- ^ a b c Jankovic J (April 2008). "Parkinson's disease: clinical features and diagnosis". Nöroloji, Nöroşirürji ve Psikiyatri Dergisi. 79 (4): 368–76. doi:10.1136/jnnp.2007.131045. PMID 18344392.
- ^ Pattij T, Vanderschuren LJ (April 2008). "The neuropharmacology of impulsive behaviour". Trends in Pharmacological Sciences. 29 (4): 192–99. doi:10.1016/j.tips.2008.01.002. PMID 18304658.
- ^ a b c d e f g h ben j k l m Schultz W (July 2015). "Neuronal Reward and Decision Signals: From Theories to Data". Fizyolojik İncelemeler. 95 (3): 853–951. doi:10.1152/physrev.00023.2014. PMC 4491543. PMID 26109341.
- ^ a b c Robinson TE, Berridge KC (1993). "The neural basis of drug craving: an incentive-sensitization theory of addiction". Brain Research. Beyin Araştırma İncelemeleri. 18 (3): 247–91. doi:10.1016/0165-0173(93)90013-p. hdl:2027.42/30601. PMID 8401595. S2CID 13471436.
- ^ Wright JS, Panksepp J (2012). "An evolutionary framework to understand foraging, wanting, and desire: the neuropsychology of the SEEKING system". Neuropsychoanalysis. 14 (1): 5–39. doi:10.1080/15294145.2012.10773683. S2CID 145747459. Alındı 24 Eylül 2015.
- ^ a b c d e Berridge KC, Robinson TE, Aldridge JW (February 2009). "Dissecting components of reward: 'liking', 'wanting', and learning". Farmakolojide Güncel Görüş. 9 (1): 65–73. doi:10.1016/j.coph.2008.12.014. PMC 2756052. PMID 19162544.
- ^ Bromberg-Martin ES, Matsumoto M, Hikosaka O (December 2010). "Dopamine in motivational control: rewarding, aversive, and alerting". Nöron. 68 (5): 815–34. doi:10.1016/j.neuron.2010.11.022. PMC 3032992. PMID 21144997.
- ^ Yager LM, Garcia AF, Wunsch AM, Ferguson SM (August 2015). "The ins and outs of the striatum: Role in drug addiction". Sinirbilim. 301: 529–41. doi:10.1016/j.neuroscience.2015.06.033. PMC 4523218. PMID 26116518.
- ^ a b Saddoris MP, Cacciapaglia F, Wightman RM, Carelli RM (August 2015). "Differential Dopamine Release Dynamics in the Nucleus Accumbens Core and Shell Reveal Complementary Signals for Error Prediction and Incentive Motivation". Nörobilim Dergisi. 35 (33): 11572–82. doi:10.1523/JNEUROSCI.2344-15.2015. PMC 4540796. PMID 26290234.
- ^ Berridge KC, Kringelbach ML (May 2015). "Pleasure systems in the brain". Nöron. 86 (3): 646–64. doi:10.1016/j.neuron.2015.02.018. PMC 4425246. PMID 25950633.
- ^ a b c Wise RA (1996). "Addictive drugs and brain stimulation reward". Annual Review of Neuroscience. 19: 319–40. doi:10.1146/annurev.ne.19.030196.001535. PMID 8833446.
- ^ Wise RA (October 2008). "Dopamine and reward: the anhedonia hypothesis 30 years on". Neurotoxicity Research. 14 (2–3): 169–83. doi:10.1007/BF03033808. PMC 3155128. PMID 19073424.
- ^ Arias-Carrión O, Pöppel E (2007). "Dopamine, learning and reward-seeking behavior". Acta Neurobiol Exp. 67 (4): 481–88.
- ^ Ikemoto, Satoshi (November 2007). "Dopamin ödül devresi: ventral orta beyinden nükleus akümbens-olfaktör tüberkül kompleksine iki projeksiyon sistemi". Beyin Araştırma İncelemeleri. 56 (1): 27–78. doi:10.1016 / j.brainresrev.2007.05.004. ISSN 0165-0173. PMC 2134972. PMID 17574681.
- ^ a b Ferreri L, Mas-Herrero E, Zatorre RJ, Ripollés P, Gomez-Andres A, Alicart H, Olivé G, Marco-Pallarés J, Antonijoan RM, Valle M, Riba J, Rodriguez-Fornells A (Ocak 2019). "Dopamin, müzikle ortaya çıkan ödül deneyimlerini modüle eder". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 116 (9): 3793–3798. doi:10.1073 / pnas.1811878116. PMC 6397525. PMID 30670642. Lay özeti – Nörobilim Haberleri (24 Ocak 2019).
Keyifli müzik dinlemeye genellikle tüylerim diken diken veya omurgada titreme gibi ölçülebilir bedensel tepkiler eşlik eder, buna genellikle "titreme" veya "frisson" denir. ... Genel olarak, sonuçlarımız, farmakolojik müdahalelerin müziğin ortaya çıkardığı ödül tepkilerini çift yönlü olarak değiştirdiğini açıkça ortaya koydu. Özellikle, risperidonun katılımcıların müzik zevki yaşama yeteneğini bozduğunu, oysa levodopa'nın bunu arttırdığını bulduk. ... Burada, tersine, insan deneklerinde soyut ödüllere verilen yanıtları inceleyerek, dopaminerjik iletimin manipülasyonunun hem hazzı (yani, EDA tarafından ölçülen titreme ve duygusal uyarılmayı bildiren süre miktarı) hem de müzikal ödülün motivasyon bileşenlerini etkilediğini gösteriyoruz. (harcamaya istekli para). Bu bulgular, dopaminerjik sinyallemenin, birincil ve ikincil ödüllerde gösterildiği gibi sadece motivasyonel tepkiler için değil, aynı zamanda müziğe karşı hedonik tepkiler için de olmazsa olmaz bir koşul olduğunu öne sürüyor. Bu sonuç, dopaminin diğer soyut ödül türleri tarafından elde edilen algılanan hoşluğa aracılık ettiğini (37) ve yiyecek gibi birincil ödüllerle ilgili hayvan modellerinde önceki bulgulara meydan okuduğunu gösteren yeni bulguları desteklemektedir (42, 43).
- ^ a b Goupil L, Aucouturier JJ (Şubat 2019). "Müzik zevki ve müzikal duygular". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 116 (9): 3364–3366. doi:10.1073 / pnas.1900369116. PMC 6397567. PMID 30770455.
PNAS'ta yayınlanan bir farmakolojik çalışmada, Ferreri ve ark. (1) levodopa veya risperidon kullanarak dopamin sinyallemesini artırmanın veya inhibe etmenin müzik dinlerken yaşanan zevki modüle ettiğine dair kanıtlar sunar. ... Sadece korelasyonel değil, aynı zamanda müzikal zevkte dopaminin nedensel imasını da saptamak için yapılan son bir salvoda, yazarlar striatumdaki dopaminerjik sinyali doğrudan manipüle etmeye, ilk önce katılımcılarının üzerine uyarıcı ve inhibe edici transkraniyal manyetik uyarım uygulayarak yöneldiler. Sol dorsolateral prefrontal korteks, striatal fonksiyonu modüle ettiği bilinen bir bölge (5) ve son olarak, mevcut çalışmada, her ikisi de algılanan zevki, uyarılmanın fizyolojik ölçümlerini etkileyen, dopamin sinaptik kullanılabilirliğini (1) değiştirebilen farmasötik ajanlar uygulayarak, ve müziğe öngörülen yönde atanan parasal değer. ... Duygunun müzikal ifadesi sorusu, PNAS da dahil olmak üzere uzun bir araştırma geçmişine sahipken (6) ve 1990'ların psikofizyolojik araştırma kolu, müzik zevkin otonom sinir sistemini harekete geçirebileceğini zaten belirlemişti (7), Yazarların ödül sisteminin müzikal duygulardaki imasını göstermesi, bunların günlük bilişsel, sosyal ve duyuşsal işlevlerimizin nörobiyolojisini bilgilendirmek için tam meşruiyete sahip gerçek duygular olduklarının ilk kanıtı olarak alındı (8). Bu arada, bu çalışma türü, Ferreri ve ark. (1), makul bir şekilde müzik bilimleri alanı için araştırma fonu çekmek için bu topluluktaki diğerlerinden daha fazlasını yaptı.
Ferreri ve ark. (1) müzik zevkin antik ödül / değerleme sistemlerinin (striatal-limbik-paralimbik) filogenetik olarak daha gelişmiş algılama / tahmin sistemleri (temporofrontal) ile etkileşiminden ortaya çıktığı zorlayıcı bir nörobiyolojik model için en son desteği sağlar. - ^ a b Missale C, Nash SR, Robinson SW, Jaber M, Caron MG (Ocak 1998). "Dopamin reseptörleri: yapıdan işleve" (PDF). Fizyolojik İncelemeler. 78 (1): 189–225. doi:10.1152 / physrev.1998.78.1.189. PMID 9457173. S2CID 223462.
- ^ a b Buttarelli FR, Fanciulli A, Pellicano C, Pontieri FE (Haziran 2011). "Periferik kan lenfositlerindeki dopaminerjik sistem: fizyolojiden farmakolojiye ve nöropsikiyatrik bozukluklara potansiyel uygulamalardan". Güncel Nörofarmakoloji. 9 (2): 278–88. doi:10.2174/157015911795596612. PMC 3131719. PMID 22131937.
- ^ a b Sarkar C, Basu B, Chakroborty D, Dasgupta PS, Basu S (Mayıs 2010). "Dopaminin bağışıklık düzenleyici rolü: bir güncelleme". Beyin, Davranış ve Bağışıklık. 24 (4): 525–28. doi:10.1016 / j.bbi.2009.10.015. PMC 2856781. PMID 19896530.
- ^ Hussain T, Lokhandwala MF (Şubat 2003). "Böbrek dopamin reseptörleri ve hipertansiyon". Deneysel Biyoloji ve Tıp. 228 (2): 134–42. doi:10.1177/153537020322800202. PMID 12563019. S2CID 10896819.
- ^ Choi MR, Kouyoumdzian NM, Rukavina Mikusic NL, Kravetz MC, Rosón MI, Rodríguez Fermepin M, Fernández BE (Mayıs 2015). "Renal dopaminerjik sistem: Patofizyolojik çıkarımlar ve klinik perspektifler". Dünya Nefroloji Dergisi. 4 (2): 196–212. doi:10.5527 / wjn.v4.i2.196. PMC 4419129. PMID 25949933.
- ^ Carey RM (Eylül 2001). "Theodore Cooper Ders: Böbrek dopamin sistemi: sodyum homeostazı ve kan basıncının parakrin düzenleyicisi". Hipertansiyon. 38 (3): 297–302. doi:10.1161 / hy0901.096422. PMID 11566894.
- ^ a b c d e Rubí B, Maechler P (Aralık 2010). "Minireview: periferik dopamin için metabolik kontrol ve tümör büyümesi üzerindeki yeni roller: hadi dengeyi arayalım". Endokrinoloji. 151 (12): 5570–81. doi:10.1210 / tr.2010-0745. PMID 21047943.
- ^ "DSÖ Model Temel İlaç Listesi" (PDF). Dünya Sağlık Örgütü. Ekim 2013. Alındı 24 Eylül 2015.
- ^ Noori S, Friedlich P, Seri I (2003). "Dopaminin Gelişimsel Olarak Düzenlenmiş Kardiyovasküler, Renal ve Nöroendokrin Etkileri Farmakoloji İncelemesi". NeoReviews. 4 (10): e283 – e288. doi:10.1542 / neo.4-10-e283. Alındı 24 Eylül 2015.
- ^ a b Bhatt-Mehta V, Nahata MC (1989). "Pediyatrik tedavide dopamin ve dobutamin". Farmakoterapi. 9 (5): 303–14. doi:10.1002 / j.1875-9114.1989.tb04142.x. PMID 2682552. S2CID 25614283.
- ^ a b c Bronwen JB, Şövalyeler KM (2009). Sağlık Profesyonelleri için Farmakoloji (2. baskı). Elsevier Avustralya. s. 192. ISBN 978-0-7295-3929-6.
- ^ De Backer D, Biston P, Devriendt J, Madl C, Chochrad D, Aldecoa C, Brasseur A, Defrance P, Gottignies P, Vincent JL (Mart 2010). "Şok tedavisinde dopamin ve norepinefrinin karşılaştırılması" (PDF). New England Tıp Dergisi. 362 (9): 779–89. doi:10.1056 / NEJMoa0907118. PMID 20200382. S2CID 2208904.
- ^ Karthik S, Lizbon A (2006). "Yoğun bakım ünitesinde düşük doz dopamin". Diyaliz Seminerleri. 19 (6): 465–71. doi:10.1111 / j.1525-139X.2006.00208.x. PMID 17150046. S2CID 22538344.
- ^ Musa, Scott. "Dopamin". Aile Hekimliği Defteri. Alındı 1 Şubat 2016.
- ^ Katritsis DG, Gersh BJ, Camm AJ (19 Eylül 2013). Klinik Kardiyoloji: Güncel Uygulama Kılavuzları. OUP Oxford. ISBN 978-0-19-150851-6.
Dopamin beta-1, beta-2, alfa-1 ve dopaminerjik reseptörlere bağlanır
- ^ Lewis RJ (2004). Sax'ın Endüstriyel Malzemelerin Tehlikeli Özellikleri (11. baskı). Hoboken, NJ.: Wiley & Sons. s. 1552. ISBN 978-0-471-47662-7.
- ^ Deng WP, Wong KA, Kirk KL (2002). "2-, 5- ve 6-floro- ve 2,6-difloro-L-DOPA'nın uygun sentezleri". Tetrahedron: Asimetri. 13 (11): 1135–40. doi:10.1016 / S0957-4166 (02) 00321-X.
- ^ Standaert DG, Walsh RR (2011). "Dopaminerjik nörotransmisyonun farmakolojisi". Taşçıyan AH, Armstrong EJ, Golan DE (editörler). Farmakolojinin İlkeleri: İlaç Tedavisinin Patofizyolojik Temeli. Lippincott Williams ve Wilkins. s. 186–206. ISBN 978-1-4511-1805-6.
- ^ Mobbs CV, Hof PR (2009). Yaşlanmanın sinirbilim el kitabı. Amsterdam: Elsevier / Academic Press. ISBN 978-0-12-374898-0. OCLC 299710911.
- ^ Ota M, Yasuno F, Ito H, Seki C, Nozaki S, Asada T, Suhara T (Temmuz 2006). "Yaşayan insan beynindeki dopamin sentezinin yaşa bağlı düşüşü, L-P-11C] DOPA ile pozitron emisyon tomografisi ile ölçülmüştür". Yaşam Bilimleri. 79 (8): 730–36. doi:10.1016 / j.lfs.2006.02.017. PMID 16580023.
- ^ Kaasinen V, Vilkman H, Hietala J, Någren K, Helenius H, Olsson H, Farde L, Rinne J (2000). "İnsan beyninin ekstrastriatal bölgelerinde yaşa bağlı dopamin D2 / D3 reseptör kaybı". Yaşlanmanın Nörobiyolojisi. 21 (5): 683–68. doi:10.1016 / S0197-4580 (00) 00149-4. PMID 11016537. S2CID 40871554.
- ^ Wang Y, Chan GL, Holden JE, Dobko T, Mak E, Schulzer M, Huser JM, Snow BJ, Ruth TJ, Calne DB, Stoessl AJ (Eylül 1998). "İnsan beynindeki dopamin D1 reseptörlerinin yaşa bağlı düşüşü: bir PET çalışması". Sinaps. 30 (1): 56–61. doi:10.1002 / (SICI) 1098-2396 (199809) 30: 1 <56 :: AID-SYN7> 3.0.CO; 2-J. PMID 9704881.
- ^ a b Wong DF, Wagner HN, Dannals RF, Links JM, Frost JJ, Ravert HT, Wilson AA, Rosenbaum AE, Gjedde A, Douglass KH (Aralık 1984). "Yaşın, yaşayan insan beyninde pozitron tomografi ile ölçülen dopamin ve serotonin reseptörleri üzerindeki etkileri". Bilim. 226 (4681): 1393–96. Bibcode:1984Sci ... 226.1393W. doi:10.1126 / science.6334363. PMID 6334363. S2CID 24278577.
- ^ a b Wang E, Snyder S (1998). Yaşlanan beynin el kitabı. San Diego, California: Academic Press. ISBN 978-0-12-734610-6. OCLC 636693117.
- ^ Chang L, Jiang CS, Ernst T (Ocak 2009). "Yaşın ve cinsiyetin beyin glutamatı ve diğer metabolitler üzerindeki etkileri". Manyetik Rezonans Görüntüleme. 27 (1): 142–45. doi:10.1016 / j.mri.2008.06.002. PMC 3164853. PMID 18687554.
- ^ Dobryakova E, Genova HM, DeLuca J, Wylie GR (12 Mart 2015). "Multipl skleroz ve diğer nörolojik bozukluklarda yorgunluğun dopamin dengesizliği hipotezi". Nörolojide Sınırlar. 6: 52. doi:10.3389 / fneur.2015.00052. PMC 4357260. PMID 25814977.
- ^ Marino F, Cosentino M (Nisan 2016). "Multipl skleroz: MS için dopaminerjik ilaçların yeniden kullanılması - kanıtlar artmaktadır". Doğa Yorumları. Nöroloji. 12 (4): 191–2. doi:10.1038 / nrneurol.2016.33. PMID 27020558. S2CID 26319461.
- ^ Dickson DV (2007). "Hareket bozukluklarının nöropatolojisi". Tolosa E, Jankovic JJ (editörler). Parkinson hastalığı ve hareket bozuklukları. Hagerstown, MD: Lippincott Williams & Wilkins. s. 271–83. ISBN 978-0-7817-7881-7.
- ^ a b Tuite PJ, Krawczewski K (Nisan 2007). "Parkinsonizm: tanıya sistemlerin gözden geçirilmesi yaklaşımı". Nörolojide Seminerler. 27 (2): 113–22. doi:10.1055 / s-2007-971174. PMID 17390256.
- ^ a b Olsen CM (Aralık 2011). "Doğal ödüller, nöroplastisite ve ilaç dışı bağımlılıklar". Nörofarmakoloji. 61 (7): 1109–22. doi:10.1016 / j.neuropharm.2011.03.010. PMC 3139704. PMID 21459101.
- ^ Ceravolo R, Frosini D, Rossi C, Bonuccelli U (Kasım 2010). "Parkinson hastalığında bağımlılık spektrumu: dopamin düzensizliği sendromundan dürtü kontrol bozukluklarına kadar". Nöroloji Dergisi. 257 (Ek 2): S276–83. doi:10.1007 / s00415-010-5715-0. PMID 21080189. S2CID 19277026.
- ^ a b c d e f g Ghodse H (2010). Ghodse'nin İlaçları ve Bağımlılık Yapan Davranışı: Tedavi Rehberi (4. baskı). Cambridge University Press. sayfa 87–92. ISBN 978-1-139-48567-8.
- ^ DJ'i iyileştir, Pierce DM (2006). "Metilfenidat ve izomerleri: bir transdermal uygulama sistemi kullanarak dikkat eksikliği hiperaktivite bozukluğunun tedavisinde rolleri". CNS İlaçları. 20 (9): 713–38. doi:10.2165/00023210-200620090-00002. PMID 16953648. S2CID 39535277.
- ^ a b Freye E (2009). Kokain, amfetaminler, ecstasy ve ilgili tasarımcı ilaçlarının farmakolojisi ve kötüye kullanımı, etki tarzları, kötüye kullanım tedavisi ve sarhoşluk hakkında kapsamlı bir inceleme. Dordrecht: Springer. ISBN 978-90-481-2448-0.
- ^ a b Kimko HC, Cross JT, Abernethy DR (Aralık 1999). "Metilfenidatın farmakokinetiği ve klinik etkinliği". Klinik Farmakokinetik. 37 (6): 457–70. doi:10.2165/00003088-199937060-00002. PMID 10628897. S2CID 397390.
- ^ Mignot EJ (Ekim 2012). "Narkolepsi ve hipersomni sendromlarının tedavisi için pratik bir kılavuz". Nöroterapötikler. 9 (4): 739–52. doi:10.1007 / s13311-012-0150-9. PMC 3480574. PMID 23065655.
- ^ Zimmerman JL (Ekim 2012). "Kokain zehirlenmesi". Yoğun Bakım Klinikleri. 28 (4): 517–26. doi:10.1016 / j.ccc.2012.07.003. PMID 22998988.
- ^ "DailyMed - QUILLIVANT XR-metilfenidat hidroklorür süspansiyonu, uzatılmış salım". dailymed.nlm.nih.gov. Alındı 11 Temmuz 2020.
- ^ López, Frank A .; Leroux, Jacques R. (2013). "Dikkat eksikliği / hiperaktivite bozukluğunun tedavisi için uzun etkili uyarıcılar: devam eden klinik zorlukları ele almak için uzun süreli salınımlı formülasyonlara ve ön ilaç lisdexamfetamin dimesilata odaklanma". Dikkat Eksikliği ve Hiperaktivite Bozuklukları. 5 (3): 249–265. doi:10.1007 / s12402-013-0106-x. ISSN 1866-6116. PMC 3751218. PMID 23564273.
- ^ Nutt DJ, Lingford-Hughes A, Erritzoe D, Stokes PR (Mayıs 2015). "Dopamin bağımlılığı teorisi: 40 yıllık iniş ve çıkışlar" (PDF). Doğa Yorumları. Sinirbilim. 16 (5): 305–12. doi:10.1038 / nrn3939. PMID 25873042. S2CID 205511111.
- ^ a b c Sinha R (Ağustos 2013). "Uyuşturucu aşermesinin klinik nörobiyolojisi". Nörobiyolojide Güncel Görüş. 23 (4): 649–54. doi:10.1016 / j.conb.2013.05.001. PMC 3735834. PMID 23764204.
- ^ Volkow ND, Baler RD (Ocak 2014). "Bağımlılık bilimi: Nörobiyolojik karmaşıklığı ortaya çıkarmak". Nörofarmakoloji. 76 Pt B: 235–49. doi:10.1016 / j.neuropharm.2013.05.007. PMC 3818510. PMID 23688927.
- ^ Nestler EJ (Aralık 2012). "Uyuşturucu bağımlılığının transkripsiyonel mekanizmaları". Klinik Psikofarmakoloji ve Sinirbilim. 10 (3): 136–43. doi:10.9758 / cpn.2012.10.3.136. PMC 3569166. PMID 23430970.
- ^ Yeo BT, Krienen FM, Sepulcre J, Sabuncu MR, Lashkari D, Hollinshead M, Roffman JL, Smoller JW, Zöllei L, Polimeni JR, Fischl B, Liu H, Buckner RL (Eylül 2011). "İnsan serebral korteksinin içsel işlevsel bağlantıyla tahmin edilen organizasyonu". Nörofizyoloji Dergisi. 106 (3): 1125–65. doi:10.1152 / jn.00338.2011. PMC 3174820. PMID 21653723.
- ^ a b c d e f g Healy D (2004). Psikofarmakolojinin Oluşumu. Harvard Üniversitesi Yayınları. s. 37–73. ISBN 978-0-674-01599-9.
- ^ a b Brunton L. Goodman ve Gilman'ın Terapötiklerin Farmakolojik Temelleri (12. baskı). McGraw Hill. sayfa 417–55.
- ^ a b c d Howes OD, Kapur S (Mayıs 2009). "Şizofreninin dopamin hipotezi: sürüm III - son ortak yol". Şizofreni Bülteni. 35 (3): 549–62. doi:10.1093 / schbul / sbp006. PMC 2669582. PMID 19325164.
- ^ Horacek J, Bubenikova-Valesova V, Kopecek M, Palenicek T, Dockery C, Mohr P, Höschl C (2006). "Atipik antipsikotik ilaçların etki mekanizması ve şizofreninin nörobiyolojisi". CNS İlaçları. 20 (5): 389–409. doi:10.2165/00023210-200620050-00004. PMID 16696579. S2CID 18226404.
- ^ Stahl SM (2018). "Şizofreninin dopamin hipotezinin ötesinde, üç nöral psikoz ağına: dopamin, serotonin ve glutamat" (PDF). CNS Spectr. 23 (3): 187–191. doi:10.1017 / S1092852918001013. PMID 29954475.
- ^ a b Malenka RC, Nestler EJ, Hyman SE (2009). "Bölüm 10 ve 13". Sydor A, Brown RY (editörler). Moleküler Nörofarmakoloji: Klinik Nörobilim Vakfı (2. baskı). New York: McGraw-Hill Medical. sayfa 266, 318–23. ISBN 978-0-07-148127-4.
- ^ Wu J, Xiao H, Sun H, Zou L, Zhu LQ (Haziran 2012). "DEHB'de dopamin reseptörlerinin rolü: sistematik bir meta-analiz". Moleküler Nörobiyoloji. 45 (3): 605–20. doi:10.1007 / s12035-012-8278-5. PMID 22610946. S2CID 895006.
- ^ a b Berridge CW, Devilbiss DM (Haziran 2011). "Bilişsel güçlendiriciler olarak psikostimülanlar: prefrontal korteks, katekolaminler ve dikkat eksikliği / hiperaktivite bozukluğu". Biyolojik Psikiyatri. 69 (12): e101–11. doi:10.1016 / j.biopsych.2010.06.023. PMC 3012746. PMID 20875636.
- ^ Spencer RC, Devilbiss DM, Berridge CW (Haziran 2015). "Psikostimülanların biliş geliştirici etkileri, prefrontal kortekste doğrudan eylemi içerir". Biyolojik Psikiyatri. 77 (11): 940–50. doi:10.1016 / j.biopsych.2014.09.013. PMC 4377121. PMID 25499957.
- ^ Ilieva IP, Hook CJ, Farah MJ (Haziran 2015). "Reçeteli Uyarıcıların Sağlıklı Önleyici Kontrol, Çalışma Belleği ve Epizodik Bellek Üzerindeki Etkileri: Bir Meta-analiz". Bilişsel Sinirbilim Dergisi. 27 (6): 1069–89. doi:10.1162 / jocn_a_00776. PMID 25591060. S2CID 15788121.
- ^ a b c Wood PB (Mayıs 2008). "Ağrı ve analjezide merkezi dopaminin rolü". Nöroterapötiklerin Uzman Değerlendirmesi. 8 (5): 781–97. doi:10.1586/14737175.8.5.781. PMID 18457535. S2CID 24325199.
- ^ a b c d Flake ZA, Scalley RD, Bailey AG (Mart 2004). "Pratik antiemetik seçimi". Amerikan Aile Hekimi. 69 (5): 1169–74. PMID 15023018.
- ^ Connolly BS, Lang AE (2014). "Parkinson hastalığının farmakolojik tedavisi: bir inceleme". JAMA. 311 (16): 1670–83. doi:10.1001 / jama.2014.3654. PMID 24756517.
- ^ Roshchina VV (2010). "Mikrobiyal, bitki ve hayvan hücrelerinde nörotransmiterlerin evrimsel değerlendirmeleri". Lyte M, Primrose PE (editörler). Mikrobiyal Endokrinoloji. New York: Springer. sayfa 17–52. ISBN 978-1-4419-5576-0.
- ^ a b Iyer LM, Aravind L, Coon SL, Klein DC, Koonin EV (Temmuz 2004). "Hayvanlarda hücre-hücre sinyallemesinin evrimi: bakterilerden geç yatay gen transferinin bir rolü var mıydı?" Genetikte Eğilimler. 20 (7): 292–99. doi:10.1016 / j.tig.2004.05.007. PMID 15219393.
- ^ a b c d e Barron AB, Søvik E, Cornish JL (2010). "Hayvan filumlarında ödül arama davranışında dopaminin ve ilgili bileşiklerin rolü". Davranışsal Sinirbilimde Sınırlar. 4: 163. doi:10.3389 / fnbeh.2010.00163. PMC 2967375. PMID 21048897.
- ^ Liu H, Mishima Y, Fujiwara T, Nagai H, Kitazawa A, Mine Y, vd. (2004). "Araguspongine / Xestospongin alkaloidinin yeni bir stereoizomeri olan Araguspongine M'nin ve deniz süngerinden elde edilen dopaminin izolasyonu Neopetrosia exigua Palau'da toplandı ". Deniz İlaçları. 2 (4): 154–63. doi:10.3390 / md204154. PMC 3783253.
- ^ Kass-Simon G, Pierobon P (Ocak 2007). "Cnidarian kimyasal nörotransmisyon, güncellenmiş bir genel bakış". Karşılaştırmalı Biyokimya ve Fizyoloji. Bölüm A, Moleküler ve Bütünleştirici Fizyoloji. 146 (1): 9–25. doi:10.1016 / j.cbpa.2006.09.008. PMID 17101286.
- ^ Cottrell GA (Ocak 1967). "Bazı omurgasız türlerinin sinir dokusunda dopamin ve noradrenalin oluşumu". İngiliz Farmakoloji ve Kemoterapi Dergisi. 29 (1): 63–69. doi:10.1111 / j.1476-5381.1967.tb01939.x. PMC 1557178. PMID 19108240.
- ^ Kindt KS, Quast KB, Giles AC, De S, Hendrey D, Nicastro I, Rankin CH, Schafer WR (Ağustos 2007). "Dopamin, C. elegans'ta duyusal plastisitenin içeriğe bağlı modülasyonuna aracılık eder". Nöron. 55 (4): 662–76. doi:10.1016 / j.neuron.2007.07.023. PMID 17698017. S2CID 2092645.
- ^ Kalivas PW, Stewart J (1 Eylül 1991). "Motor aktivitesinin ilaç ve stres kaynaklı duyarlılaşmasının başlatılması ve ekspresyonunda dopamin iletimi". Beyin Araştırması. Beyin Araştırma İncelemeleri. 16 (3): 223–44. doi:10.1016 / 0165-0173 (91) 90007-U. PMID 1665095. S2CID 10775295.
- ^ Perry CJ, Barron AB (2013). "Böceklerde ödülün sinirsel mekanizmaları" (PDF). Yıllık Entomoloji İncelemesi. 58 (1): 543–62. doi:10.1146 / annurev-ento-120811-153631. PMID 23020615. S2CID 19678766.
- ^ Takikawa Y, Kawagoe R, Hikosaka O (Ekim 2004). "Sakkadların pozisyon-ödül haritalamasına kısa ve uzun vadeli adaptasyonunda orta beyin dopamin nöronlarının olası rolü" (PDF). Nörofizyoloji Dergisi. 92 (4): 2520–9. doi:10.1152 / jn.00238.2004. PMID 15163669. S2CID 12534057.
- ^ Yamagata N, Ichinose T, Aso Y, Plaçais PY, Friedrich AB, Sima RJ, vd. (Ocak 2015). "Farklı dopamin nöronları, kısa ve uzun vadeli anılar için ödül sinyallerine aracılık eder". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 112 (2): 578–83. Bibcode:2015PNAS..112..578Y. doi:10.1073 / pnas.1421930112. PMC 4299218. PMID 25548178.
- ^ a b Waddell S (Haziran 2013). "Drosophila'da takviye sinyali; dopamin her şeyi yapıyor". Nörobiyolojide Güncel Görüş. 23 (3): 324–29. doi:10.1016 / j.conb.2013.01.005. PMC 3887340. PMID 23391527.
- ^ a b c d e f Kulma A, Szopa J (2007). "Katekolaminler bitkilerde aktif bileşiklerdir". Bitki Bilimi. 172 (3): 433–40. doi:10.1016 / j.plantsci.2006.10.013.
- ^ a b Ingle PK (2003). "L-DOPA taşıyan bitkiler" (PDF). Doğal Ürün Parlaklığı. 2: 126–133. Alındı 24 Eylül 2015.
- ^ Wichers HJ, Visser JF, Huizing HJ, Pras N (1993). "L-DOPA ve dopaminin bitkilerde ve hücre kültürlerinde görülmesi Mucuna pruriens ve 2, 4-d ve NaCl'nin bu bileşikler üzerindeki etkileri ". Bitki Hücresi, Doku ve Organ Kültürü. 33 (3): 259–64. doi:10.1007 / BF02319010. S2CID 44814336.
- ^ Longo R, Castellani A, Sberze P, Tibolla M (1974). "Vicia'da l-dopa ve ilgili amino asitlerin dağılımı". Bitki kimyası. 13 (1): 167–71. doi:10.1016 / S0031-9422 (00) 91287-1.
- ^ Van Alstyne KL, Nelson AV, Vyvyan JR, Cancilla DA (Haziran 2006). "Dopamin, ılıman yeşil alg Ulvaria obscura'da bir anti-obivor savunma işlevi görür." Oekoloji. 148 (2): 304–11. Bibcode:2006Oecol.148..304V. doi:10.1007 / s00442-006-0378-3. PMID 16489461. S2CID 5029574.
- ^ a b c Simon JD, Peles D, Wakamatsu K, Ito S (Ekim 2009). "Melanogenezi anlamada mevcut zorluklar: kimya, biyolojik kontrol, morfoloji ve işlevi köprüleme". Pigment Hücresi ve Melanom Araştırması. 22 (5): 563–79. doi:10.1111 / j.1755-148X.2009.00610.x. PMID 19627559.
- ^ Fedorow H, Tribl F, Halliday G, Gerlach M, Riederer P, Double KL (Şubat 2005). "İnsan dopamin nöronlarında nöromelanin: periferik melaninlerle karşılaştırma ve Parkinson hastalığıyla alaka". Nörobiyolojide İlerleme. 75 (2): 109–24. doi:10.1016 / j.pneurobio.2005.02.001. PMID 15784302. S2CID 503902.
- ^ Andrews RS, Pridham JB (1967). "DOPA içeren bitkilerden elde edilen melaninler". Bitki kimyası. 6 (1): 13–18. doi:10.1016/0031-9422(67)85002-7.
- ^ Beldade P, Brakefield PM (Haziran 2002). "Kelebek kanat modellerinin genetiği ve gelişimi". Doğa Yorumları. Genetik. 3 (6): 442–52. doi:10.1038 / nrg818. PMID 12042771. S2CID 17417235.
- ^ Fahn S (2008). "Parkinson hastalığının tedavisinde dopamin ve levodopa geçmişi". Hareket Bozuklukları. 23 Özel Sayı 3: S497–508. doi:10.1002 / mds.22028. PMID 18781671. S2CID 45572523.
- ^ Benes FM (Ocak 2001). "Carlsson ve dopaminin keşfi". Farmakolojik Bilimlerdeki Eğilimler. 22 (1): 46–47. doi:10.1016 / S0165-6147 (00) 01607-2. PMID 11165672.
- ^ Barondes SH (2003). Prozac'tan Daha İyi. New York: Oxford University Press. pp.21–22, 39–40. ISBN 978-0-19-515130-5.
- ^ Lee H, Dellatore SM, Miller WM, Messersmith PB (Ekim 2007). "Çok işlevli kaplamalar için midyeden ilham alan yüzey kimyası". Bilim. 318 (5849): 426–30. Bibcode:2007Sci ... 318..426L. doi:10.1126 / science.1147241. PMC 2601629. PMID 17947576.
- ^ a b Dreyer DR, Miller DJ, Freeman BD, Paul DR, Bielawski CW (2013). "Poli (dopamin) üzerine bakış açıları". Kimya Bilimleri. 4 (10): 3796. doi:10.1039 / C3SC51501J.
- ^ a b c d e Lynge ME, van der Westen R, Postma A, Städler B (Aralık 2011). "Polidopamin - biyomedikal bilimler için doğadan ilham alan bir polimer kaplama" (PDF). Nano ölçek. 3 (12): 4916–28. Bibcode:2011Nanos ... 3.4916L. doi:10.1039 / c1nr10969c. PMID 22024699. Arşivlenen orijinal 7 Mart 2014.