Tiyoüre - Thiourea
| |||
| İsimler | |||
|---|---|---|---|
| Tercih edilen IUPAC adı Tiyoüre[1] | |||
| Diğer isimler Tiyokarbamid | |||
| Tanımlayıcılar | |||
3 boyutlu model (JSmol ) | |||
| 605327 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA Bilgi Kartı | 100.000.494 | ||
| 1604 | |||
| KEGG | |||
PubChem Müşteri Kimliği | |||
| RTECS numarası |
| ||
| UNII | |||
| BM numarası | 2811 | ||
CompTox Kontrol Paneli (EPA) | |||
| |||
| |||
| Özellikleri | |||
| CH4N2S | |||
| Molar kütle | 76.12 g / mol | ||
| Görünüm | beyaz katı | ||
| Yoğunluk | 1.405 g / ml | ||
| Erime noktası | 182 ° C (360 ° F; 455 K) | ||
| 142 g / l (25 ° C) | |||
| −4.24×10−5 santimetre3/ mol | |||
| Tehlikeler | |||
| Carc. Kedi. 3 Repr. Kedi. 3 Zararlı (Xn) Çevre için tehlikeli (N) | |||
| R cümleleri (modası geçmiş) | R22, R40, R51 / 53, R63 | ||
| S-ibareleri (modası geçmiş) | (S2), S36 / 37, S61 | ||
| NFPA 704 (ateş elması) | |||
| Bağıntılı bileşikler | |||
Bağıntılı bileşikler | Üre | ||
Aksi belirtilmedikçe, veriler kendi içlerindeki malzemeler için verilmiştir. standart durum (25 ° C'de [77 ° F], 100 kPa). | |||
| Bilgi kutusu referansları | |||
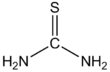
Tiyoüre (/ˌθaɪoʊjʊəˈrbenə/)[2][3] bir organosülfür bileşiği ile formül SC (NH2)2. Yapısal olarak benzerdir üre bunun dışında oksijen atom a ile değiştirilir kükürt atom, ancak üre ve tiyoüre'nin özellikleri önemli ölçüde farklılık gösterir. Thiourea bir reaktiftir organik sentez. "Tiyoüreler" genel yapıya sahip geniş bir bileşikler sınıfını ifade eder (R1R2N) (R3R4N) C = S. Thioureas ile ilgilidir tiyoamidler, Örneğin. RC (S) NR2, R nerede metil, etil, vb.

Yapı ve bağ
Tiyoüre, düzlemsel bir moleküldür. C = S bağ mesafesi 1,71 Å'dur. C-N mesafeleri ortalama 1.33 Å.[4] C-S bağının C-N pi-bağ ile zayıflaması, kısa C = S bağı ile gösterilir. tiobenzofenon 1.63 Å olan.
Thiourea ikide oluşur tatomerik sulu solüsyonlarda baskın olan thion formları. denge sabiti olarak hesaplandı Keq dır-dir 1.04×10−3.[5] İzotiyoüre olarak da bilinen tiyol formu, aşağıdaki gibi ikame edilmiş bileşiklerde karşılaşılabilir. izotiouronyum tuzlar.
Üretim
Tiyoüre'nin küresel yıllık üretimi yaklaşık 10.000 tondur. Yaklaşık% 40'ı Almanya'da,% 40'ı Çin'de ve% 20'si Japonya'da üretilmektedir. Tiyoüre aşağıdakilerden üretilebilir amonyum tiyosiyanat, ancak daha yaygın olarak reaksiyonuyla üretilir hidrojen sülfit ile kalsiyum siyanamid huzurunda karbon dioksit.[6]
Başvurular
Thiourea'nın kendi başına birkaç uygulaması vardır. Esas olarak bir öncü olarak tüketilir. tiyoüre dioksit, tekstil işlemede yaygın bir indirgeme ajanıdır.[6]
Diğer kullanımlar
Tiyoüre'nin diğer endüstriyel kullanımları arasında alev geciktirici reçinelerin üretimi ve vulkanizasyon hızlandırıcılar.
Thiourea, diazo kağıdında, ışığa duyarlı fotokopi kağıdında ve hemen hemen tüm diğer kopya kağıt türlerinde yardımcı ajan olarak kullanılır.
Aynı zamanda gümüş jelatin fotografik baskıları tonlamak için kullanılır.
Thiourea, Clifton-Phillips ve Beaver parlak ve yarı parlak elektro kaplama işlemlerinde kullanılır.[7] Ayrıca bakır için elektriksiz kalay kaplama solüsyonu olarak kalay (II) klorür içeren bir solüsyonda kullanılır. baskılı devre kartı.
Tepkiler
Materyal, alışılmadık bir özelliğe sahiptir. amonyum tiyosiyanat yukarıda ısıtıldığında 130 ° C. Soğutulduktan sonra, amonyum tuzu tekrar tiyoüreye dönüşür.[kaynak belirtilmeli ]
İndirgeyici
Tiyoüre, peroksitleri karşılık gelen dioller.[8] Reaksiyonun ara maddesi kararsız endoperoksit.

Tiyoüre ayrıca indirgeyici çalışmalarda kullanılır. ozonoliz vermek karbonil Bileşikler.[9] Dimetil sülfür aynı zamanda bu reaksiyon için etkili bir reaktiftir, ancak oldukça uçucudur (kaynama noktası37 ° C) ve iğrenç bir kokuya sahiptir, oysa tiyoüre kokusuzdur ve uygun şekilde uçucu değildir (polaritesini yansıtır).

Sülfit kaynağı
Tiyoüre, bir sülfür kaynağı olarak kullanılır, örneğin dönüştürme için Alkil halojenürler tiollere. Reaksiyon, kükürt merkezinin yüksek nükleofilisitesinden ve ara ürünün kolay hidrolizinden yararlanır. izotiouronyum tuzu:
- CS (NH2)2 + RX → RSC (NH
2)+
2X− - RSC (NH
2)+
2X−
+ 2 NaOH → RSNa + OC (NH2)2 + NaX - RSNa + HCl → RSH + NaCl
Bu örnekte, etan-1,2-ditiol -den hazırlandı 1,2-dibromoetan:[10]
- C2H4Br2 + 2 SC (NH2)2 → [C2H4(SC (NH2)2)2] Br2
- [C2H4(SC (NH2)2)2] Br2 + 2 KOH → C2H4(SH)2 + 2 OC (NH2)2 + 2 KBr
Diğerleri gibi tiyoamidler tiyoüre, metal iyonları ile reaksiyona girmesi üzerine bir sülfid kaynağı görevi görebilir. Örneğin, cıva sülfit sulu çözeltideki cıva tuzları tiyoüre ile işlendiğinde oluşur:
- Hg2+ + SC (NH2)2 + H2O → HgS + OC (NH2)2 + 2 H+
Birçok metal sülfidin sentezine uygulanan bu sülfitleme reaksiyonları, su ve tipik olarak biraz ısıtma gerektirir.[11][12]
Heterosikllerin öncüsü
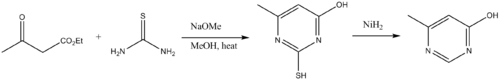
Tiyüreler yapı taşlarıdır pirimidin türevler. Böylece tiyoüreler, p-dikarbonil bileşikleri ile yoğunlaşır.[13] Tiyoüre üzerindeki amino grubu başlangıçta bir karbonil ile yoğunlaşır, ardından siklizasyon ve tatomerizasyon izler. Kükürt giderme, pirimidin sağlar.
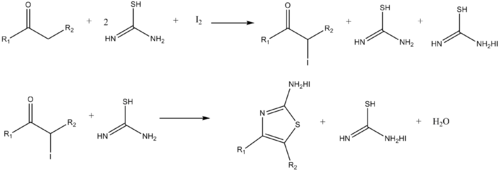
Benzer şekilde aminotiyazoller, α-halo reaksiyonu ile sentezlenebilir.ketonlar ve tiyoüre.[14]
İlaçlar tiyobarbitürik asit ve sülfatiyazol tiyoüre kullanılarak hazırlanır.[6] 4-Amino-3-hidrazino-5-merkapto-1,2,4-triazol tiyoüre reaksiyonu ile hazırlanır ve hidrazin.
Gümüş parlatma
Tüketici ürününün üzerindeki etikete göre sıvı gümüş temizlik ürünü TarnX tiyoüre içerir deterjan, ve sülfamik asit. Bir sıvıya geçiren altın ve gümüş özütleme, tiyoüreyi seçici bir şekilde oksitleyerek, siyanür kullanımı ve eritme aşamalarını atlayarak oluşturulabilir.[15]
Emniyet
LD50 tiyoüre için 125 mg / kg sıçanlar için (oral).[16]
Bir guatrojenik Tiyoüre'nin iyodür alımına müdahale etme yeteneğini yansıtan, kronik maruziyet için etki (tiroid bezinin genişlemesi) bildirilmiştir.[6]
Ayrıca bakınız
Referanslar
- ^ Organik Kimya İsimlendirme: IUPAC Önerileri ve Tercih Edilen İsimler 2013 (Mavi Kitap). Cambridge: Kraliyet Kimya Derneği. 2014. s. 98, 864. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ "Tiyoüre". Oxford Sözlükleri İngiltere Sözlüğü. Oxford University Press. Alındı 2016-01-21.
- ^ "Tiyoüre". Merriam-Webster Sözlüğü. Alındı 2016-01-21.
- ^ D. Mullen; E. Hellner (1978). "Bağ Elektronlarının Yoğunluk Dağılımlarının Basit Bir İyileştirilmesi. IX. Tiourea, CS (NH) 'de Bağ Elektron Yoğunluğu Dağılımı2)2, 123K "da. Açta Crystallogr. B34 (9): 2789–2794. doi:10.1107 / S0567740878009243.
- ^ Allegretti, P.E; Castro, E.A; Furlong, J.J.P (Mart 2000). "Amidlerin ve ilgili bileşiklerin tautomerik dengesi: teorik ve spektral kanıtlar". Moleküler Yapı Dergisi: THEOCHEM. 499 (1–3): 121–126. doi:10.1016 / S0166-1280 (99) 00294-8.
- ^ a b c d Bernd Mertschenk; Ferdinand Beck; Wolfgang Bauer (2002). "Tiyoüre ve Tiyoüre Türevleri". Ullmann'ın Endüstriyel Kimya Ansiklopedisi. Wiley-VCH. doi:10.1002 / 14356007.a26_803. ISBN 3527306730.
- ^ "81. Evrensel Metal Kaplama Kılavuzu". Metal Kaplama, Kılavuz ve Dizin Yayını. Metal Kaplama Dergisi: 285. Güz 2013. ISSN 0026-0576.
- ^ C. Kaneko; A. Sugimoro ve S. Tanaka (1974). "Kolay, tek adımlı bir sentez cis-2-siklopenten ve cisKarşılık gelen siklodienlerden -2-sikloheksen-1,4-dioller ". Sentez. 1974 (12): 876–877. doi:10.1055 / s-1974-23462.
- ^ Gupta, D., Soman, G. ve Dev, S. (1982). "Thiourea, olefin ozonoliz ürünlerinin indirgeyici bölünmesi için uygun bir reaktif". Tetrahedron. 38 (20): 3013–3018. doi:10.1016/0040-4020(82)80187-7.CS1 bakimi: birden çok ad: yazarlar listesi (bağlantı)
- ^ Speziale, A.J. (1963). "Etaneditiol". Organik Sentezler.; Kolektif Hacim, 4, s. 401
- ^ Liang, Y .; et al. (2016). "Çeşitli FeS2 nanoyapılarını basit bir hidrotermal sentez yöntemi ile sentezlemek için etkili bir öncü". CrystEngComm. 18 (33): 6262–6271. doi:10.1039 / c6ce01203e.
- ^ Bao, N .; et al. (2007). "Görünür Işık Altında Fotokatalitik Hidrojen Üretimi için Faz Kontrollü CdS Nanokristallerin Kolay Cd − Tiyoüre Kompleks Termoliz Sentezi". Fiziksel Kimya C Dergisi. 111 (47): 17527–17534. doi:10.1021 / jp076566s.
- ^ Foster, H. M. ve Snyder, H.R. (1963). "4-Metil-6-hidroksipirimidin". Organik Sentezler.CS1 bakimi: birden çok ad: yazarlar listesi (bağlantı); Kolektif Hacim, 4, s. 638
- ^ Dodson, R.M. ve King, L.C. (1945). "Ketonların halojenler ve tiyoüre ile reaksiyonu". J. Am. Chem. Soc. 67 (12): 2242–2243. doi:10.1021 / ja01228a059. PMID 21005695.
- ^ Anthony Esposito. "Peñoles, UAM, pilot thiourea Au-Ag liç tesisi - Meksika'yı açıkladı." Business News Americas (13 Temmuz 2007).
- ^ http://gis.dep.wv.gov/tri/cheminfo/msds1385.txt
daha fazla okuma
- Patai, S., ed. (1977). Çift bağlı fonksiyonel grupların kimyası. New York, NY: John Wiley & Sons. pp.1355 –1496. ISBN 0-471-92493-8.