Aprotinin - Aprotinin - Wikipedia
 | |
| Klinik veriler | |
|---|---|
| Diğer isimler | Trasylol, sığır pankreas tripsin inhibitörü |
| AHFS /Drugs.com | Monografi |
| Gebelik kategori |
|
| Bağımlılık yükümlülük | Yok |
| Rotaları yönetim | İntravenöz |
| ATC kodu | |
| Hukuki durum | |
| Hukuki durum |
|
| Farmakokinetik veri | |
| Biyoyararlanım | 100% (intravenöz ) |
| Tanımlayıcılar | |
| |
| CAS numarası | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider |
|
| UNII | |
| KEGG | |
| ChEMBL | |
| ECHA Bilgi Kartı | 100.029.983 |
| Kimyasal ve fiziksel veriler | |
| Formül | C284H432N84Ö79S7 |
| Molar kütle | 6511.51 g · mol−1 |
| | |
Uyuşturucu aprotinin (Trasylol, önceden Bayer ve şimdi Nordic Group eczacılık ürünleri), küçük bir proteindir sığır pankreas tripsin inhibitörü (BPTI) veya sığır pankreasının temel tripsin inhibitörü, hangisi bir antifibrinolitik inhibe eden molekül tripsin ve ilgili proteolitik enzimler. Ticaret unvanı altında Trasylolaprotinin, bir ilaç tedavisi tarafından yönetiliyor enjeksiyon azaltmak kanama karmaşık sırasında ameliyat kalp ve karaciğer ameliyatı gibi. Ana etkisi, fibrinoliz, kan pıhtılarının parçalanmasına yol açan süreç. Kullanımındaki amaç, ihtiyacı azaltmaktı. kan nakilleri ameliyat sırasında ve buna bağlı olarak son organ hasarı hipotansiyon Belirgin kan kaybının bir sonucu olarak (düşük tansiyon). Yapılan çalışmalar, kullanımının komplikasyon veya ölüm riskini artırdığını gösterdikten sonra, 2007 yılında dünya çapında geçici olarak geri çekildi;[1] bu, takip çalışmaları ile teyit edildi. Trasylol satışları, çok kısıtlı araştırma kullanımı dışında, Mayıs 2008'de askıya alındı. Şubat 2012'de Avrupa İlaç Ajansı (EMA) bilimsel komitesi aprotinin ile ilgili önceki bakış açısını geri aldı ve askıya almanın kaldırılmasını tavsiye etti.[2] Nordic, 2012 yılında aprotinin distribütörü oldu.[3]
Kimya
| Sığır pankreas tripsin inhibitörü | |||||||
|---|---|---|---|---|---|---|---|
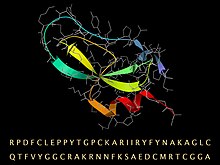 Katlanmış 3D yapısı, ikincil yapı için bir şerit ve omurga ve yan zincirler için bir çubuk modeli (gri) ile temsil edilen BPTI dizisi. | |||||||
| Tanımlayıcılar | |||||||
| Organizma | |||||||
| Sembol | PTI | ||||||
| Entrez | 404172 | ||||||
| PDB | 4PTI Daha fazla yapı | ||||||
| RefSeq (mRNA) | NM_001001554 | ||||||
| RefSeq (Prot) | NP_001001554 | ||||||
| UniProt | P00974 | ||||||
| Diğer veri | |||||||
| Kromozom | 13: 75.02 - 75.03 Mb | ||||||
| |||||||
Aprotinin, monomerik (tek zincirli) küresel bir polipeptid sığır akciğer dokusundan elde edilir. Bir moleküler ağırlık 6512 ve 16 farklı amino asit 58 kalıntı uzunluğunda bir zincirde düzenlenmiş tipler[4][5] 3 disülfid, bükülmüş bir hair-firkete ve bir C-terminal içeren, 'küçük SS açısından zengin "tipte sabit, kompakt bir üçüncül yapıya katlanır α-sarmal.[6]
Sığır BPTI'sinin amino asit dizisi RPDFC LEPPY TGPCK ARIIR YFYNA KAGLC QTFVY GGCRA KRNNF KSAED CMRTC GGA'dır.[7] 10 pozitif yüklü lizin (K) ve arginin (R) yan zincir ve sadece 4 negatif aspartat (D) ve glutamat (E) vardır, bu da proteini güçlü kılar. temel, hangisi temel onun adına. (Olağan kaynak organizma nedeniyle, BPTI bazen şu şekilde anılır: sığır pankreas tripsin inhibitörü.)
Molekülün yüksek stabilitesi, 3 Disülfür bağları 6'yı bağlamak sistein zincirin üyeleri (Cys5-Cys55, Cys14-Cys38 ve Cys30-Cys51).[8] Uzun, temel lizin Açığa çıkan halkadaki 15 yan zincir (resimde sol üstte), tripsinin aktif bölgesindeki özgüllük cebine çok sıkı bir şekilde bağlanır ve enzimatik etkisini inhibe eder. BPTI, katlanan ve daha sonra yukarıda verilen olgun diziye bölünen daha uzun, öncü bir dizi olarak sentezlenir.
BPTI, protein ailesinin klasik üyesidir. Kunitz tipi serin proteaz inhibitörleri. Fizyolojik fonksiyonları, küçük miktarlar üretildiğinde, tripsinojen öncüsünün pankreasta depolanması sırasında bölünmesi yoluyla ana sindirim enzimi tripsininin koruyucu inhibisyonunu içerir.
İlaç etki mekanizması
Aprotinin bir rekabetçi engelleyici birkaç serin proteazlar özellikle tripsin, kimotripsin ve plazmin yaklaşık 125.000 IU / ml'lik bir konsantrasyonda ve Kallikrein 300,000 IU / ml'de.[5] Eylemi Kallikrein oluşumunun engellenmesine yol açar faktör XIIa. Sonuç olarak, hem içsel pıhtılaşma yolu hem de fibrinoliz engellenir. Plazmin üzerindeki etkisi bağımsız olarak fibrinolizi yavaşlatır.[4]
İlaç etkinliği
Kan kaybı riski yüksek olan kalp cerrahisinde aprotinin, kanamayı, ölüm oranını ve hastanede kalmayı önemli ölçüde azaltmıştır.[5] Yüksek riskli ortopedik cerrahide de faydalı etkiler bildirilmiştir.[5] İçinde karaciğer nakli, fayda ile ilgili ilk raporlar, toksisite ile ilgili endişeler nedeniyle gölgede kalmıştır.[9]
İçinde meta-analiz 2004 yılında gerçekleştirilen transfüzyon gereksinimleri% 39 azalmıştır. koroner arter baypas grefti (CABG) ameliyatı.[10] Ortopedik cerrahide, kan naklinde bir azalma da aynı şekilde doğrulandı.[11]
Uyuşturucu güvenliği
Aprotininin güvenliğiyle ilgili endişeler var.[5] Anafilaksi (şiddetli bir alerjik reaksiyon) ilk kullanımda 1: 200 oranında görülür, ancak seroloji (kandaki aprotine karşı antikorların ölçülmesi) pratikte anafilaksi riskini tahmin etmek için yapılmamaktadır çünkü bu testlerin doğru yorumlanması zordur.[5]
Tromboz Muhtemelen fibrinolitik sistemin aşırı inhibisyonundan daha yüksek bir oranda meydana gelebilir, ancak 2006 yılına kadar bu ilişki için sınırlı kanıt vardı.[5][10] Benzer şekilde, böbrek fonksiyonunun biyokimyasal ölçümlerinin zaman zaman kötüleştiği bilinirken, bunun sonuçları büyük ölçüde etkilediğine dair hiçbir kanıt yoktu.[5] 2006 yılında bildirilen kalp cerrahisi hastalarında yapılan bir çalışma, gerçekten bir risk olduğunu gösterdi. akut böbrek yetmezliği, miyokardiyal enfarktüs ve kalp yetmezliği, Hem de inme ve ensefalopati.[12] Çalışma yazarları daha eski antifibrinolitikleri önermektedir (örneğin traneksamik asit ) bu risklerin belgelenmediği durumlarda.[12] Aynı grup, verilerini 2007'de güncelledi ve benzer bulgular gösterdi.[13]
Eylül 2006'da Bayer A.G., 30.000'i aprotinin ve geri kalanı diğer anti-fibrinolitikler alan 67.000 hastanın retrospektif bir çalışmasının varlığını ifade sırasında ifşa etmediği için FDA tarafından suçlandı. Çalışma, aprotininin daha büyük risk taşıdığı sonucuna vardı. FDA, ilgili araştırmacılardan biri tarafından çalışmaya uyarıldı. FDA bir endişe bildirisi yayınlamasına rağmen, ilacın belirli hasta alt popülasyonlarına fayda sağlayabileceği yönündeki tavsiyesini değiştirmedi.[14] FDA, 3 Ekim 2006 tarihli bir Halk Sağlığı Danışma Güncellemesinde, "doktorların, Trasylol kullanımının, tıbbi tedavi için azaltılmış kan kaybının klinik yararının gerekli olduğu ve potansiyel risklerden daha ağır bastığı durumlarla sınırlandırılmasını dikkate almalarını" ve hastaları dikkatle izlemelerini tavsiye etti.[15]
25 Ekim 2007'de FDA, bir kalp cerrahisi popülasyonunda "Antifibrinolitikler kullanarak kan koruma" (BART) randomize deneyine ilişkin bir bildiri yayınladı. Ön bulgular, diğer antifibrinolitik ilaçlarla (epsilon-aminokaproik asit ve traneksamik asit) karşılaştırıldığında aprotininin ölüm riskini artırabileceğini düşündürmektedir.[16] 29 Ekim 2006'da Gıda ve İlaç Dairesi, aprotininin ciddi böbrek ve kardiyovasküler toksisiteye sahip olabileceğine dair bir uyarı yayınladı. Üretici Bayer, FDA'ya ek gözlem çalışmalarının ölüm, ciddi böbrek hasarı, konjestif kalp yetmezliği ve felç olasılığını artırabileceğini gösterdiğini bildirdi. FDA, klinisyenleri, azaltılmış kan kaybının klinik yararının tıbbi tedavi için gerekli olduğu ve potansiyel risklerden daha ağır bastığı durumlarda kullanımı sınırlamayı düşünmeleri konusunda uyardı.[17] 5 Kasım 2007'de Bayer, kalp ameliyatı sırasında kanamayı önlemek için kullanıldığında ölüm riskini artırdığını gösteren bir Kanada çalışması nedeniyle Aprotinin'i geri çektiğini açıkladı.[18]
2008'in başlarında yayınlanan, her ikisi de aprotinin ile karşılaştıran iki çalışma aminokaproik asit, ölüm oranının 32 arttığını buldu[19] ve% 64,[20] sırasıyla. Bir çalışma, diyaliz ve revaskülarizasyona ihtiyaç duyulduğunda artan bir risk bulmuştur.[20]
Hiçbir durum sığır süngerimsi ensefalopati İtalya'da ilacın bundan korktuğu için geri çekilmesine rağmen aprotinin yoluyla bulaşma bildirilmiştir.[5]
In vitro kullanım
Küçük miktarlarda aprotinin, alınan kan tüplerine eklenebilir, böylece bazı hızlı bozulmuş proteinlerin laboratuar ölçümünü sağlar. glukagon.
Hücre biyolojisinde aprotinin, enzim inhibitörü proteini önlemek için bozulma sırasında liziz veya homojenizasyon hücre ve dokuların.
Aprotinin, floresein izotiyosiyanat ile etiketlenebilir. Konjugat, antiproteolitik ve karbonhidrat bağlama özelliklerini korur[21] ve üronik veya siyalik asitler açısından zengin glikokonjugatların (mukosubaddeler) boyanması için floresan histokimyasal reaktif olarak kullanılmıştır.[22]
Tarih
Başlangıçta "kallikrein inaktivatör" olarak adlandırılan aprotinin ilk olarak inekten izole edildi parotis bezleri 1930'da.[23] ve bağımsız olarak 1936'da sığır pankreasından bir tripsin inhibitörü olarak.[24] 1964 yılında sığır akciğerinden arındırıldı.[25] Pankreas enzimlerini inhibe ettiği için başlangıçta tedavide kullanılmıştır. akut pankreatit bezin kendi enzimleri tarafından yok edilmesinin patogenezin bir parçası olduğu düşünülmektedir.[26] 1960'larda büyük cerrahide kullanımı başladı.[27]
BPTI, açısından en kapsamlı çalışılan proteinlerden biridir. yapısal biyoloji, deneysel ve hesaplama dinamikleri, mutagenez ve katlama yolu. 1970 yılında laboratuvarda çözülen en eski protein kristal yapılarından biriydi. Robert Huber,[28] ve substrat benzeri etkileşim modu, 1974'te sığır tripsin kompleksi bağlamında deşifre edildi.[29] Daha sonra aynı zamanda sahip olduğu ilk protein olarak ünlendi. yapı tarafından karar verildi NMR spektroskopisi laboratuvarında Kurt Wuthrich 1980'lerin başında Zürih'teki ETH'de.[30][31]
Çünkü yapısı 1975 yılına kadar yüksek çözünürlükte belirlenmiş, küçük, kararlı bir protein,[32] kullanılarak simüle edilen ilk bilimsel ilgi makromolekülüydü moleküler dinamik hesaplama, 1977'de J. Andrew McCammon ve Bruce Gelin Karplus Harvard'daki grup.[33] Bu çalışma, NMR çalışmasında bulunan o zamanlar şaşırtıcı olan gerçeği doğruladı[34] stabil bir proteinin iç kısmındaki iyi paketlenmiş aromatik yan zincirlerin bile oldukça hızlı dönebildiğini (mikrosaniyeden milisaniyeye zaman ölçeği). Hız sabitleri, zincir boyunca bireysel peptit NH gruplarının hidrojen değişimi için NMR ile belirlendi, en fazla maruz kalan yüzeyde ölçmek için çok hızlıdan p tabakasının merkezinde en çok gömülü hidrojen bağlı gruplar için aylarca değişti ve bu değerler aynı zamanda dinamik simülasyonlarında görülen hareket derecesi ile oldukça iyi ilişkilidir.
BPTI, süreç hakkında bilgi geliştirmede önemliydi. protein katlanması, bir polipeptit zincirinin 3B'de belirli bir düzenlemeye kendi kendine montajı. 6 Cys yan zinciri arasında doğru eşleşmeleri elde etme probleminin, BPTI zincir terminalinin yakınında iki gömülü, birbirine yakın SS için özellikle zor olduğu ve olgun sekansı katlamak için doğal olmayan bir ara ürün gerektirdiği gösterildi. laboratuvar ortamında (daha sonra öncül dizinin daha kolay katlandığı keşfedildi in vivo). BPTI, 1992'de Thomas Creighton tarafından hazırlanan bir protein katlama derlemesinin kapak resmiydi.[35]
Güncel bulgular
Sıçanlarda yapılan bir bilimsel çalışma, aprotinin ile tedavinin kan-beyin bariyerinin bozulmasını önlediğini bildirdi. C. neoformans enfeksiyon.[36] Hücre kültürlerinde yapılan başka bir çalışma, ilacın SARS-CoV-2 Replikasyonunu inhibe ettiğini göstermektedir.[37]
Referanslar
- ^ "Bayer Global Trasylol Pazarlamasını Geçici Olarak Askıya Aldı" (PDF) (Basın bülteni). Trasylol.com. 2007-11-05. Arşivlenen orijinal (PDF) 2011-07-17 tarihinde. Alındı 2007-12-03.
- ^ "Avrupa İlaç Ajansı aprotinin süspansiyonunun kaldırılmasını tavsiye ediyor". Avrupa İlaç Ajansı. 2012-02-17.
- ^ "Nordic Group, Bayer HealthCare'den Trasylol® haklarını satın aldı". The Nordic Group B.V. Arşivlenen orijinal 1 Şubat 2014. Alındı 28 Ocak 2014.
- ^ a b Mannucci PM (Temmuz 1998). "Hemostatik ilaçlar". New England Tıp Dergisi. 339 (4): 245–53. doi:10.1056 / NEJM199807233390407. PMID 9673304.
- ^ a b c d e f g h ben Mahdy AM, Webster NR (Aralık 2004). "Perioperatif sistemik hemostatik ajanlar". İngiliz Anestezi Dergisi. 93 (6): 842–58. doi:10.1093 / bja / aeh227. PMID 15277296.
- ^ Richardson JS (1981). "Protein yapısının anatomisi ve taksonomisi". Protein Kimyasındaki Gelişmeler Cilt 34. Protein Kimyasındaki Gelişmeler. 34. s. 167–339. doi:10.1016 / S0065-3233 (08) 60520-3. ISBN 978-0-12-034234-1. PMID 7020376.
- ^ Kassell B, Radicevic M, Ansfield MJ, Laskowski M (Ocak 1965). "Sığır pankreasının temel tripsin inhibitörü. IV. 58 amino asidin doğrusal dizisi". Biyokimyasal ve Biyofiziksel Araştırma İletişimi. 18 (2): 255–8. doi:10.1016 / 0006-291X (65) 90749-7. PMID 14282026.
- ^ Kassell B, Laskowski M (Ağustos 1965). "Sığır pankreasının temel tripsin inhibitörü. V. Disülfür bağları". Biyokimyasal ve Biyofiziksel Araştırma İletişimi. 20 (4): 463–8. doi:10.1016 / 0006-291X (65) 90601-7. PMID 5860161.
- ^ Xia VW, Steadman RH (Ocak 2005). "Ortotopik karaciğer transplantasyonunda antifibrinolitikler: mevcut durum ve tartışmalar". Karaciğer Nakli. 11 (1): 10–8. doi:10.1002 / lt. 20275. PMID 15690531.
- ^ a b Sedrakyan A, Treasure T, Elefteriades JA (Eylül 2004). "Aprotininin koroner arter baypas greft cerrahisinde klinik sonuçlar üzerindeki etkisi: randomize klinik çalışmaların sistematik bir incelemesi ve meta-analizi". Göğüs Kalp Damar Cerrahisi Dergisi. 128 (3): 442–8. doi:10.1016 / j.jtcvs.2004.03.041. PMID 15354106.
- ^ Shiga T, Wajima Z, Inoue T, Sakamoto A (Aralık 2005). "Büyük ortopedik cerrahide aprotinin: randomize kontrollü çalışmaların sistematik bir incelemesi". Anestezi ve Analjezi. 101 (6): 1602–7. doi:10.1213 / 01.ANE.0000180767.50529.45. PMID 16301226. S2CID 33762135.
- ^ a b Mangano DT, Tudor IC, Dietzel C (Ocak 2006). "Kalp cerrahisinde aprotinin ile ilişkili risk". New England Tıp Dergisi. 354 (4): 353–65. doi:10.1056 / NEJMoa051379. PMID 16436767.
- ^ Mangano DT, Miao Y, Vuylsteke A, Tudor IC, Juneja R, Filipescu D, vd. (Şubat 2007). "Koroner arter baypas greft ameliyatını takiben 5 yıl boyunca aprotinin ile ilişkili ölüm oranı". JAMA. 297 (5): 471–9. doi:10.1001 / jama.297.5.471. PMID 17284697.
- ^ Harris G (2006-09-30). "F.D.A., Bayer'in Uyuşturucu Risk Çalışmasını Açıklayamadığını Söyledi - New York Times". New York Times. Alındı 2007-11-05.
- ^ "Gerçekler ve Karşılaştırmalar: Trasylol Halk Sağlığı Danışmanlığı Güncellemesi". Alındı 2007-11-05.
- ^ ABD Gıda ve İlaç İdaresi. "Devam Eden Bir Güvenlik İncelemesi hakkında Erken İletişim Aprotinin Enjeksiyonu (Trasylol olarak pazarlanmaktadır)". Arşivlendi 2007-10-30 tarihinde orjinalinden. Alındı 2007-10-28.CS1 Maint: yazar parametresini kullanır (bağlantı)
- ^ ABD Gıda ve İlaç İdaresi. "Sağlık Profesyonelleri için Bilgiler; Aprotinin (Trasylol olarak pazarlanmaktadır)". Arşivlendi 2006-10-10 tarihinde orjinalinden. Alındı 2006-10-30.CS1 Maint: yazar parametresini kullanır (bağlantı)
- ^ Harris G (2007-11-05). "Bayer Kalp Cerrahisi İlacını Geri Çekiyor". New York Times. Alındı 2007-11-05.
- ^ Shaw AD, Stafford-Smith M, White WD, Phillips-Bute B, Swaminathan M, Milano C, vd. (Şubat 2008). "Aprotininin koroner arter baypas aşılamasından sonraki sonuç üzerindeki etkisi". New England Tıp Dergisi. 358 (8): 784–93. doi:10.1056 / NEJMoa0707768. PMID 18287601.
- ^ a b Schneeweiss S, Seeger JD, Landon J, Walker AM (Şubat 2008). "Koroner arter baypas aşılama sırasında aprotinin ve ölüm riski". New England Tıp Dergisi. 358 (8): 771–83. doi:10.1056 / NEJMoa0707571. PMID 18287600.
- ^ Stoddart RW, Kernan JA (Mart 1973). "Aprotinin, karbonhidrat bağlayıcı bir protein". Histochemie. Histokimya. Histochimie. 34 (4): 275–80. doi:10.1007 / BF00306299. PMID 4266832. S2CID 44549220.
- ^ Kiernan JA, Stoddart RW (1973). "Floresan etiketli aprotinin: asit mukosubaddelerin histokimyasal tespiti için yeni bir reaktif". Histokimya. 34 (1): 77–84. doi:10.1007 / BF00304309. PMID 4119444. S2CID 32032724.
- ^ Kraut H, Frey EK, Bauer E (1930). "Über die Inaktivierung des kallikreins". Hoppe-Seyler'in Z Physiol Chem (Almanca'da). 192: 1–21. doi:10.1515 / bchm2.1930.192.1-3.1.
- ^ Kunitz M, Northrop JH (Temmuz 1936). "Kristalin tripsinojen, tripsin, tripsin inhibitörü ve bir inhibitör tripsin bileşiğinin sığır pankreasından izolasyon". Genel Fizyoloji Dergisi. 19 (6): 991–1007. doi:10.1085 / jgp.19.6.991. PMC 2141477. PMID 19872978.
- ^ Kraut H, Bhargava N (1964). "Versuche zur Isolierung des Kallikrein-Inaktivators aus Rinderlunge ve seine Identifizierung mit dem Inaktivator aus Rinderparotis" [Kallikrein İnaktivatörünün İzolasyonu Üzerine Deneyler. V. Kallikrein İnaktivatörünün Sığır Akciğerinden İzolasyonu ve İnhibitörle Bovin Parotis Bezinden Tanımlanması]. Hoppe-Seyler'in Zeitschrift für Physiologische Chemie (Almanca'da). 338: 231–7. doi:10.1515 / bchm2.1964.338.1-2.231. PMID 14330402.
- ^ Nugent FW, Warren KW, Jonasson H, Garciadeparedes G (Kasım 1964). "Akut Pankreatit Tedavisinde Trasylol ile Erken Deneyim". Güney Tıp Dergisi. 57 (11): 1317–21. doi:10.1097/00007611-196411000-00012. PMID 14195953. S2CID 5286289.
- ^ Tice DA, Worth MH, Clauss RH, Reed GH (Temmuz 1964). "Kardiyovasküler Operasyonlarla İlişkili Fibrinolitik Aktivitenin Trasylol İnhibisyonu". Cerrahi, Jinekoloji ve Obstetrik. 119: 71–4. PMID 14179354.
- ^ Huber R, Kukla D, Rühlmann A, Epp O, Formanek H (Ağustos 1970). "Sığır pankreasının temel tripsin inhibitörü. I. Polipeptit zincirinin yapı analizi ve konformasyonu". Die Naturwissenschaften. 57 (8): 389–92. Bibcode:1970NW ..... 57..389H. doi:10.1007 / BF00599976. PMID 5447861. S2CID 6261274.
- ^ Huber R, Kukla D, Bode W, Schwager P, Bartels K, Deisenhofer J, Steigemann W (Ekim 1974). "Sığır tripsin ve sığır pankreas tripsin inhibitörü tarafından oluşturulan kompleksin yapısı. II. 1.9 A çözünürlükte kristalografik arıtma". Moleküler Biyoloji Dergisi. 89 (1): 73–101. doi:10.1016/0022-2836(74)90163-6. PMID 4475115.
- ^ Wagner G, Wüthrich K (Mart 1982). "Protein 1H nükleer manyetik rezonans spektrumlarında sıralı rezonans atamaları. Temel pankreas tripsin inhibitörü". Moleküler Biyoloji Dergisi. 155 (3): 347–66. doi:10.1016/0022-2836(82)90009-2. PMID 6176717.
- ^ Havel TF, Wüthrich K (Mart 1985). "Çözeltideki protein konformasyonlarının belirlenmesi için nükleer manyetik rezonans ve mesafe geometrisinin birleşik kullanımının bir değerlendirmesi". Moleküler Biyoloji Dergisi. 182 (2): 281–94. doi:10.1016/0022-2836(85)90346-8. PMID 2582141.
- ^ Deisenhofer J, Steigemann W (1975). "Sığır Pankreas Tripsin Önleyicisinin Yapısının 1.5 Angstrom Çözünürlükte Kristalografik Olarak İyileştirilmesi" (PDF). Açta Crystallographica B. 31: 238. doi:10.1107 / S0567740875002415.
- ^ McCammon JA, Gelin BR, Karplus M (Haziran 1977). "Katlanmış proteinlerin dinamikleri". Doğa. 267 (5612): 585–90. Bibcode:1977Natur.267..585M. doi:10.1038 / 267585a0. PMID 301613. S2CID 4222220.
- ^ Wüthrich K, Wagner G (Şubat 1975). "Bazik pankreas tripsin inhibitöründeki aromatik amino asit kalıntılarının dinamiklerinin NMR araştırmaları". FEBS Mektupları. 50 (2): 265–8. doi:10.1016/0014-5793(75)80504-7. PMID 234403. S2CID 46084481.
- ^ Creighton TE (1992). Protein Katlama. W. H. Freeman. ISBN 978-0-7167-7027-5.
- ^ Xu CY, Zhu HM, Wu JH, Wen H, Liu CJ (Şubat 2014). "Cryptococcus menenjiti sırasında kan-beyin bariyerinin artan geçirgenliğine serin proteaz aracılık eder". Uluslararası Tıbbi Araştırmalar Dergisi. 42 (1): 85–92. doi:10.1177/0300060513504365. PMID 24398759.
- ^ Bojkova, Denisa; Bechtel, Marco; McLaughlin, Katie-May; McGreig, Jake E .; Klann, Kevin; Bellinghausen, Carla; Rohde, Gernot; Jonigk, Danny; Braubach, Peter; Ciesek, Sandra; Münch, Christian; Wass, Mark N .; Michaelis, Martin; Cinatl, Jindrich (2020). "Aprotinin SARS-CoV-2 Replikasyonunu İnhibe Eder". Hücreler. 9 (11): 2377. doi:10.3390 / hücreler9112377. ISSN 2073-4409.
