Atomik yörünge - Atomic orbital

İçinde Atomik teori ve Kuantum mekaniği, bir atomik yörünge bir matematiksel fonksiyon bir elektronun konumunu ve dalga benzeri davranışını tanımlayarak atom.[1] Bu fonksiyon, hesaplamak için kullanılabilir. olasılık etrafındaki belirli bir bölgede bir atomun herhangi bir elektronunu bulmak için atom çekirdeği. Dönem atomik yörünge yörüngenin belirli matematiksel formunun öngördüğü gibi, elektronun mevcut olduğunun hesaplanabileceği fiziksel bölge veya boşluğu da ifade edebilir.[2]
Bir atomdaki her bir yörünge, üçünün benzersiz bir değer kümesiyle karakterize edilir. Kuantum sayıları n, ℓ, ve m,[şüpheli ] sırasıyla elektronun karşılık gelen enerji, açısal momentum ve açısal momentum vektör bileşeni ( manyetik kuantum sayısı ). Bu tür yörüngelerin her biri, her biri kendine ait olan en fazla iki elektron tarafından işgal edilebilir. kuantum sayısı spin s. Basit isimler yörünge, p yörünge, d yörünge, ve f yörünge açısal momentum kuantum numaralı orbitalleri ifade eder ℓ = 0, 1, 2, ve 3 sırasıyla. Bu isimler, değeri ile birlikten, tanımlamak için kullanılır elektron konfigürasyonları atomların. Bazı serilerin erken spektroskopistleri tarafından yapılan açıklamadan türetilmiştir. alkali metal spektroskopik çizgiler gibi sarp principal diffuse ve fanlamsız. Orbitaller ℓ > 3 j (g, h, i, k, ...) hariç alfabetik olarak devam edin[3][4][5] çünkü bazı diller "i" ve "j" harfleri arasında ayrım yapmaz.[6]
Atomik orbitaller, temel yapı taşlarıdır. atomik yörünge modeli (alternatif olarak elektron bulutu veya dalga mekaniği modeli olarak da bilinir), maddedeki elektronların submikroskopik davranışını görselleştirmek için modern bir çerçeve. Bu modelde, çok elektronlu bir atomun elektron bulutu, daha basit bir ürünün bir ürünü olan bir elektron konfigürasyonunda (yaklaşık olarak) inşa edilmiş olarak görülebilir. hidrojen benzeri atom orbitalleri. Yinelenen dönemsellik 2, 6, 10 ve 14 blokların elementler bölümleri içinde periyodik tablo doğal olarak tam bir dizi kaplayan toplam elektron sayısından kaynaklanır. s, p, d, ve f atomik orbitaller, ancak kuantum sayısının daha yüksek değerleri için n, özellikle söz konusu atom pozitif bir yük taşıdığında, bazı alt kabukların enerjileri çok benzer hale gelir ve böylece sipariş elektronlar tarafından doldurulduğu söylenir (örneğin Cr = [Ar] 4s13 boyutlu5 ve Cr2+ = [Ar] 3d4) ancak biraz keyfi olarak rasyonelleştirilebilir.

Elektron özellikleri
Gelişmesiyle birlikte Kuantum mekaniği ve deneysel bulgular (elektronların iki yarık kırınımı gibi), bir çekirdeğin etrafındaki yörüngede dönen elektronların tam olarak parçacık olarak tanımlanamadığı, ancak dalga-parçacık ikiliği. Bu anlamda elektronlar aşağıdaki özelliklere sahiptir:
Dalga benzeri özellikler:
- Elektronlar çekirdeğin yörüngesinde güneşin yörüngesinde dönen bir gezegen gibi dönmezler, bunun yerine şu şekilde var olurlar: duran dalgalar. Bu nedenle, bir elektronun alabileceği en düşük enerji, temel frekans ipteki bir dalganın. Daha yüksek enerji durumları benzerdir harmonikler bu temel frekansın.
- Elektronlar hiçbir zaman tek bir nokta konumunda değildir, ancak elektronla tek bir noktada etkileşim olasılığı elektronun dalga fonksiyonundan bulunabilir. Elektronun üzerindeki yük, herhangi bir noktada elektronun kare büyüklüğüyle orantılı, sürekli bir dağılımda uzaya yayılmış gibi davranır. dalga fonksiyonu.
Parçacık benzeri özellikler:
- Çekirdeğin yörüngesindeki elektronların sayısı yalnızca bir tam sayı olabilir.
- Elektronlar, parçacıklar gibi yörüngeler arasında atlarlar. Örneğin, tek bir foton elektronları vurur, sadece tek bir elektron fotona yanıt olarak durum değiştirir.
- Elektronlar, aşağıdaki gibi parçacık benzeri özellikleri korur: her dalga durumu, elektron parçacığı ile aynı elektrik yüküne sahiptir. Her dalga durumunun, kendisine bağlı olarak tek bir ayrık dönüşü (yukarı dönüş veya aşağı dönüş) vardır. süperpozisyon.
Bu nedenle, elektronlar basitçe katı parçacıklar olarak tanımlanamaz. Bir benzetme, nispeten küçük bir gezegenin (atom çekirdeği) etrafına dağılmış, büyük ve genellikle garip bir şekilde şekillendirilmiş "atmosfer" (elektron) olabilir. Atomik orbitaller, yalnızca bir atomda tek bir elektron bulunduğunda bu "atmosferin" şeklini tam olarak tanımlar. Tek bir atoma daha fazla elektron eklendiğinde, ek elektronlar çekirdek etrafındaki boşluğu daha eşit bir şekilde doldurma eğilimindedir, böylece ortaya çıkan koleksiyon (bazen atomun "elektron bulutu" olarak adlandırılır)[7]) elektronun konumunu tanımlayan genel olarak küresel bir olasılık bölgesine doğru eğilimlidir, çünkü belirsizlik ilkesi.
Biçimsel kuantum mekaniği tanımı
Atomik orbitaller biçimsel olarak daha kesin olarak tanımlanabilir kuantum mekaniği dil. Bunlar için yaklaşık bir çözümdür. Schrodinger denklemi atoma bağlı elektronlar için Elektrik alanı atomların çekirdek. Spesifik olarak, kuantum mekaniğinde, bir atomun durumu, yani bir özdurum atomun Hamiltoniyen, bir genişleme ile yaklaştırılır (bkz. yapılandırma etkileşimi genişleme ve temel set ) içine doğrusal kombinasyonlar anti-simetrik ürünlerin (Slater belirleyicileri ) tek elektronlu fonksiyonlar. Bu tek elektronlu fonksiyonların uzamsal bileşenlerine atomik orbitaller denir. (Kişi onların da çevirmek bileşen, biri bahsediyor atomik spin yörüngeleri.) Bir durum aslında tüm elektronların koordinatlarının bir fonksiyonudur, böylece hareketleri ilişkilendirilir, ancak bu genellikle bununla yaklaşık olarak belirlenir. bağımsız parçacık modeli tek elektron dalga fonksiyonlarının çarpımları.[8] (The Londra dağılım kuvveti örneğin, elektronların hareketinin korelasyonlarına bağlıdır.)
İçinde atom fiziği, atomik spektral çizgiler geçişlere karşılık gelir (kuantum sıçraması ) arasında kuantum durumları bir atomun. Bu eyaletler bir dizi Kuantum sayıları özetlendi terim sembolü ve genellikle belirli elektron konfigürasyonları ile ilişkilidir, yani atomik orbitallerin işgal şemaları ile (örneğin, 1s2 2s2 2p6 temel durum için neon -term sembolü: 1S0).
Bu gösterim, karşılık gelen Slater determinantlarının daha yüksek bir ağırlığa sahip olduğu anlamına gelir. yapılandırma etkileşimi genişleme. Atomik yörünge kavramı bu nedenle, belirli bir veriyle ilişkili uyarma sürecini görselleştirmek için anahtar bir kavramdır. geçiş. Örneğin, belirli bir geçiş için, bir elektronun işgal edilmiş bir yörüngeden belirli bir kullanılmayan yörüngeye uyarılmasına karşılık geldiği söylenebilir. Yine de, elektronların fermiyonlar tarafından yönetilen Pauli dışlama ilkesi ve birbirinden ayırt edilemez. Dahası, bazen, konfigürasyon etkileşim genişlemesinin çok yavaş yakınsadığı ve basit tek belirleyici dalga fonksiyonundan hiç söz edilemeyeceği olur. Bu ne zaman elektron korelasyonu büyük.
Temel olarak, bir atomik orbital, tek elektronlu atomlarda çoğu elektron bulunmasa da, tek elektronlu bir dalga fonksiyonudur ve bu nedenle tek elektronlu görünüm bir yaklaşımdır. Orbitaller hakkında düşünürken, bize çoğu zaman büyük ölçüde etkilenen yörünge görselleştirme verilir. Hartree – Fock yaklaşım, karmaşıklıklarını azaltmanın bir yolu moleküler yörünge teorisi.
Orbital türleri

Atomik orbitaller, hidrojen benzeri "orbitaller" olabilir ve bunlar, Schrödinger denklemi için hidrojen benzeri "atom" (yani, tek elektronlu bir atom). Alternatif olarak, atomik orbitaller, bir elektronun koordinatlarına (yani orbitaller) bağlı olan ancak bir atom veya moleküldeki tüm elektronların eşzamanlı koordinatlarına bağlı olan dalga fonksiyonlarını yaklaştırmak için başlangıç noktaları olarak kullanılan fonksiyonlara atıfta bulunur. koordinat sistemleri atomik orbitaller için seçilenler genellikle küresel koordinatlar (r, θ, φ) atomlarda ve kartezyalılar (x, y, z) çok atomlu moleküllerde. Küresel koordinatların (atomlar için) avantajı, bir yörünge dalga fonksiyonunun, her biri tek bir koordinata bağlı olan üç faktörün bir ürünü olmasıdır: ψ (r, θ, φ) = R(r) Θ (θ) Φ (φ). Atomik orbitallerin açısal faktörleri Θ (θ) Φ (φ) s, p, d vb. işlevler üretir. gerçek kombinasyonlar nın-nin küresel harmonikler Yℓm(θ, φ) (nerede ℓ ve m kuantum sayılarıdır). Radyal fonksiyonlar için tipik olarak üç matematiksel form vardırR(r) birçok elektrona sahip atomların ve moleküllerin özelliklerinin hesaplanması için başlangıç noktası olarak seçilebilir:
- hidrojen benzeri atomik orbitaller bir elektron ve bir çekirdek için Schrödinger Denkleminin tam çözümünden türetilmiştir. hidrojen benzeri atom. Fonksiyonun mesafeye bağlı kısmı r çekirdekten düğümler (radyal düğümler) ve bozunur e- (sabit × mesafe).
- Slater tipi yörünge (STO), radyal düğümleri olmayan bir formdur, ancak hidrojen benzeri yörünge gibi çekirdekten bozulur.
- Formu Gauss tipi yörünge (Gaussian'lar) radyal düğümlere sahip değildir ve şu şekilde bozulur: .
Hidrojen benzeri yörüngeler hala pedagojik araçlar olarak kullanılsa da, bilgisayarların ortaya çıkışı, STO'ları atomlar ve diatomik moleküller için tercih edilir hale getirmiştir çünkü STO kombinasyonları hidrojen benzeri atomik yörüngedeki düğümlerin yerini alabilir. Gaussianlar tipik olarak üç veya daha fazla atomlu moleküllerde kullanılır. Kendi başlarına STO'lar kadar doğru olmasa da, birçok Gausslu'dan oluşan kombinasyonlar, hidrojen benzeri orbitallerin doğruluğuna ulaşabilir.
Tarih
"Yörünge" terimi, Robert Mulliken 1932'de kısaltması olarak tek elektronlu yörünge dalga fonksiyonu.[9] Bununla birlikte, elektronların belirli açısal momentuma sahip kompakt bir çekirdek etrafında dönebileceği fikri, en az 19 yıl önce ikna edici bir şekilde tartışıldı. Niels Bohr,[10] ve Japon fizikçi Hantaro Nagaoka 1904 gibi erken bir tarihte elektronik davranış için yörünge temelli bir hipotez yayınladı.[11] Bu elektron "yörüngelerinin" davranışını açıklamak, gelişmenin arkasındaki itici güçlerden biriydi. Kuantum mekaniği.[12]
Erken modeller
İle J. J. Thomson 1897'de elektron keşfi,[13] atomların doğanın en küçük yapı taşları olmadığı, aksine kompozit parçacıklar olduğu anlaşıldı. Atomların içinde yeni keşfedilen yapı, birçok kişiyi atomun bileşen parçalarının birbiriyle nasıl etkileşime girebileceğini hayal etmeye yöneltti. Thomson, pozitif yüklü jöle benzeri bir madde içinde birden fazla elektronun yörünge benzeri halkalarda döndüğünü teorileştirdi.[14] ve elektronun keşfi ile 1909 arasında, bu "erikli puding modeli "atomik yapının en yaygın kabul gören açıklamasıydı.
Thomson'ın keşfinden kısa bir süre sonra, Hantaro Nagaoka elektronik yapı için farklı bir model öngördü.[11] Erikli puding modelinin aksine, Nagaoka'nın "Satürn Modeli" ndeki pozitif yük, elektronları Satürn'ün halkalarını andıran dairesel yörüngelere çekerek merkezi bir çekirdeğe yoğunlaştı. O sırada Nagaoka'nın çalışmalarını çok az kişi fark etti.[15] ve Nagaoka'nın kendisi teoride temel bir kusur olduğunu, yani klasik yüklü bir nesnenin yörüngesel hareketi sürdüremediğini çünkü hızlandığını ve bu nedenle elektromanyetik radyasyon nedeniyle enerji kaybettiğini fark etti.[16] Yine de Satürn modeli modern teori ile çağdaşlarının hepsinden daha fazla ortak noktaya sahip olduğu ortaya çıktı.
Bohr atomu
1909'da, Ernest Rutherford atomik kütlenin büyük kısmının, aynı zamanda pozitif yüklü olduğu bulunan bir çekirdeğe sıkıca yoğunlaştığını keşfetti. Erikli puding modelinin atomik yapıyı açıklayamadığı 1911'deki analizinden anlaşıldı. 1913'te, Rutherford'un doktora sonrası öğrencisi, Niels Bohr, yeni bir atom modeli önerdi, burada elektronlar çekirdeğin yörüngesinde klasik periyotlarla döndüler, ancak yalnızca birimlerde nicelenen ayrı açısal momentum değerlerine sahip olmalarına izin verildi h/ 2π.[10] Bu kısıtlama otomatik olarak yalnızca belirli elektron enerjileri değerlerine izin verdi. Bohr modeli Atomun, temel durumdan radyasyondan enerji kaybı sorununu çözdü (bunun altında bir durum olmadığını ilan ederek) ve daha da önemlisi spektral çizgilerin kökenini açıkladı.

Bohr'un kullanımından sonra Einstein açıklaması fotoelektrik etki atomlardaki enerji seviyelerini yayılan ışığın dalga boyuyla ilişkilendirmek, atomlardaki elektronların yapısı ve emisyon ve absorpsiyon spektrumları Atomlar, atomlardaki elektronların anlaşılmasında giderek daha kullanışlı bir araç haline geldi. Emisyon ve soğurma spektrumlarının (19. yüzyılın ortalarından beri deneysel olarak bilinen) en belirgin özelliği, bu atomik spektrumların ayrı çizgiler içermesiydi. Bohr modelinin önemi, emisyon ve absorpsiyon spektrumlarındaki çizgileri, elektronların bir atomun etrafında alabileceği yörüngeler arasındaki enerji farklarıyla ilişkilendirmesiydi. Ancak bu, değil Bohr tarafından elektronlara bir tür dalga benzeri özellikler vererek elde edildi, çünkü elektronların şu şekilde davranabileceği fikri madde dalgaları on bir yıl sonrasına kadar önerilmedi. Yine de, Bohr modelinin nicelleştirilmiş açısal momentumu ve dolayısıyla nicelleştirilmiş enerji seviyelerini kullanması, atomlardaki elektronların anlaşılmasına yönelik önemli bir adımdı ve aynı zamanda gelişmeye doğru önemli bir adımdı. Kuantum mekaniği nicelleştirilmiş kısıtlamaların atomlardaki tüm kesintili enerji seviyelerini ve spektrumlarını hesaba katması gerektiğini öne sürerek.
İle de Broglie 1924'te ve 1926'dan kısa bir süre önce elektron madde dalgalarının varlığına dair önerisi Schrödinger denklemi tedavisi hidrojen benzeri atomlar Bohr elektron "dalga boyu" momentumunun bir fonksiyonu olarak görülebilir ve böylelikle bir Bohr yörüngesinde dönen elektron, yarı dalga boyunun bir katında bir daire içinde yörüngede döndüğü görüldü.[a] Kısa bir süreliğine Bohr modeli, 'dalga boyu' argümanı tarafından sağlanan ek bir kısıtlama ile klasik bir model olarak görülebilir. Bununla birlikte, bu dönemin yerini hemen 1926'nın tam üç boyutlu dalga mekaniği aldı. Şu anki fizik anlayışımıza göre, Bohr modeli, açısal momentum nicemlemesi nedeniyle yarı klasik bir model olarak adlandırılıyor, temelde Bohr modeli önerildikten bir düzine yıl sonra geriye bakıldığında ortaya çıkan elektron dalga boyu.
Bohr modeli, emisyon ve soğurma spektrumlarını açıklayabildi. hidrojen. Elektronların enerjileri n Bohr modelindeki = 1, 2, 3, vb. Durumlar mevcut fiziğinkilerle eşleşir. Bununla birlikte, bu, periyodik tabloda ifade edildiği gibi, farklı atomlar arasındaki benzerlikleri açıklamıyordu. helyum (iki elektron), neon (10 elektron) ve argon (18 elektron) benzer kimyasal inertlik sergiler. Modern Kuantum mekaniği bunu açısından açıklıyor elektron kabukları ve her biri tarafından belirlenen bir dizi elektron tutabilen alt kabuklar Pauli dışlama ilkesi. Böylece n = 1 durumu bir veya iki elektron tutabilirken n = 2 durumu 2s ve 2p alt kabuklarında sekize kadar elektron tutabilir. Helyumda hepsi n = 1 eyalet tamamen dolu; aynısı için de geçerli n = 1 ve n = 2 neonda. Argonda, 3s ve 3p alt kabukları benzer şekilde sekiz elektron tarafından tamamen işgal edilmiştir; kuantum mekaniği ayrıca bir 3 boyutlu alt kabuğa izin verir, ancak bu, argonda 3s ve 3p'den daha yüksek enerjide (hidrojen atomundaki durumun aksine) ve boş kalır.
Heisenberg belirsizlik ilkesiyle modern kavramlar ve bağlantılar
Hemen sonra Heisenberg keşfetti belirsizlik ilkesi,[17] Bohr herhangi bir tür dalga paketi Paketin kendisini oluşturmak için bir frekans dağılımı gerektiğinden, dalga frekansı ve dalga boyunda belirsizlik anlamına gelir.[18] Tüm parçacık momentinin dalgalarla ilişkilendirildiği kuantum mekaniğinde, dalgayı ve dolayısıyla parçacığı uzayda lokalize eden böyle bir dalga paketinin oluşmasıdır. Bir kuantum mekanik parçacığın bağlandığı durumlarda, bir dalga paketi olarak yerelleştirilmesi gerekir ve paketin varlığı ve minimum boyutu, parçacık dalga boyunda bir yayılma ve minimum değer ve dolayısıyla aynı zamanda momentum ve enerji anlamına gelir. Kuantum mekaniğinde, bir parçacık uzayda daha küçük bir bölgeye lokalize edildiğinden, ilişkili sıkıştırılmış dalga paketi, daha büyük ve daha geniş bir moment aralığı ve dolayısıyla daha büyük kinetik enerji gerektirir. Böylelikle, bir parçacığı daha küçük bir uzay bölgesinde tutacak veya hapsedecek bağlanma enerjisi, uzay alanı küçüldükçe sınırsız olarak artar. Parçacıklar uzayda geometrik bir noktayla sınırlandırılamaz, çünkü bu sonsuz bir parçacık momentumu gerektirecektir.
Kimyada, Schrödinger, Pauling, Mulliken ve diğerleri, Heisenberg ilişkisinin sonucunun, bir dalga paketi olarak elektronun yörüngesinde kesin bir konuma sahip olduğunun düşünülemeyeceğini belirtti. Max Doğum elektronun pozisyonunun bir olasılık dağılımı dalga fonksiyonunun bir noktasında elektronun bulunması ile bağlantılı olan dalga paketini tanımlamıştır. Yeni kuantum mekaniği kesin sonuçlar vermedi, sadece bu tür çeşitli olası sonuçların ortaya çıkma olasılıklarını verdi. Heisenberg, bir atomdaki elektronlarla yapamayacağımız gibi, onu gözlemleyemezsek, hareket eden bir parçacığın yolunun hiçbir anlamı olmadığını savundu.
Heisenberg, Schrödinger ve diğerlerinin kuantum resminde Bohr atom numarasın her yörünge için bir n-küre[kaynak belirtilmeli ] atomu çevreleyen elektron dalga paketinin olasılık bulutunun en olası enerjisi olarak resmedildi.
Yörünge isimleri
Yörünge notasyonu
Orbitallere genellikle şu şekilde verilen isimler verilmiştir:
nerede X karşılık gelen enerji seviyesidir Ana kuantum sayısı n; tip şekli belirten küçük harftir veya alt kabuk orbitalin, karşılık gelen açısal kuantum sayısı ℓ; ve y o yörüngedeki elektron sayısıdır.
Örneğin yörünge 1'ler2 (tek tek sayılar ve harfler olarak telaffuz edilir: "'bir' 'es' 'iki'") iki elektrona sahiptir ve en düşük enerji seviyesidir (n = 1) ve açısal kuantum sayısına sahiptir ℓ = 0, s olarak gösterilir.
X-ışını gösterimi
Ayrıca, X-ışını biliminde hala kullanılan, daha az yaygın olan başka bir sistem var X-ışını gösterimi yörünge teorisi iyi anlaşılmadan önce kullanılan notasyonların devamı olan. Bu sistemde, temel kuantum numarasına onunla ilişkili bir harf verilir. İçin n = 1, 2, 3, 4, 5, …bu sayılarla ilişkili harfler sırasıyla K, L, M, N, O, ...
Hidrojen benzeri yörüngeler
En basit atomik orbitaller, tek elektronlu sistemler için hesaplananlardır. hidrojen atomu. Başka herhangi bir elementin atomu iyonize tek bir elektrona kadar hidrojene çok benzer ve orbitaller aynı formu alır. Bir negatif ve bir pozitif parçacığın bu sistemi için Schrödinger denkleminde, atomik orbitaller özdurumlar of Hamilton operatörü enerji için. Analitik olarak elde edilebilirler, yani ortaya çıkan orbitaller bir polinom serisinin ürünleri ve üstel ve trigonometrik fonksiyonlardır. (görmek hidrojen atomu ).
İki veya daha fazla elektrona sahip atomlar için, yönetim denklemleri ancak iteratif yaklaşım yöntemlerinin kullanılmasıyla çözülebilir. Çok elektronlu atomların orbitalleri niteliksel olarak hidrojeninkine benzer ve en basit modellerde aynı biçime sahip olarak alınırlar. Daha titiz ve kesin analiz için sayısal tahminler kullanılmalıdır.
Belirli bir (hidrojen benzeri) atomik yörünge, üç kuantum sayısının benzersiz değerleri ile tanımlanır: n, ℓ, ve mℓ. Kuantum sayılarının değerlerini ve enerjilerini sınırlayan kurallar (aşağıya bakınız), atomların elektron konfigürasyonunu ve periyodik tablo.
Durağan durumlar (kuantum durumları Hidrojen benzeri atomların) atomik orbitalleridir.[açıklama gerekli ] Bununla birlikte, genel olarak, bir elektronun davranışı tek bir yörünge ile tam olarak tanımlanmamaktadır. Elektron durumları en iyi zamana bağlı "karışımlar" (doğrusal kombinasyonlar ) çoklu orbitaller. Görmek Atomik orbitallerin lineer kombinasyonu moleküler orbital yöntemi.
Kuantum sayısı n ilk olarak Bohr modeli Her dairesel elektron yörüngesinin yarıçapını belirlediği yer. Modern kuantum mekaniğinde ise, n elektronun çekirdekten ortalama mesafesini belirler; aynı değere sahip tüm elektronlar n aynı ortalama mesafede uzanmak. Bu nedenle, aynı değere sahip orbitaller n bir "kabuk ". Aynı değere sahip orbitaller n ve aynı değerdeℓ daha da yakından ilişkilidir ve bir "alt kabuk ".
Kuantum sayıları
Bir çekirdek etrafındaki elektronların kuantum mekaniksel doğası nedeniyle, atomik orbitaller, kuantum sayıları olarak bilinen bir dizi tamsayı tarafından benzersiz bir şekilde tanımlanabilir. Bu kuantum sayıları yalnızca belirli değer kombinasyonlarında meydana gelir ve bunların fiziksel yorumu, atomik orbitallerin gerçek veya karmaşık versiyonlarının kullanılmasına bağlı olarak değişir.
Karmaşık orbitaller
Fizikte en yaygın yörünge açıklamaları, yörüngelerin bir radyal fonksiyon ile saf bir küresel harmonik arasında ürün tarafından verildiği hidrojen atomunun çözümlerine dayanmaktadır. Kuantum sayıları, olası değerlerini düzenleyen kurallarla birlikte aşağıdaki gibidir:
Ana kuantum sayısı n elektronun enerjisini tanımlar ve her zaman bir pozitif tamsayı. Aslında, herhangi bir pozitif tamsayı olabilir, ancak aşağıda tartışılan nedenlerden dolayı, nadiren büyük sayılarla karşılaşılır. Her atom, genel olarak, her bir değerle ilişkili birçok orbital içerir. n; bu orbitaller birlikte bazen denir elektron kabukları.
azimut kuantum sayısı ℓ her elektronun yörüngesel açısal momentumunu açıklar ve negatif olmayan bir tamsayıdır. Bir kabuk içinde n tam sayı mı n0, ℓ ilişkiyi sağlayan tüm (tamsayı) değerler arasında aralıklar . Örneğin, n = 1 kabuk sadece orbitallere sahiptir , ve n = 2 kabuk sadece orbitallere sahiptir , ve . Belirli bir değerle ilişkili orbitaller kümesiℓ bazen toplu olarak adlandırılır alt kabuk.
manyetik kuantum sayısı, , bir elektronun manyetik momentini gelişigüzel bir yönde tanımlar ve her zaman bir tamsayıdır. Bir alt kabuğun içinde tam sayı mı , şu şekilde değişir: .
Yukarıdaki sonuçlar aşağıdaki tabloda özetlenebilir. Her hücre bir alt kabuğu temsil eder ve şu değerleri listeler: bu alt kabukta mevcut. Boş hücreler, var olmayan alt kabukları temsil eder.
| ℓ = 0 | ℓ = 1 | ℓ = 2 | ℓ = 3 | ℓ = 4 | ... | |
|---|---|---|---|---|---|---|
| n = 1 | ||||||
| n = 2 | 0 | −1, 0, 1 | ||||
| n = 3 | 0 | −1, 0, 1 | −2, −1, 0, 1, 2 | |||
| n = 4 | 0 | −1, 0, 1 | −2, −1, 0, 1, 2 | −3, −2, −1, 0, 1, 2, 3 | ||
| n = 5 | 0 | −1, 0, 1 | −2, −1, 0, 1, 2 | −3, −2, −1, 0, 1, 2, 3 | −4, −3, −2, −1, 0, 1, 2, 3, 4 | |
| ... | ... | ... | ... | ... | ... | ... |
Alt kabuklar genellikle - ve -değerler. sayısal değeriyle temsil edilir, ancak aşağıdaki gibi bir harfle temsil edilir: 0 's', 1 'p', 2 'd', 3 'f' ve 4 'g' ile temsil edilir. Örneğin, alt kabuktan söz edilebilir ve '2s alt kabuğu' olarak.
Her elektron ayrıca bir kuantum sayısı spin, s, her elektronun dönüşünü tanımlayan (yukarı veya aşağı dönüş). Numara s + olabilir1/2 veya -1/2.
Pauli dışlama ilkesi bir atomdaki iki elektronun dört kuantum sayısının hepsiyle aynı değerlere sahip olamayacağını belirtir. Bir yörüngede üç kuantum sayısı için verilen değerlere sahip iki elektron varsa, (n, ℓ, m), bu iki elektronun dönüşleri farklı olmalıdır.
Yukarıdaki kurallar, tercih edilen bir ekseni ifade eder (örneğin, z Kartezyen koordinatlarda yön) ve ayrıca bu tercih edilen eksen boyunca tercih edilen bir yönü ifade eder. Aksi takdirde ayırt etmenin bir anlamı olmazdı m = +1 itibaren m = −1. Bu nedenle model, bu simetrileri paylaşan fiziksel sistemlere uygulandığında en yararlıdır. Stern-Gerlach deneyi - bir atomun bir manyetik alana maruz kaldığı yerde - böyle bir örnek sağlar.[19]
Gerçek orbitaller
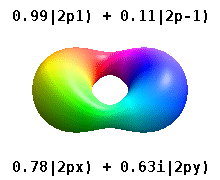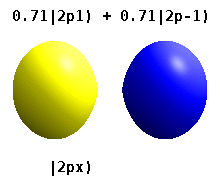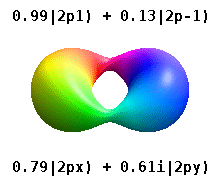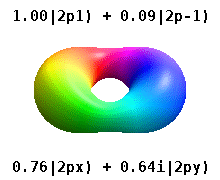
Kristal bir katıya gömülü bir atom, çok sayıda tercih edilen ekseni hisseder, ancak genellikle tercih edilen bir yön yoktur. Radyal fonksiyonların çarpımından atomik orbitaller ve tek bir küresel harmonik küresel harmoniklerin doğrusal kombinasyonları tipik olarak kullanılır, böylece küresel harmoniklerin hayali kısmı birbirini götürür. Bunlar gerçek orbitaller yörünge görselleştirmelerinde en yaygın olarak gösterilen yapı taşlarıdır.
Örneğin, gerçek hidrojen benzeri yörüngelerde, n ve ℓ karmaşık meslektaşları ile aynı yorum ve öneme sahiptir, ancak m artık iyi bir kuantum sayısı değildir (mutlak değeri olsa da). Orbitallere, standartlaştırılmış Kartezyen esasına göre şekillerine göre yeni isimler verilir. Gerçek hidrojen benzeri p orbitalleri aşağıda verilmiştir.[20][21]
nerede p0 = Rn 1 Y1 0, p1 = Rn 1 Y1 1, ve p−1 = Rn 1 Y1 −1, karşılık gelen karmaşık orbitallerdir ℓ = 1.
P denklemlerix ve Py orbitaller, küresel harmonikler için kullanılan faz kuralına bağlıdır. Yukarıdaki denklemler küresel harmoniklerin şu şekilde tanımlandığını varsayar: . Ancak bazı kuantum fizikçileri[22][23] bir faz faktörü içerir (−1)m p ile ilişkilendirme etkisine sahip olan bu tanımlardax bir yörünge fark küresel harmoniklerin ve py karşılık gelen yörünge toplam. (Daha fazla ayrıntı için bkz. Küresel harmonikler # Kurallar ).
Yörünge şekilleri

Yörünge şekillerini gösteren basit resimler, yörüngeyi işgal eden elektronların bulunma olasılığı yüksek olan uzaydaki bölgelerin açısal biçimlerini tanımlamayı amaçlamaktadır. Kuantum mekaniğine göre uzayda (neredeyse) herhangi bir yerde elektron bulma olasılığı sıfır olmadığından diyagramlar bir elektronun bulunabileceği tüm bölgeyi gösteremez. Bunun yerine diyagramlar, sınırın yaklaşık temsilleridir veya kontur yüzeyleri olasılık yoğunluğu nerede | ψ (r, θ, φ) |2 sabit bir değere sahiptir, kontur içinde elektron bulma olasılığının belirli bir olasılığı (örneğin% 90) olacak şekilde seçilir. olmasına rağmen | ψ |2 bir kare olarak mutlak değer her yerde negatif değildir, dalga fonksiyonu ψ (r, θ, φ) genellikle yörünge resminin her bir alt bölgesinde gösterilir.
Bazen ψ işlev yerine aşamalarını gösterecek şekilde | ψ (r, θ, φ) |2 olasılık yoğunluğunu gösteren ancak fazları olmayan (mutlak değeri alma sürecinde kaybolan, çünkü ψ (r, θ, φ) karmaşık bir sayıdır). | ψ (r, θ, φ) |2 yörünge grafikleri daha az küresel, daha ince loblara sahip olma eğilimindedir. ψ (r, θ, φ) grafikler, ancak aynı yerlerde aynı sayıda loblara sahip ve aksi halde tanınabilir. Bu makale, dalga fonksiyonu aşamalarını göstermek için, çoğunlukla ψ (r, θ, φ) grafikler.
Loblar şu şekilde görüntülenebilir: durağan dalga girişim iki ters yönde dönen halka rezonansı arasındaki desenler seyahat dalgası "m" ve "−m"yörüngenin bir rezonansa sahip xy düzlemi üzerine izdüşümü ile modlar"m"Çevrenin etrafındaki dalga boyları. Nadiren tasvir edilse de, hareket eden dalga çözümleri, faz bilgisini temsil eden bantlar ile dönen bantlı tori olarak görülebilir. Her biri için m iki sabit dalga çözümü var ⟨m⟩+⟨−m⟩ ve ⟨m⟩−⟨−m⟩. Durum için m = 0 yörünge dikey, ters dönüş bilgisi bilinmiyor ve yörünge zeksen simetrik. Durum için ℓ = 0 karşı döndürme modu yoktur. Yalnızca radyal modlar vardır ve şekil küresel olarak simetriktir. Herhangi bir verilen için n, Daha küçük ℓ daha fazla radyal düğüm vardır. Herhangi bir verilen için ℓ, Daha küçük n daha az radyal düğüm vardır (hangisi için sıfır) n önce var ℓ orbital). Bilinçsiz konuşma n enerjidir ℓ benzer eksantriklik, ve m yönelimdir. Klasik durumda, örneğin dairesel bir iletim hattındaki bir halka rezonant hareket eden dalga, aktif olarak zorlanmadıkça, kendiliğinden bir halka rezonant duran dalgaya dönüşecektir, çünkü yansımalar zamanla en küçük kusur veya süreksizlikte bile birikecektir.
Genel olarak, sayı n belirli bir çekirdek için yörüngenin boyutunu ve enerjisini belirler: n büyüdükçe yörünge boyutu artar. Farklı elementleri karşılaştırırken, daha yüksek nükleer yük Z Daha ağır elementlerin sayısı, orbitallerinin daha hafif olanlara kıyasla daralmasına neden olur, böylece tüm atomun toplam boyutu, daha ağır elementlerdeki elektron sayısı (daha yüksek) olsa bile, kabaca sabit kalır. Z) artışlar.

Ayrıca genel anlamda, ℓ bir yörüngenin şeklini belirler ve mℓ yönü. Bununla birlikte, bazı orbitaller aşağıdaki denklemlerle tanımlandığından Karışık sayılar şekil bazen şunlara bağlıdır: mℓ Ayrıca. Birlikte, belirli bir ℓ ve n Gittikçe karmaşıklaşan lob ve düğüm kümeleriyle birlikte, alanı mümkün olduğunca simetrik olarak doldurun.
Tek s-orbitalleri () küre şeklindedir. İçin n = 1 kabaca bir sağlam top (merkezde en yoğundur ve üssel olarak dışa doğru kaybolur), ancak n = 2 veya daha fazlası, her bir tek s-orbitali, iç içe geçmiş kabuklar olan küresel olarak simetrik yüzeylerden oluşur (yani, "dalga yapısı", bir sinüzoidal radyal bileşeni de izleyen radyaldir). Sağdaki bu iç içe geçmiş kabukların bir enine kesitinin resmine bakın. Herkes için s-orbitalleri n sayılar, çekirdeğin merkezinde bir anti-düğüme (yüksek dalga fonksiyonu yoğunluğuna sahip bir bölge) sahip tek orbitallerdir. Diğer tüm orbitaller (p, d, f, vb.) Açısal momentuma sahiptir ve bu nedenle çekirdekten kaçınır (bir dalga düğümüne sahip) -de çekirdek). Son zamanlarda, bir SrTiO'da 1s ve 2p orbitallerini deneysel olarak imgelemek için bir çaba olmuştur.3 enerji dağıtıcı x-ışını spektroskopisi ile taramalı geçirimli elektron mikroskobu kullanarak kristal.[24] Görüntüleme bir elektron ışını kullanılarak yapıldığından, genellikle etki parametresi etkisi olarak adlandırılan Coulombic ışın-yörünge etkileşimi nihai sonuca dahil edilmiştir (sağdaki şekle bakın).
P, d ve f-orbitallerinin şekilleri burada sözlü olarak tanımlanmış ve grafik olarak gösterilmiştir. Orbitaller tablosu altında. Üç p-orbitali n = 2 iki formda olmak elipsoidler Birlikte teğet noktası -de çekirdek (iki loblu şekil bazen "dambıl "- birbirine zıt yönleri gösteren iki lob vardır). Her birinde üç p-orbitali kabuk değerlerinin ilgili doğrusal kombinasyonu ile belirlendiği gibi, birbirlerine dik açılarda yönlendirilirler.mℓ. Genel sonuç, birincil eksenlerin her yönünü işaret eden bir lobdur.
Beş d-orbitalinden dördü n = 3 birbirine benziyor, her biri armut biçimli dört lobu var, her lob diğer ikisine dik açıyla teğet ve dördünün de merkezleri bir düzlemde uzanıyor. Bu düzlemlerden üçü xy-, xz- ve yz-düzlemleridir - loblar, birincil eksen çiftlerinin arasındadır - ve dördüncüsü, x ve y eksenleri boyunca merkezlere sahiptir. Beşinci ve son d-yörünge, yüksek olasılık yoğunluğuna sahip üç bölgeden oluşur: a simit z eksenine simetrik olarak yerleştirilmiş armut biçimli iki bölgeye sahiptir. Genel toplam 18 yönlü lob, her birincil eksen yönünde ve her çift arasında işaret eder.
Her biri d-orbitallerinkinden daha karmaşık şekillere sahip yedi f-orbital vardır.
Ek olarak, s orbitallerinde olduğu gibi, tek tek p, d, f ve g orbitalleri ile n Olası en düşük değerden daha yüksek değerler, dalganın en düşük (veya temel) moduna kıyasla aynı tipteki harmonik dalgaları anımsatan ek bir radyal düğüm yapısı sergiler. S orbitallerinde olduğu gibi, bu fenomen bir sonraki olası daha yüksek değerde p, d, f ve g orbitalleri sağlar. n (örneğin, 3p orbitallerine karşı temel 2p), her lobda ek bir düğüm. Hala daha yüksek değerler n her tür yörünge için radyal düğüm sayısını daha da artırın.
Tek elektronlu atomdaki atomik orbitallerin şekilleri 3 boyutlu küresel harmonikler. Bu şekiller benzersiz değildir ve herhangi bir doğrusal kombinasyon, bir dönüşüm gibi geçerlidir. kübik harmonikler, aslında tüm d'lerin aynı şekle sahip olduğu kümeler oluşturmak mümkündür, tıpkı px, py, ve pz aynı şekildedir.[25][26]
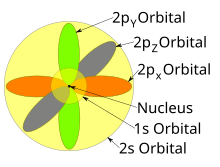
Bireysel orbitaller çoğunlukla birbirinden bağımsız olarak gösterilse de, orbitaller aynı zamanda çekirdek etrafında bir arada bulunur. Ayrıca 1927'de Albrecht Unsöld belirli bir azimut kuantum sayısının tüm orbitallerinin elektron yoğunluğunun toplanması durumunda ℓ aynı kabuğun n (örneğin, her bir yörüngenin bir elektron tarafından işgal edildiği veya her birinin bir elektron çifti tarafından işgal edildiği üç 2p orbitalinin tümü veya beş 3d orbitalin tümü), sonra tüm açısal bağımlılık ortadan kalkar; yani, o alt kabuktaki tüm atomik orbitallerin sonuçtaki toplam yoğunluğu (aynı ℓ) is spherical. Bu olarak bilinir Unsöld teoremi.
Orbitals table
This table shows all orbital configurations for the real hydrogen-like wave functions up to 7s, and therefore covers the simple electronic configuration for all elements in the periodic table up to radyum. "ψ" graphs are shown with − ve + dalga fonksiyonu phases shown in two different colors (arbitrarily red and blue). pz orbital is the same as the p0 orbital, but the px ve py are formed by taking linearcombinations of the p+1 ve p−1 orbitals (which is why they are listed under the m = ±1 etiket). Ayrıca p+1 ve p−1 are notthe same shape as the p0, since they are pure küresel harmonikler.
| s (ℓ = 0) | p (ℓ = 1) | d (ℓ = 2) | f (ℓ = 3) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| m = 0 | m = 0 | m = ±1 | m = 0 | m = ±1 | m = ±2 | m = 0 | m = ±1 | m = ±2 | m = ±3 | |||||||
| s | pz | px | py | dz2 | dxz | dyz | dxy | dx2−y2 | fz3 | fxz2 | fyz2 | fxyz | fz(x2−y2) | fx(x2−3y2) | fy(3x2−y2) | |
| n = 1 |  | |||||||||||||||
| n = 2 |  |  |  |  | ||||||||||||
| n = 3 |  |  |  |  |  |  |  |  |  | |||||||
| n = 4 |  |  |  |  |  |  |  |  |  |  |  |  |  |  |  |  |
| n = 5 |  |  |  |  |  |  |  |  |  | . . . | . . . | . . . | . . . | . . . | . . . | . . . |
| n = 6 |  |  |  |  | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . |
| n = 7 |  | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . | . . . |
Qualitative understanding of shapes
The shapes of atomic orbitals can be qualitatively understood by considering the analogous case of standing waves on a circular drum.[27] To see the analogy, the mean vibrational displacement of each bit of drum membrane from the equilibrium point over many cycles (a measure of average drum membrane velocity and momentum at that point) must be considered relative to that point's distance from the center of the drum head. If this displacement is taken as being analogous to the probability of finding an electron at a given distance from the nucleus, then it will be seen that the many modes of the vibrating disk form patterns that trace the various shapes of atomic orbitals. The basic reason for this correspondence lies in the fact that the distribution of kinetic energy and momentum in a matter-wave is predictive of where the particle associated with the wave will be. That is, the probability of finding an electron at a given place is also a function of the electron's average momentum at that point, since high electron momentum at a given position tends to "localize" the electron in that position, via the properties of electron wave-packets (see the Heisenberg belirsizlik ilkesi for details of the mechanism).
This relationship means that certain key features can be observed in both drum membrane modes and atomic orbitals. For example, in all of the modes analogous to s orbitals (the top row in the animated illustration below), it can be seen that the very center of the drum membrane vibrates most strongly, corresponding to the antinode tümünde s orbitals in an atom. This antinode means the electron is most likely to be at the physical position of the nucleus (which it passes straight through without scattering or striking it), since it is moving (on average) most rapidly at that point, giving it maximal momentum.
A mental "planetary orbit" picture closest to the behavior of electrons in s orbitals, all of which have no angular momentum, might perhaps be that of a Kepler yörüngesi ile yörünge eksantrikliği of 1 but a finite major axis, not physically possible (because parçacıklar were to collide), but can be imagined as a limit of orbits with equal major axes but increasing eccentricity.
Below, a number of drum membrane vibration modes and the respective wave functions of the hydrogen atom are shown. A correspondence can be considered where the wave functions of a vibrating drum head are for a two-coordinate system ψ (r, θ) and the wave functions for a vibrating sphere are three-coordinate ψ (r, θ, φ).
- s-type drum modes and wave functions

Drum mode

Drum mode

Drum mode

Wave function of 1s orbital (real part, 2D-cut, )

Wave function of 2s orbital (real part, 2D-cut, )

Wave function of 3s orbital (real part, 2D-cut, )
None of the other sets of modes in a drum membrane have a central antinode, and in all of them the center of the drum does not move. These correspond to a node at the nucleus for all non-s orbitals in an atom. These orbitals all have some angular momentum, and in the planetary model, they correspond to particles in orbit with eccentricity less than 1.0, so that they do not pass straight through the center of the primary body, but keep somewhat away from it.
In addition, the drum modes analogous to p ve d modes in an atom show spatial irregularity along the different radial directions from the center of the drum, whereas all of the modes analogous to s modes are perfectly symmetrical in radial direction. The non radial-symmetry properties of non-s orbitals are necessary to localize a particle with angular momentum and a wave nature in an orbital where it must tend to stay away from the central attraction force, since any particle localized at the point of central attraction could have no angular momentum. For these modes, waves in the drum head tend to avoid the central point. Such features again emphasize that the shapes of atomic orbitals are a direct consequence of the wave nature of electrons.
- p-type drum modes and wave functions

Drum mode

Drum mode

Drum mode

Wave function of 2p orbital (real part, 2D-cut, )

Wave function of 3p orbital (real part, 2D-cut, )

Wave function of 4p orbital (real part, 2D-cut, )
- d-type drum modes

Mod (3d orbital)

Mod (4d orbital)

Mod (5d orbital)
Yörünge enerjisi
In atoms with a single electron (hidrojen benzeri atomlar ), the energy of an orbital (and, consequently, of any electrons in the orbital) is determined mainly by . orbital has the lowest possible energy in the atom. Each successively higher value of has a higher level of energy, but the difference decreases as artışlar. For high , the level of energy becomes so high that the electron can easily escape from the atom. In single electron atoms, all levels with different within a given are degenerate in the Schrödinger approximation, and have the same energy. This approximation is broken to a slight extent in the solution to the Dirac equation (where the energy depends on n and another quantum number j), and by the effect of the magnetic field of the nucleus and kuantum elektrodinamiği Etkileri. The latter induce tiny binding energy differences especially for s electrons that go nearer the nucleus, since these feel a very slightly different nuclear charge, even in one-electron atoms; görmek Kuzu kayması.
In atoms with multiple electrons, the energy of an electron depends not only on the intrinsic properties of its orbital, but also on its interactions with the other electrons. These interactions depend on the detail of its spatial probability distribution, and so the enerji seviyeleri of orbitals depend not only on but also on . Higher values of are associated with higher values of energy; for instance, the 2p state is higher than the 2s state. Ne zaman , the increase in energy of the orbital becomes so large as to push the energy of orbital above the energy of the s-orbital in the next higher shell; ne zaman the energy is pushed into the shell two steps higher. The filling of the 3d orbitals does not occur until the 4s orbitals have been filled.
The increase in energy for subshells of increasing angular momentum in larger atoms is due to electron–electron interaction effects, and it is specifically related to the ability of low angular momentum electrons to penetrate more effectively toward the nucleus, where they are subject to less screening from the charge of intervening electrons. Thus, in atoms of higher atomic number, the of electrons becomes more and more of a determining factor in their energy, and the principal quantum numbers of electrons becomes less and less important in their energy placement.
The energy sequence of the first 35 subshells (e.g., 1s, 2p, 3d, etc.) is given in the following table. Each cell represents a subshell with ve given by its row and column indices, respectively. The number in the cell is the subshell's position in the sequence. For a linear listing of the subshells in terms of increasing energies in multielectron atoms, see the section below.
| s | p | d | f | g | h | |
|---|---|---|---|---|---|---|
| 1 | 1 | |||||
| 2 | 2 | 3 | ||||
| 3 | 4 | 5 | 7 | |||
| 4 | 6 | 8 | 10 | 13 | ||
| 5 | 9 | 11 | 14 | 17 | 21 | |
| 6 | 12 | 15 | 18 | 22 | 26 | 31 |
| 7 | 16 | 19 | 23 | 27 | 32 | 37 |
| 8 | 20 | 24 | 28 | 33 | 38 | 44 |
| 9 | 25 | 29 | 34 | 39 | 45 | 51 |
| 10 | 30 | 35 | 40 | 46 | 52 | 59 |
Note: empty cells indicate non-existent sublevels, while numbers in italics indicate sublevels that could (potentially) exist, but which do not hold electrons in any element currently known.
Electron placement and the periodic table

Several rules govern the placement of electrons in orbitals (elektron konfigürasyonu ). The first dictates that no two electrons in an atom may have the same set of values of quantum numbers (this is the Pauli dışlama ilkesi ). These quantum numbers include the three that define orbitals, as well as s veya kuantum sayısı spin. Thus, two electrons may occupy a single orbital, so long as they have different values ofs. Ancak, sadece two electrons, because of their spin, can be associated with each orbital.
Additionally, an electron always tends to fall to the lowest possible energy state. It is possible for it to occupy any orbital so long as it does not violate the Pauli exclusion principle, but if lower-energy orbitals are available, this condition is unstable. The electron will eventually lose energy (by releasing a foton ) and drop into the lower orbital. Thus, electrons fill orbitals in the order specified by the energy sequence given above.
This behavior is responsible for the structure of the periyodik tablo. The table may be divided into several rows (called 'periods'), numbered starting with 1 at the top. The presently known elements occupy seven periods. If a certain period has number ben, it consists of elements whose outermost electrons fall in the benth shell. Niels Bohr was the first to propose (1923) that the dönemsellik in the properties of the elements might be explained by the periodic filling of the electron energy levels, resulting in the electronic structure of the atom.[28]
The periodic table may also be divided into several numbered rectangular 'bloklar '. The elements belonging to a given block have this common feature: their highest-energy electrons all belong to the same ℓ-state (but the n associated with that ℓ-state depends upon the period). For instance, the leftmost two columns constitute the 's-block'. The outermost electrons of Li ve Ol respectively belong to the 2s subshell, and those of Na ve Mg to the 3s subshell.
The following is the order for filling the "subshell" orbitals, which also gives the order of the "blocks" in the periodic table:
- 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p
The "periodic" nature of the filling of orbitals, as well as emergence of the s, p, d, ve f "blocks", is more obvious if this order of filling is given in matrix form, with increasing principal quantum numbers starting the new rows ("periods") in the matrix. Then, each subshell (composed of the first two quantum numbers) is repeated as many times as required for each pair of electrons it may contain. The result is a compressed periodic table, with each entry representing two successive elements:
| 1 sn | |||||||||||||||
| 2s | 2p | 2p | 2p | ||||||||||||
| 3s | 3p | 3p | 3p | ||||||||||||
| 4s | 3 boyutlu | 3 boyutlu | 3 boyutlu | 3 boyutlu | 3 boyutlu | 4p | 4p | 4p | |||||||
| 5s | 4 g | 4 g | 4 g | 4 g | 4 g | 5p | 5p | 5p | |||||||
| 6s | 4f | 4f | 4f | 4f | 4f | 4f | 4f | 5 g | 5 g | 5 g | 5 g | 5 g | 6p | 6p | 6p |
| 7 sn. | 5f | 5f | 5f | 5f | 5f | 5f | 5f | 6 g | 6 g | 6 g | 6 g | 6 g | 7p | 7p | 7p |
Although this is the general order of orbital filling according to the Madelung rule, there are exceptions, and the actual electronic energies of each element are also dependent upon additional details of the atoms (see Electron configuration#Atoms: Aufbau principle and Madelung rule ).
The number of electrons in an electrically neutral atom increases with the atomik numara. The electrons in the outermost shell, or değerlik elektronları, tend to be responsible for an element's chemical behavior. Elements that contain the same number of valence electrons can be grouped together and display similar chemical properties.
Göreli etkiler
For elements with high atomic number Z, the effects of relativity become more pronounced, and especially so for s electrons, which move at relativistic velocities as they penetrate the screening electrons near the core of high-Z atomlar. This relativistic increase in momentum for high speed electrons causes a corresponding decrease in wavelength and contraction of 6s orbitals relative to 5d orbitals (by comparison to corresponding s and d electrons in lighter elements in the same column of the periodic table); this results in 6s valence electrons becoming lowered in energy.
Examples of significant physical outcomes of this effect include the lowered melting temperature of Merkür (which results from 6s electrons not being available for metal bonding) and the golden color of altın ve sezyum.[29]
İçinde Bohr Model, bir n = 1 electron has a velocity given by , nerede Z is the atomic number, ... ince yapı sabiti, ve c ışık hızıdır. In non-relativistic quantum mechanics, therefore, any atom with an atomic number greater than 137 would require its 1s electrons to be traveling faster than the speed of light. Hatta Dirac denklemi, which accounts for relativistic effects, the wave function of the electron for atoms with is oscillatory and sınırsız. The significance of element 137, also known as untriseptium, was first pointed out by the physicist Richard Feynman. Element 137 is sometimes informally called feynmanium (symbol Fy).[30] However, Feynman's approximation fails to predict the exact critical value of Z due to the non-point-charge nature of the nucleus and very small orbital radius of inner electrons, resulting in a potential seen by inner electrons which is effectively less than Z. The critical Z value, which makes the atom unstable with regard to high-field breakdown of the vacuum and production of electron-positron pairs, does not occur until Z is about 173. These conditions are not seen except transiently in collisions of very heavy nuclei such as lead or uranium in accelerators, where such electron-positron production from these effects has been claimed to be observed.
There are no nodes in relativistic orbital densities, although individual components of the wave function will have nodes.[31]
pp hybridisation (conjectured)
Geç zamanda period-8 elements a hybrid of 8p3/2 and 9p1/2 is expected to exist,[32] where "3/2" and "1/2" refer to the toplam açısal momentum kuantum sayısı. This "pp" hybrid may be responsible for the p bloğu of the period due to properties similar to p subshells in ordinary valence shells. Energy levels of 8p3/2 and 9p1/2 come close due to relativistic spin–orbit effects; the 9s subshell should also participate, as these elements are expected to be analogous to the respective 5p elements indiyum vasıtasıyla xenon.
Transitions between orbitals
Bound quantum states have discrete energy levels. When applied to atomic orbitals, this means that the energy differences between states are also discrete. A transition between these states (i.e., an electron absorbing or emitting a photon) can thus only happen if the photon has an energy corresponding with the exact energy difference between said states.
Consider two states of the hydrogen atom:
State 1) n = 1, ℓ = 0, mℓ = 0 ve s = +1/2
State 2) n = 2, ℓ = 0, mℓ = 0 ve s = +1/2
By quantum theory, state 1 has a fixed energy of E1, and state 2 has a fixed energy of E2. Now, what would happen if an electron in state 1 were to move to state 2? For this to happen, the electron would need to gain an energy of exactly E2 − E1. If the electron receives energy that is less than or greater than this value, it cannot jump from state 1 to state 2. Now, suppose we irradiate the atom with a broad-spectrum of light. Photons that reach the atom that have an energy of exactly E2 − E1 will be absorbed by the electron in state 1, and that electron will jump to state 2. However, photons that are greater or lower in energy cannot be absorbed by the electron, because the electron can only jump to one of the orbitals, it cannot jump to a state between orbitals. The result is that only photons of a specific frequency will be absorbed by the atom. This creates a line in the spectrum, known as an absorption line, which corresponds to the energy difference between states 1 and 2.
The atomic orbital model thus predicts line spectra, which are observed experimentally. This is one of the main validations of the atomic orbital model.
The atomic orbital model is nevertheless an approximation to the full quantum theory, which only recognizes many electron states. The predictions of line spectra are qualitatively useful but are not quantitatively accurate for atoms and ions other than those containing only one electron.
Ayrıca bakınız
Referanslar
Dipnotlar
- ^ This physically incorrect Bohr model is still often taught to beginning students.[kaynak belirtilmeli ]
Alıntılar
- ^ Orchin, Milton; Macomber, Roger S.; Pinhas, Allan; Wilson, R. Marshall (2005). Atomic Orbital Theory (PDF).
- ^ Daintith, J. (2004). Oxford Kimya Sözlüğü. New York: Oxford University Press. ISBN 978-0-19-860918-6.
- ^ Griffiths, David (1995). Kuantum Mekaniğine Giriş. Prentice Hall. s. 190–191. ISBN 978-0-13-124405-4.
- ^ Levine, Ira (2000). Kuantum Kimyası (5 ed.). Prentice Hall. pp.144–145. ISBN 978-0-13-685512-5.
- ^ Laidler, Keith J.; Meiser, John H. (1982). Fiziksel kimya. Benjamin / Cummings. s. 488. ISBN 978-0-8053-5682-3.
- ^ Atkins, Peter; de Paula, Julio; Friedman, Ronald (2009). Quanta, Matter, and Change: A Molecular Approach to Physical Chemistry. Oxford University Press. s. 106. ISBN 978-0-19-920606-3.
- ^ Feynman, Richard; Leighton, Robert B .; Sands, Matthew (2006). The Feynman Lectures on Physics -The Definitive Edition, Vol 1 lect 6. Pearson PLC, Addison Wesley. s. 11. ISBN 978-0-8053-9046-9.
- ^ Roger Penrose, Gerçeğe Giden Yol
- ^ Mulliken, Robert S. (July 1932). "Polyatomik Moleküllerin Elektronik Yapıları ve Valans. II. Genel Hususlar". Fiziksel İnceleme. 41 (1): 49–71. Bibcode:1932PhRv...41...49M. doi:10.1103/PhysRev.41.49.
- ^ a b Bohr, Niels (1913). "On the Constitution of Atoms and Molecules". Felsefi Dergisi. 26 (1): 476. Bibcode:1914Natur..93..268N. doi:10.1038/093268a0. S2CID 3977652.
- ^ a b Nagaoka, Hantaro (May 1904). "Kinetics of a System of Particles illustrating the Line and the Band Spectrum and the Phenomena of Radioactivity". Felsefi Dergisi. 7 (41): 445–455. doi:10.1080/14786440409463141. Arşivlenen orijinal on 2017-11-27. Alındı 2009-05-30.
- ^ Bryson Bill (2003). Neredeyse Her Şeyin Kısa Tarihi. Broadway Kitapları. pp.141 –143. ISBN 978-0-7679-0818-4.
- ^ Thomson, J. J. (1897). "Cathode rays". Felsefi Dergisi. 44 (269): 293. doi:10.1080/14786449708621070.
- ^ Thomson, J. J. (1904). "On the Structure of the Atom: an Investigation of the Stability and Periods of Oscillation of a number of Corpuscles arranged at equal intervals around the Circumference of a Circle; with Application of the Results to the Theory of Atomic Structure" (extract of paper). Felsefi Dergisi. Seri 6. 7 (39): 237–265. doi:10.1080/14786440409463107.
- ^ Rodos, Richard (1995). Atom Bombasının Yapılışı. Simon ve Schuster. s. 50–51. ISBN 978-0-684-81378-3.
- ^ Nagaoka, Hantaro (May 1904). "Kinetics of a System of Particles illustrating the Line and the Band Spectrum and the Phenomena of Radioactivity". Felsefi Dergisi. 7 (41): 446. doi:10.1080/14786440409463141. Arşivlenen orijinal on 2017-11-27. Alındı 2009-05-30.
- ^ Heisenberg, W. (March 1927). "Über den anschaulichen Inhalt der quantentheoretischen Kinematik und Mechanik". Zeitschrift für Physik A. 43 (3–4): 172–198. Bibcode:1927ZPhy...43..172H. doi:10.1007/BF01397280. S2CID 122763326.
- ^ Bohr, Niels (April 1928). "Kuantum Postülatı ve Atom Teorisinin Son Gelişimi". Doğa. 121 (3050): 580–590. Bibcode:1928Natur.121..580B. doi:10.1038 / 121580a0.
- ^ Gerlach, W .; Stern, O. (1922). "Das magnetische Moment des Silberatoms". Zeitschrift für Physik. 9 (1): 353–355. Bibcode:1922ZPhy....9..353G. doi:10.1007/BF01326984. S2CID 126109346.
- ^ Levine, Ira (2014). Kuantum Kimyası (7. baskı). Pearson Education. s. 141–2. ISBN 978-0-321-80345-0.
- ^ Blanco, Miguel A.; Flórez, M.; Bermejo, M. (December 1997). "Evaluation of the rotation matrices in the basis of real spherical harmonics". Moleküler Yapı Dergisi: THEOCHEM. 419 (1–3): 19–27. doi:10.1016/S0166-1280(97)00185-1.
- ^ Messiah, Albert (1999). Quantum mechanics : two volumes bound as one (Two vol. bound as one, unabridged reprint ed.). Mineola, NY: Dover. ISBN 978-0-486-40924-5.
- ^ Claude Cohen-Tannoudji; Bernard Diu; Franck Laloë; et al. (1996). Kuantum mekaniği. Translated by from the French by Susan Reid Hemley. Wiley-Interscience. ISBN 978-0-471-56952-7.
- ^ a b Jeong, Jong Seok; Odlyzko, Michael L.; Xu, Peng; Jalan, Bharat; Mkhoyan, K. Andre (2016-04-26). "Probing core-electron orbitals by scanning transmission electron microscopy and measuring the delocalization of core-level excitations". Fiziksel İnceleme B. 93 (16): 165140. Bibcode:2016PhRvB..93p5140J. doi:10.1103/PhysRevB.93.165140.
- ^ Powell, Richard E. (1968). "The five equivalent d orbitals". Kimya Eğitimi Dergisi. 45 (1): 45. Bibcode:1968JChEd..45...45P. doi:10.1021/ed045p45.
- ^ Kimball, George E. (1940). "Directed Valence". Kimyasal Fizik Dergisi. 8 (2): 188. Bibcode:1940JChPh...8..188K. doi:10.1063/1.1750628.
- ^ Cazenave, Lions, T., P.; Lions, P. L. (1982). "Orbital stability of standing waves for some nonlinear Schrödinger equations". Matematiksel Fizikte İletişim. 85 (4): 549–561. Bibcode:1982CMaPh..85..549C. doi:10.1007/BF01403504. S2CID 120472894.
- ^ Bohr, Niels (1923). "Über die Anwendung der Quantumtheorie auf den Atombau. I". Zeitschrift für Physik. 13 (1): 117. Bibcode:1923ZPhy...13..117B. doi:10.1007/BF01328209.
- ^ Lower, Stephen. "Primer on Quantum Theory of the Atom".
- ^ Poliakoff, Martyn; Tang, Samantha (9 February 2015). "The periodic table: icon and inspiration". Kraliyet Cemiyeti'nin Felsefi İşlemleri A. 373 (2037): 20140211. Bibcode:2015RSPTA.37340211P. doi:10.1098/rsta.2014.0211. PMID 25666072.
- ^ Szabo, Attila (1969). "Contour diagrams for relativistic orbitals". Kimya Eğitimi Dergisi. 46 (10): 678. Bibcode:1969JChEd..46..678S. doi:10.1021/ed046p678.
- ^ Fricke, Burkhard (1975). Superheavy elements: a prediction of their chemical and physical properties. Fiziğin İnorganik Kimya Üzerindeki Son Etkisi. Yapı ve Bağlanma. 21. pp.89–144. doi:10.1007 / BFb0116498. ISBN 978-3-540-07109-9. Alındı 4 Ekim 2013.
- McCaw, Charles S. (2015). Orbitals: With Applications in Atomic Spectra. Singapur: World Scientific Publishing Company. ISBN 9781783264162.
- Tipler, Paul; Llewellyn, Ralph (2003). Modern Fizik (4 ed.). New York: W. H. Freeman ve Şirketi. ISBN 978-0-7167-4345-3.
- Scerri, Eric (2007). The Periodic Table, Its Story and Its Significance. New York: Oxford University Press. ISBN 978-0-19-530573-9.
- Levine, Ira (2014). Kuantum Kimyası (7. baskı). Pearson Education. ISBN 978-0-321-80345-0.
- Griffiths, David (2000). Kuantum Mekaniğine Giriş (2 ed.). Benjamin Cummings. ISBN 978-0-13-111892-8.
- Cohen, Irwin; Bustard, Thomas (1966). "Atomic Orbitals: Limitations and Variations". J. Chem. Educ. 43 (4): 187. Bibcode:1966JChEd..43..187C. doi:10.1021/ed043p187.
Dış bağlantılar
- Guide to atomic orbitals
- Covalent Bonds and Molecular Structure
- Animation of the time evolution of an hydrogenic orbital
- The Orbitron, a visualization of all common and uncommon atomic orbitals, from 1s to 7g
- Grand table Still images of many orbitals





















































