Bamford-Stevens reaksiyonu - Bamford–Stevens reaction - Wikipedia
Bamford-Stevens reaksiyonu bir Kimyasal reaksiyon bu sayede tedavi tosilhidrazonlar güçlü baz ile verir alkenler.[1][2][3] İngiliz kimyager için seçildi William Randall Bamford ve İskoç kimyager Thomas Stevens Stevens (1900–2000). Kullanımı aprotik çözücüler ağırlıklı olarak Z- veriralkenler, süre protik çözücü E- ve Z-alkenlerin bir karışımını verir. Alken üreten bir dönüşüm olarak Bamford-Stevens reaksiyonu, sentetik metodolojide ve karmaşık molekül sentezinde geniş kullanıma sahiptir.

Tosilhidrazonların alkil lityum reaktifleri ile işlemine, Shapiro reaksiyonu.
Reaksiyon mekanizması
Bamford-Stevens reaksiyonunun ilk adımı, diazo bileşiğinin oluşmasıdır. 3.[4]

Protik çözücülerde, diazo bileşiği 3 ayrışır karbenyum iyonu 5.

Aprotik çözücülerde, diazo bileşiği 3 karbene ayrışır 7.

Yönetmen Bamford-Stevens reaksiyonu
Bamford-Stevens reaksiyonunun, alkenlerin stereoselektif oluşumu için yararlı olduğu kanıtlanmamıştır. termal ayrışma Karben merkezinin gelişigüzel 1,2-yeniden düzenlenmesinden dolayı metalize tosilhidrazonların bir karışımını verir. Bir alkil grubu, N-aziridiniliminler üzerinde bir trimetilsilil (TMS) grubu ile değiştirilerek, belirli bir hidrojen atomunun göçü artırılabilir. İle silikon beta atomu H, a σC-Si → σ*C-H stereoelektronik etki C-H bağını zayıflatır, bunun özel göçüne neden olur ve dialkil durumunda görülen ürünlerin karışımına veya diğer yerleştirme ürünlerine benzer şekilde eşit miktarlarda alilsilanlar ve izomerik homoalilsilanlar yerine neredeyse dışlayıcı alilsilan oluşumuna yol açar (yani siklopropanlar). Görmek beta-silikon etkisi.[5][6][7]
Arinlerden ve N-tosilhidrazonlardan 3-ikame edilmiş indazollerin sentezi
N-tosilhidrazonlar, çeşitli sentetik prosedürlerde kullanılabilir. Arynes ile kullanımları, önerilen iki yolla 3-ikameli indazolleri hazırlamak için kullanılmıştır. İlk adım, diazo bileşiklerinin hidrazonunun CsF kullanılarak deprotonasyonudur. Bu noktada, eşlenik bazı diazo bileşiğini vermek için ayrışabilir ve bir [3 + 2] dipolar siklokasyon ile Aryne ürünü vermek için veya bir [3 + 2] halka aynı zamanda nihai ürünü verecek olan arin ile. LiOtBu ve Cs gibi güçlü bazlar2CO3 bu kimyada sıklıkla kullanılmaktadır, CsF, o- (trimetilsilil) aril triflatlardan in situ arin oluşumunu kolaylaştırmak için kullanılmıştır. CsF'nin ayrıca N-tosilhidrazonu protonsuzlaştırmak için yeterince bazik olduğu da düşünülmüştür.[8][9]
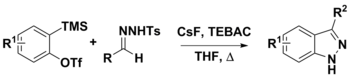
Nçapraz bağlanma reaksiyonları için reaktif olarak -tosilhidrazonlar
Barluenga ve meslektaşları, N-tosylhidrazon kullanımının ilk örneğini geliştirdiler. nükleofilik çapraz bağlanma reaksiyonlarında ortaklar. Tipik olarak, nükleofilik reaktifler eşleşme reaksiyonları olma eğiliminde organometalik çeşit, yani organomagnezyum, -zinc, -kalay, -silikon ve -boron. İle kombine elektrofilik aril halojenürler, N-tosilhidrazonlar, genellikle pahalı ve sentetik olarak talepkar organometalik reaktifler kullanılmadan, Pd-katalizli koşullar altında polisübstitüe edilmiş olefinleri hazırlamak için kullanılabilir.
Reaksiyonun kapsamı geniştir; Aldehitlerden ve ketonlardan türetilen N-tosilhidrazonlar iyi tolere edilir, bu da hem iki hem de üç ikameli olefinlere yol açar. Ayrıca, çeşitli aril halojenürler, hem elektron çeken hem de elektron veren grupları taşıyanların yanı sıra bakımından zengin ve π eksikliği olanlar da dahil olmak üzere birleştirme ortakları olarak iyi tolere edilir. aromatik heterosiklik bileşikler. Stereokimya, çoklu ikame edilmiş olefinler hazırlanırken dikkate alınması gereken önemli bir unsurdur. Doğrusal aldehitlerden türetilen hidrazonların kullanılması, yalnızca trans olefinlerle sonuçlanırken, üç ikame edilmiş olefinlerin stereokimyasal sonuçları ikame edicilerin boyutuna bağlıydı.

Bu dönüşümün mekanizmasının Bamford-Stevens reaksiyonu yoluyla alkenlerin sentezine benzer bir şekilde ilerlediği düşünülmektedir; Baz varlığında N-tosilhidrazonların ayrışması, daha sonra nitrojen gazı açığa çıkaran ve daha sonra bir elektrofil ile söndürülebilen bir karben veren diazo-bileşikler oluşturur. Bu durumda, birleştirme reaksiyonu, oksidatif ekleme aril halojenürün Pd'ye0 aril Pd'yi vermek için katalizörII karmaşık. Hidrazondan üretilen diazo bileşiğin Pd ile reaksiyonuII kompleks, bir Pd-karben kompleksi üretir. Bir göçmen ekleme aril grubu, bir alkil Pd kompleksi verir ve beta-hidrit eliminasyonu trans aril olefin üretmek ve Pd'yi yeniden oluşturmak için0 katalizör. Bu reaksiyon aynı zamanda, benzer Pd-katalizli reaksiyon koşulları altında ve aynı mekanizmayı takip ederek N-tosilhidrazonlardan ve terminal alkinlerden konjuge eninlerin hazırlanmasında da faydalı olduğunu görmüştür.

Dahası, Barluenga ve meslektaşları, aldehitlerin veya ketonların, tosilhidrazidlerin ve aril halojenürlerin tek hazneli üç bileşenli bir bağlanma reaksiyonu gösterdiler. N-tosilhidrazon yerinde oluşturulur. Bu işlem, önceden oluşturulmuş işlemle karşılaştırıldığında benzer verimlerde stereoselektif olefinler üretir. N-tosilhidrazonlar kullanılır.[10]
Barluenga ve çalışma arkadaşları ayrıca boronik asitlerle N-tosilhidrazonların metal içermeyen indirgeyici birleştirme metodolojisini geliştirdiler. Reaksiyon, aromatik, heteroaromatik, alifatik, elektron veren ve elektron çeken ikame ediciler dahil olmak üzere her iki substrat üzerinde çeşitli fonksiyonel grupları tolere eder ve potasyum karbonat varlığında yüksek verimle ilerler. Reaksiyonun, bir hidrazon tuzundan üretilen bir diazo bileşiğinin oluşumu yoluyla ilerlediği düşünülmektedir. Diazo bileşiği daha sonra boronik asit ile reaksiyona girerek bir boronat ara maddesi yoluyla benzilboronik asit üretebilir. Alternatif bir yol, benzilboronik asidin bir zwitteriyonik ara ürün yoluyla oluşumundan ve ardından protodeboronasyon bazik koşullar altında benzilboronik asidin son indirgeyici ürünü ile sonuçlanır.

Bu metodoloji, aynı zamanda, eter ve tiyoeter üretmek için heteroatom nükleofilleri de kapsayacak şekilde genişletilmiştir.[11][12]
Tandem rodyum katalizörlü Bamford-Stevens / termal alifatik Claisen yeniden düzenlemesi
Stoltz tarafından, Bamford-Stevens reaksiyonunun aşağıdakilerle birleştirildiği yeni bir süreç geliştirildi. Claisen yeniden düzenleme çeşitli olefin ürünleri üretmek için. Bu dönüşüm ilk önce diazo bileşiğini oluşturmak için N-aziridinilhidrazonların termal ayrışmasıyla devam eder (1), ardından rodyum aracılı de-diazotizasyon (2) ve syn 1,2-hidrit kayması (3). Bu substrat termal alifatiğe maruz kalır. Claisen yeniden düzenleme (4) ürünü vermek için.[13][14]

Toplam senteze uygulama
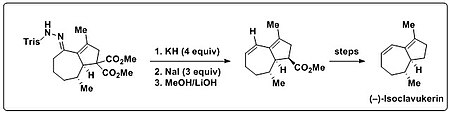
Trost vd. Bamford-Stevens reaksiyonunu kullandı. toplam sentez (-) - izoklavukerin bir Dien doğal üründe bulunan kısım. Bir bisiklik trisilhidrazon başlangıçta Shapiro reaksiyonu yalnızca tanımlanamayan bozunma ürünlerine yol açan koşullar (alkillityumlar veya LDA). Bu bisiklik trisilhidrazon güçlü baza (KH) ve ısıya maruz bırakıldığında, bununla birlikte istenen dien ürünü üretildi. Ayrıca olefin oluşumu ve sonrasının dekarboksilasyon tek bir tencerede yapılabilir. Bu amaçla, aşırı NaI eklenmiştir ve bunu kolaylaştırmak için sıcaklıkta bir yükselme ile birlikte Krapcho dekarboksilasyonu.[15][16]
Referanslar
- ^ Bamford, W. R .; Stevens, T. S. (1952). "924. Alkali ile toluen-p-sülfonilhidrazonların ayrışması". Kimya Derneği Dergisi: 4735. doi:10.1039 / JR9520004735.
- ^ Shapiro, R.H. (Mart 1976). "Tosylhidrazonlardan Alkenler". Organik Reaksiyonlar. 23. New York: Wiley. s. 405–507. ISBN 0-471-19624-X.
- ^ Adlington, R. M .; Barrett, A.G.M (1983). "Shapiro reaksiyonunun son uygulamaları". Kimyasal Araştırma Hesapları. 16 (2): 55. doi:10.1021 / ar00086a004.
- ^ Creary, X. (1986). "Tosilhidrazon tuzu pirolizleri: fenildiazometanlar". Organik Sentezler. 64: 207. doi:10.15227 / orgsyn.064.0207. (ayrıca Kolektif Cilt (1990) 7:438 (PDF))
- ^ Sarkar, T. (1992). "Β-Trimetilsilil N-aziridiniliminlerin silikona yönelik Bamford-Stevens reaksiyonu". J. Chem. Soc. Chem. Commun. (17): 1184–1185. doi:10.1039 / C39920001184.
- ^ Lambert, J. (1990). "Pozitif Yüklü Karbonlu Silikon ile Etkileşim". Tetrahedron. 46 (8): 2677–2689. doi:10.1016 / s0040-4020 (01) 88362-9.
- ^ Jorgensen, W. (1985). "Karbenium iyonları üzerindeki .beta.-silikon etkisinin büyüklüğü ve kaynağı". J. Am. Chem. Soc. 107 (6): 1496–1500. doi:10.1021 / ja00292a008.
- ^ Feng, S. (2011). "Arynes ve N-tosilhidrazonlardan 3-İkameli Indazollerin Sentezi". Org. Mektup. 13 (13): 3340–3343. doi:10.1021 / ol201086g. PMID 21630698.
- ^ Pellissier, H. (2002). "Organik sentezde arynlerin kullanımı". Tetrahedron. 59 (6): 701–730. doi:10.1016 / s0040-4020 (02) 01563-6.
- ^ Baruenga, J. (2007). "Çapraz Bağlanma Reaksiyonları için Reaktifler Olarak N-tosilhidrazonlar: Polysübstitüe Olefinlere Giden Yol". Angew. Chem. Int. Ed. 46 (29): 5587–5590. doi:10.1002 / anie.200701815. PMID 17577897.
- ^ Zhihui, S. (2012). "N-Tosilhidrazonlar: metal katalizli ve metal içermeyen çapraz bağlama reaksiyonları için çok yönlü reaktifler". Chem. Soc. Rev. 41 (2): 560–572. doi:10.1039 / c1cs15127d. PMID 21785803.
- ^ Barluenga, J. (2009). "Bornik asitler ve tosilhidrazonlar arasında metal içermeyen karbon-karbon bağı oluşturan indirgeyici bağlantı". Nat. Kimya. 1 (6): 494–499. Bibcode:2009 NatCh ... 1..494B. doi:10.1038 / nchem.328. PMID 21378917. S2CID 35892518.
- ^ Stoltz, B. (2002). "Sentezde Karbonil Stabilize Olmayan Metalokarbenoidler: Tandem Rodyum Katalizeli Bamford-Stevens / Termal Alifatik Claisen Yeniden Düzenleme Dizisinin Geliştirilmesi" (PDF). J. Am. Chem. Soc. 124 (42): 12426–12427. doi:10.1021 / ja028020j. PMID 12381180.
- ^ Wood, J. (1999). "A-Hidroksi Karbonil Bileşiklerinin Enantiyoselektif Sentezi için Rodyum Karbenoid Tarafından Başlatılan Claisen Yeniden Düzenlemesinin Geliştirilmesi". J. Am. Chem. Soc. 121 (8): 1748–1749. doi:10.1021 / ja983294l.
- ^ Trost, B.M. (1996). "Molekül İçi Pd-Katalizlenmiş TMM Siklokatisyonlarının Diastereoselektifliği Üzerine. Perhidroazulen (-) - izoklavukerin A'nın Asimetrik Bir Sentezi". J. Am. Chem. Soc. 118 (42): 10094–10105. doi:10.1021 / ja961561m.
- ^ Kurti, L .; Czako, B. (2005). Organik Sentezde İsimli Reaksiyonların Stratejik Uygulamaları. El Sevier. ISBN 978-0124297852.
