Dallanmış zincirli amino asit - Branched-chain amino acid
Bu makale daha fazlaya ihtiyacı var tıbbi referanslar için doğrulama veya çok fazla güveniyor birincil kaynaklar. (Kasım 2018) |
Bir dallanmış zincirli amino asit (BCAA) bir amino asit sahip olmak alifatik Yan zincir bir şubesi olan (bir merkezi karbon atom üç veya daha fazla karbon atomuna bağlıdır). Arasında proteinojenik amino asitler, üç BCAA vardır: lösin, izolösin, ve valin.[1] Proteinojenik olmayan BCAA'lar şunları içerir: 2-aminoizobütirik asit.
Üç proteinojenik BCAA, dokuz gerekli amino asitler insanlar için kas proteinlerindeki temel amino asitlerin% 35'ini ve memelilerin ihtiyaç duyduğu önceden oluşturulmuş amino asitlerin% 40'ını oluşturur.[2] BCAA'lar için sentez, bitkilerin tüm lokasyonlarında, plastitler metabolik yoldaki enzimleri kodlayan mRNA'ların varlığı ile belirlendiği üzere hücrenin[3]
BCAA'lar çeşitli metabolik ve fizyolojik rolleri yerine getirir. BCAA'lar metabolik olarak protein sentezini ve dönüşümünü, sinyal yollarını ve glikoz metabolizmasını destekler.[4][5] BCAA'ların oksidasyonu, yağ asidi oksidasyonunu artırabilir ve obezitede rol oynayabilir. Fizyolojik olarak BCAA'lar bağışıklık sisteminde ve beyin fonksiyonunda rol alır. BCAA'lar, bağışıklık hücreleri tarafından ifade edilen dehidrojenaz ve dekarboksilaz enzimleri tarafından etkin bir şekilde parçalanır ve lenfosit büyümesi ve çoğalması ve sitotoksik T lenfosit aktivitesi için gereklidir.[4] Son olarak, BCAA'lar beyinde aromatik amino asitlerle (Trp, Tyr ve Phe) aynı taşıma proteinini paylaşır. BCAA'lar beyinde bir kez protein sentezinde, nörotransmiterlerin sentezinde ve enerji üretiminde rol oynayabilir.[4]
Gereksinimler
ABD Tıp Enstitüsünün Gıda ve Beslenme Kurulu (FNB) aşağıdakiler için Önerilen Diyet Ödeneklerini (RDA'lar) belirledi: gerekli amino asitler 2002 yılında. Lösin için, 19 yaş ve üzeri yetişkinler için, 42 mg / kg vücut ağırlığı / gün; izolösin için 19 mg / kg vücut ağırlığı / gün; valin için 24 mg / kg vücut ağırlığı / gün.[6] 70 kg (154 lb) bir kişi için bu, 2,9, 1,3 ve 1,7 g / gün'e eşittir. Toplam protein için RDA'yı karşılayan veya aşan diyetler (0.8 g / kg / gün; 70 kg bir kişi için 56 gram), dallı zincirli amino asitler için BKA'ları karşılar veya aşar.
Araştırma
Diyetle ilgili BCAA'lar, bazı vakaları tedavi etmek için kullanılmıştır. hepatik ensefalopati.[7] Hepatik ensefalofatinin semptomlarını hafifletme etkisine sahip olabilirler, ancak daha fazla araştırma yapılması gerektiğinden ölüm oranlarına, beslenmeye veya genel yaşam kalitesine fayda sağladıklarına dair hiçbir kanıt yoktur.[8]
Bazı çalışmalar, yüksek insidans arasında olası bir bağlantı önermektedir. Amyotrofik Lateral skleroz (ALS) profesyonel Amerikan futbolcuları ve İtalyan futbolcular arasında ve BCAA'lar dahil belirli spor takviyeleri.[9] Fare çalışmalarında, BCAA'ların, genellikle ALS hastalarında gözlemlenene benzeyen hücre aşırı uyarılabilirliğine neden olduğu gösterilmiştir. Önerilen altta yatan mekanizma, hücre aşırı uyarılabilirliğinin hücre tarafından kalsiyum emiliminin artmasıyla sonuçlanması ve dolayısıyla özellikle düşük kalsiyum tamponlama yeteneklerine sahip nöronal hücrelerin hücre ölümüne yol açmasıdır.[9]Yine de BCAA'lar ile ALS arasındaki herhangi bir bağlantı tam olarak kurulmamıştır. BCAA'lar, ALS'li farelerde gözlemlenene benzer bir aşırı uyarılmayı tetikleyebilse de, mevcut çalışma, uzun bir süre boyunca verilen BCAA ile zenginleştirilmiş bir diyetin aslında ALS benzeri semptomları indükleyip tetiklemediğini göstermemektedir.[9]
BCAA'ların kan seviyeleri obez, insüline dirençli insanlarda ve diyetle indüklenen diyabetin fare ve sıçan modellerinde yükselmiştir, bu da BCAA'ların obezite ve diyabet patogenezine katkıda bulunma olasılığını düşündürmektedir.[10][11] BCAA ile sınırlı diyetler, glikoz toleransını iyileştirir ve normal kilolu farelerde zayıflığı artırır,[12] obez farelere insülin duyarlılığını ve normal vücut ağırlığını geri kazandırır[13] ve obez farelerde insülin duyarlılığını arttırır.[14]
Sentez
Beş enzim, izolösin, valin ve lösin için paralel sentez yollarında önemli bir rol oynar: treonin dehidrojenaz, asetohidroksiasit sentaz, ketoasit redüktoizomeraz, dihidroksiasit dehidrojenaz ve aminotransferaz.[3] Treonin dehidrojenaz, treoninin 2-ketobutirat ve amonyağa deaminasyonunu ve dehidrasyonunu katalize eder. İzolösin, treonin dehidrojenaz ile negatif bir geri besleme döngüsü oluşturur. Asetohidroksiasit sentaz, her iki adımda da yoğunlaşma reaksiyonu gerçekleştiren paralel yol için ilk enzimdir - valin yolunda piruvatın asetoasetata yoğunlaşması ve piruvat ile 2-ketobutiratın yoğunlaşması, izolösin yolunda asetohidroksibtilrat oluşturmak için. Sonraki ketoasit redüktizomeraz, hem valin hem de izolösin yollarında dihidroksiasitler elde etmek için önceki adımdaki asetohidroksi asitleri azaltır. Dihidroksiasit dehidrojenaz, bir sonraki adımda dihirroksiasitleri dönüştürür. Paralel yoldaki son adım, valin ve izolösin nihai ürünlerini veren amino transferaz tarafından yürütülür.[3] 2-oksolsovalerattan lösin oluşumu için bir dizi dört enzim daha - izopropilmalat sentaz, izopropilmalat izomeraz, izopropilmalat dehidrojenaz ve aminotransferaz - gereklidir.[3]
Bozulma
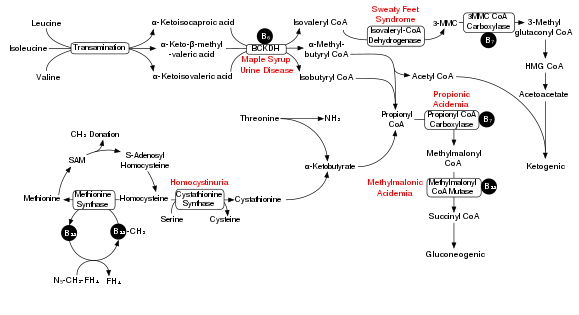
Dallı zincirli amino asitlerin bozunması, dallı zincirli alfa-keto asit dehidrojenaz kompleksi (BCKDH). Bu kompleksin bir eksikliği, dallı zincirli amino asitlerin (lösin, izolösin, ve valin ) ve bunların kandaki ve idrardaki toksik yan ürünleri, duruma adını verir akçaağaç şurubu idrar hastalığı.
BCKDH kompleksi, dallı zincirli amino asitleri açil-CoA sonraki reaksiyonlardan sonra ya dönüştürülen türevler asetil-CoA veya süksinil-CoA giren sitrik asit döngüsü.[15]
İlgili enzimler dallı zincirli aminotransferaz ve 3-metil-2-oksobutanoat dehidrojenaz.
Telefon sinyali
Çoğu amino asit karaciğerde oksitlenirken, BCAA'lar öncelikle iskelet kası ve diğer çevresel dokular.[4] BCAA uygulamasının sıçan diyaframındaki kas büyümesi üzerindeki etkileri test edildi ve BCAA'lardan oluşan bir karışımın büyüme üzerinde tam bir amino asit karışımı ile aynı etkiye sahip olduğu, aynı zamanda BCAA'ların tümü ile bir amino asit karışımının sıçan diyafram kas büyümesi üzerindeki etkisi.[16] Tek başına izolösin veya valin uygulamasının kas büyümesi üzerinde hiçbir etkisi olmamıştır, ancak tek başına lösin uygulaması, BCAA'ların tam karışımı kadar etkili görünmektedir. Lösin dolaylı olarak aktive eder p70 S6 kinaz yanı sıra montajını teşvik eder eIF4F kompleksi, çeviri başlangıcında mRNA bağlanması için gerekli olan.[16] P70 S6 kinaz, rapamisin kompleksinin memeli hedefi (mTOR) sinyal yoludur ve adaptif hipertrofiye ve sıçan kasının iyileşmesine izin verdiği gösterilmiştir.[17] Dinlenme anında protein infüzyonu, infüzyonun başlamasından 30 dakika sonra protein sentezini uyarır ve protein sentezi 90 dakika daha yüksek kalır.[18] Dinlenme sırasında lösin infüzyonu, altı saatlik bir uyarıcı etki ve iskelet kaslarında p70 S6 kinazın fosforilasyonuyla protein sentezini arttırır.[18] Direnç egzersizini takiben, BCAA uygulaması olmadan, bir direnç egzersiz seansı mTOR fosforilasyonunu etkilemez ve hatta Akt fosforilasyonunda bir azalma üretir. P70 S6 kinazın bir miktar fosforilasyonu keşfedildi. BCAA'lar bir eğitim seansının ardından uygulandığında, p70 S6 kinaz ve S6'nın yeterli fosforilasyonu, sinyalleme kaskadının aktivasyonunu gösterdi.[18]
Tip 2 diabetes mellitus'taki rolü
Hücre sinyallemesine ek olarak, mTOR yolu ayrıca beta hücre büyümesinde rol oynar ve insülin salgı.[19] Kandaki yüksek glikoz, lösinin dolaylı bir rol oynadığı mTOR sinyal yolunun sürecini başlatır.[17][20] Glikoz, lösin ve diğer aktivatörlerin kombinasyonu, mTOR'un beta hücrelerinin çoğalması ve insülin salgılanması için sinyal vermeye başlamasına neden olur. Daha yüksek lösin konsantrasyonları, mTOR yolunda hiperaktiviteye neden olur ve S6 kinaz aktive edilerek, serin fosforilasyon yoluyla insülin reseptörü substratının inhibisyonuna yol açar.[19][20] Hücrede mTOR kompleksinin artmış aktivitesi, beta hücrelerinin sonunda insülin salgılamasına neden olur ve S6 kinazın inhibe edici etkisi, hücrelerde insülin direncine yol açarak, 2 tip diyabet.[19]
Metformin, mTOR yolunda yer alan proteinleri fosforile eden AMP kinazı aktive edebilir ve mTOR kompleksinin inaktif durumundan aktif durumuna ilerlemesine yol açar.[19] Metforminin, mTOR yolağında amino asit lösine karşı yarışmalı bir inhibitör olarak hareket ettiği öne sürülmektedir.
BCAA takviyesinin egzersiz üzerindeki etkileri
BCAA'ların insülin benzeri bir etkisi vardır. glikoz, glikoz seviyelerinde bir azalmaya neden olur. Egzersizden önce yutulan BCAA'lar tarafından okside edilebilir. iskelet kası egzersiz sırasında enerji olarak kullanılır, karaciğer seviyelerini artırmak glikojenoliz. Anaerobik egzersiz sırasında piruvat glikoz metabolizmasından kaynaklanan moleküller, laktik asit birikmesi neden olabilir metabolik asidoz 6.4 kadar düşük pH seviyeleri ile.[21] Yüksek laktik asit seviyeleri, pH'ın daha da düşürülmesi için glikoz metabolizmasının durmasına neden olur. BCAA takviyesinin kastaki laktik asit seviyelerini düşürdüğü ve glikoz metabolizmasının devam etmesine izin verdiği gösterilmiştir.[22] Bu, karaciğerde düşük glikojenoliz oranlarına ve sonuç olarak daha düşük plazma glikoz seviyelerine neden olur. Bununla birlikte, BCAA'ların glukoz seviyeleri üzerindeki uzun vadeli etkileri ile ilgili yapılan çalışmalar, BCAA'ların tutarlı takviyesinin egzersiz dışında kan şekeri seviyeleri üzerinde dikkate değer bir etkiye sahip olmadığını göstermiştir.[22]
Yakın zamanda yapılan çalışmalar, BCAA'ların dolaşımdaki seviyeleri düşürdüğünü de göstermiştir. serbest yağ asitleri (FFA) kanda.[22] FFA'lar bağlanma siteleri için rekabet eder albümin ile triptofan ve kandaki SYA seviyeleri azaldığında, albümine daha fazla bağlandıkça serbest triptofan seviyeleri de azalır. Egzersiz sırasında beyne giren serbest triptofan seviyeleri artar ve bu da artışa neden olur. 5-hidroksitriptamin (5-HT), yorgunluk hissine katkıda bulunur. BCAA'lar, kandaki FFA düzeylerindeki azalmalar sayesinde beyne giren serbest triptofan düzeylerini azaltmaya yardımcı olabilir ve eforun bir sonucu olarak yorgunluk hissini azaltmaya yardımcı olabilir.[23]
BCAA'ların ayrıca serum seviyelerindeki artışı azalttığı bulunmuştur. amonyak egzersiz sırasında ortaya çıkar. Bu, kullanılan amonyak miktarını artırarak yapılır. glutamin sentez, kanda aşırı amonyak birikmesini önler.[22] Beyindeki artan amonyak seviyeleri, daha düşük seviyelerde GABA ve glutamat artışa neden oluyor merkezi yorgunluk. Kas dokusunda artan amonyak seviyeleri de artar fosfofruktokinaz Aktivite (PFK), kas yorgunluğuna önemli bir katkıda bulunan laktik asitte artışa yol açar.[24]
Ek olarak, BCAA takviyesinin kreatin kinaz kas hücrelerinde egzersiz sonrası. Kreatin kinaz, kas hasarının bir göstergesidir ve bir fosfat grubunun transferinden sorumludur. ATP Oluşturmak için fosfokreatin molekül.[25] BCAA takviyesinin, Kreatin kinaz düzeylerini düşürdüğü, daha yüksek hücre içi ATP seviyelerine ve daha az yorgunluk hissine yol açtığı gösterilmiştir.[26] Ayrıca bakınız DOMS.
Ayrıca bakınız
Referanslar
- ^ Ekiciler S. "Dallanmış Zincirli Amino Asitler Üzerine Bir Astar" (PDF). Huntington Sağlık Bilimleri Koleji. Alındı 22 Mart 2011.
- ^ Shimomura Y, Murakami T, Nakai N, Nagasaki M, Harris RA (Haziran 2004). "Egzersiz BCAA katabolizmasını teşvik eder: BCAA takviyesinin egzersiz sırasında iskelet kası üzerindeki etkileri". Beslenme Dergisi. 134 (6 Ek): 1583S - 1587S. doi:10.1093 / jn / 134.6.1583S. PMID 15173434.
- ^ a b c d Singh BK, Shaner DL (Temmuz 1995). "Dallanmış Zincirli Amino Asitlerin Biyosentezi: Test Tüpünden Sahaya". Bitki Hücresi. 7 (7): 935–944. doi:10.1105 / tpc.7.7.935. PMC 160890. PMID 12242394.
- ^ a b c d Monirujjaman M (2014). "Dallanmış Zincirli Amino Asitlerin Metabolik ve Fizyolojik Rolleri". Moleküler Biyolojideki Gelişmeler. 2014: 1–6. doi:10.1155/2014/364976.
- ^ Babchia N, Calipel A, Mouriaux F, Faussat AM, Mascarelli F (Ocak 2010). "İnsan uveal melanom hücrelerinde PI3K / Akt ve mTOR / P70S6K sinyal yolları: B-Raf / ERK ile etkileşim". Araştırmacı Oftalmoloji ve Görsel Bilimler. 51 (1): 421–9. doi:10.1167 / iovs.09-3974. PMID 19661225.
- ^ ilaç Enstitüsü (2002). "Protein ve Amino Asitler". Enerji, Karbonhidratlar, Lif, Yağ, Yağ Asitleri, Kolesterol, Protein ve Amino Asitler için Diyet Referans Alımları. Washington, DC: Ulusal Akademiler Basın. s. 589–768.
- ^ Chadalavada R, Sappati Biyyani RS, Maxwell J, Mullen K (Haziran 2010). "Hepatik ensefalopatide beslenme". Klinik Uygulamada Beslenme. 25 (3): 257–64. doi:10.1177/0884533610368712. PMID 20581319.
- ^ Gluud, Lise Lotte; Dam, Gitte; Les, Iñigo; Marchesini, Giulio; Borre, Mette; Aagaard, Niels Kristian; Vilstrup, Hendrik (18 Mayıs 2017). "Hepatik ensefalopatili insanlar için dallı zincirli amino asitler". Sistematik İncelemelerin Cochrane Veritabanı. 5: CD001939. doi:10.1002 / 14651858.cd001939.pub4. ISSN 1465-1858. PMC 6481897. PMID 28518283.
- ^ a b c Manuel M, Heckman CJ (Mart 2011). "Daha güçlü olmak her zaman daha iyi değildir: bir vücut geliştirme besin takviyesi ALS'ye yol açabilir mi?". Deneysel Nöroloji. 228 (1): 5–8. doi:10.1016 / j.expneurol.2010.12.007. PMC 3049458. PMID 21167830.
- ^ Lynch CJ, Adams SH (Aralık 2014). "Metabolik sinyal ve insülin direncinde dallı zincirli amino asitler". Doğa Yorumları. Endokrinoloji. 10 (12): 723–36. doi:10.1038 / nrendo.2014.171. PMC 4424797. PMID 25287287.
- ^ Newgard CB, An J, Bain JR, Muehlbauer MJ, Stevens RD, Lien LF, Haqq AM, Shah SH, Arlotto M, Slentz CA, Rochon J, Gallup D, Ilkayeva O, Wenner BR, Yancy WS, Eisenson H, Musante G , Surwit RS, Millington DS, Butler MD, Svetkey LP (Nisan 2009). "Obez ve zayıf insanları ayıran ve insülin direncine katkıda bulunan dallı zincirli amino asitle ilişkili metabolik imza". Hücre Metabolizması. 9 (4): 311–26. doi:10.1016 / j.cmet.2009.02.002. PMC 3640280. PMID 19356713.
- ^ Fontana L, Cummings NE, Arriola Apelo SI, Neuman JC, Kasza I, Schmidt BA, Cava E, Spelta F, Tosti V, Syed FA, Baar EL, Veronese N, Cottrell SE, Fenske RJ, Bertozzi B, Brar HK, Pietka T, Bullock AD, Figenshau RS, Andriole GL, Merrins MJ, Alexander CM, Kimple ME, Lamming DW (Temmuz 2016). "Dallanmış Zincirli Amino Asit Tüketiminin Azalması Metabolik Sağlığı İyileştirir". Hücre Raporları. 16 (2): 520–530. doi:10.1016 / j.celrep.2016.05.092. PMC 4947548. PMID 27346343.
- ^ Cummings NE, Williams EM, Kasza I, Konon EN, Schaid MD, Schmidt BA, Poudel C, Sherman DS, Yu D, Arriola Apelo SI, Cottrell SE, Geiger G, Barnes ME, Wisinski JA, Fenske RJ, Matkowskyj KA, Kimple ME, Alexander CM, Merrins MJ, Lamming DW (Aralık 2017). "Dallı zincirli amino asitlerin tüketiminin azalmasıyla metabolik sağlığın restorasyonu". Fizyoloji Dergisi. 596 (4): 623–645. doi:10.1113 / JP275075. PMC 5813603. PMID 29266268.
- ^ White PJ, Lapworth AL, An J, Wang L, McGarrah RW, Stevens RD, Ilkayeva O, George T, Muehlbauer MJ, Bain JR, Trimmer JK, Brosnan MJ, Rolph TP, Newgard CB (Temmuz 2016). "Zucker yağlı sıçanlarda dallı zincirli amino asit kısıtlaması, yağ asidi oksidasyonunun ve açil-glisin ihracatının etkinliğini artırarak kas insülin duyarlılığını artırır". Moleküler Metabolizma. 5 (7): 538–51. doi:10.1016 / j.molmet.2016.04.006. PMC 4921791. PMID 27408778.
- ^ Sears DD, Hsiao G, Hsiao A, Yu JG, Courtney CH, Ofrecio JM, Chapman J, Subramaniam S (Kasım 2009). "İnsan insülin direnci mekanizmaları ve tiyazolidindiyon aracılı insülin duyarlılığı". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 106 (44): 18745–50. doi:10.1073 / pnas.0903032106. PMC 2763882. PMID 19841271.
- ^ a b Kimball SR, Jefferson LS (Ocak 2006). "Dallı zincirli amino asitlerin protein sentezinin çeviri kontrolüne aracılık ettiği sinyal yolları ve moleküler mekanizmalar". Beslenme Dergisi. 136 (1 Ek): 227S – 31S. doi:10.1093 / jn / 136.1.227S. PMID 16365087.
- ^ a b Bodine SC, Stitt TN, Gonzalez M, Kline WO, Stover GL, Bauerlein R, Zlotchenko E, Scrimgeour A, Lawrence JC, Glass DJ, Yancopoulos GD (Kasım 2001). "Akt / mTOR yolu, iskelet kası hipertrofisinin önemli bir düzenleyicisidir ve in vivo kas atrofisini önleyebilir". Doğa Hücre Biyolojisi. 3 (11): 1014–9. doi:10.1038 / ncb1101-1014. PMID 11715023. S2CID 16284975.
- ^ a b c Blomstrand E, Eliasson J, Karlsson HK, Köhnke R (Ocak 2006). "Dallı zincirli amino asitler, fiziksel egzersizden sonra protein sentezinde anahtar enzimleri etkinleştirir". Beslenme Dergisi. 136 (1 Ek): 269S – 73S. doi:10.1093 / jn / 136.1.269S. PMID 16365096.
- ^ a b c d Melnik BC (Mart 2012). "Tip 2 diyabet ve obezite patogenezinde lösin sinyali". Dünya Diyabet Dergisi. 3 (3): 38–53. doi:10.4239 / WJD.v3.i3.38. PMC 3310004. PMID 22442749.
- ^ a b Balcazar Morales N, Aguilar de Plata C (Temmuz 2012). "AKT / mTORC1 yolunun pankreas β hücre proliferasyonundaki rolü". Kolombiya Medica. 43 (3): 235–43. doi:10,25100 / cm.v43i3.783. PMC 4001958. PMID 24893199.
- ^ Sahlin, Kent (1986). "Kas yorgunluğu ve laktik asit birikimi". Acta Physiologica Scandinavica Supplementum. 556: 83–91. PMID 3471061.
- ^ a b c d Hormoznejad, Razie; Zare Javid, Ahmad; Mansoori, Anahita (Ağustos 2019). "Kayıt Başlığı: BCAA takviyesinin egzersize merkezi yorgunluk, enerji metabolizması substratı ve kas hasarı üzerindeki etkisi: meta-analiz ile sistematik bir inceleme". Sağlık için Spor Bilimleri. 15 (2): 265–279. doi:10.1007 / s11332-019-00542-4. S2CID 78093727.
- ^ Watson, Phillip; Shirreffs, Susan M .; Maughan, Ronald J. (Aralık 2004). "Akut dallı zincirli amino asit desteğinin sıcak bir ortamda uzun süreli egzersiz kapasitesi üzerindeki etkisi". Avrupa Uygulamalı Fizyoloji Dergisi. 93 (3): 306–314. doi:10.1007 / s00421-004-1206-2. PMID 15349784. S2CID 20597074.
- ^ Mutch, B. J. C .; Banister, E.W. (1983). "Egzersiz ve yorgunlukta amonyak metabolizması: bir inceleme". Spor ve Egzersizde Tıp ve Bilim. 15 (1983): 41–50. doi:10.1249/00005768-198315010-00009. PMID 6341752.
- ^ Maughan, RJ; Gleeson, M (2010). Spor performansının biyokimyasal temeli (2 ed.). Oxford University Press. sayfa 81–82. ISBN 978-0-19-920828-9. Erişim tarihi: 12/06/2019. Tarih değerlerini kontrol edin:
| erişim tarihi =(Yardım) - ^ Mohammad Hossein, Rahimi; Shab-Bidar, Sakineh; Mollahosseini, Mehdi; Djafarian, Kurosh (Ekim 2017). "Egzersizden kurtulmada dallı zincirli amino asit takviyesi ve egzersize bağlı kas hasarı: Randomize klinik çalışmaların bir meta-analizi". Beslenme. 42: 30–36. doi:10.1016 / j.nut.2017.05.005. PMID 28870476.
Dış bağlantılar
- Dallı zincirli + amino + asitler ABD Ulusal Tıp Kütüphanesinde Tıbbi Konu Başlıkları (MeSH)
- Dallı zincirli amino asit bozunma yolu
- Mayada sentezik yol (WikiPathways)