CRISPR gen düzenleme - CRISPR gene editing
CRISPR gen düzenleme bir genetik mühendisliği teknik moleküler Biyoloji hangi tarafından genomlar canlı organizmaların% 'si değiştirilebilir. Bakterinin basitleştirilmiş bir versiyonuna dayanmaktadır. CRISPR -Cas9 antiviral savunma sistemi. Cas9'u teslim ederek nükleaz sentetik ile kompleks kılavuz RNA (gRNA) bir hücreye yerleştirildiğinde, hücrenin genomu istenen bir konumda kesilebilir ve mevcut genlerin çıkarılmasına ve / veya yenilerinin eklenmesine izin verir. in vivo (canlı organizmalarda).[1]
Teknik, genomların düzenlenmesine izin verdiği için biyoteknoloji ve tıpta oldukça önemli kabul edilir. in vivo son derece yüksek hassasiyetle, ucuza ve kolaylıkla. Yeni ilaçların, tarım ürünlerinin ve tarımsal ürünlerin oluşturulmasında kullanılabilir. genetiği değiştirilmiş Organizmalar veya patojenleri ve zararlıları kontrol etmenin bir yolu olarak. Ayrıca kalıtsalların tedavisinde de imkanları vardır. genetik hastalıklar yanı sıra ortaya çıkan hastalıklar somatik mutasyonlar kanser gibi. Ancak, kullanımı insan germ hattı genetik modifikasyonu oldukça tartışmalı. Kazanılan tekniğin gelişimi Jennifer Doudna ve Emmanuelle Charpentier Nobel Kimya Ödülü 2020 yılında.[2] Paylaşan üçüncü araştırmacı grubu Kavli Ödülü aynı keşif için[3] (liderliğinde Virginijus Šikšnys ) Nobel ödülüne layık görülmedi.[4][5]
Özet
Genetik makas gibi çalışan Cas9 nükleaz, hedeflenen dizinin her iki dizisini de açar. DNA iki yöntemden biriyle değişikliği tanıtmak. Knock-in mutasyonlar, aracılığıyla kolaylaştırılır homoloji odaklı onarım (HDR), hedeflenen genomik düzenleme yaklaşımlarının geleneksel yoludur.[6] Bu, hedeflenen DNA hasarı ve onarımı. HDR, onarım şablonu olarak işlev görmesi için eksojen DNA'nın dahil edilmesi yoluyla kırılmanın onarımını sağlamak için benzer DNA dizilerinin kullanımını kullanır.[6] Bu yöntem, onarımın başlaması için hedef bölgede periyodik ve izole edilmiş DNA hasarına dayanır. CRISPR-Cas9'un neden olduğu knock-out mutasyonları, çift sarmallı kırılmanın, homolog olmayan uç birleştirme (NHEJ). NHEJ genellikle onarım bölgesinde rasgele delesyonlara veya insersiyonlara neden olabilir ve bu da gen işlevselliğini bozabilir veya değiştirebilir. Bu nedenle, CRISPR-Cas9'un genom mühendisliği, araştırmacılara hedeflenen rastgele gen bozulması üretme yeteneği verir. Bu nedenle, genom düzenlemenin hassasiyeti büyük bir endişe kaynağıdır. Genomik düzenleme, genomda geri dönüşü olmayan değişikliklere yol açar.
Süre genom düzenleme Ökaryotik hücrelerde 1980'lerden beri çeşitli yöntemler kullanılarak mümkün olmuştur, kullanılan yöntemlerin büyük ölçekte uygulanmasının yetersiz ve pratik olmadığı kanıtlanmıştır. CRISPR'nin ve özellikle Cas9 nükleaz molekülünün keşfedilmesiyle, verimli ve son derece seçici düzenleme artık bir gerçek. Bakteriyel türlerden elde edilen Cas9 Streptococcus pyogenes CrRNA ve tracrRNA kılavuz şeritleri tarafından belirlenen belirli bir konumda hedeflenen bir kırılma oluşturmanın güvenilir bir yöntemine izin vererek ökaryotik hücrelerde hedeflenen genomik modifikasyonu kolaylaştırmıştır.[7] Araştırmacıların Cas9 ve şablon RNA ekleyebilme kolaylığı Sessizlik veya neden nokta mutasyonları spesifik olarak lokus hızlı ve verimli olmak için çok değerli olduğunu kanıtladı haritalama çeşitli ökaryotlarda çeşitli genlerle ilişkili genomik modeller ve biyolojik süreçler. Cas9 nükleazının yeni tasarlanmış varyantları, hedef dışı etkinliği önemli ölçüde azaltan geliştirilmiştir.[8]
CRISPR-Cas9 genom düzenleme teknikleri, tıp ve tarım dahil olmak üzere birçok potansiyel uygulamaya sahiptir. CRISPR-Cas9-gRNA kompleksinin genom düzenleme için kullanımı[9] oldu AAAS için seçim Yılın Atılımı 2015 yılında.[10] Birçok biyoetik CRISPR'ı kullanma olasılığı hakkında endişeler dile getirildi. germ hattı özellikle insan embriyolarında düzenleme.[11]
Tarih
Öncekiler
2000'lerin başında, araştırmacılar çinko parmak nükleazları (ZFN'ler), sentetik proteinler DNA bağlayıcı alanlar DNA'da belirli noktalarda çift sarmallı kırılmalar oluşturmalarını sağlar. 2010 yılında sentetik nükleazlar transkripsiyon aktivatör benzeri efektör nükleazlar (TALEN'ler), çift sarmallı bir kopuşu DNA sarmalı üzerindeki belirli bir konuma hedeflemenin daha kolay bir yolunu sağladı. Hem çinko parmak nükleazları hem de TALEN'ler, her bir hedeflenen DNA dizisi için özel bir proteinin tasarlanmasını ve oluşturulmasını gerektirir; bu, kılavuz RNA'ları tasarlamaktan çok daha zor ve zaman alan bir süreçtir. CRISPR'lerin tasarlanması çok daha kolaydır, çünkü proses yalnızca kısa bir RNA sekansının sentezlenmesini gerektirir, bu prosedür, diğer birçok moleküler biyoloji tekniği için zaten yaygın olarak kullanılmaktadır (örn. oligonükleotid primerler ).[12]
Gibi yöntemler ise RNA interferansı (RNAi) gen fonksiyonunu tam olarak bastırmaz, CRISPR, ZFN'ler, ve TALEN'ler tam geri dönüşü olmayan sağlamak gen nakavt.[13] CRISPR, basitçe farklı gRNA'lar ekleyerek birkaç DNA bölgesini aynı anda hedefleyebilir. Ek olarak, CRISPR kullanmanın maliyeti nispeten düşüktür.[13][14][15]
Keşif
2012 yılında Jennifer Doudna ve Emmanuelle Charpentier CRISPR-Cas9 şimdi en önemli keşiflerden biri olarak kabul edilen genomik DNA'yı düzenlemek için RNA ile programlanabilir. biyoloji tarihi.[16]
Patentler ve ticarileştirme
Kasım 2013 itibariyle[Güncelleme], SAGE Labs ( Horizon Keşfi grup) vardı özel haklar Bu şirketlerden birinden genetiği değiştirilmiş fareler üretmek ve satmak ve fare ve tavşan modelleri için münhasır olmayan haklar.[17] 2015'e kadar[Güncelleme], Thermo Fisher Scientific CRISPR reaktif kitleri geliştirmek için ToolGen'den lisanslı fikri mülkiyete sahipti.[18]
Aralık 2014 itibariyle[Güncelleme], patent hakları CRISPR'a itiraz edildi. İlgili ilaçları ve araştırma araçlarını geliştirmek için birkaç şirket kuruldu.[19] Şirketler finansmanı artırdıkça, CRISPR'nin hızla para kazanıp kazanamayacağına dair şüpheler arttı.[20] Şubat 2017'de ABD Patent Ofisi, patent müdahalesi Kaliforniya Üniversitesi tarafından verilen patentler ile ilgili dava Geniş Enstitüsü ve ökaryotik hücrelerde CRISPR-Cas9'un uygulanmasını kapsayan iddialara sahip Broad patentlerinin, California Üniversitesi tarafından iddia edilen buluşlardan farklı olduğunu buldu.[21][22][23]Kısa bir süre sonra, Kaliforniya Üniversitesi bu karara itiraz etti.[24][25]
Son olaylar
Mart 2017'de, Avrupa Patent Ofisi (EPO), her tür hücrenin Berlin'deki Max-Planck Enstitüsü, Kaliforniya Üniversitesi ve Viyana Üniversitesi'nde düzenlenmesine yönelik geniş taleplere izin verme niyetini açıkladı.[26][27] ve Ağustos 2017'de EPO, MilliporeSigma'nın sunduğu bir patent başvurusunda CRISPR taleplerine izin verme niyetini açıkladı.[26] Ağustos 2017 itibarıyla[Güncelleme] Avrupa'daki patent durumu karmaşıktı; MilliporeSigma, ToolGen, Vilnius Üniversitesi ve Harvard, Kaliforniya Üniversitesi ve Broad ile birlikte iddialar için mücadele ediyordu.[28]
Temmuz 2018'de ECJ buna karar verdi gen düzenleme bitkiler için bir alt kategoriydi GDO gıdalar ve bu nedenle CRISPR tekniğinin bundan sonra Avrupa Birliği kuralları ve yönetmelikleri ile GDO'lar.[29]
Şubat 2020'de, bir ABD denemesi, üç kanser hastasında CRISPR gen düzenlemesini güvenli bir şekilde gösterdi.[30]
Ekim 2020'de, araştırmacılar Emmanuelle Charpentier ve Jennifer Doudna, bu alandaki çalışmaları nedeniyle Nobel Kimya Ödülü'ne layık görüldü. [31]
Genom mühendisliği

CRISPR-Cas9 genom düzenlemesi, bir Tip II CRISPR sistemi. Genom düzenleme için kullanıldığında, bu sistem şunları içerir: Cas9, crRNA ve tracrRNA, her ikisinde de kullanılan isteğe bağlı bir DNA onarım şablonu bölümü ile birlikte homolog olmayan uç birleştirme (NHEJ) veya homoloji odaklı onarım (HDR).

Başlıca bileşenler
| Bileşen | Fonksiyon |
|---|---|
| crRNA | Bağlanan bir bölge ile birlikte konakçı DNA'nın doğru segmentini bulan kılavuz RNA'yı içerir. tracrRNA (genellikle bir firkete döngü form), aktif bir kompleks oluşturan. |
| tracrRNA | Bağlanır crRNA ve aktif bir kompleks oluşturur. |
| sgRNA | Tek kılavuzlu RNA'lar, aşağıdakilerden oluşan birleşik bir RNA'dır: tracrRNA ve en az bir crRNA. |
| Cas9 | Aktif formu DNA'yı değiştirebilen bir enzim. Her enzimin DNA bölgesi tanıma işlevi nedeniyle farklı işlevlere sahip birçok varyant (yani tek sarmallı kesme, çift sarmal kırma, DNA bağlanması) mevcuttur. |
| Onarım şablonu | Cas9 tarafından kırılan konakçı segmente spesifik bir DNA sekansının eklenmesine izin veren, konakçı hücrenin DNA onarım sürecinde bir şablon olarak kullanılan DNA molekülü. |
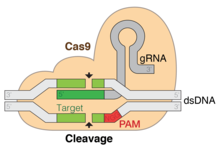
CRISPR-Cas9 genellikle bir plazmid -e transfect hedef hücreler.[32] Bu plazmidin ana bileşenleri resimde gösterilmiş ve tabloda listelenmiştir. CrRNA, Cas9'un konakçı hücrenin DNA'sındaki spesifik dizileri tanımlamak ve bunlara doğrudan bağlanmak için kullandığı sekans olduğundan, her uygulama için benzersiz bir şekilde tasarlanmıştır. CrRNA yalnızca düzenlemenin istendiği yerde bağlanmalıdır. Onarım şablonu, kesimin her iki tarafındaki DNA dizilerini bir dereceye kadar tamamlaması gerektiği ve ayrıca konakçı genomuna yerleştirilmek için istenen diziyi içermesi gerektiğinden her uygulama için benzersiz bir şekilde tasarlanmıştır.
Çoklu crRNA'lar ve tracrRNA, tek kılavuzlu bir RNA (sgRNA) oluşturmak için birlikte paketlenebilir.[33] Bu sgRNA, Cas9 proteinini kodlayan genin yanına dahil edilebilir ve hücrelere transfekte edilmek üzere bir plazmit haline getirilebilir. Etkili sgRNA dizilerinin tasarlanmasına yardımcı olacak birçok çevrimiçi araç mevcuttur.[34][35]

Yapısı
CRISPR-Cas9, yüksek derecede sadakat ve nispeten basit bir yapı sunar. Özgünlüğü için iki faktöre bağlıdır: hedef sıra ve protospacer bitişik motif (PAM) dizisi. Hedef sekans, crRNA dizisindeki her CRISPR lokusunun bir parçası olarak 20 baz uzunluğundadır.[32] Tipik bir crRNA dizisi birden çok benzersiz hedef dizisine sahiptir. Cas9 proteinleri, diziyi konukçu DNA üzerindeki baz çiftlerine bağlanmak için kullanarak konukçunun genomu üzerinde doğru konumu seçer. Sekans, Cas9 proteininin bir parçası değildir ve sonuç olarak özelleştirilebilir ve bağımsız olarak sentezlenmiş.[36][37]
Konak genomundaki PAM dizisi Cas9 tarafından tanınır. Cas9, farklı bir PAM dizisini tanıyacak şekilde kolayca değiştirilemez. Bununla birlikte, bu sonuçta çok sınırlayıcı değildir, çünkü tipik olarak genomun birçok yerinde sık sık meydana gelen çok kısa ve spesifik olmayan bir dizidir (örneğin, SpCas9 PAM dizisi 5'-NGG-3 'dür ve insan genomunda kabaca her 8 ila 12 baz çifti).[32]
Bu diziler bir plazmide birleştirilip hücrelere transfekte edildikten sonra, CrRNA'nın yardımıyla Cas9 proteini, konakçı hücrenin DNA'sında doğru diziyi bulur ve - Cas9 varyantına bağlı olarak - tek veya çift sarmallı bir kırılma oluşturur. DNA'daki uygun yer.[38]
Konakçı DNA'da düzgün aralıklarla yerleştirilmiş tek sarmallı kırılmalar tetikleyebilir homoloji odaklı onarım daha az hataya meyillidir homolog olmayan uç birleştirme bu genellikle çift sarmallı bir kopuşu izler. Bir DNA onarım şablonu sağlamak, belirli bir DNA dizisinin genom içinde kesin bir konuma eklenmesine izin verir. Onarım şablonu, Cas9 kaynaklı DNA kırılmasının ötesine 40 ila 90 baz çifti uzatmalıdır.[32] Amaç, hücrenin doğal HDR işleminin sağlanan onarım şablonunu kullanması ve böylece yeni diziyi genoma dahil etmesidir. Bir kez dahil edildiğinde, bu yeni sekans artık hücrenin genetik materyalinin bir parçasıdır ve yavru hücrelerine geçer.
Teslimat
Cas9, sgRNA ve ilişkili komplekslerin hücrelere verilmesi viral ve viral olmayan sistemler yoluyla gerçekleşebilir. Elektroporasyon DNA, RNA veya ribonükleokompleksler yaygın bir tekniktir, ancak hedef hücreler üzerinde zararlı etkilere neden olabilir.[39] Kullanılan kimyasal transfeksiyon teknikleri lipidler Cas9 ile kompleks halinde sgRNA'ları hücrelere sokmak için de kullanılmıştır.[40] Transfekte edilmesi daha zor olan hücre türleri (örneğin, kök hücreler, nöronlar ve hematopoietik hücreler), aşağıdakilere dayalı olanlar gibi daha verimli iletim sistemleri gerektirir. lentivirüs (LV'ler), adenovirüs (AdV) ve adeno ilişkili virüs (AAV).[41][42][43]
Kontrollü genom düzenleme
CRISPR-Cas9'un çeşitli varyantları, hafif veya küçük moleküller gibi harici bir tetikleyici ile gen aktivasyonuna veya genom düzenlemesine izin verir.[44][45][46] Bunlar, ışığa duyarlı protein ortaklarını bir aktivatör alanı ve gen aktivasyonu için bir dCas9 ile birleştirerek geliştirilen foto-aktifleştirilebilir CRISPR sistemlerini içerir.[47][48] veya benzer ışığa duyarlı alanları iki split-Cas9 yapısı ile birleştirerek,[49][50] veya kafesli doğal olmayan amino asitleri Cas9'a dahil ederek,[51] veya kılavuz RNA'ları genom düzenleme için ışıkla parçalanabilir tamamlayıcılarla değiştirerek.[52]
Küçük moleküllerle genom düzenlemeyi kontrol etme yöntemleri arasında, tespit edilebilir bir arka plan düzenlemesi olmayan allosterik bir Cas9 bulunur, bu, eklendikten sonra bağlanma ve bölünmeyi etkinleştirir. 4-hidroksitamoksifen (4-HT),[44] 4-HT duyarlı Intein bağlantılı Cas9,[53] veya dört ERT2 alanına birleştirildiğinde 4-HT'ye duyarlı bir Cas9.[54] Intein ile indüklenebilir split-Cas9, dimerizasyon Cas9 parçalarının sayısı[55] ve rapamisin iki split-Cas9 yapısının FRB ile birleştirilmesiyle geliştirilen indüklenebilir split-Cas9 sistemi ve FKBP parça.[56] Diğer çalışmalar Cas9'un küçük bir molekülle transkripsiyonunu indüklemeyi başardı. doksisiklin.[57][58] Küçük moleküller, homolojiye yönelik onarımı iyileştirmek için de kullanılabilir,[59] sıklıkla homolog olmayan uç birleştirme yolunu inhibe ederek.[60] Bu sistemler, geliştirilmiş hassasiyet, verimlilik ve uzay-zamansal kontrol için CRISPR etkinliğinin koşullu kontrolüne izin verir.
CRISPR taraması
Düzenli aralıklarla kümelenmiş kısa palindrom tekrarları (CRISPR) / Cas9 sistemi, çift sarmallı kırılmaları (DSB'ler), tek sarmallı çentikleri veya kılavuz ribonükleik asitlerin (RNA'lar) protospacer bitişik motif (PAM) dizisiyle bağlanabileceği herhangi bir yeri indükleyebilen bir gen düzenleme teknolojisidir.[61] Basit değiştirme sırası ile gRNA Cas9-endonükleaz, ilgilenilen bir gene verilebilir ve DSB'leri indükleyebilir.[62] Cas9-endonükleazın etkinliği ve genlerin hedeflenebilme kolaylığı, hem fare hem de insan hücreleri için CRISPR-nakavt (KO) kitaplıklarının geliştirilmesine yol açtı; bu, ilgili spesifik gen setlerini veya tüm genomu kapsayabilir.[63][64] CRISPR taraması, bilim insanının canlı model organizmalar içinde sistematik ve yüksek verimli bir genetik karışıklık yaratmasına yardımcı olur. Bu genetik tedirginlik, gen fonksiyonunu ve epigenetik düzenlemeyi tam olarak anlamak için gereklidir.[65] Havuzlanmış CRISPR kitaplıklarının avantajı, aynı anda daha fazla genin hedeflenebilmesidir.
Nakavt kütüphaneler, ifade edilen tüm gRNA'larda eşit temsil ve performans elde edecek ve dönüştürülmüş hücreleri geri kazanmak için kullanılabilen bir antibiyotik veya floresan seçim markörü taşıyacak şekilde oluşturulur.[61] İki tane plazmid CRISPR / Cas9 kitaplıklarındaki sistemler. Birincisi, sgRNA ve Cas9'un transfekte bir hücrede aynı anda üretildiği tek bir plazmid içindedir. İkincisi, iki vektörlü bir sistemdir: sgRNA ve Cas9 plazmitleri ayrı ayrı teslim edilir.[66] Düşük hızda viral transdüksiyonla binlerce benzersiz sgRNA içeren vektörü tek bir hücre damarına ulaştırmak önemlidir. enfeksiyon çokluğu (MOI, tipik olarak 0.1-0.6'da), tek bir hücre klonunun birden fazla sgRNA türü alma olasılığını önler, aksi takdirde yanlış atamaya yol açabilir. genotip -e fenotip.[63]
Havuzlanmış kitaplık bir kez hazırlandıktan sonra, sgRNA'ların bolluğunu ortaya çıkarmak için PCR ile büyütülmüş plazmid DNA'nın derin bir sekanslamasının (NGS, yeni nesil sekanslama) gerçekleştirilmesi gereklidir. İlgili hücreler sonuç olarak kütüphane tarafından enfekte edilebilir ve daha sonra fenotipe göre seçilebilir. 2 tür seçim vardır: negatif ve pozitif. Negatif seçim ile ölü veya yavaş büyüyen hücreler verimli bir şekilde tespit edilir. Moleküler olarak hedeflenen ilaçlar için adaylar olarak hizmet edebilecek hayatta kalma açısından gerekli genleri tanımlayabilir. Öte yandan, pozitif seçim, rastgele mutagenez yoluyla büyüme avantajı elde edilen popülasyonların bir koleksiyonunu verir.[61] Seçimden sonra genomik DNA toplanır ve NGS tarafından dizilenir. SgRNA'ların tükenmesi veya zenginleşmesi saptanır ve sgRNA'nın karşılık geldiği hedef gen ile açıklanmış orijinal sgRNA kitaplığıyla karşılaştırılır. Daha sonra istatistiksel analiz, ilgilenilen fenotip ile önemli ölçüde alakalı olan genleri tanımlar.[63]
| Kütüphane | İD | Türler | PI | Hedeflenen genler | Gen başına gRNA'lar | Toplam gRNA'lar |
|---|---|---|---|---|---|---|
| Bassik Mouse CRISPR Nakavt Kitaplığı | 1000000121 — 1000000130 | Fare | Bassik | Değişir (toplamda ∼23.000) | ∼10 | Değişir |
| Fare Tümörü Bastırıcı Gen CRISPR Nakavt Kitaplığı | 113584 EFS omurgası 113585 TBG omurgası | Fare | Chen | 56 | ∼4 | 286 |
| Brie fare genomu çapında kütüphane | 73632 (1 plazmid) 73633 (2 plazmid) | Fare | Doench ve Kök | 19,674 | 4 | 78,637 |
| Bassik Human CRISPR Nakavt Kitaplığı | 101926 — 101934 | İnsan | Bassik | Değişir (toplamda ∼20.500) | ∼10 | Değişir |
| Brunello insan genomu çapında kütüphane | 73179 (1 plazmid) 73178 (2 plazmid) | İnsan | Doench ve Kök | 19,114 | 4 | 76,441 |
| Mini-insan AsCpf1 tabanlı İnsan Genomu Çapında Nakavt Kitaplığı | 130630 | İnsan | Draetta | 16,977 | 3-4 | 17.032 dizi |
Nakavt etmenin yanı sıra, proteolitik olarak deaktive edilmiş Cas9-füzyon proteinlerinin (dCas9) hedef DNA'ya bağlanma yeteneğini kullanan knock-down (CRISPRi) ve aktivasyon (CRISPRa) kitaplıkları da vardır; bu, ilgilenilen genin kesilmediği anlamına gelir. aşırı ifade edilir veya bastırılır. CRISPR / Cas9 sistemini gen düzenlemede daha da ilginç hale getirdi. Aktif olmayan dCas9 proteini, hedef genlerin promoter veya transkripsiyonel başlangıç bölgelerine doğru dCas9-baskılayıcıları veya aktivatörleri hedefleyerek gen ekspresyonunu modüle eder. Genleri baskılamak için, Cas9, gRNA ile kompleks oluşturan KRAB efektör alanına kaynaştırılabilirken, CRISPRa, ekspresyonu yukarı düzenlemek için gRNA tarafından ilerletici bölgelere yönlendirilen farklı transkripsiyonel aktivasyon alanlarına kaynaşmış dCas9'u kullanır.[68][69][70]
Başvurular
Hastalık modelleri
Cas9 genomik modifikasyonu, hızlı ve verimli transgenik genetik alanındaki modeller. Cas9, hastalıkların yayılmasını ve hücrenin enfeksiyona tepkisini ve enfeksiyona karşı savunmasını modellemek için sgRNA ile birlikte plazmit transfeksiyonu yoluyla hedef hücrelere kolayca sokulabilir.[71] Cas9 yeteneği tanıtılacak in vivo Gen fonksiyonu ve mutasyon etkilerinin daha doğru modellerinin oluşturulmasına izin verirken, tümü tipik olarak eski genetik mühendisliği yöntemlerinde gözlemlenen hedef dışı mutasyonlardan kaçınır.
Genomik modellemede CRISPR ve Cas9 devrimi sadece memelileri kapsamaz. Gibi geleneksel genomik modeller Drosophila melanogaster, ilk model organizmalardan biri olan Cas9 kullanımıyla çözümlerinde daha fazla iyileştirme gördü.[71] Cas9, Cas9'un kontrollü kullanımına izin veren hücreye özgü promoterler kullanır. Cas9, yalnızca belirli hücre türlerini etkileyen Cas9 enziminin hedeflenmesi nedeniyle hastalıkları tedavi etmenin doğru bir yöntemidir. Cas9 terapisine tabi tutulan hücreler de çıkarılabilir ve terapinin güçlendirilmiş etkilerini sağlamak için yeniden dahil edilebilir.[72]
CRISPR-Cas9, organizmaların DNA'sını düzenlemek için kullanılabilir in vivo ve tek tek genleri veya hatta tamamını ortadan kaldırmak için kromozomlar bir organizmadan gelişiminin herhangi bir noktasında. Başarıyla silinen kromozomlar in vivo CRISPR tekniklerinin kullanılması, embriyonik kök hücre hatlarında yetişkin laboratuvar farelerinin ve insan kromozomları 14 ve 21'in Y kromozomunu ve X kromozomunu içerir ve anöploid sırasıyla fareler. Bu yöntem, anormal sayıda kromozomun neden olduğu genetik bozuklukların tedavisinde yararlı olabilir. Down Sendromu ve interseks bozukluklar.[73]
Başarılı in vivo CRISPR-Cas9 kullanarak genom düzenleme, aşağıdakiler de dahil olmak üzere çok sayıda model organizmada gösterilmiştir: Escherichia coli,[74] Saccharomyces cerevisiae,[75] Candida albicans,[76] Caenorhabditis elegans,[77] Arabidopsis spp.,[78] Danio rerio,[79] ve Mus musculus.[80][81] Temel biyoloji çalışmalarında, hastalık modellerinin oluşturulmasında başarılar elde edildi,[77] ve hastalık modellerinin deneysel tedavisinde.[82]
Endişeler arttı ki hedef dışı etkiler (amaçlananların yanı sıra genlerin düzenlenmesi), bir CRISPR gen düzenleme deneyinin sonuçlarını karıştırabilir (yani, gözlemlenen fenotipik değişiklik, hedef geni değiştirmekten değil, başka bir genden kaynaklanıyor olabilir). Hedef dışı etki olasılığını en aza indirmek için CRISPR'de değişiklikler yapılmıştır. Ortogonal CRISPR deneyleri, genellikle bir gen düzenleme deneyinin sonuçlarını doğrulamak için önerilir.[83][84]
CRISPR, genetiği değiştirilmiş Organizmalar hastalığı taklit eden veya bir gen olduğunda ne olduğunu gösteren araştırmalar için yıkıldı veya mutasyona uğramış. CRISPR şurada kullanılabilir: germ hattı Hedeflenen genin her yerde (yani çok hücreli bir organizmanın tüm hücrelerinde / dokularında / organlarında) değiştiği organizmalar yaratmak için seviye veya organizma içindeki yalnızca belirli hücre popülasyonlarını etkileyen lokal değişiklikler oluşturmak için germ hattı olmayan hücrelerde kullanılabilir. .[85][86][87]
CRISPR, insan hücresel hastalık modellerini oluşturmak için kullanılabilir.[88] Örneğin insana uygulandığında pluripotent kök hücreler CRISPR, ilgili genlerde hedeflenen mutasyonları tanıtmak için kullanılmıştır. polikistik böbrek hastalığı (PKD) ve fokal segmental glomerüloskleroz (FSGS).[89] Bu CRISPR ile modifiye edilmiş pluripotent kök hücreler daha sonra insan böbreğine büyütüldü organoidler hastalığa özgü fenotipler sergileyen. Böbrek organoidler PKD mutasyonlu kök hücrelerden böbrek tübüllerinden büyük, yarı saydam kist yapıları oluşturdu. Kistler, çapı bir santimetreye kadar makroskopik boyutlara ulaşabiliyordu.[90] FSGS'ye bağlı bir gende mutasyonlara sahip böbrek organoidleri, aralarında bağlantı kusurları geliştirdi. podositler, o hastalıkta etkilenen filtreleme hücreleri. Bu, podositlerin bitişik hücreler arasında mikrovil oluşturmadaki yetersizliğine dayanıyordu.[91] Daha da önemlisi, bu hastalık fenotipleri, aynı genetik geçmişe sahip kontrol organoidlerinde yoktu, ancak CRISPR modifikasyonlarından yoksundu.[89]
Modele benzer bir yaklaşım benimsendi uzun QT sendromu içinde kardiyomiyositler pluripotent kök hücrelerden elde edilir.[92] İzojenik kontrollerle CRISPR tarafından üretilen bu hücresel modeller, insan hastalıklarını incelemek ve ilaçları test etmek için yeni bir yol sağlar.
Biyotıp
CRISPR-Cas teknolojisi, çok sayıda insan hastalığının, özellikle de genetik bir nedeni olanların tedavisi olarak önerildi.[93] Spesifik DNA dizilerini değiştirme yeteneği, onu hastalığa neden olan mutasyonları düzeltme potansiyeline sahip bir araç haline getirir. Hayvan modellerinde yapılan erken araştırmalar, CRISPR teknolojisine dayalı tedavilerin çok çeşitli hastalıkları tedavi etme potansiyeline sahip olduğunu göstermektedir.[94] kanser dahil[95] beta-talasemi,[96] Orak hücre hastalığı,[97] hemofili,[98] kistik fibrozis,[99] Duchenne kas distrofisi,[100] Huntington hastalığı,[101][102] ve kalp hastalığı.[103] CRISPR ayrıca doku mühendisliği ve rejeneratif tıpta, örneğin ekspresyonu olmayan insan kan damarları oluşturarak uygulamalara sahip olabilir. MHC sınıf II genellikle nakil reddine neden olan proteinler.[104]
Enfeksiyon tedavisinde CRISPR
CRISPR-Cas tabanlı "RNA kılavuzlu nükleazlar", virülans faktörleri, kodlayan genler antibiyotik direnci ve tıbbi olarak ilgili diğer ilgi dizileri. Bu teknoloji, yeni bir antimikrobiyal tedavi biçimini ve bakteri popülasyonlarını manipüle etmek için bir stratejiyi temsil ediyor.[105][106] Son çalışmalar, CRISPR-Cas lokusunun müdahalesi ile antibiyotik direncinin kazanılması arasında bir korelasyon olduğunu göstermektedir.[107] Bu sistem, bakterilerin yabancı DNA'yı istila etmesine karşı koruma sağlar. transpozonlar, bakteriyofajlar ve plazmitler. Bu sistemin, bakteriyel patojenlerde antibiyotik direnci ve virülans faktörünün kazanılması için güçlü bir seçici baskı olduğu gösterilmiştir.[107]
Dayalı tedaviler CRISPR – Cas3 gen düzenleme tasarlanmış bakteriyofajlar tarafından sağlanan teknoloji, patojenlerde hedeflenen DNA'yı yok etmek için kullanılabilir.[108] Cas3, daha iyi bilinen Cas9'dan daha yıkıcıdır.[109][110]
Araştırmalar, CRISPR'nin çoklu kopyaların çoğaltılmasını sınırlamanın etkili bir yolu olduğunu gösteriyor. herpes virüsleri. Viral DNA'yı ortadan kaldırmayı başardı. Epstein Barr Virüsü (EBV). Anti-herpesvirüs CRISPR'leri, kansere neden olan EBV'yi tümör hücrelerinden çıkarmak, bağışlanan organlardan kurtulmaya yardımcı olmak gibi umut verici uygulamalara sahiptir. bağışıklığı zayıf viral işgalci hastaları veya önleme soğuk algınlığı bloke ederek salgınlar ve tekrarlayan göz enfeksiyonları HSV-1 yeniden etkinleştirme. Ağustos 2016 itibarıyla[Güncelleme], bunlar test edilmeyi bekliyordu.[111]
CRISPR kavramını canlandırabilir dikim insanlara hayvan organları. Retrovirüsler Hayvan genomlarında mevcut olması, nakil alıcılarına zarar verebilir. 2015 yılında bir ekip, böbrek epitel hücresindeki domuz genomundan belirli bir retroviral DNA sekansının 62 kopyasını eledi.[112] Araştırmacılar yakın zamanda, bu retrovirüsleri ilk kez CRISPR kullanarak genomlarından çıkardıktan sonra canlı domuz örneklerini doğurma yeteneğini gösterdiler.[113]
CRISPR ve kanser
CRISPR'yi içeren ilk klinik deneme 2016'da başladı. Akciğer kanseri olan kişilerden bağışıklık hücrelerinin çıkarılmasını, CRISPR'yi kullanarak geni ifade eden PD-1'i düzenlemek ve ardından değiştirilen hücrelerin aynı kişiye geri verilmesini içeriyordu. 2017 itibariyle, çoğu Çin'de olmak üzere 20 diğer deneme devam ediyor veya neredeyse hazırdı[Güncelleme].[95]
2016 yılında Amerika Birleşik Devletleri Gıda ve İlaç Dairesi (FDA), CRISPR'nin farklı kanser türlerine sahip insanlardan çıkarılan T hücrelerini değiştirmek için kullanılacağı ve daha sonra bu tasarlanmış T hücrelerini aynı kişilere geri vereceği bir klinik araştırmayı onayladı.[114]
Nakavt / aktivasyon

Cas9'un "ölü" sürümlerini kullanma (dCas9 ), istenen dizileri hedefleme yeteneğini korurken CRISPR'ın DNA kesme yeteneğini ortadan kaldırır. Birden fazla grup, dCas9'lara çeşitli düzenleyici faktörler ekleyerek neredeyse her geni açıp kapatmalarını veya aktivite seviyesini ayarlamalarını sağladı.[112] RNAi gibi, CRISPR interferansı (CRISPRi), bir siteyi kesmeden değil, hedefleyerek genleri tersine çevrilebilir bir şekilde kapatır. Hedeflenen site metillenmiş, epigenetik olarak geni değiştirmek. Bu değişiklik, transkripsiyonu engeller. Bu tam olarak yerleştirilmiş modifikasyonlar, daha sonra DNA içindeki belirli genom dizilerinin inhibisyonundan sonra gen ekspresyonları ve DNA dinamikleri üzerindeki etkileri düzenlemek için kullanılabilir. Geçtiğimiz birkaç yıl içinde, farklı insan hücrelerindeki epigenetik işaretler yakından araştırıldı ve işaretler içindeki belirli modellerin, tümör büyümesinden beyin aktivitesine kadar her şeyle ilişkili olduğu bulundu.[9] Tersine, CRISPR aracılı aktivasyon (CRISPRa) gen transkripsiyonunu destekler.[115] Cas9, DNA düzeyinde belirli genleri hedeflemenin ve susturmanın etkili bir yoludur.[116] Bakterilerde, Cas9'un tek başına varlığı, transkripsiyonu bloke etmek için yeterlidir. Memeli uygulamaları için bir protein bölümü eklenir. Kılavuz RNA, adı verilen düzenleyici DNA dizilerini hedefler. destekçiler hedef genden hemen önce gelen.[117]
Cas9 sentetik taşımak için kullanıldı Transkripsiyon faktörleri belirli insan genlerini aktive eden. Teknik, birden fazla CRISPR yapısını genin promotörü üzerindeki biraz farklı konumlara hedefleyerek güçlü bir etki elde etti.[117]
RNA düzenleme
2016'da araştırmacılar, sıradan bir ağız bakterisinden elde edilen CRISPR'nin düzenlemek için kullanılabileceğini gösterdi. RNA. Araştırmacılar, CRISPR genlerine benzeyenler için yüz milyonlarca genetik dizi içeren veritabanlarını araştırdı. Düşündüler füzobakteriler Leptotrichia shahii. CRISPR genlerine benzeyen, ancak önemli farklılıkları olan bir grup gen vardı. Araştırmacılar, C2c2 adını verdikleri bu genlerle diğer bakterileri de donattıklarında, organizmaların yeni bir savunma kazandığını gördüler.[118] C2c2 daha sonra Cas genleri için standart terminolojiye uyması için Cas13a olarak yeniden adlandırıldı.[119]
Birçok virüs, genetik bilgilerini yeni virüsler yapmak için yeniden amaçladıkları DNA yerine RNA'da kodlar. HIV ve çocuk felci bu tür virüslerdir. Cas13 içeren bakteriler, RNA'yı parçalayarak virüsü yok edebilen moleküller yapar. Bu genlerin uyarlanması, herhangi bir RNA molekülünü düzenlemeye açtı.[118]
CRISPR-Cas sistemleri ayrıca mikro RNA ve uzun kodlamayan RNA bitkilerdeki genler.[120]
Gen sürücüsü
Gen sürücüleri, istilacı türleri ortadan kaldırarak ekosistemlerin dengesini yeniden sağlamak için güçlü bir araç sağlayabilir. Etkililik, hedef türlerdeki istenmeyen sonuçlar ve hedef olmayan türler ile ilgili endişeler, özellikle laboratuarlardan doğaya kazara salınım potansiyeli açısından ortaya çıkmıştır. Bilim adamları, moleküler, üreme ve ekolojik dahil olmak üzere deneysel gen sürücülerinin kontrol altına alınmasını sağlamak için çeşitli koruma önlemleri önerdiler.[121] Birçoğu, gerektiğinde etkilerinin üzerine yazmak için aşılama ve tersine çevirme sürücülerinin gen sürücüleriyle birlikte geliştirilmesini önermektedir.[122] Uzun vadeli etkilerin, özellikle geri dönüş tahrikleri ile düzeltilemeyen ekolojik bozulma potansiyeli konusunda daha kapsamlı bir şekilde incelenmesi gerektiği konusunda fikir birliği var.[123] Gibi, DNA hesaplama gerekli olacaktır.
Laboratuvar ortamında genetik tükenme
Zenginleştirilmemiş dizileme kitaplıkları genellikle çok sayıda istenmeyen diziye sahiptir. Cas9,% 99'a varan verimlilikle ve önemli ölçüde olmadan çift sarmal kırılmasıyla istenmeyen dizileri özellikle tüketebilir hedef dışı etkiler ile görüldüğü gibi Kısıtlama enzimleri. Cas9 ile tedavi, RNA-sekans kitaplıklarında patojen duyarlılığını artırırken bol miktarda rRNA'yı tüketebilir.[124]
Prime düzenleme
Prime düzenleme[125] (veya temel düzenleme), DNA bölümlerini doğru bir şekilde eklemek veya silmek için bir CRISPR iyileştirmesidir. CRISPR düzenlemeleri her zaman mükemmel değildir ve kesintiler yanlış yerde sonuçlanabilir. Her iki konu da teknolojiyi tıpta kullanmak için bir sorundur.[126] Birincil düzenleme, çift sarmallı DNA'yı kesmez, bunun yerine CRISPR hedefleme aparatını kullanarak ek bir enzimi istenen bir diziye taşımak için tek bir nükleotidi diğerine dönüştürür.[127] PegRNA adı verilen yeni kılavuz, hedef konumda genoma eklenecek yeni bir DNA dizisi için bir RNA şablonu içerir. Bu, Cas9'a eklenmiş ikinci bir protein gerektirir: RNA şablonundan yeni bir DNA zinciri oluşturabilen ve onu çentikli bölgeye ekleyebilen bir ters transkriptaz enzimi.[128] Bu üç bağımsız eşleştirme olayının her biri, hedefleme esnekliğini ve düzenleme hassasiyetini önemli ölçüde artıran hedef dışı dizileri önleme fırsatı sunar.[127] Prime düzenleme, araştırmacılar tarafından geliştirilmiştir. Geniş MIT Enstitüsü ve Harvard Massachusetts'te.[129] Yöntemleri optimize etmek için daha fazla çalışmaya ihtiyaç vardır.[129][128]
Toplum ve kültür
İnsan germ hattı modifikasyonu
Mart 2015 itibariyle, birçok grup CRISPR'yi insan embriyolarına uygulamak için temelleri atma niyetiyle devam eden araştırmaları duyurmuştu. insan germ hattı mühendisliği ABD, Çin ve Birleşik Krallık'taki laboratuvarların yanı sıra ABD biyoteknoloji şirketi dahil OvaScience.[130] Bir CRISPR ortak keşfi de dahil olmak üzere bilim adamları, CRISPR'yi özellikle klinik kullanım için insan germ hattına uygulama konusunda dünya çapında bir moratoryum çağrısında bulundu. "Bilim adamları ve devlet kurumları arasında" tam anlamlar "tartışılana kadar, bilim adamları, gevşek yargı alanlarında, insanlarda klinik uygulama için germ hattı genom modifikasyonunu denemekten bile kaçınmalıdır" dediler.[131][132] Bu bilim adamları, CRISPR hakkında daha fazla düşük düzeyli araştırmayı destekliyor ve CRISPR'yi insanlarda kalıtsal değişiklikler yapmak için herhangi bir klinik kullanım için yeterince gelişmiş olarak görmüyorlar.[133]
Nisan 2015'te Çinli bilim adamları, cansız DNA'yı değiştirme girişiminin sonuçlarını bildirdi. insan embriyoları neden olan bir mutasyonu düzeltmek için CRISPR kullanmak beta talasemi, ölümcül bir kalıtsal bozukluk.[134][135] Çalışma daha önce her ikisi tarafından reddedilmişti Doğa ve Bilim kısmen etik kaygılar nedeniyle.[136] Deneyler, amaçlanan genlerin yalnızca bazılarının başarılı bir şekilde değiştirilmesiyle sonuçlandı ve hedef dışı etkiler diğer genlerde. Araştırmacılar, CRISPR'nin klinik uygulama için hazır olmadığını belirtti. üreme tıbbı.[136] Nisan 2016'da Çinli bilim adamlarının CRISPR kullanarak cansız insan embriyolarının DNA'sını değiştirmek için ikinci başarısız bir girişimde bulundukları bildirildi - bu sefer CCR5 embriyoyu dirençli hale getiren gen HIV enfeksiyon.[137]
Aralık 2015'te, Washington'da İnsan Geni Düzenlemesi üzerine Uluslararası Zirve gerçekleştirildi. David Baltimore. ABD, İngiltere ve Çin'deki ulusal bilim akademilerinin üyeleri, germ hattı modifikasyonunun etiğini tartıştılar. Bazı yasal ve etik kurallar çerçevesinde temel ve klinik araştırmaları desteklemeyi kabul ettiler. Arasında belirli bir ayrım yapıldı somatik hücreler, düzenlemelerin etkilerinin tek bir bireyle ve genom değişikliklerinin torunları tarafından miras alınabildiği germ hattı hücreleriyle sınırlı olduğu yerlerde. Kalıtımsal değişiklikler, insan evrimi için genetik (örneğin gen-çevre etkileşimleri) ve kültürel (ör. sosyal Darvinizm ). Değiştiriliyor gametositler ve insanlarda kalıtsal değişiklikler yaratan embriyolar sorumsuz olarak tanımlandı. Grup, bu tür endişeleri gidermek ve düzenlemeleri ülkeler arasında uyumlu hale getirmek için uluslararası bir forum başlatmayı kabul etti.[138]
Şubat 2017'de Amerika Birleşik Devletleri Ulusal Bilimler, Mühendislik ve Tıp Akademileri (NASEM İnsan Geni Düzenleme Komitesi, genom mühendisliği teknolojisinin etik, yasal ve bilimsel endişelerini gözden geçiren bir rapor yayınladı. Raporun sonucu, kalıtsal olduğunu belirtti genom düzenleme şu anda izin verilemez, ancak bazı tıbbi durumlar için haklı görülebilir; ancak, bunların kullanımını haklı çıkarmadılar CRISPR geliştirme için.[139]
Kasım 2018'de, Jiankui He genini devre dışı bırakmaya çalışmak için iki insan embriyosunu düzenlediğini açıkladı. CCR5, bir alıcıyı kodlayan HIV uses to enter cells. He said that twin girls, Lulu and Nana, had been born a few weeks earlier. He said that the girls still carried functional copies of CCR5 along with disabled CCR5 (mozaikçilik ) and were still vulnerable to HIV. The work was widely condemned as unethical, dangerous, and premature.[140] An international group of scientists called for a global moratorium on genetically editing human embryos.[141]
Policy barriers to genetic engineering
Policy regulations for the CRISPR-Cas9 system vary around the globe. In February 2016, British scientists were given permission by regulators to genetically modify human embryos by using CRISPR-Cas9 and related techniques. However, researchers were forbidden from implanting the embryos and the embryos were to be destroyed after seven days.[142]
The US has an elaborate, interdepartmental regulatory system to evaluate new genetically modified foods and crops. Örneğin, 2000 Tarım Riskini Koruma Yasası verir Amerika Birleşik Devletleri Tarım Bakanlığı the authority to oversee the detection, control, eradication, suppression, prevention, or retardation of the spread of plant pests or noxious weeds to protect the agriculture, environment, and economy of the US. The act regulates any genetiği değiştirilmiş Organizma that utilizes the genome of a predefined "plant pest" or any plant not previously categorized.[143] In 2015, Yinong Yang successfully deactivated 16 specific genes in the white button mushroom to make them non-browning. Since he had not added any foreign-species (transgenik ) DNA to his organism, the mushroom could not be regulated by the USDA under Section 340.2.[144] Yang's white button mushroom was the first organism genetically modified with the CRISPR-Cas9 protein system to pass US regulation.[145]
In 2016, the USDA sponsored a committee to consider future regulatory policy for upcoming genetic modification techniques. With the help of the US Ulusal Bilimler, Mühendislik ve Tıp Akademileri, special interests groups met on April 15 to contemplate the possible advancements in genetic engineering within the next five years and any new regulations that might be needed as a result.[146] 2017 yılında Gıda ve İlaç İdaresi proposed a rule that would classify genetic engineering modifications to animals as "animal drugs", subjecting them to strict regulation if offered for sale and reducing the ability for individuals and small businesses to make them profitable.[147][148]
In China, where social conditions sharply contrast with those of the West, genetic diseases carry a heavy stigma.[149] This leaves China with fewer policy barriers to the use of this technology.[150][151]
Tanıma
In 2012 and 2013, CRISPR was a runner-up in Bilim Dergisi 's Yılın Atılımı ödül. In 2015, it was the winner of that award.[112] CRISPR was named as one of MIT Technology Review's 10 breakthrough technologies in 2014 and 2016.[152][153] 2016 yılında Jennifer Doudna ve Emmanuelle Charpentier, along with Rudolph Barrangou, Philippe Horvath, ve Feng Zhang won the Gairdner International award. In 2017, Doudna and Charpentier were awarded the Japan Prize in Tokyo, Japan for their revolutionary invention of CRISPR-Cas9. In 2016, Charpentier, Doudna, and Zhang won the Tang Ödülü in Biopharmaceutical Science.[154] In 2020, Charpentier and Doudna were awarded the Nobel Kimya Ödülü "for the development of a method for genome editing."[155]
Ayrıca bakınız
Referanslar
- ^ Hendel A, Bak RO, Clark JT, Kennedy AB, Ryan DE, Roy S, Steinfeld I, Lunstad BD, Kaiser RJ, Wilkens AB, Bacchetta R, Tsalenko A, Dellinger D, Bruhn L, Porteus MH (September 2015). "Chemically modified guide RNAs enhance CRISPR-Cas genome editing in human primary cells". Doğa Biyoteknolojisi. 33 (9): 985–9. doi:10.1038/nbt.3290. PMC 4729442. PMID 26121415.
- ^ Cohen, Jon (October 7, 2020). "CRISPR, the revolutionary genetic "scissors," honored by Chemistry Nobel". Bilim. doi:10.1126/science.abf0540.
- ^ CohenJun. 4, Jon; 2018; Pm, 12:45 (2018-06-04). "With prestigious prize, an overshadowed CRISPR researcher wins the spotlight". Bilim | AAAS. Alındı 2020-05-02.CS1 bakimi: sayısal isimler: yazarlar listesi (bağlantı)
- ^ Lithuanian scientists not awarded Nobel prize despite discovering same technology. LRT.LT
- ^ Šikšnys, Virginijus (2018-06-16). "Imam genų žirkles, iškerpam klaidą, ligos nelieka". Laisvės TV / Freedom TV (Litvanyaca). 12:22 minutes in. LaisvėsTV. <...>Tai mes tą savo straipsnį išsiuntėm į redakciją pirmieji, bet laimės ten daug nebuvo. Viena redakcija pasakė, kad mes net recenzentam nesiųsim. Nusiuntėm į kitą redakciją - tai jis (straipsnis) pragulėjo kažkur ant redaktoriaus stalo labai ilgai. Na ir taip galų gale išsiuntėm į trečią žurnalą ir trečias žurnalas po kelių mėnesių jį išspausdino. Bet, aišku, Berklio universiteto mokslininkams sekėsi geriau - jie išsiuntė straipsnį į žurnalą Science - jį priėmė ir išspausdino per 2 savaites. Nors iš tikro jie tą straispnį išsiuntė pora mėnesių vėliau nei mes. Alındı 2018-06-30.
<...>Well, we were who had sent the article first, but had not much of luck. One editorial office told us they would not send the article to the reviewers. We had sent the article to another journal - and the article was kept too long, maybe on some desk of the editor. So finally we sent it to the third journal and it was published few months later. Meanwhile the scientists from the University of Berkeley had a better luck - they have sent the article later than we and it was accepted and published in two weeks. But actually they have sent the article few months later than we.
- ^ a b Bak RO, Gomez-Ospina N, Porteus MH (2018). "Gene Editing on Center Stage". Genetikte Eğilimler. 34 (8): 600–611. doi:10.1016/j.tig.2018.05.004. PMID 29908711.
- ^ Zhang JH, Pandey M, Kahler JF, Loshakov A, Harris B, Dagur PK, Mo YY, Simonds WF (November 2014). "Improving the specificity and efficacy of CRISPR/CAS9 and gRNA through target specific DNA reporter". Biyoteknoloji Dergisi. 189: 1–8. doi:10.1016/j.jbiotec.2014.08.033. PMC 4252756. PMID 25193712.
- ^ Vakulskas CA, Dever DP, Rettig GR, Turk R, Jacobi AM, Collingwood MA, Bode NM, McNeill MS, Yan S, Camarena J, Lee CM, Park SH, Wiebking V, Bak RO, Gomez-Ospina N, Pavel-Dinu M, Sun W, Bao G, Porteus MH, Behlke MA (August 2018). "A high-fidelity Cas9 mutant delivered as a ribonucleoprotein complex enables efficient gene editing in human hematopoietic stem and progenitor cells". Doğa Tıbbı. 24 (8): 1216–1224. doi:10.1038/s41591-018-0137-0. PMC 6107069. PMID 30082871.
- ^ a b c Ledford H (March 2016). "CRISPR: gene editing is just the beginning". Doğa. 531 (7593): 156–9. Bibcode:2016Natur.531..156L. doi:10.1038/531156a. PMID 26961639.
- ^ Travis J (17 December 2015). "Breakthrough of the Year: CRISPR makes the cut". Bilim Dergisi. American Association for the Advancement of Science.
- ^ Ledford H (June 2015). "CRISPR, the disruptor". Doğa. 522 (7554): 20–4. Bibcode:2015Natur.522...20L. doi:10.1038/522020a. PMID 26040877.
- ^ Young S (11 February 2014). "CRISPR and Other Genome Editing Tools Boost Medical Research and Gene Therapy's Reach". MIT Technology Review. Alındı 2014-04-13.
- ^ a b Heidenreich M, Zhang F (January 2016). "Applications of CRISPR-Cas systems in neuroscience". Doğa Yorumları. Sinirbilim. 17 (1): 36–44. doi:10.1038/nrn.2015.2. PMC 4899966. PMID 26656253.
- ^ Barrangou R, Doudna JA (September 2016). "Applications of CRISPR technologies in research and beyond". Doğa Biyoteknolojisi. 34 (9): 933–941. doi:10.1038/nbt.3659. PMID 27606440. S2CID 21543486.
- ^ Cox DB, Platt RJ, Zhang F (February 2015). "Therapeutic genome editing: prospects and challenges". Doğa Tıbbı. 21 (2): 121–31. doi:10.1038/nm.3793. PMC 4492683. PMID 25654603.
- ^ Pollack, Andrew (May 11, 2015). "Jennifer Doudna, a Pioneer Who Helped Simplify Genome Editing". New York Times. Alındı 8 Ekim 2020.
- ^ "CRISPR Madness". GEN. 2013-11-08.
- ^ Personel (1 Nisan 2015). "News: Products & Services". Genetik Mühendisliği ve Biyoteknoloji Haberleri (Kağıt). 35 (7): 8. doi:10.1089/gen.35.21.05.
- ^ "Who Owns the Biggest Biotech Discovery of the Century? There's a bitter fight over the patents for CRISPR, a breakthrough new form of DNA editing". MIT Teknoloji İncelemesi. Alındı 25 Şubat 2015.
- ^ Fye S. "Genetic Rough Draft: Editas and CRISPR". The Atlas Business Journal. Alındı 19 Ocak 2016.
- ^ Pollack A (15 February 2017). "Harvard and M.I.T. Scientists Win Gene-Editing Patent Fight". New York Times.
- ^ Akst J (February 15, 2017). "Broad Wins CRISPR Patent Interference Case". The Scientist Magazine.
- ^ Noonan KE (February 16, 2017). "PTAB Decides CRISPR Interference in Favor of Broad Institute -- Their Reasoning". Patent Belgeleri.
- ^ Potenza A (April 13, 2017). "UC Berkeley challenges decision that CRISPR patents belong to Broad Institute 3 comments The legal fight will likely continue for months or even years". Sınır. Alındı 22 Eylül 2017.
- ^ Buhr S (July 26, 2017). "The CRISPR patent battle is back on as UC Berkeley files an appeal". TechCrunch. Alındı 22 Eylül 2017.
- ^ a b Philippidis A (August 7, 2017). "MilliporeSigma to Be Granted European Patent for CRISPR Technology". Genetic Engineering & Biotechology News. Alındı 22 Eylül 2017.
- ^ Akst J (March 24, 2017). "UC Berkeley Receives CRISPR Patent in Europe". Bilim insanı. Alındı 22 Eylül 2017.
- ^ Cohen J (4 August 2017). "CRISPR patent battle in Europe takes a 'wild' twist with surprising player". Bilim. doi:10.1126/science.aan7211.
- ^ "Top EU court: GMO rules cover plant gene editing technique". Retuers. 25 Temmuz 2018.
- ^ AFP. "ABD Denemesi 3 Kanser Hastasının Genomlarının CRISPR Tarafından Güvenle Değiştirildiğini Gösteriyor". ScienceAlert. Alındı 2020-02-09.
- ^ JV Chamary. "These Scientists Deserved A Nobel Prize, But Didn't Discover Crispr". Forbes. Alındı 2020-07-10.
- ^ a b c d e Ran FA, Hsu PD, Wright J, Agarwala V, Scott DA, Zhang F (November 2013). "Genome engineering using the CRISPR-Cas9 system". Doğa Protokolleri. 8 (11): 2281–308. doi:10.1038/nprot.2013.143. hdl:1721.1/102943. PMC 3969860. PMID 24157548.
- ^ Ly J (2013). Discovering Genes Responsible for Kidney Diseases (Doktora). Toronto Üniversitesi. Alındı 26 Aralık 2016.
- ^ Mohr SE, Hu Y, Ewen-Campen B, Housden BE, Viswanatha R, Perrimon N (September 2016). "CRISPR guide RNA design for research applications". FEBS Dergisi. 283 (17): 3232–8. doi:10.1111/febs.13777. PMC 5014588. PMID 27276584.
- ^ Brazelton VA, Zarecor S, Wright DA, Wang Y, Liu J, Chen K, Yang B, Lawrence-Dill CJ (2015). "A quick guide to CRISPR sgRNA design tools". GM Crops & Food. 6 (4): 266–76. doi:10.1080/21645698.2015.1137690. PMC 5033207. PMID 26745836.
- ^ Horvath P, Barrangou R (January 2010). "CRISPR/Cas, the immune system of bacteria and archaea". Bilim. 327 (5962): 167–70. Bibcode:2010Sci...327..167H. doi:10.1126/science.1179555. PMID 20056882. S2CID 17960960.
- ^ Bialk P, Rivera-Torres N, Strouse B, Kmiec EB (2015-06-08). "Regulation of Gene Editing Activity Directed by Single-Stranded Oligonucleotides and CRISPR/Cas9 Systems". PLOS ONE. 10 (6): e0129308. Bibcode:2015PLoSO..1029308B. doi:10.1371/journal.pone.0129308. PMC 4459703. PMID 26053390.
- ^ Sander JD, Joung JK (April 2014). "CRISPR-Cas systems for editing, regulating and targeting genomes". Doğa Biyoteknolojisi. 32 (4): 347–55. doi:10.1038/nbt.2842. PMC 4022601. PMID 24584096.
- ^ Lino CA, Harper JC, Carney JP, Timlin JA (November 2018). "Delivering CRISPR: a review of the challenges and approaches". Drug Delivery. 25 (1): 1234–1257. doi:10.1080/10717544.2018.1474964. PMC 6058482. PMID 29801422.
- ^ Li L, Hu S, Chen X (July 2018). "Non-viral delivery systems for CRISPR/Cas9-based genome editing: Challenges and opportunities". Biyomalzemeler. 171: 207–218. doi:10.1016/j.biomaterials.2018.04.031. PMC 5944364. PMID 29704747.
- ^ Bak RO, Porteus MH (July 2017). "CRISPR-Mediated Integration of Large Gene Cassettes Using AAV Donor Vectors". Hücre Raporları. 20 (3): 750–756. doi:10.1016/j.celrep.2017.06.064. PMC 5568673. PMID 28723575.
- ^ Schmidt F, Grimm D (February 2015). "CRISPR genome engineering and viral gene delivery: a case of mutual attraction". Biyoteknoloji Dergisi. 10 (2): 258–72. doi:10.1002/biot.201400529. PMID 25663455. S2CID 37653318.
- ^ Waxmonsky N (24 September 2015). "CRISPR 101: Mammalian Expression Systems and Delivery Methods". Alındı 11 Haziran 2018.
- ^ a b Oakes BL, Nadler DC, Flamholz A, Fellmann C, Staahl BT, Doudna JA, Savage DF (June 2016). "Profiling of engineering hotspots identifies an allosteric CRISPR-Cas9 switch". Doğa Biyoteknolojisi. 34 (6): 646–51. doi:10.1038/nbt.3528. PMC 4900928. PMID 27136077.
- ^ Nuñez JK, Harrington LB, Doudna JA (March 2016). "Chemical and Biophysical Modulation of Cas9 for Tunable Genome Engineering". ACS Kimyasal Biyoloji. 11 (3): 681–8. doi:10.1021/acschembio.5b01019. PMID 26857072.
- ^ Zhou W, Deiters A (April 2016). "Conditional Control of CRISPR/Cas9 Function". Angewandte Chemie. 55 (18): 5394–9. doi:10.1002/anie.201511441. PMID 26996256.
- ^ Polstein LR, Gersbach CA (March 2015). "A light-inducible CRISPR-Cas9 system for control of endogenous gene activation". Doğa Kimyasal Biyoloji. 11 (3): 198–200. doi:10.1038/nchembio.1753. PMC 4412021. PMID 25664691.
- ^ Nihongaki Y, Yamamoto S, Kawano F, Suzuki H, Sato M (February 2015). "CRISPR-Cas9-based photoactivatable transcription system". Kimya ve Biyoloji. 22 (2): 169–74. doi:10.1016/j.chembiol.2014.12.011. PMID 25619936.
- ^ Wright AV, Sternberg SH, Taylor DW, Staahl BT, Bardales JA, Kornfeld JE, Doudna JA (March 2015). "Rational design of a split-Cas9 enzyme complex". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 112 (10): 2984–9. Bibcode:2015PNAS..112.2984W. doi:10.1073/pnas.1501698112. PMC 4364227. PMID 25713377.
- ^ Nihongaki Y, Kawano F, Nakajima T, Sato M (July 2015). "Photoactivatable CRISPR-Cas9 for optogenetic genome editing". Doğa Biyoteknolojisi. 33 (7): 755–60. doi:10.1038/nbt.3245. PMID 26076431. S2CID 205281536.
- ^ Hemphill J, Borchardt EK, Brown K, Asokan A, Deiters A (May 2015). "Optical Control of CRISPR/Cas9 Gene Editing". Amerikan Kimya Derneği Dergisi. 137 (17): 5642–5. doi:10.1021/ja512664v. PMC 4919123. PMID 25905628.
- ^ Jain PK, Ramanan V, Schepers AG, Dalvie NS, Panda A, Fleming HE, Bhatia SN (September 2016). "Development of Light-Activated CRISPR Using Guide RNAs with Photocleavable Protectors". Angewandte Chemie. 55 (40): 12440–4. doi:10.1002/anie.201606123. PMC 5864249. PMID 27554600.
- ^ Davis KM, Pattanayak V, Thompson DB, Zuris JA, Liu DR (May 2015). "Small molecule-triggered Cas9 protein with improved genome-editing specificity". Doğa Kimyasal Biyoloji. 11 (5): 316–8. doi:10.1038/nchembio.1793. PMC 4402137. PMID 25848930.
- ^ Liu KI, Ramli MN, Woo CW, Wang Y, Zhao T, Zhang X, Yim GR, Chong BY, Gowher A, Chua MZ, Jung J, Lee JH, Tan MH (November 2016). "A chemical-inducible CRISPR-Cas9 system for rapid control of genome editing". Doğa Kimyasal Biyoloji. 12 (11): 980–987. doi:10.1038/nchembio.2179. PMID 27618190. S2CID 33891039.
- ^ Truong DJ, Kühner K, Kühn R, Werfel S, Engelhardt S, Wurst W, Ortiz O (July 2015). "Development of an intein-mediated split-Cas9 system for gene therapy". Nükleik Asit Araştırması. 43 (13): 6450–8. doi:10.1093/nar/gkv601. PMC 4513872. PMID 26082496.
- ^ Zetsche B, Volz SE, Zhang F (February 2015). "A split-Cas9 architecture for inducible genome editing and transcription modulation". Doğa Biyoteknolojisi. 33 (2): 139–42. doi:10.1038/nbt.3149. PMC 4503468. PMID 25643054.
- ^ González F, Zhu Z, Shi ZD, Lelli K, Verma N, Li QV, Huangfu D (August 2014). "An iCRISPR platform for rapid, multiplexable, and inducible genome editing in human pluripotent stem cells". Hücre Kök Hücre. 15 (2): 215–26. doi:10.1016/j.stem.2014.05.018. PMC 4127112. PMID 24931489.
- ^ Dow LE, Fisher J, O'Rourke KP, Muley A, Kastenhuber ER, Livshits G, Tschaharganeh DF, Socci ND, Lowe SW (April 2015). "Inducible in vivo genome editing with CRISPR-Cas9". Doğa Biyoteknolojisi. 33 (4): 390–4. doi:10.1038/nbt.3155. PMC 4390466. PMID 25690852.
- ^ Yu C, Liu Y, Ma T, Liu K, Xu S, Zhang Y, Liu H, La Russa M, Xie M, Ding S, Qi LS (February 2015). "Small molecules enhance CRISPR genome editing in pluripotent stem cells". Hücre Kök Hücre. 16 (2): 142–7. doi:10.1016/j.stem.2015.01.003. PMC 4461869. PMID 25658371.
- ^ Maruyama T, Dougan SK, Truttmann MC, Bilate AM, Ingram JR, Ploegh HL (May 2015). "Increasing the efficiency of precise genome editing with CRISPR-Cas9 by inhibition of nonhomologous end joining". Doğa Biyoteknolojisi. 33 (5): 538–42. doi:10.1038/nbt.3190. PMC 4618510. PMID 25798939.
- ^ a b c Kurata M, Yamamoto K, Moriarity BS, Kitagawa M, Largaespada DA (February 2018). "CRISPR/Cas9 library screening for drug target discovery". İnsan Genetiği Dergisi. 63 (2): 179–186. doi:10.1038/s10038-017-0376-9. PMID 29158600. S2CID 3308058.
- ^ Hiranniramol K, Chen Y, Liu W, Wang X (January 2020). "Generalizable sgRNA design for improved CRISPR/Cas9 editing efficiency". Biyoinformatik. 36 (9): 2684–2689. doi:10.1093/bioinformatics/btaa041. PMC 7203743. PMID 31971562.
- ^ a b c Agrotis A, Ketteler R (2015-09-24). "A new age in functional genomics using CRISPR/Cas9 in arrayed library screening". Genetikte Sınırlar. 6: 300. doi:10.3389/fgene.2015.00300. PMC 4585242. PMID 26442115.
- ^ Yu JS, Yusa K (July 2019). "Genome-wide CRISPR-Cas9 screening in mammalian cells". Yöntemler. 164–165: 29–35. doi:10.1016/j.ymeth.2019.04.015. PMID 31034882.
- ^ Joung J, Konermann S, Gootenberg JS, Abudayyeh OO, Platt RJ, Brigham MD, et al. (Nisan 2017). "Genome-scale CRISPR-Cas9 knockout and transcriptional activation screening". Doğa Protokolleri. 12 (4): 828–863. doi:10.1038/nprot.2017.016. PMC 5526071. PMID 28333914.
- ^ Joung J, Konermann S, Gootenberg JS, Abudayyeh OO, Platt RJ, Brigham MD, et al. (Nisan 2017). "Genome-scale CRISPR-Cas9 knockout and transcriptional activation screening". Doğa Protokolleri. 12 (4): 828–863. doi:10.1038/nprot.2017.016. PMC 5526071. PMID 28333914.
- ^ "Addgene: Pooled Libraries". www.addgene.org. Alındı 2020-01-31.
- ^ McDade JR, Waxmonsky NC, Swanson LE, Fan M (July 2016). "Practical Considerations for Using Pooled Lentiviral CRISPR Libraries". Moleküler Biyolojinin Güncel Protokolleri. 115 (1): 31.5.1–31.5.13. doi:10.1002/cpmb.8. PMID 27366891. S2CID 5055878.
- ^ Cheng AW, Wang H, Yang H, Shi L, Katz Y, Theunissen TW, et al. (Ekim 2013). "Multiplexed activation of endogenous genes by CRISPR-on, an RNA-guided transcriptional activator system". Hücre Araştırması. 23 (10): 1163–71. doi:10.1038/cr.2013.122. PMC 3790238. PMID 23979020.
- ^ Gilbert LA, Horlbeck MA, Adamson B, Villalta JE, Chen Y, Whitehead EH, et al. (Ekim 2014). "Genome-Scale CRISPR-Mediated Control of Gene Repression and Activation". Hücre. 159 (3): 647–61. doi:10.1016/j.cell.2014.09.029. PMC 4253859. PMID 25307932.
- ^ a b Dow LE (October 2015). "Modeling Disease In Vivo With CRISPR/Cas9". Moleküler Tıpta Eğilimler. 21 (10): 609–621. doi:10.1016/j.molmed.2015.07.006. PMC 4592741. PMID 26432018.
- ^ Doudna J, Mali P (2016). CRISPR-Cas : a laboratory manual. Cold Spring Harbor, New York. ISBN 9781621821304. OCLC 922914104.
- ^ Zuo E, Huo X, Yao X, Hu X, Sun Y, Yin J, et al. (2017). "CRISPR/Cas9-mediated targeted chromosome elimination". Genom Biyolojisi. 18 (1): 224. doi:10.1186/s13059-017-1354-4. PMC 5701507. PMID 29178945. Lay özeti – Genome Web.
- ^ Javed MR, Sadaf M, Ahmed T, Jamil A, Nawaz M, Abbas H, Ijaz A (August 2018). "CRISPR-Cas System: History and Prospects as a Genome Editing Tool in Microorganisms". gözden geçirmek. Güncel Mikrobiyoloji. 75 (12): 1675–1683. doi:10.1007/s00284-018-1547-4. PMID 30078067. S2CID 51920661.
- ^ Giersch RM, Finnigan GC (December 2017). "Yeast Still a Beast: Diverse Applications of CRISPR/Cas Editing Technology in S. cerevisiae". The Yale Journal of Biology and Medicine. 90 (4): 643–651. PMC 5733842. PMID 29259528.
- ^ Raschmanová H, Weninger A, Glieder A, Kovar K, Vogl T (2018). "Implementing CRISPR-Cas technologies in conventional and non-conventional yeasts: Current state and future prospects". gözden geçirmek. Biyoteknoloji Gelişmeleri. 36 (3): 641–665. doi:10.1016/j.biotechadv.2018.01.006. PMID 29331410.
- ^ a b Ma D, Liu F (December 2015). "Genome Editing and Its Applications in Model Organisms". gözden geçirmek. Genomics, Proteomics & Bioinformatics. 13 (6): 336–44. doi:10.1016/j.gpb.2015.12.001. PMC 4747648. PMID 26762955.
- ^ Khurshid H, Jan SA, Shinwari ZK, Jamal M, Shah SH (2018). "An Era of CRISPR/ Cas9 Mediated Plant Genome Editing". gözden geçirmek. Moleküler Biyolojide Güncel Sorunlar. 26: 47–54. doi:10.21775/cimb.026.047. PMID 28879855.
- ^ Simone BW, Martínez-Gálvez G, WareJoncas Z, Ekker SC (August 2018). "Fishing for understanding: Unlocking the zebrafish gene editor's toolbox". gözden geçirmek. Yöntemler. 150: 3–10. doi:10.1016/j.ymeth.2018.07.012. PMC 6590056. PMID 30076892.
- ^ Singh P, Schimenti JC, Bolcun-Filas E (January 2015). "A mouse geneticist's practical guide to CRISPR applications". gözden geçirmek. Genetik. 199 (1): 1–15. doi:10.1534/genetics.114.169771. PMC 4286675. PMID 25271304.
- ^ Soni D, Wang DM, Regmi SC, Mittal M, Vogel SM, Schlüter D, Tiruppathi C (May 2018). "Deubiquitinase function of A20 maintains and repairs endothelial barrier after lung vascular injury". Cell Death Discovery. 4 (60): 60. doi:10.1038/s41420-018-0056-3. PMC 5955943. PMID 29796309.
- ^ Gao X, Tao Y, Lamas V, Huang M, Yeh WH, Pan B, et al. (2018). "Treatment of autosomal dominant hearing loss by in vivo delivery of genome editing agents". Doğa. 553 (7687): 217–221. Bibcode:2018Natur.553..217G. doi:10.1038/nature25164. PMC 5784267. PMID 29258297.
- ^ Kadam US, Shelake RM, Chavhan RL, Suprasanna P (October 2018). "Concerns regarding 'off-target' activity of genome editing endonucleases". gözden geçirmek. Bitki Fizyolojisi ve Biyokimyası. 131: 22–30. doi:10.1016/j.plaphy.2018.03.027. PMID 29653762.
- ^ Kimberland ML, Hou W, Alfonso-Pecchio A, Wilson S, Rao Y, Zhang S, Lu Q (August 2018). "Strategies for controlling CRISPR/Cas9 off-target effects and biological variations in mammalian genome editing experiments". gözden geçirmek. Biyoteknoloji Dergisi. 284: 91–101. doi:10.1016/j.jbiotec.2018.08.007. PMID 30142414.
- ^ van Erp PB, Bloomer G, Wilkinson R, Wiedenheft B (June 2015). "The history and market impact of CRISPR RNA-guided nucleases". Virolojide Güncel Görüş. 12: 85–90. doi:10.1016/j.coviro.2015.03.011. PMC 4470805. PMID 25914022.
- ^ Maggio I, Gonçalves MA (May 2015). "Genome editing at the crossroads of delivery, specificity, and fidelity". Biyoteknolojideki Eğilimler. 33 (5): 280–91. doi:10.1016/j.tibtech.2015.02.011. PMID 25819765.
- ^ Rath D, Amlinger L, Rath A, Lundgren M (October 2015). "The CRISPR-Cas immune system: biology, mechanisms and applications". Biochimie. 117: 119–28. doi:10.1016/j.biochi.2015.03.025. PMID 25868999.
- ^ "What Is CRISPR? How Does It Work? Is It Gene Editing? » LiveScience.Tech". LiveScience.Tech. 2018-04-30. Alındı 2020-02-06.
- ^ a b Freedman BS, Brooks CR, Lam AQ, Fu H, Morizane R, Agrawal V, et al. (Ekim 2015). "Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids". Doğa İletişimi. 6: 8715. Bibcode:2015NatCo...6.8715F. doi:10.1038/ncomms9715. PMC 4620584. PMID 26493500.
- ^ Cruz NM, Song X, Czerniecki SM, Gulieva RE, Churchill AJ, Kim YK, et al. (Kasım 2017). "Organoid cystogenesis reveals a critical role of microenvironment in human polycystic kidney disease". Doğa Malzemeleri. 16 (11): 1112–1119. Bibcode:2017NatMa..16.1112C. doi:10.1038/nmat4994. PMC 5936694. PMID 28967916.
- ^ Kim YK, Refaeli I, Brooks CR, Jing P, Gulieva RE, Hughes MR, et al. (Aralık 2017). "Gene-Edited Human Kidney Organoids Reveal Mechanisms of Disease in Podocyte Development". Kök hücreler. 35 (12): 2366–2378. doi:10.1002/stem.2707. PMC 5742857. PMID 28905451.
- ^ Bellin M, Casini S, Davis RP, D'Aniello C, Haas J, Ward-van Oostwaard D, Tertoolen LG, Jung CB, Elliott DA, Welling A, Laugwitz KL, Moretti A, Mummery CL (December 2013). "Isogenic human pluripotent stem cell pairs reveal the role of a KCNH2 mutation in long-QT syndrome". EMBO Dergisi. 32 (24): 3161–75. doi:10.1038/emboj.2013.240. PMC 3981141. PMID 24213244.
- ^ Cai L, Fisher AL, Huang H, Xie Z (December 2016). "CRISPR-mediated genome editing and human diseases". Genes & Diseases. 3 (4): 244–251. doi:10.1016/j.gendis.2016.07.003. PMC 6150104. PMID 30258895.
- ^ "Seven Diseases That CRISPR Technology Could Cure". Labiotech.eu. 2018-06-25. Alındı 2018-08-22.
- ^ a b "CRISPR/Cas9 and Cancer". Immuno-Oncology News. 2018-04-27. Alındı 2019-02-18.
- ^ Xie F, Ye L, Chang JC, Beyer AI, Wang J, Muench MO, Kan YW (September 2014). "Seamless gene correction of β-thalassemia mutations in patient-specific iPSCs using CRISPR/Cas9 and piggyBac". Genom Araştırması. 24 (9): 1526–33. doi:10.1101/gr.173427.114. PMC 4158758. PMID 25096406.
- ^ Dever DP, Bak RO, Reinisch A, Camarena J, Washington G, Nicolas CE, Pavel-Dinu M, Saxena N, Wilkens AB, Mantri S, Uchida N, Hendel A, Narla A, Majeti R, Weinberg KI, Porteus MH (2016-11-17). "CRISPR/Cas9 β-globin gene targeting in human haematopoietic stem cells". Doğa. 539 (7629): 384–389. Bibcode:2016Natur.539..384D. doi:10.1038/nature20134. PMC 5898607. PMID 27820943.
- ^ "CRISPR "One Shot Cell Therapy for Hemophilia Developed | GEN". GEN. 2018-05-02. Alındı 2018-08-22.
- ^ Marangi M, Pistritto G (2018-04-20). "Innovative Therapeutic Strategies for Cystic Fibrosis: Moving Forward to CRISPR Technique". Farmakolojide Sınırlar. 9: 396. doi:10.3389/fphar.2018.00396. PMC 5920621. PMID 29731717.
- ^ Bengtsson NE, Hall JK, Odom GL, Phelps MP, Andrus CR, Hawkins RD, Hauschka SD, Chamberlain JR, Chamberlain JS (February 2017). "Muscle-specific CRISPR/Cas9 dystrophin gene editing ameliorates pathophysiology in a mouse model for Duchenne muscular dystrophy". Doğa İletişimi. 8: 14454. Bibcode:2017NatCo...814454B. doi:10.1038/ncomms14454. PMC 5316861. PMID 28195574.
- ^ Eisenstein M (May 2018). "CRISPR takes on Huntington's disease". Doğa. 557 (7707): S42–S43. Bibcode:2018Natur.557S..42E. doi:10.1038/d41586-018-05177-y. PMID 29844549.
- ^ Dabrowska M, Juzwa W, Krzyzosiak WJ, Olejniczak M (2018). "Precise Excision of the CAG Tract from the Huntingtin Gene by Cas9 Nickases". Sinirbilimde Sınırlar. 12: 75. doi:10.3389/fnins.2018.00075. PMC 5834764. PMID 29535594.
- ^ King A (March 2018). "A CRISPR edit for heart disease". Doğa. 555 (7695): S23–S25. Bibcode:2018Natur.555.....K. doi:10.1038/d41586-018-02482-4. PMID 29517035.
- ^ Abrahimi P, Chang WG, Kluger MS, Qyang Y, Tellides G, Saltzman WM, Pober JS (July 2015). "Efficient gene disruption in cultured primary human endothelial cells by CRISPR/Cas9". Dolaşım Araştırması. 117 (2): 121–8. doi:10.1161/CIRCRESAHA.117.306290. PMC 4490936. PMID 25940550.
- ^ Gomaa AA, Klumpe HE, Luo ML, Selle K, Barrangou R, Beisel CL (January 2014). "Programmable removal of bacterial strains by use of genome-targeting CRISPR-Cas systems". mBio. 5 (1): e00928–13. doi:10.1128/mBio.00928-13. PMC 3903277. PMID 24473129.
- ^ Citorik RJ, Mimee M, Lu TK (November 2014). "Sequence-specific antimicrobials using efficiently delivered RNA-guided nucleases". Doğa Biyoteknolojisi. 32 (11): 1141–5. doi:10.1038/nbt.3011. hdl:1721.1/100834. PMC 4237163. PMID 25240928.
- ^ a b Gholizadeh P, Aghazadeh M, Asgharzadeh M, Kafil HS (October 2017). "Suppressing the CRISPR/Cas adaptive immune system in bacterial infections". Avrupa Klinik Mikrobiyoloji ve Enfeksiyon Hastalıkları Dergisi. 36 (11): 2043–2051. doi:10.1007/s10096-017-3036-2. PMID 28601970. S2CID 22716314.
- ^ Gibney, Elizabeth (January 2, 2018). "What to expect in 2018: science in the new year". Doğa. 553 (7686): 12–13. Bibcode:2018Natur.553...12G. doi:10.1038/d41586-018-00009-5. PMID 29300040.
- ^ Taylor, Phil (Jan 3, 2019). "J&J takes stake in Locus' CRISPR-based 'Pac-Man' antimicrobials". Fierce Biotech. Alındı 27 Şubat 2019.
- ^ Reardon Sara (2017). "Modified viruses deliver death to antibiotic-resistant bacteria". Doğa. 546 (7660): 586–587. Bibcode:2017Natur.546..586R. doi:10.1038/nature.2017.22173. PMID 28661508.
- ^ van Diemen FR, Kruse EM, Hooykaas MJ, Bruggeling CE, Schürch AC, van Ham PM, Imhof SM, Nijhuis M, Wiertz EJ, Lebbink RJ (2016). "CRISPR/Cas9-Mediated Genome Editing of Herpesviruses Limits Productive and Latent Infections". PLOS Patojenleri. 12 (6): e1005701. doi:10.1371/journal.ppat.1005701. PMC 4928872. PMID 27362483. Lay özeti – PLOS Media YouTube Channel.
- ^ a b c Science News Staff (December 17, 2015). "And Science's Breakthrough of the Year is …". news.sciencemag.org. Alındı 2015-12-21.
- ^ Mullin E. "Using CRISPR on pigs could make their organs safer for human transplant". MIT Technology Review. Alındı 2017-09-09.
- ^ Reardon S (2016). "First CRISPR clinical trial gets green light from US panel". Doğa. doi:10.1038/nature.2016.20137. S2CID 89466280.
- ^ Dominguez AA, Lim WA, Qi LS (January 2016). "Beyond editing: repurposing CRISPR-Cas9 for precision genome regulation and interrogation". Doğa İncelemeleri Moleküler Hücre Biyolojisi. 17 (1): 5–15. doi:10.1038/nrm.2015.2. PMC 4922510. PMID 26670017.
- ^ Shalem O, Sanjana NE, Hartenian E, Shi X, Scott DA, Mikkelsen TS, Heckl D, Ebert BL, Root DE, Doench JG, Zhang F (January 2014). "Genome-scale CRISPR-Cas9 knockout screening in human cells". Bilim. 343 (6166): 84–7. Bibcode:2014Sci...343...84S. doi:10.1126/science.1247005. PMC 4089965. PMID 24336571.
- ^ a b Pennisi E (August 2013). "The CRISPR craze". News Focus. Bilim. 341 (6148): 833–6. Bibcode:2013Sci...341..833P. doi:10.1126/science.341.6148.833. PMID 23970676.
- ^ a b Zimmer C (2016-06-03). "Scientists Find Form of Crispr Gene Editing With New Capabilities". New York Times. ISSN 0362-4331. Alındı 2016-06-10.
- ^ Pickar-Oliver A, Gersbach CA (August 2019). "The next generation of CRISPR-Cas technologies and applications". Doğa Yorumları. Moleküler Hücre Biyolojisi. 20 (8): 490–507. doi:10.1038/s41580-019-0131-5. PMC 7079207. PMID 31147612.
- ^ Basak J, Nithin C (2015). "Targeting Non-Coding RNAs in Plants with the CRISPR-Cas Technology is a Challenge yet Worth Accepting". Bitki Biliminde Sınırlar. 6: 1001. doi:10.3389/fpls.2015.01001. PMC 4652605. PMID 26635829.
- ^ Akbari OS, Bellen HJ, Bier E, Bullock SL, Burt A, Church GM, et al. (Ağustos 2015). "BIOSAFETY. Safeguarding gene drive experiments in the laboratory". Bilim. 349 (6251): 927–9. Bibcode:2015Sci...349..927A. doi:10.1126/science.aac7932. PMC 4692367. PMID 26229113.
- ^ Caplan AL, Parent B, Shen M, Plunkett C (November 2015). "No time to waste--the ethical challenges created by CRISPR: CRISPR/Cas, being an efficient, simple, and cheap technology to edit the genome of any organism, raises many ethical and regulatory issues beyond the use to manipulate human germ line cells". EMBO Raporları. 16 (11): 1421–6. doi:10.15252/embr.201541337. PMC 4641494. PMID 26450575.
- ^ Oye KA, Esvelt K, Appleton E, Catteruccia F, Church G, Kuiken T, et al. (Ağustos 2014). "Biotechnology. Regulating gene drives". Bilim. 345 (6197): 626–8. Bibcode:2014Sci...345..626O. doi:10.1126/science.1254287. PMID 25035410.
- ^ Gu W, Crawford ED, O'Donovan BD, Wilson MR, Chow ED, Retallack H, DeRisi JL (March 2016). "Depletion of Abundant Sequences by Hybridization (DASH): using Cas9 to remove unwanted high-abundance species in sequencing libraries and molecular counting applications". Genom Biyolojisi. 17: 41. doi:10.1186/s13059-016-0904-5. PMC 4778327. PMID 26944702.
- ^ Anzalone AV, Randolph PB, Davis JR, Sousa AA, Koblan LW, Levy JM, Chen PJ, Wilson C, Newby GA, Raguram A, Liu DR (2019). "Search-and-replace genome editing without double-strand breaks or donor DNA". Doğa. 576 (7785): 149–157. Bibcode:2019Natur.576..149A. doi:10.1038/s41586-019-1711-4. PMC 6907074. PMID 31634902.
- ^ A New Gene Editing Tool Could Make CRISPR More Precise. Lila Thulin, The Smithsonian Magazine. 21 Ekim 2019.
- ^ a b New 'prime' genome editor could surpass CRISPR. Jon Cohen, Bilim. 21 Ekim 2019.
- ^ a b New "Prime Editing" Method Makes Only Single-Stranded DNA Cuts. Emma Yasinski, Bilim insanı. 21 Ekim 2019.
- ^ a b Prime editing: DNA tool could correct 89% of genetic defects. James Gallagher, BBC haberleri. 21 Ekim 2019.
- ^ Regalado A (March 5, 2015). "Engineering the Perfect Baby". MIT Technology Review.
- ^ Baltimore D, Berg P, Botchan M, Carroll D, Charo RA, Church G, Corn JE, Daley GQ, Doudna JA, Fenner M, Greely HT, Jinek M, Martin GS, Penhoet E, Puck J, Sternberg SH, Weissman JS, Yamamoto KR (April 2015). "Biotechnology. A prudent path forward for genomic engineering and germline gene modification". Bilim. 348 (6230): 36–8. Bibcode:2015Sci...348...36B. doi:10.1126/science.aab1028. PMC 4394183. PMID 25791083.
- ^ Lanphier E, Urnov F, Haecker SE, Werner M, Smolenski J (March 2015). "Don't edit the human germ line". Doğa. 519 (7544): 410–1. Bibcode:2015Natur.519..410L. doi:10.1038/519410a. PMID 25810189.
- ^ Wade N (19 March 2015). "Scientists Seek Ban on Method of Editing the Human Genome". New York Times. Alındı 20 Mart 2015.
The biologists writing in Science support continuing laboratory research with the technique, and few if any scientists believe it is ready for clinical use.
- ^ Liang P, Xu Y, Zhang X, Ding C, Huang R, Zhang Z, Lv J, Xie X, Chen Y, Li Y, Sun Y, Bai Y, Songyang Z, Ma W, Zhou C, Huang J (May 2015). "CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes". Protein ve Hücre. 6 (5): 363–72. doi:10.1007/s13238-015-0153-5. PMC 4417674. PMID 25894090.
- ^ Kolata G (23 April 2015). "Chinese Scientists Edit Genes of Human Embryos, Raising Concerns". New York Times. Alındı 24 Nisan 2015.
- ^ a b Cyranoski D, Reardon S (2015). "Chinese scientists genetically modify human embryos". Doğa. doi:10.1038/nature.2015.17378. S2CID 87604469.
- ^ Regalado A (2016-05-08). "Chinese Researchers Experiment with Making HIV-Proof Embryos". MIT Technology Review. Alındı 2016-06-10.
- ^ "International Summit on Gene Editing". Ulusal Bilimler, Mühendislik ve Tıp Akademileri. 3 Aralık 2015. Alındı 3 Aralık 2015.
- ^ Brokowski, Carolyn (April 2018). "Do CRISPR Germline Ethics Statements Cut It?". CRISPR Journal. 1 (2): 115–125. doi:10.1089/crispr.2017.0024. PMC 6694771. PMID 31021208.
- ^ Begley S (28 November 2018). "Amid uproar, Chinese scientist defends creating gene-edited babies". STAT.
- ^ editor, Ian Sample Science (13 March 2019). "Scientists call for global moratorium on gene editing of embryos". Theguardian.com. Alındı 14 Mart 2019.CS1 bakimi: ek metin: yazarlar listesi (bağlantı)
- ^ Callaway E (February 2016). "UK scientists gain licence to edit genes in human embryos". Doğa. 530 (7588): 18. Bibcode:2016Natur.530...18C. doi:10.1038/nature.2016.19270. PMID 26842037.
- ^ McHughen A, Smyth S (January 2008). "US regulatory system for genetically modified [genetically modified organism (GMO), rDNA or transgenic] crop cultivars". Plant Biotechnology Journal. 6 (1): 2–12. doi:10.1111/j.1467-7652.2007.00300.x. PMID 17956539. S2CID 3210837.
- ^ USDA. "Re: Request to confirm" (PDF).
- ^ Waltz E (2016). "Gene-edited CRISPR mushroom escapes US regulation". Doğa. 532 (7599): 293. Bibcode:2016Natur.532..293W. doi:10.1038/nature.2016.19754. PMID 27111611.
- ^ Ledford H (April 2016). "Gene-editing surges as US rethinks regulations". Doğa. 532 (7598): 158–9. Bibcode:2016Natur.532..158L. doi:10.1038/532158a. PMID 27075074.
- ^ "The FDA Is Cracking Down On Rogue Genetic Engineers", Kristen V. Brown. Gizmodo. February 1, 2017. Retrieved 5 feb 2017
- ^ "Guidance for Industry #187 / Regulation of Intentionally Altered Genomic DNA in Animals" (PDF). 2020-02-11.
- ^ Cyranoski D (2017). "China's embrace of embryo selection raises thorny questions". Doğa. 548 (7667): 272–274. Bibcode:2017Natur.548..272C. doi:10.1038/548272a. PMID 28816265.
- ^ Peng Y (2016). "The morality and ethics governing CRISPR-Cas9 patents in China". Doğa Biyoteknolojisi. 34 (6): 616–8. doi:10.1038/nbt.3590. PMID 27281418. S2CID 38509820.
- ^ Rana P, Marcus AD, Fan W (2018-01-21). "China, Unhampered by Rules, Races Ahead in Gene-Editing Trials". Wall Street Journal. ISSN 0099-9660. Alındı 2018-01-23.
- ^ Talbot D (2016). "Precise Gene Editing in Plants/ 10 Breakthrough Technologies 2016". MIT Technology review. Massachusetts Teknoloji Enstitüsü. Alındı 18 Mart 2016.
- ^ Larson C, Schaffer A (2014). "Genome Editing/ 10 Breakthrough Technologies 2014". Massachusetts Teknoloji Enstitüsü. Alındı 18 Mart 2016.
- ^ 良艮創意, 很好設計, 李維宗設計. "Tang Prize Laureates". www.tang-prize.org. Alındı 2018-08-05.
- ^ "Press release: The Nobel Prize in Chemistry 2020". Nobel Vakfı. Alındı 7 Ekim 2020.
