MMP1 - MMP1
Matris metaloproteinaz-1 (MMP-1) olarak da bilinir interstisyel kollajenaz ve fibroblast kollajenaz bir enzim insanlarda kodlanır MMP1 gen.[5][6][7] Gen, kromozom 11q22.3'e lokalize olan bir MMP genleri kümesinin parçasıdır.[5] MMP-1, hem protein olarak homojenliğe kadar saflaştırılan hem de bir cDNA olarak klonlanan ilk omurgalı kolajenazıdır.[8][9]
Yapısal özellikler
MMP-1, bir ön alan, bir ön alan, bir katalitik alan, bir bağlayıcı bölge ve bir hemopeksin benzeri alan.[10] MMP-1'in birincil yapısı ilk olarak Goldberg, G I, et al.[9] Birincil yapı için iki ana isimlendirme şu anda kullanımdadır, ilk amino asidin sinyal peptidi ile başladığı orijinal isim ve ikinci amino-asidin prodomain'den saymaya başladığı ikinci isim (proenzim isimlendirme).
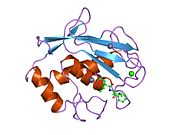
Katalitik Alan
MMP'lerin Katalitik Alanları, ~ 40 Å çapında genel bir yassı elipsoid şekline sahip çok benzer özellikleri paylaşır.[11] MMP'lerin Katalitik alanlarının benzerliğine rağmen, bu giriş yalnızca MMP-1 Katalitik Alanın yapısal özelliklerine odaklanacaktır.
Genel Yapısal Özellikler
MMP-1'in Katalitik Alanı, beş yüksek bükülmüş β-ipliği (sI-sV), üç α-heliks (hA-hC) ve toplamda beş metal iyonu, üç Ca içeren toplam sekiz döngüden oluşur.2+ ve iki Zn2+biri katalitik rol oynar.[12]
MMP-1'in Katalitik Alanı (CAT), CAT alanının N-terminal halkasının ilk amino asidi olarak F100 (kesilmemiş CAT) ile başlar. CAT alanının ilk yayınlanan x-ışını yapısı, ilk 7 amino asidin bulunmadığı bu alanın kesik formunun temsilcisiydi.[12]
İlk döngüden sonra, diziler ilk ve en uzun β-sayfayı (sI) izler. İkinci bir döngü, uzunlamasına protein bölgesini kapsayan büyük "amfipatik a-heliks" ten (hA) önce gelir. Β-sarmalları sII ve sIII, ilgili döngülerle ayrılır, döngü 4 genel olarak sII'yi sIII'e köprüleyen "kısa döngü" olarak adlandırılır. SIII sarmalını takiben dizi, peptit yapısı ve katalitik aktivite için birincil öneme sahip olan "S-şekilli çift döngü" ile karşılaşır (daha fazla bakın), çünkü yarık tarafındaki "şişkinlik" e doğru uzanır ve tek antiparalel str-sarmalına devam eder. Ana zincir oluşturarak peptidik substratları veya inhibitörleri bağlamak için birincil önem taşıyan sIV hidrojen bağı. SIV'yi takiben, döngü Gln186-Gly192 ve β-sarmal sV, proteinde bulunan birkaç metal iyonuna birçok ligandla katkıda bulunmaktan sorumludur (daha fazla bilgi edinin). MMP ailesi içinde substrat özgüllüğünde önemi kanıtlanmış sV'yi büyük bir açık döngü izler.[13] Spesifik bir bölge (183) RWTNNFREY (191), kolajenolitik aktivitenin ekspresyonu için kritik bir matris metaloproteinaz 1 segmenti olarak tanımlanmıştır.[14] CAT Alanının C-terminal kısmında, "aktif bölge sarmalı" olarak bilinen hB a-heliks, "çinko bağlama konsensüs sekansı" HEXXHXXGXXH'nin bir parçasını kapsar. Metzincin üst ailesi.[15][16] Α-helix hB, alanın son döngüsünün başladığı Gly225'te aniden biter. Bu son döngü MMP ailesindeki en kısa olan "özgüllük döngüsünü" içerir. Katalitik Alan, α-helix hC ile Gly261'de biter.
Fonksiyon
MMP'ler arızasına karışıyorlar hücre dışı matris embriyonik gelişim, üreme ve doku yeniden şekillenmesi gibi normal fizyolojik süreçlerin yanı sıra artrit ve metastaz gibi hastalık süreçlerinde. MMP-1 özellikle geçiş reklamını parçalara ayırır kolajenler türler I, II ve III.
 Matris metaloproteinaz 1 in indüksiyonu sıçan tarafından kornealar siprofloksasin, ofloksasin ve levofloksasin (b, c, d) ile karşılaştırıldığında yapay gözyaşları (a). Reviglio ve diğerleri, 2003. |
Yönetmelik
Mekanik kuvvet, insan periodontal ligament hücrelerinde MMP1 ekspresyonunu artırabilir.[17]
Etkileşimler
MMP1'in etkileşim ile CD49b.[18][19]
Referanslar
- ^ a b c GRCh38: Ensembl sürümü 89: ENSG00000196611 - Topluluk, Mayıs 2017
- ^ a b c GRCm38: Topluluk sürümü 89: ENSMUSG00000043089 - Topluluk, Mayıs 2017
- ^ "İnsan PubMed Referansı:". Ulusal Biyoteknoloji Bilgi Merkezi, ABD Ulusal Tıp Kütüphanesi.
- ^ "Mouse PubMed Referansı:". Ulusal Biyoteknoloji Bilgi Merkezi, ABD Ulusal Tıp Kütüphanesi.
- ^ a b EntrezGene 4312
- ^ Brinckerhoff CE, Ruby PL, Austin SD, Fini ME, White HD (Şubat 1987). "İnsan sinovyal hücre kollajenazının moleküler klonlanması ve genomik DNA'dan tek bir genin seçilmesi". J. Clin. Yatırım. 79 (2): 542–6. doi:10.1172 / JCI112845. PMC 424122. PMID 3027129.
- ^ Pendás AM, Santamaría I, Alvarez MV, Pritchard M, López-Otín C (Ekim 1996). "Kromozom 11q22.3 üzerinde kümelenmiş insan matriks metaloproteinaz genlerinin ince fiziksel haritalaması". Genomik. 37 (2): 266–8. doi:10.1006 / geno.1996.0557. PMID 8921407.
- ^ Gross J, Lapiere CM (Haziran 1962). "Amfibi dokularda kollajenolitik aktivite: bir doku kültürü analizi". Proc. Natl. Acad. Sci. AMERİKA BİRLEŞİK DEVLETLERİ. 48 (6): 1014–22. doi:10.1073 / pnas.48.6.1014. PMC 220898. PMID 13902219.
- ^ a b Goldberg GI, Wilhelm SM, Kronberger A, Bauer EA, Grant GA, Eisen AZ (Mayıs 1986). "İnsan fibroblast kolajenazı. Bir onkojen transformasyonunun neden olduğu sıçan proteinine tam birincil yapı ve homoloji". J. Biol. Kimya. 261 (14): 6600–5. PMID 3009463.
- ^ Li J, Brick P, O'Hare MC, Skarzynski T, Lloyd LF, Curry VA, Clark IM, Bigg HF, Hazleman BL, Cawston TE (Haziran 1995). "Tam uzunlukta domuz sinovyal kollajenazın yapısı, kalsiyum bağlantılı, dört kanatlı bir beta pervane içeren bir C-terminal alanını ortaya çıkarır". Yapısı. 3 (6): 541–9. doi:10.1016 / S0969-2126 (01) 00188-5. PMID 8590015.
- ^ Tallant C, Marrero A, Gomis-Rüth FX (Ocak 2010). "Matris metaloproteinazlar: katalitik alanlarının katlanması ve işlevi". Biochim. Biophys. Açta. 1803 (1): 20–8. doi:10.1016 / j.bbamcr.2009.04.003. PMID 19374923.
- ^ a b Spurlino JC, Smallwood AM, Carlton DD, Banks TM, Vavra KJ, Johnson JS, Cook ER, Falvo J, Wahl RC, Pulvino TA (Haziran 1994). "1.56 Olgun kesilmiş insan fibroblast kolajenazının bir yapısı". Proteinler. 19 (2): 98–109. doi:10.1002 / prot.340190203. PMID 8090713. S2CID 23973090.
- ^ Maskos K, Bode W (Kasım 2003). "Matris metaloproteinazların yapısal temeli ve metaloproteinazların doku inhibitörleri". Mol. Biyoteknol. 25 (3): 241–66. doi:10,1385 / MB: 25: 3: 241. PMID 14668538. S2CID 24110599.
- ^ Chung L, Shimokawa K, Dinakarpandian D, Grams F, Fields GB, Nagase H (Eylül 2000). "(183) RWTNNFREY (191) bölgesinin, kolajenolitik aktivitenin ekspresyonu için matris metaloproteinaz 1'in kritik bir segmenti olarak tanımlanması". J. Biol. Kimya. 275 (38): 29610–7. doi:10.1074 / jbc.M004039200. PMID 10871619.
- ^ Bode W, Gomis-Rüth FX, Stöckler W (Eylül 1993). "Astasinler, serralysinler, yılan zehiri ve matriks metaloproteinazlar, özdeş çinko bağlama ortamları (HEXXHXXGXXH ve Met-turn) ve topolojileri sergiler ve ortak bir aile olan 'metzincinler olarak gruplandırılmalıdır.'". FEBS Lett. 331 (1–2): 134–40. doi:10.1016 / 0014-5793 (93) 80312-I. PMID 8405391. S2CID 27244239.
- ^ Stöcker W, Grams F, Baumann U, Reinemer P, Gomis-Rüth FX, McKay DB, Bode W (Mayıs 1995). "Metzincinler - astasinler, adamalisinler, serralisinler ve matriksinler (kolajenazlar) arasındaki topolojik ve ardışık ilişkiler, çinko-peptidazların bir süper ailesini tanımlar". Protein Bilimi. 4 (5): 823–40. doi:10.1002 / pro.5560040502. PMC 2143131. PMID 7663339.
- ^ Huang SF, Li YH, Ren YJ, Cao ZG, Long X (Ağustos 2008). "Matris metaloproteinaz-1 (MMP-1) promotöründeki tek bir nükleotid polimorfizminin, insan periodontal ligament hücrelerinde kuvvetle indüklenen MMP-1 ekspresyonu üzerindeki etkisi". Avro. J. Oral Sci. 116 (4): 319–23. doi:10.1111 / j.1600-0722.2008.00552.x. PMID 18705799.
- ^ Stricker TP, Dumin JA, Dickeson SK, Chung L, Nagase H, Parks WC, Santoro SA (Ağustos 2001). "Alfa (2) integrin I alanı / prokollajenaz-1 (matris metaloproteinaz-1) etkileşiminin yapısal analizi". J. Biol. Kimya. 276 (31): 29375–81. doi:10.1074 / jbc.M102217200. PMID 11359774.
- ^ Dumin JA, Dickeson SK, Stricker TP, Bhattacharyya-Pakrasi M, Roby JD, Santoro SA, Parks WC (Ağustos 2001). "Pro-kolajenaz-1 (matris metaloproteinaz-1), tip I kolajen üzerinde göç eden keratinositlerden salındığında alfa (2) beta (1) integrini bağlar". J. Biol. Kimya. 276 (31): 29368–74. doi:10.1074 / jbc.M104179200. PMID 11359786.
daha fazla okuma
- Krane SM (1995). "Kolajenaz (matriks metalloproteinaz-1) kemik ve diğer bağ dokusu yeniden şekillenmesi için gerekli midir?". Clin. Ortopedi. Relat. Res. (313): 47–53. PMID 7641497.
- Massova I, Kotra LP, Fridman R, Mobashery S (1998). "Matris metaloproteinazlar: yapılar, evrim ve çeşitlendirme". FASEB J. 12 (25n26): 1075–95. CiteSeerX 10.1.1.31.3959. doi:10.1142 / S0217984998001256. PMID 9737711.
- Nagase H, Woessner JF (1999). "Matris metaloproteinazlar". J. Biol. Kimya. 274 (31): 21491–4. doi:10.1074 / jbc.274.31.21491. PMID 10419448.
- Okada Y, Hashimoto G (2001). "[Matris metaloproteinazlar tarafından hücre dışı matrisin bozulması ve eklem yıkımı]". Seikagaku. 73 (11): 1309–21. PMID 11831026.
- Seiki M (2003). "Membran tipi 1 matris metaloproteinaz: tümör istilası için anahtar bir enzim". Yengeç Harfi. 194 (1): 1–11. doi:10.1016 / S0304-3835 (02) 00699-7. PMID 12706853.
- Golubkov VS, Strongin AY (2007). "Proteoliz kaynaklı onkogenez". Hücre döngüsü. 6 (2): 147–50. doi:10.4161 / cc.6.2.3706. PMID 17245132.
Dış bağlantılar
- MEROPS peptidazlar ve inhibitörleri için çevrimiçi veritabanı: M10.001
- Mevcut tüm yapısal bilgilere genel bakış PDB için UniProt: P03956 (Geçişli kolajenaz) PDBe-KB.