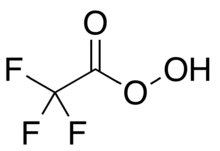
Trifloroperasetik asit - Trifluoroperacetic acid
 | |
| İsimler | |
|---|---|
| IUPAC adı 2,2,2-trifloroetaneperoksoik asit | |
Diğer isimler
| |
| Tanımlayıcılar | |
3 boyutlu model (JSmol ) | |
| ChemSpider | |
PubChem Müşteri Kimliği | |
| |
| |
| Özellikleri | |
| C2HF3Ö3 | |
| Molar kütle | 130.022 g · mol−1 |
| Görünüm | renksiz sıvı |
| Kaynama noktası | 162 ° C (324 ° F; 435 K) |
| Çözünürlük | içinde çözünür asetonitril, diklorometan, dietil eter, sülfolan |
Aksi belirtilmedikçe, veriler kendi içlerindeki malzemeler için verilmiştir. standart durum (25 ° C'de [77 ° F], 100 kPa). | |
| Bilgi kutusu referansları | |
Trifloroperasetik asit (trifluoroperoksiasetik asit, TFPAA) bir organoflorin bileşik peroksi asit analogu trifloroasetik asit, ile yoğunlaştırılmış yapısal formül CF
3COOOH.[Not 1] Bu güçlü oksitleyici ajan için organik oksidasyon gibi reaksiyonlar Baeyer-Villiger oksidasyonları nın-nin ketonlar.[1] Organik peroksi asitlerin en reaktifidir ve nispeten reaktif olmayan başarılı bir şekilde oksitlenmesine izin verir. alkenler -e epoksitler diğer peroksi asitlerin etkisiz olduğu yerlerde.[2] Ayrıca okside edebilir kalkojenler bazı fonksiyonel gruplarda, örneğin dönüştürerek Selenoethers -e Selones.[3] Potansiyel olarak patlayıcı bir malzemedir[4] ve ticari olarak mevcut değildir, ancak gerektiğinde hızlı bir şekilde hazırlanabilir.[5] Laboratuvar olarak kullanımı reaktif öncülük etti ve geliştirdi William D. Emmons.[6][7]
Özellikleri
Şurada: standart ortam sıcaklığı ve basıncı trifloroperasetik asit, renksiz bir sıvıdır. kaynama noktası 162 ° C.[8] İçinde çözünür asetonitril, diklorometan, dietil eter, ve sülfolan ve su ile kolayca reaksiyona girer.[5] Tüm peroksi asitler gibi, potansiyel olarak patlayıcıdır ve dikkatli kullanım gerektirir.[4] Ticari olarak mevcut değildir, ancak laboratuvarda üretilebilir ve −20 ° C'de birkaç haftaya kadar saklanabilir.[5] Bazı hazırlık yöntemleri, kalıntı içeren karışımlarla sonuçlanır. hidrojen peroksit ve trifloroasetik asit ve böyle bir karışımı ısıtmak son derece tehlikelidir; hidrojen peroksit olabilir ayrışmış kullanma manganez dioksit ısıtmadan önce güvenlik için.[5][8]
Hazırlık
Trifluoroperasetik asit, bir Organik Sentezler[9] tedavi süreci trifloroasetik anhidrit konsantre (% 90)[2] sulu çözelti hidrojen peroksit:
- CF
3COOCOCF
3 + H
2Ö
2 → CF
3COOOH + CF
3COOH
Anhidrit, su ile temas halinde trifloroasetik asit oluşturacağından, anhidrit fazlası da çözücünün peroksit reaktantından çıkarılmasına hizmet eder:[9]
- CF
3COOCOCF
3 + H
2Ö → 2 CF
3COOH
Trifloroasetik asitten bazı reaksiyonlar için trifloroperasetik asit oluşturmak için daha seyreltik bir hidrojen peroksit çözeltisi (% 30) kullanılabilir.[2]
- CF
3COOH + H
2Ö
2 → CF
3COOOH + H
2Ö
Saf veya yüksek konsantrasyonlu hidrojen peroksit çözeltilerinin kullanım tehlikesini önlemek için, hidrojen peroksit - üre perasit vermek için kullanılabilir.[5] Bu yöntem su içermez, bu nedenle tamamen susuz perasit,[10] bu, suyun varlığı yol açtığı zaman bir avantajdır. yan reaksiyonlar belirli oksidasyon reaksiyonları sırasında.[11]
- CF
3COOCOCF
3 + H
2Ö
2· CO (NH
2)
2 → CF
3COOOH + CF
3COOH + CO (NH
2)
2
Olduğu durumlarda pH tamponlama bir sentez için ajan gereklidir ve su varlığının tolere edildiği durumlarda başka bir yaklaşım geliştirilmiştir. Trifloroasetik anhidrit ile reaksiyona girme sodyum perkarbonat, 2Na
2CO
3· 3H
2Ö
2, trifloroperasetik asit verir ve sodyum karbonat ek bir arabellek ihtiyacını ortadan kaldırır.[5][12]
- 3 CF
3COOCOCF
3 + 4 Na
2CO
3·1 1⁄2H
2Ö
2 → 6 CF
3COOOH + 4 Na
2CO
3 + 3 H
2Ö
Trifluoroperasetik asit de üretilebilir yerinde,[13] daha sonra kullanmak üzere reaktifin bir serisini önceden sentezlemek yerine hedef substrat ile hemen reaksiyona girmesine izin verir.
Kullanımlar

6H
5I (OOCCF
3)
2
Trifluoroperasetik asit esas olarak bir oksitleyici ajan.[5][7] Eylül 1953'te Amerikan Kimya Derneği Dergisi tarafından yayınlanan çalışma William D. Emmons ve Arthur F. Ferris bu reaktifin ürettiğini bildirmek yerinde, oksitleme yeteneğine sahipti anilin -e nitrobenzen.[13] Takip eden iki yıl boyunca, Emmons bu reaktif için bir hazırlık yöntemi bildirdi ve bu dergide uygulamaları hakkında altı makale daha yayınladı;[14][15][16] Emmons öncü olarak kısmen hatırlanır[6] ve geliştirici[7] bir laboratuvar reaktifi olarak trifloroperasetik asidin reaktif birçok farklı sentetik reaksiyon türü için.
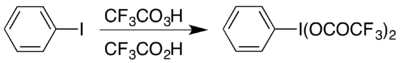
Bir örnek, hipervalent iyot bileşik (bis (trifluoroasetoksi) iyodo) benzen, (CF
3COO)
2IC
6H
5 yürütmek için kullanılan Hofmann yeniden düzenlemesi asidik koşullar altında.[17] Hipervalent bileşiğe iki şekilde erişilebilir ve hangisi seçilirse genellikle hangi materyallerin mevcut olduğuna bağlıdır: Asetatından hazırlanabilir analog bir değişim reaksiyonu ile,[18] veya tepki vererek iyodobenzen trifloroperasetik asit ve trifloroasetik asit kombinasyonu ile:[17]
Baeyer-Villiger oksidasyonu

Trifloroperasetik asit, benzer perasitlere göre yüksek asitliğinin bir sonucu olarak Baeyer-Villiger oksidasyonları için kullanılan en güçlü reaktiflerden biridir ve peroksitler.[19]:17 Bu reaksiyon dönüştürür ketonlar ya düz zincire esterler veya laktonlar, ve adı Adolf von Baeyer ve Victor Villiger, ilk kez 1899 bildirdi.[1] Reaksiyonun bir Criegee orta[5] ve iyi gösteriyor bölge seçiciliği ve kemoseçicilik oksijen atomu yerleştirme pozisyonu için stereokimya aşağıdaki örnekte görülebileceği gibi, bitişik konumda. disodyum fosfat (Na
2HPO
4) pH tamponu olarak eklenir[2] yüksek asidik trifloroasetik asit yan ürününün neden olmasını önlemek için hidroliz[20] veya transesterifikasyon[21] ester ürününün.

Epoksidasyon
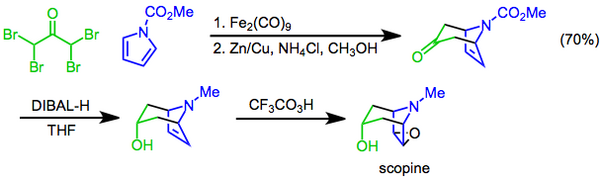
Prilezhaev reaksiyonu dönüşümünü içerir alken bir epoksit oksidan olarak bir perasit kullanmak[22] ve ilk olarak 1909'da rapor edildi.[23] Reaksiyon, sentezinin son adımı olarak kullanılmıştır. scopine, bir tropan alkaloit. Bu yaklaşımda, bir [4 + 3] siklokasyon aracılığıyla diiron nonakarbonil bisiklik iskeleti oluşturmak için kullanılır, hidroksil fonksiyonel grup daha sonra tarafından tanıtıldı diastereoselektif ile keton indirgenmesi diizobutilaluminum hidrit ve hazırlık, bir Prilezhaev trifloroperasetik asit epoksidasyonu ile tamamlandı.[24]
Trifloroperasetik asidin diğer peroksi asitlere göre yüksek reaktivitesi, bunun gibi nispeten elektron açısından fakir alkenleri başarılı bir şekilde oksitlemesine izin verir. 1-heksen ve α, β-doymamış esterler gibi metil metakrilat genellikle peroksi-asit epoksidasyona dirençli substratlar.[2] Karışıma ilave tamponlu trifloroasetik asit dahil edilmesi, bir yakın epoksit yerine hidroksi-trifloroasetat yapısı, diol asidik ile muamele edilerek metanol aşağıdaki dönüşümde olduğu gibi 1-dodesen 1,2-dodekanediol'e.[2]

Bir durumda alil alkol yakın ile bileşik karbonil fonksiyonel grup, epoksit, bir oluşturmak için bir halka genişleme reaksiyonuna girebilir. dioksolan.[5][11] Aşağıdaki süreç, toplam sentez nın-nin neosporol, bir doğal ürün:[11][25]

İzomerik bileşiğin hazırlanması sporol benzer bir dioksolan oluşumunu içeriyordu. Bu durumda, hidrojen peroksitten türetilen ve bu nedenle muhtemelen eser miktarda su içeren trifloroperasetik asidin kullanımı, çoğunlukla yarı asetal kapalı halkalı dioksolan yerine. Susuz bir malzeme veren üre kompleksinin kullanılması, başarılı bir şekilde dioksolanı ana ürün olarak verdi.[11] Dioksolan, 1,3-dioksan sentezin sonraki bir aşamasında sporolde bulunan sistem.[25]
Heteroatom oksidasyonu
Fonksiyonel gruplar kapsamak heteroatomlar düşük oksidasyon durumları trifluoroperasetik asit ile oksitlenebilir.[5][7] Yaygın durumlar arasında iyot oksidasyonu (örneğin, daha önce bahsedilen iyodobenzenden hipervalent iyot bileşiğinin oluşumu), nitrojen, kükürt ve selenyum bulunur.
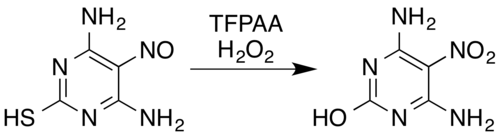
Nitrojen içeren bileşikler durumunda, bilinen dönüşümler şunları içerir: Oximes[5] ve aromatik birincil aminler[15] -e nitro bileşikleri[7] (bile elektron çeken ikame ediciler, örneğin, pentafluoroaniline ila pentafluoronitrobenzene[26]), nitrozaminler -e nitraminler,[7][14] aromatik oluşumu N-oksitler ve aromatik azin N-oksitler,[5][27] ve dönüşümü nitroso nitro bileşikleri veya nitraminlere bileşikler.[5] Örneğin, bir hidrojen peroksit ve trifloroperasetik asit karışımı, nitrozo ikameli pirimidin 4,6-diamino-5-nitrosopyrimidine-2-thiol'ü nitro analoguna dönüştürürken aynı zamanda tiol parça oksidatif hidrolitik kükürt giderme:[5][28]
Bu durumuda kalkojen elementler, sülfid kısımları (R – S – R) trifloroperasetik asit ile oksitlenerek sülfoksit (R – S (O) –R) ve / veya sülfon (R – S (O)2–R) kullanılan koşullara bağlı olarak formlar.[5] Benzer selenyum sisteminde, trifloroperasetik asit oksidasyonu Selenoethers (R – Se – R) seçimler üretir (R – Se (O)2–R) ilgili oluşum olmadan selenoksitler (R – Se (O) –R) izole edilebilir bir ürün olarak,[3] özellikle R bir olduğunda etkili olan bir reaksiyon aril grubu.[29] Oluşumuna genel bir yaklaşım sülfinil klorürler (RS (O) Cl), karşılık gelen tiyolün, sülfüril klorür (YANİ
2Cl
2). Olduğu durumlarda sülfenil klorür (RSCl) bunun yerine, bir sonraki trifloroperasetik asit oksidasyonu, 2,2,2-trifluoro-1,1-difenil durumunda olduğu gibi istenen ürünü verir.etantiol:[30]

Trifloroperasetik asit oksidasyonu tiyofen reaksiyon için rekabet eden yolları gösterir. S- oksidasyon ve epoksidasyon mümkün.[31][Not 2] Ana yol başlangıçta sülfoksiti oluşturur, ancak bu kimyasal hemen bir Diels-Alder -tip dimerizasyon daha fazla oksidasyon meydana gelmeden önce - ne tiyofen-S-oksit veya tiyofen-S,SReaksiyonun ürünleri arasında dioksit bulunur.[5][31] Dimer daha sonra oksitlenebilir ve aşağıdakilerden birini dönüştürür. S-oksit kısımları bir S,S-dioksit. Minör reaksiyon yolunda, bir Prilezhaev epoksidasyonu[22] hızla yeniden düzenlenen tiyofen-2,3-epoksit oluşumuna neden olur. izomer tiofen-2-on.[31] Tuzak deneyleri[35] bu epoksit yolunun bir alternatif tepki of S-oksit ara maddesi ve izotopik etiketleme deneyler gösteriyor ki 1,2-hidrit kayması (bir NIH kayması ) oluşur ve böylece katyonik bir ara ürün söz konusudur.[31] Trifloroperasetik asit hazırlama yönteminin seçimi, muhtemelen rakip bir baz görevi gördüğü için su küçük reaksiyon yolunu baskıladığından önemlidir.[31]

Asidik yeniden düzenleme ile oksidasyon
Trifloroperasetik asidin kullanımı bor triflorür alkenlerin oksidasyonuna neden olur ve aromatik halkalar beraberinde yeniden düzenleme moleküler iskeletin.[5]
Alkenler için reaksiyon, bir keton ürünü verir, ancak mekanik süreç basitçe epoksidasyon ve ardından bir BF3-katalize Wagner-Meerwein yeniden düzenlenmesi:[36]
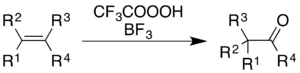
Aromatikler için, bir Organik Sentezler rapor 1,2,3,4,5,6-heksametilbenzen 2,3,4,5,6,6-heksametil-2,4-sikloheksadienona:[9]

Arenlerin oksidatif bölünmesi
Karbonil bileşikleri oluşturmak için aromatik halkaların basit oksidasyonuna ek olarak (bkz. § Asidik yeniden düzenleme ile oksidasyon ), trifloroperasetik asit tamamen yarmak halka içindeki karbon-karbon bağları. Reaktif zincirde alkil zincirinin bölünmesiyle benzoik asitler ve ilgili bileşikler veren alkilaromatik yapıların diğer oksidasyonlarından farklı olarak benzilik pozisyonunda trifloroperasetik asit bir "ters oksidasyona" neden olur, aromatik halkanın kendisini keserken alkil grubunu sağlam bırakır.[37][38]

Bazı bağ türleri için bu seçicilik, hidrokarbondların karmaşık karışımlarını ayrıştırmak için kullanılmasına izin verir. kömür yapısal detayları belirlemek için.[39][37]
Heteroatom içeren aromatik sistemler, heteroatom oksidasyon tercihli olarak gerçekleştiğinden ve peroksi asidin elektrofilik saldırısına doğru halkayı deaktive ettiğinden, bu halka açılmasına dirençlidir. Örneğin, pürinler, piridinler, ve kinolinler bunun yerine form N-oksitler,[5] octafluoro gibi kükürt sistemleridibenzotiofen sülfonlara dönüştürülür.[7][40]
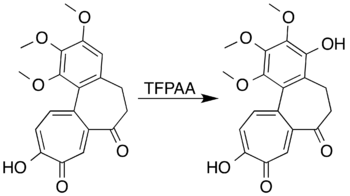
Aromatik sistemler halka aktive edici ikame ediciler oluşturmak için oksitlenebilir fenoller bir halka açma reaksiyonuna girmek yerine. Mesitilen örneğin trifloroperasetik asit ile reaksiyona girerek mesitol (2,4,6-trimetilfenol).[7] Baeyer-7-oxodeacetamido'nun Villiger oksidasyonu ile bir lakton oluşturmaya çalışan araştırmacılarkolşisin İstenilen ürünü hazırlayamadı, ancak yüksek verimle bir fenol türevi üretmek için aromatik halkanın oksidasyonunu sağladı:[5][41]
Notlar
- ^ Trifloroperasetik asidi temsil etmek için üç yoğunlaştırılmış yapısal formül kullanılır, CF
3COOOH, CF
3CO
3H, ve CF
3C (O) OOH. Eşdeğerdirler ve birbirlerinin yerine kullanılabilirler. - ^ Bu tür yarışmalar biyokimyasal öneme sahip olabilir. Örneğin, biliniyor ki döngü diüretik farmasötik ajan tienilik asit intihar zemini gibi davranır sitokrom P450 enzimler ve sürecin tiyofen oksidasyonunu içerdiği, ancak sorumlu oksidasyon yolu, önemli araştırma faaliyetlerine rağmen belirsizliğini koruyor.[32][33][34]
Referanslar
- ^ a b Kürti, László; Czakó, Barbara (2005). Organik Sentezde İsimli Reaksiyonların Stratejik Uygulamaları. Elsevier Academic Press. s. 28. ISBN 9780124297852.
- ^ a b c d e f Hiyama, Tamejiro (2000). "8.2 Trifloroasetik asit ve Trifloroperasetik asit". Organoflorin Bileşikleri: Kimya ve Uygulamalar. Springer Science & Business Media. s. 255–257. ISBN 9783662041642.
- ^ a b Kataoka, T .; Yoshimatsu, M. (1995). "Alkil Kalkojenitler: Selenyum ve Tellür bazlı Fonksiyonel Gruplar". İçinde Ley, Steven V. (ed.). Sentez: Tek Bir Bağla Bağlı Bir Heteroatomlu Karbon. Kapsamlı Organik Fonksiyonel Grup Dönüşümleri. Elsevier. pp.277–296. ISBN 9780080423234.
- ^ a b Carey, Francis A .; Sundberg, Richard J. (2007). "5.5 Epoksitleri İçeren Ekleme Reaksiyonları". İleri Organik Kimya: Bölüm A: Yapı ve Mekanizmalar (5. baskı). Springer Science & Business Media. sayfa 503–514. ISBN 9780387448978.
- ^ a b c d e f g h ben j k l m n Ö p q r s Caster, Kenneth C .; Rao, A. Somasekar; Mohan, H. Rama; McGrath, Nicholas A .; Brichacek, Matthew (2012). "Trifloroperasetik Asit". Organik Sentez için Reaktif Ansiklopedisi. e-EROS Organik Sentez Reaktifleri Ansiklopedisi. doi:10.1002 / 047084289X.rt254.pub2. ISBN 978-0471936237.
- ^ a b Freeman, Jeremiah P. (14 Kasım 2002). "William D. Emmons: 18 Kasım 1924 - 8 Aralık 2001" (PDF). Org. Synth. 80: xxvii – xxix. Arşivlenen orijinal (PDF) 16 Mart 2015. Alındı 21 Ocak 2017.
- ^ a b c d e f g h Chambers Richard D. (2004). "Oksijen, Kükürt veya Azot İçeren Fonksiyonel Bileşikler ve Türevleri". Organik Kimyada Flor. CRC Basın. sayfa 242–243. ISBN 9780849317903.
- ^ a b Luxon, S.G. (1992). Kimya Laboratuvarındaki Tehlikeler (5. baskı). Kraliyet Kimya Derneği. s. 627. ISBN 9780851862293.
- ^ a b c Hart, Harold; Lange, Richard M .; Collins, Peter M. (1968). "2,3,4,5,6,6-Heksametil-2,4-sikloheksadien-1-on". Organik Sentezler. 48: 87. doi:10.15227 / orgsyn.048.0087.; Kolektif Hacim, 5, s. 598
- ^ Cooper, Mark S .; Heaney, Harry; Newbold, Amanda J .; Sanderson, William R. (1990). "Üre-Hidrojen Peroksit Kullanarak Oksidasyon Reaksiyonları; Susuz Hidrojen Peroksite Güvenli Bir Alternatif". Synlett. 1990 (9): 533–535. doi:10.1055 / s-1990-21156.
- ^ a b c d Ziegler, Fredrick E .; Metcalf, Chester A .; Nangia, Ashwini; Schulte, Gayle (1993). "Sporol ve neosporolün yapısı ve toplam sentezi". J. Am. Chem. Soc. 115 (7): 2581–2589. doi:10.1021 / ja00060a006.
- ^ Kang, Ho-Jung; Jeong, Hee-Sun (1996). "Baeyer-Villiger Reaksiyonu için Yeni Trifluoroperoksiasetik asit Oluşturma Yöntemi". Boğa. Korean Chem. Soc. 17 (1): 5–6.
- ^ a b Emmons, William D.; Ferris, Arthur F. (1953). "Pertrifloroasetik Asit ile Oksidasyon Reaksiyonları". J. Am. Chem. Soc. 75 (18): 4623–4624. doi:10.1021 / ja01114a539.
- ^ a b Emmons, William D. (1954). "Peroksitrifloroasetik Asit. I. Nitrozaminlerin Nitraminlere Oksidasyonu". J. Am. Chem. Soc. 76 (13): 3468–3470. doi:10.1021 / ja01642a029.
- ^ a b Emmons, William D. (1954). "Peroksitrifloroasetik Asit. II. Anilinlerin Nitrobenzenlere Oksidasyonu". J. Am. Chem. Soc. 76 (13): 3470–3472. doi:10.1021 / ja01642a030.
- ^ Emmons, William D.; Pagano, Angelo S .; Freeman, Jeremiah P. (1954). "Peroksitrifloroasetik Asit. III. Olefinlerin Hidroksilasyonu". J. Am. Chem. Soc. 76 (13): 3472–3474. doi:10.1021 / ja01642a031.
Emmons, William D.; Pagano, Angelo S. (1955). "Peroksitrifloroasetik Asit. IV. Olefinlerin Epoksidasyonu". J. Am. Chem. Soc. 77 (1): 89–92. doi:10.1021 / ja01606a029.
Emmons, William D.; Lucas, George B. (1955). "Peroksitrifloroasetik Asit. V. Ketonların Esterlere Oksidasyonu". J. Am. Chem. Soc. 77 (8): 2287–2288. doi:10.1021 / ja01613a077.
Emmons, William D.; Pagano, Angelo S. (1955). "Peroksitrifloroasetik Asit. VI. Oksimlerin Nitroparafinlere Oksidasyonu". J. Am. Chem. Soc. 77 (17): 4557–4559. doi:10.1021 / ja01622a036. - ^ a b Aubé, Jeffrey; Fehl, Charlie; Liu, Ruzhang; McLeod, Michael C .; Motiwala, Hashim F. (1993). "6.15 Hofmann, Curtius, Schmidt, Lossen ve İlgili Reaksiyonlar". Heteroatom Manipülasyonları. Kapsamlı Organik Sentez II. 6. s. 598–635. doi:10.1016 / B978-08-097742-3.00623-6. ISBN 9780080977430.
- ^ Almond, M.R .; Stimmel, J. B .; Thompson, E. A .; Loudon, G.M. (1988). "Hafif Asidik Koşullar Altında Hofmann Yeniden Düzenlenmesi [ben,ben-Bis (Trifluoroacetoxy)] İyodobenzen: Siklobutankarboksamidden Siklobutilamin Hidroklorür ". Organik Sentezler. 66: 132. doi:10.15227 / orgsyn.066.0132.; Kolektif Hacim, 8, s. 132
- ^ Myers, Andrew G. "Kimya 115 El Notları: Oksidasyon" (PDF). Harvard Üniversitesi. Alındı 10 Ocak 2017.
- ^ Carruthers, William (1971). "6.3 Olefinlerin Oksidasyonu". Bazı Modern Organik Sentez Yöntemleri. Cambridge University Press. s. 259–280. ISBN 9780521096430.
- ^ Carruthers, William (1971). "6.5 Baeyer – Ketonların Villiger oksidasyonu". Bazı Modern Organik Sentez Yöntemleri. Cambridge University Press. s. 287–290. ISBN 9780521096430.
- ^ a b Hagen Timothy J. (2007). "Prilezhaev tepkisi". Li'de Jie Jack; Corey, E.J. (eds.). Fonksiyonel Grup Dönüşümlerinin İsim Tepkimeleri. John Wiley & Sons. s. 274–281. ISBN 9780470176504.
- ^ Prileschajew, Nikolaus (1909). "Oksidasyon ungesättigter Verbindungen mittels organischer Superoxyde" [Organik süperoksitler vasıtasıyla doymamış bileşiklerin oksidasyonu]. Ber. Dtsch. Chem. Ges. (Almanca'da). 42 (4): 4811–4815. doi:10.1002 / cber.190904204100.
- ^ Hayakawa, Y .; Baba, Y .; Makino, S .; Noyori, R. (1978). "Geçiş metal karbonilleri tarafından teşvik edilen karbon-karbon bağı oluşumu. 19. Tropan alkaloidlerin polibromo keton-demir karbonil reaksiyonu yoluyla genel sentezi". J. Am. Chem. Soc. 100 (6): 1786–1791. doi:10.1021 / ja00474a021.
- ^ a b Pirrung, Michael C .; Morehead, Andrew T .; Young, Bruce G., editörler. (2000). "10. Neosporol, Sporol". Bölüm B: Bisiklik ve Trisiklik Sesquiterpenler. Doğal Ürünlerin Toplam Sentezi. 11. John Wiley & Sons. s. 222–224. ISBN 9780470129630.
- ^ Brooke, G.M .; Burdon, J .; Tatlow, J.C. (1961). "Aromatik polifloro-bileşikler. Bölüm VII. Pentafloronitrobenzenin amonyak ile reaksiyonu". J. Chem. Soc.: 802–807. doi:10.1039 / JR9610000802.
- ^ Williams, W. Michael; Dolbier William R. (1969). "Azin oksitlerin termal ve fotokimyasal yeniden düzenlemeleri. I. Nitrillere pirolitik ayrışma". J. Org. Chem. 34 (1): 155–157. doi:10.1021 / jo00838a034.
- ^ Taylor, Edward C.; McKillop, Alexander (1965). "5-Nitropirimidinlerin Yeni Bir Sentezi". J. Org. Chem. 30 (9): 3153–3155. doi:10.1021 / jo01020a067.
- ^ Taylor, P.C. (1995). "Vinil ve Aril Kalkojenitler: Sülfür-, Selenyum- ve Tellür esaslı Fonksiyonel Gruplar". İçinde Ley, Steven V. (ed.). Sentez: Tek Bir Bağla Bağlı Bir Heteroatomlu Karbon. Kapsamlı Organik Fonksiyonel Grup Dönüşümleri. Elsevier. pp.705–736. ISBN 9780080423234.
- ^ Page, P. C. B .; Wilkes, R. D .; Reynolds, D. (1995). "Alkil Kalkojenitler: Sülfür Bazlı Fonksiyonel Gruplar". İçinde Ley, Steven V. (ed.). Sentez: Tek Bir Bağ ile Bağlı Bir Heteroatomlu Karbon. Kapsamlı Organik Fonksiyonel Grup Dönüşümleri. Elsevier. pp.113–276. ISBN 9780080423234.
- ^ a b c d e Treiber, Alexander (2002). "Asitle Katalize Edilmiş Perasit Oksidasyonu ile Tiyofenin Aromatik Hidroksilasyon Mekanizması". J. Org. Chem. 67 (21): 7261–7266. doi:10.1021 / jo0202177. PMID 12375952.
- ^ Mansuy, Daniel; Valadon, Philippe; Erdelmeier, Irene; López Garcia, Pilar; Amar, Claudine; Girault, Jean-Pierre; Dansette, Patrick M. (1991). "Tiyofen S-Yeni Reaktif Metabolitler Olarak Oksitler: Sitokrom P-450 Bağımlı Oksidasyon ve Nükleofillerle Reaksiyon ile Oluşum ". J. Am. Chem. Soc. 113 (20): 7825–7826. doi:10.1021 / ja00020a089.
- ^ Correia, Maria A .; Hollenberg, Paul F. (2015). "Sitokrom P450 Enzimlerinin Engellenmesi". Ortiz de Montellano, Paul R. (ed.). Sitokrom P450: Yapı, Mekanizma ve Biyokimya (4. baskı). Springer. s. 177–260. ISBN 9783319121086.
- ^ Macherey, Anne-Christine; Dansette, Patrick M. (2015). "Toksik Metabolitlere Yol Açan Biyotransformasyonlar: Kimyasal Yönler". İçinde Wermuth, Camille Georges; Aldous, David; Raboisson, Pierre; Rognan, Didier (editörler). Tıbbi Kimya Uygulaması (4. baskı). Elsevier. s. 585–614. ISBN 9780124172135.
- ^ Anslyn, Eric V.; Dougherty, Dennis A. (2006). "8.8 Mekanizmayı İncelemek İçin Çeşitli Deneyler". Modern Fiziksel Organik Kimya. Üniversite Bilim Kitapları. sayfa 471–482. ISBN 9781891389313.
- ^ Hart, Harold; Lerner, Lawrence R. (1967). "Peroksitrifloroasetik asit-boron triflorür ile oksidasyonlar. IX. Peroksitrifloroasetik asit-bor florür kullanılarak alkenlerin doğrudan ketonlara oksidasyonu". J. Org. Chem. 32 (9): 2669–2673. doi:10.1021 / jo01284a004.
- ^ a b Deno, Norman C .; Greigger, Barbara A .; Stroud Stephen G. (1978). "Kömürün yapılarını aydınlatmak için yeni yöntem". Yakıt. 57 (8): 455–459. doi:10.1016/0016-2361(78)90153-9.
- ^ Deno, Norman C .; Greigger, Barbara A .; Messer, Lauren A .; Meyer, Michael D .; Stroud, Stephen G. (1977). "Alkilbenzenlerin aromatik halka oksidasyonu". Tetrahedron Lett. 18 (20): 1703–1704. doi:10.1016 / S0040-4039 (01) 93253-8.
- ^ Deno, Norman C .; Curry, Kenneth W .; Greigger, Barbara A .; Jones, A. Daniel; Rakitsky, Walter G .; Smith, Karen A .; Wagner, Karen; Minard, Robert D. (1980). "Illinois No. 6 Monterey kömürünün dihidroaromatik yapısı". Yakıt. 59 (10): 694–698. doi:10.1016/0016-2361(80)90021-6.
- ^ Chambers, R. D .; Cunningham, J. A .; Bahar, D.J. (1968). "Polifloroaril organometalik bileşikler. Bölüm VIII. Oktaflorodibenzofuranın sentezi ve nükleofilik ikame". J. Chem. Soc. C: 1560–1565. doi:10.1039 / J39680001560.
- ^ Berg, Ulf; Bladha, Håkan; Mpamposa, Konstantinos (2004). "Kolşisin motifi üzerinde stereokimyasal varyasyonlar. Tiyokolşikonun perasit oksidasyonu. Mikrotübül düzeneğinin sentezi, konformasyonu ve inhibisyonu". Org. Biomol. Chem. 2 (14): 2125–2130. doi:10.1039 / B402840F. PMID 15254641.
