Kaspaz 1 - Caspase 1 - Wikipedia

Kaspaz-1/ Interleukin-1 dönüştürücü enzim (ICE) evrimsel olarak korunmuş bir enzim o proteolitik olarak gibi diğer proteinleri ayırır. öncüler inflamatuar sitokinler interlökin 1β ve interlökin 18 yanı sıra piroptoz indükleyici Gasdermin D aktif olgun peptidlere.[5][6][7] Bir enflamatuar yanıt başlatıcı olarak hücre bağışıklığında merkezi bir rol oynar. Bir kez oluşarak aktive edildiğinde iltihaplı kompleks, bölünme yoluyla proinflamatuar bir yanıt başlatır ve böylece iki enflamatuarın aktivasyonu sitokinler, interlökin 1β (IL-1β) ve interlökin 18 (IL-18) yanı sıra piroptoz, programlanmış bir litik hücre ölümü yol, Gasdermin D'nin bölünmesi yoluyla. Caspase-1 tarafından aktive edilen iki enflamatuar sitokin, komşu hücrelerde enflamatuar yanıtı daha da indüklemek için hücreden atılır.[8]
Hücresel ifade
Kaspaz-1 evrimsel olarak korunmuştur. ökaryotlar of Krallık Animalia. Enflamatuar immün yanıttaki rolü nedeniyle, yüksek oranda immün organlarda ifade edilir. karaciğer, böbrek, dalak, ve kan (nötrofiller ).[9][10] Enfeksiyonu takiben, enflamatuar yanıt Kaspaz-1 ekspresyonunu bir olumlu geribildirim yanıtı güçlendiren mekanizma.[10]
Yapısı
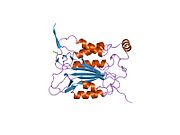
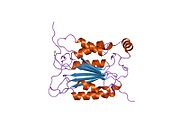
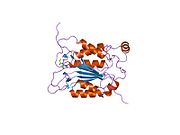
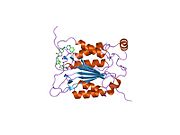
Kaspaz-1, bir zimojen bu daha sonra aktif enzimin bir parçası olan 20 kDa (p20) ve 10 kDa (p10) alt birimlerine bölünebilir. Aktif Kaspaz 1, iki heterodimerler p20 ve p10. Hem p20 hem de p10 alt birimlerini kapsayan aktif bir siteye sahip bir katalitik alan içerir,[11] katalitik olmayan bir Kaspaz Aktivasyon ve İşe Alım Alanı (KART ). Diğerleriyle etkileşime giriyor KART KART İçeren Apoptozla İlişkili Benek benzeri Protein gibi proteinler içeren (ASC ) ve Nod Benzeri Reseptör (NLR ) Aile KARTI Alan İçeren Protein 4 (NLRC4 ) inflammasom oluşumunda CARD-CARD etkileşimleri yoluyla.[7][12]
Yönetmelik


Aktivasyon

Kaspaz-1, normalde fizyolojik olarak inaktif zimojen formunda, filamentli yapıya monte edildiğinde otomatik olarak aktif hale gelir. iltihaplı otoproteoliz ile kompleksi p10 ve p20 alt birimlerine dönüştürür.[13][14] Enflammasom kompleksi, sinyal spesifik sensör proteininin trimerlerinden oluşan bir halka kompleksidir. NLR ailesi ve AIM-1 (Melanomda Yoktur) benzeri reseptörler, ASC gibi bir adaptör protein ve bu durumda Kaspaz-1 gibi bir kaspaz. Sinyalleme proteinlerinin kendi CARD'larını içerdiği bazı durumlarda, NLRP1 ve NLRC4, CARD -CARD etkileşimi doğrudandır, yani komplekste adaptör protein yoktur. Çeşitli kombinasyonları inflammasomların spesifik sinyallere tepkilerini veren çeşitli sensör ve adaptör proteinleri vardır. Bu, hücrenin, alınan tehlike sinyalinin ciddiyetine bağlı olarak değişen derecelerde enflamatuar tepkilere sahip olmasına izin verir.[15][16]
İnhibisyon
Adından da anlaşılacağı gibi yalnızca CARD proteinleri (COP'ler), yalnızca katalitik olmayan CARD'ları içeren proteinlerdir. Enflamazom oluşumunda CARD-CARD etkileşimlerinin önemi nedeniyle, birçok COP, Kaspaz aktivasyonunun bilinen inhibitörleridir. Kaspaz-1 için, belirli COP genleri - ICEBERG, COP1 (ICE / Pseudo-ICE) ve INCA (İnhibitör Kart) - hepsi lokusunun yakınında bulunur ve bu nedenle gen duplikasyon olaylarından ve daha sonra silinmelerden ortaya çıktığı düşünülmektedir. katalitik alanlar. Hepsi enflammasomlarla CARD-CARD etkileşimlerini kullanarak etkileşime girseler de, engelleyici işlevlerini yerine getirme biçimleri ve bunu yaparken etkinlikleri açısından farklılık gösterirler.[14][17][18]
Örneğin ICEBERG, Kaspaz-1 filamentlerinin oluşumunu çekirdekleştirir ve bu nedenle filamanlara dahil edilir, ancak inflammasomların aktivasyonunu inhibe etme yeteneğinden yoksundur. Bunun yerine, Kaspaz-1'in diğer önemli CARD içeren proteinlerle etkileşimine müdahale ederek Kaspaz-1 aktivasyonunu inhibe ettiği düşünülmektedir.[14][17][18]
INCA ise Caspase-1 CARD'ı kapatarak doğrudan iltihaplı montajı bloke eder. oligomerler böylece iltihaplı filamanlarda daha fazla polimerizasyonu bloke eder.[17][18][19][12]
Benzer şekilde, bazı KOK'ların (yalnızca Pyrin proteinleri) de, PYD etkileşimlerine bağlanarak ve bloke ederek inflammasom aktivasyonunu inhibe ederek Kaspaz-1 aktivasyonunu düzenlediği bilinmektedir; bu, aynı zamanda, inflammasomların oluşumunda da rol oynar, ancak kesin mekanizmalar henüz yoktur. iyi kurulmuş.[18][20]
- İnhibitörler
- Belnacasan (VX-765) [21]
- Pralnacasan (VX-740) [22]
Fonksiyon
Proteolitik bölünme
Aktive Kaspaz 1, pro IL-1β ve pro IL-18'i proteolitik olarak aktif formları olan IL-1β ve IL-18'e ayırır. Aktif sitokinler, aşağı yönde bir enflamatuar yanıta yol açar. Ayrıca Gasdermin D'yi aktif formuna böler ve bu da piroptoza yol açar.[12]
Tahrik edici cevap
Olgunlaştıktan sonra, sitokinler aşağı akış sinyal olaylarını başlatarak proinflamatuar yanı sıra ifadesini etkinleştirmek için antiviral genler. Yanıtın hızı, özgüllüğü ve türleri, alınan sinyale ve onu alan sensör proteinine bağlıdır. İltihaplanmalar tarafından alınabilen sinyaller şunları içerir: viral çift sarmallı RNA, üre, serbest radikaller ve hücresel tehlike ile ilişkili diğer sinyaller, hatta diğer bağışıklık tepkisi yollarının yan ürünleri.[23]
Olgun sitokinlerin kendileri, sitokinlere girmek için gerekli sıralama dizilerini içermez. ER-Golgi salgı yolu ve bu nedenle hücreden geleneksel yöntemlerle atılmaz. Ancak, bunların serbest bırakılmasının Proinflamatuar sitokinler yoluyla hücresel kopmaya bağlı değildir piroptoz ve aslında aktif bir süreçtir. Bu hipotezin hem lehinde hem de aleyhinde kanıtlar var. Pek çok hücre türü için, sitokinlerin kesinlikle hiçbir piroptoz belirtisi göstermemelerine rağmen salgılanması bu hipotezi desteklemektedir.[16][24] Bununla birlikte, bazı deneyler, Gasdermin D'nin işlevsel olmayan mutantlarının, sitokinlerin hala normal bölünmesine sahip olduğunu, ancak bunları salgılama yeteneğinden yoksun olduğunu göstermektedir, bu da, bir şekilde salgılama için aslında pirtozun gerekli olabileceğini göstermektedir.[25]
Pyroptoz yanıtı
Enflamatuar cevabın ardından, aktive edilmiş bir Kaspaz-1, alınan sinyale ve onu alan spesifik enflamazom algılayıcı alan proteinine bağlı olarak, hücre ölümünün litik bir formu olan pyroptozu indükleyebilir. Tam enflamatuar yanıt için piroptoz gerekli olabilir veya olmayabilir, ancak piroptoz oluşmadan önce enflamatuar yanıt tamamen gereklidir.[16] Caspase-1, pyroptozu indüklemek için Gasdermin D'yi böler, bu da ya doğrudan ya da bazı sinyal kaskadları yoluyla pyroptoza yol açar. Kesin mekanizma bilinmemektedir.[16]
Diğer roller
Kaspaz-1'in ayrıca nekroz ve çeşitli gelişim aşamalarında da işlev görebilir. Farelerde benzer bir protein üzerine yapılan çalışmalar, Huntington hastalığı. Alternatif ekleme genin, farklı izoformları kodlayan beş transkript varyantı ile sonuçlanır.[26] Son çalışmalar, kaspaz-1'in, HIV hastalığının AIDS'e ilerlemesini besleyen iki önemli olay olan, HIV ile CD4 T hücresi ölümünü ve enflamasyonu teşvik etmede rol oynadı.[27][28] Kaspaz-1 aktivitesi, bakterilerin fagositozunu takiben lizozom asidifikasyonunda da rol oynamıştır.[29] ve bağışıklık kompleksleri.[30]
Ayrıca bakınız
Referanslar
- ^ a b c GRCh38: Ensembl sürümü 89: ENSG00000137752 - Topluluk, Mayıs 2017
- ^ a b c GRCm38: Topluluk sürümü 89: ENSMUSG00000025888 - Topluluk, Mayıs 2017
- ^ "İnsan PubMed Referansı:". Ulusal Biyoteknoloji Bilgi Merkezi, ABD Ulusal Tıp Kütüphanesi.
- ^ "Mouse PubMed Referansı:". Ulusal Biyoteknoloji Bilgi Merkezi, ABD Ulusal Tıp Kütüphanesi.
- ^ Thornberry NA, Bull HG, Calaycay JR, Chapman KT, Howard AD, Kostura MJ, Miller DK, Molineaux SM, Weidner JR, Aunins J (Nisan 1992). "Monositlerde interlökin-1 beta işlemesi için yeni bir heterodimerik sistein proteaz gereklidir". Doğa. 356 (6372): 768–74. doi:10.1038 / 356768a0. PMID 1574116. S2CID 4310923.
- ^ Cerretti DP, Kozlosky CJ, Mosley B, Nelson N, Van Ness K, Greenstreet TA, March CJ, Kronheim SR, Druck T, Cannizzaro LA (Nisan 1992). "İnterlökin-1 beta dönüştürücü enzimin moleküler klonlaması". Bilim. 256 (5053): 97–100. doi:10.1126 / science.1373520. PMID 1373520.
- ^ a b Mariathasan S, Newton K, Monack DM, Vucic D, French DM, Lee WP, Roose-Girma M, Erickson S, Dixit VM (Temmuz 2004). "İltihaplanmanın kaspaz-1 adaptörleri ASC ve Ipaf ile diferansiyel aktivasyonu". Doğa. 430 (6996): 213–8. doi:10.1038 / nature02664. PMID 15190255. S2CID 4317409.
- ^ Jorgensen I, Miao EA (Mayıs 2015). "Pyroptotik hücre ölümü, hücre içi patojenlere karşı savunma sağlar". İmmünolojik İncelemeler. 265 (1): 130–42. doi:10.1111 / imr.12287. PMC 4400865. PMID 25879289.
- ^ Bakele M, Joos M, Burdi S, Allgaier N, Pöschel S, Fehrenbacher B, Schaller M, Marcos V, Kümmerle-Deschner J, Rieber N, Borregaard N, Yazdi A, Hector A, Hartl D (Şubat 2014). "Nötrofillerdeki inflammasomun lokalizasyonu ve işlevselliği". Biyolojik Kimya Dergisi. 289 (8): 5320–9. doi:10.1074 / jbc.M113.505636. PMC 3931087. PMID 24398679.
- ^ a b Kumaresan V, Ravichandran G, Nizam F, Dhayanithi NB, Arasu MV, Al-Dhabi NA, Harikrishnan R, Arockiaraj J (Şubat 2016). "Çok işlevli murrel kaspaz 1, 2, 3, 8 ve 9: Koruma, benzersizlik ve bunların patojen kaynaklı ekspresyon modeli". Balık ve Kabuklu Deniz Ürünleri İmmünolojisi. 49: 493–504. doi:10.1016 / j.fsi.2016.01.008. PMID 26777895.
- ^ Wilson KP, Black JA, Thomson JA, Kim EE, Griffith JP, Navia MA, Murcko MA, Chambers SP, Aldape RA, Raybuck SA (Temmuz 1994). "İnterlökin-1 beta dönüştürücü enzimin yapısı ve mekanizması". Doğa. 370 (6487): 270–5. doi:10.1038 / 370270a0. PMID 8035875. S2CID 4281700.
- ^ a b c Lu A, Li Y, Schmidt FI, Yin Q, Chen S, Fu TM, Tong AB, Ploegh HL, Mao Y, Wu H (Mayıs 2016). "Kaspaz-1 polimerizasyonunun moleküler temeli ve yeni bir kapatma mekanizması ile inhibisyonu". Doğa Yapısal ve Moleküler Biyoloji. 23 (5): 416–25. doi:10.1038 / nsmb.3199. PMC 4856535. PMID 27043298.
- ^ Elliott JM, Rouge L, Wiesmann C, Scheer JM (Mart 2009). "Procaspase-1 zimojen alanının kristal yapısı, inflamatuar kaspaz otoaktivasyonuna ilişkin içgörü ortaya koyuyor". Biyolojik Kimya Dergisi. 284 (10): 6546–53. doi:10.1074 / jbc.M806121200. PMC 2649088. PMID 19117953.
- ^ a b c Humke EW, Shriver SK, Starovasnik MA, Fairbrother WJ, Dixit VM (2000). "ICEBERG: interlökin-1beta oluşumunun yeni bir inhibitörü". Hücre. 103 (1): 99–111. doi:10.1016 / S0092-8674 (00) 00108-2. PMID 11051551. S2CID 15886378.
- ^ Samarani S, Allam O, Sagala P, Aldabah Z, Jenabian MA, Mehraj V, Tremblay C, Routy JP, Amre D, Ahmad A (Haziran 2016). "IL-18'in ve bunun antagonistinin insan hastalıklarında dengesiz üretimi ve bunun HIV-1 enfeksiyonu üzerindeki etkileri". Sitokin. İnflamasyon, yaşlanma, kanser ve obezitede sitokinler. 82: 38–51. doi:10.1016 / j.cyto.2016.01.006. PMID 26898120.
- ^ a b c d Vince JE, Silke J (2016). "Hücre ölümü ve iltihaplı aktivasyonun kesişimi". Hücresel ve Moleküler Yaşam Bilimleri. 73 (11–12): 2349–67. doi:10.1007 / s00018-016-2205-2. PMID 27066895. S2CID 16281016.
- ^ a b c Druilhe A, Srinivasula SM, Razmara M, Ahmad M, Alnemri ES (Haziran 2001). "IL-1beta üretiminin, iki baskın negatif kaspaz alım alanı proteini olan Pseudo-ICE ve ICEBERG tarafından düzenlenmesi". Hücre Ölümü ve Farklılaşması. 8 (6): 649–57. doi:10.1038 / sj.cdd.4400881. PMID 11536016.
- ^ a b c d Le HT, Harton JA (2013-01-01). "NLR İşlevlerinin Düzenleyicileri Olarak Yalnızca Pirin ve KART İçeren Proteinler". İmmünolojide Sınırlar. 4: 275. doi:10.3389 / fimmu.2013.00275. PMC 3775265. PMID 24062743.
- ^ Lamkanfi M, Denecker G, Kalai M, D'hondt K, Meeus A, Declercq W, Saelens X, Vandenabeele P (Aralık 2004). "INCA, interlökin-1beta oluşumunu inhibe eden yeni bir insan kaspaz yetiştirme alanı proteini". Biyolojik Kimya Dergisi. 279 (50): 51729–38. doi:10.1074 / jbc.M407891200. PMID 15383541.
- ^ Dorfleutner A, Talbott SJ, Bryan NB, Funya KN, Rellick SL, Reed JC, Shi X, Rojanasakul Y, Flynn DC, Stehlik C (Aralık 2007). "Shope Fibroma virüsü sadece PYRIN proteini, konakçı bağışıklık tepkisini modüle eder". Virüs Genleri. 35 (3): 685–94. doi:10.1007 / s11262-007-0141-9. PMC 4257706. PMID 17676277.
- ^ Flores J, Noël A, Foveau B, Lynham J, Lecrux C, LeBlanc AC (Eylül 2018). "Kaspaz-1 inhibisyonu, bir Alzheimer hastalığı fare modelinde bilişsel bozukluğu ve nöropatolojiyi hafifletir". Nat Commun. 9 (1): 3916. doi:10.1038 / s41467-018-06449-x. PMC 6156230. PMID 30254377.
- ^ Boxer MB, Quinn AM, Shen M, Jadhav A, Leister W, Simeonov A, Auld DS, Thomas CJ (Mayıs 2010). "Anahtar bir 3-siyanopropanoik asit parçası kullanan oldukça güçlü ve seçici bir kaspaz 1 inhibitörü". ChemMedChem. 5 (5): 730–8. doi:10.1002 / cmdc.200900531. PMC 3062473. PMID 20229566.
- ^ Vezzani A, Maroso M, Balosso S, Sanchez MA, Bartfai T (Ekim 2011). "Enfeksiyon, iltihaplanma, stres ve nörodejenerasyonda IL-1 reseptörü / Toll benzeri reseptör sinyallemesi, hiper uyarılabilirliği ve nöbetleri birleştirir". Beyin, Davranış ve Bağışıklık. 25 (7): 1281–9. doi:10.1016 / j.bbi.2011.03.018. PMID 21473909. S2CID 3383795.
- ^ Ainscough JS, Gerberick GF, Kimber I, Dearman RJ (Aralık 2015). "Interleukin-1β İşlemesi, Calmodulin ile Kalsiyum Aracılı Bir Etkileşime Bağlıdır". Biyolojik Kimya Dergisi. 290 (52): 31151–61. doi:10.1074 / jbc.M115.680694. PMC 4692238. PMID 26559977.
- ^ He WT, Wan H, Hu L, Chen P, Wang X, Huang Z, Yang ZH, Zhong CQ, Han J (Aralık 2015). "Gasdermin D, bir piroptoz uygulayıcısıdır ve interlökin-1β sekresyonu için gereklidir". Hücre Araştırması. 25 (12): 1285–98. doi:10.1038 / cr.2015.139. PMC 4670995. PMID 26611636.
- ^ "Entrez Geni: CASP1 kaspaz 1, apoptozla ilişkili sistein peptidaz (interlökin 1, beta, konvertaz)".
- ^ Doitsh G, Galloway NL, Geng X, Yang Z, Monroe KM, Zepeda O, Hunt PW, Hatano H, Sowinski S, Muñoz-Arias I, Greene WC (Ocak 2014). "Pirtoz nedeniyle hücre ölümü, HIV-1 enfeksiyonunda CD4 T hücresi tükenmesine neden olur". Doğa. 505 (7484): 509–14. doi:10.1038 / nature12940. PMC 4047036. PMID 24356306.
- ^ Monroe KM, Yang Z, Johnson JR, Geng X, Doitsh G, Krogan NJ, Greene WC (Ocak 2014). "HIV ile başarısız olarak enfekte olan lenfoid CD4 T hücrelerinin ölümü için IFI16 DNA sensörü gereklidir". Bilim. 343 (6169): 428–32. doi:10.1126 / science.1243640. PMC 3976200. PMID 24356113.
- ^ Sokolovska A, Becker CE, Ip WK, Rathinam VA, Brudner M, Paquette N, Tanne A, Vanaja SK, Moore KJ, Fitzgerald KA, Lacy-Hulbert A, Stuart LM (Haziran 2013). "Kaspaz-1'in NLRP3 inflammasomu tarafından aktivasyonu, fagozom fonksiyonunu kontrol etmek için NADPH oksidaz NOX2'yi düzenler". Doğa İmmünolojisi. 14 (6): 543–53. doi:10.1038 / ni.2595. PMC 3708594. PMID 23644505.
- ^ Monteith AJ, Vincent HA, Kang S, Li P, Claiborne TM, Rajfur Z, Jacobson K, Moorman NJ, Vilen BJ (Temmuz 2018). "mTORC2 Aktivitesi, Rab39a Kaspaz-1 Bölünmesini Bozarak Sistemik Lupus Eritematozusta Lizozom Asidifikasyonunu Bozar". Journal of Immunology. 201 (2): 371–382. doi:10.4049 / jimmunol.1701712. PMC 6039264. PMID 29866702.