Çözünmüş organik karbon - Dissolved organic carbon

| Bir dizinin parçası |
| Karbon döngüsü |
|---|
 |
Çözünmüş organik karbon (DOC) kesri organik karbon operasyonel olarak tanımlanmış tipik olarak 0.22 ile 0.7 arasında gözenek boyutuna sahip bir filtreden geçebilen mikrometre.[2] Filtrede kalan fraksiyona partikül organik karbon (POC).[3]
Çözünmüş organik madde (DOM) sık sık DOC ile birbirinin yerine kullanılan yakından ilişkili bir terimdir. DOC, özellikle çözünmüş organik materyaldeki karbon kütlesini ifade ederken, DOM, çözünmüş organik maddenin toplam kütlesini ifade eder. Dolayısıyla, DOM aynı zamanda organik materyalde bulunan nitrojen, oksijen ve hidrojen gibi diğer elementlerin kütlesini de içerir. DOC, DOM'un bir bileşenidir ve tipik olarak DOC'un yaklaşık iki katı DOM vardır.[4] DOC hakkında yapılabilecek birçok ifade, DOM için de aynı şekilde geçerlidir ve tersine.
DOC bol miktarda bulunur deniz ve temiz su sistemler ve en büyük bisiklet rezervuarlarından biridir. organik madde Dünya'da aynı miktarda karbon atmosferde olduğu gibi ve tüm organik karbonun% 20'sine kadar.[5] Genel olarak, organik karbon bileşiklerin sonucudur ayrışma bitkiler ve hayvanlar dahil olmak üzere ölü organik maddeden işlemler. DOC, herhangi bir su kütlesinin içinden veya dışından kaynaklanabilir. Su kütlesinden kaynaklanan DOC, otokton DOC olarak bilinir ve tipik olarak su bitkileri veya yosun su kütlesinin dışından kaynaklanan DOC allokton DOC olarak bilinirken ve tipik olarak topraklar veya karasal bitkiler.[6] Su, yüksek oranda organik toprak içeren kara alanlarından çıktığında, bu bileşenler DOC olarak nehirlere ve göllere akabilir.
Deniz DOC havuzu, kimyasal ve biyolojik dünyalar arasındaki arayüzde yer aldığından deniz ekosistemlerinin işleyişi için önemlidir. DOC yakıtları deniz besin ağları ve Dünya’nın önemli bir bileşenidir. karbon döngüsü.[7]
Genel Bakış

DOC, büyümesini destekleyen temel bir besindir. mikroorganizmalar ve küresel ölçekte önemli bir rol oynar karbon döngüsü içinden mikrobiyal döngü.[10] Geleneksel anlamda beslenmeyen bazı organizmalarda (aşamalarda), çözünmüş madde tek dış besin kaynağı olabilir.[11] Dahası, DOC, akarsulardaki organik yüklerin bir göstergesidir ve organik maddenin karasal işlemesini (örneğin toprak, ormanlar ve sulak alanlar içinde) destekler. Çözünmüş organik karbon, yüksek dereceli akışlara kıyasla birinci dereceden akışlarda yüksek oranda biyolojik olarak parçalanabilir çözünmüş organik karbon (BDOC) içerir. Kapsamlı olmadığında sulak alanlar, bataklıklar veya bataklıklar, bozulmamış havzalardaki temel akış DOC konsantrasyonları genellikle yaklaşık 1 ila 20 mg / L karbon arasında değişir.[12] Karbon konsantrasyonları ekosistemler arasında önemli ölçüde değişiklik gösterir. Örneğin, Everglades aralığın tepesine yakın olabilir ve okyanusların ortası dibe yakın olabilir. Bazen, yüksek organik karbon konsantrasyonları antropojenik etkilere işaret eder, ancak çoğu DOC doğal olarak ortaya çıkar.[13]
BDOC oranı organikten oluşur moleküller o heterotrofik bakteri enerji ve karbon kaynağı olarak kullanabilir. [14] DOC'nin bazı alt kümeleri, içme suyu için dezenfeksiyon yan ürünlerinin öncüllerini oluşturur.[15] BDOC, su dağıtım sistemlerinde istenmeyen biyolojik büyümeye katkıda bulunabilir.[16]
Çözünmüş fraksiyonu toplam organik karbon (TOC) operasyonel bir sınıflandırmadır. Birçok araştırmacı, 0,45 μm filtreden geçen bileşikler için "çözünmüş" terimini kullanır, ancak 0,22 μm filtreler daha yüksek koloidal konsantrasyonları gidermek için de kullanılmıştır.
Tipik olarak kullanılan çözünmüşlüğün pratik bir tanımı deniz kimyası nominal gözenek boyutu yaklaşık 0,7 μm olan bir GF / F filtresinden geçen tüm maddelerdir (Whatman cam mikrofiber filtre, 0,6–0,8 μm partikül tutma[17]). Önerilen prosedür, HTCO önceden yakılmış cam elyaf filtreler aracılığıyla filtreleme gerektiren teknik, tipik olarak GF / F sınıflandırması.[18]
Kararsız ve inatçı
Çözünmüş organik madde, reaktivitesine bağlı olarak kararsız veya inatçı olarak sınıflandırılabilir. İnatçı DOC ayrıca dayanıklı DOC ve bu terimler, DOC bağlamında birbirinin yerine kullanılabilir gibi görünüyor. DOC'nin kökeni ve bileşimine bağlı olarak, davranışı ve döngüsü farklıdır; DOC'nin kararsız fraksiyonu mikrobiyal veya fotokimyasal olarak aracılık edilen süreçlerle hızla ayrışırken, refrakter DOC bozulmaya karşı dirençlidir ve okyanusta binlerce yıl sürebilir. Kıyı okyanusunda, karasal bitki çöplerinden veya topraklardan gelen organik madde daha dayanıklı görünmektedir.[19] ve bu nedenle genellikle muhafazakar davranır. Ek olarak, refrakter DOC, bileşimini yeniden şekillendiren kararsız DOC'nin bakteriyel dönüşümü ile okyanusta üretilir.[20][21][22]
Doğal sistemlerde sürekli üretim ve bozulma nedeniyle, DOC havuzu, her biri kendi reaktivitesine sahip bir dizi reaktif bileşik içerir,[23] devir sürelerine bağlı olarak kararsızdan inatçıya fraksiyonlara bölünmüş olanlar,[24] aşağıdaki tabloda gösterildiği gibi ...
| DOC kesri | kısaltma | Devir süresi | Miktar |
|---|---|---|---|
| kararsız | DOCL | günler saatler | <200 Tg C |
| yarı kararsız | DOCSL | haftalar aylar | ∼600 Tg C |
| yarı inatçı | DOCSR | on yıllar | ∼1400 Tg C |
| inatçı | DOCR | binlerce yıl | ∼63000 Tg C |
| oldukça dayanıklı | on binlerce yıl | ||
Devir veya bozunma sürelerindeki bu geniş aralık, kimyasal bileşim, yapı ve moleküler boyut ile ilişkilendirilmiştir.[25][26] ancak bozunma aynı zamanda çevresel koşullara (örneğin, besinler), prokaryot çeşitliliğine, redoks durumuna, demir mevcudiyetine, mineral partikül ilişkilerine, sıcaklığa, güneş ışığına maruz kalmaya, inatçı bileşiklerin biyolojik üretimine ve bireyin astarlanmasının veya seyreltilmesinin etkisine de bağlıdır. moleküller.[25][27][28][29][30][31] Örneğin, lignin aerobik topraklarda parçalanabilir ancak anoksik deniz çökeltilerinde nispeten inatçıdır.[32] Bu örnek, biyoyararlanımın ekosistemin özelliklerine bağlı olarak değiştiğini göstermektedir. Buna göre, petrol, karboksil açısından zengin alisiklik moleküller gibi normal olarak eski ve inatçı bileşikler bile uygun çevresel ortamda bozunabilir.[33][34]
Karasal ekosistemler
Toprak


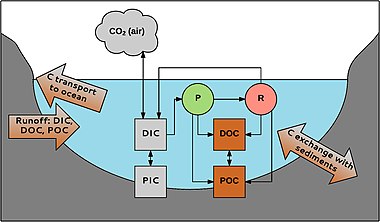
P = fotosentez R = solunum
Çözünmüş organik madde (DOM), en aktif ve hareketli karbon havuzlarından biridir ve küresel karbon döngüsünde önemli bir role sahiptir.[41] Ek olarak, çözünmüş organik karbon (DOC) toprağın negatif elektrik yüklerini etkiler. denitrifikasyon süreç asit-baz reaksiyonları toprak çözeltisinde, besin maddelerinin tutulması ve yer değiştirmesi (katyonlar ) ve hareketsiz hale getirilmesi ağır metaller ve ksenobiyotikler.[42] Toprak DOM, yağış, çöp ve mahsul kalıntılarında çözünen atmosferik karbon, gübre, kök sızıntıları ve toprak organik maddesinin (SOM) ayrışması gibi farklı kaynaklardan (girdilerden) türetilebilir. Toprakta DOM mevcudiyeti, onun tarafından modüle edilen mineral bileşenler (örneğin killer, Fe ve Al oksitler) ile etkileşimlerine bağlıdır. adsorpsiyon ve desorpsiyon süreçler.[43] Ayrıca mineralizasyon ve hareketsizleştirme süreçleriyle SOM fraksiyonlarına (örn., Stabilize organik moleküller ve mikrobiyal biyokütle) bağlıdır. Ek olarak, bu etkileşimlerin yoğunluğu toprağın doğal özelliklerine göre değişir,[44] arazi kullanımı ve mahsul yönetimi.[43][35]
Organik materyalin ayrışması sırasında çoğu karbon CO olarak kaybolur2 mikrobiyal oksidasyon ile atmosfere. Toprak tipi ve peyzaj eğimi, süzme, ve akış ayrıca topraktaki DOM kayıplarıyla ilişkili önemli süreçlerdir.[45] İyi drene edilmiş topraklarda, süzülen DOC, su tablası ve kirletebilecek besinleri ve kirleticileri serbest bırakın yeraltı suyu,[46][47] runoff ise DOM ve ksenobiyotikler diğer bölgelere, nehirlere ve göllere.[35]
Yeraltı suyu
Yağış ve yüzey suyu bitki örtüsünden çözünmüş organik karbonu (DOC) ve bitki çöpü ve toprak sütunu boyunca süzülür doymuş bölge. DOC'nin konsantrasyonu, bileşimi ve biyoyararlanımı, toprak sütunu boyunca taşıma sırasında çeşitli fizikokimyasal ve biyolojik süreçlerle değiştirilir. içine çekme, desorpsiyon, biyolojik bozunma ve biyosentez. Hidrofobik moleküller tercihen toprak minerallerine bölünür ve toprakta tutma süresine göre hidrofilik moleküller. Topraktaki kolloidlerin ve çözünmüş moleküllerin hidrofobikliği ve tutulma süresi, boyutları, polariteleri, yükleri ve biyoyararlanım. Biyoyararlanabilen DOM, mikrobiyal ayrışmaya maruz kalır, bu da boyut ve moleküler ağırlıkta bir azalmaya neden olur. Yeni moleküller şu şekilde sentezlenir: toprak mikropları ve bu metabolitlerin bir kısmı DOC rezervuarına yeraltı suyunda girer.[36]
Tatlı su ekosistemleri
Sucul karbon farklı şekillerde oluşur. İlk olarak organik ve inorganik karbon arasında bir ayrım yapılır. Organik karbon döküntü veya birincil üreticilerden kaynaklanan organik bileşiklerin bir karışımıdır. POC'ye (partikül organik karbon; partiküller> 0,45 μm) ve DOC (çözünmüş organik karbon; partiküller <0,45 μm). DOC genellikle toplam sucul organik karbon miktarının% 90'ını oluşturur. Konsantrasyonu 0.1 ila> 300 mg L-1 arasında değişir.[48]
Benzer şekilde, inorganik karbon da bir partikül (PIC) ve bir çözünmüş fazdan (DIC) oluşur. PIC esas olarak şunlardan oluşur: karbonatlar (örneğin, CaCO3), DIC karbonattan (CO32-) oluşur, bikarbonat (HCO3-), CO2 ve ihmal edilebilir derecede küçük bir kısmı karbonik asit (H2CO3). İnorganik karbon bileşikleri, suyun pH'ına bağlı olarak dengede bulunur.[49] Tatlı sudaki DIC konsantrasyonları asidik sularda yaklaşık sıfırdan karbonat bakımından zengin çökeltilere sahip bölgelerde 60 mg C L-1'e kadar değişir.[50]
POC, DOC oluşturmak için indirgenebilir; DOC şu şekilde POC olabilir: flokülasyon. İnorganik ve organik karbon, suda yaşayan organizmalar. CO2 kullanılır fotosentez (P) örneğin makrofitler, tarafından üretilen solunum (R) ve atmosfer ile değiş tokuş edildi. Organik karbon, organizmalar tarafından üretilir ve yaşamları sırasında ve sonrasında salınır; Örneğin nehirlerde, toplam DOC miktarının% 1–20'si makrofitler tarafından üretilir.[38] Karbon sisteme havzadan girebilir ve nehirler ve akarsular yoluyla okyanuslara taşınır. Çökeltilerde karbon ile değişim de vardır, örneğin organik karbonun gömülmesi için önemli olan karbon tutumu su habitatlarında.[51]
Sucul sistemler, küresel karbon tutulmasında çok önemlidir; örneğin, farklı Avrupa ekosistemleri karşılaştırıldığında, iç su sistemleri ikinci en büyük karbon yutucusunu oluşturur (19–41 Tg C y-1); sadece ormanlar daha fazla karbon alır (125–223 Tg C y-1).[52][37]
Deniz ekosistemleri

Kaynaklar
Deniz sistemlerinde DOC, otokton veya allokton kaynaklar. Otokton DOC, sistem içinde, öncelikle plankton organizmaları tarafından üretilir [53][54] ve kıyı sularında ayrıca bentik mikroalgler, bentik akılar ve makrofitler ile,[55] allokton DOC ise esas olarak yeraltı suyu ve atmosferik girdilerle desteklenen karasal kökenlidir.[56][57] Elde edilen toprağa ek olarak hümik maddeler karasal DOC ayrıca materyal içerir süzülmüş yağmur olayları sırasında ihraç edilen bitkilerden, bitki materyallerinin atmosfere emisyonu ve su ortamlarında birikme (örn., uçucu organik karbon ve polenler) ve ayrıca okyanusta eser konsantrasyonlarda ölçülebilen binlerce sentetik insan yapımı organik kimyasal.[58][59][7]
Fitoplankton
Fitoplankton, DOC üretir hücre dışı genel olarak toplam birincil üretimlerinin% 5 ila 30'unu oluşturan serbest bırakma,[60] bu türden türe değişse de.[61] Bununla birlikte, hücre dışı DOC'nin bu salınımı, yüksek ışık ve düşük besin seviyeleri altında artar ve bu nedenle, muhtemelen hücresel enerjiyi dağıtmak için bir mekanizma olarak, ötrofik alanlardan oligotrofik alanlara göreceli olarak artmalıdır.[62] Fitoplankton ayrıca DOC üretebilir: otoliz fizyolojik stres durumları sırasında, örneğin besin sınırlaması.[63] Diğer çalışmalar, fitoplankton ve bakteriler üzerinde mezo- ve makro-zooplankton beslenmesi ile ilişkili olarak DOC üretimini göstermiştir.[64][7]
Zooplankton
Zooplankton aracılı DOC salınımı, özensiz beslenme mikroplar için önemli enerji kaynakları olabilen boşaltım ve dışkılama.[65][64] Bu tür DOC üretimi, yüksek gıda konsantrasyonu ve büyük zooplankton türlerinin baskın olduğu dönemlerde en büyüktür.[66][7]
Bakteriler ve virüsler
Bakteriler genellikle DOC'nin ana tüketicileri olarak görülür, ancak aynı zamanda DOC üretebilirler. hücre bölünmesi ve viral liziz.[67][68][69] Bakterilerin biyokimyasal bileşenleri büyük ölçüde diğer organizmalarla aynıdır, ancak hücre duvarındaki bazı bileşikler benzersizdir ve bakteriyel türetilmiş DOC (örn. peptidoglikan ). Bu bileşikler okyanusta yaygın olarak dağılmıştır, bu da bakteriyel DOC üretiminin deniz sistemlerinde önemli olabileceğini düşündürmektedir.[70] Virüsler, okyanuslarda algler, bakteriler ve zooplankton dahil olmak üzere tüm yaşam formlarını enfekte eden en bol yaşam formlarıdır.[71] Enfeksiyondan sonra, virüs ya hareketsiz hale gelir (lizojenik ) veya üretken (litik ) durum.[72] Litik döngü, hücrelerin bozulmasına ve DOC'nin salınmasına neden olur.[73][7]

Sağ taraf: biyokütle kazanmak için çözünmüş organik karbon kullanan bakterilerle mikrobiyal döngü, daha sonra protistler yoluyla klasik karbon akışına yeniden girer.[74][75]

Makrofitler
Deniz makrofitler (yani makroalg ve deniz çayırı ) son derece üretkendir ve kıyı sularında geniş alanlara yayılır, ancak DOC üretimi pek ilgi görmemiştir. Makrofitler, büyüme sırasında ihtiyatlı bir tahminle (çürüyen dokulardan salınım hariç) DOC salgılar, bu da makroalglerin brüt birincil üretimlerinin% 1-39'u arasında salındığını gösterir,[77][78] deniz çayırları ise brüt birincil üretimlerinin% 5'inden daha azını DOC olarak salmaktadır.[79] Serbest bırakılan DOC'nin karbonhidratlar açısından zengin olduğu ve oranların sıcaklığa ve ışığın mevcudiyetine bağlı olduğu gösterilmiştir.[80][81] Küresel olarak makrofit topluluklarının, yıllık küresel nehir DOC girdisinin yaklaşık yarısı olan (250 Tg C yr – 1) -160 Tg C yıl – 1 DOC üretmesi önerilmiştir.[80][7]
Deniz sedimanları

Deniz sedimanları OM bozunumunun ve okyanusta gömülmesinin ana bölgelerini temsil eder ve mikropları, içinde bulunandan 1000 kat daha yüksek yoğunluklarda barındırır. su sütunu.[83] Sedimanlardaki DOC konsantrasyonları, genellikle üstteki su kolonundakinden daha yüksektir.[84] Bu konsantrasyon farkı, sürekli bir difüzif akı ile sonuçlanır ve sedimanların nehirlerden gelen DOC girdisi ile karşılaştırılabilir olan 350 Tg C yr – 1 salan önemli bir DOC kaynağı olduğunu gösterir.[85] Bu tahmin, hesaplanan dağınık akılara dayanır ve DOC'yi de serbest bırakan yeniden süspansiyon olaylarını içermez. [86] ve bu nedenle tahmin ihtiyatlı olabilir. Ayrıca, bazı çalışmalar jeotermal sistemlerin ve petrol sızıntısının önceden yaşlandırılmış DOC ile derinlere katkıda bulunduğunu göstermiştir. okyanus havzaları,[87][88] ancak genel girdiye ilişkin tutarlı küresel tahminler şu anda eksiktir. Küresel olarak, yeraltı suları okyanuslara tatlı su DOC akışının bilinmeyen bir kısmını hesaba katıyor.[89] Yeraltı suyundaki DOC, karasal, sızmış deniz ve yerinde mikrobiyal olarak üretilen malzemelerin bir karışımıdır.[90] Yeraltı suyundaki konsantrasyonlar genellikle kıyı deniz suyundan daha yüksek olduğundan, DOC'nin kıyı sularına olan bu akışı önemli olabilir.[91] ancak güvenilir küresel tahminler de şu anda eksik.[7]
Lavabolar
DOC'yi okyanus suyu sütunundan çıkaran ana işlemler şunlardır: (1) Termal bozunma, örn. denizaltı hidrotermal sistemleri;[92] (2) kabarcık pıhtılaşma ve abiyotik flokülasyon içine mikropartiküller [93] veya içine çekme parçacıklara;[94] (3) yoluyla abiyotik bozulma fotokimyasal reaksiyonlar;[95][96] ve (4) biyotik bozulma tarafından heterotrofik deniz prokaryotları.[97] Fotokimyasal ve mikrobiyal bozunmanın birleşik etkilerinin DOC'nin ana çöküşlerini temsil ettiği öne sürülmüştür.[98][7]
Termal bozulma
 Okyanusta refrakter DOC'nin kaldırılmasıYüzey sularındaki fitoplankton üretimi ve besin ağı dinamikleri, farklı reaktivitelere sahip çeşitli çözünmüş moleküller karışımını açığa çıkarır. Bakteriler ve arkealar, yukarı okyanusun yüzey ve mezopelajik sularında kararsız ve yarı kararsız DOC formlarından yararlanarak, okyanusta binlerce yıldır devam eden geniş bir refrakter DOC (RDOC) rezervuarını geride bırakır. Okyanus, çok çeşitli mikropları ve fizikokimyasal süreçleri barındıran, bu moleküller çevresel koşullarla ve onları bozabilecek mikroplarla karşılaştığında refrakter DOC'u ortadan kaldırma potansiyeline sahip düzensiz bir ortamdır. Fiziksel karıştırma, refrakter DOC'yi okyanus aleminin her yerine taşır ve böylece ortadan kalkma olasılığını artırır. Derin okyanus suları hidrotermal dolaşıma dahil edilebilir ve ilgili DOC, termal bozunma yoluyla giderilebilir. Yukarı okyanustan gelen batan parçacıklar, mikrobiyal aktivitenin sıcak noktalarını tetikleyen ve refrakter moleküllerin uzaklaştırılmasını hazırlayan değişken DOC (LDOC) salgılar. Yeraltı sularının güneşli sulara karıştırılması, refrakter DOC'yi daha yüksek sıcaklıklara ve refrakter molekülleri mineralize edip hızlı mikrobiyal kullanım için basit bileşiklere (örneğin piruvat, formaldehit) dönüştürebilen fotokimyasal işlemlere maruz bırakır. Bu nedenle, okyanustaki refrakter moleküllerin yaşam süresinin küresel devrilme sirkülasyonu (GOC) oranıyla düzenlendiği görülmektedir. Bu ilişki, sabit bir refrakter DOC (gömme panel) üretim hızı varsayılarak, GOC'nin yavaşlamasının refrakter DOC'nin rezervuar boyutunda bir artışa yol açabileceğini göstermektedir.[99]
Okyanusta refrakter DOC'nin kaldırılmasıYüzey sularındaki fitoplankton üretimi ve besin ağı dinamikleri, farklı reaktivitelere sahip çeşitli çözünmüş moleküller karışımını açığa çıkarır. Bakteriler ve arkealar, yukarı okyanusun yüzey ve mezopelajik sularında kararsız ve yarı kararsız DOC formlarından yararlanarak, okyanusta binlerce yıldır devam eden geniş bir refrakter DOC (RDOC) rezervuarını geride bırakır. Okyanus, çok çeşitli mikropları ve fizikokimyasal süreçleri barındıran, bu moleküller çevresel koşullarla ve onları bozabilecek mikroplarla karşılaştığında refrakter DOC'u ortadan kaldırma potansiyeline sahip düzensiz bir ortamdır. Fiziksel karıştırma, refrakter DOC'yi okyanus aleminin her yerine taşır ve böylece ortadan kalkma olasılığını artırır. Derin okyanus suları hidrotermal dolaşıma dahil edilebilir ve ilgili DOC, termal bozunma yoluyla giderilebilir. Yukarı okyanustan gelen batan parçacıklar, mikrobiyal aktivitenin sıcak noktalarını tetikleyen ve refrakter moleküllerin uzaklaştırılmasını hazırlayan değişken DOC (LDOC) salgılar. Yeraltı sularının güneşli sulara karıştırılması, refrakter DOC'yi daha yüksek sıcaklıklara ve refrakter molekülleri mineralize edip hızlı mikrobiyal kullanım için basit bileşiklere (örneğin piruvat, formaldehit) dönüştürebilen fotokimyasal işlemlere maruz bırakır. Bu nedenle, okyanustaki refrakter moleküllerin yaşam süresinin küresel devrilme sirkülasyonu (GOC) oranıyla düzenlendiği görülmektedir. Bu ilişki, sabit bir refrakter DOC (gömme panel) üretim hızı varsayılarak, GOC'nin yavaşlamasının refrakter DOC'nin rezervuar boyutunda bir artışa yol açabileceğini göstermektedir.[99]
Termal bozulma DOC'nin% 'si, dışarı akış DOC konsantrasyonlarının içeri akıştakinden daha düşük olduğu yüksek sıcaklıklı hidrotermal sırt kenarlarında bulunmuştur. Bu süreçlerin küresel etkisi araştırılmamış olsa da, mevcut veriler bunun küçük bir DOC havuzu olduğunu gösteriyor.[100] Abiyotik DOC flokülasyonu, tatlı su ve deniz suyu karıştığında tuzluluktaki hızlı (dakika) değişimler sırasında gözlemlenir.[101] Flokülasyon, DOC kimyasal bileşimini kaldırarak değiştirir hümik bileşikler ve moleküler boyutu küçülterek, DOC'yi otlayıcılar tarafından çökelebilecek ve / veya tüketilebilecek partikül organik topaklara dönüştürerek Filtre besleyicileri ama aynı zamanda floküle edilmiş DOC'nin bakteriyel degradasyonunu da uyarır.[102] Flokülasyonun DOC'nin kıyı sularından uzaklaştırılması üzerindeki etkileri oldukça değişkendir ve bazı çalışmalar DOC havuzunun% 30'unu kaldırabileceğini öne sürmektedir.[103][104] diğerleri çok daha düşük değerler bulurken (% 3-6;[105]). Bu tür farklılıklar, DOC kimyasal bileşimi, pH, metalik katyon konsantrasyonu, mikrobiyal reaktivite ve iyonik güçteki mevsimsel ve sistem farklılıkları ile açıklanabilir.[101][106][7]
CDOM
DOC'nin renkli kesri (CDOM), mavi ve UV ışık aralığında ışığı emer ve bu nedenle hem fotosentez için mevcut olacak olan ışığı absorbe ederek olumsuz olarak hem de plankton organizmalarını zararlı UV ışığından koruyarak plankton üretkenliğini olumlu yönde etkiler.[107][108] Bununla birlikte, UV hasarının ve onarım kabiliyetinin etkisi son derece değişken olduğundan, UV ışığı değişikliklerinin genel plankton topluluklarını nasıl etkileyebileceği konusunda bir fikir birliği yoktur.[109][110] Işığın CDOM absorpsiyonu, besin, metal ve DOC kimyasal bileşimini etkileyebilen ve DOC bozulmasını teşvik edebilen karmaşık bir dizi fotokimyasal işlemi başlatır.[111]
Fotodegradasyon
Fotodegradasyon CDOM'un daha küçük ve daha az renkli moleküllere (örneğin organik asitler) veya inorganik karbona (CO, CO2) ve besin tuzlarına (NH + 4, HPO2−4) dönüşümünü içerir.[112][113][114] Bu nedenle, genellikle fotodegradasyonun, rekalsitrantı, prokaryotlar tarafından biyokütle üretimi ve solunum için hızla kullanılabilen kararsız DOC moleküllerine dönüştürdüğü anlamına gelir. Bununla birlikte, trigliseritler gibi bileşiklerin daha karmaşık aromatik bileşiklere dönüşümü yoluyla CDOM'u da artırabilir,[115][116] mikroplar tarafından daha az parçalanabilir. Dahası, UV radyasyonu, mikroplara zararlı olan örneğin reaktif oksijen türleri üretebilir.[117] Fotokimyasal işlemlerin DOC havuzu üzerindeki etkisi aynı zamanda kimyasal bileşime de bağlıdır,[118] Bazı çalışmalar, yakın zamanda üretilen otokton DOC'nin daha az biyolojik olarak kullanılabilir hale geldiğini, allokton DOC'nin ise güneş ışığına maruz kaldıktan sonra prokaryotlar için daha fazla biyoyararlanıma girdiğini, ancak diğerleri bunun tersini bulduğunu öne sürüyor.[119][120][121] Fotokimyasal reaksiyonlar, karasal DOC'nin tahmini ∼% 20–30'unun hızla foto bozunması ve tüketilmesi ile yüksek miktarda karasal kaynaklı CDOM alan kıyı sularında özellikle önemlidir.[122] Küresel tahminler ayrıca deniz sistemlerinde DOC'nin fotodegradasyonunun ∼180 Tg C yr – 1 inorganik karbon ürettiğini, ek olarak 100 Tg C yr – 1 DOC'nin mikrobiyal bozunmaya daha uygun hale getirildiğini göstermektedir.[123][124] Küresel okyanus tahminlerine yönelik bir başka girişim de, foto degradasyonun (210 Tg C yr – 1) nehir kıyısı DOC'nin yıllık küresel girdisi (250 Tg C yr – 1) ile yaklaşık olarak aynı olduğunu göstermektedir;[125]), diğerleri ise doğrudan foto bozunmanın nehir kenarındaki DOC girdilerini aştığını öne sürüyor.[126][127][7]
İnatçı DOC

Dağıtım
1990'ların sonlarında geliştirilen daha hassas ölçüm teknikleri, çözünmüş organik karbonun deniz ortamlarında hem dikey hem de yüzey boyunca nasıl dağıldığının daha iyi anlaşılmasını sağlamıştır.[128] Artık okyanustaki çözünmüş organik karbonun çok çeşitli kararsız çok inatçı (refrakter). Kararsız çözünmüş organik karbon esas olarak deniz organizmaları tarafından üretilir ve yüzey okyanusunda tüketilir ve şeker, protein ve kolayca kullanılan diğer bileşiklerden oluşur. deniz bakterileri.[129] Rekalsitrant çözünmüş organik karbon, su sütunu boyunca eşit bir şekilde yayılır ve yüksek moleküler ağırlıktan ve deniz organizmaları için kullanımı zor olan yapısal olarak karmaşık bileşiklerden oluşur. lignin, polen veya hümik asitler.[130] Bu nedenle, gözlemlenen dikey dağılım, üst su kolonunda yüksek konsantrasyonlarda kararsız DOC ve derinlikte düşük konsantrasyonlardan oluşur.
 Oceanic DOC'un görünürde yeniden hesaplanmasını kontrol eden çevresel süreçlerNoktalar DOC moleküllerini ve oklar DOC konsantrasyonunu ve moleküler bileşimi etkileyen fizikokimyasal ve biyolojik süreçleri temsil eder. Yüzey okyanusunda, birincil üretimden türetilen DOC, mikrobiyal bozunma (siyah ok), fotokimyasal bozulma (sarı ok) veya parçacık değişimi (yeşil ok) yoluyla hızla yeniden mineralize edilir veya dönüştürülür. Kararsız bileşenler su kolonundan aşağı doğru çıkarılır ve DOC, değişmeye, eklemeye ve / veya çıkarmaya devam eden parçacık değişimi (kahverengi ok), tortu çözünmesi (gri ok) ve mikrobiyal yeniden işleme (beyaz ok) gibi işlemlerle seyreltilir. toplu DOC havuzundan moleküller. Bu nedenle, DOC'nin okyanusun iç kısmındaki görünürdeki yeniden hesaplaması, büyük ölçüde çevresel bağlam tarafından kontrol edilen ortaya çıkan bir mülktür.[76]
Oceanic DOC'un görünürde yeniden hesaplanmasını kontrol eden çevresel süreçlerNoktalar DOC moleküllerini ve oklar DOC konsantrasyonunu ve moleküler bileşimi etkileyen fizikokimyasal ve biyolojik süreçleri temsil eder. Yüzey okyanusunda, birincil üretimden türetilen DOC, mikrobiyal bozunma (siyah ok), fotokimyasal bozulma (sarı ok) veya parçacık değişimi (yeşil ok) yoluyla hızla yeniden mineralize edilir veya dönüştürülür. Kararsız bileşenler su kolonundan aşağı doğru çıkarılır ve DOC, değişmeye, eklemeye ve / veya çıkarmaya devam eden parçacık değişimi (kahverengi ok), tortu çözünmesi (gri ok) ve mikrobiyal yeniden işleme (beyaz ok) gibi işlemlerle seyreltilir. toplu DOC havuzundan moleküller. Bu nedenle, DOC'nin okyanusun iç kısmındaki görünürdeki yeniden hesaplaması, büyük ölçüde çevresel bağlam tarafından kontrol edilen ortaya çıkan bir mülktür.[76]
Dikey dağılımlara ek olarak, yatay dağılımlar da modellenmiş ve örneklenmiştir.[131] 30 metre derinlikteki yüzey okyanusunda, daha yüksek çözünmüş organik karbon konsantrasyonları Güney Pasifik Döngüsü, Güney Atlantik Döngüsü ve Hint Okyanusu'nda bulunur. 3.000 metre derinlikte, en yüksek konsantrasyonlar, yüksek konsantrasyonlu yüzey okyanusundan çözünmüş organik karbonun derinlemesine uzaklaştırıldığı Kuzey Atlantik Derin Suyu'ndadır. Hint Okyanusu'nun kuzeyinde ise, yüksek tatlı su akışı ve sedimanlar nedeniyle yüksek DOC gözlenmektedir. Okyanus tabanı boyunca yatay hareketin zaman ölçekleri binlerce yıl içinde olduğundan, refrakter çözünmüş organik karbon Kuzey Atlantik'ten giderken yavaşça tüketilir ve Kuzey Pasifik'te minimuma ulaşır.
Ortaya çıktığı gibi
Çözünmüş organik madde, binlerce, muhtemelen milyonlarca organik bileşikten oluşan heterojen bir havuzdur. Bu bileşikler yalnızca bileşim ve konsantrasyon bakımından farklılık göstermez (pM'den μM'ye), aynı zamanda çeşitli organizmalardan (fitoplankton, zooplankton ve bakteriler) ve ortamlardan (karasal bitki örtüsü ve topraklar, kıyı kenar ekosistemleri) kaynaklanır ve son zamanlarda veya binlerce kez üretilmiş olabilir. yıllar önce. Dahası, aynı kaynaktan ve aynı yaştan türetilen organik bileşikler bile, aynı DOM havuzunda birikmeden önce farklı işlem geçmişlerine tabi tutulmuş olabilir.[76]
İç okyanus DOM, yıllarca güneş ışığına maruz kaldıktan, heterotroflar tarafından kullanımdan, topaklanma ve pıhtılaşmadan ve parçacıklarla etkileşimden sonra kalan oldukça değiştirilmiş bir fraksiyondur. DOM havuzundaki bu işlemlerin çoğu bileşiğe veya sınıfa özgüdür. Örneğin, yoğunlaştırılmış aromatik bileşikler son derece ışığa duyarlıdır,[132] oysa proteinler, karbonhidratlar ve bunların monomerleri bakteriler tarafından kolaylıkla alınır.[133][134][135] Mikroplar ve diğer tüketiciler, kullandıkları DOM türünde seçicidir ve genellikle bazı organik bileşikleri diğerlerine tercih ederler. Sonuç olarak, DOM sürekli olarak yeniden çalışıldığı için daha az reaktif hale gelir. Başka bir deyişle, DOM havuzu bozulma ile daha az kararsız ve daha dayanıklı hale gelir. Yeniden çalışıldıkça, organik bileşikler, fiziksel karıştırma, parçacıklarla değişim ve / veya tüketici topluluğu tarafından organik moleküllerin üretimi yoluyla toplu DOM havuzuna sürekli olarak eklenmektedir.[136][137][138][139] Bu nedenle, bozunma sırasında meydana gelen bileşim değişiklikleri, daha kararsız bileşenlerin basitçe çıkarılmasından ve sonuçta kalan, daha az kararsız bileşiklerin birikmesinden daha karmaşıktır.[76]
Çözünmüş organik madde yeniden hesaplaması (yani, bozunmaya ve / veya kullanıma karşı genel reaktivitesi) bu nedenle ortaya çıkan bir özelliktir. DOM yeniden hesaplama algısı, organik madde bozunması sırasında ve söz konusu DOM havuzuna organik bileşikleri çıkaran veya ekleyen diğer herhangi bir işlemle bağlantılı olarak değişir.[76]
Metallerle etkileşim
DOC ayrıca metaller su sistemlerinde. Metal formu kompleksler DOC ile metal çözünürlüğünü artırırken metali azaltır biyoyararlanım.
DOM izolasyonu ve analizi
DOM, doğrudan analiz için doğada düşük konsantrasyonlarda bulunur. NMR veya HANIM. Ayrıca, DOM numuneleri genellikle bu tür tekniklerle uyumsuz olan yüksek konsantrasyonlarda inorganik tuzlar içerir.[140] Bu nedenle numunenin bir konsantrasyon ve izolasyon aşaması gereklidir.[141][142] En çok kullanılan izolasyon teknikleri ultrafiltrasyon, ters osmoz ve katı fazlı ekstraksiyon.[143] Aralarında katı fazlı ekstraksiyon en ucuz ve en kolay teknik olarak kabul edilir[144]
Ayrıca bakınız
Referanslar
- ^ Roshan, S. ve DeVries, T. (2017) "Oligotrofik okyanusta verimli çözünmüş organik karbon üretimi ve ihracatı". Doğa İletişimi, 8(1): 1–8. doi:10.1038 / s41467-017-02227-3.
- ^ "Organik karbon". Biyo-jeokimyasal Yöntemler. Alındı 2018-11-27.
- ^ Kenny, Jonathan E .; Bida, Morgan; Pagano, Todd (Ekim 2014). "Doğal Sudaki Allokton Çözünmüş Organik Karbon Düzeylerindeki Eğilimler: Değişen İklim Altındaki Potansiyel Mekanizmaların İncelenmesi". Su. 6 (10): 2862–2897. doi:10.3390 / w6102862.
- ^ Moody, C.S. ve Worrall, F. (2017) "DOM bileşimi ve hidroklimatik değişkenler kullanarak DOC bozunma hızlarını modelleme". Jeofizik Araştırma Dergisi: Biyojeoloji, 122(5): 1175–1191. doi:10.1002 / 2016JG003493.
- ^ Hedges, John I. (3 Aralık 1991). "Küresel biyojeokimyasal döngüler: ilerleme ve sorunlar" (PDF). Deniz Kimyası. 39 (1–3): 67–93. doi:10.1016 / 0304-4203 (92) 90096-sn.
- ^ Kritzberg, Emma S .; Cole, Jonathan J .; Hız, Michael L .; Granéli, Wilhelm; Bade, Darren L. (Mart 2004). "Otokton ve alokton karbon bakteri kaynakları: Bütün gölden sonuçlar 13Ek deneyler " (PDF). Limnoloji ve Oşinografi. 49 (2): 588–596. Bibcode:2004 LimitOc..49..588K. doi:10.4319 / lo.2004.49.2.0588. ISSN 0024-3590.
- ^ a b c d e f g h ben j k l m n Lønborg, C., Carreira, C., Jickells, T. ve Álvarez-Salgado, X.A. (2020) "Küresel değişimin okyanusta çözünmüş organik karbon (DOC) döngüsü üzerindeki etkileri". Deniz Bilimlerinde Sınırlar, 7: 466. doi:10.3389 / fmars.2020.00466.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ Monroy, P., Hernández-García, E., Rossi, V. and López, C. (2017) "Okyanus akışında biyojenik parçacıkların dinamik batışının modellenmesi". Jeofizikte Doğrusal Olmayan Süreçler, 24(2): 293–305. doi:10.5194 / npg-24-293-2017.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 3.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 3.0 Uluslararası Lisansı. - ^ Simon, M., Grossart, H., Schweitzer, B. ve Ploug, H. (2002) "Sucul ekosistemlerde organik agregaların mikrobiyal ekolojisi". Sucul mikrobiyal ekoloji, 28: 175–211. doi:10.3354 / ame028175.
- ^ Kirchman, David L .; Suzuki, Yoshimi; Garside, Christopher; Ducklow, Hugh W. (15 Ağustos 1991). "Bir bahar fitoplankton patlaması sırasında yüksek çözünmüş organik karbon devir hızları". Doğa. 352 (6336): 612–614. Bibcode:1991Natur.352..612K. doi:10.1038 / 352612a0. S2CID 4285758.
- ^ Jaeckle, W.B .; Manahan, D.T. (1989). "Beslenmeyen" bir larvayla beslenme: deniz suyundan çözünmüş amino asitlerin gastropodun lesitotrofik larvaları tarafından alınması Haliotis rufescens". Deniz Biyolojisi. 103: 87–94. doi:10.1007 / BF00391067. S2CID 84541307.
- ^ Cheremisinoff, Nicholas; Davletshin Anton (2015). "Hidrolik Çatlatma İşlemleri: Çevre Yönetimi Uygulamaları El Kitabı". Çevre Yönetimi. ISBN 9781119099994.
- ^ Elser, Stephen (2014). "Kahverengi Su: Göllerde Artan Çözünmüş Organik Karbonun Ekolojik ve Ekonomik Etkileri". Alıntı dergisi gerektirir
| günlük =(Yardım) - ^ Wu, Qing; Zhao, Xin-Hua; Wang, Xiao-Dan (2008). "Çin'in Kuzey Şehrindeki İçme Suyu Dağıtım Şebekelerinde Heterotrofik Bakteriler ile Bazı Fiziksel ve Kimyasal Parametreler Arasındaki İlişki". 2008 2. Uluslararası Biyoinformatik ve Biyomedikal Mühendisliği Konferansı. sayfa 4713–4716. doi:10.1109 / ICBBE.2008.336. ISBN 978-1-4244-1747-6. S2CID 24876521.
- ^ "Çözünmüş Organik Karbon (DOC)".
- ^ Narayana, P.S .; Varalakshmi, D; Pullaiah, T; Sambasiva Rao, K.R.S. (2018). Zoolojide Araştırma Metodolojisi. s. 225. ISBN 9789388172400.
- ^ "Whatman® cam mikrofiber filtreler, Sınıf GF / F". Merck.
- ^ Knap, A. Michaels; A. Kapat; A. Ducklow; H. Dickson, A. (1994). Ortak Küresel Okyanus Akısı çalışmaları (JGOFS) çekirdek ölçümleri için protokoller. JGOFS.
- ^ Cauwet G (2002) "Kıyı Bölgesinde DOM". İçinde: Hansell D ve Carlson C (Ed.) Denizde Çözünmüş Organik Maddenin Biyojeokimyası, sayfalar 579–610, Elsevier. ISBN 9780080500119.
- ^ Tremblay, L. ve Benner, R. (2006) "Çürüyen bitki artıklarında N-immobilizasyonuna ve organik madde korumasına mikrobiyal katkılar". Geochimica et Cosmochimica Açta, 70(1): 133–146. doi:10.1016 / j.gca.2005.08.024.
- ^ Jiao, N., Herndl, GJ, Hansell, DA, Benner, R., Kattner, G., Wilhelm, SW, Kirchman, DL, Weinbauer, MG, Luo, T., Chen, F. ve Azam, F. ( 2010) "İnatçı çözünmüş organik maddenin mikrobiyal üretimi: küresel okyanusta uzun vadeli karbon depolaması". Doğa İncelemeleri: Mikrobiyoloji, 8(8): 593–599. doi:10.1038 / nrmicro2386.
- ^ Lee, S.A., Kim, T.H. ve Kim, G. (2020) "Karasal ve denizdeki çözünmüş organik karbon kaynaklarının sabit karbon izotopları kullanılarak bir kıyı koyunda izlenmesi". Biyojeoloji, 17(1). doi:10.5194 / bg-17-135-2020.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ a b Vahatalo, A.V., Aarnos, H. ve Mantyniemi, S. (2010). Beta dağılımı ile tanımlanan doğal organik maddenin biyolojik parçalanabilirlik sürekliliği ve biyolojik bozunma kinetiği. Biyojeokimya 100, 227–240. doi: 10.1007 / s10533-010-9419-4
- ^ a b Hansell, D.A. (2013). Rekalsitrant çözünmüş organik karbon fraksiyonları. Ann. Rev. Mar. Sci. 5, 421–445. doi: 10.1146/annurev-marine-120710-100757
- ^ a b Amon, R. M. W., and Benner, R. (1996). Bacterial utilization of different size classes of dissolved organic matter. Limnol. Oceanogr. 41, 41–51. doi: 10.4319/lo.1996.41.1.0041
- ^ Benner, R., and Amon, R. M. (2015). The size-reactivity continuum of major bioelements in the ocean. Ann. Rev. Mar. Sci. 7, 185–205. doi: 10.1146/annurev-marine-010213-135126
- ^ Thingstad, T. F., Havskum, H., Kaas, H., Nielsen, T. G., Riemann, B., Lefevre, D., et al. (1999). Bacteria-protist interactions and organic matter degradation under P-limited conditions: analysis of an enclosure experiment using a simple model. Limnol. Oceanogr. 44, 62–79. doi: 10.4319/lo.1999.44.1.0062
- ^ Del-Giorgio, P., and Davies, J. (2003). “Patterns of dissolved organic matter lability and consumption across aquatic ecosystems,” in Aquatic Ecosystems: Interactivity of Dissolved Organic Matter, eds S. E. G. Findlay and R. L. Sinsabaugh (San Diego, CA: Academic Press), 399–424. doi: 10.1016/B978-012256371-3/50018-4
- ^ Bianchi, T. S. (2011). The role of terrestrially derived organic carbon in the coastal ocean: a changing paradigm and the priming effect. Proc. Natl. Acad. Sci. U.S.A. 108, 19473–19481. doi: 10.1073/pnas.1017982108
- ^ Kattner, G., Simon, M., and Koch, B. P. (2011). “Molecular characterization of dissolved organic matter and constraints for prokaryotic utilization,” in Microbial Carbon Pump in the Ocean, eds N. Jiao, F. Azam, and S. Sansers (Washington, DC: Science/AAAS).
- ^ Keil, R. G., and Mayer, L. M. (2014). “Mineral matrices and organic matter,” in Treatise on Geochemistry, 2nd Edn, eds H. Holland and K. Turekian (Oxford: Elsevier), 337–359. doi: 10.1016/B978-0-08-095975-7.01024-X
- ^ Bianchi, T. S., Cui, X., Blair, N. E., Burdige, D. J., Eglinton, T. I., and Galy, V. (2018). Centers of organic carbon burial and oxidation at the land-ocean interface. Org. Geochem. 115, 138–155. doi: 10.1016/j.orggeochem.2017.09.008
- ^ Ward, N. D., Keil, R. G., Medeiros, P. M., Brito, D. C., Cunha, A. C., Dittmar, T., et al. (2013). Degradation of terrestrially derived macromolecules in the Amazon River. Nat. Geosci. 6, 530–533. doi: 10.1038/ngeo1817
- ^ Myers-Pigg, A. N., Louchouarn, P., Amon, R. M. W., Prokushkin, A., Pierce, K., and Rubtsov, A. (2015). Labile pyrogenic dissolved organic carbon in major Siberian Arctic rivers: implications for wildfire-stream metabolic linkages. Geophys. Res. Lett. 42, 377–385. doi: 10.1002/2014GL062762
- ^ a b c Gmach, M.R., Cherubin, M.R., Kaiser, K. and Cerri, C.E.P. (2020) "Processes that influence dissolved organic matter in the soil: a review". Scientia Agricola, 77(3). doi:10.1590/1678-992x-2018-0164.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ a b Shen, Y., Chapelle, F.H., Strom, E.W. and Benner, R. (2015) "Origins and bioavailability of dissolved organic matter in groundwater". Biyojeokimya, 122(1): 61–78. doi:10.1038 / s41467-019-11394-4.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ a b Reitsema, R.E., Meire, P. and Schoelynck, J. (2018) "The future of freshwater macrophytes in a changing world: dissolved organic carbon quantity and quality and its interactions with macrophytes". Bitki biliminde sınırlar, 9: 629. doi:10.3389/fpls.2018.00629.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ a b Thomas, J. D. (1997). The role of dissolved organic matter, particularly free amino acids and humic substances, in freshwater ecosystems. Freshw. Biol. 38, 1–36. doi: 10.1046/j.1365-2427.1997.00206.x
- ^ Cole, J. J., Prairie, Y. T., Caraco, N. F., McDowell, W. H., Tranvik, L. J., Striegl, R. G., et al. (2007). Plumbing the global carbon cycle: integrating inland waters into the terrestrial carbon budget. Ecosystems 10, 172–185. doi: 10.1007/s10021-006-9013-8
- ^ Raymond, P. A., Hartmann, J., Lauerwald, R., Sobek, S., McDonald, C., Hoover, M., et al. (2013). Global carbon dioxide emissions from inland waters. Nature 503, 355–359. doi: 10.1038/nature12760
- ^ Kalbitz, K.; Solinger, S.; Park, J.H .; Michalzik, B .; Matzner, E. 2000. Controls on the dynamics of dissolved organic matter in soils: a review. Soil Science 165: 277–304.
- ^ Zech, W .; Senesi, N.; Guggenberger, G .; Kaiser, K.; Lehmann, J .; Miano, T.M.; Miltner, A.; Schroth, G. 1997. Factors controlling humification and mineralization of soil organic matter in the tropics. Geoderma 79: 117–161.
- ^ a b Saidy, A.R.; Smernik, R.J.; Baldock, J.A.; Kaiser, K.; Sanderman, J. 2015. Microbial degradation of organic carbon sorbed to phyllosilicate clays with and without hydrous iron oxide coating. European Journal of Soil Science 66: 83–94.
- ^ Kaiser, K.; Guggenberger, G. 2007. Sorptive stabilization of organic matter by microporous goethite: sorption into small pores vs. surface complexation. European Journal of Soil Science 58: 45–59.
- ^ Veum, K.S.; Goyne, K.W.; Motavalli, P.P.; Udawatta, R.P. 2009. Runoff and dissolved organic carbon loss from a paired-watershed study of three adjacent agricultural Watersheds. Agriculture, Ecosystems & Environment 130: 115–122.
- ^ Veum, K.S.; Goyne, K.W.; Motavalli, P.P.; Udawatta, R.P. 2009. Runoff and dissolved organic carbon loss from a paired-watershed study of three adjacent agricultural Watersheds. Agriculture, Ecosystems & Environment 130: 115–122.
- ^ Sparling, G.; Chibnall, E.; Pronger, J.; Rutledge, S.; Wall, A.; Campbell, D .; Schipper, L. 2016. Estimates of annual leaching losses of dissolved organic carbon from pastures on Allophanic soils grazed by dairy cattle, Waikato, New Zealand. New Zealand Journal of Agricultural Research 59: 32–49.
- ^ Sobek, S., Tranvik, L. J., Prairie, Y. T., Kortelainen, P., and Cole, J. J. (2007). Patterns and regulation of dissolved organic carbon: an analysis of 7,500 widely distributed lakes. Limnol. Oceanogr. 52, 1208–1219. doi: 10.4319/lo.2007.52.3.1208
- ^ Stumm, W., and Morgan, J. J. (1996). Aquatic Chemistry: Chemical Equilibria and Rates in Natural Waters. Çevre Bilimi ve Teknolojisi. New York: John Wiley & Sons, Inc.
- ^ Madsen, T. V., and Sand-Jensen, K. (1991). Photosynthetic carbon assimilation in aquatic macrophytes. Aquat. Bot. 41, 5–40. doi: 10.1016/0304-3770(91)90037-6
- ^ Regnier, P., Friedlingstein, P., Ciais, P., Mackenzie, F. T., Gruber, N., Janssens, I. A., et al. (2013). Anthropogenic perturbation of the carbon fluxes from land to ocean. Nat. Geosci. 6, 597–607. doi: 10.1038/ngeo1830
- ^ Luyssaert, S., Abril, G., Andres, R., Bastviken, D., Bellassen, V., Bergamaschi, P., et al. (2012). The European land and inland water CO2, CO, CH4 and N2O balance between 2001 and 2005. Biogeosciences 9, 3357–3380. doi: 10.5194/bg-9-3357-2012
- ^ Kawasaki, N., and Benner, R. (2006). Bacterial release of dissolved organic matter during cell growth and decline: molecular origin and composition. Limnol. Oceanogr. 51, 2170–2180. doi: 10.4319/lo.2006.51.5.2170
- ^ Lønborg, C., Álvarez-Salgado, X. A., Davidson, K., and Miller, A. E. J. (2009). Production of bioavailable and refractory dissolved organic matter by coastal heterotrophic microbial populations. Haliç. Sahil. Shelf Sci. 82, 682–688. doi: 10.1016/j.ecss.2009.02.026
- ^ Wada, S., Aoki, M. N., Tsuchiya, Y., Sato, T., Shinagawa, H., and Hama, T. (2007). Quantitative and qualitative analyses of dissolved organic matter released from Ecklonia cava Kjellman, in Oura Bay, Shimoda, Izu Peninsula, Japan. J. Exp. Mar. Biol. Ecol. 349, 344–358. doi: 10.1016/j.jembe.2007.05.024
- ^ Willey, J. D., Kieber, R. J., Eyman, M. S. Jr., and Brooks Avery, G. (2000). Rainwater dissolved organic carbon concentrations and global flux. Glob. Biogeochem. Cycles 14, 139–148. doi: 10.1029/1999GB900036
- ^ Raymond, P. A., and Spencer, R. G. M. (2015). “Riverine DOM,” in Biogeochemistry of Marine Dissolved Organic Matter, eds D. A. Hansell and C. A. Carlson (Amsterdam: Elsevier), 509–533. doi: 10.1016/B978-0-12-405940-5.00011-X
- ^ Dachs, J., and Méjanelle, L. (2010). Organic pollutants in coastal waters, sediments, and biota: a relevant driver for ecosystems during the anthropocene? Estuarines Coasts 33, 1–14. doi: 10.1007/s12237-009-9255-8
- ^ Raymond, P. A., and Spencer, R. G. M. (2015). “Riverine DOM,” in Biogeochemistry of Marine Dissolved Organic Matter, eds D. A. Hansell and C. A. Carlson (Amsterdam: Elsevier), 509–533. doi: 10.1016/B978-0-12-405940-5.00011-X
- ^ Karl, D. M., Hebel, D. V., Bjorkman, K., and Letelier, R. M. (1998). The role of dissolved organic matter release in the productivity of the oligotrophic north Pacific Ocean. Limnol. Oceanogr. 43, 1270–1286. doi: 10.4319/lo.1998.43.6.1270
- ^ Wetz, M. S., and Wheeler, P. A. (2007). Release of dissolved organic matter by coastal diatoms. Limnol. Oceanogr. 52, 798–807. doi: 10.4319/lo.2007.52.2.0798
- ^ Thornton, D. C. O. (2014). Dissolved organic matter (DOM) release by phytoplankton in the contemporary and future ocean. Avro. J. Phycol. 49, 20–46. doi: 10.1080/09670262.2013.875596
- ^ Boekell, W. H. M. V., Hansen, F. C., Riegman, R., and Bak, R. P. M. (1992). Lysis-induced decline of a Phaeocystis spring bloom and coupling with the microbial foodweb. Mart Ecol. Prog. Ser. 81, 269–276. doi: 10.3354/meps081269
- ^ a b Hygum, B. H., Petersen, J. W., and Søndergaard, M. (1997). Dissolved organic carbon released by zooplankton grazing activity- a high quality substrate pool for bacteria. J. Plankton Res. 19, 97–111. doi: 10.1093/plankt/19.1.97
- ^ Lampert, W. (1978). Release of dissolved organic carbon by grazing zooplankton. Limnol. Oceanogr. 23, 831–834. doi: 10.4319/lo.1978.23.4.0831
- ^ Jumars, P. A., Penry, D. L., Baross, J. A., and Perry, M. J. (1989). Closing the microbial loop: dissolved carbon pathway to heterotrophic bacteria from incomplete ingestion, digestion and absorption in animals. Deep Sea Res. 36, 483–495. doi: 10.1016/0198-0149(89)90001-0
- ^ Iturriaga, R., and Zsolnay, A. (1981). Transformation of some dissolved organic compounds by a natural heterotrophic population. Mar. Biol. 62, 125–129. doi: 10.1007/BF00388174
- ^ Ogawa, H., Amagai, Y., Koike, I., Kaiser, K., and Benner, R. (2001). Production of refractory dissolved organic matter by bacteria. Science 292, 917–920. doi: 10.1126/science.1057627
- ^ Kawasaki, N., and Benner, R. (2006). Bacterial release of dissolved organic matter during cell growth and decline: molecular origin and composition. Limnol. Oceanogr. 51, 2170–2180. doi: 10.4319/lo.2006.51.5.2170
- ^ McCarthy, M., Pratum, T., Hedges, J., and Benner, R. (1997). Chemical composition of dissolved organic nitrogen in the ocean. Nature 390, 150–154. doi: 10.1038/36535
- ^ Suttle, C. A. (2005). Viruses in the sea. Nature 437, 356–361. doi: 10.1038/nature04160
- ^ Weinbauer, M. A. G. (2004). Ecology of prokaryotic viruses. FEMS Microbiol. Rev. 28, 127–181. doi: 10.1016/j.femsre.2003.08.001
- ^ Lønborg, C., Middelboe, M., and Brussaard, C. P. D. (2013). Viral lysis of Micromonas pusilla: impacts on dissolved organic matter production and composition. Biogeochemistry 116, 231–240. doi: 10.1007/s10533-013-9853-1
- ^ Krabberød, AK; Bjorbækmo, MFM; Şalçyan-Tebrizi, K .; Logares, R. (2017). "Exploring the oceanic microeukaryotic interactome with metaomics approaches". Sucul Mikrobiyal Ekoloji. 79: 1–12. doi:10.3354/ame01811.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı - ^ Delong, Edward F.; Karl, David M. (2005). "Genomic perspectives in microbial oceanography". Doğa. 437 (7057): 336–342. doi:10.1038/nature04157. PMID 16163343. S2CID 4400950.
- ^ a b c d e Wagner, S., Schubotz, F., Kaiser, K., Hallmann, C., Waska, H., Rossel, P.E., Hansman, R., Elvert, M., Middelburg, J.J., Engel, A. and Blattmann, T.M. (2020) "Soothsaying DOM: A current perspective on the future of oceanic dissolved organic carbon". Deniz Bilimlerinde Sınırlar, 7:341. doi:10.3389/fmars.2020.00341.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ Brilinsky, M. (1977). Release of dissolved organic matter by some marine macrophytes. Mar. Biol. 39, 213–220. doi: 10.1007/BF00390995
- ^ Pregnall, A. M. (1983). Release of dissolved organic carbon from the estuarine intertidal macroalga Enteromorpha prolifera. Mar. Biol. 73, 37–42. doi: 10.1007/BF00396283
- ^ Penhale, P. A., and Smith, W. O. (1977). Excretion of dissolved organic carbon by eelgrass (Zostera marina) and its epiphytes. Limnol. Oceanogr. 22, 400–407. doi: 10.4319/lo.1977.22.3.0400
- ^ a b Barrón, C., and Duarte, C. M. (2015). Dissolved organic carbon pools and export from the coastal ocean. Glob. Biogeochem. Cycles 29, 1725–1738. doi: 10.1002/2014GB005056
- ^ Barrón, C., and Duarte, C. M. (2015). Dissolved organic carbon pools and export from the coastal ocean. Glob. Biogeochem. Cycles 29, 1725–1738. doi: 10.1002/2014GB005056
- ^ Martin, P., Cherukuru, N., Tan, A.S., Sanwlani, N., Mujahid, A. and Müller, M.(2018) "Distribution and cycling of terrigenous dissolved organic carbon in peatland-draining rivers and coastal waters of Sarawak, Borneo", Biyojeoloji, 15(2): 6847–6865. doi:10.5194/bg-15-6847-2018.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ Hewson, I., O’neil, J. M., Fuhrman, J. A., and Dennison, W. C. (2001). Virus-like particle distribution and abundance in sediments and overlying waters along eutrophication gradients in two subtropical estuaries. Limnol. Oceanogr. 46, 1734–1746. doi: 10.4319/lo.2001.46.7.1734
- ^ Burdige, D. J., and Gardner, K. G. (1998). Molecular weight distribution of dissolved organic carbon in marine sediment pore waters. Mar. Chem. 62, 45–64. doi: 10.1016/S0304-4203(98)00035-8
- ^ Burdige, D. J., and Komada, T. (2014). “Sediment pore waters,” in Biogeochemistry of Marine Dissolved Organic Matter, eds D. A. Hansen and C. A. Carlson (Cambridge, MA: Academic Press), 535–577. doi: 10.1016/B978-0-12-405940-5.00012-1
- ^ Komada, T., and Reimers, C. E. (2001). Resuspension-induced partitioning of organic carbon between solid and solution phases from a river–ocean transition. Mar. Chem. 76, 155–174. doi: 10.1016/S0304-4203(01)00055-X
- ^ Dittmar, T., and Koch, B. P. (2006). Thermogenic organic matter dissolved in the abyssal ocean. Mar. Chem. 102, 208–217. doi: 10.1016/j.marchem.2006.04.003
- ^ Dittmar, T., and Paeng, J. (2009). A heat-induced molecular signature in marine dissolved organic matter. Nat. Geosci. 2, 175–179. doi: 10.1038/ngeo440
- ^ Burnett, W. C., Aggarwal, P. K., Aureli, A., Bokuniewicz, H., Cable, J. E., Charette, M. A., et al. (2006). Quantifying submarine groundwater discharge in the coastal zone via multiple methods. Sci. Total Environ. 367, 498–543. doi: 10.1016/j.scitotenv.2006.05.009
- ^ Longnecker, K., and Kujawinski, E. B. (2011). Composition of dissolved organic matter in groundwater. Geochim. Cosmochim. Acta 75, 2752–2761. doi: 10.1016/j.gca.2011.02.020
- ^ Webb, J. R., Santos, I. R., Maher, D. T., Tait, D. R., Cyronak, T., Sadat-Noori, M., et al. (2019). Groundwater as a source of dissolved organic matter to coastal waters: insights from radon and CDOM observations in 12 shallow coastal systems. Limnol. Oceanogr. 64, 182–196. doi: 10.1002/lno.11028
- ^ Lang, S. Q., Butterfield, D. A., Lilley, M. D., Paul Johnson, H., and Hedges, J. I. (2006). Dissolved organic carbon in ridge-axis and ridge-flank hydrothermal systems. Geochim. Cosmochim. Acta 70, 3830–3842. doi: 10.1016/j.gca.2006.04.031
- ^ Kerner, M., Hohenberg, H., Ertl, S., Reckermann, M., and Spitzy, A. (2003). Self-organization of dissolved organic matter tomicelle-like microparticles in river water. Nature 422, 150–154. doi: 10.1038/nature01469
- ^ Chin, W. C., Orellana, M. V., and Verdugo, P. (1998). Spontaneous assembly of marine dissolved organic matter into polymer gels. Nature 391, 568–572. doi: 10.1038/35345
- ^ Moran, M. A., and Zepp, R. G. (1997). Role of photoreactions in the formation of biologically labile compounds from dissolved organic matter. Limnol. Oceanogr. 42, 1307–1316. doi: 10.4319/lo.1997.42.6.1307
- ^ Mopper, K., Kieber, D. J., and Stubbins, A. (2015). “Marine photochemistry of organic matter,” in Biogeochemistry of Marine Dissolved Organic Matter, eds C. A. Carlson and D. A. Hansell (Amsterdam: Elsevier), 389–450. doi: 10.1016/B978-0-12-405940-5.00008-X
- ^ Lønborg, C., and Álvarez-Salgado, X. A. (2012). Recycling versus export of bioavailable dissolved organic matter in the coastal ocean and efficiency of the continental shelf pump. Glob. Biogeochem. Cycles 26:GB3018. doi: 10.1029/2012GB004353
- ^ Carlson, C. A., and Hansell, D. A. (2015). “DOM sources, sinks, reactivity, and budgets,” in Biogeochemistry of Marine Dissolved Organic Matter, eds C. A. Carlson and D. A. Hansell (San Diego, CA: Academic Press), 65–126. doi: 10.1016/B978-0-12-405940-5.00003-0
- ^ Shen, Y. and Benner, R. (2018) "Mixing it up in the ocean carbon cycle and the removal of refractory dissolved organic carbon". Bilimsel raporlar, 8(1): 1–9. doi:10.1038/s41598-018-20857-5.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ Lang, S. Q., Butterfield, D. A., Lilley, M. D., Paul Johnson, H., and Hedges, J. I. (2006). Dissolved organic carbon in ridge-axis and ridge-flank hydrothermal systems. Geochim. Cosmochim. Acta 70, 3830–3842. doi: 10.1016/j.gca.2006.04.031
- ^ a b Sholkovitz, E. R. (1976). Flocculation of dissolved organic and inorganic matter during the mixing of river water and seawater. Geochim. Cosmochim. Acta 40, 831–845. doi: 10.1016/0016-7037(76)90035-1
- ^ Tranvik, L. J., and Sieburth, J. M. (1989). Effects of flocculated humic matter on free and attached pelagic microorganisms. Limnol. Oceanogr. 34, 688–699. doi: 10.4319/lo.1989.34.4.0688
- ^ Mulholland, P. J. (1981). Formation of Particulate Organic Carbon in Water from a Southeastern Swamp-Stream. Limnol. Oceanogr. 26, 790–795. doi: 10.4319/lo.1981.26.4.0790
- ^ Powell, R. T., Landing, W. M., and Bauer, J. E. (1996). Colloidal trace metals, organic carbon and nitrogen in a southeastern U.S. estuary. Mar. Chem. 55, 165–176. doi: 10.1016/S0304-4203(96)00054-0
- ^ Sholkovitz, E. R., Boyle, E. A., and Price, N. B. (1978). The removal of dissolved humic acids and iron during estuarine mixing. Dünya gezegeni. Sci. Lett. 40, 130–136. doi: 10.1016/0012-821X(78)90082-1
- ^ Volk, C., Bell, K., Ibrahim, E., Verges, D., Amy, G., and Lechevallier, M. (2000). Impact of enhanced and optimized coagulation on removal of organic matter and its biodegradable fraction in drinking water. Su Res. 34, 3247–3257. doi: 10.1016/S0043-1354(00)00033-6
- ^ Williamson, C. E., Stemberger, R. S., Morris, D. P., Frost, T. A., and Paulsen, S. G. (1996). Ultraviolet radiation in North American lakes: attenuation estimates from DOC measurements and implications for plankton communities. Limnol. Oceanogr. 41, 1024–1034. doi: 10.4319/lo.1996.41.5.1024
- ^ Williamson, C. E., Overholt, E. P., Pilla, R. M., Leach, T. H., Brentrup, J. A., Knoll, L. B., et al. (2015). Ecological consequences of longterm browning in lakes. Sci. Rep. 5:18666. doi: 10.1038/srep18666
- ^ Jeffrey, W. H., Aas, P., Lyons, M. M., Coffin, R. B., Pledger, R. J., and Mitchell, D. L. (1996). Ambient solar radiation-induced photodamage in marine bacterioplankton. Photochem. Photobiol. 64, 419–427. doi: 10.1111/j.1751-1097.1996.tb03086.x
- ^ Rhode, S. C., Pawlowski, M., and Tollrian, R. (2001). The impact of ultraviolet radiation on the vertical distribution of zooplankton of the genus Daphnia. Nature 412, 69–72. doi: 10.1038/35083567
- ^ Mopper, K., Kieber, D. J., and Stubbins, A. (2015). “Marine photochemistry of organic matter,” in Biogeochemistry of Marine Dissolved Organic Matter, eds C. A. Carlson and D. A. Hansell (Amsterdam: Elsevier), 389–450. doi: 10.1016/B978-0-12-405940-5.00008-X
- ^ Miller, W. L., and Zepp, R. G. (1995). Photochemical production of dissolved inorganic carbon from terrestrial organic matter: significance of the oceanic organic carbon cycle. Geophys. Res. Lett. 22, 417–420. doi: 10.1029/94GL03344
- ^ Moran, M. A., and Zepp, R. G. (1997). Role of photoreactions in the formation of biologically labile compounds from dissolved organic matter. Limnol. Oceanogr. 42, 1307–1316. doi: 10.4319/lo.1997.42.6.1307
- ^ Moran, M. A., Sheldon, W. M., and Zepp, R. G. (2000). Carbon loss and optical property changes during long-term photochemical and biological degradation of estuarine dissolved organic matter. Limnol. Oceanogr. 45, 1254–1264. doi: 10.4319/lo.2000.45.6.1254
- ^ Kieber, R. J., Hydro, L. H., and Seaton, P. J. (1997). Photooxidation of triglycerides and fatty acids in seawater: implication toward the formation of marine humic substances. Limnol. Oceanogr. 42, 1454–1462. doi: 10.4319/lo.1997.42.6.1454
- ^ Berto, S., Laurentiis, E. D., Tota, T., Chiavazza, E., Daniele, P. G., Minella, M., et al. (2016). Properties of the humic-like material arising from the phototransformation of L-tyrosine. Sci. Total Environ. 546, 434–444. doi: 10.1016/j.scitotenv.2015.12.047
- ^ Hudson, J. J., Dillon, P. J., and Somers, K. M. (2003). Long-term patterns in dissolved organic carbon in boreal lakes: the role of incident radiation, precipitation, air temperature, southern oscillation and acid deposition. Hydrol. Earth Syst. Sci. 7, 390–398. doi: 10.5194/hess-7-390-2003
- ^ Benner, R., Benitez-Nelson, B., Kaiser, K., and Amon, R. M. W. (2004). Export of young terrigenous dissolved organic carbon from rivers to the Arctic Ocean. Geophys. Res. Lett. 31:L05305. doi: 10.1029/2003GL019251
- ^ Obernosterer, I., and Herndl, G. J. (1995). Phytoplankton extracellular release and bacterial growth: dependence on the inorganic N:P ratio. Mart Ecol. Prog. Ser. 116, 247–257. doi: 10.3354/meps116247
- ^ Benner, R., and Ziegler, S. (1999). “Do photochemical transformations of dissolved organic matter produce biorefractory as well as bioreactive substrates?” in Proceedings of the 8th International Symposium on Microbial Ecology, eds C. R. Bell, M. Brylinsky, and P. Johnson-Green (Port Aransas, TX: University of Texas at Austin).
- ^ Sulzberger, B., and Durisch-Kaiser, E. (2009). Chemical characterization of dissolved organic matter (DOM): a prerequisite for understanding UV-induced changes of DOM absorption properties and bioavailability. Aquat. Sci. 71, 104–126. doi: 10.1007/s00027-008-8082-5
- ^ Miller, W. L., and Moran, M. A. (1997). Interaction of photochemical and microbial processes in the degradation of refractory dissolved organic matter from a coastal marine environment. Limnol. Oceanogr. 42, 1317–1324. doi: 10.4319/lo.1997.42.6.1317
- ^ Moran, M. A., and Zepp, R. G. (1997). Role of photoreactions in the formation of biologically labile compounds from dissolved organic matter. Limnol. Oceanogr. 42, 1307–1316. doi: 10.4319/lo.1997.42.6.1307
- ^ Stubbins, A., Uher, G., Law, C. S., Mopper, K., Robinson, C., and Upstill-Goddard, R. C. (2006). Open-ocean carbon monoxide photoproduction. Deep Sea Res. II Top. Damızlık. Oceanogr. 53, 1695–1705. doi: 10.1016/j.dsr2.2006.05.011
- ^ Miller, W. L., Moran, M. A., Sheldon, W. M., Zepp, R. G., and Opsahl, S. (2002). Determination of apparent quantum yield spectra for the formation of biologically labile photoproducts. Limnol. Oceanogr. 47, 343–352. doi: 10.4319/lo.2002.47.2.0343
- ^ Andrews, S. S., and Zafiriou, O. C. (2000). Photochemical oxygen consumption in marine waters: a Major soink for colored dissolved organic matter? Limnol. Oceanogr. 45, 267–277. doi: 10.4319/lo.2000.45.2.0267
- ^ Wang, X.-C., Chen, R. F., and Gardner, G. B. (2004). Sources and transport of dissolved and particulate organic carbon in the Mississippi River estuary and adjacent coastal waters of the northern Gulf of Mexico. Mar. Chem. 89, 241–256. doi: 10.1016/j.marchem.2004.02.014
- ^ Sharp, Jonathan H. (6 August 1996). "Marine dissolved organic carbon: Are the older values correct?". Deniz Kimyası. 56 (3–4): 265–277. doi:10.1016/S0304-4203(96)00075-8.
- ^ Sondergaard, Morten; Mathias Middelboe (9 March 1995). "A cross-system analysis of labile dissolved organic carbon" (PDF). Deniz Ekolojisi İlerleme Serisi. 118: 283–294. Bibcode:1995MEPS..118..283S. doi:10.3354/meps118283.
- ^ Gruber, David F .; Jean-Paul Simjouw; Sybil P. Seitzinger; Gary L. Taghon (June 2006). "Dynamics and Characterization of Refractory Dissolved Organic Matter Produced by a Pure Bacterial Culture in an Experimental Predator-Prey System". Uygulamalı ve Çevresel Mikrobiyoloji. 72 (6): 4184–4191. doi:10.1128/AEM.02882-05. PMC 1489638. PMID 16751530.
- ^ Hansell, Dennis A.; Craig A. Carlson; Daniel J. Repeta; Reiner Schlitzer (2009). "Dissolved Organic Matter in the Ocean: A Controversy Stimulates New Insights". Oşinografi. 22 (4): 202–211. doi:10.5670/oceanog.2009.109. hdl:1912/3183.
- ^ Stubbins, A., Niggemann, J., and Dittmar, T. (2012). Photo-lability of deep ocean dissolved black carbon. Biogeosciences 9, 1661–1670. doi: 10.5194/bg-9-1661-2012
- ^ Hodson, R. E., Maccubbin, A. E., and Pomeroy, L. R. (1981). Dissolved adenosine triphosphate utilization by free-living and attached bacterioplankton. Mar. Biol. 64, 43–51. doi: 10.1007/bf00394079
- ^ Hollibaugh, J. T., and Azam, F. (1983). Microbial degradation of dissolved proteins in seawater. Limnol. Oceanogr. 28, 1104–1116. doi: 10.4319/lo.1983.28.6.1104
- ^ Ferguson, R. L., and Sunda, W. G. (1984). Utilization of amino acids by planktonic marine bacteria: importance of clean technique and low substrate additions. Limnol. Oceanogr. 29, 258–274. doi: 10.4319/lo.1984.29.2.0258
- ^ Ogawa, H., Amagai, Y., Kioke, I., Kaiser, K., and Benner, R. (2001). Production of refractory dissolved organic matter by bacteria. Science 292, 917–920. doi: 10.1126/science.1057627
- ^ Jiao, N., Herndl, G. J., Hansell, D. A., Benner, R., Kattner, G., Wilhelm, S. W., et al. (2010). Microbial production of recalcitrant dissolved organic matter: long-term carbon storage in the global ocean. Nat. Rev. Microbiol. 8, 593–599. doi: 10.1038/nrmicro2386
- ^ Kaiser, K., and Benner, R. (2008). Major bacterial contribution to the ocean reservoir of detrital organic carbon and nitrogen. Limnol. Oceanogr. 53, 99–112. doi: 10.4319/lo.2008.53.1.0099
- ^ Shen, Y., and Benner, R. (2018). Mixing it up in the ocean carbon cycle and the removal of refractory dissolved organic carbon. Sci. Rep. 8:2542. doi: 10.1038/s41598-018-20857-5
- ^ Nebbioso, Antonio; Piccolo, Alessandro (January 2013). "Molecular characterization of dissolved organic matter (DOM): a critical review". Analitik ve Biyoanalitik Kimya. 405 (1): 109–124. doi:10.1007/s00216-012-6363-2. ISSN 1618-2642.
- ^ Nebbioso, Antonio; Piccolo, Alessandro (January 2013). "Molecular characterization of dissolved organic matter (DOM): a critical review". Analitik ve Biyoanalitik Kimya. 405 (1): 109–124. doi:10.1007/s00216-012-6363-2. ISSN 1618-2642.
- ^ Minor, Elizabeth C.; Swenson, Michael M.; Mattson, Bruce M.; Oyler, Alan R. (2014). "Structural characterization of dissolved organic matter: a review of current techniques for isolation and analysis". Environ. Sci.: Processes Impacts. 16 (9): 2064–2079. doi:10.1039/C4EM00062E. ISSN 2050-7887.
- ^ Green, Nelson W.; Perdue, E. Michael; Aiken, George R.; Butler, Kenna D.; Chen, Hongmei; Dittmar, Thorsten; Niggemann, Jutta; Stubbins, Aron (2014-04-20). "An intercomparison of three methods for the large-scale isolation of oceanic dissolved organic matter". Deniz Kimyası. 161: 14–19. doi:10.1016/j.marchem.2014.01.012. ISSN 0304-4203.
- ^ Minor, Elizabeth C.; Swenson, Michael M.; Mattson, Bruce M.; Oyler, Alan R. (2014-08-21). "Structural characterization of dissolved organic matter: a review of current techniques for isolation and analysis". Çevre Bilimi: Süreçler ve Etkiler. 16 (9): 2064–2079. doi:10.1039/C4EM00062E. ISSN 2050-7895.
Dış bağlantılar
- Hansell DA and Carlson CA (Eds.) (2014) Biogeochemistry of Marine Dissolved Organic Matter, Second edition, Academic Press. ISBN 9780124071537.
- Stone, Richard (June 18, 2010). "Marine Biogeochemistry: The Invisible Hand Behind A Vast Carbon Reservoir". Bilim. 328 (5985): 1476–1477. Bibcode:2010Sci...328.1476S. doi:10.1126/science.328.5985.1476. PMID 20558685.



