Görünen molar özellik - Apparent molar property
Bir görünen molar özellik bir çözüm Bir karışım veya çözeltideki bileşen, karışımın ideal olmayışına her bileşenin katkısını izole etmek amacıyla tanımlanan bir miktardır. İlgili çözüm özelliğindeki değişikliği gösterir (örneğin, Ses ) bu bileşenin tamamı çözeltiye eklendiğinde, eklenen bileşen molü başına. Olarak tanımlanmaktadır bariz çünkü bu bileşenin molar özelliğini temsil ediyor gibi görünüyor çözümde, diğer çözelti bileşenlerinin özelliklerinin ekleme sırasında sabit kalacağı varsayılır. Bununla birlikte, bir bileşenin görünen molar özelliklerinin değerleri saf haldeki molar özelliklerinden oldukça farklı olabileceğinden, bu varsayım çoğu zaman haklı değildir.
Örneğin, iki bileşen içeren bir çözeltinin hacmi[1] gibi çözücü ve çözünen
nerede V0 ... Ses çözünen madde eklemeden önce saf çözücünün onun molar hacim (çözelti ile aynı sıcaklık ve basınçta), n0 sayısı benler çözücü görünen molar hacmi çözünen, ve n1 çözeltideki çözünen maddenin mol sayısıdır. Bu ilişkiyi bir bileşenin molar miktarına bölerek, bir bileşenin görünen molar özelliği ile bileşenlerin karışım oranı arasında bir ilişki elde edilebilir.
Bu denklemin tanımı olarak hizmet eder . İlk terim, çözünen madde içermeyen aynı miktardaki çözücünün hacmine eşittir ve ikinci terim, çözünen maddenin eklenmesiyle hacim değişimidir. daha sonra çözünen maddenin molar hacmi olarak düşünülebilir varsayılırsa çözücünün molar hacminin, çözünen ilavesiyle değişmediği. Bununla birlikte, bu varsayım, aşağıdaki Örneklerde gösterildiği gibi genellikle gerçekçi olmadığı düşünülmelidir. sadece bir bariz değer.
Çözücü olarak tanımlanan bileşen için görünür bir molar miktar benzer şekilde tanımlanabilir . Bazı yazarlar, aynı solüsyonun her iki (sıvı) bileşeninin de görünür molar hacimlerini rapor etmişlerdir.[2][3] Bu prosedür, üçlü ve çok bileşenli karışımlara genişletilebilir.
Görünen miktarlar, mol sayısı yerine kütle kullanılarak da ifade edilebilir. Bu ifade, görünen özgül hacim gibi, görünür özel miktarlar üretir.
belirli miktarların küçük harflerle gösterildiği yer.
Görünen (molar) özellikler sabit değildir (belirli bir sıcaklıkta bile), ancak bileşimin işlevleridir. Sonsuzda seyreltme, görünür bir molar özellik ve karşılık gelen kısmi molar özellik eşit olmak.
Yaygın olarak kullanılan bazı belirgin molar özellikler, görünür molar entalpi, belirgin molar ısı kapasitesi ve görünen molar hacim.
Molalite ile ilişkisi
Bir çözünen maddenin görünür (molal) hacmi, bir fonksiyonu olarak ifade edilebilir. molalite b bu çözünen madde (ve çözelti ve çözücünün yoğunlukları). Bir mol çözünen çözelti hacmi
Bir mol çözünen madde başına saf çözücü hacminin çıkarılması, görünen molal hacmini verir:
Daha fazla çözünen madde için, yukarıdaki eşitlik, sanki molaliteye sahip tek bir çözünmüş gibi çözünenlerin ortalama molar kütlesi ile değiştirilir bT:
- ,
Ürün molalitelerinin toplamı - ikili çözeltilerindeki görünür molar hacimler, çözünenlerin molalitelerinin toplamı ile yukarıda bahsedilen çok bileşenli çözeltinin üçlü halindeki görünür molar hacmi arasındaki ürüne eşittir.
- ,
Karışım oranıyla ilişkisi
Bir karışımın bir bileşeninin görünür molar ile molar karışım oranı arasındaki bir ilişki, tanım ilişkisini bölerek elde edilebilir.
bir bileşenin mol sayısına. Bu, aşağıdaki ilişkiyi verir:
Kısmi (molar) miktarlarla ilişki
Kısmi molar miktar ile görünen molar miktar arasındaki zıt tanımlara dikkat edin: Kısmi molar hacimler durumunda , tarafından tanımlanan
- ,
yazabiliriz , ve bu yüzden her zaman tutar. Buna karşılık, görünür molar hacim tanımında, saf çözücünün molar hacmi, yerine, şu şekilde yazılabilir:
- ,
Karşılaştırma için. Başka bir deyişle, çözücünün hacminin değişmediğini varsayıyoruz ve çözünen maddenin mol sayısının tam olarak sıfır olduğu kısmi molar hacmi kullanıyoruz ("molar hacim"). Böylece, görünür molar hacim için tanımlayıcı ifadede ,
- ,
dönem saf çözücüye atfedilirken "kalan" fazla hacim, , çözünen maddeden kaynaklandığı kabul edilir. İle yüksek seyreltmede , sahibiz ve böylece çözünen maddenin görünen molar hacmi ve kısmi molar hacmi de yakınsar: .
Kantitatif olarak, kısmi molar özellikler ile belirgin olanlar arasındaki ilişki, görünen miktarların ve molalitenin tanımından türetilebilir. Hacim için,
Bir elektrolitin aktivite katsayısı ve çözme kabuk sayısı ile ilişkisi
Oran ra Konsantre bir çözelti içinde çözünmüş bir elektrolitin görünen molar hacmi ile çözücünün (su) molar hacmi arasında, maddenin istatistiksel bileşenine bağlanabilir. aktivite katsayısı elektrolit ve onun çözme kabuğu numara h:[4]
,
ν, elektrolitin ayrışmasından kaynaklanan iyonların sayısıdır.
Örnekler
Elektrolitler
Bir tuzun görünen molar hacmi genellikle katı tuzun molar hacminden daha azdır. Örneğin, sağlam NaCl 27 cm'lik bir hacme sahiptir3 mol başına, ancak düşük konsantrasyonlarda görünen molar hacim yalnızca 16.6 cc / mol'dür. Aslında, biraz sulu elektrolitler negatif görünen molar hacimlere sahip olanlar: NaOH −6.7, LiOH −6.0 ve Na2CO3 −6,7 cm3/köstebek.[5] Bu, belirli bir miktarda sudaki çözeltilerinin aynı miktarda saf sudan daha küçük bir hacme sahip olduğu anlamına gelir. (Ancak etki küçüktür.) Fiziksel neden, yakındaki su moleküllerinin iyonlara güçlü bir şekilde çekilmesi ve böylece daha az yer kaplamasıdır.
Alkol
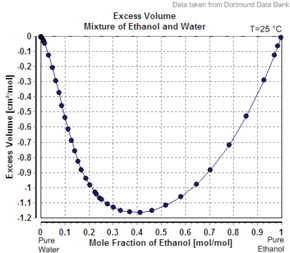
İkinci bileşenin görünen molar hacminin, saf bir madde olarak molar hacminden daha az olmasının bir başka örneği, etanol Suda. Örneğin, 20'de kitle yüzdeleri etanol, çözümün bir hacmi var 20 ° C'de kg başına 1.0326 litre, saf su ise 1.0018 L / kg'dır (1.0018 cc / g).[6] Eklenen etanolün görünen hacmi 1.0326 L - 0.8 kg x 1.0018 L / kg = 0.2317 L'dir. Etanolün mol sayısı 0.2 kg / (0.04607 kg / mol) = 4.341 mol'dür, böylece görünen molar hacim 0.2317'dir. L / 4,341 mol = 0,0532 L / mol = 53,2 cc / mol (1,16 cc / g). Bununla birlikte, saf etanol, bu sıcaklıkta 58.4 cc / mol (1.27 cc / g) bir molar hacme sahiptir.
Çözüm olsaydı ideal hacmi, karıştırılmamış bileşenlerin toplamı olacaktır. 0,2 kg saf etanol hacmi 0,2 kg x 1,27 L / kg = 0,254 L ve 0,8 kg saf su hacmi 0,8 kg x 1,0018 L / kg = 0,80144 L'dir, dolayısıyla ideal çözelti hacmi 0,254 L + 0,80144 olacaktır. L = 1.055 L Çözeltinin idealsizliği, karıştırmanın ardından kombine sistemin hacminde hafif bir azalma (kabaca% 2.2, 1.0326 yerine 1.055 L / kg) ile yansıtılır. Etanol yüzdesi% 100'e yükseldikçe, görünen molar hacim saf etanolün molar hacmine yükselir.
Elektrolit - elektrolit olmayan sistemler
Görünen miktarlar, elektrolit - elektrolit olmayan sistemlerdeki etkileşimlerin altını çizebilir; tuzlama ve tuzlamak ama aynı zamanda iyon-iyon etkileşimleri, özellikle sıcaklığa bağımlılıkları ile ilgili fikir verir.
Çok bileşenli karışımlar veya çözeltiler
Çok bileşenli çözümler için, görünen molar özellikler birkaç yolla tanımlanabilir. Bir hacmi için üçlü Örnek olarak bir çözücü ve iki çözünen içeren (3 bileşenli) çözelti, yine de sadece bir denklem olacaktır , ki bu iki görünen hacmi belirlemek için yetersizdir. (Bu, zıttır kısmi molar özellikler iyi tanımlanmış yoğun özellikler ve bu nedenle çok bileşenli sistemlerde açıkça tanımlanmıştır. Örneğin, her bileşen için kısmi molar hacim tanımlanmıştır ben gibi .)
Üçlü sulu çözeltilerin bir açıklaması, yalnızca çözünen maddelerin ağırlıklı ortalama görünür molar hacmini dikkate alır,[7] olarak tanımlandı
- ,
nerede çözüm hacmi ve Saf su hacmi. 3 bileşenli karışımlar için bu yöntem uzatılabilir.[8]
- ,
Ürün molalitelerinin toplamı - ikili çözeltilerindeki görünür molar hacimler, çözünenlerin molalitelerinin toplamı ile yukarıda bahsedilen çok bileşenli çözeltinin üçlü halindeki görünür molar hacmi arasındaki ürüne eşittir.
- ,
Diğer bir yöntem ise üçlü sistemi şu şekilde ele almaktır: sahte ve her bir çözünen maddenin görünen molar hacmini, diğer bileşenleri içeren bir ikili sisteme göre tanımlayın: su ve diğer çözünen madde.[9] İki çözünen maddenin her birinin görünen molar hacimleri daha sonra
- ve
Çözücünün görünen molar hacmi:
Bununla birlikte, bu hacimsel özelliklerin tatmin edici olmayan bir açıklamasıdır.[10]
Tek bir sözde bileşen olarak kabul edilen iki bileşenin veya çözünen maddenin görünür molar hacmi veya tek bir ortak bileşene sahip kısmi ikili karışımların hacimleriyle karıştırılmamalıdır Vij, Vjk belli bir şekilde karışmış karışım oranı belirli bir üçlü karışım oluşturmak V veya Vijk.[açıklama gerekli ]
Kuşkusuz, karışımın diğer bileşenlerine göre bir bileşenin tamamlayıcı hacmi, karışımın hacmi ile belirli bir bileşimin bir ikili alt karışımının hacmi arasındaki bir fark olarak tanımlanabilir:
Şeker veya tuz gibi bir katıyı çözüp çözemeyen sıvı karışımlarda (örneğin su ve etanol) olduğu gibi hangisinin çözücü olduğunu ve hangisinin çözündüğünü tanımlamanın kesin bir yolu olmadığı durumlar vardır. Bu durumlarda, görünür molar özellikler, karışımın tüm bileşenlerine atfedilebilir ve atfedilmelidir.
Ayrıca bakınız
- Hacim oranı
- İdeal çözüm
- Düzenli çözüm
- Çözeltinin entalpi değişimi
- Karışım entalpisi
- Blok tasarımı
- Seyreltme ısısı
- Hidrasyon enerjisi
- İyon taşıma numarası
- Solvasyon kabuğu
- Kısmi molar özellik
- Fazla molar miktar
- Tuzlama
- Üçlü arsa
- Termodinamik aktivite
Referanslar
- ^ Bu etiketleme keyfidir. İki sıvının karışımları için çözücü olarak tanımlanabilir. Bir sıvı ve bir katının karışımları için, sıvı genellikle çözücü ve katı çözünen olarak tanımlanır, ancak etiketler tersine çevrilirse teori hala geçerlidir.
- ^ Rock, Peter A., Chemical Thermodynamics, MacMillan 1969, s. 227-230 su-etanol karışımları için.
- ^ H. H. Ghazoyan ve Sh. A. Markarian (2014) 298,15 - 323,15 K SICAKLIK ARALIĞINDA METANOL VEYA ETANOL İKİLİ SİSTEMLER İLE DİYETİLSÜLFOKSİT İÇİN YOĞUNLUKLAR, AŞIRI MOLAR VE KISMİ MOLAR HACİMLERİ YEREVAN DEVLET ÜNİVERSİTESİ 2 NOLU BİLDİRİLERİ, s.17-25. Tablo 4'e bakınız.
- ^ Glueckauf, E. (1955). "Konsantre Elektrolit Çözeltilerinde İyonik Hidrasyonun Aktivite Katsayılarına Etkisi". Faraday Derneği'nin İşlemleri. 51: 1235–1244. doi:10.1039 / TF9555101235.
- ^ Herbert Harned ve Benton Owen, Elektrolitik Çözeltilerin Fiziksel Kimyası, 1950, s. 253.
- ^ CRC Handbook of Chemistry and Physics, 49. basımdaki verilerden hesaplanmıştır.
- ^ Sitrik asit Apelblat, Alexander (Springer 2014) s.50 ISBN 978-3-319-11233-6
- ^ Harned, Owen, op. cit. üçüncü baskı 1958, s. 398-399
- ^ Sitrik asit Apelblat s. 320
- ^ Apelblat s. 320
Dış bağlantılar
- Görünen Molar Özellikler: Çözümler: Arka Plan
- LiI veya ZnCl2 etanol çözeltilerinin (p, ρ, T) Özellikleri ve Görünen Molar Hacimleri
- T = (288.15'te) Pr (NO3) 3 (aq), Gd (NO3) 3 (aq), Ho (NO3) 3 (aq) ve Y (NO3) 3 (aq) 'nin görünür molar hacimleri ve görünür molar ısı kapasiteleri , 298.15, 313.15 ve 328.15) K ve p = 0.1 MPa
- Elektrolitler için izotopik etkiler görünür özellikler



































