Ötektik sistem - Eutectic system
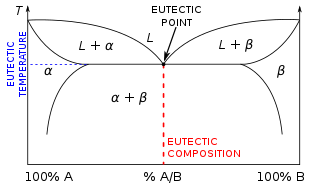
Bir ötektik sistem (/juːˈtɛktɪk/ yooTEK-tik )[1] Yunancadan "εύ" (eu = kuyu) ve "τήξις" (tēxis = erime) bir homojen karışım maddelerin erir veya katılaşır bekar sıcaklık bu daha düşük erime noktası herhangi bir bileşen.[2]
Ötektik sıcaklık, olası en düşük erime sıcaklığıdır. karışım oranları ilgili bileşen türleri için.
Herhangi bir başka karışım oranının ısıtılması ve ötektik sıcaklığa ulaşılması üzerine, kafes ilk olarak eriyecek, diğer bileşen kafeslerin erimesi için (tümü) karışımın sıcaklığı daha da artmalıdır. Tersine, ötektik olmayan bir karışım soğudukça, her karışımın bileşeni, tüm malzeme olana kadar farklı bir sıcaklıkta katılaşır (kafesini oluşturur). katı.
Bir tanımlayan koordinatlar ötektik nokta bir faz diyagramı bunlar ötektik yüzde oranı (üzerinde atomik / moleküler oran eksen (X ekseni)) ve ötektik sıcaklık (Y'de eksen diyagramın).[3]
Hepsi değil ikili alaşımlar ötektik noktaları var çünkü değerlik elektronları bileşen türlerinin% 'si her zaman uyumlu değildir,[açıklama gerekli ] herhangi bir karışım oranında, yeni tip birleşik kristal kafes oluşturmak için. Örneğin, gümüş-altın sisteminde erime sıcaklığı (Liquidus ) ve donma sıcaklığı (katılaşma ) "atomik oran ekseninin saf eleman uç noktalarında buluşurken, bu eksenin karışım bölgesinde biraz ayrılıyor."[4]
Dönem ötektik 1884'te İngiliz fizikçi ve kimyager tarafından icat edildi Frederick Guthrie (1833–1886).[5]
Ötektik faz geçişi

Ötektik katılaşma şu şekilde tanımlanır:[6]
Bu tür bir reaksiyon, değişmez tepki çünkü içinde Termal denge; bunu tanımlamanın başka bir yolu da Gibbs serbest enerjisi sıfıra eşittir. Somut olarak, bu sıvı ve iki sağlam çözümler hepsi aynı anda bir arada var olur ve kimyasal Denge. Ayrıca bir termal tutuklama sistemin sıcaklığının değişmediği faz değişimi süresi için.[6]
Ortaya çıkan katı makro yapı ötektik reaksiyondan birkaç faktöre bağlıdır. En önemli faktör, iki katı çözeltinin nasıl çekirdeklendiği ve büyüdüğüdür. En yaygın yapı bir katmanlı yapı, ancak diğer olası yapılar arasında çubuk benzeri, küresel ve sivri.[7]
Ötektik olmayan bileşimler
Ötektik bileşimde olmayan ötektik sistemlerin bileşimleri şu şekilde sınıflandırılabilir: hipoötektik veya hipereutektik. Hipoötektik bileşimler, β türlerinin daha küçük bir yüzdesine ve ötektik bileşimden (E) daha büyük bir tür bileşimi α'ya sahip olanlardır; hipereutektik çözeltiler, ötektikten daha yüksek bir tür bileşimi β ve daha düşük bir tür bileşimi α olanlarla karakterize edilir. kompozisyon. Ötektik olmayan bir bileşimin sıcaklığı düştükçe, sıvı karışım karışımın bir bileşenini diğerinden önce çökeltecektir. Hipereutektik bir çözümde, türlerin bir proeutektoid fazı olacaktır, oysa hipoötektik bir çözüm, proeutektik bir a fazına sahip olacaktır.[6]
Türler
Alaşımlar
Ötektik alaşımlar iki veya daha fazla malzemeye ve ötektik bir bileşime sahiptir. Ötektik olmayan bir alaşım katılaştığında, bileşenleri farklı sıcaklıklarda katılaşır ve plastik bir erime aralığı sergiler. Tersine, iyi karıştırılmış, ötektik bir alaşım eridiğinde, bunu tek ve keskin bir sıcaklıkta yapar. Belirli bir alaşım bileşiminin katılaşması sırasında meydana gelen çeşitli faz dönüşümleri, o alaşım için faz diyagramında sıvı fazdan katı faza dikey bir çizgi çizilerek anlaşılabilir.
Bazı kullanımlar şunları içerir:
- NEMA Ötektik Alaşım Aşırı Yük Röleleri elektriksel koruma pompalar, fanlar, konveyörler ve diğer fabrika proses ekipmanı için 3 fazlı motorlar.[8]
- Ötektik alaşımlar lehimleme, oluşan teneke (Sn), öncülük etmek (Pb) ve bazen gümüş (Ag) veya altın (Au) - özellikle Sn63Pb37 elektronik için alaşım formülü
- Döküm alaşımları, örneğin alüminyum-silikon ve dökme demir (demirde% 4.3 karbon bileşiminde bir östenit -sementit ötektik)
- Silikon çipler altın kaplama yüzeylere silikon-altın ötektik yoluyla bağlanır. ultrasonik çipe enerji. Görmek ötektik bağ.
- Lehimleme, difüzyonun alaşım elementlerini bağlantıdan çıkarabildiği yerlerde, ötektik erime ancak lehimleme işleminin erken safhalarında mümkündür
- Sıcaklık tepkisi, örn. Ahşap metal ve Field's metal için yangın fıskiyeleri
- Toksik olmayan Merkür değiştirmeler, örneğin Galinstan
- Deneysel camsı metaller son derece yüksek mukavemetli ve aşınma direnç
- Ötektik alaşımlar sodyum ve potasyum (NaK ) oda sıcaklığında sıvı olan ve soğutucu deneysel olarak hızlı nötron nükleer reaktörler.
Diğerleri

- Sodyum klorit ve Su Ötektik noktası .221,2 ° C olan ötektik bir karışım oluşturur[9] ve kütlece% 23.3 tuz.[10] Tuzun ve suyun ötektik doğası, tuzun yollara yayılmasıyla istismar edilir. kar temizleme veya düşük sıcaklıklar elde etmek için buzla karıştırılır (örneğin, geleneksel dondurma yapımı).
- Etanol-su, alışılmadık şekilde önyargılı bir ötektik noktaya sahiptir, yani saf etanole yakındır, bu da şu şekilde elde edilebilecek maksimum kanıtı belirler. fraksiyonel dondurma.
- "Güneş tuzu",% 60 NaNO3 ve% 40 KNO3, ötektik bir erimiş tuz karışımı oluşturur. termal enerji depolama içinde yoğunlaştırılmış güneş enerjisi bitkiler.[11] Erimiş güneş tuzlarında ötektik erime noktasını düşürmek için, kalsiyum nitrat şu oranda kullanılır:% 42 Ca (NO3)2,% 43 KNO3, ve% 15 NaNO3.
- Lidokain ve prilokain - her ikisi de oda sıcaklığında katılardır - 16 ° C (61 ° F) erime noktasına sahip bir yağ olan ötektik oluştururlar. lokal anestezinin ötektik karışımı (EMLA) hazırlıkları.
- Mentol ve kafur, oda sıcaklığında her iki katı da, aşağıdaki oranlarda oda sıcaklığında sıvı olan bir ötektik oluşturur: 8: 2, 7: 3, 6: 4 ve 5: 5. Her iki madde de eczane hazırlıksız müstahzarlarda ortak bileşenlerdir.[12]
- Mineraller ötektik karışımlar oluşturabilir magmatik karakteristik oluşturan kayalar iç içe geçmiş dokular sergilenen, örneğin, granofir.[13]
- Bazı mürekkepler ötektik karışımlardır. Inkjet yazıcılar daha düşük sıcaklıklarda çalışmak için.[14]
Diğer kritik noktalar

Ötektoid
Dönüşüm noktasının üzerindeki çözelti sıvıdan ziyade katı olduğunda, benzer bir ötektoid dönüşümü meydana gelebilir. Örneğin, demir-karbon sisteminde, östenit faz üretmek için bir ötektoid dönüşümü geçirebilir ferrit ve sementit, genellikle aşağıdaki gibi katmanlı yapılarda perlit ve Bainit. Bu ötektoid noktası 723 ° C'de (1,333 ° F) ve yaklaşık% 0,8 karbonda meydana gelir.[15]
Peritektoid
Bir peritektoid dönüşüm bir tür izotermal tersinir reaksiyon iki katı olan aşamalar ikili, üçlü, ... soğuduktan sonra birbirleriyle reaksiyona girme, -ary alaşım tamamen farklı ve tek bir katı faz oluşturmak.[16] Tepki, sırayla anahtar rol oynar ve ayrışma nın-nin yarı kristalli çeşitli alaşım türlerinde fazlar.[17] Benzer bir yapısal geçiş için de tahmin edilmektedir. dönen sütunlu kristaller.
Peritektik

Peritektik dönüşümler de ötektik reaksiyonlara benzer. Burada, sabit oranlarda bir sıvı ve katı faz, tek bir katı faz vermek için sabit bir sıcaklıkta reaksiyona girer. Katı ürün, iki reaktan arasındaki arayüzde oluştuğundan, bir difüzyon bariyeri oluşturabilir ve genellikle bu tür reaksiyonların ötektik veya ötektoid dönüşümlerden çok daha yavaş ilerlemesine neden olur. Bu nedenle, peritektik bir bileşim katılaştığında, katmanlı yapı Ötektik katılaşma ile bulunur.
Şeklin sol üst köşesinin yakınında görüldüğü gibi, demir-karbon sisteminde böyle bir dönüşüm vardır. Saf üretmek için sıvı ile birleşen δ fazı ile ters bir ötektiğe benzer. östenit 1,495 ° C'de (2,723 ° F) ve% 0,17 karbonda.
Peritektik ayrışma sıcaklığında, bileşik erimek yerine başka bir katı bileşiğe ve bir sıvıya ayrışır. Her birinin oranı aşağıdakilere göre belirlenir: kaldıraç kuralı. İçinde Al-Au faz diyagramı, örneğin, fazlardan sadece ikisinin uyumlu olarak eridiği görülebilir, AuAl2 ve Au2Al geri kalanı peritektik olarak ayrışırken.
Ötektik hesaplama
Bir ötektiğin bileşimi ve sıcaklığı, her bileşenin füzyon entropisinden ve entropisinden hesaplanabilir.[18]
Gibbs serbest enerjisi G kendi farkına bağlıdır:
Böylece G/T sabit basınçtaki türev aşağıdaki denklemle hesaplanır:
Kimyasal potansiyel aktivitenin konsantrasyona eşit olduğunu varsayarsak hesaplanır:
Dengede, , Böylece olarak elde edilir
Kullanma[açıklama gerekli ] ve entegre etmek verir
Entegrasyon sabiti K erime sıcaklığına sahip saf bir bileşen için belirlenebilir ve bir füzyon entalpisi :
Molar fraksiyonu, her bir bileşen için sıcaklığın bir fonksiyonu olarak belirleyen bir ilişki elde ederiz:
Karışımı n bileşenler sistem tarafından tanımlanır
hangisi çözülebilir
Ayrıca bakınız
- Azeotrop veya sürekli kaynayan karışım
- Donma noktası alçalması
Referanslar
- ^ "ötektik". Merriam-Webster Sözlüğü.
- ^ Guthrie, F. (1884). "Eutexia'da". Fiziksel Toplum: 462–482.
- ^ Smith & Hashemi 2006, s. 326–327
- ^ "Faz Diyagramlarının Toplanması". www.crct.polymtl.ca.
- ^ Guthrie, Frederick (1884) "Öteksi Üzerine", Felsefi Dergisi5. seri, 17 : 462–482. S. 462: "Mevcut iletişimin ana argümanı, temel özelliği füzyon sıcaklıklarının düşük olması olan bileşik cisimlerin varlığına dayanmaktadır. Bedenlerin bu özelliğine Ötektik cisimler veya ötektik (ötektik) cisimlere sahip olan Eutexia † denilebilir (εύ τήκειν)."
- ^ a b c Smith & Hashemi 2006, s. 327.
- ^ Smith & Hashemi 2006, s. 332–333.
- ^ "Aşırı Yüklerin Çalışması". Alındı 2015-08-05.
- ^ Muldrew, Ken; Locksley E. McGann (1997). "Faz Diyagramları". Kriyobiyoloji - Kısa Bir Kurs. Calgary Üniversitesi. Arşivlenen orijinal 2006-06-15 tarihinde. Alındı 2006-04-29.
- ^ Senese, Fred (1999). "Tuzlu su, donduğunda tatlı su kadar genleşir mi?". Çözümler: Sık sorulan sorular. Kimya Bölümü, Frostburg Eyalet Üniversitesi. Alındı 2006-04-29.
- ^ "Erimiş tuz özellikleri". Archimede Güneş Santrali Özellikleri.
- ^ Phaechamud, Thawatchai; Tuntarawongsa, Sarun; Charoensuksai, Purin (Ekim 2016). "Ötektik Çözücü ve İbuprofen Ötektik Çözeltinin Buharlaşma Davranışı ve Karakterizasyonu". AAPS PharmSciTech. 17 (5): 1213–1220. doi:10.1208 / s12249-015-0459-x. ISSN 1530-9932. PMID 26669887.
- ^ Fichter Lynn S. (2000). "Magmatik Faz Diyagramları". Volkanik taşlar. James Madison Üniversitesi. Alındı 2006-04-29.
- ^ Davies, Nicholas A .; Beatrice M. Nicholas (1992). "Sıcakta eriyen jet mürekkepler için ötektik bileşimler". ABD Patent ve Ticari Marka Ofisi, Patent Tam Metin ve Görüntü Veritabanı. Amerika Birleşik Devletleri Patent ve Ticari Marka Ofisi. Alındı 2006-04-29.
- ^ "Demir-Demir Karbür Faz Şeması Örneği". Arşivlenen orijinal (PDF) 2008-02-16 tarihinde.
- ^ IUPAC Kimyasal Terminoloji Özeti, Elektronik versiyon. "Peritektoid Reaksiyon" Erişim tarihi: May 22, 2007.
- ^ Peritektoid Dönüşümün Sayısal Modeli. Peritektoid Dönüşüm Erişim tarihi: May 22, 2007. Arşivlendi 28 Eylül 2007, Wayback Makinesi
- ^ International Journal of Modern Physics C, Cilt. 15, No. 5. (2004), s. 675–687.
Kaynakça
- Smith, William F .; Haşimi, Cevad (2006), Malzeme Bilimi ve Mühendisliğinin Temelleri (4. baskı), McGraw-Hill, ISBN 978-0-07-295358-9.
daha fazla okuma
- Askeland, Donald R .; Pradeep P. Phule (2005). Malzeme Bilimi ve Mühendisliği. Thomson-Mühendislik. ISBN 978-0-534-55396-8.
- Doğulu, Edward (1992). Metallerde ve Alaşımlarda Faz Dönüşümleri. CRC. ISBN 978-0-7487-5741-1.
- Mortimer, Robert G. (2000). Fiziksel kimya. Akademik Basın. ISBN 978-0-12-508345-4.
- Reed-Hill, R. E .; Reza Abbaschian (1992). Fiziksel Metalurji Prensipleri. Thomson-Mühendislik. ISBN 978-0-534-92173-6.
- Sadoway, Donald (2004). "Faz Dengesi ve Faz Diyagramları" (PDF). 3.091 Katı Hal Kimyasına Giriş, Güz 2004. MIT Açık Eğitim Yazılımı. Arşivlenen orijinal (PDF) 2005-10-20 tarihinde. Alındı 2006-04-12.

![text {Sıvı} xrightarrow [ text {soğutma}] { text {ötektik sıcaklık}} alpha , , text {katı çözüm} + beta , , text {katı çözüm}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ddd335b6ed20e9308b5e9588ea94d3759fe9fbff)















![{ displaystyle { begin {array} {c} left [{ begin {array} {* {20} c} { Delta x_ {1}} { Delta x_ {2}} { Delta x_ {3}} vdots { Delta x_ {n-1}} { Delta T} end {dizi}} sağ] = sol [{ begin {dizi} {* {20} c} {1 / x_ {1}} & 0 & 0 & 0 & 0 & {- { frac {H_ {1} ^ { circ}} {RT ^ {2}}}} 0 & {1 / x_ {2 }} & 0 & 0 & 0 & {- { frac {H_ {2} ^ { circ}} {RT ^ {2}}}} 0 & 0 & {1 / x_ {3}} & 0 & 0 & {- { frac {H_ {3} ^ { circ}} {RT ^ {2}}}} vdots & ddots & ddots & ddots & ddots & { vdots} 0 & 0 & 0 & 0 & {1 / x_ {n-1}} & {- { frac {H_ {n-1} ^ { circ}} {RT ^ {2}}}} { frac {-1} {1- sum limits _ {i = 1} ^ {n-1} {x_ {i}}}} ve { frac {-1} {1- sum limits _ {i = 1} ^ {n-1} {x_ {i}}}} & { frac {-1} {1- sum limits _ {i = 1} ^ {n-1} {x_ {i}}}} & { frac {-1} {1- sum limits _ { i = 1} ^ {n-1} {x_ {i}}}} ve { frac {-1} {1- sum limits _ {i = 1} ^ {n-1} {x_ {i} }}} & {- { frac {H_ {n} ^ { circ}} {RT ^ {2}}}} end {dizi}} sağ] ^ {- 1}. sol [{ begin {dizi} {* {20} c} { ln x_ {1} + { frac {H_ {1} ^ { circ}} {RT}} - { frac {H_ {1} ^ { circle}} {RT_ {1} ^ { circ}}}} { ln x_ {2} + { frac {H_ {2} ^ { circ}} {RT}} - { frac {H_ {2} ^ { circ}} {RT_ {2} ^ { circ}}}} { ln x_ {3} + { frac {H_ {3} ^ { circ}} {RT}} - { frac {H_ {3} ^ { circ}} {RT_ {3} ^ { circ}}}} vdots { ln x_ {n-1} + { frac {H_ {n-1} ^ { circ}} {RT}} - { frac {H_ {n-1} ^ { circ}} {RT_ {n-1} ^ { circ} }}} { ln left ({1- sum limits _ {i = 1} ^ {n-1} {x_ {i}}} sağ) + { frac {H_ {n} ^ { circ}} {RT}} - { frac {H_ {n} ^ { circ}} {RT_ {n} ^ { circ}}}} end {array}} right] end {dizi}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b406139e6e1704cc3d0d07f5cce485c55b01d475)