Tendon - Tendon
| Tendon | |
|---|---|
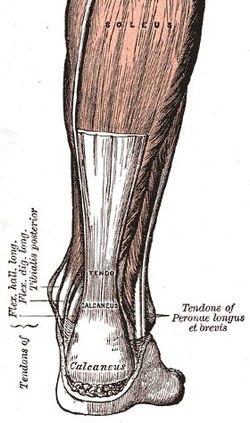 Aşil tendonu içindeki tendonlardan biri insan vücudu | |
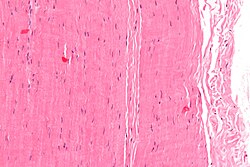 Mikrograf bir parça tendonun; H&E boyası | |
| Detaylar | |
| Tanımlayıcılar | |
| Latince | tendo |
| MeSH | D013710 |
| TH | H3.03.00.0.00020 |
| FMA | 9721 |
| Anatomik terminoloji | |
Bir tendon veya sinüs zor bir grup lifli bağ dokusu bağlanan kas -e kemik ve dayanabilir gerginlik.
Tendonlar benzerdir bağlar; her ikisi de yapılmıştır kolajen. Ligamentler bir kemiği diğerine bağlarken, tendonlar kası kemiğe bağlar.
Yapısı
Histolojik olarak tendonlar oluşur yoğun düzenli bağ dokusu. Tendonların ana hücresel bileşeni uzmanlaşmıştır fibroblastlar aranan tenositler. Tenositler sentezler hücre dışı matris yoğun bir şekilde paketlenmiş olarak bol miktarda tendon Kolajen elyafları. Kolajen lifleri birbirine paraleldir ve fasiküller. Bireysel fasiküller, endotendineum ince kollajen fibrilleri içeren hassas, gevşek bir bağ dokusu olan[1][2] ve elastik lifler.[3] Fasikül grupları, epitenon bir kılıf olan yoğun düzensiz bağ dokusu. Tüm tendon bir fasya. Fasya ve tendon dokusu arasındaki boşluk, Paratenon, yağlı areolar dokusu.[4] Normal sağlıklı tendonlar kemiğe Sharpey lifleri.
Hücre dışı matris
Toplam kütlelerinin% 30-45'ini oluşturan normal tendonların kuru kütlesi şunlardan oluşur:
- % 60-85 kolajen
- % 60-80 kolajen I
- % 0-10 kolajen III
- % 2 kolajen IV
- küçük miktarlarda kolajen V, VI ve diğerleri
- Aşağıdakiler dahil% 15-40 kollajen olmayan hücre dışı matris bileşenleri:
- 3% kıkırdak oligomerik matriks proteini,
- 1-2% Elastin,
- 1–5% proteoglikanlar,
- % 0,2 inorganik bileşenler, örneğin bakır, manganez, ve kalsiyum.[5][6][7][8]
Kolajen I tendondaki kollajenin çoğunu oluştururken, uygun tendon gelişimi ve işlevinde hayati rol oynayan birçok küçük kollajen mevcuttur. Bunlar, içindeki tip II kolajeni içerir. kıkırdaklı bölgeler, tip III kollajen retikülin vasküler duvarların lifleri, tip IX kollajen, tip IV kollajen bazal membranlarında kılcal damarlar, vasküler duvarlarda tip V kollajen ve kemikle arayüzün yakınındaki mineralize fibrokartilajda tip X kollajen.[5][9]
Ultra yapı ve kollajen sentezi
Kolajen lifleri birleşerek makro kümeler. Hücreden salgılandıktan sonra, prokollajen N- ve C-proteazlar tropokollajen molekülleri kendiliğinden çözünmeyen fibriller halinde birleşir. Bir kolajen molekülü yaklaşık 300 nm uzunluğunda ve 1-2 nm genişliğindedir ve oluşan fibrillerin çapı 50-500 nm arasında değişebilir. Tendonlarda, fibriller daha sonra 50–300 μm çapında yaklaşık 10 mm uzunluğunda fasiküller oluşturmak için ve son olarak 100–500 μm çapında bir tendon lifi oluşturmak için bir araya gelir.[10]
Tendonlardaki kollajen, proteoglikan (özellikle bağ dokusunda bulunan glikozaminoglikan gruplarına bağlı bir proteinden oluşan bir bileşik) dahil bileşenler Decorin ve tendonun sıkıştırılmış bölgelerinde, toplayıcı, belirli yerlerde kolajen fibrillere bağlanabilen.[11] Proteoglikanlar, kolajen fibrilleri ile iç içe geçmişlerdir. glikozaminoglikan (GAG) yan zincirleri, fibrillerin yüzeyi ile çoklu etkileşime sahiptir - bu, proteoglikanların fibrillerin birbirine bağlanmasında yapısal olarak önemli olduğunu gösterir.[12] Tendonun ana GAG bileşenleri dermatan sülfat ve kondroitin sülfat, kolajen ile ilişkilendirilen ve tendon gelişimi sırasında fibril montaj sürecine dahil olan. Dermatan sülfatın, fibriller arasında ilişkiler oluşturmaktan sorumlu olduğu düşünülürken, kondroitin sülfatın, onları ayrı tutmak ve deformasyona dayanmaya yardımcı olmak için fibriller arasındaki hacmi işgal etmeye daha fazla karıştığı düşünülmektedir.[13] Dekorin agregasının dermatan sülfat yan zincirleri çözelti içinde birikir ve bu davranış, kolajen fibrillerin birleşmesine yardımcı olabilir. Dekorin molekülleri bir kolajen fibriline bağlandığında, bunların dermatan sülfat zincirleri, ayrı fibrillere bağlanan dekorin üzerindeki diğer dermatan sülfat zincirleri ile uzanabilir ve birleşebilir, bu nedenle, fibriller arası köprüler oluşturur ve sonunda fibrillerin paralel hizalanmasına neden olur.[14]
Tenositler
tenositler kollajen fibrilleri üretmek için uçtan uca ve yan yana toplanan kolajen molekülleri üretir. Fibril demetleri, aralarında yakın bir şekilde paketlenmiş uzun tenositlerle lifler oluşturmak için düzenlenmiştir. Tendonda kolajenle ilişkili üç boyutlu bir hücre süreçleri ağı vardır. Hücreler birbirleriyle iletişim kurar boşluk kavşakları ve bu sinyal onlara mekanik yüklemeyi algılama ve tepki verme yeteneği verir.[15]
Kan damarları, endotendon içinde kollajen liflere paralel olarak görselleştirilebilir, ara sıra enine dallanma ile anastomozlar.
İç tendon kütlesinin sinir lifi içermediği düşünülmektedir, ancak epitenon ve paratenon sinir uçları içerirken Golgi tendon organları tendon ve kas arasındaki bağlantı noktasında bulunur.
Tendon uzunluğu tüm ana gruplarda ve kişiden kişiye değişir. Tendon uzunluğu, pratikte, gerçek ve potansiyel kas boyutu ile ilgili belirleyici faktördür. Örneğin, diğer tüm ilgili biyolojik faktörler eşit olduğunda, tendonları daha kısa ve biseps kası daha uzun olan bir adam, daha uzun tendonlu ve daha kısa kaslı bir adama göre kas kütlesi için daha fazla potansiyele sahip olacaktır. Başarılı vücut geliştiriciler genellikle daha kısa tendonlara sahip olacaktır. Tersine, sporcuların koşma veya atlama gibi eylemlerde üstünlük sağlamalarını gerektiren sporlarda, ortalamanın üzerinde olması faydalıdır. Aşil tendonu ve daha kısa baldır kası.[16]
Tendon uzunluğu genetik yatkınlıkla belirlenir ve travma, kullanım dengesizlikleri ve iyileşme ve gerilme eksikliği ile kısaltılabilen kasların aksine çevreye yanıt olarak arttığı veya azaldığı gösterilmemiştir.[17]
Fonksiyonlar

Geleneksel olarak tendonlar, kasların kemiğe ve kasların kendisine bağlandığı ve güç iletme işlevi gören bir mekanizma olarak düşünülmüştür. Bu bağlantı, tendonların hareket sırasında kuvvetleri pasif olarak modüle etmesine izin vererek, aktif çalışma olmadan ek stabilite sağlar. Bununla birlikte, son yirmi yılda, çoğu araştırma, bazı tendonların elastik özelliklerine ve yay olarak işlev görme yeteneklerine odaklandı. Yazarken parmaklar (konumsal tendonlar) ve diğerleri hareket kabiliyetini daha verimli hale getirmek için yaylar gibi davranan (enerji depolama tendonları) gibi bazı ağırlıklı olarak uzuvları konumlandıran tüm tendonların aynı işlevsel rolü yerine getirmesi gerekli değildir.[18] Enerji depolayan tendonlar enerjiyi yüksek verimlilikte depolayabilir ve geri kazanabilir. Örneğin, bir insan adımında Aşil tendonu, ayak bileği eklemi dorsifleksiyonları gibi gerilir. Adımın son bölümünde, ayak plantar bükülürken (ayak parmaklarını aşağıya doğru göstererek) depolanan elastik enerji serbest bırakılır. Dahası, tendon gerildiği için kas daha az veya hatta daha az işlev görebilir. uzunlukta değişiklik yok, kasın daha fazla güç üretmesine izin verir.
Tendonun mekanik özellikleri, kollajen lif çapına ve yönelimine bağlıdır. Kolajen fibrilleri birbirine paraleldir ve sıkıca doludur, ancak birkaç mikrometre ölçeğinde düzlemsel dalgalanmalar veya kıvrımlar nedeniyle dalgaya benzer bir görünüm gösterir.[19] Tendonlarda, kolajen lifleri, amino asit dizisindeki belirli yerlerde hidroksiprolin ve prolin kalıntılarının bulunmamasından dolayı bir miktar esnekliğe sahiptir; bu, üçlü sarmalda kıvrımlar veya iç halkalar gibi diğer biçimlerin oluşmasına izin verir ve gelişimiyle sonuçlanır. kıvrımlar.[20] Kolajen fibrillerdeki kıvrımlar, tendonların bir miktar esnekliğe ve düşük bir sıkıştırma sertliğine sahip olmasına izin verir. Ayrıca tendon, kısmen bağımsız birçok fibril ve fasikülden oluşan çok sarmallı bir yapı olduğu için tek bir çubuk gibi davranmaz ve bu özelliği esnekliğine de katkı sağlar.[21]
Tendonların proteoglikan bileşenleri de mekanik özellikler açısından önemlidir. Kolajen fibriller tendonların gerilme stresine direnmesine izin verirken, proteoglikanlar bunların sıkıştırma stresine direnmelerine izin verir. Bu moleküller çok hidrofiliktir, yani büyük miktarda suyu emebilirler ve bu nedenle yüksek bir şişme oranına sahiptirler. Fibrillere kovalent olmayan bir şekilde bağlandıklarından, fibriller arasındaki köprülerin kırılıp yeniden biçimlendirilebilmesi için tersine çevrilebilir şekilde birleşebilir ve ayrışabilirler. Bu işlem, fibrilin gerilim altında uzamasına ve çapının azalmasına izin vermede rol oynayabilir.[22] Bununla birlikte, proteoglikanlar, tendonun gerilme özelliklerinde de rol oynayabilir. Tendonun yapısı, bir dizi hiyerarşik seviye olarak yapılmış, etkili bir şekilde fiber kompozit bir malzemedir. Hiyerarşinin her seviyesinde, kolajen birimleri, gerilme yüküne oldukça dirençli bir yapı oluşturmak için kolajen çapraz bağları veya proteoglikanlar ile birbirine bağlanır.[23] Tek başına kollajen fibrillerin uzaması ve gerilmesinin, aynı miktarda stres altında tüm tendonun toplam uzaması ve gerilmesinden çok daha düşük olduğu gösterilmiş, bu da proteoglikandan zengin matrisin de deformasyona uğraması ve sertleşmesi gerektiğini göstermektedir. matris, yüksek gerilme oranlarında oluşur.[24] Kolajen olmayan matrisin bu deformasyonu, tendon hiyerarşisinin tüm seviyelerinde meydana gelir ve bu matrisin organizasyonunu ve yapısını modüle ederek, farklı tendonların gerektirdiği farklı mekanik özellikler elde edilebilir.[25] Enerji depolayan tendonların, ihtiyaç duydukları yüksek gerilme özelliklerini sağlamak için fasiküller arasında önemli miktarlarda kayma kullandıkları gösterilmiştir, konumsal tendonlar ise daha çok kolajen lifleri ve fibriller arasında kaymaya dayanır.[26] Bununla birlikte, son veriler, enerji depolayan tendonların doğası gereği bükülmüş veya sarmal olan fasiküller içerebileceğini ileri sürüyor - bu tendonlarda gerekli olan yay benzeri davranışı sağlamak için oldukça faydalı bir düzenleme.[27]
Mekanik
Tendonlar viskoelastik yapılar, yani hem elastik hem de yapışkan davranış sergiledikleri anlamına gelir. Tendonlar gerildiğinde tipik "yumuşak doku" davranışı sergiler. Kuvvet-uzama veya gerilim-gerinim eğrisi, kıvrımlı yapı düzeldikçe ve kolajen lifler, tendonun liflerindeki negatif Poisson oranını düşündüren hizalandıkça çok düşük bir sertlik bölgesiyle başlar. Daha yakın zamanlarda, in vivo (MRI yoluyla) ve ex vivo (çeşitli kadavra tendon dokusunun mekanik testi yoluyla) gerçekleştirilen testler, sağlıklı tendonların oldukça anizotropik olduğunu ve negatif bir Poisson oranı sergilediğini göstermiştir (yardımcı ) bazı düzlemlerde uzunlukları boyunca, yani normal hareket aralıkları içinde% 2'ye kadar gerildiğinde.[28] Bu "ayak" bölgesinden sonra, yapı önemli ölçüde sertleşir ve başarısız olmaya başlayana kadar doğrusal bir gerilme-gerinim eğrisine sahiptir. Tendonların mekanik özellikleri, tendonun fonksiyonel gereksinimlerine uygun olduklarından, büyük ölçüde değişir. Enerji depolayan tendonlar daha elastik veya daha az sert olma eğilimindedir, bu nedenle enerjiyi daha kolay depolayabilirken, daha sert konumsal tendonlar biraz daha viskoelastik ve daha az elastik olma eğilimindedir, bu nedenle daha iyi hareket kontrolü sağlayabilirler. Tipik bir enerji depolayan tendon, yaklaşık% 12-15 gerilimde ve 100-150 MPa bölgesinde bir gerilimde başarısız olacaktır, ancak bazı tendonlar bundan çok daha fazla uzayabilir, örneğin, yüzeysel dijital fleksör at, dörtnala giderken% 20'den fazla uzar.[29] Pozisyonel tendonlar% 6-8 gibi düşük gerilimlerde başarısız olabilir, ancak 700-1000 MPa aralığında modüle sahip olabilir.[30]
Birkaç çalışma, tendonların mekanik yüklemedeki değişikliklere büyüme ve yeniden modelleme süreçleriyle yanıt verdiğini göstermiştir. kemikler. Özellikle, yapılan bir çalışma, Aşil tendonu sıçanlarda, tendonu oluşturan kolajen lif demetlerinin ortalama kalınlığında bir azalma ile sonuçlanmıştır.[31] İnsanlarda, simüle edilmiş bir mikro-yerçekimi ortamına maruz bırakılan bir deney, deneklerin dinlenme egzersizleri yapmaları gerektiğinde bile tendon sertliğinin önemli ölçüde azaldığını buldu.[32] Bu etkilerin, yatalak hastaların tedavisinden daha etkili egzersizlerin tasarımına kadar değişen alanlarda etkileri vardır. astronotlar.
İyileştirme
Ayaktaki tendonlar oldukça karmaşık ve girifttir. Bu nedenle kırık bir tendonun iyileşme süreci uzun ve ağrılıdır. Yaralanmanın ilk 48 saati içinde tıbbi yardım görmeyen çoğu insan, yaralanmanın meydana geldiği yerde şiddetli şişlik, ağrı ve yanma hissinden muzdarip olacaktır.
Tendonların matris döngüsüne giremeyeceğine ve tenositlerin onarılamayacağına inanılıyordu. Bununla birlikte, o zamandan beri, bir kişinin yaşamı boyunca, tendondaki tenositlerin, matriks bileşenlerini ve bunun gibi enzimleri aktif olarak sentezlediği gösterilmiştir. matris metaloproteinazlar (MMP'ler) matrisi bozabilir.[33] Tendonlar, tenositler ve onları çevreleyen hücre dışı matriks tarafından kontrol edilen bir süreçte yaralanmalardan iyileşme ve iyileşme yeteneğine sahiptir.
Tendon iyileşmesinin üç ana aşaması iltihaplanma, onarım veya proliferasyon ve yeniden şekillenmedir ve bunlar daha sonra konsolidasyon ve olgunlaşmaya bölünebilir. Bu aşamalar birbiriyle çakışabilir. İlk aşamada, iltihaplı hücreler nötrofiller ile birlikte yaralanma bölgesine alınır eritrositler. Monositler ve makrofajlar ilk 24 saat içinde işe alınır ve fagositoz nın-nin nekrotik yaralanma yerinde malzemeler oluşur. Serbest bırakıldıktan sonra vazoaktif ve kemotaktik faktörler, damarlanma ve çoğalma tenositler başlatılır. Tenositler daha sonra bölgeye hareket eder ve kolajen III'ü sentezlemeye başlar.[34][35] Birkaç gün sonra onarım veya proliferasyon aşaması başlar. Bu aşamada tenositler, yaralanma bölgesinde büyük miktarlarda kollajen ve proteoglikanların sentezinde rol oynar ve GAG ve su seviyeleri yüksektir.[36] Yaklaşık altı hafta sonra yeniden şekillenme aşaması başlar. Bu aşamanın ilk kısmı, yaralanmadan yaklaşık altı ila on hafta sonra süren konsolidasyondur. Bu süre zarfında, kolajen I üretiminin artması ve fibrillerin mekanik stres yönünde hizalanması sonucu doku daha lifli hale geldikçe kolajen ve GAG sentezi azalır ve hücresellik de azalır.[35] Nihai olgunlaşma aşaması on hafta sonra gerçekleşir ve bu süre zarfında, kolajen fibrillerin çapraz bağlanmasında bir artış olur ve bu da dokunun sertleşmesine neden olur. Yavaş yavaş, yaklaşık bir yıl içinde doku lifli halden yara izine dönecektir.[36]
Matriks metaloproteinazlar (MMP'ler), bir tendon yaralanmasından sonra iyileşme süreci sırasında ECM'nin bozulması ve yeniden şekillenmesinde çok önemli bir role sahiptir. MMP-1, MMP-2, MMP-8, MMP-13 ve MMP-14 dahil olmak üzere bazı MMP'ler, kolajenaz aktivitesine sahiptir, yani diğer birçok enzimin aksine, kolajen I fibrillerini parçalayabilirler. Denatüre kolajen mevcudiyeti ile birlikte MMP-1 tarafından kolajen fibrillerin bozunması, tendon ECM'sinin zayıflamasına ve başka bir kopmanın meydana gelme potansiyelinde bir artışa neden olduğuna inanılan faktörlerdir.[37] Tekrarlanan mekanik yükleme veya yaralanmalara yanıt olarak, sitokinler tenositler tarafından salınabilir ve MMP'lerin salınmasına neden olarak ECM'nin bozulmasına neden olabilir ve tekrarlayan yaralanmalara ve kronik tendinopatilere yol açabilir.[35]
Tendon onarımı ve yenilenmesinde çeşitli başka moleküller rol oynar. Tendon iyileşmesi sırasında önemli ölçüde yukarı regüle ve aktif olduğu gösterilen beş büyüme faktörü vardır: insülin benzeri büyüme faktörü 1 (IGF-I), trombosit kaynaklı büyüme faktörü (PDGF), vasküler endotelyal büyüme faktörü (VEGF), temel fibroblast büyüme faktörü (bFGF) ve büyüme faktörü beta dönüştürme (TGF-β).[36] Bu büyüme faktörlerinin tümü, iyileşme sürecinde farklı rollere sahiptir. IGF-1, iltihabın ilk aşamasında kolajen ve proteoglikan üretimini arttırır ve PDGF, yaralanmadan sonraki erken aşamalarda da mevcuttur ve DNA sentezi ve tendon hücrelerinin çoğalması ile birlikte diğer büyüme faktörlerinin sentezini destekler.[36] Üç TGF-of izoformunun (TGF-β1, TGF-β2, TGF-β3) yara iyileşmesinde ve yara oluşumunda rol oynadığı bilinmektedir.[38] VEGF'nin anjiyogenezi teşvik ettiği ve endotel hücre proliferasyonunu ve göçünü indüklediği iyi bilinmektedir ve VEGF mRNA'nın, kollajen I mRNA ile birlikte tendon yaralanmaları bölgesinde eksprese edildiği gösterilmiştir.[39] Kemik morfogenetik proteinleri (BMP'ler), kemik ve kıkırdak oluşumunun yanı sıra doku farklılaşmasını indükleyebilen TGF-süper ailesinin bir alt grubudur ve BMP-12'nin spesifik olarak tendon dokusunun oluşumunu ve farklılaşmasını etkilediği ve fibrojenezi desteklediği gösterilmiştir.
Aktivitenin iyileşme üzerindeki etkileri
Hayvan modellerinde, aktivite seviyesi şeklindeki mekanik zorlanmanın tendon yaralanması ve iyileşme üzerindeki etkilerini araştırmak için kapsamlı çalışmalar yapılmıştır. Germe, ilk enflamatuar faz sırasında iyileşmeyi bozabilirken, akut bir yaralanmayı takiben yaklaşık bir hafta sonra tendonların kontrollü hareketinin, tenositler tarafından kolajen sentezini desteklemeye yardımcı olabileceği ve bunun da artan gerilme mukavemeti ve çapına yol açabileceği gösterilmiştir. iyileşmiş tendonlar ve hareketsizleştirilmiş tendonlara göre daha az yapışma. Kronik tendon yaralanmalarında, mekanik yüklemenin fibroblast proliferasyonunu ve kollajen sentezini ve kollajen yeniden hizalanmasını uyardığı da gösterilmiştir, bunların tümü onarım ve yeniden şekillenmeyi teşvik eder.[36] Hareket ve aktivitenin tendon iyileşmesine yardımcı olduğu teorisini daha da desteklemek için, yaralanmadan sonra tendonların hareketsizleştirilmesinin genellikle iyileşme üzerinde olumsuz bir etkisi olduğu gösterilmiştir. Tavşanlarda, hareketsizleştirilmiş kollajen fasiküller, gerilme mukavemetinde azalma göstermiştir ve hareketsizleştirme, tendonlarda daha düşük miktarlarda su, proteoglikanlar ve kolajen çapraz bağları ile sonuçlanır.[34]
Birkaç mekanotransdüksiyon mekanizmalar, tenositlerin, gen ekspresyonlarını, protein sentezlerini ve hücre fenotiplerini değiştirmelerini sağlayan ve sonunda tendon yapısında değişikliklere neden olan mekanik kuvvete tepkisinin nedenleri olarak öne sürülmüştür. Ana faktör, mekanik deformasyondur. hücre dışı matris etkileyebilecek aktin hücre iskeleti ve bu nedenle hücre şeklini, hareketliliğini ve işlevini etkiler. Mekanik kuvvetler fokal yapışma bölgeleri tarafından iletilebilir, integrinler ve hücre-hücre kavşakları. Aktin hücre iskeletindeki değişiklikler, hücre ile matris arasındaki "dıştan içe" ve "içten dışa" sinyalleşmeye aracılık eden integrinleri etkinleştirebilir. G proteinleri Hücre içi sinyalleme kaskadlarını indükleyen de önemli olabilir ve kalsiyum, sodyum veya potasyum gibi iyonların hücreye girmesine izin vermek için iyon kanalları gerilerek aktive edilir.[36]
Toplum ve kültür
Sinew boyunca yaygın olarak kullanıldı sanayi öncesi zor, dayanıklı olarak çağlar lif. Bazı özel kullanımlar arasında sinüs olarak Konu dikiş için, oklara tüy takmak (bkz. fletch ), şaftlara bağlama aracı bıçakları, vb. Tuzaklar veya canlı yapılar gibi nesneler için güçlü iplerin yapılabileceği bir malzeme olarak hayatta kalma kılavuzlarında da tavsiye edilir. Tendon, bu amaçlar için yararlı bir şekilde işlev görmesi için belirli şekillerde ele alınmalıdır. Inuit ve diğeri çevreleyen insanlar ekolojik habitatlarında diğer uygun lif kaynaklarının bulunmaması nedeniyle tüm evsel amaçlar için tek kordon olarak sinew kullanmıştır. Belirli sinüslerin elastik özellikleri de kullanıldı kompozit kıvrımlı yaylar Avrasya bozkır göçebeleri ve Yerli Amerikalılar tarafından tercih edilmektedir. İlk taş atan topçu da sinirin elastik özelliklerini kullandı.
Sinew, üç nedenden ötürü mükemmel bir ip malzemesi yapar: Son derece güçlüdür, doğal yapıştırıcılar içerir ve kurudukça küçülür, düğüm ihtiyacını ortadan kaldırır.
Mutfak kullanımları
Tendon (özellikle, sığır eti tendon) bazı Asya mutfaklarında bir yemek olarak kullanılır (genellikle yum cha veya dim sum restoranlar). Popüler yemeklerden biri suan bao niu jintendonun sarımsakla marine edildiği. Bazen Vietnam erişte yemeğinde de bulunur. phở.
Klinik önemi
Yaralanma
Tendonlar pek çok yaralanmaya maruz kalır. Çeşitli biçimleri vardır tendinopatiler veya aşırı kullanımdan kaynaklanan tendon yaralanmaları. Bu tür yaralanmalar genellikle tendonların iltihaplanması ve dejenerasyonu veya zayıflamasıyla sonuçlanır ve bu da sonunda tendon kopmasına neden olabilir.[34] Tendinopatiler, tendon hücre dışı matriksi (ECM) ile ilgili bir dizi faktörden kaynaklanabilir ve semptomları ve histopatolojileri sıklıkla benzer olduğundan sınıflandırmaları zordur.
İlk tendinopati kategorisi, tendon ile kılıfı arasında bulunan paratenonun veya paratendinöz tabakanın iltihaplanmasına işaret eden paratenonittir. Tendinoz "Hücresel düzeyde" tendonun iltihaplı olmayan yaralanması anlamına gelir. Bozulmaya, kolajen, hücreler ve tendonun vasküler bileşenlerine verilen hasar neden olur ve yırtılmaya yol açtığı bilinmektedir.[40] Kendiliğinden yırtılmaya uğrayan tendonların gözlemleri, doğru paralel yönde olmayan veya uzunluk veya çap bakımından muntazam olmayan kollajen fibrillerin yanı sıra yuvarlak tenositler, diğer hücre anormallikleri ve kan damarlarının içe doğru büyümesinin varlığını göstermiştir.[34] Yırtılmaya yol açmayan diğer tendinoz formları, fibriller arasındaki glikozaminoglikanların miktarında bir artışla birlikte, kolajen fibrillerin dejenerasyonunu, yönelim bozukluğunu ve incelmesini de göstermiştir.[35] Üçüncüsü, hem paratenon iltihabı hem de tendon dejenerasyonu kombinasyonlarının mevcut olduğu tendinozlu parateninittir. Son tendinit tendon iltihabı ile dejenerasyona ve ayrıca vasküler bozulmaya işaret eder.[5]
Tendinopatilere yaş, vücut ağırlığı ve beslenme gibi birçok iç faktör neden olabilir. Dışsal faktörler genellikle sporla ilgilidir ve aşırı kuvvet veya yükleme, zayıf eğitim teknikleri ve çevresel koşulları içerir.[33]
Diğer hayvanlar

Bazı organizmalarda dikkate değer olanlar kuşlar[41] ve ornitorik dinozorlar,[42] tendonun bazı kısımları kemikleşebilir. Bu süreçte, osteositler tendonu infiltre eder ve patella gibi sesamoid kemikte olduğu gibi kemiği bırakır. Kuşlarda tendon ossifikasyonu esas olarak arka bacakta meydana gelirken, ornithischian dinozorlarda kemikleşmiş eksenel kas tendonları muhtemelen destek için kuyruktaki sinir ve hemal dikenler boyunca bir kafes oluşturur.
Ayrıca bakınız
Referanslar
- ^ Dorlands Tıp Sözlüğü, sayfa 602
- ^ Caldini, E. G .; Caldini, N .; De-Pasquale, V .; Strocchi, R .; Guizzardi, S .; Ruggeri, A .; Montes, G.S. (1990). "Sıçan kuyruğu tendonunda ve bununla ilişkili kılıflarda elastik sistem liflerinin dağılımı". Hücre Dokular Organlar. 139 (4): 341–348. doi:10.1159/000147022. PMID 1706129.
- ^ Grant, T. M .; Thompson, M. S .; Urban, J .; Yu, J. (2013). "Elastik lifler tendon içinde geniş bir şekilde dağılmıştır ve tenositler etrafında oldukça lokalizedir". Anatomi Dergisi. 222 (6): 573–579. doi:10.1111 / joa.12048. PMC 3666236. PMID 23587025.
- ^ Dorlands Tıp Sözlüğü 2012. Sayfa 1382
- ^ a b c Jozsa, L. ve Kannus, P., İnsan Tendonları: Anatomi, Fizyoloji ve Patoloji. İnsan Kinetiği: Champaign, IL, 1997.
- ^ Lin, T. W .; Cardenas, L .; Soslowsky, L.J. (2004). "Tendon yaralanması ve onarımının biyomekaniği". Biyomekanik Dergisi. 37 (6): 865–877. doi:10.1016 / j.jbiomech.2003.11.005. PMID 15111074.
- ^ Kjær, Michael (Nisan 2004). "Tendon ve İskelet Kasının Mekanik Yüklemeye Adaptasyonunda Hücre Dışı Matriksin Rolü". Fizyolojik İncelemeler. 84 (2): 649–698. doi:10.1152 / physrev.00031.2003. ISSN 0031-9333. PMID 15044685.
- ^ Taye, Nandaraj; Karoulias, Stylianos Z .; Hubmacher, Dirk (Ocak 2020). "Diğer"% 15-40: Tendonda Kollajen Olmayan Hücre Dışı Matriks Proteinlerinin ve Küçük Kolajenlerin Rolü ". Ortopedik Araştırma Dergisi. 38 (1): 23–35. doi:10.1002 / jor.24440. ISSN 0736-0266. PMC 6917864. PMID 31410892.
- ^ Fukuta, S .; Oyama, M .; Kavalkovich, K .; Fu, F. H .; Niyibizi, C. (1998). "Sığır aşil tendonunun giriş bölgesinde tip II, IX ve X kolajenlerinin belirlenmesi". Matris Biyolojisi. 17 (1): 65–73. doi:10.1016 / S0945-053X (98) 90125-1. PMID 9628253.
- ^ Fratzl, P. (2009). "Selüloz ve kolajen: liflerden dokulara". Kolloid ve Arayüz Biliminde Güncel Görüş. 8 (1): 32–39. doi:10.1016 / S1359-0294 (03) 00011-6.
- ^ Zhang, G.E., Y .; Chervoneva, I .; Robinson, P. S .; Beason, D. P .; Carine, E. T .; Soslowsky, L. J .; Iozzo, R. V .; Birk, D. E. (2006). "Dekorin, tendon gelişimi sırasında kolajen fibrillerin birleşmesini ve biyomekanik özelliklerin kazanılmasını düzenler". Hücresel Biyokimya Dergisi. 98 (6): 1436–1449. doi:10.1002 / jcb.20776. PMID 16518859. S2CID 39384363.CS1 Maint: birden çok isim: yazarlar listesi (bağlantı)
- ^ Raspanti, M .; Congiu, T .; Guizzardi, S. (2002). "Tendonun Hücre Dışı Matrisinin Yapısal Yönleri: Bir Atomik Kuvvet ve Taramalı Elektron Mikroskobu Çalışması". Histoloji ve Sitoloji Arşivleri. 65 (1): 37–43. doi:10.1679 / aohc.65.37. PMID 12002609.
- ^ Scott, J.E.O., C. R .; Hughes, E.W. (1981). "Sıçan kuyruğu tendonunun geliştirilmesinde proteoglikan-kolajen düzenlemeleri. Elektron mikroskobu ve biyokimyasal araştırma". Biyokimyasal Dergisi. 195 (3): 573–581. doi:10.1042 / bj1950573. PMC 1162928. PMID 6459082.CS1 Maint: birden çok isim: yazarlar listesi (bağlantı)
- ^ Scott, J. E. (2003). "Hücre dışı matrikste esneklik tendon, kıkırdak vb. 'Şekil modülleri'. Kayar bir proteoglikan-filament modeli". Journal of Physiology. 553 (2): 335–343. doi:10.1113 / jphysiol.2003.050179. PMC 2343561. PMID 12923209.
- ^ McNeilly, C. M .; Banes, A. J .; Benjamin, M .; Ralphs, J.R. (1996). "Tendon hücreleri in vivo, boşluk bağlantılarıyla bağlanan üç boyutlu bir hücre süreçleri ağı oluşturur". Anatomi Dergisi. 189 (Pt 3): 593–600. PMC 1167702. PMID 8982835.
- ^ "Kısa bir Aşil tendonuna sahip olmak bir sporcunun Aşil topuğu olabilir". Alındı 2007-10-26.
- ^ Genç, Michael. "Postural Yeniden Hizalama ve Kas ve Sinir Bileşenleri Üzerine Bir İnceleme" (PDF).
- ^ Thorpe C.T., Birch H.L., Clegg P.D., Screen H.R.C. (2013). Kollajen olmayan matriksin tendon fonksiyonundaki rolü. Int J ExpPathol. 94; 4: 248-59.
- ^ Hulmes, D. J. S. (2002). "Kolajen Molekülleri, Fibriller ve Süper Elyaf Yapılar Oluşturma". Yapısal Biyoloji Dergisi. 137 (1–2): 2–10. doi:10.1006 / jsbi.2002.4450. PMID 12064927.
- ^ Silver, F. H .; Freeman, J. W .; Seehra, G.P. (2003). "Kolajen kendi kendine toplanma ve tendon mekanik özelliklerinin gelişimi". Biyomekanik Dergisi. 36 (10): 1529–1553. doi:10.1016 / S0021-9290 (03) 00135-0. PMID 14499302.
- ^ Ker, R.F. (2002). "Yapısı, onarımı ve işlevi için tendonların uyarlanabilir yorgunluk kalitesinin etkileri". Karşılaştırmalı Biyokimya ve Fizyoloji A. 133 (4): 987–1000. doi:10.1016 / S1095-6433 (02) 00171-X. PMID 12485688.
- ^ Cribb, A. M .; Scott, J.E. (1995). Gerilme-strese karşı Tendon yanıtı - kolajen - gerilmiş tendonda proteoglikan etkileşimlerinin ultrastrüktürel bir incelemesi, 1995; Cambridge Univ Press. Pp 423-428.
- ^ Ekran H.R., Lee D.A., Bader D.L., Shelton J.C. (2004). "Tendon fasiküllerinin hiyerarşik yapısının mikromekanik özellikler üzerindeki etkilerinin araştırılması". Proc Inst Mech Müh H. 218 (2): 109–119. doi:10.1243/095441104322984004. PMID 15116898. S2CID 46256718.CS1 Maint: birden çok isim: yazarlar listesi (bağlantı)
- ^ Puxkandl, R .; Zizak, I .; Paris, O .; Keckes, J .; Tesch, W .; Bernstorff, S .; Plurslow, P .; Fratzl, P. (2002). "Kolajenin viskoelastik özellikleri: senkrotron radyasyon araştırmaları ve yapısal model". Royal Society B'nin Felsefi İşlemleri. 357 (1418): 191–197. doi:10.1098 / rstb.2001.1033. PMC 1692933. PMID 11911776.
- ^ Gupta H.S., Seto J., Krauss S., Boesecke P. & Screen H.R.C. (2010). Yerinde tendon kollajenindeki viskoelastik deformasyon mekanizmalarının çok seviyeli analizi. J. Struct. Biol. 169(2):183-191.
- ^ Thorpe C.T; Udeze C.P; Birch H.L .; Clegg P.D .; Ekran H.R.C. (2012). "Tendon mekanik özelliklerinin uzmanlaşması fasiküler arası farklılıklardan kaynaklanır". Royal Society Arayüzü Dergisi. 9 (76): 3108–3117. doi:10.1098 / rsif.2012.0362. PMC 3479922. PMID 22764132.
- ^ Thorpe C.T .; Klemt C; Riley G.P .; Birch H.L .; Clegg P.D .; Ekran H.R.C. (2013). "Enerji depolayan tendonlardaki sarmal alt yapılar, verimli enerji depolama ve geri dönüşü için olası bir mekanizma sağlar". Acta Biyomater. 9 (8): 7948–56. doi:10.1016 / j.actbio.2013.05.004. PMID 23669621.
- ^ Gatt R, Vella Wood M, Gatt A, Zarb F, Formosa C, Azzopardi KM, Casha A, Agius TP, Schembri-Wismayer P, Attard L, Chockalingam N, Grima JN (2015). "Tendonlarda Negatif Poisson oranları: Beklenmedik bir mekanik tepki". Acta Biyomater. 24: 201–208. doi:10.1016 / j.actbio.2015.06.018. PMID 26102335.
- ^ Batson EL, Paramour RJ, Smith TJ, Birch HL, Patterson-Kane JC, Goodship AE. (2003). At Veterineri J. | volume = 35 | issue = 3 | pages = 314-8. At fleksör ve ekstansör tendonlarının malzeme özellikleri ve matriks bileşimi işlevlerine göre mi belirlenir?
- ^ ScreenH.R.C., Tanner, K.E. (2012). Biyolojik Kompozitlerin Yapısı ve Biyomekaniği. İçinde: Kompozit Ansiklopedisi 2. Baskı Nicolais ve Borzacchiello.Pub. John Wiley & Sons, Inc. ISBN 978-0-470-12828-2 (sayfalar 2928-39)
- ^ Nakagawa, Y. (1989). "Sıçanlarda kullanılmamanın Aşil tendonunun ultra yapısı üzerindeki etkisi". Avrupa Uygulamalı Fizyoloji Dergisi. 59 (3): 239–242. doi:10.1007 / bf02386194. PMID 2583169. S2CID 20626078.
- ^ Reeves, N. D. (2005). "90 günlük simüle edilmiş mikro-yerçekiminin insan tendonunun mekanik özellikleri üzerindeki etkisi ve huzursuzluğa karşı önlemlerin etkisi". Uygulamalı Fizyoloji Dergisi. 98 (6): 2278–2286. doi:10.1152 / japplphysiol.01266.2004. hdl:11379/25397. PMID 15705722.
- ^ a b Riley, G. (2004). "Tendinopatinin patogenezi. Moleküler bir bakış açısı" (PDF). Romatoloji. 43 (2): 131–142. doi:10.1093 / romatoloji / keg448. PMID 12867575.
- ^ a b c d Sharma, P.M., N. (2006). "Tendon yaralanmasının biyolojisi: iyileşme, modelleme ve yeniden şekillenme". Kas-İskelet ve Nöronal Etkileşimler Dergisi. 6 (2): 181–190. PMID 16849830.CS1 Maint: birden çok isim: yazarlar listesi (bağlantı)
- ^ a b c d Sharma, P .; Maffulli, N. (2005). "Tendon hasarı ve tendinopati: İyileşme ve onarım". Kemik ve Eklem Cerrahisi Dergisi. Amerikan Hacmi. 87A (1): 187–202. doi:10.2106 / JBJS.D.01850. PMID 15634833. S2CID 1111422.
- ^ a b c d e f Wang, J.H.C. (2006). "Tendonun mekanobiyolojisi". Biyomekanik Dergisi. 39 (9): 1563–1582. doi:10.1016 / j.jbiomech.2005.05.011. PMID 16000201.
- ^ Riley, G. P .; Curry, V .; DeGroot, J .; van El, B .; Verzijl, N .; Hazleman, B. L .; Banka, R.A. (2002). "Matriks metaloproteinaz aktiviteleri ve bunların tendon patolojisinde kolajen yeniden şekillenmesi ile ilişkisi". Matris Biyolojisi. 21 (2): 185–195. doi:10.1016 / S0945-053X (01) 00196-2. PMID 11852234.
- ^ Moulin, V .; Tam, B. Y. Y .; Castilloux, G .; Auger, F. A .; O'Connor-McCourt, M. D .; Philip, A .; Germain, L. (2001). "Fetal ve yetişkin insan deri fibroblastları, kasılma kapasitesinde içsel farklılıklar sergiler". Hücresel Fizyoloji Dergisi. 188 (2): 211–222. doi:10.1002 / jcp.1110. PMID 11424088. S2CID 22026692.
- ^ Boyer, M.I.W., J. T .; Lou, J .; Manske, P. R .; Gelberman, R. H .; Cai, S.R. (2001). "Erken fleksör tendon iyileşmesi sırasında vasküler endotelyal büyüme faktörü mRNA ifadesinde kantitatif varyasyon: bir köpek modelinde bir araştırma". Ortopedik Araştırma Dergisi. 19 (5): 869–872. doi:10.1016 / S0736-0266 (01) 00017-1. PMID 11562135. S2CID 20903366.CS1 Maint: birden çok isim: yazarlar listesi (bağlantı)
- ^ Astrom, M .; Rausing, A. (1995). "Kronik Aşil Tendinopatisi - Cerrahi ve Histopatolojik bulguların incelenmesi". Klinik Ortopedi ve İlgili Araştırmalar. 316 (316): 151–164. doi:10.1097/00003086-199507000-00021. PMID 7634699. S2CID 25486134.
- ^ Berge, James C. Vanden; Storer, Robert W. (1995). "Kuşlarda içsel kemikleşme: Bir inceleme". Morfoloji Dergisi. 226 (1): 47–77. doi:10.1002 / jmor.1052260105. PMID 29865323. S2CID 46926646.
- ^ Organ, Chris L. (2006). "Ornitopod dinozorlarda kemikleşmiş tendonların biyomekaniği". Paleobiyoloji. 32 (4): 652–665. doi:10.1666/05039.1. S2CID 86568665.
