Kalıtsal hemorajik telenjiektazi - Hereditary hemorrhagic telangiectasia - Wikipedia
| Kalıtsal Hemorajik Telenjiektazi | |
|---|---|
 | |
| Karakteristik dudak telenjiektazları. | |
| Uzmanlık | Tıbbi genetik |
Kalıtsal hemorajik telenjiektazi (HHT), Ayrıca şöyle bilinir Osler – Weber – Rendu hastalığı ve Osler – Weber – Rendu sendromu, nadir bir otozomal dominanttır genetik bozukluk bu, anormal kan damarı oluşumuna yol açar. cilt, mukoza zarları ve çoğu zaman bu gibi organlarda akciğerler, karaciğer, ve beyin.[1][2]
Yol açabilir burun kanaması, akut ve kronik sindirim sistemi kanaması ve diğer organların tutulmasından kaynaklanan çeşitli sorunlar. Tedavi, kan damarı lezyonlarından kanamayı azaltmaya odaklanır ve bazen ameliyat veya diğer hedefli müdahaleler kaldırılacak arteriyovenöz malformasyonlar organlarda. Kronik kanama genellikle gerektirir demir takviyeleri ve bazen kan nakilleri. HHT bir otozomal dominant moda ve Kuzey Amerika'da 5.000–8.000 kişiden birinde ortaya çıkıyor.[1][2]
Hastalık, Efendim'in isimlerini taşır William Osler, Henri Jules Louis Marie Rendu, ve Frederick Parkes Weber, onu 19. yüzyılın sonlarında ve 20. yüzyılın başlarında tanımlayan.[3]
Belirti ve bulgular
Telenjiektaziler
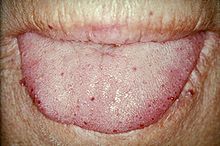
Telenjiektazi (küçük vasküler malformasyonlar) burun ve gastrointestinal sistemin deri ve mukozal astarlarında meydana gelebilir. En yaygın sorun burun kanaması (epistaksis), sıklıkla çocukluktan itibaren ortaya çıkar ve HHT'li kişilerin yaklaşık% 90-95'ini etkiler. Derideki ve ağızdaki lezyonlar daha az sıklıkta kanar, ancak kozmetik olarak rahatsız edici kabul edilebilir; yaklaşık% 80'i etkilemektedirler.[1][2] Deri lezyonları karakteristik olarak dudaklar, burun ve parmaklar ve güneşe maruz kalan bölgelerde yüzün cildinde. Zamanla artan sayı ile aniden ortaya çıkarlar.[2]
Yaklaşık% 20'si semptomatik sindirim sistemi lezyonlarından etkilenir, ancak daha yüksek bir yüzde semptomlara neden olmayan lezyonlara sahiptir. Bu lezyonlar aralıklı olarak kanayabilir ve bu nadiren fark edilecek kadar önemli ( kanlı kusma veya siyah dışkı ), ancak sonunda tükenmesine neden olabilir Demir vücutta demir eksikliği anemisi.[1][2]
Arteriyovenöz malformasyon
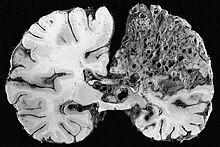
Arteriovenöz malformasyonlar (AVM'ler, daha büyük vasküler malformasyonlar) daha büyük organlarda, özellikle de akciğerlerde (pulmoner AVM'ler ) (% 50), karaciğer (% 30-70) ve beyin (serebral AVM'ler,% 10), AVM'lerin çok küçük bir kısmı (<% 1) omurilik.[1][2]
Akciğerlerdeki vasküler malformasyonlar bir takım sorunlara neden olabilir. Akciğerler normalde "filtrelenir" bakteri ve kan pıhtıları kan dolaşımından; AVM'ler akciğerlerin kılcal ağını atlar ve bunların göç beyine bakteri neden olabilir beyin apsesi ve kan pıhtıları yol açabilir inme.[1] HHT, akciğer AVM'lerinin en yaygın nedenidir: akciğer AVM'si olduğu tespit edilen tüm insanların% 70-80'i HHT'ye bağlıdır.[4][5] Akciğer AVM'lerinden kanama nispeten nadirdir, ancak neden olabilir hemoptizi (kan öksürmek) veya hemotoraks (göğüs boşluğunda biriken kan).[1][2][4] Akciğerdeki büyük vasküler malformasyonlar, oksijeni tükenmiş kana sağ ventrikül bypass etmek alveoller yani bu kanın taze oksijeni emme şansı yoktur. Bu yol açabilir nefes darlığı.[4][5] Büyük AVM'ler şunlara yol açabilir: ornitorenk, uzanmaya kıyasla otururken daha belirgin olan nefes almada güçlük; bu muhtemelen konumlandırma ile ilişkili kan akışındaki değişiklikleri yansıtır.[4] Çok büyük AVM'ler, oksijeni absorbe etmede belirgin bir yetersizliğe neden olur ve siyanoz (dudakların ve cildin mavimsi rengi), tırnakların çarpması (genellikle kronik olarak düşük oksijen seviyelerinde karşılaşılır) ve uğultulu ses akciğerin etkilenen kısmı üzerinden tespit edilebilir stetoskop.[4][5]
AVM'lerin karaciğerde ürettiği semptomlar, kan damarları arasında oluşturdukları anormal bağlantı türüne bağlıdır. Bağlantı arasındaysa arterler ve damarlar büyük miktarda kan, vücudun organlarını atlayarak kalbin telafi ettiği kardiyak çıkışı. Sonuçta konjestif kalp yetmezliği diğer sorunların yanı sıra nefes darlığı ve bacak şişmesi ile birlikte gelişir ("yüksek çıkışlı kalp yetmezliği").[1][6] AVM, aşağıdakiler arasında bir bağlantı oluşturursa portal damar ve karaciğerin kan damarları, sonuç olabilir portal hipertansiyon (artan portal ven basıncı), kollateral kan damarlarının yemek borusu (özofagus varisleri ), şiddetli şekilde kanayabilir; ayrıca, artan basınç karın boşluğunda sıvı birikmesine neden olabilir (assit ). AVM'deki akış diğer yöndeyse, portal venöz kan, karaciğerden geçmek yerine doğrudan damarlara akar; bu yol açabilir hepatik ensefalopati (beyni tahriş eden portal atık ürünlerden kaynaklanan kafa karışıklığı). Nadiren safra kanalları kandan yoksun kalır ve şiddetli kolanjit (safra kanallarının iltihabı).[1][6] Karaciğer AVM'leri, HHT'li kişilerin% 70'inden fazlasında tespit edilebilir, ancak sonuç olarak sadece% 10'u sorun yaşar.[2]
AVM'ler beyinde bazen baskı uygular ve bu da baş ağrısı. Ayrıca riski artırabilirler. nöbetler Beyindeki herhangi bir anormal doku gibi. Son olarak, bir AVM'den kaynaklanan kanama intraserebral kanama (beyne kanama), vücudun bir bölümünde güçsüzlük veya konuşma güçlüğü gibi felç semptomlarından herhangi birine neden olur. Kanama, Subaraknoid boşluk (subaraknoid hemoraji ), genellikle bir şiddetli, ani baş ağrısı ve vücudun bir bölümünde bilinç düzeyinde azalma ve genellikle zayıflık.[1][2]
Diğer problemler
Çok küçük bir oran (etkilenenler SMAD4 (MADH4) mutasyonları, aşağıya bakınız) çoklu iyi huylu polipler içinde kalın bağırsak, kanayabilir veya dönüşebilir kolorektal kanser. Benzer şekilde küçük bir oran deneyimleri pulmoner hipertansiyon, bulunduğu bir durum akciğer arterlerindeki basınç üzerinde baskı uygulayarak artar kalbin sağ tarafı ve neden periferik ödem (bacakların şişmesi), bayılma ve saldırıları göğüs ağrısı. Riskinin olduğu gözlemlenmiştir. tromboz (özellikle venöz tromboz, şeklinde derin ven trombozu veya pulmoner emboli ) artırılabilir. HHT'ye sahip olanların hafif olabileceğine dair bir şüphe var. immün yetmezlik ve bu nedenle enfeksiyon riski biraz daha yüksektir.[1]
Genetik

HHT bir genetik bozukluk bir ile otozomal dominant kalıtım kalıbı. Hastalığın akrabası olmayan HHT semptomları olanlar yeni bir mutasyona sahip olabilir.[7] Homozigotluk uteroda ölümcül görünmektedir.[1]
Beş genetik tip HHT tanınır. Bunlardan üçü bağlantılı özellikle genler, kalan ikisi şu anda yalnızca belirli bir mahal. Tüm HHT vakalarının% 80'inden fazlası, her ikisindeki mutasyonlardan kaynaklanmaktadır. ENG veya ACVRL1.[8] Toplam 600'den fazla farklı mutasyon bilinmektedir. Belirli popülasyonlarda her iki türden de bir üstünlük olması muhtemeldir, ancak veriler çelişkilidir. MADH4 HHT'ye ek olarak kolon polipozuna neden olan mutasyonlar, hastalığa neden olan mutasyonların yaklaşık% 2'sini oluşturur. Dışında MADH4, içindeki mutasyonların olup olmadığı net değil ENG ve ACVRL1 belirli semptomlara yol açar,[1] bazı raporlar bunu önermesine rağmen ENG mutasyonların akciğer sorunlarına neden olma olasılığı daha yüksektir ACVRL1 mutasyonlar daha fazla karaciğer problemine neden olabilir,[2][5] ve pulmoner hipertansiyonu olan kişilerde özel bir sorun olabilir ACVRL1 mutasyonlar.[8] Tam olarak aynı mutasyonlara sahip kişilerde semptomların farklı doğası ve şiddeti olabilir, bu da ek genlerin veya diğer risk faktörlerinin lezyonların gelişme hızını belirleyebileceğini düşündürür; bunlar henüz tanımlanmadı.[2][8]
| İsim | OMIM | Gen | Yer yer | Açıklama |
|---|---|---|---|---|
| HHT1 | 187300 | ENG | 9q34.1 | ENG endoglin için kodlar, bir reseptör nın-nin TGF-β1 (büyüme faktörü beta 1'i dönüştürmek) ve TGF-β3; genetik bağlantı 1994 yılında tanımlandı.[9] Yüksek oranda çerçeve kayması mutasyonları gözlemlendi.[1] Pratik olarak tüm mutasyonlar, proteinin hücre dışı kısmında (üzerinde oturan kısımda) meydana gelir. hücre yüzeyi ).[8] |
| HHT2 | 600376 | ACVRL1 | 12q11-q14 | ACVRL1 Alk-1 kodları (ACVR1 aktivin reseptörü benzeri kinaz 1), bir TGF-21 reseptörü; genetik bağlantı 1996'da tanımlandı.[10] |
| HHT3 | 601101 | Bilinmeyen | 5q31 | İşlev bilinmiyor, bağlantı 2005'te belirlendi.[11] |
| HHT4 | 610655 | Bilinmeyen | 7s 14. | İşlev bilinmiyor, bağlantı 2006'da belirlendi.[12] |
| JPHT | 175050 | MADH4 | 18q21.1 | MADH4 TGF süper aile reseptörleri için bir hücre içi sinyal proteini olan SMAD4'ü kodlar. Bu gendeki mutasyonlar HHT ve juvenil polipoza neden olur. Bağlantı 2004 yılında belirlendi.[13] Mutasyonlar çoğunlukla 8-11 eksonlarda, sıklıkla de novo (yeni edinilmiş, miras alınmamış).[1] |
Patofizyoloji

HHT'deki telanjiektaziler ve arteriyovenöz malformasyonların, değişiklikler nedeniyle ortaya çıktığı düşünülmektedir. damarlanma, mevcut damarlardan kan damarlarının gelişmesi. Yeni bir kan damarının geliştirilmesi, başlıca çeşitli hücre türlerinin aktivasyonunu ve göçünü gerektirir. endotel, düz kas ve perisitler. HHT mutasyonlarının bu süreci etkilediği kesin mekanizma henüz net değildir ve kan damarlarındaki pro- ve antianjiyojenik sinyaller arasındaki dengeyi bozmaları muhtemeldir. Telenjiektazilerin duvarı alışılmadık şekilde gevrek Bu lezyonların kanama eğilimini açıklar.[1]
Şimdiye kadar bilinen tüm genlerin HHT koduna bağlı olduğu bilinen TGF-β sinyal yolu. Bu, katılan bir protein grubudur. sinyal iletimi hormonlarının büyüme faktörü beta üst ailesini dönüştürmek ( büyüme faktörü beta dönüştürme, kemik morfogenetik proteini ve büyüme farklılaşma faktörü sınıflar), özellikle BMP9 / GDF2 ve BMP10. Hormonlar hücreye girmez, ancak hücre zarındaki reseptörlere bağlanır; bunlar daha sonra diğer proteinleri aktive eder ve sonunda hücresel hayatta kalma, çoğalma (sayıca artma) ve farklılaşma (daha uzmanlaşma) gibi bir dizi yolla hücresel davranışı etkiler.[1] Hormon sinyalinin yeterince iletilebilmesi için, bir protein kombinasyonu gereklidir: iki türden ikişer protein serin / treonine özgü kinaz tipi zar reseptörleri ve endoglin. Hormona bağlandığında tip II reseptör proteinleri fosforilat (Aktar fosfat ) Tip I reseptör proteinlerine (Alk-1 bir tanesidir), ki bu da bir kompleksi fosforile eder. SMAD proteinleri (esas olarak SMAD1, SMAD5 ve SMAD8 ). Bunlar SMAD4'e bağlanır ve hücre çekirdeği nerede davranıyorlar Transkripsiyon faktörleri ve katılmak transkripsiyon belirli genlerin. SMAD yoluna ek olarak, membran reseptörleri ayrıca MAPK yolu, hücrelerin davranışı üzerinde ek eylemleri olan.[2] Hem Alk-1 hem de endoglin ifade belki de bu proteinlerde HHT'ye neden olan mutasyonların neden ağırlıklı olarak kan damarı sorunlarına yol açtığını açıklayan belki de endotelyumda.[2][8] Her ikisi de ENG ve ACVRL1 mutasyonlar, proteinlerin hatalı çalışmasından ziyade ağırlıklı olarak ilgili proteinlerin yetersiz üretimine yol açar.[8]
Teşhis
Teşhis testleri çeşitli nedenlerle yapılabilir. Öncelikle teşhisi doğrulamak veya çürütmek için bazı testlere ihtiyaç vardır. İkinci olarak, herhangi bir olası komplikasyonu belirlemek için bazılarına ihtiyaç vardır.[7]
Telenjiektaziler
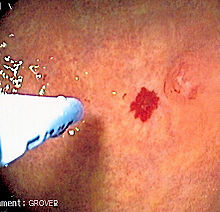
Deri ve ağız boşluğu telenjiektazileri görsel olarak tanımlanabilir. fiziksel inceleme ve benzer şekilde burundaki lezyonlar da görülebilir. endoskopi of nazofarenks veya laringoskopi. Burun kanamalarının ciddiyeti, burun kanaması vakalarının sayısının ve süresinin kaydedildiği ızgara benzeri bir anket kullanılarak objektif olarak ölçülebilir.[2]
Sindirim sistemi telenjiektazileri, özofagogastroduodenoskopi (yemek borusu, mide ve ince bağırsağın ilk kısmının endoskopisi). Bu prosedür tipik olarak, sadece burun kanamasının ciddiyetiyle beklenenden daha belirgin anemi varsa veya şiddetli kanama kanıtı (kan kusma, siyah dışkı) varsa uygulanacaktır. Endoskopide görülen lezyon sayısı beklenmedik şekilde düşükse, ince bağırsağın geri kalan kısmı ile muayene edilebilir. kapsül endoskopi içerisinde hastanın sindirim sisteminin görüntülerini taşınabilir bir dijital kayıt cihazına aktaran minyatür bir kamera içeren kapsül şeklindeki bir cihazı yutması.[2]
Arteriovenöz malformasyonlar
AVM'lerin tanımlanması ayrıntılı gerektirir tıbbi Görüntüleme Bu lezyonlardan en sık etkilenen organların oranı. Tüm AVM'ler semptomlara neden olmaz veya bunu yapma riski altında değildir ve bu nedenle bu tür araştırmaların yapılıp yapılmayacağı ve hangi yöntemle gerçekleştirileceği konusunda uzmanlar arasında bir dereceye kadar farklılıklar vardır; sıklıkla bu konudaki kararlar hasta ile birlikte alınmaktadır.[1]
Akciğer AVM'lerinden akciğerlerin anormal görünümü nedeniyle şüphelenilebilir. Göğüs röntgeni veya hipoksi (düşük oksijen seviyeleri) açık nabız oksimetresi veya arteryel kan gazı kararlılık. Kabarcık kontrast ekokardiyografi (kabarcık eko), cihazlar arasındaki anormal bağlantıları tanımlamak için bir tarama aracı olarak kullanılabilir. akciğer arterleri ve damarlar. Bu, ajite edilmiş enjeksiyonu içerir tuzlu su bir damara, ardından kalbin ultrasona dayalı görüntülenmesi. Normalde akciğerler küçük hava kabarcıklarını dolaşımdan uzaklaştırır ve bu nedenle bunlar yalnızca sağ atriyum ve sağ ventrikül. Bir AVM varsa, sol atriyum ve sol ventrikül, genellikle 3–10 kalp döngüleri sağ taraftan sonra; bu, olduğundan daha yavaş kalp kusurları Kalbin sağ ve sol tarafı arasında doğrudan bağlantıların olduğu. Daha fazla sayıda balonun bir AVM varlığını gösterme olasılığı daha yüksektir. Kabarcık yankısı, daha küçük AVM'leri kaçırabileceğinden ve AVM'lerin sitesini tanımlamadığından mükemmel bir tarama aracı değildir. Sıklıkla kontrast gelişmiş bilgisayarlı tomografi (BT anjiyografi) akciğer lezyonlarını tanımlamak için kullanılır; bu modalitede bir duyarlılık % 90'ın üzerinde.[1][2] Modern CT tarayıcılarda kontrast uygulamasının atlanması mümkün olabilir.[5] Büyük karaciğer lezyonlarına bağlı olarak pulmoner hipertansiyon veya yüksek debili kalp yetmezliği şüphesi varsa ekokardiyografi de kullanılır. kalp kateterizasyonu kalbin çeşitli odalarındaki basınçları ölçmek için.[1]

Anormallik nedeniyle karaciğer AVM'lerinden şüphelenilebilir karaciğer fonksiyon testleri kanda, kalp yetmezliği semptomları geliştiği için veya sarılık veya diğer karaciğer disfonksiyon semptomları. En güvenilir ilk tarama testi Doppler ultrasonografi karaciğerin; bu, karaciğerdeki vasküler lezyonların belirlenmesi için çok yüksek bir duyarlılığa sahiptir. Gerekirse, kontrastlı BT, AVM'leri daha da karakterize etmek için kullanılabilir.[1][2][6] Karaciğer taramalarında tesadüfi nodüller bulmak son derece yaygındır, en sık fokal nodüler hiperplazi (FNH), çünkü bunlar genel popülasyona kıyasla HHT'de yüz kat daha yaygındır. FNH zararsız olarak kabul edilir. Genel olarak, tümör belirteçleri ve FNH ile karaciğerin kötü huylu tümörlerini ayırt etmek için ek görüntüleme yöntemleri kullanılır. Karaciğer biyopsisi Karaciğer AVM'lerinden kanama riski önemli olabileceğinden, HHT'li kişilerde önerilmez.[6][7] Karaciğer taramaları, bir kişinin HHT'den şüphelenmesi durumunda yararlı olabilir, ancak karaciğer lezyonları gösterilemediği sürece kriterleri karşılamaz (aşağıya bakın).[7]
Brain AVM'leri şu cihazlarda tespit edilebilir: bilgisayarlı tomografi anjiyografi (CTA veya CT anjiyo) veya manyetik rezonans anjiyografi (MRA); CTA, damarların kendisini göstermede daha iyidir ve MRA, bir AVM ile çevreleyen beyin dokusu arasındaki ilişki hakkında daha fazla ayrıntı sağlar.[14] Genel olarak MRI önerilir.[2][7] Çeşitli tiplerde vasküler malformasyonlarla karşılaşılabilir: AVM'ler, mikro-AVM'ler, telenjiektaziler ve arteriyovenöz fistüller.[7] Ameliyat, embolizasyon veya başka bir tedavi düşünülüyorsa (aşağıya bakınız), serebral anjiyografi gemilerin yeterli detayını almak gerekebilir. Bu prosedür küçük bir inme riski taşır (% 0,5) ve bu nedenle belirli koşullarla sınırlıdır.[7][14] Son zamanlardaki profesyonel kılavuzlar, şüpheli veya kesin HHT'si olan tüm çocukların, büyük komplikasyonlara neden olabilecek AVM'leri belirlemek için yaşamlarının erken dönemlerinde bir beyin MRG'ye tabi tutulmasını önermektedir.[7] Diğerleri, herhangi bir nörolojik semptom yaşamayanlarda serebral AVM taramasının muhtemelen gereksiz olduğunu, çünkü tarama taramalarında keşfedilen lezyonların çoğu tedavi gerektirmeyerek istenmeyen bilmeceler yarattığını öne sürüyor.[1]
Genetik test
Genetik testler, ENG, ACVRL1 ve MADH4 mutasyonlar. Teşhis için test her zaman gerekli değildir, çünkü semptomlar hastalığı diğer teşhislerden ayırmak için yeterlidir. Testin özellikle yararlı olabileceği durumlar vardır. Birincisi, kesin HHT'si olan bir ebeveyni olan çocuklar ve genç yetişkinler sınırlı semptomlara sahip olabilirler, ancak yine de yukarıda bahsedilen bazı komplikasyonlardan risk altında olabilirler; eğer mutasyon etkilenen ebeveynde biliniyorsa, çocukta bu mutasyonun olmaması tarama testlerine olan ihtiyacı önleyecektir. Ayrıca, genetik testler, aksi takdirde "olası HHT" olarak etiketlenen sınırlı semptomları olanlarda teşhisi doğrulayabilir (aşağıya bakınız).[7]
HHT'de genetik teşhis zordur, çünkü bağlantılı genlerde çok sayıda farklı yerde mutasyonlar meydana gelir ve belirli mutasyonlar çok sık değildir (örneğin, ΔF508 mutasyon kistik fibrozis ). Sıra analizi Bu nedenle, dahil edilen genlerin% 75'i en kullanışlı yaklaşımdır (hassasiyet% 75), ardından büyük delesyonları ve duplikasyonları tespit etmek için ek testler (% 10 ek). Bu genlerdeki tüm mutasyonlar hastalıkla bağlantılı değildir.[7]
Mutasyonlar MADH4 gen genellikle juvenil polipoz ile ilişkilidir ve böyle bir mutasyonun saptanması, hastayı ve etkilenen akrabaları kalın bağırsağın polipleri ve tümörleri için tarama ihtiyacını gösterir.[7]
Kriterler
Tanı "olarak bilinen dört kriterin varlığına bağlı olarak yapılabilir"Curacao kriterler ".[15] Üç veya dört karşılanırsa, bir hasta "kesin HHT" ye sahipken, ikisi "olası HHT" verir:
- Spontan tekrarlayan burun kanaması
- Tipik lokasyonlarda çoklu telenjiektazi (yukarıya bakın)
- Kanıtlanmış viseral AVM (akciğer, karaciğer, beyin, omurga)
- HHT'li birinci derece aile üyesi
"Mümkün" olarak tanımlanmasına rağmen, iç organ AVM'si olan ve aile öyküsü olan, ancak burun kanaması veya telenjiektazisi olmayan birinin HHT'ye sahip olma olasılığı hala oldukça yüksektir, çünkü bu AVM'ler genel popülasyonda çok nadirdir. Aynı zamanda, her ikisi de AVM yokluğunda HHT olmayan kişilerde görülen burun kanaması ve seyrek telenjiektaziler için aynı şey söylenemez. Küçük çocuklar henüz tüm semptomları göstermeyebileceğinden, bir kişinin tanı durumu yaşam boyunca değişebilir; 16 yaşında, yüzde 13'ü hala belirsizken, 60 yaşında büyük çoğunluğun (% 99) kesin bir tanı sınıflandırması vardır. Yerleşik HHT hastalarının çocukları bu nedenle "olası HHT" olarak etiketlenebilir, çünkü% 50'si yaşamları boyunca HHT'ye sahip olabilir.[1]
Tedavi
HHT tedavisi semptomatik Telanjiektazi ve AVM'lerin gelişimini doğrudan durduran bir tedavi olmadığından (hastalığın kendisinden çok semptomlarla ilgilenir). Ayrıca yaygın komplikasyonların gelişmesini önlemek için bazı tedaviler uygulanmaktadır.[7] Kronik burun kanaması ve sindirim sistemi kanaması anemiye yol açabilir; kanamanın kendisi tamamen durdurulamazsa, anemi tedavi gerektirir. demir takviyeleri. Demir tabletlerini veya solüsyonlarını tolere edemeyenler, intravenöz demir ve kan nakli anemi, kan sayımının hızlı bir şekilde iyileştirilmesini gerektiren ciddi semptomlara neden oluyorsa.[2][7]
HHT'de kullanılan tedavilerin çoğu yetişkinlerde tanımlanmıştır ve çocukların tedavisine ilişkin deneyim daha sınırlıdır.[7] HHT'li kadınlar hamile yüksek komplikasyon riski altındadır ve mutlak risk hala düşük olmasına rağmen (% 1) yakından gözlemlenmektedir.[1]
Burun kanaması
Akut burun kanaması, burun boşluğunun emici çubuklar veya jeller ile doldurulması gibi çeşitli önlemlerle yönetilebilir. Kanamadan sonra paketlerin çıkarılması hassas damarların yeniden açılmasına neden olabilir ve bu nedenle kayganlaştırılmış veya atravmatik conta önerilir.[7] Bazı hastalar tıbbi yardıma başvurmak zorunda kalmadan burun kanamasıyla başa çıkmak için kendilerini toplamayı öğrenmek isteyebilirler.[16]
Sık sık burun kanamaları, kısmen burun deliklerini nemli tutarak ve uygulama yapılarak önlenebilir. tuzlu çözelti, estrojen - içeren kremler veya traneksamik asit; bunların çok az yan etkisi vardır ve küçük bir faydası olabilir.[7] Basit önlemler başarısız olursa, tekrarlayan kanamayı önlemek için bir dizi ek yöntem kullanılmıştır. Tıbbi tedaviler arasında oral traneksamik asit ve östrojen; kanıt çünkü bunlar nispeten sınırlıdır ve östrojen erkekler tarafından zayıf bir şekilde tolere edilir ve muhtemelen menopozu geçen kadınlarda kanser ve kalp hastalığı riski taşır.[2][7] Burun pıhtılaşması ve koterizasyon telanjiektazilerden kaynaklanan kanamayı azaltabilir ve ameliyat düşünülmeden önce önerilir. Bununla birlikte, kanamaya yatkın olan nazal mukozada septal perforasyonları ve aşırı travmayı önlemek için en az ısı ve süre kullanılması şiddetle tavsiye edilir.[kaynak belirtilmeli ] Skleroterapi, kanamayı yönetmek için başka bir seçenektir. Bu işlem, az miktarda havalandırılmış bir tahriş edici maddenin (sodyum tetradesil sülfat gibi deterjan) doğrudan telanjiektazilere enjekte edilmesini içerir. Deterjan damarın çökmesine ve sertleşmesine neden olarak yara dokusu kalıntısına neden olur. Bu, varisli damarları ve benzer bozuklukları tedavi etmek için kullanılan prosedürle aynıdır.[kaynak belirtilmeli ]
Mümkün olabilir emboli yapmak aracılığıyla vasküler lezyonlar girişimsel radyoloji; bu, bir kateterin büyük bir arterden geçirilmesini ve maksiller arter altında X-ışını rehberliği ardından kan damarlarını tıkayan partiküllerin damarına enjeksiyon yapılır. İşlemden elde edilen fayda kısa ömürlü olma eğilimindedir,[7] ve şiddetli kanama ataklarında en uygun olabilir.[16]
Burun kanamasının tekrarını ve şiddetini daha etkili bir şekilde en aza indirmek için, yukarıda listelenen tedavilerle birlikte başka seçenekler de kullanılabilir. İntravenöz uygulanan bevacizumab (Avastin markası), pazopinab ve talidomid gibi anti-VEGF maddeleri veya türevleri, zayıf ve dolayısıyla kanamaya yatkın yeni kan damarlarının üretimine müdahale eder. Mide bulantısı semptomlarını hafifletmek için hamile kadınlara talidomid reçete etme konusundaki geçmiş deneyimler ve ardından gelen korkunç doğum kusurları nedeniyle, talidomid son çare tedavisidir. Ek olarak, talidomid nöropatiye neden olabilir. Bu, dozajlarla ve lenolidomid ve pomalidomid gibi türevlerinin reçetelenmesi ile hafifletilebilse de, birçok doktor alternatif VEGF inhibitörlerini tercih eder. Bevacizumab'ın yan etkileri olmaksızın burun kanaması şiddetini önemli ölçüde azalttığı gösterilmiştir.[kaynak belirtilmeli ]
Diğer müdahaleler başarısız olduysa, fayda sağladığı birkaç işlem bildirilmiştir. Biri septal dermoplasti veya Saunders'ın prosedürü,[17] Burun deliklerine derinin nakledildiği, diğerinin ise Young'ın prosedürü olduğu,[18] Burun deliklerinin tamamen kapatıldığı.[7][16]
Deri ve sindirim sistemi
HHT'nin deri lezyonları şekil değiştirebilir ve uzun darbeli tedaviye yanıt verebilir. Nd: YAG lazer.[2] Parmak uçlarındaki deri lezyonları bazen kanayabilir ve ağrıya neden olabilir. Cilt aşılama bazen bu sorunu tedavi etmek için gereklidir.[2]
Sindirim sistemi lezyonları, hafif kanama ve sonuçta ortaya çıkan hafif anemi, demir takviyesi ile tedavi edilir ve spesifik bir tedavi uygulanmaz. Kanamayı ve anemiyi azaltmak için hormon tedavisi ve traneksamik asit hakkında sınırlı veri vardır. Şiddetli anemi veya şiddetli kanama epizodları endoskopik olarak tedavi edilir. argon plazma pıhtılaşması (APC) veya tanımlanan herhangi bir lezyonun lazer tedavisi; bu, destekleyici tedavi ihtiyacını azaltabilir. Beklenen faydalar, lezyonları tedavi etmek için tekrarlanan girişimlerin savunulacağı şekilde değildir.[7] Ani, çok şiddetli kanama olağandışıdır - karşılaşılırsa, alternatif nedenler (örn. ülser ) dikkate alınması gerekiyor[7]- ancak bu tür durumlarda embolizasyon kullanılabilir.[1]
Akciğer AVM'leri
Akciğer lezyonları belirlendikten sonra genellikle kanama olaylarını ve daha da önemlisi beyinde emboliyi önlemek için tedavi edilir. Bu, özellikle 3 mm veya daha büyük besleyici kan damarı olan lezyonlarda yapılır, çünkü bunlar tedavi edilmedikçe uzun vadeli komplikasyonlara neden olma olasılığı en yüksektir. En etkili güncel tedavi, çıkarılabilir metal bobinler veya tıkaçlarla embolizasyondur.[19] Prosedür, büyük bir damarın delinmesini içerir (genellikle bir Genel anestezi ), bunu takiben kateterin sağ ventrikülden ilerlemesi ve içine pulmoner arter, daha sonra radyokontrast AVM'leri görselleştirmek için enjekte edilir (pulmoner anjiyografi ). Lezyon belirlendikten sonra, kan akışını engelleyen ve lezyonun gerilemesine izin veren sarmallar yerleştirilir. Deneyimli ellerde, prosedür çok etkili ve sınırlı yan etkilere sahip olma eğilimindedir, ancak lezyonlar tekrarlayabilir ve daha fazla girişim gerekebilir. Nüksü izlemek için CTA taramaları tekrarlanır.[2][4][5][7] Cerrahi eksizyon artık emboloterapinin başarısı nedeniyle esasen terk edilmiştir.[5][7]
Kesin pulmoner AVM'leri veya açıkça görülebilen lezyonları olmayan anormal kontrast ekokardiyografisi olanlar, beyin embolisi nedeniyle risk altında kabul edilir. Bu nedenle kaçınmaları tavsiye edilir tüplü dalış, kan dolaşımında beyne göç edip felce neden olabilecek küçük hava kabarcıkları oluşabilir. Benzer şekilde, antimikrobiyal profilaksi Bakterilerin kan dolaşımına girebileceği prosedürler sırasında tavsiye edilir. diş işi ve hava kabarcıklarının önlenmesi damar içi tedavi.[2][5][7]
Karaciğer AVM'leri
Karaciğer AVM'lerinin genellikle yüksek çıktılı kalp yetmezliğine neden olduğu göz önüne alındığında, vurgu bunu tedavi etmek üzerinedir. diüretikler dolaşımdaki kan hacmini azaltmak, tuz ve sıvı alımını kısıtlamak ve antiaritmik ajanlar durumunda düzensiz kalp atışı. Bu, şişkinlik ve nefes darlığı semptomlarının tedavisinde yeterli olabilir. Bu tedavi etkili değilse veya yan etkilere veya komplikasyonlara yol açıyorsa, kalan tek seçenek şudur: karaciğer nakli. Bu, ciddi semptomları olan kişiler için ayrılmıştır, çünkü ölüm yaklaşık% 10'dur, ancak başarılı olursa iyi sonuçlara yol açar.[6][7] Karaciğer naklinin sunulacağı kesin nokta henüz tam olarak belirlenmemiştir.[6] Embolizasyon tedavisi denenmiştir, ancak hastaların bir kısmında ciddi komplikasyonlara yol açmaktadır ve önerilmez.[5][6][7]
Karaciğerle ilgili diğer komplikasyonlar (portal hipertansiyon, özofagus varisleri, asit, hepatik ensefalopati), aşağıdaki yöntemlerle tedavi edilir: siroz kullanımına rağmen transjuguler intrahepatik portosistemik şant belgelenmiş fayda olmaması nedeniyle tedavi önerilmemektedir.[6]
Beyin AVM'leri
Beyni tedavi etme kararı arteriyovenöz malformasyonlar neden oldukları semptomlara (nöbetler veya baş ağrıları gibi) bağlıdır. Kanama riski, önceki kanama ataklarıyla ve CTA veya MRA AVM'yi tarayın, derin oturmuş veya derin venöz drenaj var. AVM'nin boyutu ve varlığı anevrizmalar daha az önemli görünüyor.[14] HHT'de bazı lezyonlar (yüksek akımlı arteriyovenöz fistüller) daha fazla soruna neden olma eğilimindedir ve tedavi gereklidir. Diğer AVM'ler müdahale olmaksızın zamanla gerileyebilir.[7] AVM'nin konumuna ve boyutuna bağlı olarak çeşitli yöntemler mevcuttur: cerrahi, radyasyona dayalı tedavi ve embolizasyon. Bazen aynı lezyon üzerinde birden fazla yöntem kullanılır.[2][14]
Cerrahi (yapan kraniyotomi, açık beyin cerrahisi), Spetzler-Martin ölçeği (derece I-V) tarafından belirlenen tedavi risklerine göre önerilebilir; önemli beyin yapılarına yakın ve derin venöz drenajı olan daha büyük lezyonlarda bu skor daha yüksektir. Yüksek dereceli lezyonların (IV ve V) kabul edilemeyecek kadar yüksek bir riski vardır ve bu durumlarda tipik olarak cerrahi önerilmemektedir. Radyocerrahi (hedeflenen radyasyon tedavisi gibi gama bıçağı ) lezyon küçükse ancak hayati yapılara yakınsa kullanılabilir. Son olarak, embolizasyon yalnızca tek bir besleme damarı olan küçük lezyonlarda kullanılabilir.[14]
Deneysel tedaviler
Birkaç antidamarlanma kanser gibi diğer durumlar için onaylanan ilaçlar, küçük klinik çalışmalarda araştırılmıştır.[20] Anti-VEGF antikor bevacizumab örneğin, kullanılmış etiket kapalı birkaç çalışmada. Büyük bir klinik çalışmada, bevacizumab infüzyonu, tedavi edilen HHT hastalarında kalp debisinde bir azalma ve epistaksis süresi ve epizodlarının sayısında azalma ile ilişkilendirilmiştir.[21] Talidomid, başka bir anti-damarlanma ilacın HHT hastalarında da faydalı etkileri olduğu bildirildi.[22] Talidomid tedavisinin, deneysel bir fare HHT modelinde damar olgunlaşmasını indüklediği ve küçük bir HHT hastası grubunun çoğunda burun kanamalarının şiddetini ve sıklığını azalttığı bulunmuştur. Bu tedavi edilen hastaların kan hemoglobin seviyeleri, kanamanın azalması ve artmış kan damarı stabilizasyonunun bir sonucu olarak yükseldi.[23]
Epidemiyoloji

Dünyanın çeşitli bölgelerinde yapılan nüfus çalışmaları, HHT'nin hemen hemen tüm popülasyonlarda kabaca aynı oranda gerçekleştiğini göstermiştir: 5000'de 1 civarında. Bazı bölgelerde, çok daha yaygındır; örneğin, Fransızca bölgesi Haut Jura oran 1: 2351'dir - diğer popülasyonlara göre iki kat daha yaygındır. Bu, bir Kurucu etki, az sayıda atadan inen bir popülasyonun belirli bir genetik özelliğin yüksek bir oranına sahip olduğu, çünkü bu atalardan biri bu özelliği taşıyordu.[8] Haut Jura'da bunun belirli bir şeyin sonucu olduğu gösterilmiştir. ACVRL1 mutasyon (c.1112dupG veya c.1112_1113insG olarak adlandırılır).[2] En yüksek HHT oranı 1: 1331'dir. Bonaire ve Curacao, iki ada Karayipler e ait Hollanda Antilleri.[8]
HHT'li çoğu insanın normal bir ömrü vardır.[1] Deri lezyonları ve burun kanamaları çocukluk döneminde gelişme eğilimindedir. AVM'ler muhtemelen doğumdan itibaren mevcuttur, ancak herhangi bir semptoma neden olması gerekmez. Sık görülen burun kanamaları en yaygın semptomdur ve önemli ölçüde etkileyebilir yaşam kalitesi.[7]
Tarih
19. yüzyıl İngiliz doktorlarından başlayarak Henry Gawen Sutton (1836–1891)[24] ve ardından Benjamin Guy Babington (1794–1866)[25] ve John Wickham Legg (1843–1921),[26] HHT'nin en yaygın özelliklerini, özellikle tekrarlayan burun kanamalarını ve hastalığın kalıtsal yapısını anlattı. Fransız hekim Henri Jules Louis Marie Rendu (1844–1902) deri ve mukozal lezyonları gözlemledi ve durumu hemofili.[27] Kanada doğumlu Sör William Osler (1849–1919), sonra Johns Hopkins Hastanesi ve daha sonra Oxford Üniversitesi, bir 1901 raporu ile daha fazla katkıda bulundu. sindirim yolu.[28] İngiliz doktor Frederick Parkes Weber (1863–1962) 1907'de bir dizi vaka ile durumu daha ayrıntılı olarak bildirdi.[29] "Kalıtsal hemorajik telenjiektazi" terimi ilk olarak Amerikalı doktor Frederic M. Hanes (1883–1946) tarafından durumla ilgili 1909 tarihli bir makalede kullanılmıştır.[3][30]
HHT tanısı, HHT'ye neden olan genetik kusurlar, bir araştırma grubu tarafından tespit edilene kadar klinik olarak kaldı. Duke Üniversitesi Tıp Merkezi, sırasıyla 1994 ve 1996 yıllarında.[9][10] 2000 yılında, HHT Foundation International'ın uluslararası bilimsel danışma komitesi şu anda yaygın olarak kullanılan Curaçao kriterlerini yayınladı.[7][15] 2006 yılında, bir grup uluslararası uzman Kanada ve formüle etti kanıta dayalı yönerge, HHT Foundation International sponsorluğunda.[7]
Referanslar
- ^ a b c d e f g h ben j k l m n Ö p q r s t sen v w x y z Govani FS, Shovlin CL (Temmuz 2009). "Kalıtsal hemorajik telenjiektazi: klinik ve bilimsel bir inceleme". Avrupa İnsan Genetiği Dergisi. 17 (7): 860–71. doi:10.1038 / ejhg.2009.35. PMC 2986493. PMID 19337313.
- ^ a b c d e f g h ben j k l m n Ö p q r s t sen v w x y z Dupuis-Girod S, Bailly S, Plauchu H (Mart 2010). "Kalıtsal hemorajik telenjiektazi (HHT): moleküler biyolojiden hasta bakımına". J. Thromb. Haemost. 8 (7): 1447–56. doi:10.1111 / j.1538-7836.2010.03860.x. PMID 20345718.
- ^ a b Fuchizaki U, Miyamori H, Kitagawa S, Kaneko S, Kobayashi K (Kasım 2003). "Kalıtsal hemorajik telenjiektazi (Rendu – Osler – Weber hastalığı)". Lancet. 362 (9394): 1490–4. doi:10.1016 / S0140-6736 (03) 14696-X. PMID 14602446. S2CID 5304256.
- ^ a b c d e f Gossage JR, Kanj G (Ağustos 1998). "Pulmoner arteriyovenöz malformasyonlar. Son teknoloji ürünü bir inceleme". Am. J. Respir. Kritik. Bakım Med. 158 (2): 643–61. doi:10.1164 / ajrccm.158.2.9711041. PMID 9700146.
- ^ a b c d e f g h ben Faughnan ME, Granton JT, Young LH (Mayıs 2009). "Kalıtsal hemorajik telenjiektazinin pulmoner vasküler komplikasyonları". Avro. Respir. J. 33 (5): 1186–94. doi:10.1183/09031936.00061308. PMID 19407052.
- ^ a b c d e f g h Buscarini E, Plauchu H, Garcia Tsao G, vd. (Kasım 2006). "Kalıtsal hemorajik telenjiektazide karaciğer tutulumu: fikir birliği önerileri". Liver Int. 26 (9): 1040–6. doi:10.1111 / j.1478-3231.2006.01340.x. PMID 17032403.
- ^ a b c d e f g h ben j k l m n Ö p q r s t sen v w x y z aa ab AC reklam Faughnan ME, Palda VA, Garcia-Tsao G, ve diğerleri. (2011). "Kalıtsal hemorajik telenjiektazinin tanı ve yönetimi için uluslararası kılavuzlar". Tıbbi Genetik Dergisi. 48 (2): 73–87. doi:10.1136 / jmg.2009.069013. PMID 19553198. S2CID 18957466.
- ^ a b c d e f g h Abdalla SA, Letarte M (Şubat 2006). "Kalıtsal hemorajik telenjiektazi: genetik ve hastalık mekanizmaları üzerine güncel görüşler". Tıbbi Genetik Dergisi. 43 (2): 97–110. doi:10.1136 / jmg.2005.030833. PMC 2603035. PMID 15879500.
- ^ a b McAllister KA, Grogg KM, Johnson DW, ve diğerleri. (Aralık 1994). "Endotel hücrelerinin TGF-beta bağlayıcı bir proteini olan endoglin, kalıtsal hemorajik telenjiektazi tip 1 genidir". Nat. Genet. 8 (4): 345–51. doi:10.1038 / ng1294-345. PMID 7894484. S2CID 21623340.
- ^ a b Johnson DW, Berg JN, Baldwin MA, ve diğerleri. (Haziran 1996). "Kalıtsal hemorajik telenjiektazi tip 2'de aktivin reseptörü benzeri kinaz 1 genindeki mutasyonlar". Nat. Genet. 13 (2): 189–95. doi:10.1038 / ng0696-189. PMID 8640225. S2CID 21379604.
- ^ Cole SG, Begbie ME, Wallace GM, Shovlin CL (2005). "Kalıtsal hemorajik telenjiektazi (HHT3) için yeni bir lokus kromozom 5'e eşlenir". Tıbbi Genetik Dergisi. 42 (7): 577–82. doi:10.1136 / jmg.2004.028712. PMC 1736109. PMID 15994879.
- ^ Bayrak-Toydemir P, McDonald J, Akarsu N, vd. (2006). "Kalıtsal hemorajik telenjiektazi için dördüncü bir lokus, kromozom 7 ile eşleşir". Amerikan Tıbbi Genetik Dergisi. 140 (20): 2155–62. doi:10.1002 / ajmg.a.31450. PMID 16969873. S2CID 7393654.
- ^ Gallione CJ, Repetto GM, Legius E, vd. (Mart 2004). "MADH4 (SMAD4) mutasyonlarıyla ilişkili juvenil polipoz ve kalıtsal hemorajik telenjiektazinin kombine bir sendromu". Lancet. 363 (9412): 852–9. doi:10.1016 / S0140-6736 (04) 15732-2. PMID 15031030. S2CID 29539536.
- ^ a b c d e Friedlander RM (Haziran 2007). "Klinik uygulama. Beynin arteriyovenöz malformasyonları". N. Engl. J. Med. 356 (26): 2704–12. doi:10.1056 / NEJMcp067192. PMID 17596605.
- ^ a b Shovlin CL, Guttmacher AE, Buscarini E, vd. (Mart 2000). "Kalıtsal hemorajik telenjiektazi (Rendu-Osler-Weber sendromu) için tanı kriterleri". Amerikan Tıbbi Genetik Dergisi. 91 (1): 66–7. doi:10.1002 / (SICI) 1096-8628 (20000306) 91: 1 <66 :: AID-AJMG12> 3.0.CO; 2-P. PMID 10751092.
- ^ a b c Geisthoff UW, Fiorella ML, Fiorella R (2006). "HHT'de tekrarlayan epistaksisin tedavisi". Curr. Ecz. Des. 12 (10): 1237–42. doi:10.2174/138161206776361255. PMID 16611115.
- ^ Saunders WH (1963). "Septal dermoplasti: kalıtsal hemorajik telenjiektazili hastalarda burun kanamalarının kontrolü için yeni bir ameliyat prosedürü". J. Laryngol. Otol. 77 (1): 69–76. doi:10.1017 / S0022215100060382. PMID 13986828.
- ^ Young A (Mayıs 1967). "Atrofik rinitte burun deliklerinin kapatılması". J. Laryngol. Otol. 81 (5): 515–24. doi:10.1017 / S0022215100067426. PMID 6024992.
- ^ Cusumano, Lucas R .; Duckwiler, Gary R .; Roberts, Dustin G .; McWilliams, Justin P. (30 Ağustos 2019). "Tekrarlayan Pulmoner Arteriovenöz Malformasyonların Tedavisi: Proksimal ve Distal Embolizasyon Tekniğinin Karşılaştırılması". Kardiyovasküler ve Girişimsel Radyoloji. 43 (1): 29–36. doi:10.1007 / s00270-019-02328-0. PMID 31471718. S2CID 201675132.
- ^ Shovlin CL (2010). "Kalıtsal hemorajik telenjiektazi: patofizyoloji, tanı ve tedavi" (PDF). Kan Rev. 24 (6): 203–19. doi:10.1016 / j.blre.2010.07.001. hdl:10044/1/22167. PMID 20870325.
- ^ Dupuis-Girod S, Ginon I, Saurin JC, Marion D, Guillot E, Decullier E, Roux A, Carette MF, Gilbert-Dussardier B, Hatron PY, Lacombe P, Lorcerie B, Rivière S, Corre R, Giraud S, Bailly S, Paintaud G, Ternant D, Valette PJ, Plauchu H, Faure F (2012). "Bevacizumab in patients with hereditary hemorrhagic telangiectasia and severe hepatic vascular malformations and high cardiac output". JAMA. 307 (9): 948–55. doi:10.1001/jama.2012.250. PMID 22396517.
- ^ Franchini M, Frattini F, Crestani S, Bonfanti C (2012). "Novel treatments for epistaxis in hereditary hemorrhagic telangiectasia: a systematic review of the clinical experience with thalidomide". J Tromb Tromboliz. 36 (3): 355–7. doi:10.1007/s11239-012-0840-5. PMID 23143669. S2CID 33837604.
- ^ Lebrin F, Srun S, Raymond K, Martin S, van den Brink S, Freitas C, Bréant C, Mathivet T, Larrivée B, Thomas JL, Arthur HM, Westermann CJ, Disch F, Mager JJ, Snijder RJ, Eichmann A, Mummery CL (2010). "Thalidomide stimulates vessel maturation and reduces epistaxis in individuals with hereditary hemorrhagic telangiectasia". Nat Med. 16 (4): 420–8. doi:10.1038/nm.2131. PMID 20364125. S2CID 10649281.
- ^ Sutton HG (1864). "Epistaxis as an indication of impaired nutrition, and of degeneration of the vascular system". Med. Ayna: 769–81.
- ^ Babington BG (1865). "Hereditary epistaxis". Lancet. 2 (2195): 362–363. doi:10.1016/S0140-6736(02)55197-7.
- ^ Legg W (1876). "A case of haemophilia complicated with multiple naevi". Lancet. 2 (2781): 856–7. doi:10.1016/S0140-6736(02)49594-3.
- ^ Rendu HJ (1896). "Épistaxis répétées chez un sujet porteur de petits angiomes cutanés et muqueux". Gaz. Hop.: 1322–3.
- ^ Osler W (1901). "On a family form of recurring epistaxis, associated with multiple telangiectases of the skin and mucous membranes". Boğa. Johns Hopkins Hosp. 12: 333–7.
- ^ Weber FP (1907). "Multiple hereditary developmental angiomata (telangiectases) of the skin and mucous membranes associated with recurring haemorrhages". Lancet. 2 (4377): 160–162. doi:10.1016/S0140-6736(00)32590-9.
- ^ Hanes FM (1909). "Multiple hereditary telangiectasis causing hemorrhage (hereditary hemorrhagic telangiectasia)". Boğa. Johns Hopkins Hosp. 20: 63–73.
| Sınıflandırma | |
|---|---|
| Dış kaynaklar |
