Radyasyon tedavisi - Radiation therapy - Wikipedia
| Radyasyon tedavisi | |
|---|---|
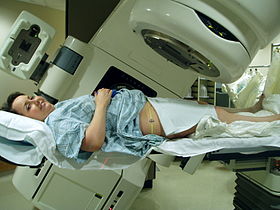 Radyasyon tedavisi leğen kemiği Varian Clinac iX doğrusal hızlandırıcı kullanarak. Tam konumu belirlemek için lazer ve bacakların altında bir kalıp kullanılır. | |
| ICD-10-ADET | D |
| ICD-9-CM | 92.2 -92.3 |
| MeSH | D011878 |
| OPS-301 kodu | 8–52 |
| MedlinePlus | 001918 |
Radyasyon tedavisi veya radyoterapi, genellikle kısaltılmış RT, RTxveya XRT, kullanan bir terapidir iyonlaştırıcı radyasyon genellikle kanser tedavisinin bir parçası olarak kontrol etmek veya öldürmek için kötü huylu hücreler ve normalde bir Doğrusal hızlandırıcı. Radyasyon tedavisi, vücudun bir bölgesine lokalize edilmişse, bazı kanser türlerinde iyileştirici olabilir. Ayrıca bir parçası olarak da kullanılabilir adjuvan tedavi, birincil kötü huylu bir tümörü çıkarmak için ameliyattan sonra tümörün nüksetmesini önlemek için (örneğin, meme kanserinin erken aşamaları). Radyasyon tedavisi ile sinerjiktir kemoterapi duyarlı kanserlerde kemoterapi öncesinde, sırasında ve sonrasında kullanılmıştır. Onkolojinin radyoterapi ile ilgili alt uzmanlık alanına denir. radyasyon onkoloğu.
Radyasyon tedavisi, hücre büyümesini kontrol etme kabiliyeti nedeniyle genellikle kanserli tümöre uygulanır. İyonlaştırıcı radyasyon, DNA kanserli dokunun hücresel ölüm. Normal dokuları (tümörü tedavi etmek için radyasyonun geçmesi gereken deri veya organlar gibi) korumak için, şekillendirilmiş radyasyon ışınlarının çeşitli açılardan tümöre kesişmesi hedeflenir ve çok daha büyük emilen doz orada çevredeki sağlıklı dokudan daha fazla. Tümörün kendisinin yanı sıra, radyasyon alanları, tümörle klinik veya radyolojik olarak ilgiliyse veya subklinik malign yayılma riski olduğu düşünülüyorsa, drene olan lenf düğümlerini de içerebilir. Günlük kurulum ve dahili tümör hareketindeki belirsizliklere izin vermek için tümörün etrafına bir normal doku marjı dahil etmek gerekir. Bu belirsizliklere iç hareket (örneğin solunum ve mesane dolumu) ve dış deri izlerinin tümör pozisyonuna göre hareketi neden olabilir.
Radyasyon onkolojisi, radyasyon reçetesi yazmayla ilgili tıbbi uzmanlık alanıdır ve radyasyondan farklıdır. radyoloji radyasyon kullanımı tıbbi Görüntüleme ve Teşhis. Radyasyon, bir radyasyon onkoloğu iyileştirme ("iyileştirici") veya adjuvan tedavi amaçlı. Olarak da kullanılabilir Hafifletici tedavi (tedavinin mümkün olmadığı ve amacın lokal hastalık kontrolü veya semptomatik rahatlama olduğu durumlarda) veya terapötik tedavi (terapinin hayatta kalma yararı olduğu ve iyileştirici olabildiği durumlarda). Radyasyon tedavisinin birlikte kullanılması da yaygındır. ameliyat kemoterapi hormon tedavisi, immünoterapi veya dördünün bir karışımı. En yaygın kanser türleri bir şekilde radyasyon tedavisi ile tedavi edilebilir.
Kesin tedavi amacı (küratif, adjuvan, neoadjuvan terapötik veya palyatif) tümör tipi, yeri ve evresinin yanı sıra hastanın genel sağlığına da bağlı olacaktır. Toplam vücut ışınlaması (TBI), vücudu bir almaya hazırlamak için kullanılan bir radyasyon tedavisi tekniğidir. kemik iliği nakli. Brakiterapi içinde radyoaktif kaynak Tedavi gerektiren bölgenin içine veya yanına yerleştirilirse, meme, prostat ve diğer organ kanserlerini tedavi etmek için prosedürler sırasında sağlıklı dokuya maruz kalmayı en aza indiren başka bir radyasyon tedavisi şeklidir. Radyasyon tedavisinin kötü huylu olmayan durumlarda çeşitli uygulamaları vardır. trigeminal nöralji, akustik nöromalar, şiddetli tiroid göz hastalığı, pterjiyum, pigmentli villonodüler sinovit ve önlenmesi keloid yara izi büyümesi, vasküler restenoz, ve heterotopik kemikleşme. Kötü huylu olmayan koşullarda radyasyon tedavisinin kullanımı, kısmen radyasyona bağlı kanser riski konusundaki endişelerle sınırlıdır.
Tıbbi kullanımlar

Farklı kanserler radyasyon tedavisine farklı şekillerde yanıt verir.[1][2][3]
Bir kanserin radyasyona tepkisi, radyosensitivitesiyle tanımlanır. Yüksek radyasyona duyarlı kanser hücreleri, mütevazı radyasyon dozları tarafından hızla öldürülür. Bunlar arasında lösemiler, çoğu lenfomalar ve germ hücreli tümörler.Çoğunluğu epitel kanserleri Sadece orta derecede radyasyona duyarlıdır ve radikal bir tedavi elde etmek için önemli ölçüde daha yüksek bir radyasyon dozu (60-70 Gy) gerektirir. klinik uygulamada. Böbrek hücresi kanseri ve melanom genellikle radyasyona dirençli kabul edilir, ancak radyasyon tedavisi hala metastatik melanomlu birçok hasta için palyatif bir seçenektir. Radyasyon tedavisini birleştirmek immünoterapi aktif bir araştırma alanıdır ve melanom ve diğer kanserler için umut vaat etmektedir.[4]
Bir dereceye kadar laboratuar ölçüsü olan belirli bir tümörün radyosensitivitesini, gerçek klinik uygulamada bir kanserin radyasyon "iyileştirilebilirliğinden" ayırt etmek önemlidir. Örneğin, lösemiler vücutta yayıldıkları için genellikle radyasyon tedavisi ile tedavi edilemezler. Lenfoma, vücudun bir bölgesine lokalize ise kökten iyileştirilebilir. Benzer şekilde, yaygın, orta derecede radyoreponsif tümörlerin çoğu, eğer erken bir aşamadalarsa, küratif dozlarda radyasyon tedavisi ile rutin olarak tedavi edilir. Örneğin, melanom dışı cilt kanseri, baş ve boyun kanseri, meme kanseri, kucuk hucreli olmayan akciger kanseri, Rahim ağzı kanseri, anal kanser, ve prostat kanseri. Metastatik kanserler genellikle radyasyon tedavisi ile tedavi edilemez çünkü tüm vücudu tedavi etmek mümkün değildir.
Tedaviden önce, tümörü ve çevresindeki normal yapıları tanımlamak için genellikle bir BT taraması yapılır. Hasta, tedavi alanlarının yerleştirilmesine rehberlik etmek için küçük deri izleri alır.[5] Hastanın her tedavi sırasında aynı pozisyona yerleştirilmesi gerekeceğinden, bu aşamada hasta konumlandırması çok önemlidir. Bu amaçla, hastaya göre kalıplanabilen maskeler ve yastıklar dahil olmak üzere birçok hasta konumlandırma cihazı geliştirilmiştir.
Bir tümörün radyasyon tedavisine yanıtı aynı zamanda boyutuyla da ilgilidir. Karmaşık nedeniyle radyobiyoloji çok büyük tümörler, daha küçük tümörlere veya mikroskobik hastalıklara göre radyasyona daha az yanıt verir. Bu etkinin üstesinden gelmek için çeşitli stratejiler kullanılır. En yaygın teknik, radyasyon tedavisinden önce cerrahi rezeksiyondur. Bu, en yaygın olarak meme kanseri tedavisinde görülür. geniş lokal eksizyon veya mastektomi bunu takiben adjuvan radyasyon tedavisi. Diğer bir yöntem de tümörü küçültmektir. neoadjuvan radikal radyasyon tedavisinden önce kemoterapi. Üçüncü bir teknik, radyasyon tedavisi sırasında belirli ilaçlar verilerek kanserin radyosensitivitesini artırmaktır. Radyosensitize edici ilaçların örnekleri şunları içerir: Cisplatin, Nimorazole, ve Setuksimab.[6]
Radyoterapinin etkisi, farklı kanser türleri ve farklı gruplar arasında değişiklik gösterir.[7] Örneğin, meme kanseri için meme koruyucu cerrahi radyoterapinin hastalığın tekrarlama oranını yarıya indirdiği bulunmuştur.[8]
Yan etkiler
Radyasyon tedavisi kendi başına ağrısızdır. Birçok düşük doz palyatif tedaviler (örneğin, kemikli radyasyon tedavisi metastazlar Tedavi edilen bölgedeki sinirleri sıkıştıran ödem nedeniyle tedaviyi takip eden günlerde kısa süreli ağrı alevlenmeleri yaşanabilse de, çok az yan etkiye neden olur veya hiç neden olmaz. Daha yüksek dozlar, tedavi sırasında (akut yan etkiler), tedaviyi takip eden aylarda veya yıllarda (uzun vadeli yan etkiler) veya yeniden tedaviden sonra (kümülatif yan etkiler) çeşitli yan etkilere neden olabilir. Yan etkilerin niteliği, ciddiyeti ve uzun ömürlülüğü radyasyonu alan organlara, tedavinin kendisine (radyasyon tipi, doz, fraksiyonlama, eş zamanlı kemoterapi) ve hastaya bağlıdır.
Çoğu yan etki tahmin edilebilir ve beklenir. Radyasyondan kaynaklanan yan etkiler genellikle hastanın vücudunun tedavi altındaki bölgesi ile sınırlıdır. Yan etkiler doza bağlıdır; örneğin daha yüksek dozlarda baş ve boyun radyasyonu aşağıdakilerle ilişkilendirilebilir: kardiyovasküler komplikasyonlar tiroid disfonksiyon ve hipofiz eksen disfonksiyonu.[9] Modern radyasyon tedavisi, yan etkileri en aza indirmeyi ve hastanın kaçınılmaz olan yan etkileri anlamasına ve bunlarla başa çıkmasına yardımcı olmayı amaçlamaktadır.
Bildirilen ana yan etkiler, hafif ila orta derecede güneş yanığı gibi yorgunluk ve cilt tahrişidir. Yorgunluk genellikle bir tedavi sürecinin ortasında başlar ve tedavi bittikten sonra haftalarca sürebilir. Tahriş olmuş cilt iyileşir, ancak eskisi kadar elastik olmayabilir.[10]
Akut yan etkiler
- Mide bulantısı ve kusma
- Bu, radyasyon tedavisinin genel bir yan etkisi değildir ve mekanik olarak yalnızca mide veya karın tedavisi (genellikle tedaviden birkaç saat sonra tepki verir) veya tedavi sırasında kafadaki bazı mide bulantısı üreten yapılara radyasyon tedavisi ile ilişkilidir. belirli baş ve boyun tümörleri, en yaygın olarak iç kulakların vestibülleri.[11] Herhangi bir üzücü tedavide olduğu gibi, bazı hastalar radyoterapi sırasında veya hatta beklentisiyle hemen kusarlar, ancak bu psikolojik bir yanıt olarak kabul edilir. Herhangi bir nedenle mide bulantısı antiemetiklerle tedavi edilebilir.[12]
- Hasar epitel yüzeyler[13]
- Epitel yüzeyler radyasyon tedavisinden zarar görebilir. Tedavi edilen bölgeye bağlı olarak bu, deri, ağız mukozası, faringeal, bağırsak mukozası ve üreteri içerebilir. Hasarın başlama ve ondan iyileşme oranları, epitel hücrelerinin devir hızına bağlıdır. Tipik olarak cilt, tedaviye birkaç hafta kala pembeleşmeye ve ağrımaya başlar. Tedavi sırasında ve radyasyon tedavisinin bitiminden sonra yaklaşık bir hafta kadar reaksiyon daha şiddetli hale gelebilir ve cilt bozulabilir. Buna rağmen nemli deskuamasyon rahatsız edici, iyileşme genellikle hızlıdır. Kadın göğsünün altı, kulak arkası ve kasık gibi deride doğal kıvrımların olduğu bölgelerde cilt reaksiyonları daha kötü olma eğilimindedir.
- Ağız, boğaz ve mide yaraları
- Baş ve boyun bölgesi tedavi edilirse genellikle ağızda ve boğazda geçici ağrı ve ülser oluşur.[14] Şiddetliyse, bu yutmayı etkileyebilir ve hastanın ağrı kesicilere ve beslenme desteğine / gıda takviyesine ihtiyacı olabilir. Yemek borusu, doğrudan tedavi edilirse veya genellikle olduğu gibi, akciğer kanseri tedavisi sırasında bir doz kollateral radyasyon alırsa ağrıyabilir. Karaciğer kanserlerini ve metastazlarını tedavi ederken, kollateral radyasyonun mide, mide veya duodenum ülserlerine neden olması mümkündür.[15][16] Bu ikincil radyasyon genellikle infüze edilen radyoaktif ajanların hedeflenmemiş bir şekilde verilmesinden (reflü) kaynaklanır.[17] Bu tür olumsuz yan etkilerin oluşumunu azaltmak için yöntemler, teknikler ve cihazlar mevcuttur.[18]
- Bağırsak rahatsızlığı
- Bağırsak alt kısmı doğrudan radyasyonla tedavi edilebilir (rektal veya anal kanser tedavisi) veya radyasyon tedavisi ile diğer pelvik yapılara (prostat, mesane, kadın genital sistemi) maruz bırakılabilir. Tipik semptomlar ağrı, ishal ve mide bulantısıdır. Beslenme müdahaleleri, radyoterapiye bağlı ishale yardımcı olabilir. [19] Birincil pelvik kanser için antikanser tedavisinin bir parçası olarak pelvik radyoterapi alan kişilerde yapılan çalışmalar, radyoterapi sırasında diyetteki yağ, lif ve laktozdaki değişikliklerin tedavinin sonunda ishali azalttığını buldu. [19]
- Şişme
- Generalin bir parçası olarak iltihap yumuşak dokuların şişmesi, radyasyon tedavisi sırasında sorunlara neden olabilir. Bu, beyin tümörlerinin ve beyin metastazlarının tedavisi sırasında, özellikle de önceden var olan bir sorundur. kafa içi basınç veya tümörün neredeyse tamamen tıkanmasına neden olduğu yerde lümen (Örneğin., trakea veya ana bronş ). Radyasyon tedavisinden önce cerrahi müdahale düşünülebilir. Ameliyatın gereksiz veya uygunsuz görülmesi durumunda hasta, steroidler şişliği azaltmak için radyasyon tedavisi sırasında.
- Kısırlık
- gonadlar (yumurtalıklar ve testisler) radyasyona çok duyarlıdır. Üretemeyebilirler gametler takip etme direkt Çoğu normal tedavi dozunda radyasyona maruz kalma. Tüm vücut bölgeleri için tedavi planlaması, birincil tedavi alanı değilse, gonadlara dozu tamamen dışlamasa da en aza indirecek şekilde tasarlanmıştır.
Geç yan etkiler
Geç yan etkiler tedaviden aylar ila yıllar sonra ortaya çıkar ve genellikle tedavi edilen alanla sınırlıdır. Genellikle kan damarlarının ve bağ dokusu hücrelerinin hasar görmesinden kaynaklanırlar. Birçok geç etki, tedaviyi daha küçük parçalara ayırarak azaltılır.
- Fibroz
- Işınlanmış dokular, yaygın bir yara izi sürecinden dolayı zamanla daha az elastik olma eğilimindedir.
- Epilasyon
- 1 Gy'nin üzerindeki dozlarda tüylü herhangi bir ciltte epilasyon (saç dökülmesi) meydana gelebilir. Yalnızca radyasyon alanı / alanları içinde oluşur. Tek doz 10 Gy ile saç dökülmesi kalıcı olabilir, ancak doz bölünürse kalıcı saç dökülmesi doz 45 Gy'yi geçene kadar oluşmayabilir.
- Kuruluk
- Tükürük bezleri ve gözyaşı bezlerinin radyasyon toleransı yaklaşık 30'dur.Gy 2 Gy'lik fraksiyonlarda, çoğu radikal baş ve boyun kanseri tedavisinin aştığı bir doz. Kuru ağız (kserostomi ) ve kuru gözler (kseroftalmi ) rahatsız edici uzun vadeli problemler haline gelebilir ve hastanın yaşam kalitesi. Benzer şekilde, ter bezleri tedavi edilen ciltte (örneğin koltukaltı ) çalışmayı bırakma eğiliminde ve doğal olarak nemli vajinal mukoza pelvik ışınlamadan sonra genellikle kurudur.
- Lenfödem
- Lokalize sıvı tutulması ve doku şişmesi durumu olan lenfödem, radyasyon tedavisi sırasında lenfatik sistemde meydana gelen hasardan kaynaklanabilir. Aksiller lenf nodlarını temizlemek için cerrahi sonrası adjuvan aksiller radyoterapi alan meme radyasyonu tedavisi gören hastalarda en sık bildirilen komplikasyondur.[20]
- Kanser
- Radyasyon potansiyel bir kanser nedenidir ve bazı hastalarda ikincil maligniteler görülür. Yaşam tarzı seçimleri, genetik ve önceki radyasyon tedavisi gibi bir dizi faktöre bağlı olarak kanserden kurtulanların genel nüfustan daha fazla malignite geliştirme olasılığı daha yüksektir. Bu ikincil kanserlerin oranlarını tek bir nedenden dolayı doğrudan ölçmek zordur. Çalışmalar, hastaların sadece küçük bir azınlığı için ikincil malignitelerin nedeni olarak radyasyon tedavisini bulmuştur.[21][22] Dozu sağlıklı dokulara düşürmeyi amaçlayan proton ışın tedavisi ve karbon iyonu radyoterapisi gibi yeni teknikler bu riskleri azaltacaktır.[23][24] Tedaviden 4-6 yıl sonra ortaya çıkmaya başlar, ancak 3 yıl içinde bazı hematolojik maligniteler gelişebilir. Vakaların büyük çoğunluğunda, bu risk, daha yüksek ikincil malignite yükü taşıyan pediatrik malignitelerde bile birincil kanseri tedavi ederek sağlanan riskin azalmasıyla büyük ölçüde ağır basmaktadır.[25]
- Kalp-damar hastalığı
- Radyasyon, önceki meme kanseri RT rejimlerinde gözlemlendiği gibi kalp hastalığı ve ölüm riskini artırabilir.[26] Terapötik radyasyon, daha sonraki bir kardiyovasküler olay (yani kalp krizi veya felç) riskini, ağırlaştırıcı faktörler dahil, bir kişinin normal hızının 1,5 ila 4 katı kadar artırır.[27] Artış, RT'nin doz kuvveti, hacmi ve konumu ile ilgili olarak doza bağlıdır.
- Kardiyovasküler geç yan etkiler, radyasyona bağlı kalp hastalığı (RIHD) ve radyasyona bağlı vasküler hastalık (RIVD) olarak adlandırılmıştır.[28] Belirtiler doza bağlıdır ve şunları içerir: kardiyomiyopati, miyokardiyal fibroz, kalp kapak HASTALIĞI, koroner arter hastalığı, kalp aritmi ve periferik arter hastalığı. Radyasyona bağlı fibroz, vasküler hücre hasarı ve oksidatif stres bunlara ve diğer geç yan etki semptomlarına yol açabilir.[28] Radyasyona bağlı kardiyovasküler hastalıkların çoğu tedaviden 10 veya daha fazla yıl sonra ortaya çıkar ve nedensellik tespitini daha zor hale getirir.[27]
- Bilişsel düşüş
- Başa uygulanan radyasyon durumlarında radyasyon tedavisi neden olabilir bilişsel gerileme. Bilişsel düşüş özellikle 5 ila 11 yaş arasındaki küçük çocuklarda belirgindi. Araştırmalar, örneğin, 5 yaşındaki çocukların IQ'sunun tedaviden sonra her yıl birkaç IQ puanı kadar düştüğünü buldu.[29]
- Radyasyon enteropatisi
- Karın ve pelvik radyoterapi sonrasında gastrointestinal sistem zarar görebilir.[30] Atrofi, fibroz ve vasküler değişiklikler üretir emilim bozukluğu, ishal, steatore ve kanama ile safra asidi ishal ve b12 vitamini ileal tutulum nedeniyle yaygın olarak bulunan malabsorpsiyon. Pelvik radyasyon hastalığı içerir radyasyon proktit kanama, ishal ve aciliyet üreten,[31] ve ayrıca mesane etkilendiğinde radyasyon sistitine neden olabilir.
- Radyasyona bağlı polinöropati
- Radyasyon tedavileri, sinir dokusu da olduğu için hedef bölgenin yakınındaki veya iletim yolundaki sinirlere zarar verebilir. radyasyona duyarlı.[32] İyonlaştırıcı radyasyondan kaynaklanan sinir hasarı, mikrovasküler yaralanmanın ilk aşaması, kılcal hasar ve sinir demiyelinizasyonu.[33] Sonraki hasar vasküler daralmadan oluşur ve sinir sıkışması Nedeniyle kontrolsüz lifli doku büyümesi radyasyonun neden olduğu.[33] Radyasyona bağlı polinöropati, ICD-10-CM Kodu G62.82, radyasyon tedavisi alanların yaklaşık% 1-5'inde görülür.[33][32]
- Işınlanmış bölgeye bağlı olarak, her iki durumda da geç etki nöropati oluşabilir. merkezi sinir sistemi (CNS) ya da periferik sinir sistemi (PNS). Örneğin CNS'de, kraniyal sinir yaralanması tipik olarak tedaviden 1-14 yıl sonra görme keskinliği kaybı olarak ortaya çıkar.[33] PNS'de pleksus sinirlerinin yaralanması, radyasyona bağlı brakiyal pleksopati veya radyasyona bağlı lumbosakral pleksopati tedaviden sonra 3 yıla kadar ortaya çıkan.[33]
- Radyasyon nekrozu
- Radyasyon nekroz ışınlanmış bölgenin yakınındaki sağlıklı dokunun ölümüdür. Bu bir tür Pıhtılaşma nekrozu Bu, radyasyonun bölgedeki kan damarlarına doğrudan veya dolaylı olarak zarar vermesi nedeniyle oluşur, bu da kalan sağlıklı dokuya kan akışını azaltır ve ölmesine neden olur. iskemi olana benzer şekilde iskemik inme.[34] Tedavinin dolaylı bir etkisi olduğu için radyasyona maruz kaldıktan aylar ila on yıllar sonra ortaya çıkar.[34]
Kümülatif yan etkiler
Bu sürecin kümülatif etkileri, uzun vadeli etkilerle karıştırılmamalıdır - kısa vadeli etkiler ortadan kalktığında ve uzun vadeli etkiler subklinik olduğunda, yeniden ışınlama hala sorunlu olabilir.[35] Bu dozlar radyasyon onkolojisi uzmanı tarafından hesaplanır ve sonraki radyasyon gerçekleşmeden önce birçok faktör dikkate alınır.
Üreme üzerindeki etkiler
Sonraki ilk iki hafta boyunca döllenme, radyasyon tedavisi ölümcül ama değil teratojenik.[36] Hamilelik sırasında yüksek doz radyasyon indükler anormallikler, bozulmuş büyüme ve zihinsel engelli ve artan bir risk olabilir çocukluk çağı lösemi ve yavrulardaki diğer tümörler.[36]
Daha önce radyoterapi almış erkeklerde, tedaviden sonra gebe kalan çocuklarında genetik kusurlarda veya konjenital malformasyonlarda artış olmadığı görülmektedir.[36] Ancak, kullanımı yardımcı üreme teknolojileri ve mikromanipülasyon teknikleri bu riski artırabilir.[36]
Hipofiz sistemi üzerindeki etkiler
Hipopituitarizm genellikle sellar ve parasellar neoplazmalar, ekstrasellar beyin tümörleri, baş ve boyun tümörleri için radyasyon tedavisinden sonra ve sistemik malignitelerde tüm vücut ışınlamasından sonra gelişir.[37] Radyasyona bağlı hipopituitarizm esas olarak büyüme hormonu ve gonadal hormonlar.[37] Tersine, adrenokortikotrofik hormon (ACTH) ve tiroid uyarıcı hormon (TSH) eksiklikleri, radyasyona bağlı hipopituitarizmi olan insanlar arasında en az görülenidir.[37] Değişiklikler prolaktin Salgılama genellikle hafiftir ve radyasyonun bir sonucu olarak vazopressin eksikliği çok nadir görülür.[37]
Radyasyon tedavisi kazaları
Radyasyon tedavisinin hastalara yanlışlıkla aşırı maruz kalma riskini en aza indirmek için sıkı prosedürler bulunmaktadır. Ancak bazen hatalar meydana gelir; örneğin radyasyon tedavisi makinesi Therac-25 1985 ve 1987 yılları arasında hastalara amaçlanan dozun yüz katına kadar verildiği en az altı kazadan sorumluydu; iki kişi doğrudan aşırı doz radyasyonla öldürüldü. 2005'ten 2010'a, bir hastanede Missouri yeni radyasyon ekipmanı yanlış kurulmuş olduğu için beş yıllık bir süre içinde 76 hastayı (çoğu beyin kanseri) aşırı maruz bıraktı.[38]
Tıbbi hatalar son derece nadir olmakla birlikte, radyasyon onkologları, tıbbi fizikçiler ve radyasyon tedavisi tedavi ekibinin diğer üyeleri bunları ortadan kaldırmak için çalışıyor. ASTRO adlı bir güvenlik girişimi başlattı Güvenle Hedefleyin bu, diğer şeylerin yanı sıra, ulusal çapta hataları kaydetmeyi amaçlamaktadır, böylece doktorlar her bir hatadan bir şeyler öğrenebilir ve bunların olmasını engelleyebilir. ASTRO ayrıca, her tedavinin mümkün olduğu kadar güvenli olmasını sağlamak için hastaların doktorlarına radyasyon güvenliği hakkında sormaları için bir soru listesi yayınlamaktadır.[39]
Kanserli olmayan hastalıklarda kullanın

Erken evreyi tedavi etmek için radyasyon tedavisi kullanılır Dupuytren hastalığı ve Ledderhose hastalığı. Dupuytren'in hastalığı nodüller ve kordonlar aşamasındayken veya parmaklar 10 dereceden daha az minimum deformasyon aşamasındayken, hastalığın daha fazla ilerlemesini önlemek için radyasyon tedavisi kullanılır. Radyasyon tedavisi de bazı durumlarda hastalığın ilerlemesini önlemek için ameliyat sonrası kullanılır. Düşük doz radyasyon, beş gün boyunca tipik olarak üç gri radyasyon kullanılır, üç ay ara verilir ve ardından beş gün boyunca üç gri radyasyonun başka bir aşaması izlenir.[40]
Teknik
Hareket mekanizması
Radyasyon tedavisi, DNA kanserli hücrelerin. Bu DNA hasarına iki tür enerjiden biri neden olur. foton veya yüklü parçacık. Bu hasar doğrudan veya dolaylıdır iyonlaşma DNA zincirini oluşturan atomların Dolaylı iyonlaşma suyun iyonlaşması sonucu oluşur, serbest radikaller özellikle hidroksil daha sonra DNA'ya zarar veren radikaller.
Foton terapisinde radyasyon etkisinin çoğu serbest radikaller aracılığıyladır. Hücrelerin, tek sarmallı DNA hasarını onarmak için mekanizmaları vardır ve çift sarmallı DNA hasar. Bununla birlikte, çift sarmallı DNA kırıklarının onarımı çok daha zordur ve dramatik kromozomal anormalliklere ve genetik delesyonlara yol açabilir. Çift sarmallı kırılmaları hedeflemek, hücrelerin geçme olasılığını artırır hücre ölümü. Kanser hücreleri genellikle daha azdır farklılaşmış ve dahası kök hücre -sevmek; en sağlıklıdan daha fazla ürerler farklılaşmış Hücreler ve ölümcül olmayan hasarı onarma yeteneği azalmıştır. Tek iplikli DNA hasarı daha sonra hücre bölünmesi yoluyla aktarılır; kanser hücrelerinin DNA'sındaki hasar birikerek ölmelerine veya daha yavaş çoğalmalarına neden olur.
Foton radyasyon tedavisinin en büyük sınırlamalarından biri, katı tümör hücrelerinin yetersiz kalmasıdır. oksijen. Katı tümörler, kan akışını aşabilir ve düşük oksijen durumuna neden olabilir. hipoksi. Oksijen güçlüdür radyosensitizör, DNA'ya zarar veren serbest radikaller oluşturarak belirli bir radyasyon dozunun etkinliğini artırmak. Hipoksik bir ortamdaki tümör hücreleri, normal oksijen ortamındakilere göre radyasyon hasarına 2 ila 3 kat daha dirençli olabilir.[41]Yüksek basınçlı oksijen tanklarının kullanımı da dahil olmak üzere hipoksinin üstesinden gelmek için birçok araştırma yapılmıştır. hipertermi tedavisi (tümör bölgesine kan damarlarını genişleten ısı tedavisi), artan oksijen taşıyan kan ikameleri, hipoksik hücre radyosensitize edici ilaçlar gibi misonidazol ve metronidazol ve hipoksik sitotoksinler (doku zehirleri), örneğin tirapazamin. Daha yeni araştırma yaklaşımları şu anda incelenmektedir, buna klinik öncesi ve klinik araştırmalar da dahildir. oksijen difüzyonu arttırıcı bileşik gibi trans sodyum krosetinat (TSC) olarak radyosensitizör.[42]
Gibi yüklü parçacıklar protonlar ve bor, karbon, ve neon iyonlar, yüksek LET (yüksek LET) yoluyla kanser hücresi DNA'sına doğrudan zarar verebilir.doğrusal enerji transferi ) ve tümör oksijen kaynağından bağımsız bir antitümör etkisine sahiptir, çünkü bu partiküller çoğunlukla doğrudan enerji transferi yoluyla etki eder ve genellikle çift sarmallı DNA kırılmalarına neden olur. Nispeten büyük kütleleri nedeniyle, protonlar ve diğer yüklü parçacıkların dokuda çok az yanal yan dağılımı vardır - ışın çok genişlemez, tümör şekline odaklanır ve çevreleyen dokuya küçük dozda yan etkiler verir. Ayrıca tümörü kullanarak daha kesin olarak hedef alırlar. Bragg zirvesi etki. Görmek proton tedavisi Yoğunluk ayarlı radyasyon terapisinin (IMRT) farklı etkilerinin güzel bir örneği için yüklü parçacık tedavisi. Bu prosedür, yüklü parçacık radyasyon kaynağı ile tümör arasındaki sağlıklı dokuya verilen hasarı azaltır ve tümöre ulaşıldıktan sonra doku hasarı için sınırlı bir aralık belirler. Buna karşılık, IMRT'nin yüksüz partikül kullanması, enerjisinin vücuttan çıktığında sağlıklı hücrelere zarar vermesine neden olur. Bu mevcut hasar terapötik değildir, tedavinin yan etkilerini artırabilir ve ikincil kanser indüksiyon olasılığını artırır.[43] Bu fark, diğer organların birbirine yakın olmasının herhangi bir başıboş iyonlaşmayı çok zararlı hale getirdiği durumlarda çok önemlidir (örnek: baş ve boyun kanserleri Bu röntgen ışınına maruz kalma, büyüyen vücutları nedeniyle özellikle çocuklar için kötüdür ve ilk RT'den 5 yıl sonra ikinci bir malignite olasılığı% 30'dur.[44]
Doz
Foton radyasyon tedavisinde kullanılan radyasyon miktarı, griler (Gy) ve tedavi edilen kanserin türüne ve evresine bağlı olarak değişir. Küratif vakalar için, katı bir epitel tümörünün tipik dozu 60 ila 80 Gy arasında değişirken, lenfomalar 20 ila 40 Gy ile tedavi edilir.
Önleyici (adjuvan) dozlar tipik olarak 1.8-2 Gy'lik fraksiyonlarda (meme, baş ve boyun kanserleri için) 45-60 Gy civarındadır. radyasyon onkologları hastanın kemoterapi alıp almadığı, hasta komorbiditeleri, radyasyon tedavisinin ameliyattan önce mi yoksa sonra mı uygulandığı ve ameliyatın başarı derecesi dahil olmak üzere bir doz seçerken.
Reçete edilen bir dozun teslimat parametreleri, tedavi planlaması (parçası dozimetri ). Tedavi planlaması genellikle özel tedavi planlama yazılımı kullanılarak özel bilgisayarlarda gerçekleştirilir. Radyasyon verme yöntemine bağlı olarak, gerekli toplam dozu toplamak için birkaç açı veya kaynak kullanılabilir. Planlayıcı, tümöre tek tip bir reçete dozu veren ve çevredeki sağlıklı dokulara dozu en aza indiren bir plan tasarlamaya çalışacaktır.
Radyasyon tedavisinde, üç boyutlu doz dağılımları kullanılarak değerlendirilebilir. dozimetri olarak bilinen teknik jel dozimetresi.[45]
- Fraksiyonlama
Toplam doz, birkaç önemli nedenden dolayı bölünür (zamana yayılır). Fraksiyonlama, normal hücrelerin iyileşme süresine izin verirken, tümör hücreleri genellikle fraksiyonlar arasındaki onarımda daha az etkilidir. Fraksiyonlama ayrıca, bir tedavi sırasında hücre döngüsünün nispeten radyasyona dirençli fazında bulunan tümör hücrelerinin, bir sonraki fraksiyon verilmeden önce döngünün hassas bir fazına geçmesine izin verir. Benzer şekilde, kronik olarak veya akut olarak hipoksik olan (ve dolayısıyla radyasyona daha dirençli) tümör hücreleri, fraksiyonlar arasında yeniden oksijenlenerek tümör hücresi ölümünü iyileştirebilir.[46]
Fraksiyonasyon rejimleri, farklı radyasyon tedavisi merkezleri arasında ve hatta bireysel doktorlar arasında kişiselleştirilir. Kuzey Amerika, Avustralya ve Avrupa'da, yetişkinler için tipik fraksiyonasyon programı haftada beş gün, günde 1,8 ila 2 Gy'dir. Bazı kanser türlerinde, fraksiyon programının çok uzun süre uzatılması, tümörün yeniden çoğalmaya başlamasına izin verebilir ve baş-boyun ve servikal skuamöz hücre kanserleri dahil olmak üzere bu tümör türleri için, radyasyon tedavisi tercihen belirli bir miktarda tamamlanır. zaman. Çocuklar için, tipik bir fraksiyon boyutu günde 1,5 ila 1,8 Gy olabilir, çünkü daha küçük fraksiyon boyutları, normal dokularda geç başlayan yan etkilerin azalması ve şiddeti ile ilişkilidir.
Bazı durumlarda, bir tedavi sürecinin sonuna doğru günde iki fraksiyon kullanılır. Eşzamanlı destek rejimi veya hiperfraksiyonasyon olarak bilinen bu program, daha küçük olduklarında daha hızlı yenilenen tümörlerde kullanılır. Özellikle baş-boyun bölgesindeki tümörler bu davranışı göstermektedir.
Alan hastalar palyatif radyasyon Komplike olmayan ağrılı kemik metastazını tedavi etmek için tek bir radyasyon fraksiyonundan fazlasını almamalıdır.[47] Tek bir tedavi, çok fraksiyonlu tedavilere benzer ağrı kesici ve morbidite sonuçları sağlar ve sınırlı yaşam beklentisi olan hastalar için, tek bir tedavi, hasta konforunu artırmak için en iyisidir.[47]
- Fraksiyonasyon için programlar
Giderek daha fazla kullanılan ve üzerinde çalışılmaya devam eden bir fraksiyonasyon programı hipofraksiyonasyondur. Bu, toplam radyasyon dozunun büyük dozlara bölündüğü bir radyasyon tedavisidir. Tipik dozlar, kanser türüne göre önemli ölçüde değişir, 2,2 Gy / fraksiyon ila 20 Gy / fraksiyon, ikincisi, subkraniyal lezyonlar için stereotaktik tedavilerin tipik (stereotaktik ablatif vücut radyoterapisi veya SABR - SBRT veya stereotaktik vücut radyoterapisi) veya İntrakraniyal lezyonlar için SRS (stereotaktik radyocerrahi). Hipofraksiyonasyonun mantığı, klonojenik hücrelerin çoğalmaları için ihtiyaç duydukları zamanı inkar ederek ve ayrıca bazı tümörlerin radyosensitivitesinden faydalanarak lokal nüks olasılığını azaltmaktır.[48] Özellikle, stereotaktik tedavilerin bir ablasyon işlemi ile klonojenik hücreleri yok etmesi amaçlanmıştır - yani rutin radyoterapide olduğu gibi tekrar tekrar klonojenik hücre bölünmesi sürecini (apoptoz) kesintiye uğratmak yerine, klonojenik hücreleri doğrudan yok etmeyi amaçlayan bir dozun verilmesi.
Hedef duyarlılığa dayalı doz tahmini
Farklı kanser türlerinin farklı radyasyon duyarlılığı vardır. Bununla birlikte, biyopsi örneklerinin genomik veya proteomik analizlerine dayalı olarak duyarlılığı tahmin etmenin zor olduğu kanıtlanmıştır.[49][50] Genomik ve proteomik için alternatif bir yaklaşım, mikroplarda radyasyondan korunmanın enzimatik olmayan kompleksler tarafından sunulduğunun keşfiyle önerildi. manganez ve küçük organik metabolitler.[51] Manganez içeriği ve varyasyonunun (elektron paramanyetik rezonans ile ölçülebilen) iyi prediktörleri olduğu bulunmuştur. radyosensitivite ve bu bulgu insan hücrelerine de uzanıyor.[52] Toplam hücresel manganez içerikleri ile bunların varyasyonu ve farklı tümör hücrelerinde klinik olarak çıkarılan radyolojik cevaplar arasında bir ilişki teyit edildi, bu daha kesin radyodozajlar ve kanser hastalarının iyileştirilmiş tedavisi için faydalı olabilecek bir bulgu.[53]
Türler
Tarihsel olarak, radyasyon tedavisinin üç ana bölümü şunlardır:
- dış ışın radyasyon tedavisi (EBRT veya XRT) veya teleoterapi;
- brakiterapi veya kapalı kaynaklı radyasyon tedavisi; ve
- sistemik radyoizotop tedavisi veya mühürsüz kaynak radyoterapi.
Farklılıklar, radyasyon kaynağının konumu ile ilgilidir; dış vücut dışındadır, brakiterapi tam olarak tedavi altındaki bölgeye yerleştirilmiş kapalı radyoaktif kaynakları kullanır ve sistemik radyoizotoplar infüzyon veya oral yoldan verilir. Brakiterapi, radyoaktif kaynakların geçici veya kalıcı olarak yerleştirilmesini kullanabilir. Geçici kaynaklar genellikle yükleme sonrası adı verilen bir teknikle yerleştirilir. Sonradan yüklemede içi boş bir tüp veya aplikatör, tedavi edilecek organa cerrahi olarak yerleştirilir ve aplikatör implante edildikten sonra kaynaklar aplikatöre yüklenir. Bu, sağlık personelinin radyasyona maruz kalmasını en aza indirir.
Partikül tedavisi parçacıkların bulunduğu özel bir harici ışın radyasyon terapisidir. protonlar veya daha ağır iyonlar.
Dış ışın radyasyon tedavisi
Aşağıdaki üç bölüm, x-ışınları kullanılarak yapılan tedaviye atıfta bulunmaktadır.
Geleneksel harici ışın radyasyon tedavisi

- bir uluslararası standart kaynak tutucu (genellikle liderlik eder),
- bir tutma halkası ve
- aşağıdakilerden oluşan bir teleterapi "kaynağı"
- iç içe geçmiş iki paslanmaz çelik kutu
- çevreleyen iki paslanmaz çelik kapak
- koruyucu bir iç kalkan (genellikle uranyum metali veya tungsten alaşımı) ve
- radyoaktif kaynak malzemeden bir silindir, genellikle ancak her zaman değil kobalt-60. "Kaynağın" çapı 30 mm'dir.
Tarihsel olarak geleneksel harici ışın radyasyon terapisi (2DXRT), kilovoltaj terapisi x-ışını üniteleri, yüksek enerjili x-ışınları üreten tıbbi doğrusal hızlandırıcılar veya görünüşte doğrusal bir hızlandırıcıya benzer makinelerle iki boyutlu ışınlar aracılığıyla verildi, ancak yukarıda gösterilen gibi kapalı bir radyoaktif kaynak kullandı.[54][55] 2DXRT esas olarak hastaya çeşitli yönlerden verilen tek bir radyasyon ışınından oluşur: genellikle ön veya arka ve her iki taraf.
Konvansiyonel tedavi şeklini ifade eder planlanmış veya simüle Doğrusal hızlandırıcı eylemlerini (veya bazen gözle) yeniden oluşturduğu için simülatör olarak bilinen özel olarak kalibre edilmiş tanısal bir röntgen makinesinde ve istenen bir sonuca ulaşmak için radyasyon ışınlarının genellikle iyi yapılandırılmış düzenlemelerine plan. Simülasyonun amacı, tedavi edilecek hacmi doğru bir şekilde hedeflemek veya lokalize etmektir. Bu teknik iyi oluşturulmuştur ve genellikle hızlı ve güvenilirdir. The worry is that some high-dose treatments may be limited by the radiation toxicity capacity of healthy tissues which lie close to the target tumor volume.
An example of this problem is seen in radiation of the prostate gland, where the sensitivity of the adjacent rectum limited the dose which could be safely prescribed using 2DXRT planning to such an extent that tumor control may not be easily achievable. Prior to the invention of the CT, physicians and physicists had limited knowledge about the true radiation dosage delivered to both cancerous and healthy tissue. For this reason, 3-dimensional conformal radiation therapy has become the standard treatment for almost all tumor sites. More recently other forms of imaging are used including MRI, PET, SPECT and Ultrasound.[56]
Stereotactic radiation
Stereotactic radiation is a specialized type of external beam radiation therapy. It uses focused radiation beams targeting a well-defined tumor using extremely detailed imaging scans. Radiation oncologists perform stereotactic treatments, often with the help of a neurosurgeon for tumors in the brain or spine.
There are two types of stereotactic radiation. Stereotaktik radyocerrahi (SRS) is when doctors use a single or several stereotactic radiation treatments of the brain or spine. Stereotactic body radiation therapy (SBRT) refers to one or several stereotactic radiation treatments with the body, such as the lungs.[57]
Some doctors say an advantage to stereotactic treatments is that they deliver the right amount of radiation to the cancer in a shorter amount of time than traditional treatments, which can often take 6 to 11 weeks. Plus treatments are given with extreme accuracy, which should limit the effect of the radiation on healthy tissues. One problem with stereotactic treatments is that they are only suitable for certain small tumors.
Stereotactic treatments can be confusing because many hospitals call the treatments by the name of the manufacturer rather than calling it SRS or SBRT. Brand names for these treatments include Axesse, Cyberknife, Gama Bıçağı, Novalis, Primatom, Synergy, X-Knife, TomoTherapy, Trilogy and Truebeam.[58] This list changes as equipment manufacturers continue to develop new, specialized technologies to treat cancers.
Virtual simulation, and 3-dimensional conformal radiation therapy
The planning of radiation therapy treatment has been revolutionized by the ability to delineate tumors and adjacent normal structures in three dimensions using specialized CT and/or MRI scanners and planning software.[59]
Virtual simulation, the most basic form of planning, allows more accurate placement of radiation beams than is possible using conventional X-rays, where soft-tissue structures are often difficult to assess and normal tissues difficult to protect.
An enhancement of virtual simulation is 3-dimensional conformal radiation therapy (3DCRT), in which the profile of each radiation beam is shaped to fit the profile of the target from a beam's eye view (BEV) using a multileaf collimator (MLC) and a variable number of beams. When the treatment volume conforms to the shape of the tumor, the relative toxicity of radiation to the surrounding normal tissues is reduced, allowing a higher dose of radiation to be delivered to the tumor than conventional techniques would allow.[5]
Intensity-modulated radiation therapy (IMRT)

Intensity-modulated radiation therapy (IMRT) is an advanced type of high-precision radiation that is the next generation of 3DCRT.[60] IMRT also improves the ability to conform the treatment volume to concave tumor shapes,[5] for example when the tumor is wrapped around a vulnerable structure such as the spinal cord or a major organ or blood vessel.[61] Computer-controlled x-ray accelerators distribute precise radiation doses to malignant tumors or specific areas within the tumor. The pattern of radiation delivery is determined using highly tailored computing applications to perform optimizasyon and treatment simulation (Treatment Planning ). The radiation dose is consistent with the 3-D shape of the tumor by controlling, or modulating, the radiation beam's intensity. The radiation dose intensity is elevated near the gross tumor volume while radiation among the neighboring normal tissues is decreased or avoided completely. This results in better tumor targeting, lessened side effects, and improved treatment outcomes than even 3DCRT.
3DCRT is still used extensively for many body sites but the use of IMRT is growing in more complicated body sites such as CNS, head and neck, prostate, breast, and lung. Unfortunately, IMRT is limited by its need for additional time from experienced medical personnel. This is because physicians must manually delineate the tumors one CT image at a time through the entire disease site which can take much longer than 3DCRT preparation. Then, medical physicists and dosimetrists must be engaged to create a viable treatment plan. Also, the IMRT technology has only been used commercially since the late 1990s even at the most advanced cancer centers, so radiation oncologists who did not learn it as part of their residency programs must find additional sources of education before implementing IMRT.
Proof of improved survival benefit from either of these two techniques over conventional radiation therapy (2DXRT) is growing for many tumor sites, but the ability to reduce toxicity is generally accepted. This is particularly the case for head and neck cancers in a series of pivotal trials performed by Professor Christopher Nutting of the Royal Marsden Hospital. Both techniques enable dose escalation, potentially increasing usefulness. There has been some concern, particularly with IMRT,[62] about increased exposure of normal tissue to radiation and the consequent potential for secondary malignancy. Overconfidence in the accuracy of imaging may increase the chance of missing lesions that are invisible on the planning scans (and therefore not included in the treatment plan) or that move between or during a treatment (for example, due to respiration or inadequate patient immobilization). New techniques are being developed to better control this uncertainty—for example, real-time imaging combined with real-time adjustment of the therapeutic beams. This new technology is called image-guided radiation therapy (IGRT) or four-dimensional radiation therapy.
Another technique is the real-time tracking and localization of one or more small implantable electric devices implanted inside or close to the tumor. There are various types of medical implantable devices that are used for this purpose. It can be a magnetic transponder which senses the magnetic field generated by several transmitting coils, and then transmits the measurements back to the positioning system to determine the location.[63] The implantable device can also be a small wireless transmitter sending out an RF signal which then will be received by a sensor array and used for localization and real-time tracking of the tumor position.[64][65]
A well-studied issue with IMRT is the "tongue and groove effect" which results in unwanted underdosing, due to irradiating through extended tongues and grooves of overlapping MLC (multileaf collimator) leaves.[66] While solutions to this issue have been developed, which either reduce the TG effect to negligible amounts or remove it completely, they depend upon the method of IMRT being used and some of them carry costs of their own.[66] Some texts distinguish "tongue and groove error" from "tongue or groove error", according as both or one side of the aperture is occluded.[67]
Volumetric modulated arc therapy (VMAT)
Volumetric modulated arc therapy (VMAT) is a radiation technique introduced in 2007[68] which can achieve highly conformal dose distributions on target volume coverage and sparing of normal tissues. The specificity of this technique is to modify three parameters during the treatment. VMAT delivers radiation by rotating gantry (usually 360° rotating fields with one or more arcs), changing speed and shape of the beam with a multileaf collimator (MLC) ("sliding window" system of moving) and fluence output rate (dose rate) of the medical linear accelerator. VMAT has an advantage in patient treatment, compared with conventional static field intensity modulated radiotherapy (IMRT), of reduced radiation delivery times.[69][70] Comparisons between VMAT and conventional IMRT for their sparing of healthy tissues and Organs at Risk (OAR) depends upon the cancer type. Tedavisinde nazofarengeal, orofaringeal ve hypopharyngeal carcinomas VMAT provides equivalent or better OAR protection.[68][69][70] Tedavisinde prostat kanseri the OAR protection result is mixed[68] with some studies favoring VMAT, others favoring IMRT.[71]
Otomatik planlama
Automated treatment planning has become an integrated part of radiotherapy treatment planning. There are in general two approaches of automated planning. 1) Knowledge based planning where the treatment planning system has a library of high quality plans, from which it can predict the target and OAR DVH.[72] 2) The other approach is commonly called protocol based planning, where the treatment planning system tried to mimic an experienced treatment planner and through an iterative process evaluates the plan quality from on the basis of the protocol.[73][74][75][76]
Partikül tedavisi
In particle therapy (proton tedavisi being one example), energetic ionizing particles (protons or carbon ions) are directed at the target tumor.[77] The dose increases while the particle penetrates the tissue, up to a maximum (the Bragg zirvesi ) that occurs near the end of the particle's Aralık, and it then drops to (almost) zero. The advantage of this energy deposition profile is that less energy is deposited into the healthy tissue surrounding the target tissue.
Auger tedavisi
Auger tedavisi (AT) makes use of a very high dose[78] of ionizing radiation in situ that provides molecular modifications at an atomic scale. AT differs from conventional radiation therapy in several aspects; it neither relies upon radioactive nuclei to cause cellular radiation damage at a cellular dimension, nor engages multiple external pencil-beams from different directions to zero-in to deliver a dose to the targeted area with reduced dose outside the targeted tissue/organ locations. Instead, the in situ delivery of a very high dose at the molecular level using AT aims for in situ molecular modifications involving molecular breakages and molecular re-arrangements such as a change of stacking structures as well as cellular metabolic functions related to the said molecule structures.
Contact x-ray brachytherapy
Contact x-ray brachytherapy (also called "CXB", "electronic brachytherapy" or the "Papillon Technique") is a type of radiation therapy using kilovoltage X ışınları applied close to the tumour to treat rektal kanser. The process involves inserting the röntgen tüpü içinden anüs into the rectum and placing it against the cancerous tissue, then high doses of X-rays are emitted directly into the tümör at two weekly intervals. It is typically used for treating early rectal cancer in patients who may not be candidates for surgery.[79][80][81] A 2015 NICE review found the main side effect to be bleeding that occurred in about 38% of cases, and radiation-induced ulcer which occurred in 27% of cases.[79]
Brachytherapy (sealed source radiotherapy)

Brachytherapy is delivered by placing radiation source(s) inside or next to the area requiring treatment. Brachytherapy is commonly used as an effective treatment for cervical,[82] prostat,[83] meme,[84] and skin cancer[85] and can also be used to treat tumours in many other body sites.[86]
In brachytherapy, radiation sources are precisely placed directly at the site of the cancerous tumour. This means that the irradiation only affects a very localized area – exposure to radiation of healthy tissues further away from the sources is reduced. These characteristics of brachytherapy provide advantages over external beam radiation therapy – the tumour can be treated with very high doses of localized radiation, whilst reducing the probability of unnecessary damage to surrounding healthy tissues.[86][87] A course of brachytherapy can often be completed in less time than other radiation therapy techniques. This can help reduce the chance of surviving cancer cells dividing and growing in the intervals between each radiation therapy dose.[87]
As one example of the localized nature of breast brachytherapy, the SAVI device delivers the radiation dose through multiple catheters, each of which can be individually controlled. This approach decreases the exposure of healthy tissue and resulting side effects, compared both to external beam radiation therapy and older methods of breast brachytherapy.[88]
Unsealed source radiotherapy (systemic radioisotope therapy)
Systemic radioisotope therapy (RIT) is a form of targeted therapy. Targeting can be due to the chemical properties of the isotope such as radioiodine which is specifically absorbed by the thyroid gland a thousandfold better than other bodily organs. Targeting can also be achieved by attaching the radioisotope to another molecule or antibody to guide it to the target tissue. The radioisotopes are delivered through infüzyon (into the bloodstream) or ingestion. Examples are the infusion of Metaiodobenzylguanidine (MIBG) to treat nöroblastom, of oral iyot-131 tedavi etmek tiroid kanseri veya tirotoksikoz, and of hormone-bound lutesyum-177 ve itriyum-90 tedavi etmek nöroendokrin tümörler (peptid reseptör radyonüklid tedavisi ).
Another example is the injection of radioactive yttrium-90 or holmium-166 microspheres into the Hepatik arter to radioembolize liver tumors or liver metastases. These microspheres are used for the treatment approach known as selective internal radiation therapy. The microspheres are approximately 30µm in diameter (about one-third of a human hair) and are delivered directly into the artery supplying blood to the tumors. These treatments begin by guiding a kateter up through the femoral artery in the leg, navigating to the desired target site and administering treatment. The blood feeding the tumor will carry the microspheres directly to the tumor enabling a more selective approach than traditional systemic chemotherapy. There are currently three different kinds of microspheres: SIR-Küreler, TheraSphere and QuiremSpheres.
A major use of systemic radioisotope therapy is in the treatment of bone metastasis kanserden. The radioisotopes travel selectively to areas of damaged bone, and spare normal undamaged bone. Isotopes commonly used in the treatment of bone metastasis are radium-223,[89] strontium-89 ve samarium (153Sm) lexidronam.[90]
2002 yılında Amerika Birleşik Devletleri Gıda ve İlaç Dairesi (FDA) onaylandı ibritumomab tiuxetan (Zevalin), which is an anti-CD20 monoklonal antikor conjugated to yttrium-90.[91]In 2003, the FDA approved the tositumomab /iodine (131I) tositumomab regimen (Bexxar), which is a combination of an iodine-131 labelled and an unlabelled anti-CD20 monoclonal antibody.[92]These medications were the first agents of what is known as radioimmunotherapy, and they were approved for the treatment of refractory non-Hodgkin lenfoma.
Intraoperative radiotherapy
İntraoperatif radyasyon tedavisi (IORT) is applying therapeutic levels of radiation to a target area, such as a kanser tumor, while the area is exposed during ameliyat.[93]
Gerekçe
The rationale for IORT is to deliver a high dose of radiation precisely to the targeted area with minimal exposure of surrounding tissues which are displaced or shielded during the IORT. Conventional radiation techniques such as external beam radiotherapy (EBRT) following surgical removal of the tumor have several drawbacks: The tumor bed where the highest dose should be applied is frequently missed due to the complex localization of the wound cavity even when modern radiotherapy planning is used. Additionally, the usual delay between the surgical removal of the tumor and EBRT may allow a repopulation of the tumor cells. These potentially harmful effects can be avoided by delivering the radiation more precisely to the targeted tissues leading to immediate sterilization of residual tumor cells. Another aspect is that wound fluid has a stimulating effect on tumor cells. IORT was found to inhibit the stimulating effects of wound fluid.[94]
Deep inspiration breath-hold
Deep inspiration breath-hold (DIBH) is a method of delivering radiotherapy while limiting radiation exposure to the heart and lungs.[95] It is used primarily for treating left-sided breast cancer. The technique involves a patient holding their breath during treatment. There are two basic methods of performing DIBH: free-breathing breath-hold and spirometry-monitored deep inspiration breath hold.[96]
Tarih

Medicine has used radiation therapy as a treatment for cancer for more than 100 years, with its earliest roots traced from the discovery of X-rays in 1895 by Wilhelm Röntgen.[97] Emil Grubbe of Chicago was possibly the first American physician to use X-rays to treat cancer, beginning in 1896.[98]
The field of radiation therapy began to grow in the early 1900s largely due to the groundbreaking work of Nobel Ödülü –winning scientist Marie Curie (1867–1934), who discovered the radioactive elements polonyum ve radyum in 1898. This began a new era in medical treatment and research.[97] Through the 1920s the hazards of radiation exposure were not understood, and little protection was used. Radium was believed to have wide curative powers and radiotherapy was applied to many diseases.
Prior to World War 2, the only practical sources of radiation for radiotherapy were radyum, its "emanation", radon gas, and the X ışını tüpü. Dış ışın radyoterapisi (teletherapy) began at the turn of the century with relatively low voltage (<150 kV) X-ray machines. It was found that while superficial tumors could be treated with low voltage X-rays, more penetrating, higher energy beams were required to reach tumors inside the body, requiring higher voltages. Orthovoltage X-ışınları, which used tube voltages of 200-500 kV, began to be used during the 1920s. To reach the most deeply buried tumors without exposing intervening skin and tissue to dangerous radiation doses required rays with energies of 1 MV or above, called "megavolt" radiation. Producing megavolt X-rays required voltajlar on the X-ray tube of 3 to 5 million volt, which required huge expensive installations. Megavoltage X-ray units were first built in the late 1930s but because of cost were limited to a few institutions. One of the first, installed at St. Bartholomew hastanesi, London in 1937 and used until 1960, used a 30 foot long X-ray tube and weighed 10 tons. Radium produced megavolt Gama ışınları, but was extremely rare and expensive due to its low occurrence in ores. In 1937 the entire world supply of radium for radiotherapy was 50 grams, valued at £800,000, or $50 million in 2005 dollars.
İcadı nükleer reaktör içinde Manhattan Projesi during World War 2 made possible the production of artificial radyoizotoplar for radiotherapy. Kobalt tedavisi, teleterapi machines using megavolt gamma rays emitted by kobalt-60, a radioisotope produced by irradiating ordinary cobalt metal in a reactor, revolutionized the field between the 1950s and the early 1980s. Cobalt machines were relatively cheap, robust and simple to use, although due to its 5.27 year yarı ömür the cobalt had to be replaced about every 5 years.
Tıbbi doğrusal parçacık hızlandırıcılar, developed since the 1940s, began replacing X-ray and cobalt units in the 1980s and these older therapies are now declining. The first medical linear accelerator was used at the Hammersmith Hastanesi 1953'te Londra'da.[55] Linear accelerators can produce higher energies, have more collimated beams, and do not produce radioactive waste with its attendant disposal problems like radioisotope therapies.
İle Godfrey Hounsfield ’s invention of bilgisayarlı tomografi (CT) in 1971, three-dimensional planning became a possibility and created a shift from 2-D to 3-D radiation delivery. CT-based planning allows physicians to more accurately determine the dose distribution using axial tomographic images of the patient's anatomy. The advent of new imaging technologies, including manyetik rezonans görüntüleme (MRI) in the 1970s and Pozitron emisyon tomografi (PET) in the 1980s, has moved radiation therapy from 3-D conformal to intensity-modulated radiation therapy (IMRT) and to image-guided radiation therapy (IGRT) tomoterapi. These advances allowed radiation oncologists to better see and target tumors, which have resulted in better treatment outcomes, more organ preservation and fewer side effects.[99]
While access to radiotherapy is improving globally, more than half of patients in low and middle income countries still do not have available access to the therapy as of 2017.[100]
Ayrıca bakınız
Referanslar
- ^ CK Bomford, IH Kunkler, J Walter. Walter and Miller’s Textbook of Radiation therapy (6th Ed), p311
- ^ "Radiosensitivity" on GP notebook http://www.gpnotebook.co.uk/simplepage.cfm?ID=2060451853
- ^ "Radiation therapy- what GPs need to know" on patient.co.uk http://patient.info/doctor/radiotherapy
- ^ Maverakis E, Cornelius LA, Bowen GM, Phan T, Patel FB, Fitzmaurice S, ve diğerleri. (Mayıs 2015). "Metastatik melanom - mevcut ve gelecekteki tedavi seçeneklerinin gözden geçirilmesi". Açta Dermato-Venereologica. 95 (5): 516–24. doi:10.2340/00015555-2035. PMID 25520039.
- ^ a b c Camphausen KA, Lawrence RC. "Principles of Radiation Therapy" Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (Eds) içinde Kanser Yönetimi: Multidisipliner Bir Yaklaşım. 11 ed. 2008.
- ^ Falls KC, Sharma RA, Lawrence YR, Amos RA, Advani SJ, Ahmed MM, Vikram B, Coleman CN, Prasanna PG (September 2018). "Radiation-Drug Combinations to Improve Clinical Outcomes and Reduce Normal Tissue Toxicities: Current Challenges and New Approaches: Report of the Symposium Held at the 63rd Annual Meeting of the Radiation Research Society, 15-18 October 2017; Cancun, Mexico". 190 (4). Avrupa PMC. doi:10.1667/rr15121.1. PMID 30280985. Alındı 10 Mayıs 2020. Alıntı dergisi gerektirir
| günlük =(Yardım) - ^ Seidlitz A, Combs SE, Debus J, Baumann M (2016). "Practice points for radiation oncology". In Kerr DJ, Haller DG, van de Velde CJ, Baumann M (eds.). Oxford Textbook of Oncology. Oxford University Press. s. 173. ISBN 9780191065101.
- ^ Darby S, McGale P, Correa C, Taylor C, Arriagada R, Clarke M, et al. (Kasım 2011). "Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10,801 women in 17 randomised trials". Lancet. 378 (9804): 1707–16. doi:10.1016/S0140-6736(11)61629-2. PMC 3254252. PMID 22019144.
- ^ Mahmood SS, Nohria A (July 2016). "Cardiovascular Complications of Cranial and Neck Radiation". Current Treatment Options in Cardiovascular Medicine. 18 (7): 45. doi:10.1007/s11936-016-0468-4. PMID 27181400.
- ^ "Radiation Therapy for Breast Cancer: Possible Side Effects". Rtanswers.com. 2012-03-15. Arşivlenen orijinal 2012-03-01 tarihinde. Alındı 2012-04-20.
- ^ Lee VH, Ng SC, Leung TW, Au GK, Kwong DL (September 2012). "Dosimetric predictors of radiation-induced acute nausea and vomiting in IMRT for nasopharyngeal cancer". Uluslararası Radyasyon Onkolojisi Dergisi, Biyoloji, Fizik. 84 (1): 176–82. doi:10.1016/j.ijrobp.2011.10.010. PMID 22245210.
- ^ "Arşivlenmiş kopya". Arşivlenen orijinal 2012-03-30 tarihinde. Alındı 2012-05-02.CS1 Maint: başlık olarak arşivlenmiş kopya (bağlantı) Common radiation side effects
- ^ "Radiation Therapy Side Effects and Ways to Manage them". Ulusal Kanser Enstitüsü. 2007-04-20. Alındı 2012-05-02.
- ^ Hall, Eric J. (2000). Radiobiology for the radiologist. Philadelphia: Lippincott Williams Wilkins. s. 351. ISBN 9780781726498.
- ^ Carretero C, Munoz-Navas M, Betes M, Angos R, Subtil JC, Fernandez-Urien I, et al. (Haziran 2007). "Gastroduodenal injury after radioembolization of hepatic tumors" (PDF). Amerikan Gastroenteroloji Dergisi. 102 (6): 1216–20. hdl:10171/27487. PMID 17355414.
- ^ Yip D, Allen R, Ashton C, Jain S (March 2004). "Radiation-induced ulceration of the stomach secondary to hepatic embolization with radioactive yttrium microspheres in the treatment of metastatic colon cancer". Gastroenteroloji ve Hepatoloji Dergisi. 19 (3): 347–9. doi:10.1111/j.1440-1746.2003.03322.x. PMID 14748889.
- ^ Murthy R, Brown DB, Salem R, Meranze SG, Coldwell DM, Krishnan S, et al. (Nisan 2007). "Gastrointestinal complications associated with hepatic arterial Yttrium-90 microsphere therapy". Vasküler ve Girişimsel Radyoloji Dergisi. 18 (4): 553–61, quiz 562. doi:10.1016/j.jvir.2007.02.002. PMID 17446547.
- ^ Arepally A, Chomas J, Kraitchman D, Hong K (April 2013). "Quantification and reduction of reflux during embolotherapy using an antireflux catheter and tantalum microspheres: ex vivo analysis". Vasküler ve Girişimsel Radyoloji Dergisi. 24 (4): 575–80. doi:10.1016/j.jvir.2012.12.018. PMID 23462064.
- ^ a b Henson, Caroline C; Burden, Sorrel; Davidson, Susan E; Lal, Simon (2013-11-26). "Nutritional interventions for reducing gastrointestinal toxicity in adults undergoing radical pelvic radiotherapy". Sistematik İncelemelerin Cochrane Veritabanı (11): CD009896. doi:10.1002/14651858.cd009896.pub2. ISSN 1465-1858. PMID 24282062.
- ^ Meek AG (December 1998). "Breast radiotherapy and lymphedema". Kanser. 83 (12 Suppl American): 2788–97. doi:10.1002/(SICI)1097-0142(19981215)83:12B+<2788::AID-CNCR27>3.0.CO;2-I. PMID 9874399.
- ^ Kamran SC, Berrington de Gonzalez A, Ng A, Haas-Kogan D, Viswanathan AN (June 2016). "Therapeutic radiation and the potential risk of second malignancies". Kanser. 122 (12): 1809–21. doi:10.1002/cncr.29841. PMID 26950597.
- ^ Dracham CB, Shankar A, Madan R (June 2018). "Radiation induced secondary malignancies: a review article". Radiation Oncology Journal. 36 (2): 85–94. doi:10.3857/roj.2018.00290. PMC 6074073. PMID 29983028.
At present after surviving from a primary malignancy, 17%–19% patients develop second malignancy. ... [Radiotherapy] contributes to only about 5% of the total treatment related second malignancies. However the incidence of only radiation on second malignancies is difficult to estimate...
- ^ Mohamad O, Tabuchi T, Nitta Y, Nomoto A, Sato A, Kasuya G, et al. (Mayıs 2019). "Risk of subsequent primary cancers after carbon ion radiotherapy, photon radiotherapy, or surgery for localised prostate cancer: a propensity score-weighted, retrospective, cohort study". Neşter. Onkoloji. 20 (5): 674–685. doi:10.1016/S1470-2045(18)30931-8. PMID 30885458.
- ^ Facoetti A, Barcellini A, Valvo F, Pullia M (September 2019). "The Role of Particle Therapy in the Risk of Radio-induced Second Tumors: A Review of the Literature". Antikanser Araştırması. 39 (9): 4613–4617. doi:10.21873/anticanres.13641. PMID 31519558.
- ^ Ohno T, Okamoto M (June 2019). "Carbon ion radiotherapy as a treatment modality for paediatric cancers". Lancet Çocuk ve Ergen Sağlığı. 3 (6): 371–372. doi:10.1016/S2352-4642(19)30106-3. PMID 30948250.
- ^ Taylor CW, Nisbet A, McGale P, Darby SC (Aralık 2007). "Cardiac exposures in breast cancer radiotherapy: 1950s-1990s". Uluslararası Radyasyon Onkolojisi Dergisi, Biyoloji, Fizik. 69 (5): 1484–95. doi:10.1016/j.ijrobp.2007.05.034. PMID 18035211.
- ^ a b Weintraub NL, Jones WK, Manka D (March 2010). "Understanding radiation-induced vascular disease". Amerikan Kardiyoloji Koleji Dergisi. 55 (12): 1237–9. doi:10.1016/j.jacc.2009.11.053. PMC 3807611. PMID 20298931.
- ^ a b Klee NS, McCarthy CG, Martinez-Quinones P, Webb RC (November 2017). "Out of the frying pan and into the fire: damage-associated molecular patterns and cardiovascular toxicity following cancer therapy". Therapeutic Advances in Cardiovascular Disease. 11 (11): 297–317. doi:10.1177/1753944717729141. PMC 5933669. PMID 28911261.
- ^ "Late Effects of Treatment for Childhood Cancer". Ulusal Kanser Enstitüsü. 12 Nisan 2012. Alındı 7 Haziran 2012.
- ^ Hauer-Jensen M, Denham JW, Andreyev HJ (August 2014). "Radiation enteropathy--pathogenesis, treatment and prevention". Doğa Yorumları. Gastroenteroloji ve Hepatoloji. 11 (8): 470–9. doi:10.1038/nrgastro.2014.46. PMC 4346191. PMID 24686268.
- ^ Fuccio L, Guido A, Andreyev HJ (December 2012). "Management of intestinal complications in patients with pelvic radiation disease". Klinik Gastroenteroloji ve Hepatoloji. 10 (12): 1326–1334.e4. doi:10.1016/j.cgh.2012.07.017. PMID 22858731.
- ^ a b Christian Custodio; Cody Christian Andrews (August 1, 2017). "Radiation Plexopathy". American Academy of Physical Medicine and Rehabilitation.

- ^ a b c d e Delanian S, Lefaix JL, Pradat PF (December 2012). "Radiation-induced neuropathy in cancer survivors". Radyoterapi ve Onkoloji. 105 (3): 273–82. doi:10.1016/j.radonc.2012.10.012. PMID 23245644.
- ^ a b "Radiation Necrosis: Background, Pathophysiology, Epidemiology". 2019-11-09.
- ^ Nieder C, Milas L, Ang KK (July 2000). "Tissue tolerance to reirradiation". Radyasyon Onkolojisi Seminerleri. 10 (3): 200–9. doi:10.1053/srao.2000.6593. PMID 11034631.
- ^ a b c d Arnon J, Meirow D, Lewis-Roness H, Ornoy A (2001). "Genetic and teratogenic effects of cancer treatments on gametes and embryos". İnsan Üreme Güncellemesi. 7 (4): 394–403. doi:10.1093/humupd/7.4.394. PMID 11476352. [1]
- ^ a b c d Fernandez A, Brada M, Zabuliene L, Karavitaki N, Wass JA (September 2009). "Radiation-induced hypopituitarism" (PDF). Endokrinle İlgili Kanser. 16 (3): 733–72. doi:10.1677/ERC-08-0231. PMID 19498038.
- ^ Bogdanich W, Ruiz RR (25 February 2010). "Missouri Hospital Reports Errors in Radiation Doses". New York Times. Alındı 26 Şubat 2010.
- ^ "What Questions Should I Ask My Doctor?: Questions to ask after treatment ends". Rtanswers.com. 2010-09-22. Arşivlenen orijinal 2012-04-12 tarihinde. Alındı 2012-04-20.
- ^ Eaton C, Seegenschmiedt MH, Bayat A, Gabbiani G, Werker P, Wach W (2012). Dupuytren's Disease and Related Hyperproliferative Disorders: Principles, Research, and Clinical Perspectives. Springer. s. 355–364. ISBN 978-3-642-22696-0.
- ^ Harrison LB, Chadha M, Hill RJ, Hu K, Shasha D (2002). "Impact of tumor hypoxia and anemia on radiation therapy outcomes". Onkolog. 7 (6): 492–508. doi:10.1634/theoncologist.7-6-492. PMID 12490737.
- ^ Sheehan JP, Shaffrey ME, Gupta B, Larner J, Rich JN, Park DM (October 2010). "Improving the radiosensitivity of radioresistant and hypoxic glioblastoma". Geleceğin Onkolojisi. 6 (10): 1591–601. doi:10.2217/fon.10.123. PMID 21062158.
- ^ Curtis RE, Freedman DM, Ron E, Ries LAG, Hacker DG, Edwards BK, Tucker MA, Fraumeni JF Jr. (eds). New Malignancies Among Cancer Survivors: SEER Cancer Registries, 1973–2000. Ulusal Kanser Enstitüsü. NIH Publ. No. 05-5302. Bethesda, MD, 2006.
- ^ http://www.helmholtz-muenchen.de/fileadmin/ISS/PDF/Risikoanalyse/Georgetown/Robison.pdf
- ^ Baldock C, De Deene Y, Doran S, Ibbott G, Jirasek A, Lepage M, et al. (Mart 2010). "Polymer gel dosimetry". Tıp ve Biyolojide Fizik. 55 (5): R1-63. Bibcode:2010PMB....55R...1B. doi:10.1088/0031-9155/55/5/r01. PMC 3031873. PMID 20150687.
- ^ Ang, K. Kian (October 1998). "Altered fractionation trials in head and neck cancer". Radyasyon Onkolojisi Seminerleri. 8 (4): 230–236. doi:10.1016/S1053-4296(98)80020-9. PMID 9873100.
- ^ a b Amerikan Darülaceze ve Palyatif Tıp Akademisi, "Hekimlerin ve Hastaların Sorgulaması Gereken Beş Şey", Akıllıca Seçmek: bir girişimi ABIM Vakfı, Amerikan Darülaceze ve Palyatif Tıp Akademisi, alındı 1 Ağustos, 2013, hangi alıntı
- Lutz S, Berk L, Chang E, Chow E, Hahn C, Hoskin P, et al. (Mart 2011). "Palliative radiotherapy for bone metastases: an ASTRO evidence-based guideline". Uluslararası Radyasyon Onkolojisi Dergisi, Biyoloji, Fizik. 79 (4): 965–76. doi:10.1016/j.ijrobp.2010.11.026. PMID 21277118.
- ^ [Pollack, Alan, and Mansoor Ahmed . Hypofractionation: Scientific Concepts and Clinical Experiences. 1 inci. Ellicot City: LimiText Publishing, 2011]
- ^ Scott JG, Berglund A, Schell MJ, Mihaylov I, Fulp WJ, Yue B, et al. (Şubat 2017). "A genome-based model for adjusting radiotherapy dose (GARD): a retrospective, cohort-based study". Neşter. Onkoloji. 18 (2): 202–211. doi:10.1016/S1470-2045(16)30648-9. PMID 27993569.
- ^ Lacombe J, Azria D, Mange A, Solassol J (February 2013). "Proteomic approaches to identify biomarkers predictive of radiotherapy outcomes". Proteomiklerin Uzman Değerlendirmesi. 10 (1): 33–42. doi:10.1586/epr.12.68. PMID 23414358.
- ^ Daly MJ (March 2009). "A new perspective on radiation resistance based on Deinococcus radiodurans". Doğa Yorumları. Mikrobiyoloji. 7 (3): 237–45. doi:10.1038/nrmicro2073. PMID 19172147.
- ^ Sharma A, Gaidamakova EK, Grichenko O, Matrosova VY, Hoeke V, Klimenkova P, et al. (Ekim 2017). "2+, gauged by paramagnetic resonance". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 114 (44): E9253–E9260. doi:10.1073/pnas.1713608114. PMC 5676931. PMID 29042516.
- ^ Doble PA, Miklos GL (September 2018). "Distributions of manganese in diverse human cancers provide insights into tumour radioresistance". Metalomik. 10 (9): 1191–1210. doi:10.1039/c8mt00110c. PMID 30027971.
- ^ Hill R, Healy B, Holloway L, Kuncic Z, Thwaites D, Baldock C (Mart 2014). "Kilovoltaj x-ışını ışın dozimetrisindeki gelişmeler". Tıp ve Biyolojide Fizik. 59 (6): R183-231. Bibcode:2014PMB .... 59R.183H. doi:10.1088/0031-9155/59/6/R183. PMID 24584183.
- ^ a b Thwaites DI, Tuohy JB (July 2006). "Back to the future: the history and development of the clinical linear accelerator". Tıp ve Biyolojide Fizik. 51 (13): R343-62. Bibcode:2006PMB....51R.343T. doi:10.1088/0031-9155/51/13/R20. PMID 16790912.
- ^ Lagendijk JJ, Raaymakers BW, Van den Berg CA, Moerland MA, Philippens ME, van Vulpen M (November 2014). "MR guidance in radiotherapy". Tıp ve Biyolojide Fizik. 59 (21): R349-69. Bibcode:2014PMB....59R.349L. doi:10.1088/0031-9155/59/21/R349. PMID 25322150.
- ^ "American Society for Radiation Oncology" (PDF). Astro.org. Arşivlenen orijinal (PDF) 2010-06-13 tarihinde. Alındı 2012-04-20.
- ^ "Treatment Types: Stereotactic Radiation Therapy". Rtanswers.com. 2010-01-04. Arşivlenen orijinal 2012-05-09 tarihinde. Alındı 2012-04-20.
- ^ Bucci MK, Bevan A, Roach M (2005). "Advances in radiation therapy: conventional to 3D, to IMRT, to 4D, and beyond". CA. 55 (2): 117–34. doi:10.3322/canjclin.55.2.117. PMID 15761080.
- ^ Galvin JM, Ezzell G, Eisbrauch A, Yu C, Butler B, Xiao Y, et al. (Nisan 2004). "Implementing IMRT in clinical practice: a joint document of the American Society for Therapeutic Radiology and Oncology and the American Association of Physicists in Medicine". Uluslararası Radyasyon Onkolojisi Dergisi, Biyoloji, Fizik. 58 (5): 1616–34. doi:10.1016/j.ijrobp.2003.12.008. PMID 15050343.
- ^ "Intensity Modulated Radiation Therapy". Irsa.org. Alındı 2012-04-20.
- ^ Hall EJ, Wuu CS (May 2003). "Radiation-induced second cancers: the impact of 3D-CRT and IMRT". Uluslararası Radyasyon Onkolojisi Dergisi, Biyoloji, Fizik. 56 (1): 83–8. doi:10.1016/S0360-3016(03)00073-7. PMID 12694826.
- ^ Maleki T, Papiez L, Ziaie B (August 2010). "Magnetic tracking system for radiation therapy". Biyomedikal Devreler ve Sistemlerde IEEE İşlemleri. 4 (4): 223–31. doi:10.1109/TBCAS.2010.2046737. PMID 23853368.
- ^ M. Pourhomayoun; M. L. Fowler; Z. Jin. "A Novel Method for Tumor Localization and Tracking in Radiation Therapy". IEEE Asilomar Conference on Signals, Systems and Computers, 2012.
- ^ M. Pourhomayoun; M. L. Fowler; Z. Jin. "Robustness Analysis of Sparsity Based Tumor Localization under Tissue Configuration Uncertainty". IEEE Signal Processing in Medicine and Biology Symposium (SPMB12), 2012.
- ^ a b S. Webb (1 October 2004). Contemporary IMRT: Developing Physics and Clinical Implementation. CRC Basın. sayfa 77–80. ISBN 978-1-4200-3453-0.
- ^ Mikhail J. Atallah; Marina Blanton (20 November 2009). Algorithms and Theory of Computation Handbook, Volume 2: Special Topics and Techniques. CRC Basın. s. 7. ISBN 978-1-58488-821-5.
- ^ a b c Teoh M, Clark CH, Wood K, Whitaker S, Nisbet A (November 2011). "Volumetric modulated arc therapy: a review of current literature and clinical use in practice". The British Journal of Radiology. 84 (1007): 967–96. doi:10.1259/bjr/22373346. PMC 3473700. PMID 22011829.
- ^ a b Bertelsen A, Hansen CR, Johansen J, Brink C (May 2010). "Single Arc Volumetric Modulated Arc Therapy of head and neck cancer". Radyoterapi ve Onkoloji. 95 (2): 142–8. doi:10.1016/j.radonc.2010.01.011. PMID 20188427.
- ^ a b Van Gestel D, van Vliet-Vroegindeweij C, Van den Heuvel F, Crijns W, Coelmont A, De Ost B, et al. (Şubat 2013). "RapidArc, SmartArc and TomoHD compared with classical step and shoot and sliding window intensity modulated radiotherapy in an oropharyngeal cancer treatment plan comparison". Radyasyon Onkolojisi. 8 (37): 37. doi:10.1186/1748-717X-8-37. PMC 3599972. PMID 23425449.
- ^ Biegała M, Hydzik A (2016). "Analysis of dose distribution in organs at risk in patients with prostate cancer treated with the intensity-modulated radiation therapy and arc technique". Tıp Fiziği Dergisi. 41 (3): 198–204. doi:10.4103/0971-6203.189490. PMC 5019039. PMID 27651567.
- ^ Fogliata A, Belosi F, Clivio A, Navarria P, Nicolini G, Scorsetti M, et al. (Aralık 2014). "On the pre-clinical validation of a commercial model-based optimisation engine: application to volumetric modulated arc therapy for patients with lung or prostate cancer". Radyoterapi ve Onkoloji. 113 (3): 385–91. doi:10.1016/j.radonc.2014.11.009. PMID 25465726.
- ^ Hazell I, Bzdusek K, Kumar P, Hansen CR, Bertelsen A, Eriksen JG, et al. (Ocak 2016). "Automatic planning of head and neck treatment plans". Journal of Applied Clinical Medical Physics. 17 (1): 272–282. doi:10.1120/jacmp.v17i1.5901. PMC 5690191. PMID 26894364.
- ^ Hansen CR, Bertelsen A, Hazell I, Zukauskaite R, Gyldenkerne N, Johansen J, et al. (Aralık 2016). "Automatic treatment planning improves the clinical quality of head and neck cancer treatment plans". Clinical and Translational Radiation Oncology. 1: 2–8. doi:10.1016/j.ctro.2016.08.001. PMC 5893480. PMID 29657987.
- ^ Hansen CR, Nielsen M, Bertelsen AS, Hazell I, Holtved E, Zukauskaite R, et al. (Kasım 2017). "Automatic treatment planning facilitates fast generation of high-quality treatment plans for esophageal cancer". Acta Oncologica. 56 (11): 1495–1500. doi:10.1080/0284186X.2017.1349928. PMID 28840767.
- ^ Roach D, Wortel G, Ochoa C, Jensen HR, Damen E, Vial P, Janssen T, Hansen CR (2019-04-01). "Adapting automated treatment planning configurations across international centres for prostate radiotherapy". Physics and Imaging in Radiation Oncology. 10: 7–13. doi:10.1016/j.phro.2019.04.007.
- ^ Laurance, Jeremy (12 January 2009). "Brain tumor patient 'unaware' treatment was available on NHS". Bağımsız. Arşivlenen orijinal 22 Haziran 2009. Alındı 10 Nisan 2009.
- ^ Kereiakes JG, Rao DV (1992). "Auger electron dosimetry: report of AAPM Nuclear Medicine Committee Task Group No. 6". Tıp fiziği. 19 (6): 1359. Bibcode:1992MedPh..19.1359K. doi:10.1118/1.596925. PMID 1461197.
- ^ a b "Contact X-ray Brachytherapy for early rectal cancer". Ulusal Sağlık ve Bakım Mükemmelliği Enstitüsü. Eylül 2015.
- ^ Sun Myint A, Gerard J, Myerson RJ (2014). "Contact X-Ray Brachytherapy for Rectal Cancer". In Longo WE, Reddy V, Audisio RA (eds.). Modern Management of Cancer of the Rectum. Springer. s. 109ff. ISBN 9781447166092.
- ^ American Association of Physicists in Medicine (February 2009). "The 2007 AAPM response to the CRCPD request for recommendations for the CRCPD's model regulations for electronic brachytherapy" (PDF). Amerikan Tıp Fizikçileri Derneği. Alındı 17 Nisan 2010.
- ^ Gerbaulet A, et al. (2005). "Cervix carcinoma". Gerbaulet A, Pötter R, Mazeron J, Limbergen EV'de (editörler). GEC ESTRO brakiterapi el kitabı. Belçika: ACCO.
- ^ Ash D, vd. (2005). "Prostat kanseri". Gerbaulet A, Pötter R, Mazeron J, Limbergen EV'de (editörler). GEC ESTRO brakiterapi el kitabı. Belçika: ACCO.
- ^ Van Limbergen E, vd. (2005). "Meme kanseri". Gerbaulet A, Pötter R, Mazeron J, Limbergen EV'de (editörler). GEC ESTRO brakiterapi el kitabı. Belçika: ACCO.
- ^ Van Limbergen E, vd. (2005). "Cilt kanseri". Gerbaulet A, Pötter R, Mazeron J, Limbergen EV'de (editörler). GEC ESTRO brakiterapi el kitabı. Belçika: ACCO.
- ^ a b Gerbaulet A, vd. (2005). "Genel hususlar". Gerbaulet A, Pötter R, Mazeron J, Limbergen EV'de (editörler). GEC ESTRO brakiterapi el kitabı. Belçika: ACCO.
- ^ a b Stewart AJ; et al. (2007). "Brakiterapi için radyobiyolojik kavramlar". Devlin P'de (ed.). Brakiterapi. Uygulamalar ve Teknikler. Philadelphia: LWW.
- ^ Yashar CM, Blair S, Wallace A, Scanderbeg D (2009). "Hızlandırılmış kısmi meme radyasyonu için Strut-Adjusted Volume Implant brakiterapi aplikatörü ile ilk klinik deneyim". Brakiterapi. 8 (4): 367–72. doi:10.1016 / j.brachy.2009.03.190. PMID 19744892.
- ^ Parker C, Nilsson S, Heinrich D, Helle SI, O'Sullivan JM, Fosså SD, ve diğerleri. (Temmuz 2013). "Alfa yayıcı radyum-223 ve metastatik prostat kanserinde hayatta kalma". New England Tıp Dergisi. 369 (3): 213–23. doi:10.1056 / NEJMoa1213755. PMID 23863050.
- ^ Sartor O (2004). "Ağrılı metastatik kemik hastalığının tedavisinde samarium sm 153 lexidronam'a genel bakış". Üroloji İncelemeleri. 6 Özel Sayı 10 (Ek 10): S3 – S12. PMC 1472939. PMID 16985930.
- ^ Fda, Hodgkin Olmayan Lenfomayı Tedavi Etmek İçin İlk Radyofarmasötik Ürünü Onayladı Arşivlendi 19 Ocak 2009, Wayback Makinesi
- ^ Tositumomab ve İyot I 131 Tositumomab - Ürün Onay Bilgileri - Lisanslama İşlemi Arşivlendi 13 Mayıs 2009, Wayback Makinesi
- ^ Dutta SW, Showalter SL, Showalter TN, Libby B, Trifiletti DM (Nisan 2017). "Meme kanseri hastaları için intraoperatif radyasyon tedavisi: güncel bakış açıları". Meme Kanseri: Hedefler ve Tedavi. 9: 257–263. doi:10.2147 / BCTT.S112516. PMC 5402914. PMID 28458578.
- ^ Belletti B, Vaidya JS, D'Andrea S, Entschladen F, Roncadin M, Lovat F, ve diğerleri. (Mart 2008). "Hedefe yönelik intraoperatif radyoterapi, meme kanseri hücre çoğalmasının uyarılmasını ve cerrahi yaraların neden olduğu istilayı bozar". Klinik Kanser Araştırmaları. 14 (5): 1325–32. doi:10.1158 / 1078-0432.CCR-07-4453. PMID 18316551.
- ^ Hanley J, Debois MM, Mah D, Mageras GS, Raben A, Rosenzweig K, ve diğerleri. (Ekim 1999). "Akciğer tümörleri için derin inspirasyon nefes tutma tekniği: hedef immobilizasyonun potansiyel değeri ve doz artışında düşük akciğer yoğunluğu" Uluslararası Radyasyon Onkolojisi Dergisi, Biyoloji, Fizik. 45 (3): 603–11. doi:10.1016 / S0360-3016 (99) 00154-6. PMID 10524412.
- ^ "Derin İlham Nefes Tutun". Genesis Bakımı. Alındı 14 Ocak 2016.
- ^ a b "Alabama Üniversitesi, Birmingham Kapsamlı Kanser Merkezi, Radyasyon Onkolojisi Tarihi". Arşivlenen orijinal (itibaren Wayback Makinesi ) 2008-01-05 tarihinde.
- ^ "Bilim Haberleri". Bilim. Yeni seri. 125 (3236): 18–22. Ocak 1957. Bibcode:1957Sci ... 125T..18.. doi:10.1126 / science.125.3236.18. JSTOR 1752791. PMID 17835363.
- ^ "Radyasyon Tedavisinin Tarihçesi: Terapötik Radyolojinin Evrimi". Rtanswers.com. 2010-03-31. Arşivlenen orijinal 2012-03-01 tarihinde. Alındı 2012-04-20.
- ^ "Kansere yaklaşmak". Ekonomist. 16 Eylül 2017. Alındı 25 Eylül 2017.
daha fazla okuma
- Ash D, Dobbs J, Barrett, A (1999). Pratik radyasyon tedavisi planlaması. Londra: Arnold. ISBN 978-0-340-70631-2.CS1 bakım: birden çok isim: yazarlar listesi (bağlantı)
- Lawrence Chin, MD ve William Regine, MD, Editörler (2008). Stereotaktik Cerrahinin Prensipleri. Berlin: Springer. ISBN 978-0-387-71069-3.CS1 bakım: birden çok isim: yazarlar listesi (bağlantı)
- Mayles, P; Rosenwald, JC; Nahum, A (2007). Radyasyon Terapisi Fiziği El Kitabı: Teori ve Uygulama. Taylor ve Francis. ISBN 978-0-7503-0860-1.
- McGarry, M (2002). Tedavide Radyasyon tedavisi. AUSG Kitapları.
- Williams JR, Thwaites DI (1993). Uygulamada radyasyon tedavisi fiziği. Oxford [Oxfordshire]: Oxford University Press. ISBN 978-0-19-963315-9.
Dış bağlantılar
- Bilgi
- İnsan Sağlığı Kampüsü Uluslararası Atom Enerjisi Ajansı'nın Radyasyon Tıbbı Uzmanlarına adanmış resmi web sitesi. Bu site, İnsan Sağlığı Bölümü, Nükleer Bilimler ve Uygulamalar Bölümü tarafından yönetilmektedir.
- RT Cevapları - ASTRO: hasta bilgi sitesi
- Proton Radyasyon Tedavisi
- Radyasyon Tedavisi Onkolojisi Grubu: radyasyon onkolojisi araştırmaları için bir organizasyon
- Radyoloji Bilgisi -Hastalar için radyoloji bilgi kaynağı: Radyasyon Tedavisi
- Kanser kök hücrelerinin radyasyona karşı direncinin kaynağı YouTube'da açıklandı.
- Kanser Tedavisi El Kitabı: Radyasyon Tedavisinin İlkeleri
- Biyolojik olarak eşdeğer doz hesaplayıcı
- Radyobiyoloji Tedavi Boşluk Telafi Hesaplayıcı
- Meslek hakkında
- PROS (Pediatrik Radyasyon Onkolojisi Derneği)
- Amerikan Radyasyon Onkolojisi Derneği - ASTRO: radyasyon onkologları için resmi site
- PACT: Kanser Tedavisi için Eylem Programı Radyasyon tedavisi yardımıyla gelişmekte olan dünyada kanser bakım kapasitesi ve kapsamlı kanser kontrolü oluşturma programı
- Avrupa Terapötik Radyoloji ve Onkoloji Derneği
- Radyasyon Onkolojisinde kim ne yapar? - Amerika Birleşik Devletleri'ndeki Radyasyon Onkolojisi bünyesindeki çeşitli personelin sorumlulukları
- Radyograflar Derneği (İngiltere)
- Kazalar ve QA
