Bipolar bozukluğun biyolojisi - Biology of bipolar disorder
Bipolar bozukluk dönemlerle karakterize duygusal bir bozukluktur yüksek ve bunalımlı ruh hali. Bipolar bozukluğun nedeni ve mekanizması henüz bilinmemektedir ve biyolojik kökenlerinin araştırılması devam etmektedir. Tek bir gen bozukluğa neden olmasa da, bozukluğun riskini artırmak için bir dizi gen bağlantılıdır ve çeşitli gen ortamı etkileşimleri, bireyleri bipolar bozukluk geliştirmeye yatkınlaştırmada rol oynayabilir. Nörogörüntüleme ve postmortem çalışmalar, çeşitli beyin bölgelerinde anormallikler bulmuştur ve en yaygın olarak etkilenen bölgeler arasında ventral Prefrontal korteks ve amigdala. Bu bölgelerde bulunan duygusal devrelerdeki işlev bozukluğunun bipolar bozukluk için bir mekanizma olduğu varsayılmıştır.[1] Bir dizi kanıt, nörotransmisyon, hücre içi sinyalleşme ve hücresel işlevler muhtemelen bipolar bozuklukta bir rol oynamaktadır.[2]

Bipolar bozukluk çalışmaları, özellikle nörogörüntüleme çalışmaları, ilaç tedavisi, komorbidite ve küçük örneklem boyutu gibi karıştırıcı etkilere karşı savunmasızdır, bu da güçsüz bağımsız çalışmalara ve önemli heterojeniteye yol açar.[4]
Etiyoloji
Genetik
Bipolar bozukluğun etiyolojisi bilinmemektedir. Genel olarak kalıtım Bipolar'ın% 79-93 olduğu tahmin edilmektedir ve bipolar probandların birinci derece akrabalarında 7-10 civarında bipolar gelişme göreceli riski vardır. Kalıtılabilirlik yüksek olmasına rağmen, hiçbir spesifik gen bipolar ile kesin olarak ilişkilendirilmemiştir ve bu gerçeği açıklamak için bir dizi hipotez öne sürülmüştür. "Poligenik ortak nadir varyant" hipotezi, bir popülasyonda çok sayıda risk oluşturan genlerin taşındığını ve bir kişi bu genlerden yeterli sayıda olduğunda bir hastalığın ortaya çıktığını ileri sürer. "Çoklu nadir varyant" modeli, popülasyonda nadir bulunan çoklu genlerin bir hastalığa neden olabileceğini ve bir veya birkaçını taşımanın hastalığa yol açabileceğini öne sürüyor.[6] Mani ve depresyonun ailevi geçişi büyük ölçüde birbirinden bağımsızdır. Bu, bipolar'ın aslında biyolojik olarak farklı ancak oldukça komorbid durum olma olasılığını ortaya çıkarmaktadır.[7]
Bir dizi genom çapında ilişkiler dahil olmak üzere bildirildi CACNA1C[8] ve ODZ4, ve TRANK1.[9][10][11][12][13] Daha az tutarlı olarak bildirilen lokuslar şunları içerir: ANK3 ve NCAN, ITIH1, ITIH3 ve NEK4. Şizofreni ile önemli örtüşmeler CACNA1C, ITIH, ANK3 ve ZNF804A. Bu örtüşme, şizofrenili probandların akrabalarının bipolar bozukluk açısından daha yüksek risk altında olduğu ve bunun tersi olduğu gözlemiyle uyumludur.
Bipolar ve sirkadiyen anormallikler (uyku ihtiyacının azalması ve uyku gecikmesinin artması gibi) arasındaki ilişkiler ışığında, polimorfizmler SAAT Bulgular tutarsız olmasına rağmen, gen ilişki için test edilmiştir,[6] ve bir meta analiz, bipolar veya majör depresif bozuklukla hiçbir ilişki bildirmemiştir.[14] Gevşemiş anlamlılık eşiklerinde bipolar ile ilişkili diğer sirkadiyen genler arasında ARTNL, RORB, ve ARALIK1.[15] Bir meta analiz, kısa alelin önemli bir ilişkisini bildirdi. serotonin taşıyıcısı Ancak çalışma Avrupa popülasyonlarına özeldi.[16] İki polimorfizm triptofan hidroksilaz 2 gen bipolar bozuklukla ilişkilendirilmiştir.[17] NFIA mevsimsel mani kalıplarıyla ilişkilendirilmiştir.[18]
CACNA1C üzerinde yer alan ve bipolar bozukluk için risk oluşturan belirli bir SNP, prefrontal kortekste CACNA1C mRNA ekspresyonunun artması ve hastanın indüklediği nöronlarda artmış kalsiyum kanal ekspresyonu ile ilişkilidir. pluripotent kök hücreler.[19]
İçin önemli bir ilişki yok BDNF Val66Met alel ve bipolar bozukluk, muhtemelen bipolar II vakalarının bir alt grubu dışında,[20] ve intihar.[21]
GWAS'daki tutarsız bulgular nedeniyle, çok sayıda çalışma, biyolojik yolaklardaki SNP'leri analiz etme yaklaşımını üstlenmiştir. Bu çalışmalar tarafından desteklenen ve geleneksel olarak bipolar bozuklukla ilişkilendirilen sinyal yolları şunları içerir: CRH sinyal verme, kardiyak β-adrenerjik sinyal fosfolipaz C sinyal glutamat reseptör sinyali,[22] kardiyak hipertrofi sinyali, Wnt sinyali, çentik sinyali,[23] ve endotelin 1 sinyalleşme. Bu yolaklarda tanımlanan 16 genden üçünün, dorsolateral prefrontal korteks ölüm sonrası çalışmalarda beynin bir kısmı, CACNA1C, GNG2, ve ITPR2.[24]
İleri baba yaşı artan yeni hipoteziyle tutarlı olarak, yavrularda bipolar bozukluk şansının biraz artmasıyla ilişkilendirilmiştir. genetik mutasyonlar.[25]
Çevresel
Manik bölümler tarafından üretilebilir uyku eksikliği bipolar olan kişilerin yaklaşık% 30'unda. Bipolar olan tüm insanlar duygusal semptomların mevsimselliğini göstermese de, bipolardaki sirkadiyen disfonksiyon teorilerini destekleyen sürekli olarak bildirilen bir özelliktir.[26]
Bipolar için risk faktörleri arasında obstetrik komplikasyonlar, kötüye kullanım, uyuşturucu kullanımı ve önemli yaşam stres faktörleri bulunur.[27]
"çıra modeli "duygudurum bozuklukları, büyük çevresel stres faktörlerinin ilk duygudurum dönemlerini tetiklediğini, ancak duygudurum dönemleri meydana geldikçe, daha zayıf ve daha zayıf tetikleyiciler duygusal bir dönemi hızlandırabilir. Bu model, başlangıçta epilepsi için yaratıldı, neden daha zayıf ve daha zayıf elektrik uyarımının ortaya çıkarmak için gerekli olduğunu açıklamak için oluşturuldu. hastalık ilerledikçe bir nöbet. Bipolar bozukluk ve epilepsi arasında paralellikler kurulurken, çıra hipotezini destekler,[28] bu model genellikle iki kutuplu deneklerde doğrudan değerlendiren çalışmalar tarafından desteklenmez.[26]
Nörolojik bozukluklar
Mani% 2 ile% 30 arasında nörolojik koşullara sekonder olarak ortaya çıkar. Mani en sık sağ taraf lezyonlarda, prefrontal korteksi ayıran lezyonlarda veya sol hemisferdeki eksitatör lezyonlarda görülür.[29]
"İkincil mani" ile ilişkili hastalıklar şunları içerir: Cushing hastalığı, demans, deliryum, menenjit, hiperparatiroidizm, hipoparatiroidizm, tirotoksikoz, multipl Skleroz, Huntington hastalığı, epilepsi, nörosifil, HIV demans, üremi, Hem de travmatik beyin hasarı ve B12 vitamini eksikliği.[30]
Patofizyoloji
Nörobiyolojik ve nöroanatomik modeller
Bipolardaki nörogörüntülemenin ve nöropatolojik bulguların ana lokuslarının mPFC'den oluşan bir "visceromotor" ağda disfonksiyon oluşturduğu öne sürülmüştür. ön singulat korteks (ACC), orbitofrontal korteks (OFC), hipokamp amigdala hipotalamus, striatum ve talamus.[31]
Stephen M. Strakowski liderliğindeki bir çalışma grubu tarafından üretilen bir fonksiyonel nöroanatomi modeli, bipolar'ın prefrontal-striatal-pallidal-talamik-limbik ağdaki anormal budama veya gelişmeye bağlı olarak azalmış bağlanabilirlik ile karakterize edildiği ve düzensiz duygusal tepkilere yol açtığı sonucuna vardı. Bu model, bir dizi yaygın nörogörüntüleme bulgusuyla desteklenmiştir. Limbik yapıların düzensizliği, yüz uyaranlarına yanıt olarak amigdalada hiperaktivitenin manide sürekli olarak bildirilmesiyle kanıtlanmıştır.[32] Amigdala hiperaktivitesi tek tip bir bulgu olmasa da, bir takım metodolojik zorluklar tutarsızlıkları açıklayabilir. Çoğu çalışma, ölçmek için fMRI kullandığından kan oksijen düzeyine bağlı sinyal aşırı temel aktivite, çıkarma analizi nedeniyle boş bulgulara neden olabilir. Dahası, heterojen çalışma tasarımı, belirli uyaranlara karşı tutarlı hiperaktiviteyi maskeleyebilir. Amigdala anormalliklerinin yönlülüğüne bakılmaksızın, amigdala duygusal sistemlerde merkezi bir rol oynadığından, bu bulgular bipolardaki işlevsiz duygusal devreleri destekler. Bipolar'da ventrolateral prefrontal korteks aktivitesinde genel bir azalma gözlenir ve duygudurum açısından lateralize edilir (yani, sol depresyon, sağ mani) ve amigdala anormalliklerinin altında yatabilir. Dorsal ACC, genellikle bipolar'da yetersiz aktive olur ve genellikle bilişsel işlevlerde rol alırken, ventral ACC hiperaktiftir ve duygusal işlevlerle ilişkilendirilir. Bu anormallikler birlikte, bipolar bozuklukta duygusal düzenlemedeki işlev bozukluğunun altında yatan prefrontal-striatal-pallidial-talamik limbik ağı destekler.[33] Strakowski, DelBello ve Adler ile birlikte bir "ön limbik" bipolar bozuklukta disfonksiyon birçok makalede.[34][35][36][37][38]
Green at al 2007, belirli yapılar üzerinde bilişsel ve duygusal işlemenin yakınsamasına dayanan bir bipolar bozukluk modeli önermiştir. Örneğin, dACC ve sgACC, duygudurum üzerinde aşırı etkiye sahip olan duygusal uyaranlara dönüşebilen duygusal tepkilerin ve kendi kendini izlemenin engellenmesinin bozulması ile bilişsel olarak ilişkilendirilmiştir. Anormal dlPFC işlevi ile ilişkili çalışma belleğindeki eksiklikler, duygusal uyaranları temsil etme yeteneğinin bozulmasına ve dolayısıyla duygusal uyaranları yeniden değerlendirme yeteneğinin bozulmasına da dönüşebilir. Amigdala ve striatumdaki işlev bozukluğu, dikkat yanlılığı ile ilişkilendirilmiştir ve işlevsiz duygusal işlemenin aşağıdan yukarıya bir mekanizmasını temsil edebilir.[39]
Blond vd. "amigdala-anterior paralimbik" sistemdeki işlev bozukluğuna odaklanan bir model önerdi. Bu model, ventral prefrontal korteks ve amigdaladaki tutarlı fonksiyonel ve yapısal anormalliklere dayanıyordu. Model aynı zamanda bipolar bozukluğun gelişimsel bir bileşenini önermektedir, burada limbik anormallikler erken dönemde mevcuttur, ancak daha sonra rostral prefrontal anormallikler gelişmektedir. Gelişimin erken dönemlerinde limbik disfonksiyonun önemi, yetişkinliğin erken dönemlerinde amigdala lezyonlarının yetişkinlikte amigdala hasarı gelişen insanlarda bulunmayan duygusal anormallikler ürettiği gözlemiyle vurgulanmaktadır.[40]
Meziyal temporal lob nöbetleri olan kişilerde bipolara benzer lateralize nöbet sekelleri bildirilmiştir ve ateşleme hipotezleri bipolar hakkında.[41] Bu gözlem, ruh halini dengelemede etkili olan bipolardaki antikonvülsanlarla ilk deneylere yol açtı. Engelleyici internöron belirteçlerinin azaldığını bildiren çalışmalar otopsi analojiyi epilepsi ile duygusal devrelerde engelleyici aktivitede olası bir azalmaya bağlar.[40] Epilepsi ile örtüşme, hücre içi sinyallemedeki anormallikleri, hipokampustaki ve prefrontal korteksteki biyokimyayı ve amigdalanın yapısı ve işlevini kapsayacak şekilde genişler.[42]
Nörolojik bozukluklara sekonder maninin fenomenolojisi ve nöroanatomisi, birincil mani ve bipolar bozukluktaki bulgularla uyumludur. Lezyonların çeşitliliği ve hastalık öncesi psikiyatrik durumların dışlanmasındaki zorluk, çıkarılabilecek sonuçları sınırlarken, bir dizi bulgu oldukça tutarlıdır. Yapısal olarak ikincil mani, sağ hemisferde, özellikle frontal korteks, mezial temporal lob ve bazal ganglionlarda ortaya çıkma eğiliminde olan yıkıcı lezyonlarla ilişkilidir. İkincil mani vakalarında sol bazal ganglionlarda ve subkortikal yapılarda fonksiyonel olarak hiperaktivite ve sağ ventral prefrontal ve bazotemporal kortekste hipoaktivite bildirilmiştir. Sağ hemisfer veya ön alanların yok edilmesinin aşırı sol taraflı veya subkortikal ödül işlemeye geçişe yol açtığı varsayılmaktadır.[29]
John O. Brooks III, "kortikolimbik sistem" adı verilen bir devrenin düzensizliğini içeren bir bipolar bozukluk modeli ortaya koydu. Model, mOFC, vlPFC ve dlPFC'deki azalmış aktivitenin az çok tutarlı gözlemlerine ve ayrıca amigdala, parahipokampal girus, serebellar vermis, anterior temporal korteks, sgACC'de artan aktivitenin az çok tutarlı gözlemlerine dayanıyordu. ve ACC. Bu anormal aktivite paterninin, bipolar bozuklukta bozulmuş bilişsel ve duygusal süreçlere katkıda bulunduğu öne sürüldü.[43]
Nörobiliş
Akut duygudurum dönemleri sırasında, bipolar olan kişiler duygudurumla uyumlu işlem önyargıları gösterirler. Depresif hastalar, olumsuz olarak değerlendirilen uyaranlara daha hızlı tepki verirken, manik hastalar olumlu olarak değerlendirilmiş uyaranlara daha hızlı tepki verirler.[44] Akut duygudurum dönemleri, karar verme görevleri sırasındaki uyumlu anormalliklerle de ilişkilidir. Depresif bipolar, konservatif yanıtla ilişkiliyken, manik bipolar liberal yanıtlarla ilişkilidir. Hem depresyon hem de mani, benzer ve geniş bilişsel bozukluklarla ilişkilidir. Dikkat, işleme hızı, çalışma belleği, yürütücü işlevler ve tepki süresi.[45]
Klinik olarak mani, harcama çılgınlıkları, zayıf muhakeme ve uygunsuz konuşma ve davranışla karakterizedir. Bununla bağlantılı olarak, mani, Devam Etme görevlerinde dürtüsellik, duygusal karar vermedeki eksiklikler, zayıf olasılıklı akıl yürütme, sürekli performans görevlerinde bozulmuş yetenek, set değiştirme ve planlama ile ilişkilidir. Klinik fenomenoloji ve nörobilişsel kusurlar, hasar gören hastalarda görülenlere benzer. orbitofrontal korteks (OFC) Bipolar manide fonksiyonel beyin görüntüleme çalışmalarında anormal olduğu bildirilmiştir. Spesifik olarak, lateral OFC'ye kan akışının azaldığı bildirilmiştir ve nörobilişsel kusurlara yol açan disfonksiyonu yansıtabilir.[46]
Yeni ortamlarda, hem bipolar manik hem de bipolar ötimik insanlar, kontrollerden, DEHB olanlardan ve şizofreni hastalarından daha fazla artan aktivite, keşif ve doğrusal hareket sergiler. Bu davranışsal örüntüyü "ters çeviri" çalışmalarında kullanarak, bu davranışsal anormallik, manide yükselmiş dopaminerjik sinyali öne süren kolinerjik-aminerjik hipotez ile ilişkilendirilmiştir. İşlevini azaltmak DAT farmakolojik veya genetik yolların kullanılması, hayvan modellerinde benzer bir davranış modeli oluşturur. Bazı çalışmalar uyarıcılara aşırı duyarlılık bildirdiği için farmakolojik veriler, bipolardaki dopamin disfonksiyonu ile tutarlıdır (ancak, bazı çalışmalar, uyarıcıların manik davranışı etkili bir şekilde zayıflattığını ve eşzamanlı DEHB ve bipolar'ın uyarıcılarla etkili bir şekilde tedavi edildiğini bulmuştur),[47] ve antimanik ilaçların mekanizması, hafifletici dopamin sinyalini içerebilir.[48]
Ödül sistemlerinin aşırı duyarlılığı, bipolardaki ruh hali durumlarında tutarlıdır ve prodromda belirgindir. Hedefe yönelik davranışta artış, risk alma,[49] Ötimide ödüle yanıt olarak olumlu duygular, iddialı hedef belirleme ve hedefe yönelik davranışlarda esneklik mevcuttur. Hem mani hem de depresyon, striatumda artmış dinlenme aktivitesi ve artmış aktivite ile ilişkili olduğundan, beyin görüntüleme çalışmaları ödül sistemlerindeki sürekli aşırı duyarlılık ile tutarlıdır. striatum ve duygusal işleme, ödülün alınması ve ödül beklentisi sırasında OFC.[50] Striatum ve OFC'de artan aktivite, ötimide de ödülün beklenmesi ve alınması sırasında bildirilmiştir, ancak bu bulgu son derece tutarsızdır.[51] Bu anormallikler, her iki süreçten sorumlu sinir sistemleri işlevsel olarak bağlantılı olduğundan, artan uyku gecikmesi, akşam tercihi ve kötü uyku kalitesi dahil olmak üzere bipolardaki sirkadiyen ritim disfonksiyonuyla ilişkili olabilir.[50] Birkaç kanıt dizisi, muhtemelen düşük işlevsellikten dolayı, dopamin sinyalinin yükseldiğini göstermektedir. DAT, ödül işlevindeki anormalliklerin altında yatar. Dopaminerjik ilaçlar L-DOPA maniyi ve hücre dışı olarak dopaminerjik sinyali zayıflatan ilaçları hızlandırabilir (antipsikotikler ) ve hücre içi olarak (lityum ) mani tedavisinde etkili olabilir. DAT hipofonksiyonunu desteklemek için çok sayıda çeviri kanıtı varken, in vivo kanıt kaudatta azalmış DAT bağlanmasını bildiren bir çalışma ile sınırlıdır.[52]
Nöro-görüntüleme
Yapısal
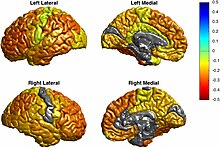
Bipolar bozuklukta yapısal nörogörüntülemenin bir incelemesinde Strakowski, talamus, globus pallidus, striatum, vlPFC, vmPFC, ACC, amigdala, dlPFC ve serebellar vermisten oluşan "anterior limbik ağ" olarak adlandırılan yinelemeli bir duygusal ağda disfonksiyon önermiştir. Yapısal görüntüleme çalışmaları sıklıkla bu bölgelerde bipolar bozuklukta bozulan duygusal ve bilişsel işlevlerle ilgili olduğu varsayılan anormallikler bulmaktadır. Örneğin, yapısal beyin görüntüleme çalışmaları bipolar bozuklukta her zaman anormal PFC hacmi bulmazken, bulduklarında PFC hacmi azalır. Ayrıca, azalmış PFC hacmi, yanıt inhibisyon eksiklikleri ve hastalık süresi ile ilişkilidir. Genel olarak PFC incelenmediğinde ve odak OFC / vPFC'ye daraltıldığında, bipolar gençlikte olmasa da daha tutarlı bir şekilde gözlenen azalmalarla sonuçlanır. SgACC hacminin sadece bipolar bozuklukta değil, aynı zamanda unipolar bozuklukta ve ayrıca ailesinde afektif bozukluk öyküsü olan kişilerde azaldığı gözlenmiştir. Striatum ve globus pallidusun genişlemesi yaygın olarak bulunur ve bazı çalışmalar bunu gözlemlemekte başarısız olmasına rağmen, en az bir çalışma hacimsel değil, ince morfometrik anormallikler bildirmemiştir.[38]
Yapısal nörogörüntüleme çalışmaları, bipolar olan kişilerde sürekli olarak beyaz cevher hiperintensitelerinin arttığını bildirmektedir. Ancak lezyonların nedensel bir rol oynayıp oynamadığı bilinmemektedir. Bipolar'da artmış kardiyovasküler hastalık riskinin altında yatan süreçler gibi ikincil faktörlerin bir sonucu olmaları mümkündür. Öte yandan, frontal-subkortikal bölgelerde azalmış beyaz cevher bütünlüğünün gözlemlenmesi, bu hiperintensitelerin limbik ve kortikal bölgeler arasında bir rol disfonksiyonu oynamasını mümkün kılar. Bipolar'da global beyin hacmi ve morfolojisi normaldir. Hacimdeki bölgesel açıklar, ventrolateral ve dorsolateral prefrontal bölgeler. Buna dayanarak, prefrontal bölgeler tarafından azaltılmış limbik regülasyonun bipolar'da rol oynadığı öne sürülmüştür. Bazal gangliyonların hacmi ile ilgili bulgular tutarsızdır.
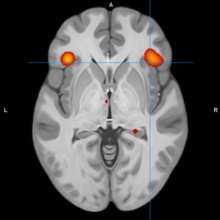
Sağlıklı kontrollerde amigdala hacmi yaşla ters orantılıdır. Bu ilişki bipolar bozuklukta tersine döner,[54] ve meta analizler, pediatrik bipolar bozuklukta amigdala hacminin azaldığını ve yetişkinlikte amigdala hacminin arttığını bulmuştur.[55][56] Bunun, muhtemelen bozulmuş sinaptik budamayı içeren anormal amigdala gelişimini yansıttığı varsayılmaktadır, ancak bu ilaç veya telafi edici etkileri yansıtabilir; yani, bu anormallikler bipolar mekanizmaya dahil olmayabilir ve bunun yerine bir sonuç olabilir.[57]
Bir 2016 meta analizi, bipolar bozukluğun ACC, vmPFC ve temporal loba uzanan insulada bilateral gri madde azalması ile ilişkili olduğunu bildirdi. Tek kutuplu depresyondaki gri cevher azalmaları ile karşılaştırıldığında, insular ve medial prefrontal bölgelerde anlamlı örtüşme meydana geldi. Tek kutuplu depresyon, mPFC'nin en ventral ve dorsal çoğu bölgelerinde ve korpus kallozumun genusuna yakın bir bölge ile bipolar azalmalarla ilişkili olmasına rağmen, örtüşme hala istatistiksel olarak anlamlıydı.[58] Majör depresyon ile örtüşmeye benzer şekilde, bipolar bozukluk ile önemli bir örtüşme şizofreni gri cevherde ön singulat kortekste, medial prefrontal kortekste, lateral prefrontal kortekste ve bilateralde hacim azalması meydana gelir Insula.[59]
Kontroller ve bipolar bozukluk arasındaki bölgesel gri cevher hacmindeki farklılıkların bir 2010 meta analizi, alt frontal korteks ve insulada bilateral olarak azalmalar rapor etti; bu, sağ tarafta preantral girusu içerecek şekilde daha belirgin bir şekilde genişledi ve ayrıca pregenual gri madde azaldı. ön singulat korteks (BA24) ve ön singulat korteks (BA32).[60] Bir meta analiz, lateral ventriküllerin ve globus pallidusun genişlemesinin yanı sıra, hipokampus hacminde ve korpus kallozumun enine kesit alanında azalmalar bildirdi.[61] Başka bir meta analiz, benzer bir artış hacmini bildirdi. Globus pallidus ve lateral ventriküllerin yanı sıra şizofreni hastalarına göre artan amigdala hacmi.[62] Sağ inferior frontal girus, insula, pars triangularis, pars opercularis ve orta ve superior temporal girusta da azalmalar bildirilmiştir.[63] Bipolar bozukluğa yatkın kişilerde (yani, bipolar bozukluğu olan birkaç akrabası olan) yapısal nörogörüntüleme birkaç tutarlı sonuç üretmiştir. Yetişkin birinci derece akrabalardaki tutarlı anormallikler daha büyük insüler korteks hacimleri içerirken, yavrular artmış sağ inferior frontal girus hacimlerini gösterir.[64]
ENIGMA bipolar bozukluk çalışma grubu, sol tarafta kortikal incelme bildirdi Pars operkularis (BA44-inferior frontal girus), sol fuziform girus, sol rostral orta frontal korteks, sağ alt parietal korteks, sağ entorhinal kortekste bir artış ile birlikte. Hastalık süresi, perikarin girus, sol rostral anterior singulat ve sağ cuneustaki bilateral azalmalarla ve sağ entorinal kortekste artışlarla ilişkilendirildi. Lityum ile tedavi, superior parietal girusta, sol parasantral girusta ve sol parasantral lobülde bilateral olarak artmış kortikal kalınlık ile ilişkilendirildi. Bir psikoz öyküsü, sağ ön kutupta azalmış yüzey alanı ile ilişkilendirildi.[53] Aynı araştırma grubu tarafından subkortikal anormallikler üzerine yapılan bir başka çalışma, ventriküler genişlemeyle birlikte hipokamp, amigdala ve talamusta azalma olduğunu bildirdi.[65]
Bir meta analiz, artan hipokampal hacim ile ilişkili olan lityum tedavisini düzeltirken, bipolar hastalarının hipokampüs hacminin azaldığını gösterdi.[66]
Arka korpus kallozumda, anterior singulata komşu bölgelerde, sol optik radyasyonda ve sağ üst uzunlamasına yolda beyaz madde azalır ve beyincikte ve mercimek çekirdeği.[67]
İşlevsel
Dinlenme kan akışını veya metabolizmayı inceleyen çalışmalarda genellikle ruh hali durumuna bağlı anormallikler gözlemlendi. Bipolar depresyon genellikle dlPFC ve mOFC hipometabolizması ile ilişkilidir. Daha az tutarlı ilişkiler, azalmış temporal korteks metabolizması, artmış limbik metabolizma ve azalmış ACC metabolizmasını içerir. Mani ayrıca dlPFC ve OFC hipometabolizması ile de ilişkilidir. Limbik hipermetabolizma, bipolar depresyonda olduğundan daha tutarlıdır, ancak akut manik hastalarda nörogörüntüleme ile ilişkili sınırlamalar nedeniyle genel çalışma kalitesi düşüktür.[69] Başka bir derleme, maninin genellikle frontal / ventral hipoaktivasyon ile ilişkili olduğunu, depresyonun ise genellikle bunun tersi ile ilişkili olduğunu bildirdi. Anormalliklerle ilgili olarak bir derece lateralizasyon bildirilmiştir, mani sağ hemisfer ile ve depresyon solda ile ilişkilidir. Ötimik hastalarda ventral prefrontal kortekste hipoaktivite ve amigdalada hiperaktivite dahil olmak üzere sürekli anormallikler gözlenmiştir.[70]
Bilişsel veya duygusal görevler sırasında, fonksiyonel nörogörüntüleme çalışmaları, sürekli olarak hiperaktivasyon bulur. Bazal ganglion, amigdala, ve talamus. Prefrontal anormallikler daha az tutarlı bir şekilde rapor edilir, ancak ventral prefrontal kortekste hiperaktivasyon oldukça tutarlı bir bulgudur.[71] Duygusal uyaranlara maruz kalma sırasında amigdaladaki hiperaktivite ve medial ve ventral prefrontal korteksteki hipoaktivite, duygusal düzenleme devrelerindeki disfonksiyonu yansıtan olarak yorumlanmıştır. Amigdala ve orbitofrontal korteks arasında artan etkili bağlantı ve ödül görevleri sırasında artan striatal yanıt verme, pozitif duygu ve ödül döngüsünde aşırı duyarlılık olarak yorumlandı. Bu devrelerdeki anormal aktivite, duygusal olmayan görevlerde gözlenmiştir ve bu devrelerdeki gri ve beyaz cevherdeki değişikliklerle uyumludur.[72] Ödül görevleri sırasında sinirsel tepki, tek kutuplu depresyonu bipolar depresyondan ayırır, ilki azalmış sinir tepkisi ile, ikincisi ise yüksek sinir tepkisi ile ilişkilidir.[73] Yetişkinleri ve ergenleri karşılaştıran işlevsel beyin görüntülemenin bir ALE meta analizi, yetişkinlere göre ergenlerde ön singulat kortekste daha yüksek derecede hipoaktivitenin yanı sıra, inferior frontal girus ve prekuneusta daha büyük bir hiperaktivite derecesi buldu.[74]
Duygudurum durumuna bakılmaksızın, yanıt engelleme görevleri sırasında, bipolar bozukluğu olan kişiler sağ inferior frontal girusu az aktif hale getirir. Ötimiye özgü değişiklikler, sol üst temporal girustaki hiperaktivasyonları ve bazal gangliyonlardaki hipoaktivasyonları içerir ve maniye özgü değişiklikler, bazal ganglionlardaki hiperaktivasyonu içerir.[75] FMRI çalışmalarının bir meta analizi, inferior frontal girus ve Putamen ve hiperaktivasyonu parahipokampus, hipokampus ve amigdala. Mani ve ötimi için duruma özgü anormallikler bildirilmiştir. Mani sırasında, alt frontal girusta hipoaktivasyon önemliyken, ötimia lingual girusun hipoaktivasyonu ve amigdalanın hiperaktivasyonu ile ilişkiliydi.[68]
İlgi bölgesi (istatistiksel parametrik haritalamanın aksine) analizini kullanan bir meta analiz, ötimik, depresif ve manik denekler için paradigmalar arasında anormallikler bildirdi. Bipolar manide, üst, orta ve alt frontal girusta azalmış aktivite bildirilirken, parahipokampal, superior temporal, orta temporal ve alt temporal girri. Bipolar depresyonda, sgACC, ACC ve orta frontal girusta azalmış aktivite bildirilmiştir. Ötimide, dlPFC, vlPFC ve ACC'de azalmış aktivite bildirilirken, amigdalada artan aktivite bildirilmiştir. Duygusal yüzlere tepkiyi inceleyen çalışmalarda, hem mani hem de ötiminin artmış amigdala aktivitesi ile ilişkili olduğu bildirildi.[76]
Yüz duygularını içeren paradigmaları kullanan bipolar çalışmaların aktivasyon olasılığı tahmini meta analizi, sağlıklı kontrollere kıyasla aktivasyonda bir dizi artış ve azalma bildirmiştir. Parahipokampal girus, putamen ve pulvinar çekirdeklerde artmış aktivite bildirilirken, inferior frontal girusta bilateral olarak azalmış aktivite bildirilmiştir. Majör depresif bozuklukla karşılaştırıldığında, bipolar hastalar vACC'yi, pulvinar çekirdeği ve parahipokampus girus / amigdalayı daha fazla aktif hale getirirken, dACC'yi daha az aktive etti. Bipolar denekler, hem korkulu hem de mutlu ifadeler için parahipokampusu aşırı aktive ederken, kaudat ve putamen sırasıyla mutluluk ve korku için aşırı harekete geçirildi. Bipolar denekler, ACC'yi hem korkulu hem de mutlu ifadeler için yeterince aktif hale getirmezken, IFG yalnızca korkulu ifadeler için yetersiz kaldı. Bu sonuçlar, bipolar bozuklukta duygusal olarak dikkat çekici uyaranlarla artan bağlılığı yansıttığı şeklinde yorumlandı.[77]
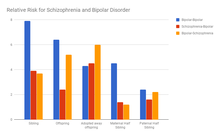
Spesifik semptomlar, şizofreninin yanı sıra bipolar bozukluktaki çeşitli nörogörüntüleme anormallikleriyle ilişkilendirilmiştir. Gerçek bozulma, düzensizlik ve psikomotor yoksulluk hem şizofrenide hem de bipolardaki prefrontal, talamik ve striatal bölgelerle ilişkilendirilmiştir (Tablo 1).[78]
| Belirti boyutu | Bipolar'da yer alan bölgeler | Şizofrenide yer alan bölgeler |
|---|---|---|
| Düzensizlik |
|
|
| Gerçeklik bozulması |
|
|
| Psikomotor yoksulluk |
|
|
Ön korteks
Literatürde, alt cins (sgACC) ve rostral (rACC) bölümleri büyük ölçüde ayrılmış olarak ACC'nin farklı bölgeleri incelenmiştir. SgACC'deki gri madde hacminin, bazı istisnalar olmakla birlikte, bipolar'da azaldığı bulunmuştur. Bununla birlikte, bipolar, tedavi ile normalleşen sgACC'de artan kan akışı ile ilişkilidir. Bu anormalliklerle birlikte, ölüm sonrası çalışmalarda gözlenen glial hücrelerde bir azalma ve muhtemelen hemisferik bir dengesizliği içeren beyaz cevherin bütünlüğünün azalmasıdır. RACC'deki bulgular büyük ölçüde sgACC (azaltılmış GM, artan metabolizma) ile aynıdır, ancak protein ekspresyonu ve nöronal morfoloji üzerine daha fazla çalışma yapılmıştır. RACC azaltılmış ekspresyon NMDA, kainat ve GABA ile ilgili proteinleri gösterir. Bu bulgular, MRS çalışmalarında artan Glx ile kanıtlandığı gibi, artan glutaminerjik aferentleri telafi ediyor olabilir. Bir DBH çalışması, dACC'de azalmış gri madde bildirdi. Bilişsel görevlerin fonksiyonel nörogörüntülemesi sırasında tutarsız sonuçlar bulunmuştur, hem azalmış hem de artmış aktivasyon gözlemlenmiştir. DACC'de azalmış nöron hacmi ve nöral yoğunlukta uyumlu bir artış bulundu. Sinirsel bağlantı belirteçlerinin azalmış ifadesi rapor edilmiştir (ör. sinaptofizin, GAP-43 ), bölgede gözlenen anormal yapısal bağlantı ile uyumludur.[79]
Orbitofrontal korteks, azalmış gri madde, fonksiyonel aktivite, GAD67 mRNA, katman I'deki nöronal hacim ve bipolar olan kişilerde mikroyapısal bütünlük.
Akut duygudurum durumlarının rolü bilinmemekle birlikte, gri cevher hacminin genellikle dlPFC'de azaldığı, dinlenme ve görevle uyandırılan fonksiyonel sinyaller olduğu bildirilmektedir. GABAegic nöronların miyelinleşme sinyalleri ve yoğunluğu da dlPFC'de, özellikle II-V katmanlarında azalır.[80]
Nörokimya
Manyetik rezonans spektroskopisi
İlaç durumuna bakılmaksızın küresel olarak artan kombine glutamin ve glutamat (Glx) gözlemlenmiştir.[81] Artan Glx, NMDA sinyallemesinde işlev bozukluğu olarak yorumlanan, önden yanlış eşleşme olumsuzluğunun azalmasıyla ilişkilendirilmiştir.[82] N-asetil aspartat Bipolar bozuklukta bazal gangliyondaki seviyeler azalır ve artış eğilimi dorsolateral prefrontal korteks. NAA'dan kreatin hipokampta oranlar azalır.[83]
Bir inceleme manyetik rezonans spektroskopisi çalışmalar artış bildirdi kolin bazal ganglionlarda ve singulatta ve dlPFC ve hipokampusta NAA'da azalma. Eyalete özgü bulguların, yüksek fosfomonoesterler akut ruh hali durumlarında ve azalmış inositol tedavi ile.[84] Başka bir derlemede, bazal gangliyonlarda ve frontal, temporal ve singulat bölgelerde inositol anormallikleri bildirilmiştir.[85] DlPFC'de artan NAA konsantrasyonlarına doğru bir eğilim bulgusu, lityum veya valproat ile tedavinin null bulgulara ve hatta frontal kortekste yüksek NAA seviyelerine yol açtığı kaydedildiği için ilaç durumuna bağlı olabilir. İlaçsız popülasyonlarda, azalmış NAA, prefrontal kortekste, özellikle dlPFC'de sürekli olarak bulunur.[86]
Bir meta analiz, bipolar bozuklukta MRS ile ölçülen GABA'da değişiklik olmadığını bildirmiştir.[87]
Monoaminler
İle ilgili çeşitli hipotezler monoaminler önerilmiştir. Biyojenik amin hipotezi, bipolar ve afektif bozuklukların altında monoaminlerin genel düzensizliğini ortaya koymaktadır. Kolinerjik aminerjik denge hipotezi, adrenerjik sinyale göre artmış kolinerjik aktivite oranının depresyonun altında yattığını, kolinerjik sinyale göre artmış adrenerjik sinyalin maninin altında yattığını varsayar. Müsamahakâr hipotez, serotoninin gerekli olduğunu ancak duygusal semptomlar için yeterli olmadığını ve azalmış serotonerjik tonunun hem depresyon hem de manide yaygın olduğunu öne sürüyor.[88]
Bağlanma potansiyeli çalışmaları dopamin reseptörü D2 ve dopamin taşıyıcı tutarsızdı ama dopamin reseptörü D1 bağlanma potansiyelinin azaldığı gözlenmiştir. Dopamin salgılayan ilaçlar, maniye benzer etkiler yaratır ve bazılarının, maninin artmış katekolaminerjik sinyali içerdiğini varsaymasına yol açar. Dopamin ayrıca genetik yolla bulaşmıştır. "ters çeviri" azaltılmış DAT işlevselliği ile manik semptomlar arasında bir ilişki gösteren çalışmalar. Muskarinik reseptörlerin bağlanma potansiyeli, depresyon sırasında ve ayrıca ölüm sonrası çalışmalarda kolinerjik aminerjik denge hipotezini destekleyerek in vivo azalır.[89]
Monoaminlerin bipolardaki rolü, nörotransmiter metabolitleri kullanılarak incelenmiştir. Azaltılmış konsantrasyon homovanillic asit dopaminin birincil metaboliti Beyin omurilik sıvısı Depresyonu olan kişilerin (CSF) sürekli olarak rapor edilmektedir. Bu bulgu psikomotor gerilik ve anhedoni ile ilişkilidir. Ayrıca, Parkinson hastalığı yüksek depresyon oranları ile ilişkilidir ve bir vaka çalışması manik ataklar sırasında parkinson semptomlarının ortadan kalktığını bildirmiştir. The binding potential of VMAT2 is also elevated in bipolar I patients with a history of psychosis, although this finding is inconsistent with finding that valproate increases VMAT2 expression in rodents.[90] Üzerine bir çalışma DAT binding in acutely depressed people with bipolar reported reductions in the caudate but not putamen.[91]
Studies of serotonin's primary metabolite 5-SED have been inconsistent,[92] although limited evidence points towards reduced central serotonin signaling in a subgroup of aggressive or suicidal patients.[90] Studies assessing the binding potential of the serotonin transporter or serotonin receptors have also been inconsistent, but generally point towards abnormal serotonin signalling.[93] One study reported both increased SERT binding in the insula, mPFC, ACC and thalamus, and decreased SERT binding in the raphe çekirdekleri in acutely depressed bipolar.[91] Serotonin may play a role in mania by increasing the salience of stimuli related to reward.[94]
One more line of evidence that suggests a role of monoamines in bipolar is the process of antidepressant related affective switches. Seçici serotonin geri alım inhibitörleri and more frequently, trisiklik antidepresanlar are associated with between a 10%-70% risk of affective switch from depression to mania or hypomania, depending upon the criteria used. The more robust association between TCAs and affective switches, as opposed to more selective drugs, has been interpreted as indicating that more extensive perturbation in monoamine systems is associated with more frequent mood switching.[95]
Hypothalamic pituitary adrenal axis
Bipolar disorder is associated with elevated basal and deksametazon ortaya çıkan kortizol ve adrenocorticotropic hormone (ACTH). These abnormalities are particularly prominent in mania, and are inversely associated with antipsychotic use.[96] The incidence of psychiatric symptoms associated with kortikosteroidler is between 6% and 32%. Corticosteroids may precipitate mania, supporting the role of the HPA axis in affective episodes.[95] Measures from urinary versus salivary cortisol have been contradictory, with one study of the former concluding that HPA hyperactivity was a trait marker, while a study of the latter concluded that no difference in HPA activity exists in remission.[97] Measurement during the morning are thought to be more sensitive due to the cortisol awakening response. Studies are generally more consistent, and observe HPA hyperactivity.[97]
Nörotrofik faktörler
Brain derived neurotrophic factor levels are peripherally reduced in both manic and depressive phases.[98]
Hücre içi sinyalleşme
Seviyeleri Gαs but not other G proteins is increased in the frontal, temporal and occipital cortices. The binding of serotonin receptors to G proteins is also elevated globally. Leukocyte and platelet levels of Gαs ve Gαi is also elevated in those with bipolar disorder. Downstream targets of G protein signaling is also altered in bipolar disorder. Artan seviyeleri adenilil siklaz, protein kinaz A (PKA), and siklik adenozin monofosfat induced PKA activity are also reported. Phosphoinositide signaling is also altered, with elevated levels of fosfolipaz C, protein kinaz C, ve Gαq being reported in bipolar.[99] Elevated cAMP stimulated phosphorylation or Rap1 (a substrate of PKA), along with increased levels of Rap1 have been reported in peripherally collected cells of people with bipolar. Increased coupling of serotonin reseptörleri to G proteins has been observed. While linkage studies performed on genes related to G protein signaling, as well as studies on post mortem mRNA concentration fail to report an association with bipolar disorder, the overall evidence suggests abnormal coupling of neurotransmission systems with G proteins.[100]
Mania may be specifically associated with protein kinaz C hyperactivity, although most evidence for this mechanism is indirect. The gene DGKH has been reported in genome wide association studies to be related to bipolar disorder, and it is known to be involved in PKC regulation. Manipulation of PKC in animals produces behavioral phenotypes similar to mania, and PKC inhibition is a plausible mechanism of action for mood stabilizers. Overactive PKC signalling may lead to long term structural changes in the frontal cortex as well, potentially leading to progression of manic symptoms.[101][102]
Glikojen sentaz kinaz 3 has been implicated in bipolar disorder, as bipolar medications lithium and valproat have been shown to increase its phosphorylation, thereby inhibiting it. However, some postmortem studies have not shown any differences in GSK-3 levels or the levels of a downstream target β-katenin.[99] In contrast, one review reported a number of studies observing reduced expression of β-catenin and GSK3 mRNA in the prefrontal and temporal cortex.[103]
Excessive response of arakidonik asit signaling cascades in response to stimulation by dopamine receptor D2 or NMDA receptors may be involved in bipolar mania. The evidence for this is primarily pharmacological, based on the observation that drugs that are effective in treating bipolar reduced AA cascade magnitude, while drugs that exacerbate bipolar do the opposite.[104]
Calcium homeostasis may be impaired across all mood states. Elevated basal intracellular, and provoked calcium concentrations in platelets and transformed lymphoblasts are found in people with bipolar. Serum concentrations of calcium are also elevated, and abnormal calcium concentrations in response to stimulation of olfactory neurons is also observed. These findings are congruent with the genetic association of bipolar with CACNAC1, an L-type calcium channel,[100] as well as the efficacy of anti-epileptic agents.[105] Normal platelets placed in plasma from people with bipolar disorder do not demonstrate elevated levels of intracellular calcium, indicating that dysfunction lies intracellularly. One possible mechanism is that elevated inositol triphosphate (IP3) caused by hyperactive neuronal calcium sensor 1 causes excessive calcium release.[30] Serum levels of S100B (a calcium binding protein) are elevated in bipolar mania.[106]
Mitokondriyal disfonksiyon
Some researchers have suggested bipolar disorder is a mitochondrial disease. Some cases of familial kronik ilerleyici dış oftalmopleji demonstrate increased rates of bipolar disorder before the onset of CPEO, and the higher rate of maternal inheritance patterns support this hypothesis.[107] Downregulation of genes encoding for mitochondrial subunits, decreased concentration of phosphocreatine, decreased brain pH, and elevated laktat concentrations have also been reported. Mitochondrial dysfunction may be related to elevated levels of the lipid peroxidation marker thiobarbituric acid reactive substances, which are attenuated by lithium treatment.[108]
Nöropatoloji
A number of abnormalities in GABAergic neurons have been reported in people with bipolar disorder. People with bipolar demonstrate reduced expression of GAD67 içinde CA3/CA2 alt bölgesi hipokamp. More extensive reductions of other indicators of GABA function have been reported in the CA4 and CA1. Abnormal expression of kainate receptors on GABAergic cells have been reported, with reductions in GRIK1 ve GRIK2 mRNA in the CA2/CA3 being found in people with bipolar. Decreased levels of HCN kanalları have also been reported, which, along with abnormal glutamate signaling, could contribute to reduced GABAergic tone in the hippocampus.[109]
The observation of increased Glx in the prefrontal cortex is congruent with the observation of reduced glial cell counts and prefrontal cortex volume, as glia play an important role in glutamate homeostasis.[110] Although the number and quality of studies examining NMDA receptor subunits is poor, evidence for reduced NMDA signaling and reduced contribution from the NR2A subunit is consistent.[111]
Decreased neuron density and soma size in the ACC and dlPFC has been observed. The dlPFC also demonstrates reduced glial density, a finding that is less consistent in the ACC. The reduction in cell volume may be due to early stage apoptosis, a mechanism that is supported by studies observing reduced anti-apoptotic gene expression in both peripheral cells and neurons, as well as the reduction in BDNF that is consistently found in bipolar.[112] Reductions in cortical glia are not found across the whole cortex (e.g. somatosensory areas demonstrate normal glial density and counts), indicating that systematic dysfunction in glial cells is not likely; rather, abnormal functionality of connectivity in specific regions may result in abnormal glia, which may in turn exacerbate dysfunction.[113]
Dendritic atrophy and loss of oligodendrositler is found in the medial prefrontal cortex, and is possibly specific to GABAergic neurons.[114]
Bağışıklık disfonksiyonu
Elevated levels of IL-6, C-reaktif protein (CRP) ve TNFα have been reported in bipolar. Levels of some (IL-6 and CRP) but not all (TNFα) may be reduced by treatment. Increases in IL-6 have been reported in mood episodes, regardless of polarity.[115] Inflammation has been consistently reported in bipolar disorder, and the progressive nature lies in dysregulation of NF-κB.[116]
Referanslar
- ^ Townsend, J; Altshuler, LL (June 2012). "Emotion processing and regulation in bipolar disorder: a review". Bipolar Bozukluklar. 14 (4): 326–39. doi:10.1111/j.1399-5618.2012.01021.x. PMID 22631618.
- ^ Newberg, AR; Catapano, LA; Zarate, CA; Manji, HK (January 2008). "Neurobiology of bipolar disorder". Nöroterapötiklerin Uzman Değerlendirmesi. 8 (1): 93–110. doi:10.1586/14737175.8.1.93. PMID 18088203.
- ^ Maletic, V; Raison, C (2014). "Integrated neurobiology of bipolar disorder". Psikiyatride Sınırlar. 5: 98. doi:10.3389 / fpsyt.2014.00098. PMC 4142322. PMID 25202283.
- ^ Cousins, DA; Grunze, H (March 2012). "Interpreting magnetic resonance imaging findings in bipolar disorder". CNS Neuroscience & Therapeutics. 18 (3): 201–7. doi:10.1111/j.1755-5949.2011.00280.x. PMC 6493435. PMID 22449107.
- ^ Buxbaum, Joseph; Charney, Dennis; Sklar, Pamela; Nestler, Eric. Charney & Nestler'in Ruhsal Hastalık Nörobiyolojisi. Oxford University Press. s. 162.
- ^ a b Sklar, P. "The Genetics of Schizophrenia and Bipolar Disorder". In Charney, D; Buxmaum, J; Nestler, E (eds.). Akıl Hastalığının Nörobiyolojisi. Oxford University Press.
- ^ Bearden, C; Zandi, P; Freimer, N. "Molecular Architecture and Neurobiology of Bipolar Disorder". In Lehner, T; Miller, B; State, M (eds.). Genomics, Circuits, and Pathways in Neuropsychiatry. Elsevier.
- ^ Ferreira, MA; O'Donovan, MC; Meng, YA; Jones, IR; Ruderfer, DM; Jones, L; Fan, J; Kirov, G; Perlis, RH; Green, EK; Smoller, JW; Grozeva, D; Stone, J; Nikolov, I; Chambert, K; Hamshere, ML; Nimgaonkar, VL; Moskvina, V; Thase, ME; Caesar, S; Sachs, GS; Franklin, J; Gordon-Smith, K; Ardlie, KG; Gabriel, SB; Fraser, C; Blumenstiel, B; Defelice, M; Breen, G; Gill, M; Morris, DW; Elkin, A; Muir, WJ; McGhee, KA; Williamson, R; MacIntyre, DJ; MacLean, AW; St, CD; Robinson, M; Van Beck, M; Pereira, AC; Kandaswamy, R; McQuillin, A; Collier, DA; Bass, NJ; Young, AH; Lawrence, J; Ferrier, IN; Anjorin, A; Farmer, A; Curtis, D; Scolnick, EM; McGuffin, P; Daly, MJ; Corvin, AP; Holmans, PA; Blackwood, DH; Gurling, HM; Owen, MJ; Purcell, SM; Sklar, P; Craddock, N; Wellcome Trust Case Control, Consortium. (Eylül 2008). "Collaborative genome-wide association analysis supports a role for ANK3 and CACNA1C in bipolar disorder". Doğa Genetiği. 40 (9): 1056–8. doi:10.1038/ng.209. PMC 2703780. PMID 18711365.
- ^ Charney, AW; Ruderfer, DM; Stahl, EA; Moran, JL; Chambert, K; Belliveau, RA; Forty, L; Gordon-Smith, K; Di Florio, A; Lee, PH; Bromet, EJ; Buckley, PF; Escamilla, MA; Fanous, AH; Fochtmann, LJ; Lehrer, DS; Malaspina, D; Marder, SR; Morley, CP; Nicolini, H; Perkins, DO; Rakofsky, JJ; Rapaport, MH; Medeiros, H; Sobell, JL; Green, EK; Backlund, L; Bergen, SE; Juréus, A; Schalling, M; Lichtenstein, P; Roussos, P; Knowles, JA; Jones, I; Jones, LA; Hultman, CM; Perlis, RH; Purcell, SM; McCarroll, SA; Pato, CN; Pato, MT; Craddock, N; Landén, M; Smoller, JW; Sklar, P (10 January 2017). "Evidence for genetic heterogeneity between clinical subtypes of bipolar disorder". Çeviri Psikiyatrisi. 7 (1): e993. doi:10.1038/tp.2016.242. PMC 5545718. PMID 28072414.
- ^ Psychiatric GWAS Consortium Bipolar Disorder Working, Group. (18 September 2011). "Large-scale genome-wide association analysis of bipolar disorder identifies a new susceptibility locus near ODZ4". Doğa Genetiği. 43 (10): 977–83. doi:10.1038/ng.943. PMC 3637176. PMID 21926972.
- ^ Mühleisen, TW; Leber, M; Schulze, TG; Strohmaier, J; Degenhardt, F; Treutlein, J; Mattheisen, M; Forstner, AJ; Schumacher, J; Breuer, R; Meier, S; Herms, S; Hoffmann, P; Lacour, A; Witt, SH; Reif, A; Müller-Myhsok, B; Lucae, S; Maier, W; Schwarz, M; Vedder, H; Kammerer-Ciernioch, J; Pfennig, A; Bauer, M; Hautzinger, M; Moebus, S; Priebe, L; Czerski, PM; Hauser, J; Lissowska, J; Szeszenia-Dabrowska, N; Brennan, P; McKay, JD; Wright, A; Mitchell, PB; Fullerton, JM; Schofield, PR; Montgomery, GW; Medland, SE; Gordon, SD; Martin, NG; Krasnow, V; Chuchalin, A; Babadjanova, G; Pantelejeva, G; Abramova, LI; Tiganov, AS; Polonikov, A; Khusnutdinova, E; Alda, M; Grof, P; Rouleau, GA; Turecki, G; Laprise, C; Rivas, F; Mayoral, F; Kogevinas, M; Grigoroiu-Serbanescu, M; Propping, P; Becker, T; Rietschel, M; Nöthen, MM; Cichon, S (11 March 2014). "Genome-wide association study reveals two new risk loci for bipolar disorder". Doğa İletişimi. 5: 3339. Bibcode:2014NatCo...5.3339M. doi:10.1038/ncomms4339. PMID 24618891.
- ^ Chen, DT; Jiang, X; Akula, N; Shugart, YY; Wendland, JR; Steele, CJ; Kassem, L; Park, JH; Chatterjee, N; Jamain, S; Cheng, A; Leboyer, M; Muglia, P; Schulze, TG; Cichon, S; Nöthen, MM; Rietschel, M; BiGS.; McMahon, FJ; Farmer, A; McGuffin, P; Craig, I; Lewis, C; Hosang, G; Cohen-Woods, S; Vincent, JB; Kennedy, JL; Strauss, J (February 2013). "Genome-wide association study meta-analysis of European and Asian-ancestry samples identifies three novel loci associated with bipolar disorder". Moleküler Psikiyatri. 18 (2): 195–205. doi:10.1038/mp.2011.157. PMID 22182935.
- ^ Craddock, N; Sklar, P (11 May 2013). "Genetics of bipolar disorder". Lancet. 381 (9878): 1654–62. doi:10.1016/S0140-6736(13)60855-7. PMID 23663951.
- ^ Kishi, T; Yoshimura, R; Fukuo, Y; Kitajima, T; Okochi, T; Matsunaga, S; Inada, T; Kunugi, H; Kato, T; Yoshikawa, T; Ujike, H; Umene-Nakano, W; Nakamura, J; Ozaki, N; Serretti, A; Correll, CU; Iwata, N (November 2011). "The CLOCK gene and mood disorders: a case-control study and meta-analysis". Kronobiyoloji Uluslararası. 28 (9): 825–33. doi:10.3109/07420528.2011.609951. PMID 22080789.
- ^ McCarthy, MJ; Nievergelt, CM; Kelsoe, JR; Welsh, DK (2012). "A survey of genomic studies supports association of circadian clock genes with bipolar disorder spectrum illnesses and lithium response". PLOS One. 7 (2): e32091. Bibcode:2012PLoSO...732091M. doi:10.1371/journal.pone.0032091. PMC 3285204. PMID 22384149.
- ^ Jiang, HY; Qiao, F; Xu, XF; Yang, Y; Bai, Y; Jiang, LL (9 August 2013). "Meta-analysis confirms a functional polymorphism (5-HTTLPR) in the serotonin transporter gene conferring risk of bipolar disorder in European populations". Sinirbilim Mektupları. 549: 191–6. doi:10.1016/j.neulet.2013.05.065. PMID 23756178.
- ^ Gao, J; Jia, M; Qiao, D; Qiu, H; Sokolove, J; Zhang, J; Pan, Z (March 2016). "TPH2 gene polymorphisms and bipolar disorder: A meta-analysis". Amerikan Tıbbi Genetik Dergisi. Bölüm B, Nöropsikiyatrik Genetik. 171 M (2): 145–52. doi:10.1002 / ajmg.b.32381. PMID 26365518.
- ^ Grunze, H. "Bipolar Disorder". In Zigmond, M; Rowland, L; Coyle, J (eds.). Neurobiology of Brain Disorder: Biological Basis of Neurological and Psychiatric Disorders. Elsevier.
- ^ Harrison, PJ (February 2016). "Molecular neurobiological clues to the pathogenesis of bipolar disorder". Nörobiyolojide Güncel Görüş. 36: 1–6. doi:10.1016/j.conb.2015.07.002. PMC 4779149. PMID 26210959.
- ^ Wang, Z; Li, Z; Gao, K; Fang, Y (24 December 2014). "Association between brain-derived neurotrophic factor genetic polymorphism Val66Met and susceptibility to bipolar disorder: a meta-analysis". BMC Psikiyatri. 14: 366. doi:10.1186/s12888-014-0366-9. PMC 4297385. PMID 25539739.
- ^ González-Castro, TB; Nicolini, H; Lanzagorta, N; López-Narváez, L; Genis, A; Pool García, S; Tovilla-Zárate, CA (February 2015). "The role of brain-derived neurotrophic factor (BDNF) Val66Met genetic polymorphism in bipolar disorder: a case-control study, comorbidities, and meta-analysis of 16,786 subjects". Bipolar Bozukluklar. 17 (1): 27–38. doi:10.1111/bdi.12227. PMID 25041243.
- ^ Torkamani, A; Topol, EJ; Schork, NJ (November 2008). "Genom çapında ilişki ile değerlendirilen yedi yaygın hastalığın yol analizi". Genomik. 92 (5): 265–72. doi:10.1016 / j.ygeno.2008.07.011. PMC 2602835. PMID 18722519.
- ^ Pedroso, I; Lourdusamy, A; Rietschel, M; Nöthen, MM; Cichon, S; McGuffin, P; Al-Chalabi, A; Barnes, MR; Breen, G (15 August 2012). "Common genetic variants and gene-expression changes associated with bipolar disorder are over-represented in brain signaling pathway genes" (PDF). Biyolojik Psikiyatri. 72 (4): 311–7. doi:10.1016 / j.biopsych.2011.12.031. PMID 22502986.
- ^ Nurnberger JI, Jr; Koller, DL; Jung, J; Edenberg, HJ; Foroud, T; Guella, I; Vawter, MP; Kelsoe, JR; Psychiatric Genomics Consortium Bipolar, Group. (Haziran 2014). "Bipolar bozukluk için yolların belirlenmesi: bir meta-analiz". JAMA Psikiyatri. 71 (6): 657–64. doi:10.1001 / jamapsychiatry.2014.176. PMC 4523227. PMID 24718920.
- ^ Frans EM, Sandin S, Reichenberg A, Lichtenstein P, Långström N, Hultman CM (2008). "Advancing Paternal Age and Bipolar Disorder". Genel Psikiyatri Arşivleri. 65 (9): 1034–1040. doi:10.1001/archpsyc.65.9.1034. PMID 18762589.
- ^ a b Young, JW; Dulcis, D (15 July 2015). "Bipolar bozuklukta durumlar arasında geçişin altında yatan mekanizmanın / mekanizmaların araştırılması". Avrupa Farmakoloji Dergisi. 759: 151–62. doi:10.1016 / j.ejphar.2015.03.019. PMC 4437855. PMID 25814263.
- ^ Smith, Daniel; Whitham, Elizabeth; Ghaemi, Nassir (2012). "Bipolar Disorder". In Schlaepfer, Thomas; Nemeroff, Charles (eds.). Neurobiology of Psychiatric Disorders (1. baskı). Elsevier. ISBN 9780444535009.
- ^ Bostock, EC; Kirkby, KC; Garry, MI; Taylor, BV (1 September 2015). "Comparison of precipitating factors for mania and partial seizures: Indicative of shared pathophysiology?". Duygusal Bozukluklar Dergisi. 183: 57–67. doi:10.1016/j.jad.2015.04.057. PMID 26001664.
- ^ a b Satzer, D; Bond, DJ (May 2016). "Mania secondary to focal brain lesions: implications for understanding the functional neuroanatomy of bipolar disorder". Bipolar Bozukluklar. 18 (3): 205–20. doi:10.1111/bdi.12387. PMID 27112231.
- ^ a b Dubovsky, SL (June 2015). "Mania". Devamlılık (Minneapolis, Minn.). 21 (3 Behavioral Neurology and Neuropsychiatry): 737–55. doi:10.1212/01.CON.0000466663.28026.6f. PMID 26039851.
- ^ Manji & Zarate 2011, s. 200.
- ^ Strakowski, Stephen M (2014). "Neurophysiology of Bipolar Disorder". Bipolar bozukluk. New York: Oxford University Press. s. 36. ISBN 9780199995684.
- ^ Strakowski, SM; Adler, CM; Almeida, J; Altshuler, LL; Blumberg, HP; Chang, KD; DelBello, MP; Frangou, S; McIntosh, A; Phillips, ML; Sussman, JE; Townsend, JD (Haziran 2012). "Bipolar bozukluğun fonksiyonel nöroanatomisi: bir fikir birliği modeli". Bipolar Bozukluklar. 14 (4): 313–25. doi:10.1111 / j.1399-5618.2012.01022.x. PMC 3874804. PMID 22631617.
- ^ Cerullo, MA; Adler, CM; Delbello, MP; Strakowski, SM (2009). "The functional neuroanatomy of bipolar disorder". International Review of Psychiatry (Abingdon, England). 21 (4): 314–22. doi:10.1080/09540260902962107. PMID 20374146.
- ^ DelBello, MP; Adler, CM; Strakowski, SM (April 2006). "The neurophysiology of childhood and adolescent bipolar disorder". CNS Spektrumları. 11 (4): 298–311. doi:10.1017/s1092852900020794. PMID 16641835.
- ^ Strakowski, SM; Delbello, MP; Adler, CM (January 2005). "The functional neuroanatomy of bipolar disorder: a review of neuroimaging findings". Moleküler Psikiyatri. 10 (1): 105–16. doi:10.1038/sj.mp.4001585. PMID 15340357.
- ^ Adler, CM; DelBello, MP; Strakowski, SM (April 2006). "Brain network dysfunction in bipolar disorder". CNS Spektrumları. 11 (4): 312–20, quiz 323–4. doi:10.1017/s1092852900020800. PMID 16641836.
- ^ a b Strakowski, Stephen M. (2011). "Structural Imaging of Bipolar Illness". In Shenton, Martha E; Turetsky, Bruce I (eds.). Understanding Neuropsychiatric Disorders: Insights From Neuroimaging. New York: Cambridge University Press. ISBN 9780521899420.
- ^ Yeşil, MJ; Cahill, CM; Malhi, GS (November 2007). "The cognitive and neurophysiological basis of emotion dysregulation in bipolar disorder". Duygusal Bozukluklar Dergisi. 103 (1–3): 29–42. doi:10.1016/j.jad.2007.01.024. PMID 17328959.
- ^ a b Blond, BN; Fredericks, CA; Blumberg, HP (June 2012). "Functional neuroanatomy of bipolar disorder: structure, function, and connectivity in an amygdala-anterior paralimbic neural system". Bipolar Bozukluklar. 14 (4): 340–55. doi:10.1111/j.1399-5618.2012.01015.x. PMC 3880745. PMID 22631619.
- ^ Wiglusz, MS; Landowski, J; Cubała, WJ; Agius, M (September 2015). "Overlapping phenomena of bipolar disorder and epilepsy--a common pharmacological pathway". Psychiatria Danubina. 27 Suppl 1: S177–81. PMID 26417756.
- ^ Mazza, M; Di Nicola, M; Della Marca, G; Janiri, L; Bria, P; Mazza, S (August 2007). "Bipolar disorder and epilepsy: a bidirectional relation? Neurobiological underpinnings, current hypotheses, and future research directions". The Neuroscientist : A Review Journal Bringing Neurobiology, Neurology and Psychiatry. 13 (4): 392–404. doi:10.1177/10738584070130041101. PMID 17644769.
- ^ Brooks, John O; Wang, PoW; Ketter, Terence A (2010). "Functional Brain Imaging Studies in Bipolar Disorder: Focus on Cerebral Metabolism and Blood Flow". In Yatham, Lakshmi N; Maj, Mario (eds.). Bipolar Disorder: Clinical and Neurobiology Foundations. Wiley Blackwell. ISBN 9780470721988.
- ^ Fredericks, Carolyn A; Kalmar, Jessica H; Blumberg, Hilary P (2006). "The role of the ventral prefrontal cortex in mood disorders". In Zald, David H; Rauch, Scott L (eds.). The Orbitofrontal Cortex. New York: Oxford University Press. s. 552–553. ISBN 978-0198565741.
- ^ Murphy, F. C.; Sahakian, B. J. (2001). "Neuropsychology of bipolar disorder". İngiliz Psikiyatri Dergisi. 178 (S41): s120–s127. doi:10.1192/bjp.178.41.s120.
- ^ Clark, L; Sahakian, BJ (2008). "Bipolar bozuklukta bilişsel sinirbilim ve beyin görüntüleme". Klinik Sinirbilimde Diyaloglar. 10 (2): 153–63. PMC 3181872. PMID 18689286.
- ^ Hegerl, Ulrich; Sander, Christian; Hensch, Tilman. "Arousal Regulation in Affective Disorders". In Frodl, Thomas (ed.). Systems Neuroscience in Depression. Elsevier Science. s. 353.
In conclusion, stimulants in bipolar disorder seem to be relatively safe, and there are even several case reports suggesting rapid antimanic effects of psychostimulants (Beckmann & Heinemann, 1976; Garvey, Hwang, Teubner-Rhodes, Zander, & Rhem, 1987; Max, Richards, & Hamdanallen, 1995). In a study by Bschor, Müller-Oerlinghausen, and Ulrich (2001), improvement of manic symptoms occurred about 2 h after oral intake of methylphenidate in a manic patient with signs of unstable EEG-vigilance regulation. Three months later, when the patient was admitted anew, a rapid antimanic effect was again shown after re-exposition to methylphenidate
- ^ van Enkhuizen, J; Geyer, MA; Minassian, A; Perry, W; Henry, BL; Young, JW (November 2015). "Investigating the underlying mechanisms of aberrant behaviors in bipolar disorder from patients to models: Rodent and human studies". Nörobilim ve Biyodavranışsal İncelemeler. 58: 4–18. doi:10.1016/j.neubiorev.2015.08.008. PMC 4684462. PMID 26297513.
- ^ Edge, MD; Johnson, SL; Ng, T; Carver, CS (15 August 2013). "Iowa Gambling Task performance in euthymic bipolar I disorder: a meta-analysis and empirical study". Duygusal Bozukluklar Dergisi. 150 (1): 115–22. doi:10.1016/j.jad.2012.11.027. PMC 3716836. PMID 23219060.
- ^ a b Alloy, LB; Nusslock, R; Boland, EM (2015). "The development and course of bipolar spectrum disorders: an integrated reward and circadian rhythm dysregulation model". Klinik Psikolojinin Yıllık Değerlendirmesi. 11: 213–50. doi:10.1146/annurev-clinpsy-032814-112902. PMC 4380533. PMID 25581235.
- ^ Rizvi, SJ; Lambert, C; Kennedy, S (8 March 2018). "Presentation and Neurobiology of Anhedonia in Mood Disorders: Commonalities and Distinctions". Güncel Psikiyatri Raporları. 20 (2): 13. doi:10.1007/s11920-018-0877-z. PMID 29520717.
- ^ Whitton, AE; Treadway, MT; Pizzagalli, DA (January 2015). "Reward processing dysfunction in major depression, bipolar disorder and schizophrenia". Psikiyatride Güncel Görüş. 28 (1): 7–12. doi:10.1097/YCO.0000000000000122. PMC 4277233. PMID 25415499.
- ^ a b Hibar, D P; Westlye, L T; Doan, N T; Jahanshad, N; Cheung, J W; Ching, C R K; Versace, A; Bilderbeck, A C; Uhlmann, A; Mwangi, B; Krämer, B; Overs, B; Hartberg, C B; Abé, C; Dima, D; Grotegerd, D; Sprooten, E; Bøen, E; Jimenez, E; Howells, F M; Delvecchio, G; Temmingh, H; Starke, J; Almeida, J R C; Goikolea, J M; Houenou, J; Beard, L M; Rauer, L; Abramovic, L; et al. (2 Mayıs 2017). "Cortical abnormalities in bipolar disorder: an MRI analysis of 6503 individuals from the ENIGMA Bipolar Disorder Working Group". Moleküler Psikiyatri. 23 (4): 932–942. doi:10.1038/mp.2017.73. PMC 5668195. PMID 28461699.
- ^ Usher, J; Leucht, S; Falkai, P; Scherk, H (30 April 2010). "Correlation between amygdala volume and age in bipolar disorder - a systematic review and meta-analysis of structural MRI studies". Psikiyatri Araştırması. 182 (1): 1–8. doi:10.1016/j.pscychresns.2009.09.004. PMID 20226638.
- ^ Pfeifer, JC; Welge, J; Strakowski, SM; Adler, CM; DelBello, MP (November 2008). "Meta-analysis of amygdala volumes in children and adolescents with bipolar disorder". Amerikan Çocuk ve Ergen Psikiyatrisi Akademisi Dergisi. 47 (11): 1289–98. doi:10.1097/CHI.0b013e318185d299. PMID 18827720.
- ^ Strakowski, Stephen M (2014). "Neurophysiology of Bipolar Disorder". Bipolar bozukluk. New York: Oxford University Press. s. 35. ISBN 9780199995684.
- ^ Brambilla, Paolo; Soares, Jair (2010-10-11). "Structural Brain Imaging in Bipolar Disorder". In Lakshmi, Yatham; Maj, Mario (eds.). Bipolar Disorder: Clinical and Neurobiology Foundations. Wiley Blackwell. ISBN 978-0-470-72198-8.
- ^ Wise, T; Radua, J; Via, E; Cardoner, N; Abe, O; Adams, TM; Amico, F; Cheng, Y; Cole, JH; de Azevedo Marques Périco, C; Dickstein, DP; Farrow, TFD; Frodl, T; Wagner, G; Gotlib, IH; Gruber, O; Ham, BJ; Job, DE; Kempton, MJ; Kim, MJ; Koolschijn, PCMP; Malhi, GS; Mataix-Cols, D; McIntosh, AM; Nugent, AC; O'Brien, JT; Pezzoli, S; Phillips, ML; Sachdev, PS; Salvadore, G; Selvaraj, S; Stanfield, AC; Thomas, AJ; van Tol, MJ; van der Wee, NJA; Veltman, DJ; Young, AH; Fu, CH; Cleare, AJ; Arnone, D (October 2017). "Common and distinct patterns of grey-matter volume alteration in major depression and bipolar disorder: evidence from voxel-based meta-analysis". Moleküler Psikiyatri. 22 (10): 1455–1463. doi:10.1038/mp.2016.72. PMC 5622121. PMID 27217146.
- ^ Heckers, Stephan; Woodward, Neil; Öngür, Dost (2018). "Neuroimaging of Psychotic Disorders". In Sklar, Pamela; Charney, Dennis; Buxbaum, Joseph; Nestler, Eric (eds.). Akıl Hastalığının Nörobiyolojisi (5. baskı). Oxford University Press. ISBN 9780190681425.
- ^ Bora, E; Fornito, A; Yücel, M; Pantelis, C (1 June 2010). "Bipolar bozuklukta gri cevher anormalliklerinin Voxelwise meta-analizi". Biyolojik Psikiyatri. 67 (11): 1097–105. doi:10.1016/j.biopsych.2010.01.020. PMID 20303066.
- ^ Kempton, MJ; Geddes, JR; Ettinger, U; Williams, SC; Grasby, PM (September 2008). "Bipolar bozuklukta 98 yapısal görüntüleme çalışmasının meta analizi, veritabanı ve meta-regresyon". Genel Psikiyatri Arşivleri. 65 (9): 1017–32. doi:10.1001 / archpsyc.65.9.1017. PMID 18762588.
- ^ Arnone, D; Cavanagh, J; Gerber, D; Lawrie, SM; Ebmeier, KP; McIntosh, AM (September 2009). "Bipolar bozukluk ve şizofrenide manyetik rezonans görüntüleme çalışmaları: meta-analiz". İngiliz Psikiyatri Dergisi. 195 (3): 194–201. doi:10.1192 / bjp.bp.108.059717. PMID 19721106.
- ^ Selvaraj, S; Arnone, D; Job, D; Stanfield, A; Farrow, TF; Nugent, AC; Scherk, H; Gruber, O; Chen, X; Sachdev, PS; Dickstein, DP; Malhi, GS; Ha, TH; Ha, K; Phillips, ML; McIntosh, AM (March 2012). "Bipolar bozuklukta gri madde farklılıkları: voksel tabanlı morfometri çalışmalarının bir meta analizi". Bipolar Bozukluklar. 14 (2): 135–45. doi:10.1111 / j.1399-5618.2012.01000.x. PMID 22420589.
- ^ Nery, FG; Monkul, ES; Lafer, B (December 2013). "Gray matter abnormalities as brain structural vulnerability factors for bipolar disorder: A review of neuroimaging studies of individuals at high genetic risk for bipolar disorder". Avustralya ve Yeni Zelanda Psikiyatri Dergisi. 47 (12): 1124–35. doi:10.1177/0004867413496482. PMID 23864160.
- ^ Hibar, DP; Westlye, LT; van Erp, TG; Rasmussen, J; Leonardo, CD; Faskowitz, J; Haukvik, UK; Hartberg, CB; Doan, NT; Agartz, I; Dale, AM; Gruber, O; Krämer, B; Trost, S; Liberg, B; Abé, C; Ekman, CJ; Ingvar, M; Landén, M; Fears, SC; Freimer, NB; Bearden, CE; Costa Rica/Colombia Consortium for Genetic Investigation of Bipolar, Endophenotypes.; Sprooten, E; Glahn, DC; Pearlson, GD; Emsell, L; Kenney, J; Scanlon, C; McDonald, C; Cannon, DM; Almeida, J; Versace, A; Caseras, X; Lawrence, NS; Phillips, ML; Dima, D; Delvecchio, G; Frangou, S; Satterthwaite, TD; Wolf, D; Houenou, J; Henry, C; Malt, UF; Bøen, E; Elvsåshagen, T; Young, AH; Lloyd, AJ; Goodwin, GM; Mackay, CE; Bourne, C; Bilderbeck, A; Abramovic, L; Boks, MP; van Haren, NE; Ophoff, RA; Kahn, RS; Bauer, M; Pfennig, A; Alda, M; Hajek, T; Mwangi, B; Soares, JC; Nickson, T; Dimitrova, R; Sussmann, JE; Hagenaars, S; Whalley, HC; McIntosh, AM; Thompson, PM; Andreassen, OA (December 2016). "Subcortical volumetric abnormalities in bipolar disorder". Moleküler Psikiyatri. 21 (12): 1710–1716. doi:10.1038/mp.2015.227. PMC 5116479. PMID 26857596.
- ^ Hajek, T; Kopecek, M; Höschl, C; Alda, M (September 2012). "Smaller hippocampal volumes in patients with bipolar disorder are masked by exposure to lithium: a meta-analysis". Psikiyatri ve Sinirbilim Dergisi. 37 (5): 333–43. doi:10.1503/jpn.110143. PMC 3447132. PMID 22498078.
- ^ Pezzoli, S; Emsell, L; Yip, SW; Dima, D; Giannakopoulos, P; Zarei, M; Tognin, S; Arnone, D; James, A; Haller, S; Frangou, S; Goodwin, GM; McDonald, C; Kempton, MJ (January 2018). "Meta-analysis of regional white matter volume in bipolar disorder with replication in an independent sample using coordinates, T-maps, and individual MRI data". Nörobilim ve Biyodavranışsal İncelemeler. 84: 162–170. doi:10.1016/j.neubiorev.2017.11.005. PMC 5771263. PMID 29162519.
- ^ a b Chen, CH; Emzirme, J; Lennox, BR; Ooi, C; Bullmore, ET (Şubat 2011). "Bipolar bozuklukta fMRI çalışmalarının nicel bir meta-analizi". Bipolar Bozukluklar. 13 (1): 1–15. doi:10.1111 / j.1399-5618.2011.00893.x. PMID 21320248.
- ^ Brooks III, John; Ketter, Terrence; Wang, Po (2010). "Functional Imaging Studies in Bipolar: Focus on Cerebral Metabolism and Blood Flow". In Yatham, L; Maj, M (eds.). Bipolar Disorder Clinical and Neurobiological Foundations. Wiley Blackwell.
- ^ Blond, B; Blumberg, H. "Functional Neuroimaging Research in Bipolar". Manji, H; Zarate, C (editörler). Behavioral Neurobiology of Bipolar Disorder and its Treatment. pp. 230–240.
- ^ Patel, N; Nandagopal, J; Cerullo, M; Fleck, D; Adler, C; Strakowski, S; DelBello, M. "Neuroimaging Biomarkers for Bipolar Disorder Across the Lifespan". In Ritsner, M (ed.). The Handbook of Neuropsychiatric Biomarkers, Endophenotypes and Genes: Volume II: Neuroanatomical and Neuroimaging Endophenotypes and Biomarkers. Springer.
- ^ Phillips, ML; Swartz, HA (Ağustos 2014). "Bipolar bozukluğun nörogörüntüleme çalışmalarının kritik bir değerlendirmesi: altta yatan sinir devrelerinin yeni bir kavramsallaştırmasına ve gelecekteki araştırmalar için bir yol haritasına doğru". Amerikan Psikiyatri Dergisi. 171 (8): 829–43. doi:10.1176 / appi.ajp.2014.13081008. PMC 4119497. PMID 24626773.
- ^ Nusslock, R; Young, CB; Damme, KS (November 2014). "Bipolar bozukluğun benzersiz bir biyolojik belirteci olarak ödülle ilişkili yüksek nöral aktivasyon: değerlendirme ve tedavi sonuçları". Davranış Araştırması ve Terapisi. 62: 74–87. doi:10.1016 / j.brat.2014.08.011. PMC 6727647. PMID 25241675.
- ^ Wegbreit, E; Cushman, GK; Puzia, ME; Weissman, AB; Kim, KL; Laird, AR; Dickstein, DP (August 2014). "Developmental meta-analyses of the functional neural correlates of bipolar disorder". JAMA Psikiyatri. 71 (8): 926–35. doi:10.1001/jamapsychiatry.2014.660. PMC 4545589. PMID 25100166.
- ^ Hajek, T; Alda, M; Hajek, E; Ivanoff, J (December 2013). "Functional neuroanatomy of response inhibition in bipolar disorders--combined voxel based and cognitive performance meta-analysis". Psikiyatrik Araştırmalar Dergisi. 47 (12): 1955–66. doi:10.1016/j.jpsychires.2013.08.015. PMID 24070910.
- ^ Kupferschmidt, DA; Zakzanis, KK (30 August 2011). "Toward a functional neuroanatomical signature of bipolar disorder: quantitative evidence from the neuroimaging literature". Psikiyatri Araştırması. 193 (2): 71–9. doi:10.1016/j.pscychresns.2011.02.011. PMID 21676596.
- ^ Delvecchio, G; Fossati, P; Boyer, P; Brambilla, P; Falkai, P; Gruber, O; Hietala, J; Lawrie, SM; Martinot, JL; McIntosh, AM; Meisenzahl, E; Frangou, S (February 2012). "Common and distinct neural correlates of emotional processing in Bipolar Disorder and Major Depressive Disorder: a voxel-based meta-analysis of functional magnetic resonance imaging studies". Avrupa Nöropsikofarmakoloji. 22 (2): 100–13. doi:10.1016/j.euroneuro.2011.07.003. PMID 21820878.
- ^ Frangou, S (May 2014). "A systems neuroscience perspective of schizophrenia and bipolar disorder". Şizofreni Bülteni. 40 (3): 523–31. doi:10.1093/schbul/sbu017. PMC 3984528. PMID 24609453.
- ^ Savitz, J; Drevets, W. "Neuroimaging and Neuropathological Findings in Bipolar Disorder". In H, Manji; Zarate, C (editörler). Behavioral Neurobiology of Bipolar Disorder and its Treatment. Springer. pp. 200–208.
- ^ Savitz, J; Drevets, W. "Neuroimaging and Neuropathological Findings in Bipolar Disorder". In H, Manji; Zarate, C (editörler). Behavioral Neurobiology of Bipolar Disorder and its Treatment. Springer. pp. 208–212.
- ^ Gigante, AD; Bond, DJ; Lafer, B; Lam, RW; Genç, LT; Yatham, LN (August 2012). "Brain glutamate levels measured by magnetic resonance spectroscopy in patients with bipolar disorder: a meta-analysis". Bipolar Bozukluklar. 14 (5): 478–87. doi:10.1111/j.1399-5618.2012.01033.x. PMID 22834460.
- ^ Chitty, KM; Lagopoulos, J; Lee, RS; Hickie, IB; Hermens, DF (November 2013). "A systematic review and meta-analysis of proton magnetic resonance spectroscopy and mismatch negativity in bipolar disorder". Avrupa Nöropsikofarmakoloji. 23 (11): 1348–63. doi:10.1016/j.euroneuro.2013.07.007. PMID 23968965.
- ^ Kraguljac, NV; Reid, M; White, D; Jones, R; den Hollander, J; Lowman, D; Lahti, AC (2012). "Neurometabolites in schizophrenia and bipolar disorder - a systematic review and meta-analysis". Psikiyatri Araştırması. 203 (2–3): 111–25. doi:10.1016/j.pscychresns.2012.02.003. PMC 3466386. PMID 22981426.
- ^ Monkul, ES; Yıldız, A; C Soares, J (2004). "[Magnetic resonance spectroscopy (MRS) applications in bipolar disorder]". Turk Psikiyatri Dergisi = Turkish Journal of Psychiatry. 15 (2): 138–47. PMID 15208769.
- ^ Silverstone, PH; McGrath, BM; Kim, H (February 2005). "Bipolar disorder and myo-inositol: a review of the magnetic resonance spectroscopy findings". Bipolar Bozukluklar. 7 (1): 1–10. doi:10.1111/j.1399-5618.2004.00174.x. PMID 15654927.
- ^ Lyoo, Kyoon; Renshaw, Perry (2010). "Functional Magnetic Resonance Imaging, Diffusion Tensor Imaging, and Magnetic Resonance Spectroscopy in Bipolar Disorder". In Yatham, Lakshmi; Maj, Mario (eds.). Bipolar Bozukluk: Klinik ve Nörobiyolojik Temeller. Wiley Blackwell.
- ^ Schür, RR; Draisma, LW; Wijnen, JP; Boks, MP; Koevoets, MG; Joëls, M; Klomp, DW; Kahn, RS; Vinkers, CH (September 2016). "Brain GABA levels across psychiatric disorders: A systematic literature review and meta-analysis of (1) H-MRS studies". İnsan Beyin Haritalama. 37 (9): 3337–52. doi:10.1002/hbm.23244. PMID 27145016.
- ^ Manji & Zarate 2011, s. 107.
- ^ van Enkhuizen, J; Janowsky, DS; Olivier, B; Minassian, A; Perry, W; Young, JW; Geyer, MA (15 April 2015). "The catecholaminergic-cholinergic balance hypothesis of bipolar disorder revisited". Avrupa Farmakoloji Dergisi. 753: 114–26. doi:10.1016/j.ejphar.2014.05.063. PMC 4318788. PMID 25107282.
- ^ a b Manji, HK; Quiroz, JA; Payne, JL; Singh, J; Lopes, BP; Viegas, JS; Zarate, CA (October 2003). "Bipolar bozukluğun altında yatan nörobiyoloji". Dünya Psikiyatrisi. 2 (3): 136–46. PMC 1525098. PMID 16946919.
- ^ a b Savitz, JB; Drevets, WC (April 2013). "Depresyonda nöro reseptör görüntüleme". Hastalığın Nörobiyolojisi. 52: 49–65. doi:10.1016 / j.nbd.2012.06.001. PMID 22691454.
- ^ Manji & Zarate 2011, s. 110.
- ^ Manji & Zarate 2011, s. 112.
- ^ Jacobs, Barry; Müller, Christian (2009). Handbook of the behavioral neurobiology of serotonin (1. baskı). London: Elsevier. s. 329. ISBN 978-0-12-374634-4.
- ^ a b Salvadore, G; Quiroz, JA; Machado-Vieira, R; Henter, ID; Manji, HK; Zarate CA, Jr (November 2010). "The neurobiology of the switch process in bipolar disorder: a review". Klinik Psikiyatri Dergisi. 71 (11): 1488–501. doi:10.4088 / JCP.09r05259gre. PMC 3000635. PMID 20492846.
- ^ Belvederi Murri, M; Prestia, D; Mondelli, V; Pariante, C; Patti, S; Olivieri, B; Arzani, C; Masotti, M; Respino, M; Antonioli, M; Vassallo, L; Serafini, G; Perna, G; Pompili, M; Amore, M (January 2016). "The HPA axis in bipolar disorder: Systematic review and meta-analysis". Psikonöroendokrinoloji. 63: 327–42. doi:10.1016/j.psyneuen.2015.10.014. PMID 26547798.
- ^ a b Dinan, Timothy; Bauer, Michael (2010). "Neuroendocrinology of Bipolar Disorder". In Yatham, Lakshmi; Maj, Mario (eds.). Bipolar Bozukluk: Klinik ve Nörobiyolojik Temeller. Wiley-Blackwell.
- ^ Fernandes, BS; Molendijk, ML; Köhler, CA; Soares, JC; Leite, CM; Machado-Vieira, R; Ribeiro, TL; Silva, JC; Sales, PM; Quevedo, J; Oertel-Knöchel, V; Vieta, E; González-Pinto, A; Berk, M; Carvalho, AF (30 November 2015). "Peripheral brain-derived neurotrophic factor (BDNF) as a biomarker in bipolar disorder: a meta-analysis of 52 studies". BMC Tıp. 13: 289. doi:10.1186/s12916-015-0529-7. PMC 4666054. PMID 26621529.
- ^ a b Gawryluk, J; Young, T. "Bipolar Bozukluğun Patofizyolojisinde Sinyal İletim Yolları". Manji, H; Zarate, C (editörler). Bipolar Bozukluğun Davranışsal Nörobiyolojisi ve Tedavisi. Springer. s. 151–152.
- ^ a b Andreazza, Ana; Feng Wang, Jun; Young, Trevor (2010). "Molecular Biology of Bipolar Disorder". In Yatham, Lakshmi; Maj, Mario (eds.). Bipolar Bozukluk: Klinik ve Nörobiyolojik Temeller. Wiley-Blackwell. ISBN 9780470721988.
- ^ Arnsten, AFT; Manji, HK (March 2008). "Mani: rasyonel bir nörobiyoloji". Geleceğin Nörolojisi. 3 (2): 125–131. doi:10.2217/14796708.3.2.125.
- ^ Saxena, A; Scaini, G; Bavaresco, DV; Leite, C; Valvassoria, SS; Carvalho, AF; Quevedo, J (November 2017). "Role of Protein Kinase C in Bipolar Disorder: A Review of the Current Literature". Molecular Neuropsychiatry. 3 (2): 108–124. doi:10.1159/000480349. PMC 5701269. PMID 29230399.
- ^ Muneer, A (31 May 2017). "Wnt and GSK3 Signaling Pathways in Bipolar Disorder: Clinical and Therapeutic Implications". Klinik Psikofarmakoloji ve Sinirbilim. 15 (2): 100–114. doi:10.9758/cpn.2017.15.2.100. PMC 5426498. PMID 28449557.
- ^ Rapoport, SI; Basselin, M; Kim, HW; Rao, JS (October 2009). "Bipolar bozukluk ve duygudurum dengeleyicilerin etki mekanizmaları". Beyin Araştırma İncelemeleri. 61 (2): 185–209. doi:10.1016 / j.brainresrev.2009.06.003. PMC 2757443. PMID 19555719.
- ^ Harrison, PJ; Geddes, JR; Tunbridge, EM (January 2018). "Bipolar Bozukluğun Ortaya Çıkan Nörobiyolojisi". Sinirbilimlerindeki Eğilimler. 41 (1): 18–30. doi:10.1016 / j.tins.2017.10.006. PMC 5755726. PMID 29169634.
- ^ da Rosa, MI; Simon, C; Grande, AJ; Barichello, T; Oses, JP; Quevedo, J (December 2016). "Serum S100B in manic bipolar disorder patients: Systematic review and meta-analysis". Duygusal Bozukluklar Dergisi. 206: 210–215. doi:10.1016/j.jad.2016.07.030. PMID 27475892.
- ^ Manji & Zarate 2011, s. 193.
- ^ Young, Trevor; Cintoh, Arabah. "Understanding the Neurobiology of Bipolar Depression". In Zarate, C; Manji, H (eds.). Bipolar Depression: Molecular Neurobiology, Clinical Diagnosis and Pharmacotherapy (Milestones in Drug Therapy) (2. baskı). Springer.
- ^ Manji & Zarate 2011, s. 125-130.
- ^ Manji & Zarate 2011, s. 143.
- ^ Fountoulakis, KN (2012). "The possible involvement of NMDA glutamate receptor in the etiopathogenesis of bipolar disorder". Güncel İlaç Tasarımı. 18 (12): 1605–8. doi:10.2174/138161212799958585. PMID 22280433.
- ^ Gigante, AD; Genç, LT; Yatham, LN; Andreazza, AC; Nery, FG; Grinberg, LT; Heinsen, H; Lafer, B (September 2011). "Bipolar bozuklukta morfometrik ölüm sonrası çalışmalar: oksidatif stres ve apoptoz ile olası ilişki". Uluslararası Nöropsikofarmakoloji Dergisi. 14 (8): 1075–89. doi:10.1017 / S146114571000146X. PMID 21205433.
- ^ Vawter, MP; Serbest, WJ; Kleinman, JE (15 Eylül 2000). "Bipolar bozukluğun nöropatolojisi". Biyolojik Psikiyatri. 48 (6): 486–504. doi:10.1016 / s0006-3223 (00) 00978-1. PMID 11018222.
- ^ Savitz, JB; Fiyat, JL; Drevets, WC (Mayıs 2014). "Bipolar bozuklukta nöropatolojik ve nöromorfometrik anormallikler: medial prefrontal kortikal ağdan görünüm". Nörobilim ve Biyodavranışsal İncelemeler. 42: 132–47. doi:10.1016 / j.neubiorev.2014.02.008. PMID 24603026.
- ^ Muneer, A (Ocak 2016). "Bipolar Bozukluğun Nörobiyolojisi: Bütünleşik Bir Yaklaşım". Chonnam Tıp Dergisi. 52 (1): 18–37. doi:10.4068 / cmj.2016.52.1.18. PMC 4742607. PMID 26865997.
- ^ Elhaik, E; Zandi, P (Kasım 2015). "Bipolar bozukluğun potansiyel bir indükleyicisi olarak NF-κB yolağının düzensizliği". Psikiyatrik Araştırmalar Dergisi. 70: 18–27. doi:10.1016 / j.jpsychires.2015.08.009. PMID 26424419.
