Parkinson hastalığı - Parkinsons disease - Wikipedia
| Parkinson hastalığı | |
|---|---|
| Diğer isimler | Parkinson hastalığı, idiyopatik veya birincil parkinsonizm, hipokinetik rijit sendrom, felç agitanları, titreme felci |
 | |
| Parkinson hastalığını gösteren resim William Richard Gowers, ilk yayınlandı Sinir Sistemi Hastalıkları El Kitabı (1886) | |
| Uzmanlık | Nöroloji |
| Semptomlar | titreme, katılık, hareketin yavaşlığı, yürümede zorluk[1] |
| Komplikasyonlar | Demans, depresyon, kaygı[2] |
| Olağan başlangıç | 60 yaş üstü[1][3] |
| Nedenleri | Bilinmeyen[4] |
| Risk faktörleri | Pestisit poz, kafa yaralanmaları[4] |
| Teşhis yöntemi | Semptomlara göre[1] |
| Ayırıcı tanı | Lewy cisimcikli demans, ilerleyici supranüklear felç, temel titreme, antipsikotik kullanım[5] |
| Tedavi | İlaçlar, ameliyat[1] |
| İlaç tedavisi | L-DOPA, dopamin agonistleri[2] |
| Prognoz | Yaşam beklentisi yaklaşık 7-15 yaş [6] |
| Sıklık | 6,2 milyon (2015)[7] |
| Ölümler | 117,400 (2015)[8] |
Parkinson hastalığı (PD), ya da sadece Parkinson [9] uzun vadeli dejeneratif bozukluk of Merkezi sinir sistemi esas olarak etkileyen motor sistemi. Semptomlar genellikle yavaş ortaya çıkar ve hastalık kötüleştikçe motor dışı semptomlar daha yaygın hale gelir.[1][4] En belirgin erken belirtiler titreme, katılık, hareketin yavaşlığı, ve yürümede zorluk,[1] fakat bilişsel ve davranışsal sorunlar da ortaya çıkabilir. Parkinson hastalığı demansı Hastalığın ileri evrelerinde yaygınlaşır. Depresyon Parkinson hastalarının üçte birinden fazlasında ortaya çıkan anksiyete de yaygındır.[2] Diğer semptomlar arasında duyusal, uyku, ve duygusal sorunlar.[1][2] Ana motor semptomlara toplu olarak "Parkinsonizm "veya bir" parkinson sendromu ".[4]
PD'nin nedeni ise Bilinmeyen, ikisini de içerdiğine inanılıyor miras ve çevresel faktörler. Etkilenen bir aile üyesi olanların hastalığı kendilerinin alma olasılığı daha yüksektir. Ayrıca belirli etkilere maruz kalan kişilerde risk artışı vardır. Tarım ilacı ve önceden sahip olanlar arasında kafa yaralanmaları düşük risk varken tütün içenler ve Kahve veya Çay içenler.[4][10] Hastalığın motor semptomları, hücrelerin ölümü içinde Substantia nigra, bir bölge orta beyin, yol açan dopamin açık.[1] Bu hücre ölümünün nedeni tam olarak anlaşılamamıştır, ancak proteinler içine Lewy cisimleri içinde nöronlar.[4]
Tipik vakaların teşhisi, aşağıdaki gibi testlerle temel olarak semptomlara dayanır. nöro-görüntüleme diğer hastalıkları dışlamak için kullanılır.[1] Parkinson hastalığı tipik olarak 60 yaşın üzerindeki kişilerde görülür ve bunların yaklaşık yüzde biri etkilenir.[1][3] Erkekler yaklaşık 3: 2 oranında kadınlardan daha sık etkilenir.[4] 50 yaşın altındaki kişilerde görüldüğünde erken başlangıçlı PH olarak adlandırılır.[11] 2015 yılında PD, 6,2 milyon kişiyi etkiledi ve dünya çapında yaklaşık 117.400 ölümle sonuçlandı.[7][8] Ortalama yaşam beklentisi takip eden tanı 7 ila 15 yıl arasındadır.[2]
PD'nin tedavisi yoktur; tedavi semptomları iyileştirmeyi amaçlar.[1][12] İlk tedavi tipik olarak ilaç levodopa (L-DOPA ), bunu takiben dopamin agonistleri levodopa daha az etkili hale geldiğinde.[2] Hastalık ilerledikçe, bu ilaçlar daha az etkili hale gelirken aynı zamanda yan etki tarafından işaretlenmiş istemsiz kas hareketleri.[2] Diyet ve bazı rehabilitasyon biçimleri semptomların iyileştirilmesinde bir miktar etkinlik göstermiştir.[13][14] Ameliyat yerleştirmek mikroelektrotlar için Derin beyin uyarımı ilaçların etkisiz olduğu ağır vakalarda motor semptomları azaltmak için kullanılmıştır.[1] Uyku bozuklukları ve duygusal problemler gibi hareketle ilgili olmayan PH semptomlarının tedavisine yönelik kanıtlar daha az güçlüdür.[4]
Hastalığa İngiliz doktorun adı verilmiştir James Parkinson, ilk ayrıntılı açıklamayı yayınlayan Titreyen Felç Üzerine Bir Deneme, 1817'de.[15][16] Halkı bilinçlendirme kampanyaları arasında Dünya Parkinson Günü (11 Nisan'da James Parkinson'ın doğum günü) ve kırmızı biber lale hastalığın sembolü olarak.[17] Halkın bu duruma ilişkin farkındalığını artıran Parkinson hastaları arasında boksör Muhammed Ali, aktör Michael J. Fox, Olimpik bisikletçi Davis Phinney ve aktör Alan Alda.[18][19][20][21]
Sınıflandırma
PD'de bulunan hareket zorluklarına denir Parkinsonizm olarak tanımlanan bradikinezi (gönüllü hareketleri başlatmada yavaşlık, hızda kademeli azalma ve gönüllü parmak vurma gibi tekrarlayan eylemler aralığı[22]) diğer üç fiziksel belirtiden biriyle kombinasyon halinde: kaslı (kurşun boru veya dişli çark ) sertlik, titreme istirahatte ve Postürel dengesizlik. Bir dizi farklı bozuklukta parkinsonizm tipi hareket sorunları olabilir.[23][24]
Parkinson hastalığı, parkinsonizmin en yaygın şeklidir ve bazen "idiyopatik parkinsonizm" olarak adlandırılır, yani tanımlanabilir bir nedeni olmayan parkinsonizm anlamına gelir.[12][25] Parkinsonizmin tanımlanabilir nedenleri arasında toksinler, enfeksiyonlar, ilaçların yan etkileri, metabolik bozukluklar ve felç gibi beyin lezyonları bulunur. Birkaç nörodejeneratif bozukluk da parkinsonizm ile ortaya çıkabilir ve bazen "atipik parkinsonizm" veya "Parkinson plus" sendromlar (parkinsonizmli hastalıklar artı onları PD'den ayıran diğer bazı özellikler). Onlar içerir çoklu sistem atrofisi, ilerleyici supranüklear felç, kortikobazal dejenerasyon, ve Lewy cisimcikli demans (DLB).[12][26]
Bilim adamları bazen Parkinson hastalığına sinükleinopati (anormal birikim nedeniyle alfa-sinüklein beyindeki protein) gibi diğer nörodejeneratif hastalıklardan ayırt etmek için Alzheimer hastalığı beynin biriktiği yer tau proteini.[27] Aralarında önemli klinik ve patolojik örtüşme vardır. tauopatiler ve sinükleinopatiler. Parkinson hastalığının aksine, Alzheimer hastalığı en yaygın olarak hafıza kaybıyla ortaya çıkar ve Parkinson hastalığının temel belirtileri (yavaşlık, titreme, sertlik ve postüral dengesizlik) Alzheimer'ın normal özellikleri değildir.
Lewy cisimcikli demans, başka bir sinükleinopatidir ve PD ile özellikle yakın patolojik benzerlikleri vardır. demans olarak bilinir Parkinson hastalığı demansı. PD ve DLB arasındaki ilişki karmaşıktır ve tam olarak anlaşılmamıştır.[28] Değişken ayırt edici klinik ve patolojik özelliklere sahip bir sürekliliğin parçalarını temsil edebilirler veya ayrı hastalıklar olduklarını kanıtlayabilirler.[28]
Belirti ve bulgular

Parkinson hastalığında en çok tanınan semptomlar hareket ("motor") ile ilgilidir.[31] Aşağıdakileri içeren motor dışı semptomlar otonom disfonksiyon, nöropsikiyatrik sorunlar (ruh hali, biliş, davranış veya düşünce değişiklikleri) ve duyusal (özellikle değişen koku alma duyusu) ve uyku güçlükleri de yaygındır. Bu motor olmayan semptomların bazıları tanı anında mevcut olabilir.[31]
Motor
Dört motor semptom dikkate alınır kardinal PD'de: titreme, hareket yavaşlığı (bradikinezi), sertlik ve postural instabilite.[31]
En yaygın sunum bulgusu kaba bir yavaş titreme etkilenen kolun istemli hareketi sırasında ve uykunun daha derin aşamalarında kaybolan istirahat halindeki el.[31] Tipik olarak sadece bir elde ortaya çıkar ve sonunda hastalık ilerledikçe her iki eli de etkiler.[31] PD titreme sıklığı 4 ile 6 arasında hertz (saniyedeki döngü). Titremenin bir özelliği Hap yuvarlamasıişaret parmağı ile baş parmağın dokunma ve birlikte dairesel bir hareket yapma eğilimi.[31][32] Terim, PD'li kişilerin hareketi ile hapları manuel olarak yapmanın erken farmasötik tekniği arasındaki benzerlikten türemiştir.[32]
Bradikinezi (hareketin yavaşlığı) her PD vakasında bulunur ve bu durum motor planlama hareketin başlaması ve planlamadan başlatmaya ve bir hareketin yürütülmesine kadar tüm hareket süreci boyunca zorluklarla ilişkili. Sıralı ve eşzamanlı hareketin performansı bozulur. Bradikinezi, Parkinson hastalığının en engelleyici semptomudur ve giyinme, beslenme ve banyo gibi günlük işlerde zorluklara neden olur. Aynı anda iki bağımsız motor aktiviteyi gerçekleştirmede özellikle zorluğa yol açar ve duygusal stres veya eşzamanlı hastalıklar tarafından daha da kötüleştirilebilir. Paradoksal olarak, Parkinson hastalığı olan hastalar, genellikle bir seviyede yürümekten daha kolay bir şekilde bisiklete binebilir veya merdivenleri çıkabilir. Doktorların çoğu bradikineziyi kolayca fark edebilirken, resmi değerlendirme, hastanın parmakları ve ayaklarıyla tekrarlayan hareketler yapmasını gerektirir.[33]
Sertlik artışın neden olduğu uzuv hareketine karşı sertlik ve dirençtir kas tonusu, kasların aşırı ve sürekli kasılması.[31] Parkinsonizmde sertlik, "kurşun-boru sertliği" olarak bilinen tek tip olabilir veya "dişli çark sertliği" olarak bilinen çentik olabilir.[12][31][34][35] Titreme ve artan ton kombinasyonunun, dişli çark sertliğinin kaynağı olduğu düşünülmektedir.[36] Sertlik, eklem ağrısı ile ilişkilendirilebilir; bu tür ağrı, hastalığın sık görülen bir ilk belirtisidir.[31] Parkinson hastalığının erken evrelerinde, sertlik genellikle asimetriktir ve yüz ve ekstremitelerin kaslarından önce boyun ve omuz kaslarını etkileme eğilimindedir.[37] Hastalığın ilerlemesiyle birlikte, sertlik tipik olarak tüm vücudu etkiler ve hareket etme yeteneğini azaltır.
Postürel dengesizlik Hastalığın sonraki aşamalarında tipiktir, denge bozukluğuna ve sık düşmeye neden olur,[38] ve ikincil olarak kemik kırıkları, güven kaybı ve azalan hareketlilik.[39] Kararsızlık genellikle ilk aşamalarda, özellikle genç insanlarda, özellikle iki taraflı semptomların gelişmesinden önce yoktur.[40] PD teşhisi konan kişilerin% 40'a kadarı düşme yaşayabilir ve yaklaşık% 10'u haftalık olarak düşebilir, düşme sayısı PD'nin ciddiyetiyle ilişkilidir.[31]
Bilinen diğer motor belirti ve semptomlar arasında yürüyüş ve aşağıdaki gibi duruş bozuklukları bulunur. bayram (hızlı karıştırma adımları ve öne eğik duruş bükülmüş kol salınımı olmadan yürürken). Yürüyüşün donması (özellikle dönerken veya yön değiştirirken ayaklar yere yapışmış gibi göründüğünde kısa süreli tutuklamalar), geveleyerek monoton bir sessiz ses, maske benzeri yüz ifadesi ve gittikçe küçülen el yazısı diğer yaygın işaretlerdir.[41]
Nöropsikiyatrik
Parkinson hastalığı neden olabilir nöropsikiyatrik hafif ila şiddetli arasında değişebilen rahatsızlıklar. Buna biliş, ruh hali, davranış ve düşünce bozuklukları dahildir.[31]
Bilişsel bozukluklar, hastalığın erken evrelerinde ve bazen tanıdan önce ortaya çıkabilir ve hastalığın süresi ile prevalans artabilir.[31][42] Parkinson hastalığında en yaygın bilişsel eksiklik yönetici işlev bozukluğu planlama ile ilgili sorunları içerebilen, bilişsel esneklik soyut düşünme, kural edinme, uygunsuz eylemleri engellemek, uygun eylemleri başlatmak, çalışan bellek, ve dikkatin kontrolü.[42][43] Diğer bilişsel zorluklar şunları içerir: yavaş bilişsel işlem hızı, ayrılmış hatırlama ve bozulmuş zaman algısı ve tahmini.[42][43] Bununla birlikte, hatırlama ipuçları ile desteklendiğinde iyileşme görülür.[42] Görsel-uzamsal zorluklar da hastalığın bir parçasıdır, örneğin kişiden yüz tanıma testleri ve çizilmiş çizgilerin yönelimini algılaması istendiğinde görülür.[42][43]
PD'li bir kişi, genel popülasyona kıyasla iki ila altı kat daha fazla demans riskine sahiptir.[31][42] PD'li kişilerin% 78'ine kadar Parkinson hastalığı demansı vardır.[44] Demans prevalansı yaşla ve daha az oranda hastalık süresi ile artar.[45] Demans azalmış yaşam kalitesi PD'li kişilerde ve bakıcılar, artan ölüm oranı ve daha yüksek ihtiyaç duyma olasılığı bakım evi bakımı.[42]
Patolojik kumar, kompülsif cinsel davranış, aşırı yeme, kompulsif alışveriş ve umursamaz cömertlik dahil dürtü kontrol bozuklukları, ilaçlardan, özellikle de oral olarak aktif dopamin agonistlerinden kaynaklanabilir. dopamin disregülasyon sendromu - aşırı kullanıma yol açan ilaç istemek - levodopa kullanımının nadir bir komplikasyonudur.[46]
Davranış ve duygudurum değişiklikleri, bilişsel bozukluğu olmayan PD'de genel popülasyona göre daha yaygındır ve genellikle demanslı PD'de mevcuttur. En sık görülen ruh hali zorlukları depresyon, ilgisizlik, ve kaygı.[31] Depresyon teşhisinin konulması, depresyonun vücut dilinin, üzgün, ifadesiz, endişeli bir yüz, sarkık köpek görünümü, yavaş hareket ve monoton konuşma dahil olmak üzere PH gibi görünmesi nedeniyle karmaşıktır. Parkinson hastalarının% 30 kadarı, anksiyete belirtileri yaşayabilir. genelleştirilmiş anksiyete bozukluğu -e sosyal fobi, panik bozuklukları ve obsesif kompulsif bozukluklar. Bozulmuş yaşam kalitesine ve açma / kapama dalgalanmaları veya donma olayları gibi motor semptomların şiddetinin artmasına katkıda bulunurlar.
Punding karmaşık tekrarlayan amaçsız basmakalıp davranışlar saatlerce ortaya çıkan, anti-Parkinson ilaçlarının neden olduğu bir başka rahatsızlıktır.
Halüsinasyonlar veya sanrılar Parkinson hastalarının yaklaşık% 50'sinde hastalık süresince ortaya çıkar ve bunamanın ortaya çıkışının habercisi olabilir. Bunlar, küçük halüsinasyonlardan - "geçiş duygusu" (kişinin yanından hızla geçen bir şey) veya "mevcudiyet duygusu" (kişinin yanında veya arkasında duran bir şeyin / birinin algılanması) - tamamen canlı, görsel halüsinasyonlar oluşturdu ve paranoyak fikir. İşitsel halüsinasyonlar PD'de nadirdir ve nadiren ses olarak tanımlanır. Artık psikozun hastalığın ayrılmaz bir parçası olduğuna inanılıyor. Sanrılar ve ilişkili bir psikoz deliryum Parkinson karşıtı ilaç tedavisinin bilinen bir komplikasyonudur ve idrar yolu enfeksiyonlarından da kaynaklanabilir (kırılgan yaşlılarda sıklıkla görüldüğü gibi), ancak ilaçlar ve enfeksiyon tek faktör değildir ve altta yatan beyin patolojisi veya nörotransmiterlerdeki veya reseptörlerindeki değişiklikler (örneğin, asetilkolin, serotonin) de PD'de psikozda rol oynadığı düşünülmektedir.[47][48]
Diğer
Uyku bozuklukları hastalığın bir özelliğidir ve ilaçlarla daha da kötüleşebilir.[31] Semptomlar gündüz olarak ortaya çıkabilir uyuşukluk (ani uyku atakları dahil) narkolepsi ), içindeki rahatsızlıklar REM uyku veya uykusuzluk hastalığı.[31] REM davranış bozukluğu Hastaların bazen kendilerini veya yatak arkadaşlarını yaralayarak rüyalar gördüğü (RBD), PD'nin motor veya bilişsel özelliklerinin gelişmesinden yıllar önce başlayabilir. DLB.[49]
Değişiklikler otonom sinir sistemi e sebep olabilir ortostatik hipotansiyon (ayakta dururken düşük tansiyon), yağlı cilt ve aşırı terleme, idrarını tutamamak ve değişen cinsel işlev.[31] Kabızlık ve bozulmuş mide boşalması (gastrik dismotilite) rahatsızlığa neden olacak ve hatta sağlığı tehlikeye atacak kadar şiddetli olabilir.[13] Algılamadaki değişiklikler arasında bozulmuş bir koku alma duyusu, rahatsız görme, ağrı ve parestezi (karıncalanma ve uyuşma).[31] Tüm bu semptomlar hastalığın teşhis edilmesinden yıllar önce ortaya çıkabilir.[31]
Nedenleri
Bazen hastalığın olası mekanizmalarına ilişkin teorilerle ilgili olarak birçok risk faktörü önerilmiştir; ancak hiçbiri kesin olarak kanıtlanmamıştır.[50] En sık tekrarlanan ilişkiler, pestisitlere maruz kalanlarda artan bir risk ve sigara içenlerde daha az risktir.[50][51] PD ve arasında olası bir bağlantı vardır H. pylori Levodopa dahil bazı ilaçların emilimini engelleyebilen enfeksiyon.[52][53]
Çevresel faktörler
Maruz kalmak Tarım ilacı ve kafa travması geçmişinin her biri Parkinson hastalığı (PD) ile ilişkilendirilmiştir, ancak riskler orta düzeydedir. Hiç sigara içmemek ve asla kafeinli içecek içmemek de PD geliştirme riskinde küçük artışlarla ilişkilidir.[46]
Düşük konsantrasyonlar urate Kanın içinde serum artmış PD riski ile ilişkilidir.[54]
Genetik
Araştırmalar, PD'nin genetik ve genetik arasındaki karmaşık etkileşimin ürünü olduğunu göstermektedir. çevresel faktörler.[4] PD'li bireylerin yaklaşık% 15'inin birinci derece akraba kimde hastalığı var[12] ve Parkinson hastalarının% 5-10'unun bir nedene bağlı olarak ortaya çıkan hastalık formlarına sahip olduğu bilinmektedir. mutasyon birkaç spesifik genden birinde.[55] Bu gen mutasyonlarından birini barındırmak hastalığa yol açmayabilir; duyarlılık faktörleri, kişiyi genellikle diğer risk faktörleri ile birlikte artan bir risk altına sokar ve bu da başlangıç yaşını, ciddiyeti ve ilerlemeyi etkiler.[55] En az 17 otozomal dominant ve otozomal resesif gen mutasyonları dahil olmak üzere PD'nin geliştirilmesinde rol oynamıştır SNCA, LRRK2/PARK8, GBA, PRKN, PEMBE1, DJ1/PARK7, VPS35, EIF4G1, DNAJC13, CHCHD2 ve UCHL1.[56][57]
PD'li kişilerin yaklaşık% 5'inin GBA1 gen.[58] Bu mutasyonlar, etkilenmemiş popülasyonun% 1'inden daha azında mevcuttur. Bu mutasyonlar mevcutsa PD geliştirme riski 20-30 kat artar. Bu mutasyonlarla ilişkili PD aynı klinik özelliklere sahiptir, ancak daha erken bir başlangıç yaşı ve daha hızlı bir bilişsel ve motor gerileme vardır. Bu gen kodlar glukoserebrosidaz. Bu enzimin düşük seviyeleri Gaucher hastalığı.
SNCA PD'de gen mutasyonları önemlidir çünkü bu genin kodladığı protein, alfa-sinüklein, ana bileşenidir Lewy cisimleri Parkinson hastalarının beyinlerinde biriken.[55] Alfa-sinüklein ATM'yi etkinleştirir (ataksi telenjiektazi mutasyona uğramış ), büyük bir DNA hasarı onarım sinyali kinaz.[59] Ek olarak, alfa-sinüklein, homolog olmayan uç birleştirme DNA onarımı patika. Alfa sinükleinin kümelenmesi Lewy cisimleri indirgenmiş arasında bir bağlantı gibi görünüyor DNA onarımı ve PD'de beyin hücresi ölümü.[59]
Aşağıdakiler dahil bazı genlerdeki mutasyonlar SNCA, LRRK2 ve GBA"sporadik" (ailesel olmayan) PD için risk faktörleri olduğu bulunmuştur.[55] Gendeki mutasyonlar LRRK2 Ailesel ve sporadik PH'nin en yaygın bilinen nedenidir, aile öyküsü olan bireylerin yaklaşık% 5'ini ve sporadik vakaların% 3'ünü oluşturur.[60][55] Bir mutasyon GBA Parkinson hastalığına yakalanmanın en büyük genetik riskini sunar.[56]
Parkinson ile ilgili birkaç gen, lizozomlar, hücresel atık ürünleri sindiren organeller. Bazı PD vakalarının neden olabileceği öne sürülmüştür. lizozomal bozukluklar hücrelerin parçalanma yeteneğini azaltan alfa-sinüklein.[61]
Bir otozomal dominant formdaki mutasyonlarla ilişkilendirilmiştir LRP10 gen.[62]
Patofizyoloji
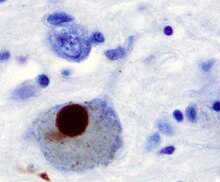
Ana patolojik PD'nin özellikleri beyindeki hücre ölümüdür Bazal ganglion (% 70'e kadar dopamin salgılama nöronlar Substantia nigra pars compacta yaşamın sonunda)[60] ve varlığı Lewy cisimleri (protein birikimleri alfa-sinüklein ) kalan nöronların çoğunda. Bu nöron kaybına, astrositler (Yıldız şekilli glial hücreler) ve sayısında önemli bir artış mikroglia Substantia nigra'da (başka bir glial hücre türü).[63]
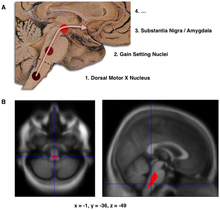
- Braak ve meslektaşları tarafından önerildiği gibi, Parkinson hastalığının ilk aşamalarında Lewy cisimciği birikintilerinin şematik ilk ilerlemesi
- Önemli beyin alanının lokalizasyonu hacim azaltma ilk PD'de, bir nörogörüntüleme çalışmasında hastalığı olmayan bir grup katılımcı ile karşılaştırıldığında, beyin sapı hasar, PD'nin ilk tanımlanabilir aşaması olabilir nöropatoloji[64]
Beyinde diğer beyin bölgelerini bazal ganglionlara bağlayan beş ana yol vardır. Bunlar olarak bilinir motor, okülo-motor, ilişkisel, limbik ve orbitofrontal her devrenin ana projeksiyon alanını belirten isimlerle birlikte devreler.[65] Hepsi PH'den etkilenir ve bozulması hastalığın semptomlarının çoğunu açıklar, çünkü bu devreler hareket, dikkat ve öğrenme dahil olmak üzere çok çeşitli işlevlerle ilgilidir.[65] Bilimsel olarak, motor devresi en yoğun şekilde incelenmiştir.[65]
Motor devresinin belirli bir kavramsal modeli ve bunun PD ile değiştirilmesi, 1980'den beri büyük etkiye sahiptir, ancak modifikasyonlara yol açan bazı sınırlamalara işaret edilmiştir.[65] Bu modelde, bazal gangliyonlar normal olarak çok çeşitli motor sistemleri üzerinde sürekli bir inhibitör etki yapar ve uygunsuz zamanlarda aktif hale gelmelerini engeller. Belirli bir eylemi gerçekleştirmeye karar verildiğinde, engelleme gerekli motor sistemi için azaltılır, böylece aktivasyon için serbest bırakılır. Dopamin, inhibisyonun bu salınımını kolaylaştırmak için hareket eder, bu nedenle yüksek seviyelerde dopamin fonksiyonu motor aktiviteyi teşvik etme eğilimindeyken, PD'de meydana gelen gibi düşük dopamin fonksiyonu seviyeleri, herhangi bir hareket için daha fazla çaba gerektirir. Bu nedenle, dopamin tükenmesinin net etkisi, hipokinezi, motor çıkışında genel bir azalma.[65] Tersine, PD'yi tedavi etmek için kullanılan ilaçlar, aşırı dopamin aktivitesi oluşturarak motor sistemlerinin uygun olmayan zamanlarda aktive olmasına ve dolayısıyla diskineziler.[65]
Beyin hücresi ölümü
Beyin hücrelerinin kaybolabileceği birkaç mekanizma hakkında spekülasyonlar var.[66] Bir mekanizma anormal bir protein birikiminden oluşur alfa-sinüklein bağlı olmak Ubikitin hasarlı hücrelerde. Bu çözülmez protein oluşturan nöronların içinde birikir kapanımlar Lewy cisimleri aradı.[60][67] Göre Braak evreleme tarafından önerilen patolojik bulgulara göre hastalığın sınıflandırılması Heiko Braak Lewy cisimleri ilk olarak koku soğanı, medulla oblongata ve pontine tegmentum; Bu aşamadaki bireyler asemptomatik olabilir veya erken dönem motor olmayan semptomlara sahip olabilir (koku duyusunun kaybı veya biraz uyku veya otomatik işlev bozukluğu gibi). Hastalık ilerledikçe, Lewy cisimcikleri substantia nigra'da gelişir. orta beyin ve bazal ön beyin ve son olarak neokorteks.[60] Bu beyin bölgeleri, PD'deki nöronal dejenerasyonun ana yerleridir; bununla birlikte, Lewy cisimcikleri hücre ölümüne neden olmayabilir ve koruyucu olabilirler (anormal protein sekestre edilmiş veya duvarla çevrili). Diğer alfa-sinüklein formları (ör. oligomerler ) Lewy cisimciklerinde toplanmayan ve Lewy nöritler aslında proteinin toksik formları olabilir.[66][67] Demanslı kişilerde, kortikal bölgelerde genel Lewy cisimciklerinin varlığı yaygındır. Nörofibrillerin ve yaşlılık plakları, nin kişilik özelliği Alzheimer hastalığı kişi demans olmadıkça yaygın değildir.[63]
Diğer hücre ölüm mekanizmaları şunları içerir: proteazomal ve lizozomal sistem disfonksiyonu ve azaltılmış mitokondriyal aktivite.[66] Substantia nigra'da demir birikimi tipik olarak protein inklüzyonları ile birlikte gözlenir. İle ilgili olabilir oksidatif stres, protein toplanması ve nöronal ölüm, ancak mekanizmalar tam olarak anlaşılmamıştır.[68]
Teşhis
Bir doktor başlangıçta Parkinson hastalığını dikkatli bir şekilde değerlendirecektir. tıbbi geçmiş ve nörolojik muayene.[31] İnsanlara levodopa verilebilir ve motor bozuklukta ortaya çıkan herhangi bir iyileşme PD tanısını doğrulamaya yardımcı olur. Orta beyindeki Lewy cisimlerinin bulunması otopsi genellikle kişinin PD'ye sahip olduğunun nihai kanıtı olarak kabul edilir. Hastalığın zaman içindeki klinik seyri, Parkinson hastalığı olmadığını ortaya çıkarabilir, bu da tanının doğruluğunu teyit etmek için klinik sunumun periyodik olarak gözden geçirilmesini gerektirir.[31][69]
İkincil olarak parkinsonizme neden olabilecek diğer nedenler şunlardır: inme ve ilaçlar.[69] Parkinson artı sendromları gibi ilerleyici supranüklear felç ve çoklu sistem atrofisi olmalıdır dışlandı.[31] Anti-Parkinson ilaçları tipik olarak Parkinson artı sendromlardaki semptomları kontrol etmede daha az etkilidir.[31] Daha hızlı ilerleme oranları, erken bilişsel işlev bozukluğu veya postüral dengesizlik, başlangıçta minimal titreme veya simetri, PD'nin kendisinden ziyade bir Parkinson plus hastalığına işaret edebilir.[70] Otozomal genetik formlar baskın veya çekinik kalıtım paterni bazen ailesel Parkinson hastalığı veya ailesel parkinsonizm olarak adlandırılır.[12]
Tıbbi kuruluşlar yarattı teşhis kriterleri özellikle hastalığın erken evrelerinde teşhis sürecini kolaylaştırmak ve standartlaştırmak. En çok bilinen kriterler, Birleşik Krallık Queen Square Nörolojik Bozukluklar Beyin Bankası ve ABD'den gelmektedir. Ulusal Nörolojik Bozukluklar ve İnme Enstitüsü. Queen Square Beyin Bankası kriterleri, hareket yavaşlığı (bradikinezi) artı sertlik, istirahat titremesi veya postural instabilite gerektirir. Bu semptomların diğer olası nedenleri göz ardı edilmelidir. Son olarak, başlangıç veya evrim sırasında aşağıdaki destekleyici özelliklerden üç veya daha fazlası gereklidir: tek taraflı başlangıç, istirahatte titreme, zamanla ilerleme, motor semptomlarda asimetri, en az beş yıl levodopaya yanıt, en az on yıllık klinik seyir ve görünüşü diskineziler aşırı levodopa alımıyla indüklenir.[71]
PD teşhisleri otopsi ile kontrol edildiğinde, hareket bozuklukları uzmanlarının ortalama olarak ilk değerlendirmede% 79.6, bir takip muayenesinde tanılarını iyileştirdikten sonra% 83.9 doğru olduğu bulunmuştur. Ağırlıklı olarak uzman olmayanlar tarafından yapılan klinik teşhisler otopsi ile kontrol edildiğinde ortalama doğruluk% 73,8'dir. Genel olarak, PD tanılarının% 80,6'sı doğrudur ve Beyin Bankası kriterlerini kullanan tanıların% 82,7'si doğrudur.[72]
Bir görev gücü Uluslararası Parkinson ve Hareket Bozukluğu Derneği (MDS), Parkinson hastalığı için tanı kriterlerinin yanı sıra teşhis için araştırma kriterleri önermiştir. prodromal hastalık, ancak bunlar daha yerleşik kriterlere göre doğrulama gerektirecektir.[73][74]
Görüntüleme
Bilgisayarlı tomografi Parkinson hastalarının (BT) taramaları genellikle normal görünür.[75] MR Zamanla, özellikle demir duyarlılığı yoluyla hastalığın teşhisinde daha doğru hale geldi T2 * ve SWI En az 3T'lik bir manyetik alan kuvvetinde diziler, her ikisi de karakteristik 'kırlangıç kuyruğu' görüntüleme modelinin yokluğunu gösterebilir. dorsolateral Substantia nigra.[76] Bir meta-analizde, bu modelin yokluğu oldukça hassas ve özel hastalık için.[77] 2020 meta-analizi şunu buldu: nöromelanin-MRI Parkinson hastalarını sağlıklı deneklerden ayırmada olumlu bir teşhis performansı vardı.[78] Difüzyon MR PD ve Parkinson artı sendromları arasında ayrım yapma potansiyeli olduğunu göstermiştir, ancak tanısal değeri hala araştırılmaktadır.[75] BT ve MRI, parkinsonizmin ikincil nedenleri olabilecek diğer hastalıkları dışlamak için de kullanılır. ensefalit ve kronik iskemik hakaretler ve bazal gangliyonlar gibi daha az sıklıkta olan varlıklar tümörler ve hidrosefali.[75]
metabolik aktivite nın-nin dopamin taşıyıcıları bazal gangliyonlarda doğrudan ölçülebilir EVCİL HAYVAN ve SPECT taramalar ile DaTSCAN bu çalışmanın ortak bir tescilli versiyonu. Parkinson'un klinik teşhisi ile büyük bir uyum göstermiştir.[79] Bazal ganglionlarda azalmış dopamin ile ilgili aktivite, ilaca bağlı Parkinsonizmi dışlamaya yardımcı olabilir. Bununla birlikte, bu bulgu tamamen spesifik değildir ve hem PD hem de Parkinson-plus bozukluklarında görülebilir.[75] Amerika Birleşik Devletleri'nde DaTSCAN'lar yalnızca FDA Parkinson hastalığı veya Parkinson sendromlarını aşağıdakilerden ayırt etmek için onaylanmıştır temel titreme.[80]
Ayırıcı tanı
PD'ye benzer sunumlara sahip olabilecek diğer koşullar şunları içerir:[81]
- Artrit
- Corticobasal sendrom
- Lewy cisimcikli demans
- Depresyon
- İlaca bağlı parkinsonizm
- Kırılgan X ile ilişkili tremor / ataksi sendromu
- Kromozom 17 ile bağlantılı frontotemporal demans ve parkinsonizm
- Huntington hastalığı
- İdiyopatik bazal gangliyon kalsifikasyonu
- Çoklu sistem atrofisi
- Beyin demir birikimi ile nörodejenerasyon
- Normal basınçlı hidrosefali
- Takıntılı yavaşlık
- İlerleyici supranüklear felç
- Psikojenik parkinsonizm
- Toksinler
- Wilson hastalığı
- Vasküler parkinsonizm
Önleme
Orta yaşta egzersiz, yaşamın ilerleyen dönemlerinde Parkinson hastalığı riskini azaltabilir.[14] Kafein ayrıca, kahve gibi daha fazla kafeinli içecek alımıyla ortaya çıkan riskte daha büyük bir azalma ile koruyucu görünmektedir.[82] Sigara içen veya kullanan kişiler dumansız tütün Sigara içmeyenlere göre PD geliştirme olasılığı daha düşüktür ve ne kadar çok tütün kullanırlarsa PD geliştirmeleri o kadar az olasıdır. Bu etkinin altında neyin yattığı bilinmemektedir. Tütün kullanımı aslında PD'ye karşı koruma sağlayabilir veya bilinmeyen bir faktör hem PD riskini artırıyor hem de tütünden hoşlanmama ya da tütün kullanımını bırakmayı kolaylaştırıyor olabilir.[83][84]
Antioksidanlar, gibi C vitamini ve E, hastalığa karşı koruma sağlamak için önerilmiştir, ancak çalışmaların sonuçları çelişkilidir ve olumlu bir etkisi kanıtlanmamıştır.[50] Yağ ile ilgili sonuçlar ve yağ asitleri Koruyucu etkiler, risk artırıcı etkiler bildiren veya hiçbir etki bildirmeyen çeşitli çalışmalarla çelişkili olmuştur.[50] Kullanımının ön göstergeler olmuştur. antienflamatuvar ilaçlar ve Kalsiyum kanal blokerleri koruyucu olabilir.[4] Bir 2010 meta-analiz bulundu steroid olmayan antienflamatuvar ilaçlar (dışında aspirin ), Parkinson hastalığı gelişme insidansında en az yüzde 15 (uzun vadeli ve düzenli kullanıcılarda daha yüksek) azalma ile ilişkilendirilmiştir.[85]
Yönetim
Parkinson hastalığının tedavisi yoktur, ancak ilaçlar, ameliyat ve fiziksel tedavi rahatlama sağlayabilir ve Alzheimer hastalığı gibi diğer nörolojik bozukluklar için mevcut tedavilerden çok daha etkilidir, motor nöron hastalığı, ve Parkinson artı sendromları. Motor semptomların tedavisinde yararlı olan ana ilaç aileleri şunlardır: levodopa (her zaman bir dopa dekarboksilaz inhibitörü ve bazen de COMT inhibitörü ), dopamin agonistleri ve MAO-B inhibitörleri. Hastalığın evresi ve hastalığın başlangıç yaşı, hangi grubun en yararlı olduğunu belirler.[86]
Braak evreleme Parkinson hastalığının erken evrelerini, sonraki aşamaları ve geç aşamaları belirlemek için kullanılabilecek altı aşama verir. Bazı sakatlıkların halihazırda geliştiği ve farmakolojik tedavi gerektirdiği ilk aşamayı, levodopa kullanımına bağlı komplikasyonların gelişmesiyle ilişkili sonraki aşamalar ve dopamin eksikliği veya levodopa tedavisi ile ilgili olmayan semptomların baskın olabileceği üçüncü aşama izler.[87]
İlk aşamadaki tedavi, optimal bir Pazarlıksız semptom kontrolü ve tedavi yan etkileri arasında. Levodopa tedavisinin başlangıcı, levodopa kullanımına bağlı komplikasyonların başlangıcını geciktirme umuduyla, başlangıçta MAO-B inhibitörleri ve dopamin agonistleri gibi diğer ilaçlar kullanılarak ertelenebilir.[88] Bununla birlikte, levodopa, PH'nin motor semptomları için hala en etkili tedavidir ve yaşam kaliteleri bozulduğunda hastalarda geciktirilmemelidir. Levodopa ile ilişkili diskineziler, hastalığın süresi ve ciddiyeti ile levodopa tedavisinin süresinden daha güçlü bir şekilde ilişkilidir, bu nedenle bu tedaviyi geciktirmek, erken kullanıma göre çok daha uzun diskinezisiz süre sağlamayabilir.[89]
Daha sonraki aşamalarda amaç, ilacın etkisindeki dalgalanmaları kontrol ederken PD semptomlarını azaltmaktır. İlaçlardan ani çekilme veya aşırı kullanımı yönetilmelidir.[88] Ağızdan alınan ilaçlar semptomları kontrol etmeye yetmediğinde, ameliyat, Derin beyin uyarımı, deri altı uyanma günü apomorfin infüzyon ve enteral dopa pompaları kullanışlı olabilir.[90] Geç dönem PH, özellikle psikiyatrik semptomlar için olanlar dahil olmak üzere çeşitli tedaviler gerektiren birçok zorluk sunar. depresyon, ortostatik hipotansiyon mesane disfonksiyonu ve erektil disfonksiyon.[90] Hastalığın son aşamalarında, palyatif bakım yaşam kalitesinin iyileştirilmesi sağlanır.[91]
İlaçlar
Levodopa
PD'nin motor semptomları, beynin bazal ganglionlarında azalmış dopamin üretiminin sonucudur. Dopamin, Kan beyin bariyeri Bu nedenle, beynin tükenmiş dopamin seviyelerini artırmak için bir ilaç olarak alınamaz. Ancak bir öncü Dopamin, levodopa, beyine geçerek kolayca dopamine dönüşebilir ve levodopa uygulaması PD'nin motor semptomlarını geçici olarak azaltır. Levodopa, 40 yılı aşkın süredir en yaygın olarak kullanılan PD tedavisi olmuştur.[88]
Levodopanın yalnızca% 5-10'u kan-beyin bariyerini geçer. Geri kalanın çoğu vücudun başka yerlerinde dopamine metabolize olur ve bu da dahil olmak üzere çeşitli yan etkilere neden olur. mide bulantısı, kusma ve ortostatik hipotansiyon.[92] Carbidopa ve benserazid vardır dopa dekarboksilaz inhibitörleri kan-beyin bariyerini geçmeyen ve levodopanın beyin dışında dopamine dönüşümünü engelleyen, yan etkileri azaltan ve beyne geçiş için levodopanın mevcudiyetini artıran. Bu ilaçlardan biri genellikle levodopa ile birlikte alınır ve genellikle aynı hap içinde levodopa ile birleştirilir.[93]
Levodopa kullanımı uzun vadede komplikasyonların gelişmesine yol açar: istemsiz hareketler denilen diskineziler ve ilacın etkinliğindeki dalgalanmalar.[88] Dalgalanmalar meydana geldiğinde, kişi ilaca iyi yanıt veren ve PD semptomlarının azaldığı ("açık" durumu) ve ilaca zayıf yanıt veren ve önemli PD semptomlarının ("kapalı" durumu) olduğu aşamalardan geçebilir.[88] Daha düşük dozlarda levodopa kullanmak, levodopanın neden olduğu bu komplikasyonların riskini ve şiddetini azaltabilir.[94] Levodopa ile ilişkili diskinezi ve dalgalanmaları azaltmaya yönelik eski bir strateji, levodopa ilacını bir süre için geri çekmekti. Bunun gibi tehlikeli yan etkilere neden olabileceği için artık önerilmez. nöroleptik malign sendrom.[88] PD'li çoğu insan, sonunda levodopaya ihtiyaç duyacak ve daha sonra levodopanın neden olduğu dalgalanmalar ve diskineziler geliştirecektir.[88]
Var kontrollü salım levodopa versiyonları. Daha eski kontrollü salımlı levodopa preparatları zayıf ve güvenilmezdir. absorpsiyon ve biyoyararlanım ve hızlı salım preparatlarıyla karşılaştırıldığında, PD motor semptomlarının kontrolünde iyileşme veya levodopa ile ilişkili komplikasyonlarda azalma göstermemiş. Daha yeni bir uzun süreli salınımlı levodopa preparatı, dalgalanmaları azaltmada daha etkili görünmektedir, ancak birçok hastada sorunlar devam etmektedir. Levodopa'nın (Duodopa) intestinal infüzyonları, dalgalanmaların neden olduğu yetersiz alımdan kaynaklandığı zaman, oral levodopaya kıyasla dalgalanmalarda çarpıcı iyileşmelerle sonuçlanabilir. gastroparezi. Diğer oral, daha uzun süre etkili formülasyonlar üzerinde çalışılmaktadır ve diğer uygulama modları (solunan, transdermal) geliştirilmektedir.[93]
COMT inhibitörleri
Bu makale daha fazlaya ihtiyacı var tıbbi referanslar için doğrulama ya da çok fazla güveniyor birincil kaynaklar. (Ağustos 2020) |
Katekol-O-metiltransferaz (COMT) inhibitörleri, beyne iletilen levodopa miktarını artırarak periferal levodopa metabolizmasını inhibe etmek için levodopa ve dopamin dearboksilaz (DDC) inhibitörleri ile birlikte kullanılır.[95]
Parkinson Hastalığı ve doz sonu motor dalgalanmaları olan yetişkinleri tedavi etmek için üç COMT inhibitörü mevcuttur: opikapon, entakapon ve tolcapone.[96][97][98] Tolcapone birkaç yıldır mevcuttur, ancak faydası olası karaciğer hasarı komplikasyonları ile sınırlıdır ve bu nedenle karaciğer fonksiyonunun izlenmesini gerektirir.[98] Entakapon ve opikaponun karaciğer fonksiyonunda önemli değişikliklere neden olduğu gösterilmemiştir.[99][100] Entakaponun lisanslı müstahzarları, tek başına veya karbidopa ve levodopa ile kombinasyon halinde entakapon içerir.[97][101] Opikapon, günde bir KOMT inhibitörüdür.[96]
Dopamin agonistleri
Birkaç dopamin agonistleri beyindeki dopamin reseptörlerine bağlanan, levodopa ile benzer etkilere sahiptir.[88] Bunlar başlangıçta levodopa komplikasyonları (açma-kapama dalgalanmaları ve diskineziler) yaşayan bireyler için levodopaya tamamlayıcı bir tedavi olarak kullanıldı; they are now mainly used on their own as first therapy for the motor symptoms of PD with the aim of delaying the initiation of levodopa therapy and so delaying the onset of levodopa's complications.[88][102] Dopamine agonists include bromokriptin, pergolid, pramipexole, ropinirol, Piribedil, kabergolin, apomorfin ve Lisuride.
Though dopamine agonists are less effective than levodopa at controlling PD motor symptoms, they are usually effective enough to manage these symptoms in the first years of treatment.[12] Dyskinesias due to dopamine agonists are rare in younger people who have PD but, along with other complications, become more common with older age at onset.[12] Thus dopamine agonists are the preferred initial treatment for younger onset PD, and levodopa is preferred for older onset PD.[12]
Dopamine agonists produce significant, although usually mild, side effects including uyuşukluk, hallucinations, insomnia, nausea, and constipation.[88] Sometimes side effects appear even at a minimal clinically effective dose, leading the physician to search for a different drug.[88] Agonists have been related to impulse control disorders (such as compulsive sexual activity, eating, gambling and shopping) even more strongly than levodopa.[103] They tend to be more expensive than levodopa.[12]
Apomorfin, a non-orally administered dopamine agonist, may be used to reduce off periods and dyskinesia in late PD.[88] It is administered by intermittent injections or continuous subcutaneous infusions.[88] Since secondary effects such as confusion and hallucinations are common, individuals receiving apomorphine treatment should be closely monitored.[88] Two dopamine agonists that are administered through skin patches (Lisuride ve rotigotine ) and are useful for people in the initial stages and possibly to control off states in those in the advanced state.[104]
MAO-B inhibitors
MAO-B inhibitors (safinamide, selegilin ve rasagilin ) increase the amount of dopamine in the basal ganglia by inhibiting the activity of monoamine oxidase B (MAO-B), an enzyme which breaks down dopamine.[88] Like dopamine agonists, their use may delay the commencement of levodopa therapy in early disease, but MAO-B inhibitors produce more adverse effects and are less effective than levodopa at controlling PD motor symptoms. There are few studies of their effectiveness in the advanced stage, although results suggest that they are useful to reduce fluctuations between on and off periods.[88] An initial study indicated that selegiline in combination with levodopa increased the risk of death, but this was later disproven.[88]
Diğer uyuşturucular
Other drugs such as amantadine ve anticholinergics may be useful as treatment of motor symptoms. However, the evidence supporting them lacks quality, so they are not first choice treatments.[88][105] In addition to motor symptoms, PD is accompanied by a diverse range of symptoms. A number of drugs have been used to treat some of these problems.[106] Examples are the use of ketiapin for psychosis, kolinesteraz inhibitörleri for dementia, and modafinil için daytime sleepiness.[106][107] 2016 yılında pimavanserin was approved for the management of Parkinson's disease psychosis.[108]
Doxepin and rasagline may reduce physical fatigue in PD.[109]
Ameliyat

Treating motor symptoms with surgery was once a common practice, but since the discovery of levodopa, the number of operations has declined.[110] Studies in the past few decades have led to great improvements in surgical techniques, so that surgery is again being used in people with advanced PD for whom drug therapy is no longer sufficient.[110] Surgery for PD can be divided in two main groups: lesional and Derin beyin uyarımı (DBS). Target areas for DBS or lesions include the talamus, Globus pallidus ya da subtalamik çekirdek.[110] Deep brain stimulation is the most commonly used surgical treatment, developed in the 1980s by Alim Louis Benabid ve diğerleri. It involves the implantation of a medical device called a neurostimulator, which sends electrical impulses to specific parts of the brain. DBS is recommended for people who have PD with motor fluctuations and tremor inadequately controlled by medication, or to those who are intolerant to medication, as long as they do not have severe neuropsychiatric problems.[111] Other, less common, surgical therapies involve intentional formation of lesions to suppress overactivity of specific subcortical alanlar. Örneğin, pallidotomy involves surgical destruction of the globus pallidus to control dyskinesia.[110]
Four areas of the brain have been treated with neural stimulators in PD.[112] Bunlar globus pallidus interna, talamus, subtalamik çekirdek ve pedunculopontine nucleus. DBS of the globus pallidus interna improves motor function while DBS of the thalamic DBS improves tremor but has little effect on bradykinesia or rigidity. DBS of the subthalamic nucleus is usually avoided if a history of depression or neurocognitive impairment is present. DBS of the subthalamic nucleus is associated with reduction in medication. Pedunculopontine nucleus DBS remains experimental at present. Generally DBS is associated with 30–60% improvement in motor score evaluations.[kaynak belirtilmeli ]
Rehabilitasyon
Exercise programs are recommended in people with Parkinson's disease.[14] There is some evidence that speech or mobility problems can improve with rehabilitation, although studies are scarce and of low quality.[113][114] Düzenli fiziksel egzersiz birlikte veya ayrı fizik Tedavi can be beneficial to maintain and improve mobility, flexibility, strength, gait speed, and quality of life.[114] When an exercise program is performed under the supervision of a physiotherapist, there are more improvements in motor symptoms, mental and emotional functions, daily living activities, and quality of life compared to a self-supervised exercise program at home.[115] In terms of improving flexibility and range of motion for people experiencing katılık, generalized relaxation techniques such as gentle rocking have been found to decrease excessive muscle tension. Other effective techniques to promote relaxation include slow rotational movements of the extremities and trunk, rhythmic initiation, diaphragmatic breathing, ve meditasyon teknikleri.[116] As for gait and addressing the challenges associated with the disease such as hipokinezi (slowness of movement), shuffling and decreased arm swing; physiotherapists have a variety of strategies to improve functional mobility and safety. Areas of interest with respect to gait during rehabilitation programs focus on, but are not limited to improving gait speed, the base of support, stride length, trunk and arm swing movement. Strategies include utilizing assistive equipment (pole walking and treadmill walking), verbal cueing (manual, visual and auditory), exercises (marching and PNF patterns) and altering environments (surfaces, inputs, open vs. closed).[117] Strengthening exercises have shown improvements in strength and motor function for people with primary muscular weakness and weakness related to inactivity with mild to moderate Parkinson's disease. However, reports show a significant interaction between strength and the time the medications was taken. Therefore, it is recommended that people with PD should perform exercises 45 minutes to one hour after medications when they are at their best.[118] Also, due to the forward flexed posture, and respiratory dysfunctions in advanced Parkinson's disease, deep diaphragmatic breathing exercises are beneficial in improving chest wall mobility and vital capacity.[119] Exercise may improve constipation.[13] It is unclear if exercise reduces physical fatigue in PD.[109]
One of the most widely practiced treatments for speech disorders associated with Parkinson's disease is the Lee Silverman ses tedavisi (LSVT).[113][120] Speech therapy and specifically LSVT may improve speech.[113] İş terapisi (OT) aims to promote health and quality of life by helping people with the disease to participate in as many of their daily living activities olabildiğince.[113] There have been few studies on the effectiveness of OT and their quality is poor, although there is some indication that it may improve motor skills and quality of life for the duration of the therapy.[113][121]
Palyatif bakım
Palyatif bakım is specialized medical care for people with serious illnesses, including Parkinson's. The goal of this speciality is to improve quality of life for both the person with Parkinson's and the family by providing relief from the symptoms, pain, and stress of illnesses.[122] As Parkinson's is not a curable disease, all treatments are focused on slowing decline and improving quality of life, and are therefore palliative in nature.[123]
Palliative care should be involved earlier, rather than later in the disease course.[124][125] Palliative care specialists can help with physical symptoms, emotional factors such as loss of function and jobs, depression, fear, and existential concerns.[124][125][126]
Along with offering emotional support to both the patient and family, palliative care serves an important role in addressing goals of care. People with Parkinson's may have many difficult decisions to make as the disease progresses such as wishes for besleme tüpü, non-invasive ventilator, ve trakeostomi; wishes for or against kardiyopulmoner resüsitasyon; and when to use darülaceze bakım.[123] Palliative care team members can help answer questions and guide people with Parkinson's on these complex and emotional topics to help them make the best decision based on their own values.[125][127]
Muscles and nerves that control the digestive process may be affected by PD, resulting in kabızlık ve gastroparezi (food remaining in the stomach for a longer period than normal).[13] A balanced diet, based on periodical nutritional assessments, is recommended and should be designed to avoid weight loss or gain and minimize consequences of gastrointestinal dysfunction.[13] As the disease advances, swallowing difficulties (disfaji ) may appear. In such cases it may be helpful to use koyulaştırıcı ajanlar for liquid intake and an upright posture when eating, both measures reducing the risk of choking. Gastrostomi to deliver food directly into the stomach is possible in severe cases.[13]
Levodopa and proteinler use the same transportation system in the intestine and the blood–brain barrier, thereby competing for access.[13] When they are taken together, this results in a reduced effectiveness of the drug.[13] Therefore, when levodopa is introduced, excessive protein consumption is discouraged and well balanced Akdeniz diyeti tavsiye edilir. In advanced stages, additional intake of low-protein products such as bread or pasta is recommended for similar reasons.[13] To minimize interaction with proteins, levodopa should be taken 30 minutes before meals.[13] At the same time, regimens for PD restrict proteins during breakfast and lunch, allowing protein intake in the evening.[13]
Prognoz

| veri yok < 5 5–12.5 12.5–20 20–27.5 27.5–35 35–42.5 | 42.5–50 50–57.5 57.5–65 65–72.5 72.5–80 > 80 |
PD invariably progresses with time. A severity rating method known as the Birleşik Parkinson hastalığı derecelendirme ölçeği (UPDRS) is the most commonly used metric for clinical study. A modified version known as the MDS-UPDRS is also sometimes used. An older scaling method known as the Hoehn and Yahr scale (originally published in 1967), and a similar scale known as the Modified Hoehn and Yahr scale, have also been commonly used. The Hoehn and Yahr scale defines five basic stages of progression.
Motor symptoms, if not treated, advance aggressively in the early stages of the disease and more slowly later. Untreated, individuals are expected to lose independent ambulation after an average of eight years and be bedridden after ten years.[128] However, it is uncommon to find untreated people nowadays. Medication has improved the prognosis of motor symptoms, while at the same time it is a new source of disability, because of the undesired effects of levodopa after years of use.[128] In people taking levodopa, the progression time of symptoms to a stage of high dependency from caregivers may be over 15 years.[128] However, it is hard to predict what course the disease will take for a given individual.[128] Age is the best predictor of disease progression.[66] The rate of motor decline is greater in those with less impairment at the time of diagnosis, while cognitive impairment is more frequent in those who are over 70 years of age at symptom onset.[66]
Since current therapies improve motor symptoms, disability at present is mainly related to non-motor features of the disease.[66] Nevertheless, the relationship between disease progression and disability is not linear. Disability is initially related to motor symptoms.[128] As the disease advances, disability is more related to motor symptoms that do not respond adequately to medication, such as swallowing/speech difficulties, and gait/balance problems; and also to levodopa-induced complications, which appear in up to 50% of individuals after 5 years of levodopa usage.[128] Finally, after ten years most people with the disease have autonomic disturbances, sleep problems, mood alterations and cognitive decline.[128] All of these symptoms, especially cognitive decline, greatly increase disability.[66][128]
yaşam beklentisi of people with PD is reduced.[128] Mortality ratios are around twice those of unaffected people.[128] Cognitive decline and dementia, old age at onset, a more advanced disease state and presence of swallowing problems are all mortality risk factors. On the other hand, a disease pattern mainly characterized by tremor as opposed to rigidity predicts an improved survival.[128] Death from aspirasyon pnömonisi is twice as common in individuals with PD as in the healthy population.[128]
In 2016 PD resulted in about 211,000 deaths globally, an increase of 161% since 1990.[129] The death rate increased by 19% to 1.81 per 100,000 people during that time.[129]
Epidemiyoloji

PD is the second most common nörodejeneratif bozukluk sonra Alzheimer hastalığı and affects approximately seven million people globally and one million people in the United States.[38][50][130] proportion in a population at a given time is about 0.3% in industrialized countries. PD is more common in the elderly and rates rise from 1% in those over 60 years of age to 4% of the population over 80.[50] The mean age of onset is around 60 years, although 5–10% of cases, classified as young onset PD, begin between the ages of 20 and 50.[12] Males are more often affected than females at a ratio of around 3:2.[4] PD may be less prevalent in those of African and Asian ancestry, although this finding is disputed.[50] Some studies have proposed that it is more common in men than women, but others failed to detect any differences between the two sexes.[50] yıllık yeni vaka sayısı of PD is between 8 and 18 per 100,000 person–years.[50] The age adjusted rate of Parkinson's disease in Estonia is 28.0/100,000 person years.[131] The Estonian rate has been stable between 2000 and 2019.[131]
Tarih

Several early sources, including an Mısırlı papirüs, bir Ayurveda medical treatise, the Kutsal Kitap, ve Galen 's writings, describe symptoms resembling those of PD.[132] After Galen there are no references unambiguously related to PD until the 17th century.[132] In the 17th and 18th centuries, several authors wrote about elements of the disease, including Sylvius, Gaubius, Avcı ve Chomel.[132][133][134]
In 1817 an English doctor, James Parkinson, published his essay reporting six cases of paralysis agitans.[17] Titreyen Felç Üzerine Bir Deneme karakteristik istirahat titremesini, anormal duruş ve yürüyüşü, felç ve kas gücünün azalmasını ve hastalığın zamanla nasıl ilerlediğini anlattı.[15][135] Early neurologists who made further additions to the knowledge of the disease include Trousseau, Gowers, Kinnier Wilson ve Erb, and most notably Jean-Martin Charcot, whose studies between 1868 and 1881 were a landmark in the understanding of the disease.[17] Among other advances, he made the distinction between rigidity, weakness and bradykinesia.[17] He also championed the renaming of the disease in honor of James Parkinson.[17]
1912'de Frederic Lewy described microscopic particles in affected brains, later named "Lewy cisimleri ".[17] 1919'da Konstantin Tretiakoff substantia nigra'nın etkilenen ana serebral yapı olduğunu bildirdi, ancak bu bulgunun yayınladığı ileri çalışmalarla doğrulanana kadar geniş çapta kabul görmediğini bildirdi. Rolf Hassler 1938'de.[17] Temel biyokimyasal changes in the beyin were identified in the 1950s, due largely to the work of Arvid Carlsson nörotransmiter dopamin üzerinde ve Oleh Hornykiewicz PD'deki rolü üzerine.[136] In 1997, alpha-synuclein was found to be the main component of Lewy bodies by Spillantini, Trojanowski, Goedert ve diğerleri.[67]
Anticholinergics and surgery (lesioning of the kortikospinal yol or some of the basal ganglia structures) were the only treatments until the arrival of levodopa, which reduced their use dramatically.[133][137] Levodopa ilk olarak 1911'de sentezlendi Casimir Funk ancak 20. yüzyılın ortalarına kadar çok az ilgi gördü.[136] It entered clinical practice in 1967 and brought about a revolution in the management of PD.[136][138] By the late 1980s Derin beyin uyarımı tarafından tanıtıldı Alim Louis Benabid ve şuradaki meslektaşlarım Grenoble, France, emerged as a possible treatment.[139]
Toplum ve kültür
Maliyet
Bu makalenin olması gerekiyor güncellenmiş. (Ağustos 2020) |

The costs of PD to society are high, but precise calculations are difficult due to methodological issues in research and differences between countries.[140] The annual cost in the UK is estimated to be between £49 million and £3.3 billion, while the cost per patient per year in the U.S. is probably around $10,000 and the total burden around $23 billion.[140] The largest share of direct cost comes from hasta bakımı and nursing homes, while the share coming from medication is substantially lower.[140] Indirect costs are high, due to reduced productivity and the burden on caregivers.[140] In addition to economic costs, PD reduces yaşam kalitesi of those with the disease and their caregivers.[140]
Savunuculuk
The birthday of James Parkinson, 11 April, has been designated as World Parkinson's Day.[17] A red tulip was chosen by international organizations as the symbol of the disease in 2005: it represents the James Parkinson Tulip kültivar, registered in 1981 by a Dutch horticulturalist.[141] Advocacy organizations include the Ulusal Parkinson Vakfı, which has provided more than $180 million in care, research and support services since 1982,[142] Parkinson Hastalığı Vakfı, which has distributed more than $115 million for research and nearly $50 million for education and advocacy programs since its founding in 1957 by William Black;[143][144] American Parkinson Disease Association, founded in 1961;[145] ve European Parkinson's Disease Association, founded in 1992.[146]
Önemli durumlar

Aktör Michael J. Fox has PD and has greatly increased the public awareness of the disease.[18] After diagnosis, Fox embraced his Parkinson's in television roles, sometimes acting without medication, in order to further illustrate the effects of the condition. He has written two autobiographies in which his fight against the disease plays a major role,[147] and appeared before the Amerika Birleşik Devletleri Kongresi without medication to illustrate the effects of the disease.[147] Michael J. Fox Vakfı Parkinson hastalığı için bir tedavi geliştirmeyi amaçlamaktadır.[147] Fox received an Onursal doktora in medicine from Karolinska Enstitüsü for his contributions to research in Parkinson's disease.[148]
Professional cyclist and Olympic medalist Davis Phinney, who was diagnosed with young onset Parkinson's at age 40, started the Davis Phinney Foundation in 2004 to support Parkinson's research, focusing on quality of life for people with the disease.[19][149]
Boksör Muhammed Ali showed signs of Parkinson's when he was 38, but was not diagnosed until he was 42, and has been called the "World's most famous Parkinson's patient".[20] Whether he had PD or parkinsonism related to boxing is unresolved.[150][151]
Araştırma
Bu makalenin olması gerekiyor güncellenmiş. (Temmuz 2020) |
There are no approved disease modifying drugs (drugs that target the causes or damage) for Parkinson's, this is a major focus of Parkinson's research.[152] Active research directions include the search for new hayvan modelleri of the disease and studies of the potential usefulness of gen tedavisi, kök hücre transplants and nöroprotektif ajanlar.[152]
Hayvan modelleri
PD is not known to occur naturally in any species other than humans, although animal models which show some features of the disease are used in research. The appearance of parkinsonism in a group of drug addicts in the early 1980s who consumed a contaminated batch of the synthetic afyon MPPP led to the discovery of the chemical MPTP as an agent that causes parkinsonism in non-human primates as well as in humans.[153] Other predominant toxin-based models employ the insecticide rotenone, the herbicide paraquat and the fungicide maneb.[154] Models based on toxins are most commonly used in primatlar. Transgenik rodent models that replicate various aspects of PD have been developed.[155] Kullanımı nörotoksin 6-hydroxydopamine, creates a model of Parkinson's disease in rats by targeting and destroying dopaminergic neurons in the nigrostriatal pathway when injected into the substantia nigra.[156]
Gen tedavisi
Gene therapy typically involves the use of a non-infectious virüs (i.e., a viral vector benzeri adeno-associated virus ) to shuttle genetic material into a part of the brain. Several approaches have been tried. These approaches have involved the expression of growth factors to try to prevent damage (Nörturin - bir GDNF -family growth factor), and enzymes such as glutamic acid decarboxylase (GAD – the enzyme that produces GABA ), tyrosine hydroxylase (the enzyme that produces L-DOPA) and katekol-O-metil transferaz (COMT – the enzyme that converts L-DOPA to dopamine). There have been no reported safety concerns, but the approaches have largely failed in phase 2 clinical trials.[152] The delivery of GAD showed promise in phase 2 trials in 2011, but whilst effective at improving motor function was inferior to DBS. Follow-up studies in the same cohort have suggested persistent improvement.[157]
Neuroprotective treatments

Investigations on nöroproteksiyon are at the forefront of PD research. Several molecules have been proposed as potential treatments.[66] However, none of them have been conclusively demonstrated to reduce degeneration.[66] Agents currently under investigation include, antiglutamatergics, monoamin oksidaz inhibitörleri (selegilin, rasagilin ), promitochondrials (coenzyme Q10, kreatin ), Kalsiyum kanal blokerleri (isradipine ) ve büyüme faktörleri (GDNF ).[66] İndirgeme alpha-synuclein pathology is a major focus of preclinical research.[158] Bir aşı that primes the human immune system to destroy alpha-synuclein, PD01A (developed by Austrian company, Affiris), entered clinical trials and a phase 1 report in 2020 suggested safety and tolerability.[159][160] In 2018, an antibody, PRX002/RG7935, showed preliminary safety evidence in stage I trials supporting continuation to stage II trials.[161]
Cell-based therapies
Since early in the 1980s, cenin, porcine, karotis veya retina tissues have been used in cell transplants, in which dissociated cells are injected into the substantia nigra in the hope that they will incorporate themselves into the brain in a way that replaces the dopamine-producing cells that have been lost.[66] These sources of tissues have been largely replaced by uyarılmış pluripotent kök hücre derived dopaminergic neurons as this is thought to represent a more feasible source of tissue. There was initial evidence of mesencephalic dopamine-producing cell transplants being beneficial, double-blind trials to date have not determined whether there is a long-term benefit.[162] An additional significant problem was the excess release of dopamine by the transplanted tissue, leading to diskinezi.[162] In 2020, a first in human clinical trial reported the transplantation of induced pluripotent stem cells into the brain of a person suffering from Parkinson's disease. [163]
Diğer
Repetitive transcranial magnetic stimulation temporarily improves levodopa-induced dyskinesias.[164] Its usefulness in PD is an open research topic.[165] Birkaç besinler have been proposed as possible treatments; however there is no evidence that vitaminler veya Gıda katkı maddeleri improve symptoms.[166] There is no evidence to substantiate that akupunktur ve uygulaması Çigong veya Tai Chi, have any effect on the course of the disease or symptoms.[167][168][169]
Rolü bağırsak-beyin ekseni ve bağırsak florası in Parkinsons became a topic of study in the 2010s, starting with work in germ-free transgenic mice, in which dışkı nakli from people with PD had worse outcomes. Some studies in humans have shown a correlation between patterns of dysbiosis in the gut flora in the people with PD, and these patterns, along with a measure of severity of constipation, could diagnose PD with a 90% specificity but only a 67% sensitivity. As of 2017 some scientists hypothesized that changes in the gut flora might be an early site of PD pathology, or might be part of the pathology.[170][171] Evidence indicates that gut microbiota can produce lipopolisakkarit that interferes with the normal function of α-synuclein.[172]
Ventures have been undertaken to explore antagonists of adenosin reseptörleri (özellikle Bir2A ) as an avenue for novel drugs for Parkinson's.[173] Bunların, istradefylline has emerged as the most successful medication and was approved for medical use in the United States in 2019.[174] It is approved as an add-on treatment to the levodopa/carbidopa regime.[174]
Referanslar
- ^ a b c d e f g h ben j k l "Parkinson's Disease Information Page". NINDS. 30 Haziran 2016. Alındı 18 Temmuz 2016.
- ^ a b c d e f g Sveinbjornsdottir S (October 2016). "The clinical symptoms of Parkinson's disease". Nörokimya Dergisi. 139 Suppl 1: 318–24. doi:10.1111/jnc.13691. PMID 27401947.
- ^ a b Carroll WM (2016). International Neurology. John Wiley & Sons. s. 188. ISBN 978-1118777367. Arşivlendi 8 Eylül 2017 tarihinde orjinalinden.
- ^ a b c d e f g h ben j k Kalia LV, Lang AE (August 2015). "Parkinson's disease". Lancet. 386 (9996): 896–912. doi:10.1016/s0140-6736(14)61393-3. PMID 25904081. S2CID 5502904.
- ^ Ferri FF (2010). "Chapter P". Ferri'nin ayırıcı tanısı: Semptomların, belirtilerin ve klinik bozuklukların ayırıcı tanısı için pratik bir kılavuz (2. baskı). Philadelphia, PA: Elsevier/Mosby. ISBN 978-0323076999.
- ^ Macleod AD, Taylor KS, Counsell CE (November 2014). "Mortality in Parkinson's disease: a systematic review and meta-analysis". Hareket Bozuklukları. 29 (13): 1615–22. doi:10.1002/mds.25898. PMID 24821648.
- ^ a b GBD 2015 Hastalık Yaralanma İnsidans Yaygınlığı İşbirlikçileri (Ekim 2016). "Küresel, bölgesel ve ulusal insidans, yaygınlık ve 310 hastalık ve yaralanmada engellilikle geçen yıllar, 1990–2015: Küresel Hastalık Yükü Çalışması 2015 için sistematik bir analiz". Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ^ a b GBD 2015 Ölüm Sebepleri İşbirlikçileri (Ekim 2016). "Küresel, bölgesel ve ulusal yaşam beklentisi, tüm nedenlere bağlı ölüm oranı ve 249 ölüm nedeni için nedene özgü ölüm oranı, 1980–2015: Küresel Hastalık Yükü Çalışması 2015 için sistematik bir analiz". Lancet. 388 (10053): 1459–1544. doi:10.1016 / s0140-6736 (16) 31012-1. PMC 5388903. PMID 27733281.
- ^ "Understanding Parkinson's". Parkinson Vakfı. Alındı 12 Ağustos 2020.
- ^ Barranco Quintana JL, Allam MF, Del Castillo AS, Navajas RF (February 2009). "Parkinson's disease and tea: a quantitative review". Journal of the American College of Nutrition. 28 (1): 1–6. doi:10.1080/07315724.2009.10719754. PMID 19571153. S2CID 26605333.
- ^ Mosley AD (2010). The encyclopedia of Parkinson's disease (2. baskı). New York: Dosyadaki Gerçekler. s. 89. ISBN 978-1438127491. Arşivlendi 8 Eylül 2017 tarihinde orjinalinden.
- ^ a b c d e f g h ben j k Samii A, Nutt JG, Ransom BR (May 2004). "Parkinson's disease". Lancet. 363 (9423): 1783–93. doi:10.1016/S0140-6736(04)16305-8. PMID 15172778. S2CID 35364322.
- ^ a b c d e f g h ben j k Barichella M, Cereda E, Pezzoli G (October 2009). "Major nutritional issues in the management of Parkinson's disease". Hareket Bozuklukları. 24 (13): 1881–92. doi:10.1002/mds.22705. hdl:2434/67795. PMID 19691125. S2CID 23528416.
- ^ a b c Ahlskog JE (July 2011). "Kuvvetli egzersizin Parkinson hastalığında nöroprotektif bir etkisi var mı?". Nöroloji. 77 (3): 288–94. doi:10.1212/wnl.0b013e318225ab66. PMC 3136051. PMID 21768599.
- ^ a b Parkinson J (1817). Titreyen Felç Üzerine Bir Deneme. London: Whittingham and Roland for Sherwood, Neely, and Jones. Arşivlendi 24 Eylül 2015 tarihinde orjinalinden.
- ^ Shulman JM, De Jager PL, Feany MB (February 2011) [25 October 2010]. "Parkinson's disease: genetics and pathogenesis". Patolojinin Yıllık İncelemesi. 6: 193–222. doi:10.1146/annurev-pathol-011110-130242. PMID 21034221. S2CID 8328666.
- ^ a b c d e f g h Lees AJ (September 2007). "James Parkinson'un 250. doğum günü kutlamalarında sarsılan felçle ilgili çözülmemiş sorunlar". Hareket Bozuklukları. 22 Suppl 17 (Suppl 17): S327–34. doi:10.1002 / mds.21684. PMID 18175393. S2CID 9471754.
- ^ a b Davis P (3 May 2007). "Michael J. Fox". The TIME 100. Zaman. Arşivlendi from the original on 25 April 2011. Alındı 2 Nisan 2011.
- ^ a b Macur J (26 March 2008). "For the Phinney Family, a Dream and a Challenge". New York Times. Arşivlendi 6 Kasım 2014 tarihinde orjinalinden. Alındı 25 Mayıs 2013.
About 1.5 million Americans have received a diagnosis of Parkinson's disease, but only 5 to 10 percent learn of it before age 40, according to the National Parkinson Foundation. Davis Phinney was among the few.
- ^ a b Brey RL (April 2006). "Muhammad Ali's Message: Keep Moving Forward". Nöroloji Şimdi. 2 (2): 8. doi:10.1097/01222928-200602020-00003. Arşivlenen orijinal 27 Eylül 2011'de. Alındı 22 Ağustos 2020.
- ^ Alltucker K (31 July 2018). "Alan Alda has Parkinson's disease: Here are 5 things you should know". Bugün Amerika. Alındı 6 Mayıs 2019.
- ^ Ling H, Massey LA, Lees AJ, Brown P, Day BL (April 2012). "Hypokinesia without decrement distinguishes progressive supranuclear palsy from Parkinson's disease". Beyin. 135 (Pt 4): 1141–53. doi:10.1093/brain/aws038. PMC 3326257. PMID 22396397.
- ^ "Parkinson's Disease vs. Parkinsonism" (PDF). National Parkinson Foundation. Arşivlenen orijinal (PDF) 30 Ağustos 2017. Alındı 22 Haziran 2017.
- ^ "Queen Square Brain Bank diagnostic criteria for Parkinson's disease". Alındı 22 Haziran 2017.
- ^ Schrag A (2007). "Epidemiology of movement disorders". In Tolosa E, Jankovic JJ (eds.). Parkinson's disease and movement disorders. Hagerstown, Maryland: Lippincott Williams & Wilkins. pp. 50–66. ISBN 978-0-7817-7881-7.
- ^ Nuytemans K, Theuns J, Cruts M, Van Broeckhoven C (July 2010) [18 May 2010]. "Genetic etiology of Parkinson disease associated with mutations in the SNCA, PARK2, PINK1, PARK7, and LRRK2 genes: a mutation update". İnsan Mutasyonu. 31 (7): 763–80. doi:10.1002/humu.21277. PMC 3056147. PMID 20506312.
- ^ Galpern WR, Lang AE (March 2006) [17 February 2006]. "Interface between tauopathies and synucleinopathies: a tale of two proteins". Nöroloji Yıllıkları. 59 (3): 449–58. doi:10.1002/ana.20819. PMID 16489609. S2CID 19395939.
- ^ a b Aarsland D, Londos E, Ballard C (April 2009) [28 January 2009]. "Parkinson's disease dementia and dementia with Lewy bodies: different aspects of one entity". International Psychogeriatrics. 21 (2): 216–19. doi:10.1017/S1041610208008612. PMID 19173762.
- ^ Photo by Arthur Londe from Nouvelle Iconographie de la Salpètrière, cilt. 5, p. 226
- ^ Charcot J, Sigerson G (1879). Lectures on the diseases of the nervous system (İkinci baskı). Philadelphia: Henry C. Lea. s.113.
The strokes forming the letters are very irregular and sinuous, whilst the irregularities and sinuosities are of a very limited width. (...) the down-strokes are all, with the exception of the first letter, made with comparative firmness and are, in fact, nearly normal – the finer up-strokes, on the contrary, are all tremulous in appearance (...).
- ^ a b c d e f g h ben j k l m n Ö p q r s t sen v w Jankovic J (April 2008). "Parkinson's disease: clinical features and diagnosis". Nöroloji, Nöroşirürji ve Psikiyatri Dergisi. 79 (4): 368–76. doi:10.1136/jnnp.2007.131045. PMID 18344392. Arşivlendi from the original on 19 August 2015.
- ^ a b Cooper G, Eichhorn G, Rodnitzky RL (2008). "Parkinson's disease". In Conn PM (ed.). Neuroscience in medicine. Totowa, NJ: Humana Press. pp. 508–12. ISBN 978-1-60327-454-8.
- ^ Lees AJ, Hardy J, Revesz T (June 2009). "Parkinson's disease". Lancet. 373 (9680): 2055–66. doi:10.1016/S0140-6736(09)60492-X. PMID 19524782. S2CID 42608600.
- ^ Banich MT, Compton RJ (2011). "Motor control". Bilişsel sinirbilim. Belmont, CA: Wadsworth, Cengage learning. pp. 108–44. ISBN 978-0-8400-3298-0.
- ^ Longmore M, Wilkinson IB, Turmezei T, Cheung CK (4 January 2007). Oxford Handbook of Clinical Medicine. Oxford University Press. s. 486. ISBN 978-0-19-856837-7.
- ^ Fung VS, Thompson PD (2007). "Rigidity and spasticity". In Tolosa E, Jankovic (eds.). Parkinson's disease and movement disorders. Hagerstown, MD: Lippincott Williams & Wilkins. pp. 504–13. ISBN 978-0-7817-7881-7.
- ^ O'Sullivan SB, Schmitz TJ (2007). "Parkinson hastalığı". Fiziksel Rehabilitasyon (5. baskı). Philadelphia: F.A. Davis. pp. 856–57.
- ^ a b Yao SC, Hart AD, Terzella MJ (May 2013). "An evidence-based osteopathic approach to Parkinson disease". Osteopathic Family Physician. 5 (3): 96–101. doi:10.1016/j.osfp.2013.01.003.
- ^ Hallett M, Poewe W (13 October 2008). Therapeutics of Parkinson's Disease and Other Movement Disorders. John Wiley & Sons. s. 417. ISBN 978-0-470-71400-3. Arşivlendi 8 Eylül 2017 tarihinde orjinalinden.
- ^ Hoehn MM, Yahr MD (May 1967). "Parkinsonizm: başlangıç, ilerleme ve ölüm oranı". Nöroloji. 17 (5): 427–42. doi:10.1212 / wnl.17.5.427. PMID 6067254.
- ^ Pahwa R, Lyons KE (25 Mart 2003). Parkinson Hastalığı El Kitabı (Üçüncü baskı). CRC Basın. s. 76. ISBN 978-0-203-91216-4. Arşivlendi 8 Eylül 2017 tarihinde orjinalinden.
- ^ a b c d e f g Caballol N, Martí MJ, Tolosa E (Eylül 2007). Parkinson hastalığında "bilişsel işlev bozukluğu ve demans". Hareket Bozuklukları. 22 Ek 17 (Ek 17): S358–66. doi:10.1002 / mds.21677. PMID 18175397. S2CID 3229727.
- ^ a b c Parker KL, Lamichhane D, Caetano MS, Narayanan NS (Ekim 2013). "Parkinson hastalığında yönetici işlev bozukluğu ve zamanlama eksiklikleri". Bütünleştirici Sinirbilimde Sınırlar. 7: 75. doi:10.3389 / fnint.2013.00075. PMC 3813949. PMID 24198770.
- ^ Gomperts SN (Nisan 2016). "Lewy Vücut Demansları: Lewy Gövdeli Demans ve Parkinson Hastalığı Demansı". Süreklilik (Minneap Minn) (Gözden geçirmek). 22 (2 Demans): 435–63. doi:10.1212 / CON.0000000000000309. PMC 5390937. PMID 27042903.
- ^ Garcia-Ptacek S, Kramberger MG (Eylül 2016). "Parkinson Hastalığı ve Demans". Geriatrik Psikiyatri ve Nöroloji Dergisi. 29 (5): 261–70. doi:10.1177/0891988716654985. PMID 27502301. S2CID 21279235.
- ^ a b Noyce AJ, Bestwick JP, Silveira-Moriyama L, vd. (Aralık 2012). "Parkinson hastalığı için erken motor olmayan özelliklerin ve risk faktörlerinin meta analizi". Nöroloji Yıllıkları (Gözden geçirmek). 72 (6): 893–901. doi:10.1002 / ana.23687. PMC 3556649. PMID 23071076.
- ^ Shergill SS, Walker Z, Le Katona C (Ekim 1998). "Parkinson hastalığında yanallığın ve psikoza yatkınlığın ön araştırması". Nöroloji, Nöroşirürji ve Psikiyatri Dergisi. 65 (4): 610–11. doi:10.1136 / jnnp.65.4.610. PMC 2170290. PMID 9771806.
- ^ Friedman JH (Kasım 2010). "Parkinson hastalığı psikozu 2010: bir inceleme makalesi". Parkinsonizm ve İlgili Bozukluklar. 16 (9): 553–60. doi:10.1016 / j.parkreldis.2010.05.004. PMID 20538500.
- ^ Kim YE, Jeon BS (1 Ocak 2014). "Parkinson hastalığında REM uyku davranış bozukluğunun klinik anlamı". Parkinson Hastalığı Dergisi. 4 (2): 237–44. doi:10.3233 / jpd-130293. PMID 24613864.
- ^ a b c d e f g h ben de Lau LM, Breteler MM (Haziran 2006). "Parkinson hastalığının epidemiyolojisi". Neşter. Nöroloji. 5 (6): 525–35. doi:10.1016 / S1474-4422 (06) 70471-9. PMID 16713924. S2CID 39310242.
- ^ Barreto GE, Iarkov A, Moran VE (Ocak 2015). "Nikotin, kotinin ve metabolitlerinin Parkinson hastalığı için potansiyel ajanlar olarak faydalı etkileri". Yaşlanma Nörobiliminde Sınırlar. 6: 340. doi:10.3389 / fnagi.2014.00340. PMC 4288130. PMID 25620929.
- ^ Çamcı G, Oğuz S (Nisan 2016). "Parkinson Hastalığı ve Helikobakter pilori". Klinik Nöroloji Dergisi. 12 (2): 147–50. doi:10.3988 / jcn.2016.12.2.147. PMC 4828559. PMID 26932258.
- ^ McGee DJ, Lu XH, Disbrow EA (2018). "Parkinson Hastalığında Helicobacter pylori için Patojenik Bir Rol Olasılığını Bulmak". Parkinson Hastalığı Dergisi. 8 (3): 367–74. doi:10.3233 / JPD-181327. PMC 6130334. PMID 29966206.
- ^ Chahine LM, Stern MB, Chen-Plotkin A (Ocak 2014). "Parkinson hastalığı için kan bazlı biyolojik belirteçler". Parkinsonizm ve İlgili Bozukluklar. 20 Özel Sayı 1: S99–103. doi:10.1016 / S1353-8020 (13) 70025-7. PMC 4070332. PMID 24262199.
- ^ a b c d e Lesage S, Brice A (Nisan 2009). "Parkinson hastalığı: monojenik formlardan genetik duyarlılık faktörlerine". İnsan Moleküler Genetiği. 18 (R1): R48–59. doi:10.1093 / hmg / ddp012. PMID 19297401.
- ^ a b Kalia LV, Lang AE (Ağustos 2015). "Parkinson hastalığı". Lancet. 386 (9996): 896–912. doi:10.1016 / S0140-6736 (14) 61393-3. PMID 25904081. S2CID 5502904.
- ^ Dexter DT, Jenner P (Eylül 2013). "Parkinson hastalığı: patolojiden moleküler hastalık mekanizmalarına". Ücretsiz Radikal Biyoloji ve Tıp. 62: 132–44. doi:10.1016 / j.freeradbiomed.2013.01.018. PMID 23380027.
- ^ Stoker TB, Torsney KM, Barker RA (2018). "GBA1 mutasyonu ile ilişkili Parkinson hastalığının patolojik mekanizmaları ve klinik yönleri.". Stoker TB'de, Greenland JC (editörler). Parkinson Hastalığı: Patogenez ve klinik yönler. Brisbane: Codon Yayınları.
- ^ a b Abugable AA, Morris JL, Palminha NM, vd. (Eylül 2019). "DNA onarımı ve nörolojik hastalık: Moleküler anlayıştan teşhis ve model organizmaların gelişimine". DNA Onarımı. 81: 102669. doi:10.1016 / j.dnarep.2019.102669. PMID 31331820.
- ^ a b c d Davie CA (2008). "Parkinson hastalığının gözden geçirilmesi". İngiliz Tıp Bülteni. 86 (1): 109–27. doi:10.1093 / bmb / ldn013. PMID 18398010.
- ^ Gan-Or Z, Dion PA, Rouleau GA (2 Eylül 2015). "Otofaji-lizozom yolunun Parkinson hastalığında rolüne genetik bakış açısı". Otofaji. 11 (9): 1443–57. doi:10.1080/15548627.2015.1067364. PMC 4590678. PMID 26207393.
- ^ Quadri M, Mandemakers W, Grochowska MM, ve diğerleri. (Temmuz 2018). "Ailevi Parkinson hastalığı ve Lewy cisimcikli demansta LRP10 genetik varyantları: genom çapında bir bağlantı ve sıralama çalışması". Neşter. Nöroloji. 17 (7): 597–608. doi:10.1016 / s1474-4422 (18) 30179-0. PMID 29887161. S2CID 47009438.
- ^ a b Dickson DV (2007). "Hareket bozukluklarının nöropatolojisi". Tolosa E, Jankovic JJ (editörler). Parkinson hastalığı ve hareket bozuklukları. Hagerstown, MD: Lippincott Williams & Wilkins. s. 271–83. ISBN 978-0-7817-7881-7.
- ^ Jubault T, Brambati SM, Degroot C, Kullmann B, Strafella AP, Lafontaine AL, Chouinard S, Monchi O (Aralık 2009). Gendelman HE (ed.). "İdiyopatik Parkinson hastalığında anatomik MR ile tespit edilen bölgesel beyin sapı atrofisi". PLOS ONE. 4 (12): e8247. Bibcode:2009PLoSO ... 4.8247J. doi:10.1371 / journal.pone.0008247. PMC 2784293. PMID 20011063.
- ^ a b c d e f Obeso JA, Rodríguez-Oroz MC, Benitez-Temino B, Blesa FJ, Guridi J, Marin C, Rodriguez M (2008). "Bazal gangliyonların fonksiyonel organizasyonu: Parkinson hastalığı için terapötik çıkarımlar". Hareket Bozuklukları. 23 Ek 3 (Ek 3): S548–59. doi:10.1002 / mds.22062. PMID 18781672. S2CID 13186083.
- ^ a b c d e f g h ben j k Obeso JA, Rodriguez-Oroz MC, Goetz CG, vd. (Haziran 2010). "Parkinson hastalığı bulmacasında eksik parçalar". Doğa Tıbbı. 16 (6): 653–61. doi:10.1038 / nm.2165. PMID 20495568. S2CID 3146438.
- ^ a b c Schulz-Schaeffer WJ (Ağustos 2010). "Lewy cisimcikli demansta alfa-sinüklein agregasyonunun sinaptik patolojisi, Parkinson hastalığı ve Parkinson hastalığı demansı". Acta Neuropathologica. 120 (2): 131–43. doi:10.1007 / s00401-010-0711-0. PMC 2892607. PMID 20563819.
- ^ Hirsch EC (Aralık 2009). "Parkinson hastalığında demir taşınması". Parkinsonizm ve İlgili Bozukluklar. 15 Özel Sayı 3 (Ek 3): S209–11. doi:10.1016 / S1353-8020 (09) 70816-8. PMID 20082992.
- ^ a b Kronik Koşullar için Ulusal İşbirliği Merkezi, ed. (2006). "Parkinson Hastalığının Teşhisi". Parkinson hastalığı. Londra: Kraliyet Hekimler Koleji. s. 29–47. ISBN 978-1-86016-283-1. Arşivlendi 24 Eylül 2010 tarihinde orjinalinden.
- ^ Poewe W, Wenning G (Kasım 2002). "Parkinson hastalığının ayırıcı tanısı". Avrupa Nöroloji Dergisi. 9 Özel Sayı 3 (Ek 3): 23–30. doi:10.1046 / j.1468-1331.9.s3.3.x. PMID 12464118.
- ^ Gibb WR, Lees AJ (Haziran 1988). "Lewy gövdesinin idiyopatik Parkinson hastalığının patogeneziyle ilgisi". Nöroloji, Nöroşirürji ve Psikiyatri Dergisi. 51 (6): 745–52. doi:10.1136 / jnnp.51.6.745. PMC 1033142. PMID 2841426.
- ^ Rizzo G, Copetti M, Arcuti S, Martino D, Fontana A, Logroscino G (Şubat 2016). "Parkinson hastalığının klinik teşhisinin doğruluğu: Sistematik bir inceleme ve meta-analiz". Nöroloji. 86 (6): 566–76. doi:10.1212 / WNL.0000000000002350. PMID 26764028. S2CID 207110404.
- ^ Postuma RB, Berg D, Stern M, Poewe W, Olanow CW, Oertel W, Obeso J, Marek K, Litvan I, Lang AE, Halliday G, Goetz CG, Gasser T, Dubois B, Chan P, Bloem BR, Adler CH , Deuschl G (Ekim 2015). "Parkinson hastalığı için MDS klinik tanı kriterleri". Hareket Bozuklukları. 30 (12): 1591–1601. doi:10.1002 / mds.26424. PMID 26474316. S2CID 35567298.
- ^ Berg D, Postuma RB, Adler CH, Bloem BR, Chan P, Dubois B, Gasser T, Goetz CG, Halliday G, Joseph L, Lang AE, Liepelt-Scarfone I, Litvan I, Marek K, Obeso J, Oertel W, Olanow CW, Poewe W, Stern M, Deuschl G (Ekim 2015). "Prodromal Parkinson hastalığı için MDS araştırma kriterleri" (PDF). Hareket Bozuklukları. 30 (12): 1600–11. doi:10.1002 / mds.26431. PMID 26474317. S2CID 206248344.
- ^ a b c d Brooks DJ (Nisan 2010). "Parkinson hastalığına görüntüleme yaklaşımları". Nükleer Tıp Dergisi. 51 (4): 596–609. doi:10.2967 / jnumed.108.059998. PMID 20351351.
- ^ Schwarz ST, Afzal M, Morgan PS, Bajaj N, Gowland PA, Auer DP (2014). "Sağlıklı nigrozomun 'kırlangıç kuyruğu' görünümü - Parkinson hastalığının yeni ve doğru bir testi: 3T'de bir vaka kontrollü ve geriye dönük kesitsel MRI çalışması". PLOS ONE. 9 (4): e93814. Bibcode:2014PLoSO ... 993814S. doi:10.1371 / journal.pone.0093814. PMC 3977922. PMID 24710392.
- ^ Mahlknecht P, Krismer F, Poewe W, Seppi K (Nisan 2017). "Parkinson hastalığı için bir belirteç olarak manyetik rezonans görüntülemede dorsolateral nigral hiperintensitenin meta-analizi". Hareket Bozuklukları. 32 (4): 619–23. doi:10.1002 / mds.26932. PMID 28151553. S2CID 7730034.
- ^ Cho SJ, Bae YJ, Kim JM, vd. (Eylül 2020). "Parkinson hastalığı olan hastalar için nöromelanine duyarlı manyetik rezonans görüntülemenin tanısal performansı ve heterojenliği için faktör analizi: sistematik bir inceleme ve meta-analiz". Avrupa Radyolojisi. 30 (10): 1–13. doi:10.1007 / s00330-020-07240-7. PMID 32886201. S2CID 221478854.
- ^ Suwijn SR, van Boheemen CJ, de Haan RJ, Tissingh G, Booij J, de Bie RM (2015). "Parkinson hastalığı veya klinik olarak belirsiz parkinsonizmi olan hastalarda nigrostriatal hücre kaybını tespit etmek için dopamin taşıyıcı SPECT görüntülemenin tanısal doğruluğu: sistematik bir inceleme". EJNMMI Araştırma. 5: 12. doi:10.1186 / s13550-015-0087-1. PMC 4385258. PMID 25853018.
- ^ "DaTSCAN Onay Mektubu" (PDF). FDA.gov. Gıda ve İlaç İdaresi. Alındı 22 Mart 2019.
- ^ Grönland JC, Stoker TB (2018). Parkinson Hastalığı: Patogenez ve Klinik Yönler. Codon Yayınları. s. 109–28. ISBN 978-0-9944381-6-4.
- ^ Costa J, Lunet N, Santos C, Santos J, Vaz-Carneiro A (2010). "Kafeine maruz kalma ve Parkinson hastalığı riski: sistematik bir inceleme ve gözlemsel çalışmaların meta-analizi". Alzheimer Hastalığı Dergisi. 20 Ek 1 (Ek 1): S221–38. doi:10.3233 / JAD-2010-091525. PMID 20182023.
- ^ Ma C, Liu Y, Neumann S, Gao X (2017). "Sigara içimi ve diyet ve Parkinson hastalığından kaynaklanan nikotin: bir inceleme". Translasyonel Nörodejenerasyon. 6: 18. doi:10.1186 / s40035-017-0090-8. PMC 5494127. PMID 28680589.
- ^ Dorsey ER, Sherer T, Okun MS, Bloem BR (2018). "Parkinson Pandemisinin Ortaya Çıkan Kanıtı". J Parkinsons Dis (Gözden geçirmek). 8 (s1): S3–8. doi:10.3233 / JPD-181474. PMC 6311367. PMID 30584159.
- ^ Gagne JJ, Power MC (Mart 2010). "Anti-inflamatuar ilaçlar ve Parkinson hastalığı riski: bir meta-analiz". Nöroloji. 74 (12): 995–1002. doi:10.1212 / WNL.0b013e3181d5a4a3. PMC 2848103. PMID 20308684.
- ^ Connolly BS, Lang AE (30 Nisan 2014). "Parkinson hastalığının farmakolojik tedavisi: bir inceleme". JAMA. 311 (16): 1670–83. doi:10.1001 / jama.2014.3654. PMID 24756517. S2CID 205058847.
- ^ "PD'nin motor ve dopaminerjik olmayan kısımları". Parkinson Hastalığı: Motor Olmayan ve Dopaminerjik Olmayan Özellikler. Olanow, C. Warren., Stocchi, Fabrizio., Lang, Anthony E. Wiley-Blackwell. 2011. ISBN 978-1405191852. OCLC 743205140.CS1 Maint: diğerleri (bağlantı)
- ^ a b c d e f g h ben j k l m n Ö p q r Kronik Koşullar için Ulusal İşbirliği Merkezi, ed. (2006). "Parkinson hastalığında semptomatik farmakolojik tedavi". Parkinson hastalığı. Londra: Kraliyet Hekimler Koleji. s. 59–100. ISBN 978-1-86016-283-1. Arşivlendi 24 Eylül 2010 tarihinde orjinalinden.
- ^ Zhang J, Tan LC (2016). "Parkinson Hastalığının Tıbbi Yönetimine Yeniden Bakış: Levodopa, Dopamin Agonistine Karşı". Güncel Nörofarmakoloji. 14 (4): 356–63. doi:10.2174 / 1570159X14666151208114634. PMC 4876591. PMID 26644151.
- ^ a b Pedrosa DJ, Timmermann L (2013). "Gözden geçirme: Parkinson hastalığının yönetimi". Nöropsikiyatrik Hastalık ve Tedavi (Gözden geçirmek). 9: 321–40. doi:10.2147 / NDT.S32302. PMC 3592512. PMID 23487540.
- ^ Kronik Koşullar için Ulusal İşbirliği Merkezi, ed. (2006). "Parkinson hastalığında palyatif bakım". Parkinson hastalığı. Londra: Kraliyet Hekimler Koleji. s. 147–51. ISBN 978-1-86016-283-1. Arşivlendi 24 Eylül 2010 tarihinde orjinalinden.
- ^ Maria N (2017). Levodopa farmakokinetiği - mideden beyne Parkinson hastalığı olan hastalar üzerinde bir çalışma. Linköping: Linköping Üniversitesi Elektronik Yayınları. s. 10. ISBN 978-9176855577. OCLC 993068595.
- ^ a b Oertel WH (13 Mart 2017). "Parkinson hastalığının tedavisinde son gelişmeler". F1000Research (Gözden geçirmek). 6: 260. doi:10.12688 / f1000research.10100.1. PMC 5357034. PMID 28357055.
- ^ Aquino CC, Fox SH (Ocak 2015). "Levodopa kaynaklı komplikasyonların klinik spektrumu". Hareket Bozuklukları. 30 (1): 80–89. doi:10.1002 / mds.26125. PMID 25488260. S2CID 22301199.
- ^ Poewe W, Seppi K, Tanner CM, vd. (Mart 2017). "Parkinson hastalığı". Doğa Yorumları. Hastalık Astarları. 3 (1): 17013. doi:10.1038 / nrdp.2017.13. PMID 28332488. S2CID 11605091.
- ^ a b "Opikapon ürün özelliklerinin özeti".
- ^ a b "Ürün özelliklerinin Entacapone özeti".
- ^ a b "Tolcapone ürün özelliklerinin özeti".
- ^ Scott LJ (Eylül 2016). "Opikapon: Parkinson Hastalığında Bir İnceleme". İlaçlar. 76 (13): 1293–1300. doi:10.1007 / s40265-016-0623-y. PMID 27498199. S2CID 5787752.
- ^ Watkins P (2000). "COMT inhibitörleri ve karaciğer toksisitesi". Nöroloji. 55 (11 Ek 4): S51–52. PMID 11147510.
- ^ "Ürün özelliklerinin stalevo özeti".
- ^ Goldenberg MM (Ekim 2008). "Parkinson hastalığının tıbbi yönetimi". P & T. 33 (10): 590–606. PMC 2730785. PMID 19750042.
- ^ Ceravolo R, Frosini D, Rossi C, Bonuccelli U (Aralık 2009). "Parkinson hastalığında dürtü kontrol bozuklukları: tanım, epidemiyoloji, risk faktörleri, nörobiyoloji ve yönetim". Parkinsonizm ve İlgili Bozukluklar. 15 Ek 4 (Ek 4): S111–15. doi:10.1016 / S1353-8020 (09) 70847-8. PMID 20123548.
- ^ Tolosa E, Katzenschlager R (2007). "Parkinson hastalığının farmakolojik yönetimi". Tolosa E, Jankovic JJ (editörler). Parkinson hastalığı ve hareket bozuklukları. Hagerstwon, MD: Lippincott Williams & Wilkins. sayfa 110–45. ISBN 978-0-7817-7881-7.
- ^ Crosby N, Deane KH, Clarke CE (2003). "Parkinson hastalığında amantadin". Sistematik İncelemelerin Cochrane Veritabanı (1): CD003468. doi:10.1002 / 14651858.CD003468. PMID 12535476.
- ^ a b Kronik Koşullar için Ulusal İşbirliği Merkezi, ed. (2006). "Parkinson hastalığının motor olmayan özellikleri". Parkinson hastalığı. Londra: Kraliyet Hekimler Koleji. s. 113–33. ISBN 978-1-86016-283-1. Arşivlendi 24 Eylül 2010 tarihinde orjinalinden.
- ^ Hasnain M, Vieweg WV, Baron MS, Beatty-Brooks M, Fernandez A, Pandurangi AK (Temmuz 2009). "Parkinsonizmli yaşlı hastalarda psikozun farmakolojik yönetimi". Amerikan Tıp Dergisi. 122 (7): 614–22. doi:10.1016 / j.amjmed.2009.01.025. PMID 19559160.
- ^ "FDA, Parkinson hastalığıyla ilişkili halüsinasyonları ve sanrıları tedavi etmek için ilk ilacı onayladı". www.fda.gov (Basın bülteni). 29 Nisan 2016. Alındı 12 Ekim 2018.
- ^ a b Elbers RG, Verhoef J, van Wegen EE, Berendse HW, Kwakkel G (Ekim 2015). "Parkinson hastalığında yorgunluğa yönelik müdahaleler". Sistematik İncelemelerin Cochrane Veritabanı (İnceleme) (10): CD010925. doi:10.1002 / 14651858.CD010925.pub2. PMID 26447539.
- ^ a b c d Kronik Koşullar için Ulusal İşbirliği Merkezi, ed. (2006). "Parkinson hastalığı için cerrahi". Parkinson hastalığı. Londra: Kraliyet Hekimler Koleji. sayfa 101–11. ISBN 978-1-86016-283-1. Arşivlendi 24 Eylül 2010 tarihinde orjinalinden.
- ^ Bronstein JM, Tagliati M, Alterman RL, vd. (Şubat 2011). "Parkinson hastalığı için derin beyin stimülasyonu: uzman görüş birliği ve temel sorunların gözden geçirilmesi". Nöroloji Arşivleri. 68 (2): 165. doi:10.1001 / archneurol.2010.260. PMC 4523130. PMID 20937936.
- ^ Dallapiazza RF, Vloo PD, Fomenko A, vd. (2018). "Parkinson hastalığı için Derin Beyin Stimülasyonu cerrahisinde Hasta ve Hedef Seçimi için Hususlar". Stoker TB'de, Greenland JC (editörler). Parkinson hastalığı: Patogenez ve klinik yönler. Brisbane: Codon Yayınları.
- ^ a b c d e Kronik Koşullar için Ulusal İşbirliği Merkezi, ed. (2006). "Diğer önemli müdahaleler". Parkinson hastalığı. Londra: Kraliyet Hekimler Koleji. s. 135–46. ISBN 978-1-86016-283-1. Arşivlendi 24 Eylül 2010 tarihinde orjinalinden.
- ^ a b Goodwin VA, Richards SH, Taylor RS, Taylor AH, Campbell JL (Nisan 2008). "Parkinson hastalığı olan kişiler için egzersiz müdahalelerinin etkinliği: sistematik bir inceleme ve meta-analiz". Hareket Bozuklukları. 23 (5): 631–40. doi:10.1002 / mds.21922. hdl:10871/17451. PMID 18181210. S2CID 3808899.
- ^ Dereli EE, Yaliman A (Nisan 2010). "Fizyoterapist gözetiminde bir egzersiz programının ve kendi kendine denetlenen bir egzersiz programının Parkinson hastalarında yaşam kalitesi üzerindeki etkilerinin karşılaştırılması". Klinik Rehabilitasyon. 24 (4): 352–62. doi:10.1177/0269215509358933. PMID 20360152. S2CID 10947269.
- ^ O'Sullivan ve Schmitz 2007, s. 873, 876
- ^ O'Sullivan ve Schmitz 2007, s. 879
- ^ O'Sullivan ve Schmitz 2007, s. 877
- ^ O'Sullivan ve Schmitz 2007, s. 880
- ^ Fox CM, Ramig LO, Ciucci MR, Sapir S, McFarland DH, Farley BG (Kasım 2006). "LSVT / LOUD bilimi ve uygulaması: Parkinson hastalığı ve diğer nörolojik bozuklukları olan bireylerin tedavisinde sinirsel esneklik ilkeli yaklaşım". Dil ve Konuşma Seminerleri. 27 (4): 283–99. doi:10.1055 / s-2006-955118. PMID 17117354.
- ^ Dixon L, Duncan D, Johnson P, vd. (Temmuz 2007). "Parkinson hastalığı olan hastalar için mesleki terapi". Sistematik İncelemelerin Cochrane Veritabanı (3): CD002813. doi:10.1002 / 14651858.CD002813.pub2. PMC 6991932. PMID 17636709.
- ^ Ferrell B, Connor SR, Cordes A, vd. (Haziran 2007). "Kaliteli palyatif bakım için ulusal gündem: Ulusal Konsensüs Projesi ve Ulusal Kalite Forumu". Journal of Pain and Symptom Management. 33 (6): 737–44. doi:10.1016 / j.jpainsymman.2007.02.024. PMID 17531914.
- ^ a b Lorenzl S, Nübling G, Perrar KM, Voltz R (2013). "Kronik nörolojik bozuklukların palyatif tedavisi". Nörolojide Etik ve Hukuki Sorunlar. Klinik Nöroloji El Kitabı. 118. s. 133–39. doi:10.1016 / B978-0-444-53501-6.00010-X. ISBN 978-0444535016. PMID 24182372.
- ^ a b Ghoche R (Aralık 2012). "İlerlemiş Parkinson hastalığına uygulanan palyatif bakımın kavramsal çerçevesi". Parkinsonizm ve İlgili Bozukluklar. 18 Özel Sayı 3 (Ek 3): S2–5. doi:10.1016 / j.parkreldis.2012.06.012. PMID 22771241.
- ^ a b c Wilcox SK (Ocak 2010). "Palyatif bakımın Parkinson hastalarını kapsayacak şekilde genişletilmesi". British Journal of Hospital Medicine. 71 (1): 26–30. doi:10.12968 / hmed.2010.71.1.45969. PMID 20081638.
- ^ Moens K, Higginson IJ, Harding R (Ekim 2014). "Gelişmiş kanser ve sekiz kanser dışı durumla yaşayan insanlarda palyatif bakımla ilgili sorunların yaygınlığında farklılıklar var mı? Sistematik bir inceleme". Journal of Pain and Symptom Management. 48 (4): 660–77. doi:10.1016 / j.jpainsymman.2013.11.009. PMID 24801658.
- ^ Casey G (Ağustos 2013). "Parkinson hastalığı: uzun ve zorlu bir yolculuk". Hemşirelik Yeni Zelanda. 19 (7): 20–24. PMID 24195263.
- ^ a b c d e f g h ben j k l Poewe W (Aralık 2006). "Parkinson hastalığının doğal seyri". Nöroloji Dergisi. 253 Ek 7 (Ek 7): vii2 – vii6. doi:10.1007 / s00415-006-7002-7. PMID 17131223. S2CID 35082340.
- ^ a b Feigin VL, Nichols E, Alam T, vd. (Mayıs 2019). "Küresel, bölgesel ve ulusal nörolojik bozukluk yükü, 1990-2016: Küresel Hastalık Yükü Çalışması 2016 için sistematik bir analiz". Lancet Neurol. 18 (5): 459–80. doi:10.1016 / S1474-4422 (18) 30499-X. PMC 6459001. PMID 30879893.
- ^ Mhyre TR, Boyd JT, Hamill RW, Maguire-Zeiss KA (2012). Parkinson hastalığı. Hücre altı Biyokimya. 65. s. 389–455. doi:10.1007/978-94-007-5416-4_16. ISBN 978-94-007-5415-7. PMC 4372387. PMID 23225012.
- ^ a b Kadastik-Eerme L, Taba N, Asser T, Taba P (16 Nisan 2019). "Estonya'da Parkinson Hastalığının Sıklığı ve Ölümlülüğü". Nöroepidemiyoloji. 53 (1–2): 63–72. doi:10.1159/000499756. PMID 30991384. S2CID 119103425.
- ^ a b c García Ruiz PJ (Aralık 2004). "Prehistoria de la enfermedad de Parkinson" [Parkinson hastalığının tarih öncesi dönemi]. Nöroloji (ispanyolca'da). 19 (10): 735–37. PMID 15568171.. Makale yanlışlıkla Eyüp 33:19 yerine Eyüp 34:19'dan bahsediyor.
- ^ a b Lanska DJ (2010). Bölüm 33: Hareket Bozukluklarının Tarihi. Klinik Nöroloji El Kitabı. 95. sayfa 501–46. doi:10.1016 / S0072-9752 (08) 02133-7. ISBN 978-0444520098. PMID 19892136.
- ^ Koehler PJ, Keyser A (Eylül 1997). "Hollandalı doktorların Latince metinlerinde titreme: 16-18. Yüzyıllar". Hareket Bozuklukları. 12 (5): 798–806. doi:10.1002 / mds.870120531. PMID 9380070. S2CID 310819.
- ^ Louis ED (Kasım 1997). "Titreyen felç, ilk kırk beş yıl: İngiliz edebiyatında bir yolculuk". Hareket Bozuklukları. 12 (6): 1068–72. doi:10.1002 / mds.870120638. PMID 9399240. S2CID 34630080.
- ^ a b c Fahn S (2008). "Parkinson hastalığının tedavisinde dopamin ve levodopa geçmişi". Hareket Bozuklukları. 23 Ek 3 (Ek 3): S497–508. doi:10.1002 / mds.22028. PMID 18781671. S2CID 45572523.
- ^ Guridi J, Lozano AM (Kasım 1997). "Kısa bir pallidotomi öyküsü". Nöroşirürji. 41 (5): 1169–80, tartışma 1180–83. doi:10.1097/00006123-199711000-00029. PMID 9361073.
- ^ Hornykiewicz O (2002). "L-DOPA: biyolojik olarak inaktif bir amino asitten başarılı bir terapötik ajana". Amino asitler. 23 (1–3): 65–70. doi:10.1007 / s00726-001-0111-9. PMID 12373520. S2CID 25117208.
- ^ Coffey RJ (Mart 2009). "Derin beyin stimülasyon cihazları: kısa bir teknik tarih ve inceleme". Yapay Organlar. 33 (3): 208–20. doi:10.1111 / j.1525-1594.2008.00620.x. PMID 18684199.
- ^ a b c d e Findley LJ (Eylül 2007). "Parkinson hastalığının ekonomik etkisi". Parkinsonizm ve İlgili Bozukluklar. 13 Ek (Ek): S8–12. doi:10.1016 / j.parkreldis.2007.06.003. PMID 17702630.
- ^ "Parkinson - 'titreyen felç'". GlaxoSmithKline. 1 Nisan 2009. Arşivlenen orijinal 14 Mayıs 2011.
- ^ "Ulusal Parkinson Vakfı - Misyon". Arşivlenen orijinal 21 Aralık 2010'da. Alındı 28 Mart 2011.
- ^ "Eğitim: Verme Sevinci". Zaman. 18 Ocak 1960. Arşivlendi 20 Şubat 2011 tarihinde orjinalinden. Alındı 2 Nisan 2011.
- ^ "PDF Hakkında". Parkinson Hastalığı Vakfı. Arşivlenen orijinal 15 Mayıs 2011 tarihinde. Alındı 24 Temmuz 2016.
- ^ "Amerikan Parkinson Hastalığı Derneği: Ana Sayfa". Amerikan Parkinson Hastalığı Derneği. Arşivlenen orijinal 10 Mayıs 2012 tarihinde. Alındı 9 Ağustos 2010.
- ^ "EPDA Hakkında". Avrupa Parkinson Hastalığı Derneği. 2010. Arşivlendi 15 Ağustos 2010'daki orjinalinden. Alındı 9 Ağustos 2010.
- ^ a b c Brockes E (11 Nisan 2009). "'Almaya devam eden hediye'". Gardiyan. Arşivlendi 8 Ekim 2013 tarihinde orjinalinden. Alındı 25 Ekim 2010.
- ^ "Michael J. Fox, Karolinska Enstitüsü'nde fahri doktor olacak". Karolinska Enstitüsü. 5 Mart 2010. Arşivlenen orijinal 30 Eylül 2011'de. Alındı 2 Nisan 2011.
- ^ "Biz Kimiz". Davis Phinney Vakfı. Arşivlendi 11 Ocak 2012 tarihinde orjinalinden. Alındı 18 Ocak 2012.
- ^ Matthews W (Nisan 2006). "Ali'nin Savaşan Ruhu". Nöroloji Şimdi. 2 (2): 10–23. doi:10.1097/01222928-200602020-00004. S2CID 181104230.
- ^ Tauber P (17 Temmuz 1988). "Ali: Hala Büyü". New York Times. Arşivlendi 17 Kasım 2016'daki orjinalinden. Alındı 2 Nisan 2011.
- ^ a b c Poewe W, Seppi K, Tanner CM, vd. (23 Mart 2017). "Parkinson hastalığı". Doğa İncelemeleri Hastalık Astarları. 3 (1): 17013. doi:10.1038 / nrdp.2017.13. ISSN 2056-676X. PMID 28332488. S2CID 11605091.
- ^ Langston JW, Ballard P, Tetrud JW, Irwin I (Şubat 1983). "Meperidin-analog sentezinin bir ürünü nedeniyle insanlarda kronik Parkinsonizm". Bilim. 219 (4587): 979–80. Bibcode:1983Sci ... 219..979L. doi:10.1126 / science.6823561. PMID 6823561. S2CID 31966839.
- ^ Cicchetti F, Drouin-Ouellet J, Gross RE (Eylül 2009). "Çevresel toksinler ve Parkinson hastalığı: pestisit kaynaklı hayvan modellerinden ne öğrendik?". Farmakolojik Bilimlerdeki Eğilimler. 30 (9): 475–83. doi:10.1016 / j.tips.2009.06.005. PMID 19729209.
- ^ Harvey BK, Wang Y, Hoffer BJ (2008). Parkinson hastalığının transgenik kemirgen modelleri. Açta Neurochirurgica. Ek. Açta Neurochirurgica Supplementum. 101. sayfa 89–92. doi:10.1007/978-3-211-78205-7_15. ISBN 978-3-211-78204-0. PMC 2613245. PMID 18642640.
- ^ Blum D, Torch S, Lambeng N, vd. (Ekim 2001). "6-OHDA, dopamin ve MPTP'nin nörotoksisitesinde yer alan moleküler yollar: Parkinson hastalığında apoptotik teoriye katkı". Nörobiyolojide İlerleme. 65 (2): 135–72. doi:10.1016 / S0301-0082 (01) 00003-X. PMID 11403877. S2CID 19095092.
- ^ Hitti FL, Yang AI, Gonzalez-Alegre P, Baltuch GH (Eylül 2019). "Parkinson hastalığının tedavisi için insan gen tedavisi yaklaşımları: Mevcut ve tamamlanmış klinik deneylere genel bakış". Parkinsonizm İlişkisi. Disord. 66: 16–24. doi:10.1016 / j.parkreldis.2019.07.018. PMID 31324556.
- ^ Dimond PF (16 Ağustos 2010). "Yakın Zamanda Yeni Parkinson Hastalığı İlacı Beklenmiyor". GEN haberlerinde öne çıkanlar. GEN-Genetik Mühendisliği ve Biyoteknoloji Haberleri. Arşivlendi 31 Ekim 2010 tarihinde orjinalinden.
- ^ Volc D, Poewe W, Kutzelnigg A, vd. (Temmuz 2020). "Parkinson hastalığı olan hastalarda a-sinüklein aktif immünoterapötik PD01A'nın güvenliği ve immünojenitesi: randomize, tek kör, faz 1 çalışma". Neşter. Nöroloji. 19 (7): 591–600. doi:10.1016 / S1474-4422 (20) 30136-8. PMID 32562684. S2CID 219947651.
- ^ "Dünyanın ilk Parkinson aşısı denendi". Yeni Bilim Adamı. Londra. 7 Haziran 2012. Arşivlendi 23 Nisan 2015 tarihinde orjinalinden.
- ^ Jankovic J, Goodman I, Safirstein B, vd. (Ekim 2018). "Parkinson Hastalığı Olan Hastalarda Bir Anti-α-Sinüklein Monoklonal Antikoru olan PRX002 / RG7935'in Çoklu Artan Dozlarının Güvenliği ve Tolere Edilebilirliği: Randomize Bir Klinik Çalışma". JAMA Nörolojisi. 75 (10): 1206–14. doi:10.1001 / jamaneurol.2018.1487. PMC 6233845. PMID 29913017.
- ^ a b Henchcliffe C, Parmar M (2018). "Beyni Onarmak: Kök Hücre Tabanlı Teknolojiler Kullanarak Hücre Değişimi". Parkinson Hastalığı Dergisi. 8 (s1): S131–37. doi:10.3233 / JPD-181488. PMC 6311366. PMID 30584166.
- ^ Schweitzer JS, Song B, Herrington TM, ve diğerleri. (Mayıs 2020). "Parkinson Hastalığı için Kişiselleştirilmiş iPSC-Türetilmiş Dopamin Progenitör Hücreler". New England Tıp Dergisi. 382 (20): 1926–32. doi:10.1056 / NEJMoa1915872. PMC 7288982. PMID 32402162.
- ^ Koch G (2010). "Parkinson hastalarında levodopa kaynaklı diskineziler üzerinde rTMS etkileri: etkili kortikal hedeflerin araştırılması". Restoratif Nöroloji ve Sinirbilim. 28 (4): 561–68. doi:10.3233 / RNN-2010-0556. PMID 20714078.
- ^ Platz T, Rothwell JC (2010). "Beyin uyarımı ve beyin onarımı - rTMS: hayvan deneylerinden klinik deneylere - ne biliyoruz?". Restoratif Nöroloji ve Sinirbilim. 28 (4): 387–98. doi:10.3233 / RNN-2010-0570. PMID 20714064.
- ^ Suchowersky O, Gronseth G, Perlmutter J, Reich S, Zesiewicz T, Weiner WJ (Nisan 2006). "Uygulama Parametresi: Parkinson hastalığı için nöroprotektif stratejiler ve alternatif tedaviler (kanıta dayalı bir inceleme): Amerikan Nöroloji Akademisi Kalite Standartları Alt Komitesi raporu". Nöroloji. 66 (7): 976–82. doi:10.1212 / 01.wnl.0000206363.57955.1b. PMID 16606908.
- ^ Lee MS, Lam P, Ernst E (Aralık 2008). "Parkinson hastalığı için tai chi'nin etkinliği: kritik bir inceleme". Parkinsonizm ve İlgili Bozukluklar. 14 (8): 589–94. doi:10.1016 / j.parkreldis.2008.02.003. PMID 18374620.
- ^ Lee MS, Ernst E (Ocak 2009). "Hareket bozuklukları için Qigong: Sistematik bir inceleme". Hareket Bozuklukları. 24 (2): 301–03. doi:10.1002 / mds.22275. PMID 18973253. S2CID 206239252.
- ^ Lee MS, Shin BC, Kong JC, Ernst E (Ağustos 2008). "Parkinson hastalığı için akupunkturun etkinliği: sistematik bir inceleme". Hareket Bozuklukları. 23 (11): 1505–15. doi:10.1002 / mds.21993. PMID 18618661. S2CID 24713983.
- ^ Tremlett H, Bauer KC, Appel-Cresswell S, Finlay BB, Waubant E (Mart 2017). "İnsan nörolojik hastalığında bağırsak mikrobiyomu: Bir inceleme". Nöroloji Yıllıkları. 81 (3): 369–82. doi:10.1002 / ana.24901. PMID 28220542. S2CID 25394413.
- ^ Klingelhoefer L, Reichmann H (2017). "Parkinson Hastalığında Bağırsak ve Motor Olmayan Semptomlar". Motor Olmayan Parkinson: Gizli Yüz - Yönetim ve İlgili Bozuklukların Gizli Yüzü. Uluslararası Nörobiyoloji İncelemesi. 134. sayfa 787–809. doi:10.1016 / bs.irn.2017.05.027. ISBN 978-0128126035. PMID 28805583.
- ^ Bhattacharyya, Dipita; Mohite, Ganesh M .; Krishnamoorthy, Janarthanan; Gayen, Nilanjan; Mehra, Surabhi; Navalkar, Ambuja; Kotler, Samuel A .; Ratha, Bhisma N .; Ghosh, Anirban; Kumar, Rakesh; Garai, Kanchan; Mandal, Atın K .; Maji, Samir K .; Bhunia, Anirban (2019). "Gut Microbiota'dan Lipopolisakkarit, a-Sinüklein Birleşmesini Modüle Eder ve Biyolojik Fonksiyonunu Değiştirir". ACS Kimyasal Nörobilim. 10 (5): 2229–2236. doi:10.1021 / acschemneuro.8b00733. ISSN 1948-7193. PMID 30855940.
- ^ Jenner P (2014). "Parkinson hastalığında adenosin A2A reseptör antagonistlerine genel bir bakış". Uluslararası Nörobiyoloji İncelemesi. 119: 71–86. doi:10.1016 / B978-0-12-801022-8.00003-9. ISBN 978-0128010228. ISSN 2162-5514. PMID 25175961.
- ^ a b Komiserlik Ofisi (20 Şubat 2020). "FDA, Parkinson hastalığı olan yetişkinlerde atakları tedavi etmek için yeni ek ilacı onayladı". FDA. Alındı 23 Şubat 2020.
Dış bağlantılar
- Parkinson hastalığı -de Curlie
- Parkinson Hastalığı: Araştırma Yoluyla Umut (Ulusal Nörolojik Bozukluklar ve İnme Enstitüsü)
- Dünya Parkinson Hastalığı Derneği
- PDGENE - Parkinson Hastalığı genetik ilişkilendirme çalışmaları için veritabanı
| Sınıflandırma | |
|---|---|
| Dış kaynaklar |
|
