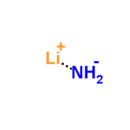
Lityum amid - Lithium amide
 | |
 | |
| İsimler | |
|---|---|
| IUPAC adı Lityum amid | |
| Diğer isimler Lithamid | |
| Tanımlayıcılar | |
3 boyutlu model (JSmol ) | |
| ChemSpider | |
| ECHA Bilgi Kartı | 100.029.062 |
PubChem Müşteri Kimliği | |
| UNII | |
CompTox Kontrol Paneli (EPA) | |
| |
| |
| Özellikleri | |
| LiNH 2 | |
| Molar kütle | 22.96 g / mol |
| Görünüm | beyaz katı |
| Yoğunluk | 1.178 g / cm3 |
| Erime noktası | 375 ° C (707 ° F; 648 K) |
| Kaynama noktası | 430 ° C (806 ° F; 703 K) ayrışır |
| tepki | |
| Çözünürlük | biraz çözünür etanol içinde çözülmez amonyak |
| Termokimya | |
Std entalpisi oluşum (ΔfH⦵298) | -182 kJ / mol |
| Tehlikeler | |
| NFPA 704 (ateş elması) | |
Aksi belirtilmedikçe, veriler kendi içlerindeki malzemeler için verilmiştir. standart durum (25 ° C'de [77 ° F], 100 kPa). | |
| Bilgi kutusu referansları | |
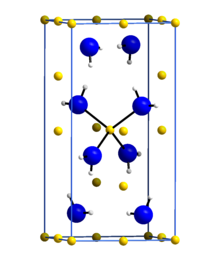
Lityum amid veya lityum azanid bir inorganik bileşik LiNH kimyasal formülü ile2. Tetragonal kristal yapıya sahip beyaz bir katıdır. Lityum amid işlenerek yapılabilir lityum sıvı ile metal amonyak:[1]
- 2Li + 2NH3 → 2LiNH2 + H2
Diğer lityum amidler
Aminlerin eşlenik bazları amidler olarak bilinir. Böylece, bir lityum amid ayrıca bir lityum tuzu sınıfındaki herhangi bir bileşiği de ifade edebilir. amin. Bu bileşikler genel form Li
- 2Li + 2R2NH → 2LiNR2 + H2
Lityum amidler çok reaktif bileşiklerdir. Özellikle güçlüler üsler.
Örnekler
Lityum tetrametilpiperidid, bir tetramer olarak kristalize edilmiştir.[2] Öte yandan, bis (1-feniletil) aminin lityum türevi bir trimer olarak kristalleşir:[3]
 Tetramerik lityum tetrametilpiperidid |  Trimerik lityum bis (1-feniletil) amid |
Karışık metal oligomerleri yapmak da mümkündür. alkoksitler ve amidler.[4] Bunlar ile ilgilidir süper üsler metal alkoksitler ve alkillerin karışımlarıdır. Siklik oligomerler, amidin nitrojeni bir sigma bağı nitrojen ise lityuma yalnız çift başka bir metal merkeze bağlanır.
Diğer organolityum bileşikleri (örneğin BuLi ) genellikle yüksek sıralı, kümelenmiş türlerde var olduğu ve bunlar aracılığıyla çalıştığı kabul edilir.
Ayrıca bakınız
Referanslar
- ^ P.W. Schenk (1963). "Lityum amid". G. Brauer'de (ed.). Hazırlayıcı İnorganik Kimya El Kitabı, 2. Baskı. 1. NY, NY: Academic Press. s. 454.
- ^ M.F. Lappert; M.J. Slade; A. Singh; J.L. Atwood; R.D. Rogers; R. Şakir (1983). "Sterik olarak engellenmiş lityum amidlerin ve bunların dietil eteratlarının yapısı ve reaktivitesi: [Li {N (SiMe3)2} (OEt2)]2 ve tetrakis (2,2,6,6-tetrametilpiperidinatolityum) ". Amerikan Kimya Derneği Dergisi. 105 (2): 302–304. doi:10.1021 / ja00340a031.
- ^ D.R. Armstrong; K.W. Henderson; A.R. Kennedy; W.J. Kerr; F.S. Mair; J.H. Moir; P.H. Moran; R. Snaith (1999). "Kiral lityum amidlerin yapısal çalışmaları [{PhC (H) Me}2NLi] ve [PhCH2{PhC (H) Me} NLi · THF] a-metilbenzilaminden türetilmiştir ". Dalton İşlemleri: 4063–4068. doi:10.1039 / A904725E.
- ^ K.W. Henderson, D.S. Walther ve P.G. Williard (1995). "Bir Unimetal Baz Kompleksinin Tanımlanması 6Li NMR Spektroskopisi ve Tek Kristal Analizi ". Amerikan Kimya Derneği Dergisi. 117 (33): 8680–8681. doi:10.1021 / ja00138a030.
- Merck Endeksi, 11. Baskı, 5398.

