Lityum iridat - Lithium iridate - Wikipedia
| |||
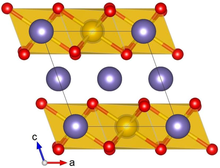 | |||
 Α-Li'nin kristal yapısı2IRO3 Ir sarı, Li mor ve O kırmızı ile gösterilir | |||
| İsimler | |||
|---|---|---|---|
| Tercih edilen IUPAC adı Lityum iridat | |||
| Tanımlayıcılar | |||
| Özellikleri | |||
| Li2IRO3 | |||
| Görünüm | Siyah kristaller | ||
| Yapısı | |||
| Monoklinik, C2 / m[2] | |||
a = 5,1633 (2) Å, b = 8.9294 (3) Å, c = 5,1219 (2) Å α = 90 °, β = 109.759 (3) °, γ = 90 ° | |||
Formül birimleri (Z) | 4 | ||
| Bağıntılı bileşikler | |||
Diğer anyonlar | Lityum rutenat, lityum platinat | ||
Diğer katyonlar | Sodyum iridat | ||
Aksi belirtilmedikçe, veriler kendi içlerindeki malzemeler için verilmiştir. standart durum (25 ° C'de [77 ° F], 100 kPa). | |||
| Bilgi kutusu referansları | |||
Lityum iridat, Li2IRO3kimyasal bir bileşiktir lityum, iridyum ve oksijen. Üç biraz farklı katmanlı atomik yapıya sahip siyah kristaller oluşturur, α, β ve bazen γ. Lithium iridate metal benzeri, sıcaklıktan bağımsızdır elektiriksel iletkenlik ve manyetik sırasını paramanyetik -e antiferromanyetik 15 K'ye soğutulduktan sonra
Yapısı
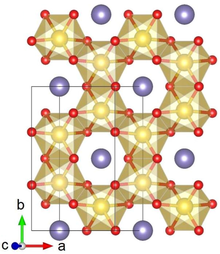
Li2IRO3 tipik olarak α veya fazında kristalleşir ve nadir bir fazı bildirilmiştir. Α-Li'nin kristal yapısı2IRO3 altıgen Li katmanlarından ve kenar paylaşımlı IrO peteklerinden oluşan alternatif bir istiflemeden oluşur6 ortada Li ile octahedra. Bitişik katmanlardaki kayma, nispeten düşük (monoklinik) bir kristal simetrisiyle sonuçlanır. Li2IRO3 kristallerin bol miktarda ikizlenme kusurları vardır. ab kristal düzlemler 120 ° döndürülür. c eksen.[1]
Sentez


Li2IRO3 kristaller doğrudan büyütülebilir sinterleme Ortam atmosferinde ısıtma sırasında oksitlenen Ir ve Li metalleri. Α fazı 750–1050 ° C'de oluşturulurken, daha yüksek sıcaklıklara ısıtma β fazıyla sonuçlanır. Daha geleneksel yerine Li metalinin kullanılması lityum karbonat kullanımı ve depolanması daha kolay olan, daha büyük kristaller ile sonuçlanır. Γ fazı, lityum karbonatın kalsinasyonu ile elde edilebilir ve iridyum (IV) oksit ardından erimiş halde tavlama lityum hidroksit 700–800 ° C'de.[1]
Özellikleri
Lityum iridat siyah renktedir ve nispeten yüksek, sıcaklıktan bağımsız metal iletkenlik özelliğine sahiptir.[2] Hem α hem de β fazları, Ir'dan kaynaklanan manyetik dönüşler arasındaki Kitaev değişim kuplajını gösterir.4+ iyonlar. Bu dönüşler, 15 K'nin altındaki sıcaklıklarda antiferromanyetik bir kafes oluşturur (Néel sıcaklığı, TN), malzeme yukarıda paramanyetik iken TN.[1]
Potansiyel uygulamalar
Lityum iridat, potansiyel bir elektrot malzemesidir. Lityum iyon batarya.[2] Bu uygulama, daha ucuz Li ile karşılaştırıldığında, yüksek Ir maliyetleri nedeniyle engellenmektedir.2MnO3 alternatif.[3]
Referanslar
- ^ a b c d e f g Freund, F .; Williams, S. C .; Johnson, R. D .; Coldea, R .; Gegenwart, P .; Jesche, A. (2016). "Ayrılmış eğitimlerden tek kristal büyümesi ve lityum geçiş metal oksitlere uygulanması". Bilimsel Raporlar. 6: 35362. arXiv:1604.04551. Bibcode:2016NatSR ... 635362F. doi:10.1038 / srep35362. PMC 5066249. PMID 27748402.
- ^ a b c O'Malley, Matthew J .; Verweij, Henk; Woodward, Patrick M. (2008). "Sıralı Li'nin yapısı ve özellikleri2IRO3 ve Li2PtO3". Katı Hal Kimyası Dergisi. 181 (8): 1803. Bibcode:2008JSSCh.181.1803O. doi:10.1016 / j.jssc.2008.04.005.
- ^ Yoshio, Masaki; Brodd, Ralph J .; Kozawa, Akiya (17 Temmuz 2010). Lityum İyon Piller: Bilim ve Teknolojiler. Springer Science & Business Media. s. 10. ISBN 978-0-387-34445-4.


