Depresyon biyolojisi - Biology of depression
Bilimsel çalışmalar, farklı beyin bölgelerinin, insanlarda değişen aktivite gösterdiğini bulmuştur. majör depresif bozukluk ve bu, psikolojik veya durumsal nedenleri vurgulayan teorilerin aksine, hastalığın biyokimyasal kökenini belirlemeye çalışan çeşitli teorilerin savunucularını cesaretlendirdi. Bu nedensel grupları kapsayan faktörler, beslenme yetersizliklerini içerir. magnezyum, D vitamini, ve triptofan durumsal kaynaklı ancak biyolojik etkiye sahip. İle ilgili birkaç teori biyolojik temelli depresyon nedeni etrafında dönen teoriler de dahil olmak üzere yıllar boyunca önerilmiştir monoamin nörotransmiterler, nöroplastisite, nörojenez, iltihap ve sirkadiyen ritim. Aşağıdakiler dahil fiziksel hastalıklar hipotiroidizm ve mitokondriyal hastalık ayrıca depresif semptomları da tetikleyebilir.[1][2]
Sinir devreleri Depresyonla ilgili olanlar arasında ödülün yanı sıra duygu üretimi ve düzenlenmesiyle ilgili olanlar da vardır. Anormallikler genellikle lateral prefrontal kortekste bulunur ve varsayılan işlevi genellikle duygu düzenlemesini içerdiği düşünülür. Gibi duygu ve ödül üretimiyle ilgili bölgeler amigdala, ön singulat korteks (ACC), orbitofrontal korteks (OFC), ve striatum sıklıkla bununla ilişkilendirilmektedir. Bu bölgeler, bir monoaminerjik çekirdek tarafından innerve edilir ve kesin olmayan kanıtlar, anormal monoaminerjik aktivite.[3][4]
Genetik faktörler
Gen çalışmalarının zorluğu
Tarihsel olarak, aday gen çalışmaları çalışmanın ana odak noktası olmuştur. Bununla birlikte, gen sayısı doğru bir aday gen seçme olasılığını azalttığından, Tip I hataları (yanlış pozitifler) büyük olasılıkla. Aday gen çalışmaları, sıklıkla genotipleme hataları ve istatistiksel olarak yetersiz güçlenme dahil olmak üzere bir dizi kusura sahiptir. Bu etkiler, gen-gen etkileşimlerine bakılmaksızın genlerin olağan değerlendirmesi ile birleştirilir. Bu sınırlamalar, hiçbir aday genin genom çapında bir öneme ulaşmadığı gerçeğinde yansıtılmaktadır.[5]
Gen adayları
5-HTTLPR
2003 yılında yapılan bir araştırma, gen-çevre etkileşimi (GxE), serotonin-taşıyıcıya bağlı promoter bölgesinin allelik bir varyasyonuna bağlı olarak, yaşam stresinin neden bazı kişilerde depresif epizotlar için bir belirleyici olduğunu ancak diğerlerinde olmadığını açıklayabilir (5-HTTLPR ).[6] 2019 itibariyle, 5-HTTLPR GxE etkileşiminin altı meta analizi gerçekleştirilmiştir. İki 2009 meta analizi boş bulgular bildirdi,[7][8] daha liberal dahil edilme kriterlerine sahip bir 2011 meta analizi ise anlamlı bir ilişki bildirmiştir.[9] Bir 2016 meta analizi, bir GxE etkileşimi için kanıtın en iyi ihtimalle zayıf olduğu sonucuna vardı.[10] Bir 2018 meta analizi, önemli heterojenlikle sınırlı olan zayıf ama önemli bir ilişki bildirdi.[11] 2019 meta analizi, şiddetli intihar davranışı (MDD'nin bir komplikasyonu) ile gen arasında bir ilişki olduğunu bildirdi.[12]
BDNF
BDNF polimorfizmlerin de genetik bir etkiye sahip olduğu varsayılmıştır, ancak çoğaltma sonuçları karıştırılmıştır ve 2005 itibariyle meta-analiz için yetersiz kalmıştır.[13] Çalışmalar ayrıca azalmış BDNF üretiminin intihar davranışı ile ilişkisini de göstermektedir.[14] Bununla birlikte, gen-çevre etkileşimleri çalışmalarından elde edilen bulgular, mevcut BDNF depresyon modellerinin çok basit olduğunu göstermektedir.[15] 2008 yılında yapılan bir çalışmada etkileşimler bulundu (biyolojik epistasis ) BDNF'nin sinyal yollarında ve serotonin taşıyıcısı; BDNF Val66Met Serotonine karşı duyarlılığın azaldığı tahmin edilen alelin, aksi takdirde bireyleri stresli olaylardan sonra depresif dönemlere yatkın hale getirdiğine inanılan kısa 5-HTTLPR aleli olan kişilerde koruyucu etkiler uyguladığı bulundu.[16] Bu nedenle, strese ve antidepresanlara nöroplastik yanıtlarda yer alan BDNF aracılı sinyalleşme, diğer genetik ve çevresel değiştiricilerden etkilenir.[15]
SIRT1 ve LHPP
Han Çinli kadınlarda 2015 yılında yapılan bir GWAS çalışması, yakın intronik bölgelerde iki varyantı pozitif olarak tanımladı. SIRT1 ve LHPP genom çapında önemli bir ilişki ile.[17][18]
Norepinefrin taşıyıcı polimorfizmleri
Norepinefrin taşıyıcı polimorfizmler ile depresyon arasında bir korelasyon bulma girişimleri olumsuz sonuçlar vermiştir.[19]
Bir gözden geçirme, sıkça incelenen çok sayıda aday gen belirledi. İçin kodlayan genler 5-HTT ve 5-HT2A reseptör tutarsız bir şekilde depresyon ve tedavi yanıtı ile ilişkilendirildi. İçin karışık sonuçlar bulundu beyin kaynaklı nörotrofik faktör (BDNF) Val66Met polimorfizmleri. Polimorfizmler triptofan hidroksilaz geninin intihar davranışı ile geçici olarak ilişkili olduğu bulundu.[20] 2008'de yayınlanan 182 vaka kontrollü genetik çalışmanın meta analizi bulundu Apolipoprotein E verepsilon 2'nin koruyucu olması ve GNB3 825T, MTHFR 677T, SLC6A4 44bp ekleme veya delesyonları ve risk vermek için SLC6A3 40 bpVNTR 9/10 genotipi.[21]
Sirkadiyen ritim

Uyku
Depresyon, bölgedeki anormalliklerle ilişkili olabilir. sirkadiyen ritim,[22] veya biyolojik saat. Örneğin, hızlı göz hareketi (REM) uykusu - içinde bulunduğu aşama rüya görmek ortaya çıkar — depresif kişilerde hızlı ve yoğun olabilir. REM uykusu azalmaya bağlıdır serotonin seviyeler beyin sapı,[23] ve beyin sapı yapılarında serotonerjik tonu artıran antidepresanlar gibi bileşikler tarafından bozulur.[23] Genel olarak, serotonerjik sistem uyku sırasında en az aktiftir ve en çok uyanıklık sırasında aktiftir. Nedeniyle uzun süreli uyanıklık uyku eksikliği[22] seçici serotonin geri alım inhibitörleri (SSRI'lar) gibi antidepresanların terapötik etkisine benzer süreçlere yol açan serotonerjik nöronları aktive eder. Depresyondaki bireyler, bir gece uykusuzluktan sonra ruh halinde önemli bir yükselme sergileyebilirler. SSRI'lar, terapötik etkileri için merkezi serotonerjik nörotransmisyonun artışına, uyku ve uyanıklık döngülerini etkileyen aynı sisteme doğrudan bağlı olabilir.[23]
Işık tedavisi
Etkileri üzerine araştırma ışık tedavisi açık mevsimsel duygusal bozukluk ışık yoksunluğunun serotonerjik sistemdeki azalmış aktivite ve özellikle uykusuzluk olmak üzere uyku döngüsündeki anormalliklerle ilişkili olduğunu düşündürmektedir. Işığa maruz kalma aynı zamanda serotonerjik sistemi hedef alır ve bu sistemin depresyonda oynayabileceği önemli rol için daha fazla destek sağlar.[24] Uyku yoksunluğu ve ışık tedavisi her ikisi de antidepresan ilaçlar olarak aynı beyin nörotransmiter sistemini ve beyin alanlarını hedefliyor ve şimdi depresyonu tedavi etmek için klinik olarak kullanılıyor.[25] MDB nedeniyle hastaneye kaldırılan kişilerde derin bir depresyonu kesmek için ışık tedavisi, uyku yoksunluğu ve uyku zamanı yerinden etme (uyku fazı ilerletme tedavisi) hızlı bir şekilde birlikte kullanılmaktadır.[24]
Artan ve azalan uyku süresi, depresyon için bir risk faktörü gibi görünmektedir.[26] MDB'si olan kişiler bazen mevsimsel olmayan depresyonda bile semptom şiddetinde günlük ve mevsimsel değişkenlik gösterir. Günlük ruh halindeki iyileşme, dorsal sinir ağlarının aktivitesi ile ilişkilendirildi. Artmış ortalama çekirdek sıcaklığı da gözlendi. Bir hipotez, depresyonun bir faz kaymasının sonucu olduğunu öne sürdü.[27]
Gündüz ışığına maruz kalma, bazı depresyonların mevsimselliğinin altında yatan azalmış serotonin taşıyıcı aktivitesi ile ilişkilidir.[28]
Monoaminler
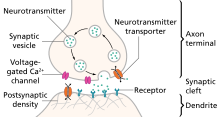
Monoaminler vardır nörotransmiterler o dahil serotonin, dopamin, norepinefrin, ve epinefrin.[29]
Monoamin depresyon hipotezi
Birçok antidepresan ilaçlar hızla artıyor sinaptik monoamin nörotransmitteri, serotonin seviyeleri, ancak aynı zamanda diğer iki nörotransmiterin, norepinefrin ve dopaminin seviyelerini artırabilirler. Bu etkinliğin gözlemlenmesi, depresyonun monoamin hipotezi, belirli nörotransmiterlerin eksikliğinin depresyondan sorumlu olduğunu ve hatta bazı nörotransmiterlerin belirli semptomlarla bağlantılı olduğunu varsayar. Normal serotonin seviyeleri, ruh hali ve davranış düzenlemesi, uyku ve sindirimle ilişkilendirilmiştir; norepinefrin savaş ya da kaç tepkisi; ve dopaminden hareket, zevk ve motivasyon. Bazıları ayrıca uyku ve intiharda serotonin, disforide norepinefrin, yorgunluk, ilgisizlik, bilişsel işlev bozukluğu ve motivasyon kaybında ve psikomotor semptomlarda dopamin gibi monoaminler ve fenotipler arasındaki ilişkiyi öne sürmüşlerdir.[30] Depresyonun monoamin hipotezinin ana sınırlaması, antidepresan tedavinin başlaması ile semptomlarda algılanan iyileşme arasındaki terapötik gecikmedir. Bu terapötik gecikme için bir açıklama, sinaptik serotonindeki ilk artışın sadece geçici olmasıdır, çünkü serotonerjik nöronların dorsal raphe 5-HT aktivitesi ile uyum sağlayın1 A otomatik alıcılar. Antidepresanların terapötik etkisinin, bir süre boyunca otoreseptör duyarsızlaşmasından kaynaklandığı ve sonunda serotonerjik nöronların ateşlenmesini artırdığı düşünülmektedir.[31]

Serotonin
Depresyonda serotonin ile ilgili ilk çalışmalar, serotonin metaboliti gibi çevresel önlemleri inceledi. 5-Hidroksiindoleasetik asit (5-HIAA) ve trombosit bağlanması. Sonuçlar genellikle tutarsızdı ve merkezi sinir sistemine genellenemeyebilir. Ancak kanıt reseptör bağlanması çalışmalar ve farmakolojik zorluklar, depresyonda serotonin nörotransmisyonunun işlev bozukluğu için bazı kanıtlar sağlar.[32] Serotonin, ruh halini değiştirerek dolaylı olarak etkileyebilir. duygusal işlem önyargıları hem bilişsel / davranışsal hem de sinirsel düzeyde görülen.[33][32] Farmakolojik olarak serotonin sentezini azaltmak ve farmakolojik olarak arttırmak sinaptik serotonini, sırasıyla negatif afektif önyargıları üretebilir ve hafifletebilir. Bu duygusal işleme önyargıları, terapötik boşluğu açıklayabilir.[33]
Dopamin
Dopaminerjik sistemlerde çeşitli anormallikler gözlenirken, sonuçlar tutarsızdır. MDD'ye sahip kişilerde, dekstroamfetamin kontrollere kıyasla ve bunun doğal hipoaktiviteye bağlı dopaminerjik yolların aşırı duyarlılığından kaynaklandığı öne sürülmüştür. D4 ve D3 reseptörünün polimorfizmleri depresyonda yer alırken, ilişkiler tutarlı bir şekilde kopyalanmamıştır. Ölüm sonrası çalışmalarda da benzer tutarsızlık bulunmuştur, ancak çeşitli dopamin reseptörü agonistleri MDB'nin tedavisinde umut vaat etmektedir.[34] Azaldığına dair bazı kanıtlar var nigrostriatal yol melankolik depresyonlu kişilerde aktivite (psikomotor gerilik).[35] Dopaminin depresyondaki rolünü daha fazla destekleyen, serebrospinal sıvının azalması ve dopaminin juguler metabolitlerinin tutarlı bulgusudur.[36] yanı sıra değiştirilmiş ölüm sonrası bulguları Dopamin reseptörü D3 ve dopamin taşıyıcı ifade.[37] Çalışmalar kemirgenler dopaminerjik sistemlerin strese bağlı işlev bozukluğunu içeren potansiyel bir mekanizmayı desteklemişlerdir.[38]
Katekolaminler
Depresyonda adrenerjik aktivitenin azaldığını gösteren bir dizi kanıt bildirilmiştir. Bulgular arasında tirozin hidroksilaz aktivitesinin azalması, lokus coeruleus boyutunun azalması, artmış alfa 2 adrenerjik reseptör yoğunluk ve azaldı alfa 1 adrenerjik reseptör yoğunluk.[36] Ayrıca, fare modellerinde norepinefrin taşıyıcı nakavt, depresyona norepinefrini dahil ederek, strese toleranslarını arttırır.[39]
Monoaminlerin rolünü incelemek için kullanılan bir yöntem, monoamin tükenmesidir. Tükenmesi triptofan (serotoninin öncüsü), tirozin ve fenilalanin (dopamin öncülleri), depresyona yatkınlığı olanlarda ruh halinin azalmasına neden olur, ancak yatkınlığı olmayan kişilerde değil. Öte yandan, dopamin ve norepinefrin sentezinin inhibisyonu ile alfa-metil-para-tirozin sürekli olarak ruh halinin azalmasına neden olmaz.[40]
Monoamin oksidaz
Monoamin hipotezinin bir dalı şunu önermektedir: monoamin oksidaz A Monoaminleri metabolize eden bir enzim olan (MAO-A) depresif kişilerde aşırı derecede aktif olabilir. Bu da monoamin seviyelerinin düşmesine neden olur. Bu hipotez, bir EVCİL HAYVAN Bazı depresif kişilerin beyninde MAO-A'nın önemli ölçüde artmış aktivitesini bulan çalışma.[41] Genetik çalışmalarda, MAO-A ile ilişkili genlerdeki değişiklikler sürekli olarak depresyon ile ilişkilendirilmemiştir.[42][43] Monoamin hipotezinin varsayımlarının aksine, MAO-A'nın azalmış ancak artmamış aktivitesi ergenlerde depresif semptomlarla ilişkilendirilmiştir. Bu ilişki sadece kötü muameleye maruz kalan gençlerde gözlendi, bu da depresif bozuklukların gelişiminde hem biyolojik (MAO genleri) hem de psikolojik (kötü muamele) faktörlerin önemli olduğunu gösteriyor.[44] Ek olarak, bazı kanıtlar, depresyonun altında kimyasal dengedeki değişikliklerden ziyade sinir ağları içindeki bilgi işlemenin bozulmasının yattığını gösteriyor.[45]
Sınırlamalar
1990'lardan beri, araştırmalar monoamin hipotezinin birçok sınırını ortaya çıkardı ve yetersizliği psikiyatri camiasında eleştirildi.[46] Öncelikle, serotonin sistemi disfonksiyonu, depresyonun tek nedeni olamaz. İle tedavi edilen tüm hastalar antidepresanlar sinaptik serotoninde genellikle hızlı artışa rağmen iyileşme gösterir. Duygudurumda önemli gelişmeler meydana gelirse, bu genellikle en az iki ila dört hafta sürmez. Bu gecikme için olası bir açıklama, nörotransmiter aktivitesinin artmasının, haftalar sürebilen otomatik reseptör duyarsızlaştırmasının sonucu olmasıdır.[47] Yoğun araştırma, MDD'li kişilerde belirli bir monoamin sisteminin birincil işlev bozukluğuna dair ikna edici kanıtlar bulamadı. Monoamin sistemi yoluyla etki etmeyen antidepresanlar, örneğin Tianeptin ve opipramol, uzun zamandır biliniyor. Serum seviyeleri ile ilgili tutarsız bulgular da vardır. 5-SED, bir serotonin metaboliti.[48] Monoaminlerin tükenmesine neden olan farmakolojik ajanlarla yapılan deneyler, bu tükenmenin sağlıklı insanlarda depresyona neden olmadığını göstermiştir.[49][50] Ortaya çıkan diğer bir sorun, monoaminleri tüketen ilaçların aslında antidepresan özelliklere sahip olabilmesidir. Dahası, bazıları depresyonun hiperserotonerjik bir durumla işaretlenebileceğini savundu.[51] Zaten sınırlı olan monoamin hipotezi, halka sunulduğunda daha da basitleştirildi.[52]
Reseptör bağlama
2012 itibariyle, nörotransmiter reseptör ekspresyonundaki farklılıkları veya MDB'li kişilerin beyinlerindeki işlevi kullanarak belirleme çabaları Pozitron emisyon tomografi (PET) tutarsız sonuçlar gösterdi. 2012 itibariyle mevcut olan PET görüntüleme teknolojisi ve reaktifleri kullanarak, D1 reseptörü MDD'li kişilerin striatumunda yetersiz ifade edilebilir. 5-HT1 A reseptör bağlanma literatürü tutarsızdır; ancak meziyotemporal kortekste genel bir azalmaya yönelir. 5-HT2A MDD'li kişilerde reseptör bağlanması düzensiz görünmektedir. 5-HTT bağlanması üzerine yapılan çalışmalardan elde edilen sonuçlar değişkendir, ancak MDD'li kişilerde daha yüksek seviyeleri gösterme eğilimindedir. İle sonuçlar D2 / D3 reseptörü bağlayıcı çalışmalar herhangi bir sonuç çıkarmak için çok tutarsızdır. Kanıtlar, MDB'li kişilerde artan MAO aktivitesini desteklemektedir ve hatta bir özellik belirteci olabilir (tedaviye yanıtla değişmez). Muskarinik reseptör bağlanması depresyonda artmış gibi görünmektedir ve ligand bağlanma dinamikleri göz önüne alındığında, artmış kolinerjik aktiviteyi düşündürmektedir.[53]
Depresyonda reseptör bağlanması üzerine iki meta analiz gerçekleştirilmiştir. serotonin taşıyıcısı (5-HTT), biri 5-HT'ye1 Ave diğeri dopamin taşıyıcı (DAT). 5-HTT üzerine bir meta analiz, bağlanmanın azaldığını bildirdi. orta beyin ve amigdala ilki daha büyük yaşla, ikincisi ise depresyon şiddeti ile ilişkilidir.[54] Hem post-mortem hem de in vivo reseptör bağlanma çalışmaları dahil olmak üzere 5-HTT ile ilgili başka bir meta-analiz, in vivo çalışmalar striatum, amigdala ve orta beyinde 5-HTT'nin azaldığını bulurken, post mortem çalışmaların önemli bir ilişki bulmadığını bildirdi.[55] 5-HT1 A ön singulat korteks, meziyotemporal lob, insula ve hipokampusta azaldığı, ancak amigdala veya oksipital lobda azalmadığı bulundu. En yaygın kullanılan 5-HT1 A ligandlar, endojen serotonin ile yer değiştirmez, bu da reseptör yoğunluğunun veya afinitesinin azaldığını gösterir.[56] Depresyonda dopamin taşıyıcı bağlanması değişmez.[57]
Duygusal işleme ve sinir devreleri
Duygusal Önyargı
MDD'ye sahip kişiler, duygusal işlem mutlu yüzleri daha olumsuz değerlendirme eğilimi ve üzücü ifadelere daha dikkatli kaynak ayırma eğilimi gibi.[58] Depresyonda olan insanlar ayrıca mutlu, kızgın, tiksinti, korku ve şaşkın yüzleri tanımakta güçlük çekerler, ancak üzgün değiller.[59] Fonksiyonel nörogörüntüleme, olumsuz duygusal uyaranlara yanıt olarak çeşitli beyin bölgelerinde hiperaktivite ve pozitif uyaranlara yanıt olarak hipoaktivite göstermiştir. Bir meta analiz, depresif deneklerin solda azalmış aktivite gösterdiğini bildirdi. dorsolateral prefrontal korteks ve negatif uyaranlara yanıt olarak amigdalada artan aktivite.[60] Başka bir meta analiz, ilaç tedavisi görmemiş, yaşlı olmayan ve komorbiditesi olmayan depresif deneklerin bir alt grubunda hipokampus ve talamus aktivitesinin arttığını bildirdi.[61] Antidepresanların terapötik gecikmesinin, antidepresanların duygudurum değişikliklerine yol açan duygusal süreci değiştirmesinin bir sonucu olduğu öne sürülmüştür. Bu, hem akut hem de subkronik gözlemle desteklenmektedir. SSRI yönetim olumlu yüzlere tepkiyi artırır.[62] Antidepresan tedavi, ruh haliyle uyumlu önyargıları tersine çeviriyor gibi görünmektedir. limbik, prefrontal ve füziform alanlar. dlPFC yanıtı güçlendirilir ve amigdala yanıtı, önceki veya artan yukarıdan aşağı düzenlemeyi yansıttığı düşünülen olumsuz duyguların işlenmesi sırasında zayıflatılır. fuziform girus ve diğeri görsel işleme alanları olumlu bir işleme yanlılığını yansıttığı düşünülen antidepresan tedavi ile olumlu uyaranlara daha güçlü yanıt verir.[63] Bu etkiler, serotonerjik veya noradrenerjik antidepresanlara özgü görünmüyor, ancak aynı zamanda diğer tedavi biçimlerinde de ortaya çıkıyor. Derin beyin uyarımı.[64]
Sinir devreleri
Depresyonda işlevsel nörogörüntülemenin bir meta analizi, duygusal bir işleme yanlılığını yansıttığı varsayılan bir anormal sinirsel aktivite modeli gözlemledi. Kontrollere göre, MDB'si olan kişilerde hiperaktivite görüldü. devreler içinde çıkıntı ağı (SN), oluşur pulvinar çekirdekleri, Insula ve dorsal ön singulat korteks (dACC) ve ayrıca striatum ve dlPFC'den oluşan düzenleyici devrelerde azalmış aktivite.[65]

Depresyondaki erken biyolojik bulguları açıklamak için limbik-kortikal model adı verilen nöroanatomik bir model önerildi. Model, spesifik depresyon semptomlarını nörolojik anormalliklerle ilişkilendirmeye çalışır. Amigdalanın uyarılmasının olumsuz anıların müdahaleci hatırlanmasıyla ilişkili olduğu bildirildiğinden, yüksek istirahat amigdala aktivitesinin ruminasyonun altında yattığı ileri sürüldü. ACC ikiye ayrıldı pregenual (pgACC) ve alt cins bölgeler (sgACC), ilki elektrofizyolojik olarak korku ile ilişkilendirilirken, ikincisi metabolik olarak sağlıklı deneklerde üzüntüyle ilişkilendirilir. Ödül öğrenmedeki bölgelerin rolleri göz önüne alındığında, lateral orbitofrontal ve insular bölgelerin hiperaktivitesinin yanal prefrontal bölgelerdeki anormalliklerle birlikte uyumsuz duygusal tepkilerin altında yattığı ileri sürülmüştür.[67][68] Bu model ve bir diğeri, daha çok kandaki anormalliklere odaklanan "kortikal striatal model" olarak adlandırıldı. kortiko-bazal gangliyon-talamo-kortikal döngü, son literatür tarafından desteklenmiştir. Azaltılmış striatal aktivite, yüksek OFC aktivitesi ve yüksek sgACC aktivitesi, önerilen modellerle tutarlı bulgulardı. Bununla birlikte, amigdala aktivitesinin limbik-kortikal modelin aksine azaldığı bildirildi. Ayrıca, tedavi ile sadece lateral prefrontal bölgeler modüle edilmiştir, bu da prefrontal alanların durum belirteçleri olduğunu (yani ruh haline bağlı), subkortikal anormalliklerin ise özellik belirteçleri olduğunu (yani bir duyarlılığı yansıtır) gösterir.[69]
Ödül
Bir bütün olarak depresyon şiddeti, ödüle körelmiş bir sinirsel tepki ile ilişkili olmasa da, Anhedonia doğrudan düşük aktivite ile ilişkilidir. ödül sistemi.[70] Depresyonda ödül çalışması, ödül ve anhedoni tanım ve kavramsallaştırmalarındaki heterojenlikle sınırlıdır. Anhedonia genel olarak hissetme yeteneğinin azalması olarak tanımlanır. Zevk ancak anketler ve klinik değerlendirmeler nadiren motivasyonel "isteme" ile tüketime yönelik "beğenme" arasında ayrım yapar. Bir dizi çalışma, depresif kişilerin olumlu uyaranları daha az olumlu ve daha az uyarıcı olarak değerlendirdiklerini öne sürerken, bazı çalışmalar bir fark bulamadı. Ayrıca, aşağıdaki gibi doğal ödüllere yanıt sakaroz zayıflamış görünmüyor. Genel duygusal küntleşme Hem pozitif hem de negatif uyaranların meta analizi, azalmış yoğunluk derecesini ortaya çıkardığından, depresyondaki "anhedonik" semptomları açıklayabilir.[71][72] Anhedoni, depresyonun belirgin bir semptomu olduğundan, depresif kişilerin sağlıklı kişilerle doğrudan karşılaştırılması, subgenual anterior singulat korteks (sgACC) ve azaltılmış aktivasyon ventral striatum ve özellikle çekirdek akümbens (NAcc) olumlu uyaranlara yanıt olarak.[73] Ödül paradigmaları sırasında azalmış NAcc aktivitesi bulgusu oldukça tutarlı olsa da, NAcc işlevsel olarak çeşitli nöronlardan oluşur ve azaltılmış kan oksijen düzeyine bağlı (BOLD) Bu bölgedeki sinyal, azaltılmış afferent aktivite veya azaltılmış inhibitör çıktı dahil olmak üzere çeşitli şeyleri gösterebilir.[74] Bununla birlikte, bu bölgeler ödül işlemede önemlidir ve bunların depresyondaki işlevsizliğinin altında yattığı düşünülmektedir. Anhedonia. Serotonerjik antidepresanlar tarafından iyi hedeflenmeyen rezidüel anhedoninin, dopamin salınımının aktivasyonu ile inhibisyonundan kaynaklandığı varsayılmaktadır. 5-HT2C reseptörleri striatumda.[73] Medialde ödüle verilen yanıt orbitofrontal korteks (OFC) depresyonda zayıflatılırken, yanal OFC tepkisi cezalandırmaya dönüşür. Yanal OFC, ödül veya cezanın yokluğuna sürekli yanıt verir ve değişen olasılıklara yanıt olarak davranışı değiştirmek için gerekli olduğu düşünülmektedir. IOFC'deki aşırı duyarlılık, hayvanlarda öğrenilmiş çaresizliğe benzer bir etki yaratarak depresyona yol açabilir.[75]
SgACC'deki yüksek yanıt, ödülle ilgili görevler de dahil olmak üzere bir dizi paradigma kullanan nörogörüntüleme çalışmalarında tutarlı bir bulgudur.[73][76][77] Tedavi ayrıca sgACC'deki zayıflatılmış aktivite ile de ilişkilidir.[78] ve sgACC'nin kemirgen homologunda nöronların inhibisyonu, infralimbik korteks (IL), antidepresan etki yaratır.[79] SgACC'nin hiperaktivitesinin, ödül veya olumlu uyaranlara verilen somatik tepkiyi zayıflatarak depresyona yol açtığı varsayılmaktadır.[80] Çalışmalarının aksine fonksiyonel manyetik rezonans görüntüleme görevler sırasında sgACC'de yanıt, sgACC'de dinlenme metabolizması azalır. Bununla birlikte, bu yalnızca depresyonla ilişkili sgACC hacmindeki belirgin azalma için düzeltme yapılırken belirgindir; Nöropatolojik çalışmalar sgACC hücre belirteçlerinin azaldığını bildirdiği için yapısal anormallikler hücresel düzeyde belirgindir. Drevets ve arkadaşları tarafından bu bulgulardan önerilen depresyon modeli. azalmış sgACC aktivitesinin artmış sempatik sinir sistemi aktivitesi ve körelmiş HPA eksen geri beslemesi ile sonuçlandığını öne sürmektedir.[81] Duygusal düzenleme sırasında depresif deneklerde nörogörüntülemeyi inceleyen bir incelemenin yazarları, artmış sgACC aktivitesi modelinin depresyonda otomatik duygusal tepkileri düzenleme ihtiyacının arttığını yansıttığını varsaydığından, sgACC'deki aktivite depresyonda da nedensel olmayabilir. Pozitif duygusal işlem sırasında daha kapsamlı sgACC ve genel prefrontal kayıt, pozitif duygulara körelmiş subkortikal yanıt ve denek anhedoni ile ilişkilendirildi. Bu, yazarlar tarafından prefrontal korteksin aşırı görevlendirilmesiyle olumlu duyguların aşağı doğru düzenlenmesini yansıtacak şekilde yorumlandı.[82]
Nöroanatomi
Major depresif bozukluğu olan kişilerde bir dizi nörogörüntüleme bulgusu tutarlı bir şekilde bildirilirken, depresif popülasyonların heterojenliği bu bulguları yorumlamada zorluklar ortaya çıkarmaktadır. Örneğin, popülasyonlar arasında ortalama alma, alt grupla ilgili belirli bulguları gizleyebilir; depresyonda azalmış dlPFC aktivitesi rapor edilirken, bir alt grup, yüksek dlPFC aktivitesi ile mevcut olabilir. Ortalama alma ayrıca, bir denek alt grubunda gerçekte mevcut olan azalmış hipokampal hacimler gibi istatistiksel olarak önemli bulgular da verebilir.[83] Depresyonun uzunlamasına tutarlılığı da dahil olmak üzere bu sorunlar ve diğerleri nedeniyle, çoğu nöral model muhtemelen tüm depresyona uygulanamaz.[69]
Yapısal nörogörüntüleme

Kullanılarak gerçekleştirilen meta analizler tohum tabanlı d eşleme bazı ön bölgelerde gri cevher azalması bildirdiler. Erken başlangıçlı genel depresyonun bir meta analizi, bilateralde gri cevher azalması bildirdi. ön singulat korteks (ACC) ve dorsomedial prefrontal korteks (dmPFC).[85] İlk epizod depresyonu üzerine bir meta analiz, ilaçsız ve kombine popülasyonlarda farklı gri madde azalması modelleri gözlemledi; ilaçsız depresyon, sağdaki azalmalarla ilişkilendirildi dorsolateral prefrontal korteks, sağ amigdala, ve doğru alt temporal girus; ilaçsız ve ilaçlı depresyon kombinasyonu üzerine yapılan analiz, sol insulada, sağ tamamlayıcı motor bölgesinde ve sağ orta temporal girusta azalmalar bulmuştur.[86] İlk MDB atağı olan kişilerle sınırlı olmamakla birlikte ilaçlı ve ilaçsız popülasyonları ayıran bir başka derleme, bilateral üst, sağ orta ve sol alt frontal girustaki kombine popülasyonda bilateral ile birlikte azalmalar bulmuştur. parahipokampus. Talamik ve ACC gri cevherindeki artışlar sırasıyla ilaçsız ve ilaçlı popülasyonlarda bildirilmiştir.[87] "Aktivasyon olasılığı tahmini" kullanılarak gerçekleştirilen bir meta analiz, paracingulate korteks, dACC ve amigdalada azalmalar bildirdi.[88]
İstatistiksel parametrik haritalama kullanarak, bir meta analiz, ACC, medial prefrontal korteks, inferior frontal girus, hipokampus ve talamustaki azalmış gri maddenin önceki bulgularını tekrarladı; ancak OFC'deki azalmalar ve ventromedial prefrontal korteks gri cevher de rapor edildi.[89]
ENIGMA konsorsiyumundan, biri kortikal kalınlık ve diğeri subkortikal hacim üzerine olmak üzere depresyon üzerine iki çalışma yayınlandı. Bilateral OFC, ACC, insula, orta temporal girus, fusiform girus ve posterior singulat kortekslerde azalmış kortikal kalınlık bildirilirken, medial oksipital, inferior parietal, orbitofrontal ve precentral bölgelerde yüzey alanı açıkları bulundu.[90] Özellikle erken başlangıçlı depresyonda belirgin olan hipokamp ve amigdala hacimlerindeki azalmalar dahil olmak üzere subkortikal anormallikler.[91]

Değerlendiren çalışmalarda çoklu meta analizi yapılmıştır Beyaz madde bütünlük kullanarak fraksiyonel anizotropi (FA). Azalmış FA rapor edilmiştir. korpus kallozum (CC) her iki ilk bölümde de ilaç saflığı,[93][94] ve genel majör depresif popülasyonlar.[92][95] KK azaltımlarının kapsamı, çalışmadan çalışmaya farklılık gösterir. Daha önce antidepresan almamış MDB'si olan kişilerde sadece CC'nin vücudunda azalma olduğu bildirilmiştir.[93] ve sadece CC'nin özünde.[94] Öte yandan, genel MDD örneklerinin MK gövdesinde azalmalara sahip olduğu bildirilmiştir,[94] CC'nin gövdesi ve genu,[92] ve sadece CC'nin genu.[95] FA'da düşüşler de rapor edilmiştir. iç kapsülün ön kolu (ALIC)[93][92] ve üstün uzunlamasına fasikül.[93][94]
Fonksiyonel nörogörüntüleme
Dinlenme durumu aktivitesi çalışmaları, bölgesel homojenlik (ReHO), düşük frekans dalgalanmalarının genliği (ALFF), düşük frekans dalgalanmalarının fraksiyonel genliği (fALFF) dahil olmak üzere bir dizi dinlenme durumu aktivitesi göstergesini kullanmıştır. arteriyel spin etiketleme (ASL) ve Pozitron emisyon tomografi bölgesel serebral kan akışı veya metabolizmasının ölçümleri.
ALFF ve fALFF kullanan çalışmalar, ACC aktivitesinde yükselmeler bildirmiş, ilki daha çok ventral bulgu ve ikincisi daha fazla dorsal bulgu bildirmiştir.[96] ALFF ve CBF çalışmalarının birleşik analizi, daha önce tedavi edilmemiş kişilerde artan insula aktivitesine sahip olarak sol insulada birleşti. Yükseltilmiş kuyruklu CBF de rapor edildi[97] Birden fazla dinlenme aktivitesi göstergesini birleştiren bir meta analiz, yükselmiş ön singulat, striatal ve talamik aktivite ve azalmış sol insula, post-santral girus ve fusiform girus aktivitesi bildirdi.[98] PET / SPECT dinlenme durumu çalışmalarının bir aktivasyon olasılığı tahmini (ALE) meta analizi, sol insula, pregenual ve dorsal anterior singulat kortekste azalmış aktivite ve talamus, kaudat, anterior hipokampus ve amigdalada artmış aktivite bildirmiştir.[99] PET / SPECT çalışmalarının ALE meta analiziyle karşılaştırıldığında, çok çekirdekli yoğunluk analizi kullanan bir çalışma, yalnızca pulvinar çekirdekleri talamusun.[65]
Beyin bölgeleri
MDB'si olan kişilerin beyinleri üzerine yapılan araştırmalar, genellikle beynin birçok bölümü arasında rahatsız edici etkileşim kalıpları olduğunu gösterir. Depresyonun biyolojisini daha tam olarak anlamaya çalışan çalışmalarda beynin çeşitli alanları yer almaktadır:
Alt cins cingulate
Çalışmalar göstermiştir ki Brodmann bölgesi 25 subgenual singulat olarak da bilinen, metabolik olarak aşırı aktiftir tedaviye dirençli depresyon. Bu bölge son derece zengindir serotonin taşıyıcıları ve aşağıdaki gibi alanları içeren geniş bir ağın yöneticisi olarak kabul edilir hipotalamus ve beyin sapı iştah ve uykudaki değişiklikleri etkileyen; amigdala ve Insula ruh halini ve kaygıyı etkileyen; hipokamp hafıza oluşumunda önemli rol oynayan; ve bazı kısımları ön korteks benlik saygısından sorumludur. Bu nedenle bu bölgedeki rahatsızlıklar veya bu alanın normalden küçük olması depresyona katkıda bulunur. Derin beyin uyarımı Tedaviye dirençli depresyonu olan kişilerde aktivitesini azaltmak için bu bölge hedeflenmiştir.[100]:576–578[101]
Prefrontal korteks
Bir inceleme, hipoaktivite bildirdi. Prefrontal korteks Kontrollere kıyasla depresyonu olanların oranı.[102] Prefrontal korteks, duygusal işleme ve düzenlemede rol oynar ve bu sürecin disfonksiyonu, depresyon etiyolojisinde rol oynayabilir. Antidepresan tedavisi üzerine yapılan bir çalışma, antidepresanların uygulanmasına yanıt olarak PFC aktivitesinde bir artış bulmuştur.[103] 2012'de yayınlanan bir meta analiz, prefrontal korteksin alanlarının MDB'li kişilerde olumsuz uyaranlara yanıt olarak hipoaktif olduğunu buldu.[65] Bir çalışma, prefrontal korteksin alanlarının, MDD'li kişilerde hipoaktif görünen dorsal ve pregenual singulat, bilateral orta frontal girus, insula ve superior temporal girus gibi bir bölge ağının parçası olduğunu ileri sürdü. Ancak yazarlar, dışlama kriterleri, tutarlılık eksikliği ve küçük örneklerin sonuçları sınırlandırdığı konusunda uyardı.[99]
Amigdala
Duygusal işlemeyle ilgili bir yapı olan amigdala, majör depresif bozukluğu olanlarda hiperaktif görünmektedir.[101] İlaçsız depresif kişilerdeki amigdala, ilaç kullananlardan daha küçük olma eğilimindeydi, ancak toplu veriler depresif ve sağlıklı kişiler arasında hiçbir fark olmadığını gösteriyor.[104] Duygusal işlemleme görevleri sırasında sağ amigdala soldan daha aktiftir, ancak bilişsel görevler sırasında hiçbir fark yoktur ve dinlenme durumunda sadece sol amigdala daha hiperaktif görünür.[105] Bununla birlikte, bir çalışma, duygusal işleme görevleri sırasında amigdala aktivitesinde hiçbir fark bulamadı.[106]
Hipokamp
Hipokampusun atrofisi, stres ve nörogenezin hayvan modelleriyle uyumlu olarak, depresyon sırasında gözlenmiştir.[107][108]
Stres, hipokampal nörojenezdeki baskılamanın yanı sıra, birkaç anahtar beyin bölgesinde monoaminerjik değişiklikler yoluyla depresyon ve depresyon benzeri semptomlara neden olabilir.[109] Bu, duygu ve bilişle ilgili beyin bölgelerinde ve HPA eksen disfonksiyonunda değişikliğe yol açar. Disfonksiyon yoluyla, stresin etkileri 5-HT üzerindeki etkileri de dahil olmak üzere şiddetlenebilir. Dahası, bu etkilerin bazıları, hipokampal nörogenezi artırarak etki edebilen antidepresan etki ile tersine çevrilir. This leads to a restoration in HPA activity and stress reactivity, thus restoring the deleterious effects induced by stress on 5-HT.[110]
Hipotalamik-pituiter-adrenal eksen bir zincir endokrin structures that are activated during the body's response to stressors of various sorts. The HPA axis involves three structure, the hypothalamus which release CRH that stimulates the pituitary gland to release ACTH which stimulates the adrenal glands to release cortisol. Cortisol has a negative feedback effect on the pituitary gland and hypothalamus. In people with MDD the often shows increased activation in depressed people, but the mechanism behind this is not yet known.[111] Increased basal cortisol levels and abnormal response to dexamethasone challenges have been observed in people with MDD.[112] Early life stress has been hypothesized as a potential cause of HPA dysfunction.[113][114] HPA axis regulation may be examined through a dexamethasone suppression tests, which tests the feedback mechanisms. Non-suppression of dexamethasone is a common finding in depression, but is not consistent enough to be used as a diagnostic tool.[115] HPA axis changes by be responsible for some of the changes such as decreased bone mineral density and increased weight found in people with MDD. One drug, ketoconazole, currently under development has shown promise in treating MDD.[116]
Hippocampal Neurogenesis
Azaltılmış hipokampal neurogenesis leads to a reduction in hippocampal volume. A genetically smaller hippocampus has been linked to a reduced ability to process psikolojik travma and external stress, and subsequent predisposition to psychological illness.[117] Depression without familial risk or childhood trauma has been linked to a normal hippocampal volume but localised dysfunction.[118]
Animal Models
A number of animal models exist for depression, but they are limited in that depression involves primarily subjective emotional changes. However, some of these changes are reflected in physiology and behavior, the latter of which is the target of many animal models. These models are generally assessed according to four facets of validity; the reflection of the core symptoms in the model; the predictive validity of the model; the validity of the model with regard to human characteristics of etiology;[119] and the biological plausibility.[120][121]
Different models for inducing depressive behaviors have been utilized; neuroanatomical manipulations such as olfactory bulbectomy or circuit specific manipulations with optogenetics; genetic models such as 5-HT1A knockout or selectively bred animals;[119] models involving environmental manipulation associated with depression in humans, including chronic mild stress, early life stress and learned helplessness.[122] The validity of these models in producing depressive behaviors may be assessed with a number of behavioral tests. Anhedonia and motivational deficits may, for example, be assessed via examining an animal's level of engagement with rewarding stimuli such as sucrose or intracranial self-stimulation. Anxious and irritable symptoms may be assessed with exploratory behavior in the presence of a stressful or novelty environment, such as the open field test, novelty suppressed feeding, or the elevated plus-maze. Fatigue, psychomotor poverty, and agitation may be assessed with locomotor activity, grooming activity, and open field tests.
Animal models possess a number of limitations due to the nature of depression. Some core symptoms of depression, such as rumination, low self-esteem, guilt, and depressed mood cannot be assessed in animals as they require subjective reporting.[121] From an evolutionary standpoint, the behavior correlates of defeats of loss are thought to be an adaptive response to prevent further loss. Therefore, attempts to model depression that seeks to induce defeat or despair may actually reflect adaption and not disease. Furthermore, while depression and anxiety are frequently comorbid, dissociation of the two in animal models is difficult to achieve.[119] Pharmacological assessment of validity is frequently disconnected from clinical pharmacotherapeutics in that most screening tests assess acute effects, while antidepressants normally take a few weeks to work in humans.[123]
Neurocircuits
Regions involved in reward are common targets of manipulation in animal models of depression, including the nucleus accumbens (NAc), ventral tegmental area (VTA), ventral pallidum (VP), lateral habenula (LHb) ve medial prefrontal korteks (mPFC). Tentative fMRI studies in humans demonstrate elevated LHb activity in depression.[124] The lateral habenula projects to the RMTg to drive inhibition of dopamine neurons in the VTA during omission of reward. In animal models of depression, elevated activity has been reported in LHb neurons that project to the ventral tegmental alan (ostensibly reducing dopamine release). The LHb also projects to aversion reactive mPFC neurons, which may provide an indirect mechanism for producing depressive behaviors.[125] Learned helplessness induced potentiation of LHb synapses are reversed by antidepressant treatment, providing predictive validity.[124] A number of inputs to the LHb have been implicated in producing depressive behaviors. Silencing GABAergic projections from the NAc to the LHb reduces conditioned place preference induced in social aggression, and activation of these terminals induces CPP. Ventral pallidum firing is also elevated by stress induced depression, an effect that is pharmacologically valid, and silencing of these neurons alleviates behavioral correlates of depression.[124] Tentative in vivo evidence from people with MDD suggests abnormalities in dopamine signalling.[126] This led to early studies investigating VTA activity and manipulations in animal models of depression. Massive destruction of VTA neurons enhances depressive behaviors, while VTA neurons reduce firing in response to chronic stress. However, more recent specific manipulations of the VTA produce varying results, with the specific animal model, duration of VTA manipulation, method of VTA manipulation, and subregion of VTA manipulation all potentially leading to differential outcomes.[127] Stress and social defeat induced depressive symptoms, including anhedonia, are associated with potentiation of excitatory inputs to Dopamine D2 receptor-expressing medium spiny neurons (D2-MSNs) and depression of excitatory inputs to Dopamine D1 receptor-expressing medium spiny neurons (D1-MSNs). Optogenetic excitation of D1-MSNs alleviates depressive symptoms and is rewarding, while the same with D2-MSNs enhances depressive symptoms. Excitation of glutaminergic inputs from the ventral hippocampus reduces social interactions, and enhancing these projections produces susceptibility to stress-induced depression.[127] Manipulations of different regions of the mPFC can produce and attenuate depressive behaviors. For example, inhibiting mPFC neurons specifically in the intralimbic cortex attenuates depressive behaviors. The conflicting findings associated with mPFC stimulation, when compared to the relatively specific findings in the infralimbic cortex, suggest that the prelimbic cortex and infralimbic cortex may mediate opposing effects.[79] mPFC projections to the raphe nuclei are largely GABAergic and inhibit the firing of serotonergic neurons. Specific activation of these regions reduce immobility in the forced swim test but do not affect open field or forced swim behavior. Inhibition of the raphe shifts the behavioral phenotype of uncontrolled stress to a phenotype closer to that of controlled stress.[128]
Altered neuroplasticity
Recent studies have called attention to the role of altered nöroplastisite in depression. A review found a convergence of three phenomena:
- Chronic stress reduces synaptic and dendritic plasticity
- Depressed subjects show evidence of impaired neuroplasticity (e.g. shortening and reduced complexity of dendritic trees)
- Anti-depressant medications may enhance neuroplasticity at both a molecular and dendritic level.
The conclusion is that disrupted neuroplasticity is an underlying feature of depression, and is reversed by antidepressants.[129]
Blood levels of BDNF in people with MDD increase significantly with antidepressant treatment and correlate with decrease in symptoms.[130] Post mortem studies and rat models demonstrate decreased neuronal density in the prefrontal cortex thickness in people with MDD. Rat models demonstrate histological changes consistent with MRI findings in humans, however studies on neurogenesis in humans are limited. Antidepressants appear to reverse the changes in neurogenesis in both animal models and humans.[131]
Inflammation and oxidative stress
Various review have found that general inflammation may play a role in depression.[132][133] One meta analysis of cytokines in people with MDD found increased levels of pro-inflammatory IL-6 and TNF-a levels relative to controls.[134] The first theories came about when it was noticed that interferon therapy caused depression in a large number of people receiving it.[135] Meta analysis on cytokine levels in people with MDD have demonstrated increased levels of IL-1, IL-6, C-reaktif protein, Ama değil IL-10.[136][137] Increased numbers of T-Cells presenting activation markers, levels of Neopterin, IFN gamma, sTNFR, and IL-2 receptors have been observed in depression.[138] Various sources of inflammation in depressive illness have been hypothesized and include trauma, sleep problems, diet, smoking and obesity.[139] Cytokines, by manipulating neurotransmitters, are involved in the generation of sickness behavior, which shares some overlap with the symptoms of depression. Neurotransmitters hypothesized to be affected include dopamine and serotonin, which are common targets for antidepressant drugs. Induction of indolamine-2,3 dioxygenease by cytokines has been proposed as a mechanism by which immune dysfunction causes depression.[140] One review found normalization of cytokine levels after successful treatment of depression.[141] A meta analysis published in 2014 found the use of anti-inflammatory drugs such as NSAIDs and investigational cytokine inhibitors reduced depressive symptoms.[142] Exercise can act as a stressor, decreasing the levels of IL-6 and TNF-a and increasing those of IL-10, an anti-inflammatory cytokine.[143]
Inflammation is also intimately linked with metabolic processes in humans. For example, low levels of Vitamin D have been associated with greater risk for depression.[144] The role of metabolic biomarkers in depression is an active research area. Recent work has explored the potential relationship between plasma sterols and depressive symptom severity.[145]
A marker of DNA oxidation, 8-Okso-2'-deoksiguanozin, has been found to be increased in both the plasma and urine of people with MDD. This along with the finding of increased F2-isoprostanes levels found in blood, urine and cerebrospinal fluid indicate increased damage to lipids and DNA in people with MDD. Studies with 8-Oxo-2' Deoxyguanosine varied by methods of measurement and type of depression, but F2-Isoprostane level was consistent across depression types. Authors suggested lifestyle factors, dysregulation of the HPA axis, immune system and autonomics nervous system as possible causes.[146] Another meta-analysis found similar results with regards to oxidative damage products as well as decreased oxidative capacity.[147] Oksidatif DNA hasarı may play a role in MDD.[148]
Mitochondrial Dysfunction:
Increased markers of oxidative stress relative to controls have been found in people with MDD.[149] These markers include high levels of RNS ve ROS which have been shown to influence chronic inflammation, damaging the elektron taşıma zinciri and biochemical cascades in mitokondri. This lowers the activity of enzymes in the respiratory chain resulting in mitochondrial dysfunction.[150] The brain is a highly energy-consuming and has little capacity to store glucose as glycogen and so depends greatly on mitochondria. Mitochondrial dysfunction has been linked to the dampened nöroplastisite observed in depressed brains.[151]
Large-scale brain network theory
Instead of studying one brain region, studying large scale brain networks is another approach to understanding psychiatric and neurological disorders,[152] supported by recent research that has shown that multiple brain regions are involved in these disorders. Understanding the disruptions in these networks may provide important insights into interventions for treating these disorders. Recent work suggests that at least three large-scale brain networks are important in psychopathology:[152]
Central executive network
central executive network is made up of fronto-parietal regions, including dorsolateral prefrontal cortex and lateral posterior parietal cortex.[153][154] This network is involved in high level bilişsel fonksiyonlar such as maintaining and using information in çalışan bellek, problem solving, and decision making.[152][155] Deficiencies in this network are common in most major psychiatric and neurological disorders, including depression.[156][157] Because this network is crucial for everyday life activities, those who are depressed can show impairment in basic activities like test taking and being decisive.[158]
Varsayılan mod ağı
varsayılan mod ağı includes hubs in the prefrontal cortex and posterior cingulate, with other prominent regions of the network in the medial temporal lobe and angular gyrus.[152] The default mode network is usually active during mind-wandering and thinking about social situations. In contrast, during specific tasks probed in cognitive science (for example, simple attention tasks), the default network is often deactivated.[159][160] Research has shown that regions in the default mode network (including medial prefrontal cortex and posterior cingulate) show greater activity when depressed participants ruminate (that is, when they engage in repetitive self-focused thinking) than when typical, healthy participants ruminate.[161] People with MDD also show increased connectivity between the default mode network and the subgenual cingulate and the adjoining ventromedial prefrontal cortex in comparison to healthy individuals, individuals with dementia or with autism. Numerous studies suggest that the subgenual cingulate plays an important role in the dysfunction that characterizes major depression.[162] The increased activation in the default mode network during rumination and the atypical connectivity between core default mode regions and the subgenual cingulate may underlie the tendency for depressed individual to get "stuck" in the negative, self-focused thoughts that often characterize depression.[163] However, further research is needed to gain a precise understanding of how these network interactions map to specific symptoms of depression.
Dikkat çekici ağ
belirginlik ağı is a cingulate-frontal operculum network that includes core nodes in the anterior cingulate and anterior insula.[153] Bir belirginlik network is a large-scale brain network involved in detecting and orienting the most pertinent of the external stimuli and internal events being presented.[152] Individuals who have a tendency to experience negative emotional states (scoring high on measures of nevrotiklik ) show an increase in the right anterior insula during decision-making, even if the decision has already been made.[164] This atypically high activity in the right anterior insula is thought to contribute to the experience of negative and worrisome feelings.[165] In major depressive disorder, anxiety is often a part of the emotional state that characterizes depression.[166]
Ayrıca bakınız
Referanslar
- ^ Anglin, Rebecca E.; Tarnopolsky, Mark A.; Mazurek, Michael F.; Rosebush, Patricia I. (January 2012). "The Psychiatric Presentation of Mitochondrial Disorders in Adults". Nöropsikiyatri ve Klinik Nörobilim Dergisi. 24 (4): 394–409. doi:10.1176/appi.neuropsych.11110345. ISSN 0895-0172. PMID 23224446.
- ^ CARROLL, BERNARD J. (October 2004). "Psychoneuroendocrinology: The Scientific Basis of Clinical Practice. Edited by O. M. Wolkowitz and A. J. Rothschild. (Pp. 606; $73.95; ISBN 0-88048-857-3 pb.) American Psychiatric Publishing, Inc.: Arlington, Virginia, 2003". Psikolojik Tıp. 34 (7): 1359–1360. doi:10.1017/S0033291704213678. ISSN 0033-2917.
- ^ Kupfer DJ, Frank E, Phillips ML (17 March 2012). "Major depressive disorder: new clinical, neurobiological, and treatment perspectives". Lancet. 379 (9820): 1045–55. doi:10.1016/S0140-6736(11)60602-8. PMC 3397431. PMID 22189047.
- ^ aan het Rot M, Mathew SJ, Charney DS (3 February 2009). "Neurobiological mechanisms in major depressive disorder". Kanada Tabipler Birliği Dergisi. 180 (3): 305–13. doi:10.1503/cmaj.080697. PMC 2630359. PMID 19188629.
- ^ Levinson, Douglas F.; Nichols, Walter E. (2018). "24. Genetics of Depression". In Charney, Dennis S.; Sklar, Pamela; Buxbaum, Joseph D .; Nestler, Eric J. (eds.). Charney & Nestlers Neurobiology of Mental Illness (5. baskı). New York: Oxford University Press. s. 310.
- ^ Nierenberg, AA (2009). "The long tale of the short arm of the promoter region for the gene that encodes the serotonin uptake protein". CNS Spektrumları. 14 (9): 462–3. doi:10.1017/s1092852900023506. PMID 19890228.
- ^ Risch, N; Herrell, R; Lehner, T; Liang, KY; Eaves, L; Hoh, J; Griem, A; Kovacs, M; Ott, J; Merikangas, KR (17 June 2009). "Serotonin taşıyıcı gen (5-HTTLPR), stresli yaşam olayları ve depresyon riski arasındaki etkileşim: bir meta-analiz". JAMA. 301 (23): 2462–71. doi:10.1001 / jama.2009.878. PMC 2938776. PMID 19531786.
- ^ Munafò, MR; Durrant, C; Lewis, G; Flint, J (1 February 2009). "Serotonin taşıyıcı lokusunda Gen X çevre etkileşimleri". Biyolojik Psikiyatri. 65 (3): 211–9. doi:10.1016 / j.biopsych.2008.06.009. PMID 18691701.
- ^ Karg, K; Burmeister, M; Shedden, K; Sen, S (May 2011). "Serotonin taşıyıcı destekleyici varyantı (5-HTTLPR), stres ve depresyon meta analizi yeniden gözden geçirildi: genetik denetimin kanıtı". Genel Psikiyatri Arşivleri. 68 (5): 444–54. doi:10.1001 / archgenpsychiatry.2010.189. PMC 3740203. PMID 21199959.
- ^ Taylor, AE; Munafò, MR (31 May 2016). "Triangulating meta-analyses: the example of the serotonin transporter gene, stressful life events and major depression". BMC Psikolojisi. 4 (1): 23. doi:10.1186/s40359-016-0129-0. PMC 4886450. PMID 27240561.
- ^ Bleys, D; Luyten, P; Soenens, B; Claes, S (15 January 2018). "Gene-environment interactions between stress and 5-HTTLPR in depression: A meta-analytic update" (PDF). Duygusal Bozukluklar Dergisi. 226: 339–345. doi:10.1016/j.jad.2017.09.050. PMID 29031184.
- ^ Fanelli G, Serretti A (2019). "The influence of the serotonin transporter gene 5-HTTLPR polymorphism on suicidal behaviors: a meta-analysis". Prog Neuropsychopharmacol Biol Psikiyatri. 88: 375–387. doi:10.1016/j.pnpbp.2018.08.007. PMID 30125622.CS1 Maint: yazar parametresini kullanır (bağlantı)
- ^ Levinson, D. (2006). "The genetics of depression: a review". Biyolojik Psikiyatri. 60 (2): 84–92. doi:10.1016/j.biopsych.2005.08.024. PMID 16300747.
- ^ Dwivedi Y (2009). "Brain-derived neurotrophic factor: role in depression and suicide". Nöropsikiyatr Hastalık Tedavisi. 5: 433–49. doi:10.2147/NDT.S5700. PMC 2732010. PMID 19721723.
- ^ a b Krishnan, V .; Nestler, E. (2008). "The molecular neurobiology of depression". Doğa. 455 (7215): 894–902. Bibcode:2008Natur.455..894K. doi:10.1038/nature07455. PMC 2721780. PMID 18923511.
- ^ Pezawas, L.; Meyer-Lindenberg, A .; Goldman, A. L.; Verchinski, B. A.; Chen, G .; Kolachana, B. S.; Egan, M. F.; Mattay, V. S.; Hariri, A. R .; Weinberger, D. R. (2008). "Evidence of biologic epistasis between BDNF and SLC6A4 and implications for depression". Moleküler Psikiyatri. 13 (7): 709–716. doi:10.1038/mp.2008.32. PMID 18347599.
- ^ Converge Consortium; Bigdeli, Tim B.; Kretzschmar, Warren; Li, Yihan; Liang, Jieqin; Song, Li; Hu, Jingchu; Li, Qibin; Jin, Wei; Hu, Zhenfei; Wang, Guangbiao; Wang, Linmao; Qian, Puyi; Liu, Yuan; Jiang, Tao; Lu, Yao; Zhang, Xiuqing; Yin, Ye; Li, Yingrui; Xu, Xun; Gao, Jingfang; Reimers, Mark; Webb, Todd; Riley, Brien; Bacanu, Silviu; Peterson, Roseann E.; Chen, Yiping; Zhong, Hui; Liu, Zhengrong; et al. (2015). "Seyrek tüm genom dizilimi, majör depresif bozukluk için iki lokusu tanımlar". Doğa. 523 (7562): 588–91. Bibcode:2015Natur.523..588C. doi:10.1038 / nature14659. PMC 4522619. PMID 26176920.
- ^ Smoller, Jordan W (2015). "The Genetics of Stress-Related Disorders: PTSD, Depression, and Anxiety Disorders". Nöropsikofarmakoloji. 41 (1): 297–319. doi:10.1038/npp.2015.266. PMC 4677147. PMID 26321314.
- ^ Zhao, Xiaofeng; Huang, Yinglin; Ma, Hui; Jin, Qiu; Wang, Yuan; Zhu, Gang (15 August 2013). "Association between major depressive disorder and the norepinephrine transporter polymorphisms T-182C and G1287A: a meta-analysis". Duygusal Bozukluklar Dergisi. 150 (1): 23–28. doi:10.1016/j.jad.2013.03.016. ISSN 1573-2517. PMID 23648227.
- ^ Lohoff, Falk W. (6 December 2016). "Overview of the Genetics of Major Depressive Disorder". Güncel Psikiyatri Raporları. 12 (6): 539–546. doi:10.1007/s11920-010-0150-6. ISSN 1523-3812. PMC 3077049. PMID 20848240.
- ^ López-León, S.; Janssens, A. C. J. W.; González-Zuloeta Ladd, A. M.; Del-Favero, J.; Claes, S. J.; Oostra, B. A .; van Duijn, C. M. (1 August 2008). "Meta-analyses of genetic studies on major depressive disorder". Moleküler Psikiyatri. 13 (8): 772–785. doi:10.1038/sj.mp.4002088. ISSN 1476-5578. PMID 17938638.
- ^ a b Carlson Neil R. (2013). Davranış fizyolojisi (11. baskı). Boston: Pearson. pp. 578–582. ISBN 978-0-205-23939-9. OCLC 769818904.
- ^ a b c Adrien J.. Neurobiological bases for the relation between sleep and depression. Uyku Tıbbı Yorumları. 2003;6(5):341–51. doi:10.1053/smrv.2001.0200. PMID 12531125.
- ^ a b Terman M. Evolving applications of light therapy. Uyku Tıbbı Yorumları. 2007;11(6):497–507. doi:10.1016/j.smrv.2007.06.003. PMID 17964200.
- ^ Benedetti F, Barbini B, Colombo C, Smeraldi E. Chronotherapeutics in a psychiatric ward. Uyku Tıbbı Yorumları. 2007;11(6):509–22. doi:10.1016/j.smrv.2007.06.004. PMID 17689120.
- ^ Zhai, Long; Zhang, Hua; Zhang, Dongfeng (1 September 2015). "Sleep Duration and Depression Among Adults: A Meta-Analysis of Prospective Studies". Depresyon ve Kaygı. 32 (9): 664–670. doi:10.1002/da.22386. ISSN 1520-6394. PMID 26047492.
- ^ Germain, Anne; Kupfer, David J. (6 December 2016). "Circadian rhythm disturbances in depression". İnsan Psikofarmakolojisi. 23 (7): 571–585. doi:10.1002/hup.964. ISSN 0885-6222. PMC 2612129. PMID 18680211.
- ^ Savitz, Jonathan B.; Drevets, Wayne C. (1 April 2013). "Depresyonda nöro reseptör görüntüleme". Hastalığın Nörobiyolojisi. 52: 49–65. doi:10.1016 / j.nbd.2012.06.001. ISSN 1095-953X. PMID 22691454.
- ^ Carlson, Neil R. (2005). Foundations of Physiological Psychology (6. baskı). Boston: Pearson A and B. p.108. ISBN 978-0-205-42723-9. OCLC 60880502.
- ^ Marchand; Valentina; Jensen. "Neurobiology of Mood disorders". Hastane Hekimi: 17–26.
- ^ Hjorth, S; Bengtsson, HJ; Kullberg, A; Carlzon, D; Peilot, H; Auerbach, SB (June 2000). "Serotonin autoreceptor function and antidepressant drug action". Journal of Psychopharmacology (Oxford, İngiltere). 14 (2): 177–85. doi:10.1177/026988110001400208. PMID 10890313.
- ^ a b COWEN, P (September 2008). "Serotonin and depression: pathophysiological mechanism or marketing myth?". Farmakolojik Bilimlerdeki Eğilimler. 29 (9): 433–436. doi:10.1016/j.tips.2008.05.004. PMID 18585794.
- ^ a b Harmer, CJ (November 2008). "Serotonin and emotional processing: does it help explain antidepressant drug action?". Nörofarmakoloji. 55 (6): 1023–8. doi:10.1016/j.neuropharm.2008.06.036. PMID 18634807.
- ^ Dunlop, Boadie W.; Nemeroff, Charles B. (1 April 2007). "The Role of Dopamine in the Pathophysiology of Depression". Genel Psikiyatri Arşivleri. 64 (3): 327–37. doi:10.1001 / archpsyc.64.3.327. ISSN 0003-990X. PMID 17339521.
- ^ Willner, Paul (1 December 1983). "Dopamine and depression: A review of recent evidence. I. Empirical studies". Beyin Araştırma İncelemeleri. 6 (3): 211–224. doi:10.1016/0165-0173(83)90005-X. PMID 6140979.
- ^ a b HASLER, GREGOR (4 December 2016). "Pathophysiology of Depression: Do We Have Any Solid Evidence of Interest to Clinicians?". Dünya Psikiyatrisi. 9 (3): 155–161. doi:10.1002 / j.2051-5545.2010.tb00298.x. ISSN 1723-8617. PMC 2950973. PMID 20975857.
- ^ Kunugi, Hiroshi; Hori, Hiroaki; Ogawa, Shintaro (1 October 2015). "Biochemical markers subtyping major depressive disorder". Psikiyatri ve Klinik Nörobilim. 69 (10): 597–608. doi:10.1111/pcn.12299. ISSN 1440-1819. PMID 25825158.
- ^ Lammel, S.; Tye, K. M.; Warden, M. R. (1 January 2014). "Progress in understanding mood disorders: optogenetic dissection of neural circuits". Genler, Beyin ve Davranış. 13 (1): 38–51. doi:10.1111/gbb.12049. ISSN 1601-183X. PMID 23682971.
- ^ Delgado PL, Moreno FA (2000). "Depresyonda norepinefrinin rolü". J Clin Psikiyatri. 61 Özel Sayı 1: 5–12. PMID 10703757.
- ^ Ruhe, HG; Mason, NS; Schene, AH (2007). "Ruh hali, insanlarda serotonin, norepinefrin ve dopamin seviyeleri ile dolaylı olarak ilişkilidir: monoamin tükenmesi çalışmalarının bir meta-analizi". Moleküler Psikiyatri. 12 (4): 331–359. doi:10.1038 / sj.mp.4001949. PMID 17389902.
- ^ Meyer JH, Ginovart N, Boovariwala A, et al. (Kasım 2006). "Elevated monoamine oxidase a levels in the brain: An explanation for the monoamine imbalance of major depression". Genel Psikiyatri Arşivleri. 63 (11): 1209–16. doi:10.1001 / archpsyc.63.11.1209. PMID 17088501.
- ^ Huang SY, Lin MT, Lin WW, Huang CC, Shy MJ, Lu RB (19 December 2007). "Han Çin popülasyonunda monoamin oksidaz A (MAOA) polimorfizmlerinin ve majör depresif bozuklukların klinik alt gruplarının birleşmesi". Dünya Biyolojik Psikiyatri Dergisi. 10 (4 Pt 2): 544–51. doi:10.1080/15622970701816506. PMID 19224413.
- ^ Yu YW, Tsai SJ, Hong CJ, Chen TJ, Chen MC, Yang CW (Eylül 2005). "Bir monoamin oksidaz ve bir gen promoter polimorfizminin majör depresif bozukluk ve antidepresan yanıtla ilişkilendirilmesi çalışması". Nöropsikofarmakoloji. 30 (9): 1719–23. doi:10.1038 / sj.npp.1300785. PMID 15956990.
- ^ Cicchetti D, Rogosch FA, Sturge-Apple ML (2007). "Interactions of child maltreatment and serotonin transporter and monoamine oxidase A polymorphisms: depressive symptomatology among adolescents from low socioeconomic status backgrounds". Dev. Psikopatol. 19 (4): 1161–80. doi:10.1017/S0954579407000600. PMID 17931441.
- ^ Castrén, E (2005). "Is mood chemistry?". Doğa Yorumları Nörobilim. 6 (3): 241–46. doi:10.1038/nrn1629. PMID 15738959.
- ^ Hirschfeld RM (2000). "History and evolution of the monoamine hypothesis of depression". Klinik Psikiyatri Dergisi. 61 Suppl 6: 4–6. PMID 10775017.
- ^ Davis, Kenneth L .; ve diğerleri, eds. (2002). Nöropsikofarmakoloji: beşinci nesil ilerleme: Amerikan Nöropsikofarmakoloji Koleji'nin resmi yayını (5. baskı). Philadelphia, Pa.: Lippincott Williams & Wilkins. pp. 1139–1163. ISBN 9780781728379.
- ^ Jacobsen, Jacob P. R.; Medvedev, Ivan O.; Caron, Marc G. (5 September 2012). "The 5-HT deficiency theory of depression: perspectives from a naturalistic 5-HT deficiency model, the tryptophan hydroxylase 2Arg439His knockin mouse". Kraliyet Topluluğu'nun Felsefi İşlemleri B: Biyolojik Bilimler. 367 (1601): 2444–2459. doi:10.1098/rstb.2012.0109. ISSN 0962-8436. PMC 3405680. PMID 22826344.
- ^ Delgado PL, Moreno FA (2000). "Depresyonda norepinefrinin rolü". J Clin Psikiyatri. 61 Özel Sayı 1: 5–12. PMID 10703757.
- ^ Delgado PL (2000). "Depression: the case for a monoamine deficiency". Klinik Psikiyatri Dergisi. 61 Suppl 6: 7–11. PMID 10775018.
- ^ Andrews, Paul W.; Bharwani, Aadil; Lee, Kyuwon R.; Fox, Molly; Thomson, J. Anderson (1 April 2015). "Serotonin bir üst mü yoksa bir düşürücü mü? Serotonerjik sistemin evrimi ve depresyondaki rolü ve antidepresan tepkisi". Nörobilim ve Biyodavranışsal İncelemeler. 51: 164–188. doi:10.1016 / j.neubiorev.2015.01.018. ISSN 1873-7528. PMID 25625874.
- ^ Lacasse, Jeffrey R .; Leo, Jonathan (8 November 2005). "Serotonin ve Depresyon: Reklamlar ve Bilimsel Literatür Arasında Bir Kopukluk". PLOS Tıp. 2 (12): e392. doi:10.1371 / journal.pmed.0020392. PMC 1277931. PMID 16268734.

- ^ Savitz, Jonathan; Drevets, Wayne (2013). "Depresyonda nöro reseptör görüntüleme". Hastalığın Nörobiyolojisi. 52: 49–65. doi:10.1016 / j.nbd.2012.06.001. PMID 22691454.
- ^ Gryglewski, G; Lanzenberger, R; Kranz, GS; Cumming, P (July 2014). "Meta-analysis of molecular imaging of serotonin transporters in major depression". Serebral Kan Akışı ve Metabolizma Dergisi. 34 (7): 1096–103. doi:10.1038/jcbfm.2014.82. PMC 4083395. PMID 24802331.
- ^ Kambeitz, JP; Howes, OD (1 November 2015). "The serotonin transporter in depression: Meta-analysis of in vivo and post mortem findings and implications for understanding and treating depression". Duygusal Bozukluklar Dergisi. 186: 358–66. doi:10.1016/j.jad.2015.07.034. PMID 26281039.
- ^ Wang, L; Zhou, C; Zhu, D; Wang, X; Fang, L; Zhong, J; Mao, Q; Güneş, L; Gong, X; Xia, J; Lian, B; Xie, P (13 September 2016). "Serotonin-1A receptor alterations in depression: a meta-analysis of molecular imaging studies". BMC Psikiyatri. 16 (1): 319. doi:10.1186/s12888-016-1025-0. PMC 5022168. PMID 27623971.
- ^ Li, Z; Hey; Tang, J; Zong, X; Hu, M; Chen, X (15 March 2015). "Molecular imaging of striatal dopamine transporters in major depression—a meta-analysis". Duygusal Bozukluklar Dergisi. 174: 137–43. doi:10.1016/j.jad.2014.11.045. PMID 25497470.
- ^ Bourke, Cecilia; Douglas, Katie; Porter, Richard (1 August 2010). "Processing of facial emotion expression in major depression: a review". Avustralya ve Yeni Zelanda Psikiyatri Dergisi. 44 (8): 681–696. doi:10.3109/00048674.2010.496359. ISSN 1440-1614. PMID 20636189.
- ^ Dalili, M. N.; Penton-Voak, I. S .; Harmer, C. J.; Munafò, M. R. (7 December 2016). "Meta-analysis of emotion recognition deficits in major depressive disorder". Psikolojik Tıp. 45 (6): 1135–1144. doi:10.1017/S0033291714002591. ISSN 0033-2917. PMC 4712476. PMID 25395075.
- ^ Groenewold, Nynke A.; Opmeer, Esther M.; de Jonge, Peter; Aleman, André; Costafreda, Sergi G. (1 February 2013). "Emotional valence modulates brain functional abnormalities in depression: evidence from a meta-analysis of fMRI studies". Nörobilim ve Biyodavranışsal İncelemeler. 37 (2): 152–163. doi:10.1016/j.neubiorev.2012.11.015. ISSN 1873-7528. PMID 23206667.
- ^ Müller, VI; Cieslik, EC; Serbanescu, I; Laird, AR; Fox, PT; Eickhoff, SB (1 January 2017). "Altered Brain Activity in Unipolar Depression Revisited: Meta-analyses of Neuroimaging Studies". JAMA Psikiyatri. 74 (1): 47–55. doi:10.1001/jamapsychiatry.2016.2783. PMC 5293141. PMID 27829086.
- ^ Harmer, C. J.; Goodwin, G. M.; Cowen, P. J. (31 July 2009). "Why do antidepressants take so long to work? A cognitive neuropsychological model of antidepressant drug action". İngiliz Psikiyatri Dergisi. 195 (2): 102–108. doi:10.1192/bjp.bp.108.051193. PMID 19648538.
- ^ Delaveau, P; Jabourian, M; Lemogne, C; Guionnet, S; Bergouignan, L; Fossati, P (April 2011). "Brain effects of antidepressants in major depression: a meta-analysis of emotional processing studies". Duygusal Bozukluklar Dergisi. 130 (1–2): 66–74. doi:10.1016/j.jad.2010.09.032. PMID 21030092.
- ^ Pringle, A; Harmer, CJ (December 2015). "The effects of drugs on human models of emotional processing: an account of antidepressant drug treatment". Klinik Sinirbilimde Diyaloglar. 17 (4): 477–87. PMC 4734885. PMID 26869848.
- ^ a b c Hamilton, J. Paul; Etkin, Amit; Furman, Daniella J.; Lemus, Maria G.; Johnson, Rebecca F.; Gotlib, Ian H. (1 July 2012). "Majör depresif bozukluğun fonksiyonel nörogörüntülemesi: bir meta-analiz ve temel hat aktivasyonu ve nöral yanıt verilerinin yeni entegrasyonu". Amerikan Psikiyatri Dergisi. 169 (7): 693–703. doi:10.1176 / appi.ajp.2012.11071105. ISSN 1535-7228. PMID 22535198.
- ^ Drevets, WC; Fiyat, JL; Furey, ML (September 2008). "Brain structural and functional abnormalities in mood disorders: implications for neurocircuitry models of depression". Beyin Yapısı ve İşlevi. 213 (1–2): 93–118. doi:10.1007/s00429-008-0189-x. PMC 2522333. PMID 18704495.
- ^ Drevets, WC (April 2001). "Neuroimaging and neuropathological studies of depression: implications for the cognitive-emotional features of mood disorders". Nörobiyolojide Güncel Görüş. 11 (2): 240–9. doi:10.1016/S0959-4388(00)00203-8. PMID 11301246.
- ^ Mayberg, Helen (1 August 1997). "Limbik-kortikal düzensizlik: önerilen bir depresyon modeli". Nöropsikiyatri ve Klinik Nörobilim Dergisi. 9 (3): 471–481. doi:10.1176/jnp.9.3.471. ISSN 0895-0172. PMID 9276848.
- ^ a b Graham, Julia; Salimi-Khorshidi, Gholamreza; Hagan, Cindy; Walsh, Nicholas; Goodyer, Ian; Lennox, Belinda; Suckling, John (1 November 2013). "Meta-analytic evidence for neuroimaging models of depression: State or trait?". Duygusal Bozukluklar Dergisi. 151 (2): 423–431. doi:10.1016 / j.jad.2013.07.002. PMID 23890584.
- ^ Anticevic, A; Schleifer, C; Youngsun, TC (December 2015). "Emotional and cognitive dysregulation in schizophrenia and depression: understanding common and distinct behavioral and neural mechanisms". Klinik Sinirbilimde Diyaloglar. 17 (4): 421–34. PMC 4734880. PMID 26869843.
- ^ Rømer Thomsen, K; Whybrow, PC; Kringelbach, ML (2015). "Reconceptualizing anhedonia: novel perspectives on balancing the pleasure networks in the human brain". Davranışsal Sinirbilimde Sınırlar. 9: 49. doi:10.3389/fnbeh.2015.00049. PMC 4356228. PMID 25814941.
- ^ Treadway, MT; Zald, DH (January 2011). "Reconsidering anhedonia in depression: lessons from translational neuroscience". Nörobilim ve Biyodavranışsal İncelemeler. 35 (3): 537–55. doi:10.1016/j.neubiorev.2010.06.006. PMC 3005986. PMID 20603146.
- ^ a b c Sternat T, Katzman MA (1 January 2016). "Hedonik tonun nörobiyolojisi: tedaviye dirençli depresyon, dikkat eksikliği hiperaktivite bozukluğu ve madde bağımlılığı arasındaki ilişki". Nöropsikiyatrik Hastalık ve Tedavi. 12: 2149–64. doi:10.2147 / NDT.S111818. PMC 5003599. PMID 27601909.
- ^ Russo, SJ; Nestler, EJ (September 2013). "The brain reward circuitry in mood disorders". Doğa Yorumları. Sinirbilim. 14 (9): 609–25. doi:10.1038/nrn3381. PMC 3867253. PMID 23942470.
- ^ Rolls, ET (Eylül 2016). "Ödülsüz bir çeker depresyon teorisi" (PDF). Nörobilim ve Biyodavranışsal İncelemeler. 68: 47–58. doi:10.1016 / j.neubiorev.2016.05.007. PMID 27181908.
- ^ Miller, CH; Hamilton, JP; Sacchet, MD; Gotlib, IH (October 2015). "Meta-analysis of Functional Neuroimaging of Major Depressive Disorder in Youth". JAMA Psikiyatri. 72 (10): 1045–53. doi:10.1001/jamapsychiatry.2015.1376. PMID 26332700.
- ^ Graham, J; Salimi-Khorshidi, G; Hagan, C; Walsh, N; Goodyer, I; Lennox, B; Suckling, J (November 2013). "Depresyonun nörogörüntüleme modelleri için meta-analitik kanıt: durum mu yoksa özellik mi?". Duygusal Bozukluklar Dergisi. 151 (2): 423–31. doi:10.1016 / j.jad.2013.07.002. PMID 23890584.
- ^ Drevets, WC; Savitz, J; Trimble, M (August 2008). "The subgenual anterior cingulate cortex in mood disorders". CNS Spektrumları. 13 (8): 663–81. doi:10.1017/S1092852900013754. PMC 2729429. PMID 18704022.
- ^ a b Lammel, S; Tye, KM; Warden, MR (January 2014). "Progress in understanding mood disorders: optogenetic dissection of neural circuits". Genler, Beyin ve Davranış. 13 (1): 38–51. doi:10.1111/gbb.12049. PMID 23682971.
- ^ Groenewold, NA; Opmeer, EM; de Jonge, P; Aleman, A; Costafreda, SG (February 2013). "Emotional valence modulates brain functional abnormalities in depression: evidence from a meta-analysis of fMRI studies". Nörobilim ve Biyodavranışsal İncelemeler. 37 (2): 152–63. doi:10.1016/j.neubiorev.2012.11.015. PMID 23206667.
- ^ Drevets, WC; Savitz, J; Trimble, M (August 2008). "The subgenual anterior cingulate cortex in mood disorders". CNS Spektrumları. 13 (8): 663–81. doi:10.1017/S1092852900013754. PMC 2729429. PMID 18704022.
Together, these data suggest the hypothesis that dysfunction of the sgACC results in understimulation of parasympathetic tone in mood disorders.
- ^ Rive, MM; van Rooijen, G; Veltman, DJ; Phillips, ML; Schene, AH; Ruhé, HG (December 2013). "Neural correlates of dysfunctional emotion regulation in major depressive disorder. A systematic review of neuroimaging studies". Nörobilim ve Biyodavranışsal İncelemeler. 37 (10 Pt 2): 2529–53. doi:10.1016/j.neubiorev.2013.07.018. PMID 23928089.
- ^ Dunlop, BW; Mayberg, HS (December 2014). "Neuroimaging-based biomarkers for treatment selection in major depressive disorder". Klinik Sinirbilimde Diyaloglar. 16 (4): 479–90. PMC 4336918. PMID 25733953.
- ^ Wise, T; Radua, J; Via, E; Cardoner, N; Abe, O; Adams, TM; Amico, F; Cheng, Y; Cole, JH; de Azevedo Marques Périco, C; Dickstein, DP; Farrow, TFD; Frodl, T; Wagner, G; Gotlib, IH; Gruber, O; Ham, BJ; Job, DE; Kempton, MJ; Kim, MJ; Koolschijn, PCMP; Malhi, GS; Mataix-Cols, D; McIntosh, AM; Nugent, AC; O'Brien, JT; Pezzoli, S; Phillips, ML; Sachdev, PS; Salvadore, G; Selvaraj, S; Stanfield, AC; Thomas, AJ; van Tol, MJ; van der Wee, NJA; Veltman, DJ; Young, AH; Fu, CH; Cleare, AJ; Arnone, D (October 2017). "Common and distinct patterns of grey-matter volume alteration in major depression and bipolar disorder: evidence from voxel-based meta-analysis". Moleküler Psikiyatri. 22 (10): 1455–1463. doi:10.1038/mp.2016.72. PMC 5622121. PMID 27217146.
- ^ Bora, E; Fornito, A; Pantelis, C; Yücel, M (April 2012). "Gray matter abnormalities in Major Depressive Disorder: a meta-analysis of voxel based morphometry studies". Duygusal Bozukluklar Dergisi. 138 (1–2): 9–18. doi:10.1016/j.jad.2011.03.049. PMID 21511342.
- ^ Zhang, H; Küçük; Wu, M; Chen, Z; Hu, X; Chen, Y; Zhu, H; Jia, Z; Gong, Q (January 2016). "Brain gray matter alterations in first episodes of depression: A meta-analysis of whole-brain studies". Nörobilim ve Biyodavranışsal İncelemeler. 60: 43–50. doi:10.1016/j.neubiorev.2015.10.011. PMID 26592799.
- ^ Zhao, YJ; Du, MY; Huang, XQ; Lui, S; Chen, ZQ; Liu, J; Luo, Y; Wang, XL; Kemp, GJ; Gong, QY (October 2014). "Brain grey matter abnormalities in medication-free patients with major depressive disorder: a meta-analysis". Psikolojik Tıp. 44 (14): 2927–37. doi:10.1017/S0033291714000518. PMID 25065859.
- ^ Sacher, J; Neumann, J; Fünfstück, T; Soliman, A; Villringer, A; Schroeter, ML (October 2012). "Mapping the depressed brain: a meta-analysis of structural and functional alterations in major depressive disorder". Duygusal Bozukluklar Dergisi. 140 (2): 142–8. doi:10.1016/j.jad.2011.08.001. PMID 21890211.
- ^ Arnone, D; Job, D; Selvaraj, S; Abe, O; Amico, F; Cheng, Y; Colloby, SJ; O'Brien, JT; Frodl, T; Gotlib, IH; Ham, BJ; Kim, MJ; Koolschijn, PC; Périco, CA; Salvadore, G; Thomas, AJ; Van Tol, MJ; van der Wee, NJ; Veltman, DJ; Wagner, G; McIntosh, AM (April 2016). "Computational meta-analysis of statistical parametric maps in major depression". İnsan Beyin Haritalama. 37 (4): 1393–404. doi:10.1002/hbm.23108. PMC 6867585. PMID 26854015.
- ^ Schmaal, L; Hibar, DP; Sämann, PG; Hall, GB; Baune, BT; Jahanshad, N; Cheung, JW; van Erp, TGM; Bos, D; Ikram, MA; Vernooij, MW; Niessen, WJ; Tiemeier, H; Hofman, A; Wittfeld, K; Grabe, HJ; Janowitz, D; Bülow, R; Selonke, M; Völzke, H; Grotegerd, D; Dannlowski, U; Arolt, V; Opel, N; Heindel, W; Kugel, H; Hoehn, D; Czisch, M; Couvy-Duchesne, B; Rentería, ME; Strike, LT; Wright, MJ; Mills, NT; de Zubicaray, GI; McMahon, KL; Medland, SE; Martin, NG; Gillespie, NA; Goya-Maldonado, R; Gruber, O; Krämer, B; Hatton, SN; Lagopoulos, J; Hickie, IB; Frodl, T; Carballedo, A; Frey, EM; van Velzen, LS; Penninx, BWJH; van Tol, MJ; van der Wee, NJ; Davey, CG; Harrison, BJ; Mwangi, B; Cao, B; Soares, JC; Veer, IM; Walter, H; Schoepf, D; Zurowski, B; Konrad, C; Schramm, E; Normann, C; Schnell, K; Sacchet, MD; Gotlib, IH; MacQueen, GM; Godlewska, BR; Nickson, T; McIntosh, AM; Papmeyer, M; Whalley, HC; Hall, J; Sussmann, JE; Li, M; Walter, M; Aftanas, L; Brack, I; Bokhan, NA; Thompson, PM; Veltman, DJ (June 2017). "Cortical abnormalities in adults and adolescents with major depression based on brain scans from 20 cohorts worldwide in the ENIGMA Major Depressive Disorder Working Group". Moleküler Psikiyatri. 22 (6): 900–909. doi:10.1038/mp.2016.60. PMC 5444023. PMID 27137745.
- ^ Schmaal, L; Veltman, DJ; van Erp, TG; Sämann, PG; Frodl, T; Jahanshad, N; Loehrer, E; Tiemeier, H; Hofman, A; Niessen, WJ; Vernooij, MW; Ikram, MA; Wittfeld, K; Grabe, HJ; Blok, A; Hegenscheid, K; Völzke, H; Hoehn, D; Czisch, M; Lagopoulos, J; Hatton, SN; Hickie, IB; Goya-Maldonado, R; Krämer, B; Gruber, O; Couvy-Duchesne, B; Rentería, ME; Grev, LT; Mills, NT; de Zubicaray, GI; McMahon, KL; Medland, SE; Martin, NG; Gillespie, NA; Wright, MJ; Hall, GB; MacQueen, GM; Frey, EM; Carballedo, A; van Velzen, LS; van Tol, MJ; van der Wee, NJ; Veer, IM; Walter, H; Schnell, K; Schramm, E; Normann, C; Schoepf, D; Konrad, C; Zurowski, B; Nickson, T; McIntosh, AM; Papmeyer, M; Whalley, HC; Sussmann, JE; Godlewska, BR; Cowen, PJ; Fischer, FH; Gül, M; Penninx, BW; Thompson, PM; Hibar, DP (Haziran 2016). "Majör depresif bozuklukta subkortikal beyin değişiklikleri: ENIGMA Majör Depresif Bozukluk çalışma grubunun bulguları". Moleküler Psikiyatri. 21 (6): 806–12. doi:10.1038 / mp.2015.69. PMC 4879183. PMID 26122586.
- ^ a b c d Chen, G; Hu, X; Küçük; Huang, X; Lui, S; Kuang, W; Ai, H; Bi, F; Gu, Z; Gong, Q (24 Şubat 2016). "Majör depresif bozuklukta beyaz cevher yapısının düzensizliği: yayılma tensör görüntülemesinin yol tabanlı uzamsal istatistiklerle meta-analizi". Bilimsel Raporlar. 6: 21825. Bibcode:2016NatSR ... 621825C. doi:10.1038 / srep21825. PMC 4764827. PMID 26906716.
- ^ a b c d Chen, G; Guo, Y; Zhu, H; Kuang, W; Bi, F; Ai, H; Gu, Z; Huang, X; Lui, S; Gong, Q (2 Haziran 2017). "İlk bölümde beyaz cevher mikro mimarisinin içsel bozulması, ilaca naif majör depresif bozukluk: Difüzyon tensör görüntülemenin voksel tabanlı meta analizi". Nöro-psikofarmakoloji ve Biyolojik Psikiyatride İlerleme. 76: 179–187. doi:10.1016 / j.pnpbp.2017.03.011. PMID 28336497.
- ^ a b c d Jiang, J; Zhao, YJ; Hu, XY; Du, MY; Chen, ZQ; Wu, M; Li, KM; Zhu, HY; Kumar, P; Gong, QY (Mayıs 2017). "Majör depresif bozukluğu olan ilaçsız hastalarda mikroyapısal beyin anormallikleri: difüzyon tensör görüntülemesinin sistematik bir incelemesi ve meta-analizi". Psikiyatri ve Sinirbilim Dergisi. 42 (3): 150–163. doi:10.1503 / jpn.150341. PMC 5403660. PMID 27780031.
- ^ a b Bilge, T; Radua, J; Nortje, G; Cleare, AJ; Genç, AH; Arnone, D (15 Şubat 2016). "Majör Depresyon ve Bipolar Bozuklukta Yapısal Bağlantısızlığın Voksel Tabanlı Meta-Analitik Kanıtı". Biyolojik Psikiyatri. 79 (4): 293–302. doi:10.1016 / j.biopsych.2015.03.004. PMID 25891219.
- ^ Zhou, M; Hu, X; Lu, L; Zhang, L; Chen, L; Gong, Q; Huang, X (3 Nisan 2017). "Majör depresif bozukluğu olan yetişkinlerde dinlenme durumunda içsel serebral aktivite: Bir meta-analiz". Nöro-psikofarmakoloji ve Biyolojik Psikiyatride İlerleme. 75: 157–164. doi:10.1016 / j.pnpbp.2017.02.001. PMID 28174129.
- ^ Li, W; Chen, Z; Wu, M; Zhu, H; Gu, L; Zhao, Y; Kuang, W; Bi, F; Kemp, GJ; Gong, Q (1 Mart 2017). "Beyin kan akışının karakterizasyonu ve majör depresif bozuklukta düşük frekanslı dalgalanmaların genliği: Çok modlu bir meta-analiz". Duygusal Bozukluklar Dergisi. 210: 303–311. doi:10.1016 / j.jad.2016.12.032. PMID 28068619.
- ^ Kühn, S; Gallinat, J (Mart 2013). "Şizofrenide ve majör depresyonda dinlenme hali beyin aktivitesi: nicel bir meta-analiz". Şizofreni Bülteni. 39 (2): 358–65. doi:10.1093 / schbul / sbr151. PMC 3576173. PMID 22080493.
- ^ a b Fitzgerald, PB; Laird, AR; Maller, J; Daskalakis, ZJ (Haziran 2008). "Depresyonda beyin aktivasyonundaki değişikliklerin meta-analitik çalışması". İnsan Beyin Haritalama. 29 (6): 683–95. doi:10.1002 / hbm.20426. PMC 2873772. PMID 17598168.
- ^ Carlson Neil R. (2012). Davranış Fizyolojisi Kitapları A La Carte Edition (11. baskı). Boston: Pearson Koleji Div. ISBN 978-0-205-23981-8.
- ^ a b Miller, Chris H .; Hamilton, J. Paul; Sacchet, Matthew D .; Gotlib, Ian H. (1 Ekim 2015). "Gençlerde Majör Depresif Bozukluğun Fonksiyonel Nörogörüntülemesinin Meta-analizi". JAMA Psikiyatri. 72 (10): 1045–1053. doi:10.1001 / jamapsychiatry.2015.1376. ISSN 2168-6238. PMID 26332700.
- ^ Wessa, Michèle; Lois, Giannis (30 Kasım 2016). "Majör Depresyonda Psikofarmakolojik Tedavinin Beyin Fonksiyonel Etkileri: Duygusal İşlemenin Sinir Devresine Odaklanma". Güncel Nörofarmakoloji. 13 (4): 466–479. doi:10.2174 / 1570159X13666150416224801. ISSN 1570-159X. PMC 4790403. PMID 26412066.
- ^ Outhred, Tim; Hawkshead, Brittany E .; Bahis, Tor D .; Das, Pritha; Malhi, Gin S .; Kemp, Andrew H. (1 Eylül 2013). "Duygu işleme üzerinde seçici serotonin geri alım inhibitörlerine karşı noradrenalin geri alım inhibitörlerinin akut nöral etkileri: Farklı tedavi etkinliği için çıkarımlar" (PDF). Nörobilim ve Biyodavranışsal İncelemeler. 37 (8): 1786–1800. doi:10.1016 / j.neubiorev.2013.07.010. ISSN 1873-7528. PMID 23886514.
- ^ Hamilton, J. Paul; Siemer, Matthias; Gotlib, Ian H. (8 Eylül 2009). "Majör Depresif Bozuklukta Amigdala hacmi: Manyetik rezonans görüntüleme çalışmalarının bir meta-analizi". Moleküler Psikiyatri. 13 (11): 993–1000. doi:10.1038 / mp.2008.57. ISSN 1359-4184. PMC 2739676. PMID 18504424.
- ^ Palmer, Susan M .; Crewther, Sheila G .; Carey, Leeanne M. (14 Ocak 2015). "Klinik Depresyonda Beyin Aktivitesindeki Değişikliklerin Meta Analizi". İnsan Nörobiliminde Sınırlar. 8: 1045. doi:10.3389 / fnhum.2014.01045. ISSN 1662-5161. PMC 4294131. PMID 25642179.
- ^ Fitzgerald, Paul B .; Laird, Angela R .; Maller, Jerome; Daskalakis, Zafiris J. (5 Aralık 2016). "Depresyonda Beyin Aktivasyonundaki Değişikliklerin Meta-Analitik Çalışması". İnsan Beyin Haritalama. 29 (6): 683–695. doi:10.1002 / hbm.20426. ISSN 1065-9471. PMC 2873772. PMID 17598168.
- ^ Cole, James; Costafreda, Sergi G .; McGuffin, Peter; Fu, Cynthia H. Y. (1 Kasım 2011). "İlk epizod depresyonda hipokampal atrofi: manyetik rezonans görüntüleme çalışmalarının bir meta-analizi". Duygusal Bozukluklar Dergisi. 134 (1–3): 483–487. doi:10.1016 / j.jad.2011.05.057. ISSN 1573-2517. PMID 21745692.
- ^ Videbech, Poul; Ravnkilde, Barbara (1 Kasım 2004). "Hipokampal hacim ve depresyon: MRI çalışmalarının bir meta-analizi". Amerikan Psikiyatri Dergisi. 161 (11): 1957–1966. doi:10.1176 / appi.ajp.161.11.1957. ISSN 0002-953X. PMID 15514393.
- ^ Mahar, I; Bambico, FR; Mechawar, N; Nobrega, JN (Ocak 2014). "Depresyon ve antidepresan etkileri ile ilgili olarak stres, serotonin ve hipokampal nörogenez". Nörobilim ve Biyodavranışsal İncelemeler. 38: 173–92. doi:10.1016 / j.neubiorev.2013.11.009. PMID 24300695.
- ^ Willner, P; Scheel-Krüger, J; Belzung, C (Aralık 2013). "Depresyonun nörobiyolojisi ve antidepresan etki". Nörobilim ve Biyodavranışsal İncelemeler. 37 (10 Pt 1): 2331–71. doi:10.1016 / j.neubiorev.2012.12.007. PMID 23261405.
- ^ Pariante CM, Lightman SL (Eylül 2008). "Majör depresyonda HPA ekseni: klasik teoriler ve yeni gelişmeler". Trendler Neurosci. 31 (9): 464–468. doi:10.1016 / j.tins.2008.06.006. PMID 18675469.
- ^ Belvederi Murri, Martino; Pariante, Carmine; Mondelli, Valeria; Masotti, Mattia; Atti, Anna Rita; Mellacqua, Zefiro; Antonioli, Marco; Ghio, Lucio; Menchetti, Marco; Zanetidou, Stamatula; Innamorati, Marco; Amore, Mario (1 Mart 2014). "HPA ekseni ve depresyonda yaşlanma: sistematik inceleme ve meta-analiz". Psikonöroendokrinoloji. 41: 46–62. doi:10.1016 / j.psyneuen.2013.12.004. ISSN 1873-3360. PMID 24495607.
- ^ Juruena, Mario F. (1 Eylül 2014). "Erken yaşam stresi ve HPA ekseni, tekrarlayan yetişkinlik depresyonunu tetikler". Epilepsi ve Davranış. 38: 148–159. doi:10.1016 / j.yebeh.2013.10.020. ISSN 1525-5069. PMID 24269030.
- ^ Heim, Christine; Newport, D. Jeffrey; Mletzko, Tanja; Miller, Andrew H .; Nemeroff, Charles B. (1 Ağustos 2008). "Çocukluk çağı travması ve depresyon arasındaki bağlantı: İnsanlarda yapılan HPA eksen araştırmalarından elde edilen bilgiler". Psikonöroendokrinoloji. 33 (6): 693–710. doi:10.1016 / j.psyneuen.2008.03.008. ISSN 0306-4530. PMID 18602762.
- ^ Arana, G. W .; Baldessarini, R. J .; Ornsteen, M. (1 Aralık 1985). "Psikiyatride tanı ve prognoz için deksametazon bastırma testi. Yorum ve inceleme". Genel Psikiyatri Arşivleri. 42 (12): 1193–1204. doi:10.1001 / archpsyc.1985.01790350067012. ISSN 0003-990X. PMID 3000317.
- ^ Varghese, Femina P .; Brown, E. Sherwood (1 Ocak 2001). "Majör Depresif Bozuklukta Hipotalamik-Hipofiz-Adrenal Eksen: Birinci Basamak Doktorları İçin Kısa Bir Astar". Klinik Psikiyatri Dergisinin Birinci Basamak Arkadaşı. 3 (4): 151–155. doi:10.4088 / pcc.v03n0401. ISSN 1523-5998. PMC 181180. PMID 15014598.
- ^ Gilbertson, M. W .; Shenton, M. E .; Ciszewski, A .; Kasai, K .; Lasko, N. B .; Orr, S. P .; Pitman, R. K. (2002). "Daha küçük hipokampal hacim, psikolojik travmaya karşı patolojik savunmasızlığı öngörür". Doğa Sinirbilim. 5 (11): 1242–7. doi:10.1038 / nn958. PMC 2819093. PMID 12379862.
- ^ Vythilingam, Escort; Vermetten Eric; Anderson, George M .; Luckenbaugh, David; Anderson, Eric R .; Kar, Joseph; Staib, Lawrence H .; Charney, Dennis S .; Bremner, J. Douglas (15 Temmuz 2004). "Majör depresif bozuklukta hipokampal hacim, hafıza ve kortizol durumu: tedavinin etkileri". Biyolojik Psikiyatri. 56 (2): 101–112. doi:10.1016 / j.biopsych.2004.04.002. ISSN 0006-3223. PMID 15231442.
- ^ a b c Krishnan, V; Nestler, EJ (2011). Depresyonun hayvan modelleri: moleküler perspektifler. Davranışsal Sinirbilimlerde Güncel Konular. 7. sayfa 121–47. doi:10.1007/7854_2010_108. ISBN 978-3-642-19702-4. PMC 3270071. PMID 21225412.
- ^ Belzung, C; Lemoine, M (7 Kasım 2011). "Psikiyatrik bozuklukların hayvan modelleri için geçerlilik kriterleri: anksiyete bozuklukları ve depresyona odaklanma". Ruh Hali ve Anksiyete Bozukluklarının Biyolojisi. 1 (1): 9. doi:10.1186/2045-5380-1-9. PMC 3384226. PMID 22738250.
- ^ a b Alcantara, Lyonna F .; Övgü, Eric M .; Bolanos-Guzman, Carlos A. (2018). "26. Duygudurum Bozukluklarının Hayvan Modelleri". Charney, Dennis'te; Sklar, Pamela; Nestler, Eric; Buxbaum, Joseph (editörler). Charney & Nestler'in Ruhsal Hastalık Nörobiyolojisi (5. baskı). New York: Oxford University Press. s. 329–333.
- ^ Yan, HC; Cao, X; Das, M; Zhu, XH; Gao, TM (Ağustos 2010). "Depresyonun davranışsal hayvan modelleri". Nörobilim Bülteni. 26 (4): 327–37. doi:10.1007 / s12264-010-0323-7. PMC 5552573. PMID 20651815.
- ^ Czéh, B; Fuchs, E; Wiborg, O; Simon, M (4 Ocak 2016). "Büyük depresyonun hayvan modelleri ve klinik etkileri". Nöro-psikofarmakoloji ve Biyolojik Psikiyatride İlerleme. 64: 293–310. doi:10.1016 / j.pnpbp.2015.04.004. PMID 25891248.
- ^ a b c Yang, Y; Wang, H; Hu, J; Hu, H (Şubat 2018). "Depresyonun patofizyolojisinde lateral habenula". Nörobiyolojide Güncel Görüş. 48: 90–96. doi:10.1016 / j.conb.2017.10.024. PMID 29175713.
- ^ Proulx, CD; Hikosaka, O; Malinow, R (Eylül 2014). "Normal ve depresif davranışlarda lateral habenula ile ödül işleme". Doğa Sinirbilim. 17 (9): 1146–52. doi:10.1038 / nn.3779. PMC 4305435. PMID 25157511.
- ^ Belujon, P; Grace, AA (1 Aralık 2017). "Major Depresif Bozukluklarda Dopamin Sistemi Düzensizliği". Uluslararası Nöropsikofarmakoloji Dergisi. 20 (12): 1036–1046. doi:10.1093 / ijnp / pyx056. PMC 5716179. PMID 29106542.
- ^ a b Knowland, D; Lim, BK (5 Ocak 2018). "Depresif davranışların devre tabanlı çerçeveleri: Ödül devresinin rolü ve ötesi". Farmakoloji Biyokimyası ve Davranış. 174: 42–52. doi:10.1016 / j.pbb.2017.12.010. PMC 6340396. PMID 29309799.
- ^ Heller, AS (2016). "Depresyonda Kortikal-Subkortikal Etkileşimler: Hayvan Modellerinden İnsan Psikopatolojisine". Sistem Nörobiliminde Sınırlar. 10: 20. doi:10.3389 / fnsys.2016.00020. PMC 4780432. PMID 27013988.
- ^ Christopher Pittenger; Ronald S Duman (2008). "Stres, Depresyon ve Nöroplastisite: Mekanizmaların Yakınsaması". Nöropsikofarmakoloji. 33 (1): 88–109. doi:10.1038 / sj.npp.1301574. PMID 17851537.
- ^ Brunoni, André Russowsky; Lopes, Mariana; Fregni, Felipe (1 Aralık 2008). "Majör depresyon ve BDNF düzeyleri üzerine klinik çalışmaların sistematik bir incelemesi ve meta-analizi: depresyonda nöroplastisitenin rolü için çıkarımlar". Uluslararası Nöropsikofarmakoloji Dergisi. 11 (8): 1169–1180. doi:10.1017 / S1461145708009309. ISSN 1461-1457. PMID 18752720.
- ^ Serafini, Gianluca (22 Haziran 2012). "Nöroplastisite ve majör depresyon, modern antidepresan ilaçların rolü". Dünya Psikiyatri Dergisi. 2 (3): 49–57. doi:10.5498 / wjp.v2.i3.49. ISSN 2220-3206. PMC 3782176. PMID 24175168.
- ^ Krishnadas, Rajeev; Cavanagh, Jonathan (1 Mayıs 2012). "Depresyon: iltihaplı bir hastalık mı?". Nöroloji, Nöroşirürji ve Psikiyatri Dergisi. 83 (5): 495–502. doi:10.1136 / jnnp-2011-301779. ISSN 1468-330X. PMID 22423117.
- ^ Patel, Amisha (1 Eylül 2013). "Gözden geçirme: inflamasyonun depresyondaki rolü". Psychiatria Danubina. 25 Özel Sayı 2: S216–223. ISSN 0353-5053. PMID 23995180.
- ^ Dowlati, Yekta; Herrmann, Nathan; Swardfager, Walter; Liu, Helena; Sham, Lauren; Reim, Elyse K .; Lanctôt, Krista L. (1 Mart 2010). "Majör depresyondaki sitokinlerin meta-analizi". Biyolojik Psikiyatri. 67 (5): 446–457. doi:10.1016 / j.biopsych.2009.09.033. ISSN 1873-2402. PMID 20015486.
- ^ Dantzer, Robert; O’Connor, Jason C .; Freund, Gregory G .; Johnson, Rodney W .; Kelley, Keith W. (3 Aralık 2016). "Enflamasyondan hastalık ve depresyona: bağışıklık sistemi beyni kontrol altına aldığında". Doğa Yorumları Nörobilim. 9 (1): 46–56. doi:10.1038 / nrn2297. ISSN 1471-003X. PMC 2919277. PMID 18073775.
- ^ Hiles, Sarah A .; Baker, Amanda L .; de Malmanche, Theo; Attia, John (1 Ekim 2012). "Depresyonu olan ve olmayan insanlar arasındaki IL-6 ve IL-10 farklılıklarının bir meta-analizi: heterojenliğin nedenlerini keşfetmek". Beyin, Davranış ve Bağışıklık. 26 (7): 1180–1188. doi:10.1016 / j.bbi.2012.06.001. ISSN 1090-2139. PMID 22687336.
- ^ Howren, M. Bryant; Lamkin, Donald M .; Suls, Jerry (1 Şubat 2009). "Depresyonun C-reaktif protein, IL-1 ve IL-6 ile ilişkileri: bir meta-analiz". Psikosomatik Tıp. 71 (2): 171–186. doi:10.1097 / PSY.0b013e3181907c1b. ISSN 1534-7796. PMID 19188531.
- ^ Maes, Michael (29 Nisan 2011). "Depresyon iltihaplı bir hastalıktır, ancak hücre aracılı bağışıklık aktivasyonu, depresyonun anahtar bileşenidir". Nöro-Psikofarmakoloji ve Biyolojik Psikiyatride İlerleme. 35 (3): 664–675. doi:10.1016 / j.pnpbp.2010.06.014. ISSN 1878-4216. PMID 20599581.
- ^ Berk, Michael; Williams, Lana J; Jacka, Felice N; O’Neil, Adrienne; Pasco, Julie A; Moylan, Steven; Allen, Nicholas B; Stuart, Amanda L; Hayley, Amie C; Byrne, Michelle L; Maes, Michael (12 Eylül 2013). "Öyleyse depresyon iltihaplı bir hastalıktır ama iltihap nereden gelir?". BMC Tıp. 11: 200. doi:10.1186/1741-7015-11-200. ISSN 1741-7015. PMC 3846682. PMID 24228900.
- ^ Leonard, Brian; Maes, Michael (1 Şubat 2012). "Hücre aracılı bağışıklık aktivasyonunun, inflamasyonun ve oksidatif ve nitrozatif stres yollarının ve bunların sekellerinin ve eşlikçilerinin tek kutuplu depresyonun patofizyolojisinde nasıl rol oynadığı mekanik açıklamalar". Nörobilim ve Biyodavranışsal İncelemeler. 36 (2): 764–785. doi:10.1016 / j.neubiorev.2011.12.005. ISSN 1873-7528. PMID 22197082.
- ^ Raedler, Thomas J. (1 Kasım 2011). "Majör depresif bozuklukta iltihaplanma mekanizmaları". Psikiyatride Güncel Görüş. 24 (6): 519–525. doi:10.1097 / YCO.0b013e32834b9db6. ISSN 1473-6578. PMID 21897249.
- ^ Köhler, Ole; Benros, Michael E .; Nordentoft, Merete; Farkouh, Michael E .; İyengar, Rupa L .; Mors, Ole; Krogh, Jesper (1 Aralık 2014). "Anti-inflamatuar tedavinin depresyon, depresif belirtiler ve yan etkiler üzerindeki etkisi: randomize klinik çalışmaların sistematik bir incelemesi ve meta-analizi". JAMA Psikiyatri. 71 (12): 1381–1391. doi:10.1001 / jamapsychiatry.2014.1611. ISSN 2168-6238. PMID 25322082.
- ^ Medine, Johnna L .; Jacquart, Jolene; Smits, Jasper A.J. (2015). "Depresyon için egzersiz reçetesini optimize etmek: tepkinin biyolojik belirteçleri arayışı". Psikolojide Güncel Görüş. 4: 43–47. doi:10.1016 / j.copsyc.2015.02.003. ISSN 2352-250X. PMC 4545504. PMID 26309904.
- ^ Parker GB, Brotchie H, Graham RK (Ocak 2017). "D vitamini ve depresyon". J Disord'u Etkilemek. 208: 56–61. doi:10.1016 / j.jad.2016.08.082. PMID 27750060.
- ^ Cenik B, Cenik C, Snyder MP, Brown ES (2017). "Popülasyon temelli bir kohortta plazma sterolleri ve depresif belirti şiddeti". PLOS One. 12 (9): e0184382. Bibcode:2017PLoSO..1284382C. doi:10.1371 / journal.pone.0184382. PMC 5590924. PMID 28886149.
- ^ Siyah, Catherine N .; Bot, Mariska; Scheffer, Peter G .; Cuijpers, Pim; Penninx, Brenda W.J.H (1 Ocak 2015). "Depresyon oksidatif stresin artmasıyla ilişkili mi? Sistematik bir inceleme ve meta-analiz". Psikonöroendokrinoloji. 51: 164–175. doi:10.1016 / j.psyneuen.2014.09.025. ISSN 1873-3360. PMID 25462890.
- ^ Liu, Tao; Zhong, Shuming; Liao, Xiaoxiao; Chen, Jian; O, Tingting; Lai, Shunkai; Jia, Yanbin (1 Ocak 2015). "Depresyondaki Oksidatif Stres Belirteçlerinin Meta Analizi". PLOS One. 10 (10): e0138904. Bibcode:2015PLoSO..1038904L. doi:10.1371 / journal.pone.0138904. ISSN 1932-6203. PMC 4596519. PMID 26445247.
- ^ Raza MU, Tufan T, Wang Y, Hill C, Zhu MY (Ağustos 2016). "Başlıca Psikiyatrik Hastalıklarda DNA Hasarı". Nörotoks Res. 30 (2): 251–67. doi:10.1007 / s12640-016-9621-9. PMC 4947450. PMID 27126805.
- ^ Liu, Tao; Zhong, Shuming; Liao, Xiaoxiao; Chen, Jian; O, Tingting; Lai, Shunkai; Jia, Yanbin (7 Ekim 2015). "Depresyondaki Oksidatif Stres Belirteçlerinin Meta Analizi". PLOS One. 10 (10): e0138904. Bibcode:2015PLoSO..1038904L. doi:10.1371 / journal.pone.0138904. ISSN 1932-6203. PMC 4596519. PMID 26445247.
- ^ M, Morris G ve Berk (2015). "Nöroimmün ve nöropsikiyatrik bozukluklarda mitokondriyal disfonksiyona giden birçok yol". BMC Tıp. 13: 68. doi:10.1186 / s12916-015-0310-y. PMC 4382850. PMID 25889215.
- ^ Allen, Josh; Romay-Tallon, Raquel; Brymer, Kyle J .; Caruncho, Hector J .; Kalynchuk, Lisa E. (6 Haziran 2018). "Mitokondri ve Ruh Hali: Depresyon Tezahüründe Anahtar Oyuncu Olarak Mitokondriyal Disfonksiyon". Sinirbilimde Sınırlar. 12: 386. doi:10.3389 / fnins.2018.00386. ISSN 1662-453X. PMC 5997778. PMID 29928190.
- ^ a b c d e Menon, Vinod (Ekim 2011). "Büyük ölçekli beyin ağları ve psikopatoloji: birleştirici üçlü ağ modeli". Bilişsel Bilimlerdeki Eğilimler. 15 (10): 483–506. doi:10.1016 / j.tics.2011.08.003. PMID 21908230.
- ^ a b Seeley, W.W; et al. (Şubat 2007). "Belirginlik işleme ve yönetici kontrolü için ayrılabilir iç bağlantı ağları". Nörobilim Dergisi. 27 (9): 2349–56. doi:10.1523 / JNEUROSCI.5587-06.2007. PMC 2680293. PMID 17329432.
- ^ Habas, C; et al. (1 Temmuz 2009). "İçsel bağlantı ağlarına farklı serebellar katkılar". Nörobilim Dergisi. 29 (26): 8586–94. doi:10.1523 / JNEUROSCI.1868-09.2009. PMC 2742620. PMID 19571149.
- ^ Petrides, M (2005). "Yanal prefrontal korteks: mimari ve işlevsel organizasyon". Royal Society B'nin Felsefi İşlemleri. 360 (1456): 781–795. doi:10.1098 / rstb.2005.1631. PMC 1569489. PMID 15937012.
- ^ Woodward, N.D .; et al. (2011). "Fonksiyonel dinlenme durumu ağları şizofrenide farklı şekillerde etkilenir". Şizofreni Araştırmaları. 130 (1–3): 86–93. doi:10.1016 / j.schres.2011.03.010. PMC 3139756. PMID 21458238.
- ^ Menon, Vinod; et al. (2001). "Şizofrenide işitsel çalışma belleğinin fonksiyonel nöroanatomisi: pozitif ve negatif semptomlarla ilişkisi". NeuroImage. 13 (3): 433–446. doi:10.1006 / nimg.2000.0699. PMID 11170809.
- ^ Levin, R.L .; et al. (2007). "Depresyonda bilişsel eksiklikler ve bölgesel beyin aktivitesinin fonksiyonel özgüllüğü". Bilişsel Terapi ve Araştırma. 31 (2): 211–233. doi:10.1007 / s10608-007-9128-z.
- ^ Qin, P; Northoff, G (2011). "Orta hat bölgeleriyle ve varsayılan mod ağıyla nasıl ilişkimiz var?". NeuroImage. 57 (3): 1221–1233. doi:10.1016 / j.neuroimage.2011.05.028. PMID 21609772.
- ^ Raichle, M.E .; et al. (2001). "Varsayılan bir beyin işlevi modu". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 98 (2): 676–682. Bibcode:2001PNAS ... 98..676R. doi:10.1073 / pnas.98.2.676. PMC 14647. PMID 11209064.
- ^ Cooney, R.E .; et al. (2010). "Depresyondaki ruminasyonun sinirsel bağlantıları". Bilişsel, Duyuşsal ve Davranışsal Sinirbilim. 10 (4): 470–478. doi:10.3758 / cabn.10.4.470. PMC 4476645. PMID 21098808.
- ^ Broyd, S.J .; et al. (2009). "Ruhsal bozukluklarda varsayılan mod beyin disfonksiyonu: sistematik bir inceleme". Nörobilim ve Biyodavranışsal İncelemeler. 33 (3): 279–296. doi:10.1016 / j.neubiorev.2008.09.002. PMID 18824195.
- ^ Hamani, C; et al. (15 Şubat 2011). "Büyük depresyon bağlamında subkallosal singulat girus". Biyolojik Psikiyatri. 69 (4): 301–8. doi:10.1016 / j.biopsych.2010.09.034. PMID 21145043.
- ^ Feinstein, J.S .; et al. (Eylül 2006). "Belirli kararlar sırasında ön insula reaktivitesi nevrotiklik ile ilişkilidir". Sosyal Bilişsel ve Duyuşsal Sinirbilim. 1 (2): 136–142. doi:10.1093 / tarama / nsl016. PMC 2555442. PMID 18985124.
- ^ Paulus, M.P; Stein, M.B. (2006). "Kaygıya dar görüşlü bir bakış". Biyolojik Psikiyatri. 60 (4): 383–387. doi:10.1016 / j.biopsych.2006.03.042. PMID 16780813.
- ^ Antony, M.M. (2009). Oxford Anksiyete ve İlgili Bozukluklar El Kitabı. Oxford University Press.
daha fazla okuma
- Szafran, K; Faron-Górecka, A; Kolasa, M; Kuamider, M; Solich, J; Zurawek, D; Dziedzicka-Wasylewska, M (2013). "Nöropsikiyatrik bozukluklarda G proteinine bağlı reseptör (GPCR) heterodimerizasyonunun potansiyel rolü: depresyona odaklanma" (PDF). Pharmacol Temsilcisi. 65 (6): 1498–505. doi:10.1016 / s1734-1140 (13) 71510-x. PMID 24552997.
- Naumenko, VS; Popova, NK; Lacivita, E; Leopoldo, M; Ponimaskin, EG (Temmuz 2014). "Depresif bozukluklarda serotonin 5-HT1A ve 5-HT7 reseptörleri arasındaki etkileşim". CNS Neurosci Ther. 20 (7): 582–90. doi:10.1111 / cns.12247. PMC 6493079. PMID 24935787.
