Erken başlangıçlı Alzheimer hastalığı - Early-onset Alzheimers disease - Wikipedia
| Erken başlangıçlı Alzheimer hastalığı | |
|---|---|
| Uzmanlık | Nöroloji |
Erken başlangıçlı Alzheimer hastalığı, olarak da adlandırılır erken başlayan Alzheimer, daha genç başlangıçlı Alzheimer [1] veya erken başlangıçlı AD, dır-dir Alzheimer hastalığı 65 yaşından önce teşhis edilir. Alzheimer'ın nadir görülen bir şeklidir ve tüm Alzheimer vakalarının yalnızca% 5-10'unu oluşturur. Yaklaşık% 60'ının olumlu bir Alzheimer aile öyküsü vardır ve bunların% 13'ü otozomal dominant bir şekilde kalıtılır. Bununla birlikte, erken başlangıçlı Alzheimer vakalarının çoğu, "geç başlangıçlı" formla aynı özellikleri paylaşır ve genetik mutasyonlardan kaynaklanmaz. Nasıl başladığı hakkında çok az şey anlaşılıyor.
Ailevi olmayan erken başlangıçlı AD, 30'lu veya 40'lı yaşlarındaki kişilerde gelişebilir, ancak bu son derece nadirdir.[2] Erken başlangıçlı Alzheimer hastalarının çoğu 50'li veya 60'lı yaşların başındadır.
Alzheimer hastalığının tarihçesi
Belirgin olarak hastalığın semptomları nozolojik varlık ilk olarak tarafından tanımlandı Emil Kraepelin ve karakteristik nöropatoloji ilk olarak Alois Alzheimer Bu anlamda hastalık, Kraepelin laboratuvarında çalışan Kraepelin ve Alzheimer tarafından birlikte keşfedildi. Kraepelin'in psikiyatrik bozuklukların nöropatolojik temelini bulmaya verdiği büyük önem nedeniyle Kraepelin, hastalığın Alzheimer adını taşıyacağına karar verdi.[3]
Ailevi Alzheimer hastalığı
Ailevi Alzheimer hastalığı (FAD) veya erken başlangıçlı ailesel Alzheimer hastalığı (EOFAD), genellikle yaşamın erken dönemlerinde ortaya çıkan, 65 yaşından önce (genellikle 30 ila 60 yaş arası) olarak tanımlanan ve alzheimer hastalığının nadir bir şeklidir. otozomal dominant moda, genetik ve başlangıç yaşı gibi diğer özelliklerle tanımlanır. Ailevi AD, hastanın en az bir birinci derece akraba EOAD geçmişi ile. FAD genellikle bir veya daha fazla nesilden etkilenen birden fazla kişiyi ifade eder.[4] Ailevi olmayan AD vakaları, genetik risk faktörlerinin küçük veya belirsiz olduğu "sporadik" AD olarak adlandırılır.[kaynak belirtilmeli ]
Erken başlangıçlı ailesel AD'nin toplam Alzheimer hastalığının sadece% 1'ini oluşturduğu tahmin edilirken,[2] bozukluğun çeşitli yönlerini incelemek için faydalı bir model sunmuştur. Şu anda, erken başlangıçlı ailesel AD gen mutasyonları, AD için hayvan modeline dayalı terapötik keşif ve geliştirmenin büyük çoğunluğuna rehberlik etmektedir.[kaynak belirtilmeli ]
Klinik özellikler
Alzheimer hastalığı (AD) en yaygın nedenidir demans ve genellikle ihtiyarlık. Her zaman ölümcüldür, genellikle ilk belirtilerden sonraki 10 yıl içinde. AD'nin erken belirtileri arasında, özellikle son olayları ve insanların ve eşyaların adlarını hatırlamada olağandışı hafıza kaybı bulunur. logopenik birincil ilerleyici afazi. Hastalık ilerledikçe hasta daha ciddi sorunlar yaşar, ruh hali değişimlerine maruz kalır ve araba kullanma gibi karmaşık aktiviteleri yapamaz. Diğer yaygın bulgular arasında kafa karışıklığı, zayıf muhakeme, dil bozukluğu, ajitasyon, geri çekilme, halüsinasyonlar, nöbetler, Parkinson özellikleri, artmış kas tonusu, miyoklonus, inkontinans ve mutizm bulunur.[4] Sonraki aşamalarda, saçlarını fırçalamak gibi basit şeyleri nasıl yapacaklarını unuturlar ve ardından tam zamanlı bakıma ihtiyaç duyarlar.
Histolojik olarak ailesel AD, pratik olarak hastalığın diğer formlarından ayırt edilemez. Mevduat amiloid bölümlerinde görülebilir beyin doku. Bu amiloid proteini plaklar oluşturur ve nörofibrillerin beyinde ilerleyen. Çok nadiren, plak benzersiz olabilir veya AD'ye özgü olmayabilir; bu, genlerden birinde, genellikle mutasyonlardan kaynaklanan etkisiz gen ürünleri yerine işlevsel, ancak bozuk bir protein oluşturan bir mutasyon meydana geldiğinde meydana gelebilir.[kaynak belirtilmeli ]
Bu hastalığın altında yatan nörobiyoloji yeni yeni anlaşılmaya başlandı. Araştırmacılar, AD'nin gelişimi, ilerlemesi ve dejeneratif özellikleri ile ilişkili iltihaplanma yollarını haritalamak için çalışıyorlar. Bu yollarda yer alan ana moleküller arasında glial hücreler (özellikle astrositler ve mikroglia), beta-amiloid ve proinflamatuar bileşikler bulunur. Nöronlar beyinde yaralanıp ölürken, nöron ağları arasındaki bağlantılar bozulabilir ve birçok beyin bölgesi küçülebilir. Alzheimer'ın son aşamalarında, beyin atrofisi adı verilen bu süreç yaygındır ve beyin hacminde önemli kayıplara neden olur. Bu beyin hacmi kaybı, kişinin düzgün yaşama ve çalışma yeteneğini etkiler ve sonuçta ölümcül olur.[5]
Beta-amiloid, amiloid öncü protein (APP) adı verilen daha büyük bir proteinin küçük bir parçasıdır. APP aktive edildiğinde, diğer proteinlerin daha küçük bölümlerine kesilir. Bu kesme işleminde üretilen parçalardan biri β-amiloiddir. β-amiloid, cut-up APP'den üretilen diğer herhangi bir parçadan "daha yapışkandır", bu nedenle beyinde çeşitli genetik ve biyokimyasal anormalliklerden kaynaklanan bir birikim sürecini başlatır. Sonunda, fragmanlar oligomerleri, ardından fibrilleri, beta yapraklarını ve son olarak plakları oluşturur. Beyinde β-amiloid plakların varlığı, vücudun mikroglial hücreleri ve astrositleri işe almasına ve etkinleştirmesine neden olur.[kaynak belirtilmeli ]
Genetik
Ailesel Alzheimer hastalığına, en az üç genden birinde meydana gelen bir mutasyon neden olur. presenilin 1, presenilin 2, ve amiloid öncü protein (APP).[6][7][8] Diğer gen mutasyonları araştırılıyor.
PSEN1 - Presenilin 1
Presenilin 1 geni (PSEN1 kromozom 14'te bulunan) Sherrington (1995) tarafından tanımlanmıştır[9] ve çok sayıda mutasyon tanımlanmıştır. Bu gendeki mutasyonlar, ailesel Alzheimer tip 3'e kesin olarak ve genellikle 50 yaşın altında neden olur. Bu tür, EOFAD'ın% 30-70'ini oluşturur.[4] Bu protein, APP'den amiloid beta peptidi ayıran enzimatik kompleksin bir parçası olarak tanımlanmıştır (aşağıya bakınız).
Gen 14 içerir Eksonlar ve kodlama kısmının 60 kb olduğu tahmin edilmektedir, Rogaev (1997)[10] ve Del-Favero (1999).[11] Genin kodladığı protein (PS1), bütünleyici bir zar proteinidir. Ikeuchi'nin (2002) belirttiği gibi[12] Notch1 proteinini parçaladığı için Koizumi (2001) tarafından düşünülmüştür.[13] embriyoda somitogenezde rol almak. Aynı zamanda, FAD patogenezinde olası rolünü veren amiloid öncü protein üzerinde bir etkiye sahiptir. Bitkilerde, omurgasızlarda ve diğer omurgalılarda PS1 homologları bulunmuştur.
90'dan fazlası bilinen gendeki mutasyonlardan bazıları şunlardır: His163Arg, Ala246Glu, Leu286Val ve Cys410Tyr. Çoğu ekran tamamlandı nüfuz etme, ancak ortak bir mutasyon Glu318Gly'dir ve bu, Taddei (2002) tarafından yapılan bir çalışma ile bireyleri ailesel AD'ye yatkın hale getirir.[14] ailesel AD'li hastalarda% 8.7'lik bir insidans bulmak.
PSEN2 - Presenilin 2
Presenilin 2 geni (PSEN2 ) yapı ve işlev açısından çok benzerdir PSEN1. Kromozom 1 (1q31-q42) üzerinde bulunur ve bu gendeki mutasyonlar tip 4 FAD'ye neden olur. Bu tür, tüm EOFAD vakalarının% 5'inden azını oluşturur.[4] Gen, 1995 yılında Rudolph Tanzi ve Jerry Schellenberg tarafından tanımlandı.[15] Kovacs tarafından yapılan sonraki bir çalışma (1996)[16] PS1 ve PS2 proteinlerinin benzer miktarlarda ve aynı şekilde ifade edildiğini gösterdi organeller birbirleri gibi memeli nöronal hücreler. Levy-Lahad (1996)[17] belirledi PSEN2 10'u ekson kodlayan 12 ekson içeriyordu ve birincil transkript 448 amino asit kodluyor polipeptid % 67 homoloji ile PS1. Bu protein, APP'den amiloid beta peptidi ayıran enzimatik kompleksin bir parçası olarak tanımlanmıştır (aşağıya bakınız).
Mutasyonlar kadar çalışılmadı PSEN1, ancak farklı allelik varyantlar tanımlanmıştır. Bunlara, ilk olarak ailesel Alzheimer hastalığı olan Volga Alman ailelerinde Rudolph Tanzi ve Jerry Schellenberg tarafından tanımlanan Asn141Ile dahildir (Levy-Lahad ve diğerleri Nature, 1995). Nochlin (1998) tarafından yapılan bu çalışmalardan biri şiddetli amiloid buldu anjiyopati bir ailede etkilenen bireylerde. Bu fenotip, Tomita (1997) tarafından yapılan bir çalışma ile açıklanabilir.[18] Bu, Asn141Ile mutasyonunun, amiloid öncü protein (APP) metabolizmasını değiştirdiğini ve plaklarda protein birikiminin artmasına neden olduğunu göstermektedir.
Diğer allelik varyantlar, Rogaev (1995) tarafından bir İtalyan soy ağacında tanımlanan Met239Val'dir.[19] Ayrıca, genin PSEN1'e benzer olabileceğini ve genin ekson 12'sinde bir Asp439Ala mutasyonunu Lleo (2001)[20] PS2'nin endoproteolitik işlemesini değiştirmek için.
APP - amiloid beta (A4) öncü protein
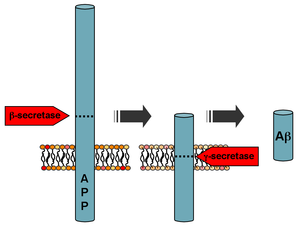
Mutasyonlar amiloid beta A4 öncü protein (APP) kromozom 21'in (21q21.3) uzun kolunda bulunan, ailesel Alzheimer hastalığına neden olur.[8]
[21] Bu tür, EOFAD'ın% 10-15'inden fazlasını oluşturmaz.[4]
Farklı iki UYGULAMA tanımlanan ve karakterize edilen mutasyonlar İsveççe mutasyon[22] ve Arktik mutasyon.[23] Bu mutasyonların fonksiyonel analizleri, hastalık patogenezinin anlaşılmasını önemli ölçüde artırmıştır. Oysa İsveççe β-sekretaz için bölünme bölgesinde bulunan mutasyon, β-salgılama bölünmesini artırarak genel olarak daha yüksek Aβ peptit üretimi ile sonuçlanır,[24] Arktik mutasyon, Ap peptidinin konformasyon değişikliğine ve toksik Ap protofibrillerinin oluşumunda artışa yol açar.[25]
Patofizyoloji
Tarafından bölünmenin ardından β-sır APP, Aβ üretmek için-sekretaz adı verilen zara bağlı bir protein kompleksi tarafından bölünür.[26] Presenilinler 1 ve 2, nikastrin, Aph1 ve PEN-2 ile birlikte bu kompleksin enzimatik merkezleridir. Ap üretimini engelleyen APP'nin alfa-sekretaz bölünmesi, APP için en yaygın işleme olayıdır. APP geninde 21 allelik mutasyon keşfedilmiştir. Bunlar, erken başlangıçlı ailesel Alzheimer hastalığının başlangıcını garanti eder ve tümü AP alanını kodlayan APP geni bölgesinde meydana gelir.
Genetik test
Semptomatik bireyler ve asemptomatik akrabalar için genetik test mevcuttur.[7] EOFAD'li ailelerin% 40-80'inde APP, PSEN1 veya PSEN2 geninde tespit edilebilir bir mutasyon olacaktır. Bu nedenle, EOFAD'li bazı ailelerde mevcut testle tanımlanabilir bir mutasyon olmayacaktır.
Erken başlangıçlı Alzheimer'ın etkisi
Erken başlangıçlı Alzheimer'ın tipik olmayan yaşam süreci zamanlaması, deneyim üzerinde farklı etkiler sunduğu anlamına gelir. Örneğin, hastalığın kariyerleri, bakıcıları ve hastaların aile üyeleri üzerinde yıkıcı etkileri olabilir.[27][28]
Çalışanlar işlerini yetkin bir şekilde yerine getirme becerilerini kaybederler ve erken emekliliğe zorlanırlar. Bu tahmin edilebildiği zaman, çalışanlar geleceklerini işverenleri ile ve karşılaşmayı bekledikleri beceri kayıplarını tartışmalıdır.[29] Erken emekli olmaya zorlananlar, hükümetin belirlediği asgari yaşta emekli olanların yararlanabileceği tüm yardımlardan yararlanamayabilir.[29] Bazı işlerde, bir hatanın çok sayıda insanda yıkıcı sonuçları olabilir ve durumunun farkında olmayan, erken başlangıçlı Alzheimer hastalığına sahip bir kişinin sıkıntıya neden olduğu vakalar bildirilmiştir.[30][ölü bağlantı ]
Alzheimer hastası genç insanlar, para yönetimi gibi kendi ihtiyaçlarını karşılama becerilerini de kaybedebilirler.[31]
Bununla birlikte, Alzheimer ve yaşlanmanın kavramsallaştırmalarının iki farklı koşul olduğu fikrine direnmesi gerektiği de vurgulanmıştır.[32] Özellikle gençlerin ihtiyaçlarına odaklanan ikili bir model, yaşlı insanların yaşadığı zorlukların hafife alınmasına yol açabilir.[33]
Ayrıca bakınız
- Hala Alice (Roman) ve film Hala Alice, ana kahramanı EOAD olan
- Unutulmaz Ruh müzisyenin veda turunu anlatan bir belgesel film John Mann ve onun grubu Batının Ruhu erken başlangıçlı Alzheimer teşhisinin ardından
- Thanmathra (film), erken başlayan Alzheimer hastalığının bir baba ve oğluyla olan ilişkisi üzerindeki etkilerini detaylandıran ödüllü bir Hint filmi.
Referanslar
- ^ "Daha genç / Erken başlangıçlı Alzheimer". Alzheimer Derneği. Alındı 9 Temmuz 2020.
- ^ a b Harvey RJ, Skelton-Robinson M, Rossor MN (Eylül 2003). "65 yaşın altındaki kişilerde demans prevalansı ve nedenleri". Nöroloji, Nöroşirürji ve Psikiyatri Dergisi. 74 (9): 1206–9. doi:10.1136 / jnnp.74.9.1206. PMC 1738690. PMID 12933919.
- ^ Weber MM (1997). "Aloys Alzheimer, Emil Kraepelin'in bir iş arkadaşı". Psikiyatrik Araştırmalar Dergisi. 31 (6): 635–43. doi:10.1016 / S0022-3956 (97) 00035-6. PMID 9447568.
- ^ a b c d e Bird, Thomas D. (1993), Adam, Margaret P .; Ardinger, Holly H .; Pagon, Roberta A .; Wallace, Stephanie E. (editörler), "Erken Başlangıçlı Ailevi Alzheimer Hastalığı - YALNIZCA TARİHSEL REFERANS İÇİN ARŞİVLENMİŞ BÖLÜM", GeneReviews®, Washington Üniversitesi, Seattle, PMID 20301414, alındı 2020-05-07
- ^ "Alzheimer Hastalığında Beyne Ne Olur?". Ulusal Yaşlanma Enstitüsü. Alındı 2020-05-07.
- ^ Bertram L, Tanzi RE (Ekim 2008). "Otuz yıllık Alzheimer hastalığı genetiği: sistematik meta-analizlerin sonuçları". Doğa Yorumları. Sinirbilim. 9 (10): 768–78. doi:10.1038 / nrn2494. PMID 18802446. S2CID 5946769.
- ^ a b Williamson J, Goldman J, Marder KS (Mart 2009). "Alzheimer hastalığının genetik yönleri". Nörolog. 15 (2): 80–6. doi:10.1097 / NRL.0b013e318187e76b. PMC 3052768. PMID 19276785.
- ^ a b Ertekin-Taner N (Ağustos 2007). "Alzheimer hastalığının genetiği: asırlık bir inceleme". Nörolojik Klinikler. 25 (3): 611–67, v. doi:10.1016 / j.ncl.2007.03.009. PMC 2735049. PMID 17659183.
- ^ Sherrington R, Rogaev EI, Liang Y, Rogaeva EA, Levesque G, Ikeda M, ve diğerleri. (Haziran 1995). "Erken başlangıçlı ailesel Alzheimer hastalığında yanlış mutasyonlar taşıyan bir genin klonlanması". Doğa. 375 (6534): 754–60. Bibcode:1995Natur.375..754S. doi:10.1038 / 375754a0. PMID 7596406. S2CID 4308372.
- ^ Rogaev EI, Sherrington R, Wu C, Levesque G, Liang Y, Rogaeva EA, ve diğerleri. (Mart 1997). "Erken başlangıçlı Alzheimer hastalığı ile ilişkili presenilin-1 geninin (PSEN1) 5 'sekansının, genomik yapısının ve alternatif birleştirmesinin analizi". Genomik. 40 (3): 415–24. doi:10.1006 / geno.1996.4523. PMID 9073509.
- ^ Del-Favero J, Goossens D, Van den Bossche D, Van Broeckhoven C (Mart 1999). "Tekrarlayan ve tek kopyalı dizilerle YAC parçalanması: kromozom 14 üzerindeki presenilin 1 geninin ayrıntılı fiziksel haritalaması". Gen. 229 (1–2): 193–201. doi:10.1016 / S0378-1119 (99) 00023-2. PMID 10095119.
- ^ Ikeuchi T, Sisodia SS (2002). "Notch1 hücre içi alanının (NICD) ve APP-CTfgammanın hücresiz üretimi: farklı intramembranöz" gama-sekretaz "aktiviteleri için kanıt. Nöromoleküler Tıp. 1 (1): 43–54. doi:10,1385 / NMM: 1: 1: 43. PMID 12025815. S2CID 21552663.
- ^ Koizumi K, Nakajima M, Yuasa S, Saga Y, Sakai T, Kuriyama T, vd. (Nisan 2001). "Somit segmentasyonu sırasında presenilin 1'in rolü". Geliştirme. 128 (8): 1391–402. PMID 11262239.
- ^ Taddei K, Fisher C, Laws SM, Martins G, Paton A, Clarnette RM, ve diğerleri. (2002). "Avustralya popülasyonunda presenilin-1 Glu318Gly mutasyonu ve ailesel Alzheimer hastalığı arasındaki ilişki". Moleküler Psikiyatri. 7 (7): 776–81. doi:10.1038 / sj.mp.4001072. PMID 12192622.
- ^ Levy-Lahad E, Wasco W, Poorkaj P, Romano DM, Oshima J, Pettingell WH, ve diğerleri. (Ağustos 1995). "Kromozom 1 ailesel Alzheimer hastalığı lokusu için aday gen". Bilim. 269 (5226): 973–7. Bibcode:1995Sci ... 269..973L. doi:10.1126 / science.7638622. PMID 7638622.
- ^ Kovacs DM, Fausett HJ, Page KJ, Kim TW, Moir RD, Merriam DE, ve diğerleri. (Şubat 1996). "Alzheimer ile ilişkili presenilinler 1 ve 2: beyinde nöronal ekspresyon ve memeli hücrelerinde hücre içi membranlara lokalizasyon". Doğa Tıbbı. 2 (2): 224–9. doi:10.1038 / nm0296-224. PMID 8574969. S2CID 25596140.
- ^ Levy-Lahad E, Poorkaj P, Wang K, Fu YH, Oshima J, Mulligan J, Schellenberg GD (Haziran 1996). "Kromozom 1 ailesel Alzheimer hastalığı geni olan STM2'nin genomik yapısı ve ifadesi". Genomik. 34 (2): 198–204. doi:10.1006 / geno.1996.0266. PMID 8661049.
- ^ Tomita T, Maruyama K, Saido TC, Kume H, Shinozaki K, Tokuhiro S, ve diğerleri. (Mart 1997). "Ailesel Alzheimer hastalığına (Volga Alman aileleri) bağlı presenilin 2 mutasyonu (N141I) 42. (veya 43.) kalıntıda biten amiloid beta proteininin salgılanmasını arttırır". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 94 (5): 2025–30. Bibcode:1997PNAS ... 94.2025T. doi:10.1073 / pnas.94.5.2025. JSTOR 41579. PMC 20036. PMID 9050898.
- ^ Rogaev EI, Sherrington R, Rogaeva EA, Levesque G, Ikeda M, Liang Y, ve diğerleri. (Ağustos 1995). "Alzheimer hastalığı tip 3 geniyle ilişkili kromozom 1 üzerindeki bir gende yanlış mutasyonlu akraba Alzheimer hastalığı". Doğa. 376 (6543): 775–8. Bibcode:1995Natur.376..775R. doi:10.1038 / 376775a0. PMID 7651536. S2CID 4259326.
- ^ Lleó A, Blesa R, Gendre J, Castellví M, Pastor P, Queralt R, Oliva R (Kasım 2001). "Erken başlangıçlı Alzheimer hastalığı olan bir hastada yeni bir presenilin 2 gen mutasyonu (D439A)". Nöroloji. 57 (10): 1926–8. doi:10.1212 / WNL.57.10.1926. PMID 11723295.
- ^ Malenka EJ, Nestler SE, Hyman RC (2009). Moleküler Nörofarmakoloji: Klinik Nörobilim Vakfı (2. baskı). New York: McGraw-Hill Medical. ISBN 9780071481274.[sayfa gerekli ]
- ^ Mullan M, Crawford F, Axelman K, Houlden H, Lilius L, Winblad B, Lannfelt L (Ağustos 1992). "Beta-amiloidin N-terminalindeki APP genindeki olası Alzheimer hastalığı için patojenik bir mutasyon". Doğa Genetiği. 1 (5): 345–7. doi:10.1038 / ng0892-345. PMID 1302033. S2CID 20046036.
- ^ Nilsberth C, Westlind-Danielsson A, Eckman CB, Condron MM, Axelman K, Forsell C, ve diğerleri. (Eylül 2001). "'Arktik' APP mutasyonu (E693G), gelişmiş Abeta protofibril oluşumuyla Alzheimer hastalığına neden olur" (PDF). Doğa Sinirbilim. 4 (9): 887–93. doi:10.1038 / nn0901-887. PMID 11528419.
- ^ Johnston JA, Cowburn RF, Norgren S, Wiehager B, Venizelos N, Winblad B, ve diğerleri. (Kasım 1994). "İsveç Alzheimer hastalığı APP670 / 671 mutasyonu olan aile üyelerinden elde edilen fibroblast hücre çizgilerinde artan beta-amiloid salımı ve amiloid öncü protein (APP) seviyeleri". FEBS Mektupları. 354 (3): 274–8. doi:10.1016/0014-5793(94)01137-0. PMID 7957938.
- ^ Johansson AS, Berglind-Dehlin F, Karlsson G, Edwards K, Gellerfors P, Lannfelt L (Haziran 2006). "Alzheimer hastalığı ile ilgili peptidlerin A beta 1-42Arctic ve A beta 1-42wt'nin fizyokimyasal karakterizasyonu". FEBS Dergisi. 273 (12): 2618–30. doi:10.1111 / j.1742-4658.2006.05263.x. PMID 16817891.
- ^ Chow VW, Mattson MP, Wong PC, Gleichmann M (Mart 2010). "APP işleme enzimlerine ve ürünlerine genel bakış". Nöromoleküler Tıp. 12 (1): 1–12. doi:10.1007 / s12017-009-8104-z. PMC 2889200. PMID 20232515.
- ^ Mayo Clinic personeli, Erken başlangıçlı Alzheimer: Belirtiler 65 yaşından önce başladığında, Mayo Kliniği
- ^ Mary Brophy Marcus, Erken Alzheimer teşhisinin ardından aile yolculuğu paylaşıyor, Bugün Amerika (2 Eylül 2008).
- ^ a b Erken Başlangıçlı Alzheimer Hastalığı ile Yaşamak Arşivlendi 2007-10-19 Wayback Makinesi, Cleveland Clinic Sağlık Sistemi
- ^ Erken Başlangıçlı Alzheimer Yükseliyor, CBS Haberleri (8 Mart 2008).
- ^ Kathleen Fackelmann, Bu kadar genç birisinde Alzheimer'ı kim düşünüyor?, Bugün Amerika (11 Haziran 2007).
- ^ Rahman, S. (2016). Genç Başlangıçlı Demans: çok uzak bir etiket mi?, Demans Derneği, 27 Temmuz 2016
- ^ Tolhurst E (2016). "Genç Başlangıçlı Demansa İlgi Artan İlgi: Dengeyi düzeltmek mi yoksa yaşçılığı güçlendirmek mi?" (PDF). Uluslararası Yaşlanma ve Daha Sonra Yaşam Dergisi. 10 (2): 9–29. doi:10.3384 / ijal.1652-8670.16302.
Dış bağlantılar
| Sınıflandırma |
|---|
- Erken Başlangıçlı Ailevi Alzheimer Hastalığı - GeneRevies'de MD Thomas D Bird tarafından (NIH.gov)
