Leigh sendromu - Leigh syndrome
| Leigh sendromu | |
|---|---|
| Diğer isimler | juvenil subakut nekrotizan ensefalomiyelopati, Leigh hastalığı, infantil subakut nekrotizan ensefalomiyelopati, subakut nekrotizan ensefalomiyelopati (SNEM)[1] |
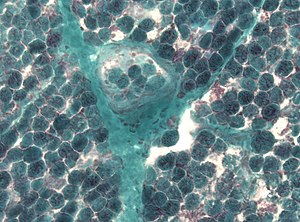 | |
| Kas biyopsisinde çok sayıda düzensiz kırmızı lifin tespiti | |
| Uzmanlık | Nöroloji |
Leigh sendromu (olarak da adlandırılır Leigh hastalığı ve subakut nekrotizan ensefalomiyelopati) kalıtsal bir nörometabolik bozukluktur. Merkezi sinir sistemi. Bir İngiliz olan Archibald Denis Leigh'in adını almıştır. nöropsikiyatrist durumu ilk kez 1951'de tanımlayan.[2] Normal seviyeleri tiamin, tiamin monofosfat, ve tiamin difosfat yaygın olarak bulunur, ancak azaltılmış veya bulunmayan bir düzeyde tiamin trifosfat. Bunun enzimdeki bir tıkanmadan kaynaklandığı düşünülmektedir. tiamin-difosfat kinaz ve bu nedenle bazı hastalarda tedavi günlük tiamin trifosfat almak olacaktır.[3][4]
Belirti ve bulgular
Leigh sendromunun semptomları klasik olarak bebeklik döneminde başlar ve birkaç yıl içinde ölüme yol açar;[1] ancak, daha fazla vaka fark edildikçe, semptomların her yaşta ortaya çıkabileceği - ergenlik veya yetişkinlik dahil - ve hastaların teşhisi takiben yıllarca hayatta kalabileceği açıktır.[5] Belirtiler genellikle enfeksiyon veya ameliyat gibi vücudun enerji üretimini zorlayan tetikleyici bir olaydan sonra görülür. Leigh sendromunun genel seyri, metabolik stres zamanlarında epizodik gelişimsel gerilemedir. Bazı hastalar, hastalık ilerlemesi olmadan uzun dönemler geçirirken, diğerleri ilerleyen düşüş geliştirir.[6]
Sendromlu bebeklerin aşağıdakileri içeren semptomları vardır: ishal, kusma, ve disfaji (yutma veya emme sorunu), gelişememe.[1] Erken Leigh hastalığı olan çocuklar da huzursuz görünebilir ve sağlıklı bebeklerden çok daha fazla ağlayabilir. Nöbetler sıklıkla görülür. AŞIRI laktat görülebilir idrar, Beyin omurilik sıvısı, ve kan Leigh sendromlu bir kişinin.[5]
Hastalık ilerledikçe, kas sistemi beyin kasların kasılmasını kontrol edemediği için vücutta zayıflar. Hipotoni (düşük kas tonusu ve güç), distoni (istemsiz, sürekli kas kasılması) ve ataksi (hareket üzerinde kontrol eksikliği) genellikle Leigh hastalığı olan kişilerde görülür. gözler özellikle etkilenir; Gözleri kontrol eden kaslar, denilen koşullarda zayıf, felçli veya kontrol edilemez hale gelir. oftalmoparezi (zayıflık veya felç) ve nistagmus (istemsiz göz hareketleri).[1] Yavaş Sakkadlar bazen de görülür.[6] kalp ve akciğerler Leigh hastalığının bir sonucu olarak da başarısız olabilir. Hipertrofik kardiyomiyopati (kalp kasının bir kısmının kalınlaşması) da bazen bulunur ve ölüme neden olabilir;[1] asimetrik septal hipertrofi Leigh sendromu ile de ilişkilendirilmiştir.[7] Leigh sendromu ile ilişkili çocuklarda ventriküler septal kusurlar piruvat dehidrogenaz eksikliğinden kaynaklanan, yüksek alın ve büyük kulaklar görülür; yüz anormallikleri Leigh sendromuna özgü değildir.[6]
Ancak, Solunum yetmezliği Leigh sendromlu kişilerde en yaygın ölüm nedenidir. Diğer nörolojik semptomlar arasında periferik nöropati ekstremitelerde oluşan hasarın neden olduğu his kaybı Periferik sinir sistemi.[1]
Hipertrikoz Leigh sendromunda nükleer gendeki mutasyonların neden olduğu görülür SURF1.[6]
Genomik

Mutasyonlar içinde mitokondriyal DNA (mtDNA) ve 30'dan fazla gen nükleer DNA (gen SURF1[8] ve bazı COX montaj faktörleri) Leigh hastalığına karışmıştır.[1]
Bozuklukları oksidatif fosforilasyon, hücrelerin ana enerji kaynağını ürettikleri süreç adenozin trifosfat (ATP), mtDNA'daki veya nükleer kodlanmış genlerdeki mutasyonlardan kaynaklanabilir. İkincisi, belirli bir kişide durumdan sorumlu spesifik mutasyonu tanımlamak her zaman mümkün olmasa da, Leigh hastalığının çoğunu oluşturur. Beşin dördü protein kompleksleri Oksidatif fosforilasyonda yer alan en yaygın olarak, ya hatalı biçimlendirilmiş protein ya da bu komplekslerin birleşimindeki bir hata nedeniyle Leigh sendromunda bozulur. Genetik temele bakılmaksızın, mutasyondan etkilenen komplekslerin oksidatif fosforilasyondaki rollerini yerine getirememesine neden olur. Leigh hastalığı durumunda, beyin sapı ve bazal gangliyonlar etkilenir. Bu, hücrelerde kronik bir enerji eksikliğine neden olur ve bu da hücre ölümüne yol açar ve buna bağlı olarak merkezi sinir sistemini etkiler ve motor fonksiyonları engeller. Kalp ve diğer kaslar da çok fazla enerjiye ihtiyaç duyar ve Leigh sendromundaki kronik enerji eksikliklerinin neden olduğu hücre ölümünden etkilenir.[1]
Mitokondriyal DNA mutasyonları
Mitokondri önemlidir organeller içinde ökaryotik hücreler. İşlevleri, potansiyel enerjiyi dönüştürmektir. glikoz, amino asitler, ve yağ asitleri içine adenozin trifosfat (ATP) adlı bir süreçte oksidatif fosforilasyon. Mitokondri kendi DNA mitokondriyal DNA (mtDNA) olarak adlandırılır. MtDNA'da depolanan bilgiler, birkaç tane üretmek için kullanılır. enzimler ATP üretimi için gereklidir.[1]
Leigh sendromu vakalarının yüzde 20 ila 25'i mitokondriyal DNA'daki mutasyonlardan kaynaklanmaktadır. Bu mutasyonlardan en yaygın olanı Leigh sendromunun yüzde 10 ila 20'sinde bulunur ve MT-ATP6 oksidatif fosforilasyon zincirinin son kompleksindeki bir proteini kodlayan bir gen, ATP sentaz doğrudan ATP üreten bir enzim. ATP sentaz olmadan, elektron taşıma zinciri herhangi bir ATP üretmeyecektir.[1] Leigh sendromunda bulunan en yaygın MT-ATP6 mutasyonu, nokta mutasyonu 8993 nükleotidinde bir timin bir guanin. Leigh sendromuyla ilişkili bu ve diğer nokta mutasyonları, protein kompleksini istikrarsızlaştırır veya bozar ve etkilenen hücrelerde enerji üretimini azaltır.[9] Oksidatif fosforilasyon zincirinin ilk kompleksinin yaratılmasında yer alan birkaç mitokondriyal gen, genler de dahil olmak üzere bir Leigh sendromu vakasına dahil edilebilir. MT-ND2, MT-ND3, MT-ND5, MT-ND6 ve MT-CO1.[7][10]
Mitokondriyal DNA, anasoylu olarak adı verilen bir modelle aktarılır. anne mirası - anne, Leigh sendromu genlerini hem erkek hem de kız çocuklara aktarabilir, ancak babalar mitokondriyal genleri aktaramaz.[1]
Nükleer DNA mutasyonları

Nükleer DNA çoğunu içerir genetik şifre bir organizmanın içinde cinsel olarak üreme organizmalar, mitokondriyal DNA'nın maternal kalıtım modelinin aksine, her iki ebeveynden de miras alınır. Nükleer DNA mutasyonlarının neden olduğu Leigh sendromu, bir otozomal resesif Desen. Bu, mutasyona uğramış genin iki kopyasının hastalığa neden olması gerektiği anlamına gelir, bu nedenle, her biri bir mutant taşıyan iki etkilenmemiş ebeveyn alel, çocuk mutant aleli her iki ebeveynden de miras alırsa etkilenmiş bir çocuğa sahip olabilir.[1]
Leigh sendromunun yüzde 75 ila 80'i nükleer DNA'daki mutasyonlardan kaynaklanır; oksidatif fosforilasyonda yer alan dördüncü kompleksin işlevini veya montajını etkileyen mutasyonlar, sitokrom c oksidaz (COX), çoğu Leigh hastalığı vakasına neden olur. Adlı bir gendeki mutasyonlar SURF1 (surfeit1) Leigh sendromunun bu alt tipinin en yaygın nedenidir. SURF1'in kodladığı protein erken sonlandırılır ve bu nedenle işlevini yerine getiremez, COX'in alt birimlerini birlikte işlevsel bir protein kompleksine götürür. Bu, mitokondri tarafından üretilen enerji miktarını azaltan COX proteini eksikliği ile sonuçlanır.[1] SURF1, uzun kolunda bulunur. kromozom 9.[11] Leigh sendromuna neden olan başka bir nükleer DNA mutasyonu, mitokondride başka bir protein kompleksini etkiler, piruvat dehidrojenaz, hangisi bir enzim içinde Bağlantı tepkisi patika.[1] Bazı SURF1 mutasyonları türleri, özellikle geç başlangıçlı ancak benzer şekilde değişken klinik seyri olan bir Leigh sendromu alt tipine neden olur.[6]
Leigh sendromuyla ilişkili diğer nükleer genler, kromozom 2 (BCS1L ve NDUFA10 ); kromozom 5 (SDHA, NDUFS4, NDUFAF2, ve NDUFA2 ); kromozom 8 (NDUFAF6 ), kromozom 10 (COX15 ); kromozom 11 (NDUFS3, NDUFS8, ve FOXRED1 ); kromozom 12 (NDUFA9 ve NDUFA12 ); ve kromozom 19 (NDUFS7 ). Bu genlerin çoğu, ilk oksidatif fosforilasyon kompleksini etkiler.[7]
X'e bağlı Leigh sendromu

Leigh sendromuna ayrıca piruvat dehidrojenaz kompleksinin (PDHC) eksikliğinden de kaynaklanabilir, en yaygın olarak X'e bağlı bir gen tarafından kodlanan bir PDHC alt birimini içerir (OMIM 308930 ). Leigh sendromunun PDHC eksikliğinden kaynaklanan nörolojik özellikleri diğer formlardan ayırt edilemez. Ancak PDHC eksikliğinde nörolojik olmayan özellikler (laktik asidoz dışında) görülmez.[kaynak belirtilmeli ]
X'e bağlı resesif Leigh sendromu erkek çocukları kız çocuklardan çok daha fazla etkiler çünkü onlarda yalnızca bir kopyası vardır. X kromozomu. Kız çocukların X'e bağlı Leigh sendromundan etkilenmesi için hatalı genin iki kopyasına ihtiyacı olacaktır.[1]
Fransız Kanadalı Leigh sendromu
Leigh sendromunun türü, çok daha yüksek oranda Saguenay-Lac-Saint-Jean Quebec bölgesi, LRPPRC 2. kromozomun küçük ('p') kolunda bulunan gen.[7][12] Her ikisi de bileşik heterozigotluk ve homozigot Fransız Kanadalı Leigh sendromunda mutasyonlar gözlemlenmiştir. Hastalığın bu alt tipi ilk olarak 1993 yılında bölgeden 34 çocukta tanımlandı ve hepsinde ciddi bir yetersizlik vardı. sitokrom c oksidaz (COX), mitokondriyaldeki dördüncü kompleks elektron taşıma zinciri. Etkilenen hücrelerde bulunan proteinin alt birimleri işlevsel olsa da, düzgün bir şekilde birleştirilmediler. Eksikliğin beyin ve karaciğer dokularında neredeyse tamamlandığı ve önemli (normal enzim aktivitesinin yaklaşık% 50'si) fibroblastlar (bağ dokusu hücreleri) ve iskelet kası. Böbrek ve kalp dokularının COX eksikliğine sahip olmadığı bulundu.[12]
Fransız Kanadalı Leigh sendromu, diğer Leigh sendromu türlerine benzer semptomlara sahiptir. Başlangıç yaşı ortalama olarak 5 aydır ve ortalama ölüm yaşı 1 yıl 7 aydır. Hastalığı olan çocuklar gelişimsel olarak gecikmiş, hafifçe var dismorfik dahil olmak üzere yüz özellikleri hipoplazi orta yüz ve geniş burun köprüsü, kronik metabolik asidoz, ve hipotoni (kas gücünde azalma). Diğer belirtiler arasında taşipne (alışılmadık derecede hızlı nefes alma hızı), zayıf emme yeteneği, hipoglisemi (düşük kan şekeri) ve titreme. Şiddetli, ani metabolik asidoz, yaygın bir ölüm nedenidir.[12]
Oranının tahminleri genetik taşıyıcılar Saguenay-Lac-Saint-Jean bölgesinde 23'te 1 ile 28'de 1 arasında değişir; Hastalıkla doğan çocukların sayısı 2063'te 1, 2473 canlı doğumda 1 olarak tahmin edilmektedir. Soy araştırmaları, sorumlu mutasyonun bölgeye erken Avrupalı yerleşimciler tarafından tanıtıldığını göstermektedir.[12]
Patofizyoloji
Leigh sendromunun karakteristik semptomları en azından kısmen bilateral, fokal lezyonlar içinde beyin sapı, Bazal ganglion, beyincik ve beynin diğer bölgeleri. Lezyonlar farklı biçimler alır. demiyelinizasyon, süngersi, gliosis, nekroz, ve kılcal damar çoğalma.[7] Demiyelinizasyon, miyelin kılıf etrafında aksonlar nöronların diğer nöronlarla iletişim kurma yeteneklerini engeller. Beyin sapı, nefes alma, yutma ve dolaşım gibi temel yaşam işlevlerinin sürdürülmesinde rol oynar; bazal gangliya ve beyincik, hareketi ve dengeyi kontrol eder. Bu alanların hasar görmesi, bu nedenle Leigh sendromunun başlıca semptomlarına - bu alanlar tarafından kontrol edilen işlevler üzerinde kontrolün kaybedilmesine - neden olur.[1]
Bazen Leigh sendromuyla ilişkilendirilen laktik asidoz, piruvat, belirli oksidatif fosforilasyon eksikliklerine sahip kişilerde işlenemeyen. Piruvat ya dönüştürülür alanin üzerinden alanin aminotransferaz veya laktik aside dönüştürülür laktat dehidrogenaz; Bu maddelerin her ikisi de vücutta birikebilir.[6]
Teşhis
Leigh sendromu klinik bulgularla önerilir ve laboratuvar ve genetik testlerle doğrulanır.[6]
Klinik bulgular
Distoni, nistagmus ve ile ilgili sorunlar otonom sinir sistemi zarar önermek Bazal ganglion ve beyin sapı Leigh sendromundan kaynaklanabilir. Diğer belirtiler de beyin hasarının göstergesidir. hipertrikoz ve nörolojik nedenli sağırlık. Laktik asidoz veya asideminin laboratuvar bulguları ve hiperalaninemi (yüksek seviyeler alanin kanda) Leigh sendromunu da önerebilir. İdrardaki organik asit seviyesinin değerlendirilmesi, aynı zamanda metabolik yol.[6]
Ayırıcı tanı
Diğer hastalıklar Leigh sendromuna benzer bir klinik görünüme sahip olabilir; Benzer klinik semptomların diğer nedenlerini hariç tutmak, genellikle Leigh sendromunu teşhis etmenin ilk adımıdır. Leigh hastalığına benzer görünebilecek durumlar şunları içerir: perinatal asfiksi, kernikterus, karbonmonoksit zehirlenmesi, metanol toksisitesi, tiamin eksikliği, Wilson hastalığı, biotine duyarlı bazal gangliya hastalığı ve bazı biçimleri ensefalit. Perinatal asfiksi, bilateral gangliyal lezyonlara ve talamus Leigh sendromunda görülen belirtilere benzer. Ne zaman hiperbilirubinemi ile tedavi edilmez fototerapi, bilirubin birikebilir Bazal ganglion ve Leigh sendromunda görülenlere benzer lezyonlara neden olur. Fototerapinin ortaya çıkışından beri bu pek yaygın değil.[6]
Tedavi
Süksinik asit Çalışılmış ve hem Leigh sendromu hem de MELAS sendromu.[13][14] Yüksek yağlı düşük karbonhidratlı diyet X kromozomu üzerindeki bir gen, bir bireyin Leigh sendromunda yer alıyorsa izlenebilir. Tiamin (B vitamini1) eğer verilebilir piruvat dehidrojenaz eksikliği biliniyor veya şüpheleniliyor. Laktik asidozun semptomları diyete aşağıdakiler eklenerek tedavi edilir: sodyum bikarbonat (kabartma tozu) veya sodyum sitrat, ancak bu maddeler Leigh sendromunun nedenini tedavi etmez. Dikloroasetat Leigh sendromu ile ilişkili laktik asidozun tedavisinde de etkili olabilir; Bu madde ile ilgili araştırmalar devam etmektedir.[5] Koenzim Q10 Bazı durumlarda takviyelerin semptomları iyileştirdiği görülmüştür.[7]
Leigh sendromu için EPI-743 ilacının klinik deneyleri devam etmektedir.[15]
2016 yılında John Zhang ve New York, ABD'deki New Hope Fertility Center'daki ekibi, iğ aktarımı mitokondriyal bağış Meksika'da Leigh hastalığı olan bir bebek üretme riski taşıyan bir anne üzerinde teknik. 6 Nisan 2016'da sağlıklı bir erkek çocuk doğdu. Ancak tekniğin tamamen güvenilir ve güvenli olup olmadığı henüz belli değil.[16]
Prognoz
Leigh sendromunun farklı genetik nedenleri ve türleri farklı prognozlara sahiptir, ancak hepsi kötüdür. Etkilenen proteinlerden birinde tam bir eksikliğin neden olduğu hastalığın en şiddetli formları, birkaç yaşında ölüme neden olur. Eksiklik tam değilse, prognoz biraz daha iyidir ve etkilenen bir çocuğun 6-7 yıl ve nadir durumlarda ergenlik yıllarına kadar hayatta kalması beklenir.[5]
Epidemiyoloji
Leigh sendromu, 40.000 canlı doğumdan en az 1'inde ortaya çıkar, ancak bazı popülasyonların çok daha yüksek oranları vardır. İçinde Saguenay-Lac-Saint-Jean merkez bölgesi Quebec Leigh sendromu 2000 yenidoğanda 1 oranında ortaya çıkar.[1]
Tarih
Leigh sendromu ilk olarak Denis Leigh 1951'de[17] ve benzerlerinden farklı Wernicke ensefalopatisi 1954'te.[7] 1968'de, hastalığın mitokondriyal aktivite ile bağlantısı ilk kez tespit edildi, ancak sitokrom c oksidazdaki mutasyonlar ve diğer elektron taşıma zinciri proteinler 1977'ye kadar keşfedilmedi.[6]
Ayrıca bakınız
Referanslar
- ^ a b c d e f g h ben j k l m n Ö p q "Leigh sendromu". Genetik Ana Referans. Ulusal Sağlık Enstitüsü. 23 Eylül 2013. Alındı 16 Ekim 2013.
- ^ Asil, Peter (2018). "Denis Archibald Leigh". Psikiyatri Bülteni. 22 (10): 648–9. doi:10.1192 / pb.22.10.648.
- ^ Murphy, Jerome V (1974). "Leigh Hastalığı: İnhibitörün Biyokimyasal Özellikleri". Nöroloji Arşivleri. 31 (4): 220–7. doi:10.1001 / archneur.1974.00490400034002.
- ^ Murphy, J. V; Craig, L (1975). "Leigh hastalığı: Beyindeki biyokimyasal değişikliklerin önemi". Nöroloji, Nöroşirürji ve Psikiyatri Dergisi. 38 (11): 1100–3. doi:10.1136 / jnnp.38.11.1100. PMC 492163. PMID 1206418.
- ^ a b c d "NINDS Leigh's Hastalığı Bilgi Sayfası". Ulusal Nörolojik Hastalıklar ve İnme Enstitüsü. NIH. 16 Aralık 2011. Arşivlenen orijinal 3 Aralık 2013 tarihinde. Alındı 25 Kasım 2013.
- ^ a b c d e f g h ben j Baertling, F; Rodenburg, R. J; Schaper, J; Smeitink, J. A; Koopman, W. J. H; Mayatepek, E; Morava, E; Distelmaier, F (2013). "Leigh sendromunun tanı ve tedavisi için bir rehber". Nöroloji, Nöroşirürji ve Psikiyatri Dergisi. 85 (3): 257–65. doi:10.1136 / jnnp-2012-304426. PMID 23772060. S2CID 45323262.
- ^ a b c d e f g "Leigh Sendromu". İnsanda Çevrimiçi Mendel Kalıtımı. McKusick-Nathans Genetik Tıp Enstitüsü. 13 Mart 2013. Alındı 25 Kasım 2013.
- ^ Pronicki, M; Matyja, E; Piekutowska-Abramczuk, D; Szymanska-Debinska, T; Karkucinska-Wieckowska, A; Karczmarewicz, E; Grajkowska, W; Kmiec, T; Popowska, E; Sykut-Cegielska, J (2008). "Leigh hastalığı ile ilişkili SURF1 gen mutasyonlarına sahip hastaların kaslarının ışık ve elektron mikroskobu özellikleri". Klinik Patoloji Dergisi. 61 (4): 460–6. doi:10.1136 / jcp.2007.051060. PMC 2571978. PMID 17908801.
- ^ "MT-ATP6". Genetik Ana Referans. NIH. 19 Kasım 2013. Alındı 25 Kasım 2013.
- ^ Poole, Olivia V .; Everett, Chris M .; Gandhi, Sonia; Marino, Silvia; Bugiardini, Enrico; Woodward, Cathy; Lam, Amanda; Quinlivan, Ros; Hanna, Michael G .; Pitceathly, Robert D.S. (Temmuz 2019). "MT-CO1'de yeni durdurma kodon mutasyonu m.6579G> A ile bağlantılı yetişkin başlangıçlı Leigh sendromu". Mitokondri. 47: 294–297. doi:10.1016 / j.mito.2019.02.004. PMID 30743023.
- ^ "SURF1". Genetik Ana Referans. NIH. 19 Kasım 2013. Alındı 25 Kasım 2013.
- ^ a b c d "Leigh Sendromu, Fransız Kanada tipi". İnsanda Çevrimiçi Mendel Kalıtımı. Johns Hopkins Üniversitesi. 1 Aralık 2011. Alındı 25 Aralık 2013.
- ^ Ehinger, Johannes K; Piel, Sarah; Ford, Rhonan; Karlsson, Michael; Sjövall, Fredrik; Frostner, Eleonor Åsander; Morota, Saori; Taylor, Robert W; Turnbull, Doug M; Cornell, Clive; Moss, Steven J; Metzsch, Carsten; Hansson, Magnus J; Fliri, Hans; Elmér, Eskil (2016). "Hücre geçirgen süksinat ön ilaçları, mitokondriyal kompleks I eksikliğini atlar". Doğa İletişimi. 7: 12317. Bibcode:2016NatCo ... 712317E. doi:10.1038 / ncomms12317. PMC 4980488. PMID 27502960.
- ^ Oguro, Hiroaki; Iijima, Kenichi; Takahashi, Kazuo; Nagai, Atsushi; Bokura, Hirokazu; Yamaguchi, Shuhei; Kobayashi, Shotai (2004). "MELAS'lı Bir Hastada Süksinat ile Başarılı Tedavi". Dahiliye. 43 (5): 427–31. doi:10.2169 / internalmedicine.43.427. PMID 15206559.
- ^ "Arşivlenmiş kopya". Arşivlenen orijinal 2013-08-19 tarihinde. Alındı 2013-07-24.CS1 Maint: başlık olarak arşivlenmiş kopya (bağlantı)
- ^ Roberts, Michelle (2016-09-27). "Yeni yöntemle doğan ilk 'üç kişilik bebek'. BBC haberleri. Alındı 2016-09-28.
- ^ Leigh, D (1951). "Bir Bebekte Subakut Nekrotizan Ensefalomiyelopati". Nöroloji, Nöroşirürji ve Psikiyatri Dergisi. 14 (3): 216–21. doi:10.1136 / jnnp.14.3.216. PMC 499520. PMID 14874135.
daha fazla okuma
- Mitokondriyal DNA ile İlişkili Leigh Sendromu ve NARP üzerine GeneReviews / NCBI / NIH / UW girişi
- Mitokondriyal DNA İlişkili Leigh Sendromu ve NARP hakkındaki OMIM girişleri
- Leigh sendromu; Subakut nekrotizan ensefalopati; Leigh hastalığı -de NIH Ofisi Nadir Hastalıklar
- uyuşukluk -de DOKUZLAR
- Maternally Kalıtımsal Leigh Sendromu -de NIH Ofisi Nadir Hastalıklar
Dış bağlantılar
| Sınıflandırma |
|---|
