Fumonisin B1 - Fumonisin B1
 | |
| İsimler | |
|---|---|
| IUPAC adı (2S,2'S)-2,2'-{[(5S,6R,7R,9R,11S,16R,18S,19S) -19-Amino-11,16,18-trihidroksi-5,9-dimetilikosan-6,7-diyil] bis [oksi (2-oksoetan-2,1-diyl)]} disüksinik asit | |
| Diğer isimler Makrofusin | |
| Tanımlayıcılar | |
3 boyutlu model (JSmol ) | |
| ECHA Bilgi Kartı | 100.150.289 |
| KEGG | |
PubChem Müşteri Kimliği | |
| UNII | |
CompTox Kontrol Paneli (EPA) | |
| |
| |
| Özellikleri | |
| C34H59NÖ15 | |
| Molar kütle | 721.838 g · mol−1 |
| Görünüm | Beyaz ila beyazımsı toz |
Aksi belirtilmedikçe, veriler kendi içlerindeki malzemeler için verilmiştir. standart durum (25 ° C'de [77 ° F], 100 kPa). | |
| Bilgi kutusu referansları | |
Fumonisin B1 bir toksin ailesinin en yaygın üyesidir. fumonisinler çeşitli türler tarafından üretilmiştir Fusarium kalıplar, gibi Fusarium verticillioides,[1] başlıca mısır (mısır), buğday ve diğer tahıllarda ortaya çıkar. Mısırda Fumonisin B1 kontaminasyonu, dünya çapında mg / kg seviyelerinde rapor edilmiştir. İnsan maruziyeti, mikrogram ila miligram / gün seviyelerinde meydana gelir ve en çok mısır ürünlerinin diyetin temel maddesi olduğu bölgelerde görülür.
Fumonisin B1 dır-dir hepatotoksik ve nefrotoksik test edilen tüm hayvan türlerinde. Fumonisin ile tedavi edilen hayvanların ya karaciğerinde ya da böbreklerinde görülen en erken histolojik değişiklik, artan apoptoz ve ardından rejeneratif hücre proliferasyonudur. Fumonisinin akut toksisitesi düşük olmakla birlikte, hızlı başlangıçlı evcil hayvanlarda ortaya çıkan iki hastalığın bilinen nedenidir: at lökoensefalomalazi ve domuz akciğer ödemi sendromu. Bu hastalıkların her ikisi de bozulmuş sfingolipid metabolizmasını ve kardiyovasküler disfonksiyonu içerir.
Tarih

1970 yılında bir salgın lökoensefalomalazi Güney Afrika'daki atlarda, mısırın mantarla kontaminasyonu ile ilişkilendirildi Fusarium verticillioides.[2] Mısırla ilişkili en yaygın tohum kaynaklı mantarlardan biridir.[3] Mantar toksinlerinin olası rolü üzerine başka bir çalışma yapıldı. etiyoloji insanın yemek borusu kanseri Güney Afrika'da bir bölgede. Bu bölgede yaşayan insanların beslenme şekli, evde yetiştirilen mısır ve F. verticillioides yemek borusu kanseri görülme sıklığı yüksek olan kişilerde mısırda en yaygın olarak tüketilen mantardır.[3] Daha fazla lökoensefalomalazi salgınları ve yüksek özofagus kanseri insidansı olan belirli bölgelerdeki insanlar hakkında daha fazla araştırmaya yol açtı. F. verticillioides. Yakında deneysel olarak şunu buldular F. verticillioides atlarda ve domuzlarda lökoensefalomalaziye neden oldu akciğer ödemi domuzlarda. Sıçanlarda oldukça hepatotoksik ve kardiyotoksik olduğu bulunmuştur. 1984'te farelerde mantarın hepatokarsinojenik olduğu gösterildi.[3] Tüm bunlara neden olan metabolitlerin kimyasal doğası 1984 yılında henüz keşfedilmemişti. Mantarın kanserojenliğinin keşfedilmesinden sonra, üretilen mikotoksinlerin ve kanserojenlerin izolasyonu ve kimyasal karakterizasyonu F. verticillioides acildi. 1988'e kadar kanserojenin kimyasal doğası çözülmedi. Fumonisin B1 ve fumonisin B2 kültürlerinden izole edildi F. verticillioides Mikotoksinler ve Deneysel Karsinojenez Programında.[4] Yapılar, Bilimsel ve Endüstriyel Araştırma Konseyi ile işbirliği içinde açıklandı.[5] Katı pirinç kültüründe birkaç fumonisin B1 izomeri tespit edilmiştir. [6] Artık 100'den fazla farklı fumonisin bilinmektedir, en önemlileri fumonisin B'dir.1, B2 ve B3.[7][8]
Toksikokinetik
Toksikokinetik ile ilgili olarak, insan verisi yoktur, ancak hayvanlar üzerinde araştırmalar yapılmıştır.
Emilim
FB1 gıda yoluyla ağızdan alınır. Genel olarak, FB1 zayıf emilir,% 6'dan azdır.[9]Ağızdan uygulanan fumonisin B'nin emilimi1 (10 mg / kg vücut ağırlığı) sıçanlara düşük (dozun% 3,5'i) ancak hızlıdır (Tmax = 1.02 saat).[10]FB1 insan cildine önemli ölçüde nüfuz etmez ve bu nedenle cilde maruz kaldıktan sonra önemli bir sistemik sağlık riski taşımaz.[11]
Dağıtım
Emilimden sonra, bazıları karaciğer ve böbreklerde tutuluyor gibi görünmektedir. Birkaç hafta boyunca fumonisin içeren diyetlerle beslenen sıçanlar için, böbreklerdeki fumonisin konsantrasyonları, karaciğerdekinden yaklaşık 10 kat daha yüksekti.[12]
Absorbe edilen dozun plazma dağılımı, iki bölmeli açık model ve doku (karaciğer, böbrek) konsantrasyon süresi sonuçları, bir tek bölmeli açık model.[10]
Boşaltım
Sıçanlarda eliminasyon yarı ömrü plazma için 3.15 saat, karaciğer için 4.07 saat ve böbrek için 7.07 saattir.[10] Ancak, FB1 Çoğunlukla orijinal haliyle hızla atılır. Küçük miktarlar idrarla atılır; çoğu dışkı ile atılır.[9]
Toksikodinamik
Benzerliklerinden dolayı fumonisinler inhibe edebilirler sfingozin -sphinganin-transferazlar ve seramid sentezler ve bu nedenle rekabetçi inhibitörleri sfingolipid biyosentez ve metabolizma.

Şekil 2, sfingolipid metabolizmasını (şematik) ve fumonisinlerin neden olduğu inhibisyonu göstermektedir. Fumonisin B1 seramid sentaz enzimini inhibe eder (sfingosin Nsfingoid bazlarını asilatlayan asiltransferaz). Bu, seramid oluşumunu iki yoldan bloke eder. De novo sfinganin ve yağlanma yoluyla de oluşumunu engeller. açil-CoA ve seramidaz tarafından seramidin parçalanmasıyla üretilen sfingosin yoluyla. inhibisyon, sfinganin, sfingozin ve bunların 1-fosfat metabolitlerinin konsantrasyonlarının artmasına ve kompleks sfingolipidlerin azalmasına neden olur. sfinganin ve sfingozin birikimi, toksisitenin birincil nedenidir. fumonisin B1 [14] Sfinganin ve sfingosin sitotoksiktir ve büyümeyi engelleyici etkilere sahiptir. Ayrıca, bu sfingoid bazlar apoptozu indükler. Artan apoptoz, tümör indüksiyonu dahil toksik etkilerde önemli bir rol oynar gibi görünmektedir.[9] Bununla birlikte, azalan seramid konsantrasyonunun ve artan sfingosin-1-fosfat konsantrasyonunun (FB'nin bir sonucu olarak) belirtilmelidir.1 alım) apoptozun inhibisyonuna neden olur ve mitoz ve rejenerasyonu teşvik eder.[14] Apoptozu inhibe eden bileşiklerin hücre içi konsantrasyonu ile apoptozu indükleyenler arasındaki denge, hücresel yanıtı belirleyecektir.[15]Ayrıca, karmaşık sfingolipidlerin azalan konsantrasyonlarının, etkilenen hücrelerin anormal davranışında ve morfolojisinde bir rol oynadığı görülmektedir.[12]
Hareket mekanizması
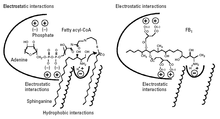
Önerilen etki mekanizması şekil 3'te gösterilmektedir. Fumonisin B1 seramid sentazında hem sfinganinin (veya sfingozin) hem de yağlı açil-CoA'nın boşluğunu ve elektrostatik etkileşimlerini kaplar. FB parçası1 sfingoid bazlarla (aminopentol kısmı) yapısal benzerliğe sahip olanlar, sfinganin bağlanma sahası ile etkileşime girebilirken, negatif yüklü trikarbilik asit grupları, yağlı açil-CoA bağlanma sahası ile etkileşime girebilir.[9]
Çünkü FB1 ayrıca yağlı açil-CoA alanını kaplar, açillenmez, çünkü açilleme için açil-CoA gereklidir; FB1 sadece seramid sentazı inhibe eder. Bununla birlikte, tricarbillic asit grupları FB'den çıkarıldığında1 hidroliz ile ortaya çıkan ürün (aminopentol, AP1) sadece bir inhibitör olarak değil, aynı zamanda seramid sentaz için bir substrat olarak da hareket eder; aminopentol, N-palmitoyl-AP1 oluşturmak için seramid sentaz tarafından asillenir.[14] Bu, FB'nin aminopentol kısmının1 enzimdeki sfinganin alanını kaplar. N-palmitoyl-AP1, seramid sentazın daha da güçlü bir inhibitörüdür ve bu nedenle nixtamalize fumonisinlerin toksisitesinde bir rol oynayabilir.[14]
Toksik etkiler
Fumonisin B1'in riskleri, Dünya Sağlık Örgütü'nün Uluslararası Kimyasal Güvenlik Programı ve Avrupa Komisyonu Gıda Bilimsel Komitesi tarafından değerlendirilmiştir. FB için tolere edilebilir bir günlük alım belirlediler1, FB2, FB3tek başına veya 2 ug / kg vücut ağırlığı kombinasyonu.[16] Şimdiye kadar, fumonisin B'nin kinetiği ve metabolizması hakkında hiçbir şey yok.1 insanlarda rapor edilmiştir. Diğer hayvanlar üzerinde çok fazla araştırma yapılmıştır, ancak insanlarla karşılaştırılamayabilir. Farelerde FB'nin ortadan kaldırılması1 çok hızlıdır, ancak insanlarda vücut ağırlıklarına göre çok daha yavaş olabilir.[7] Fumonisin B'nin toksik etkilerine neden olan birkaç olası yol vardır.1. Toksik etkilerin çoğu, seramid sentazın inhibisyonu ile değişen sfingolipid metabolizmasına bağlıdır. Reaktif oksijen türlerinin üretimi meydana gelebilir. Bu oksidatif stresi artırır ve lipid peroksidasyonunu tetikler ve hücrelere zarar verebilir. Bununla uyumlu olarak, bazı çalışmalar karaciğerde glutatyon seviyelerinin azaldığını gösterdi, ancak diğer çalışmalar yüksek glutatyon seviyelerini bile gösterdi.[7] Sitotoksik etkiler de bildirilmiştir.[7]FB'ye maruz kalmanın başka bir etkisi1 apoptozdur. Bu, birkaç farklı hücre ve dokuda gözlenmiştir. Bu etkiden seramid sentazın inhibisyonu sorumlu değildir. Ana faktörler, DNA parçalanması ve kaspaz-3 aktivasyonu olabilir.[7]FB1 ayrıca immünotoksik etkilere sahiptir, ancak bağışıklık sistemi üzerindeki etkilere dair net bir genel bakış elde etmek için çok daha fazla araştırma yapılması gerekmektedir.
İnsanlarda toksik etkiler
Nöral tüp kusurları
Nöral tüp defekti, nöral tüpün kapanmaması nedeniyle embriyodaki beyin ve omurilikte meydana gelen anormalliklerdir.[17] Epidemiyolojik çalışmalar ve klinik araştırmalar, folat eksikliğinin nöral tüp kusurları için önemli bir risk faktörü olduğunu göstermiştir.[18] FB1 sfingolipid metabolizmasını bozar ve bu nedenle bu folat alımını etkileyebilir ve nöral tüp kusurlarına neden olabilir.[7]1990 ve 1991'de Teksas-Meksika sınırında ani bir nöral tüp defekti patlak verdi. Bu salgının yüksek FB seviyelerinden kaynaklanmış olabileceğine inanılıyor1 önceki yıllarda mısırda görülmüştür.[19] Mısır tüketiminin yüksek olduğu Çin ve Güney Afrika bölgelerinde de nöral tüp kusurları görülme sıklığı yüksektir.[7][20]
Yemek borusu kanseri
Oluşumu arasında bir ilişki olduğu düşünülmektedir. F. verticillioides ve insan yemek borusu kanseri. Düşük sosyoekonomik durum ve çoğunlukla mısır ve buğdaydan oluşan daha az çeşitli beslenme, yemek borusu kanserinin ortaya çıkmasıyla ilişkilendirilir.[7] Bu, çeşitli ülkelerdeki epidemiyolojik çalışmalardan kaynaklanmaktadır. Diğer çalışmalar, daha yüksek FB konsantrasyonlarının1, FB2 ve F. verticillioides yemek borusu kanseri oranının yüksek olduğu bölgelerde mısır yetiştiriciliğinde bulunur. Bu, düşük seviyeli bölgelerin aksine F. verticillioides, FB1 ve FB2 mısırda.[21] Bunun da ötesinde, mısır alımının yüksek olduğu kişilerin, mısır alımının düşük olduğu kişilere göre yemek borusu kanserine yakalanma riskinin daha yüksek olduğu görülmektedir. Bu, İtalya, İran, Kenya, Zimbabve, Amerika Birleşik Devletleri ve Brezilya'daki yemek borusu kanseri insidansının yüksek olduğu bölgelerdeki insanlar tarafından gözlemlenmektedir.[22]Sfingolipid seviyeleri ile kanser insidansı arasındaki ilişki üzerine yapılan bir başka çalışma, serum sfingolipidleri ile özofagus kanseri riski arasında anlamlı bir ilişki göstermedi. Bu oldukça dikkat çekicidir, çünkü yüksek sfingolipid seviyelerinin sfinganin ve sfingozinin FB'ye maruz kalma için biyolojik belirteçler olduğuna inanılmaktadır.1.[7]
Akut mikotoksikoz
Akut mikotoksikoz, mantarlarla kontamine olmuş gıda ürünleri tarafından gıda zehirlenmesidir. 1995 yılında Hindistan'ın 27 köyünde ishal ve karın ağrısı ile karakterize bir hastalık salgını meydana geldi. Bu, yağmurdan kaynaklanan küflü sorgum ve mısır tüketiminin sonucuydu. Bu salgın üzerinde çalışıldı ve mikotoksikoz mayasız ekmek tüketimiyle bağlantılıydı. Hanelerden mısır ve sorgum örnekleri toplanmış ve incelenmiştir. Mısır ve sorgum, Fusarium ve Aspergillus tarafından kontamine olmuş ve yüksek seviyede FB içermektedir.1 etkilenmemiş hanelerin örnekleriyle karşılaştırıldığında.[7]
Hayvanlarda toksik etkiler
FB'nin toksik etkileri üzerine çok fazla araştırma yapıldı1 hayvanlarda. In vivo çalışmalar, karaciğer ve böbreklerin ana hedef organlar olduğunu göstermektedir.[7] Fumonisinler zayıf bir şekilde emilir, hızla elimine edilir ve hayvanlarda metabolize edilmez.[23] Domuzlarda ve sıçanlarda geniş bir FB dağılımı vardır.1 ve küçük miktarların sadece karaciğer ve böbreklerde biriktiği bulunmuştur. İçinde vervet maymunları, biraz FB1 bağırsakta kısmen hidrolize olur.[7]
Kanserojen etkiler
FB'ye maruz kalan sıçanlarda ve farelerde1 tümör oluşumu meydana geldi. Bu konuda çeşitli çalışmalar yapılmıştır. Kullanılan farelerin türüne bağlı olarak farklı karsinomlar gösterildi.[7] FB1 toksik olmadığı gösterilmiştir. Bu nedenle, kanser gelişiminden sorumlu mekanizmalar başka yerde yatmalıdır. Fumonisin B'ye bağlı kanser gelişimi için önemli mekanizmalar1 oksidatif hasar (reaktif oksijen türlerinin üretimi) ve lipid peroksidasyonu olabilir. Karaciğer ve böbrek tümörleri ayrıca FB tarafından apoptoza bağlı olabilir.1. Buna bir yanıt olarak, kansere neden olan hücrelerin sürekli yenilenmesi olabilir. Görünüşe göre bozulmuş sfingolipid metabolizması FB için nedensel faktördür.1toksik etkilerde olduğu gibi uyarılmış kanserojenlik.[7] Tüm bu hayvan çalışmalarına dayanarak FB1 Uluslararası Kanser Araştırma Ajansı (IARC) tarafından muhtemelen insanlar için kanserojen olarak sınıflandırılmıştır (Grup 2B).[24]
Domuz akciğer ödemi
FB'ye bağlı domuz akciğer ödemi1 1981'de domuz ile kontamine olmuş mısıra maruz kaldıktan sonra akciğer ödemi olan ilk rapordan sonra yoğun bir şekilde çalışılmıştır. F. verticillioides. Özellikle akciğer, kalp, nazik ve karaciğer dokusunda sfingolipid biyosentezinde değişiklik bildirilmiştir. FB konsantrasyonları ile beslenmeye maruz kaldıktan sonra 4-7 gün içinde ölümcül pulmoner ödem gelişmiştir.1 > 16 mg / kg vücut ağırlığı (> milyonda 92 kısım). Milyonda 10 parçalık dozlar daha hafif bir akciğer ödemine neden oldu.[7]
At lökoensefalomalazi
Lökoensefalomalazi, atların nörotoksik bir hastalığıdır. 20. yüzyılda bu hastalığın salgınları bir dizi çalışma ile sonuçlandı. Görünüşe göre FB1 bu hastalığın sebebiydi. Karaciğer hasarına işaret eden yüksek serum enzim seviyeleri gösterilmiştir. Normalde sfinganin / sfingozin oranının yükselmesiyle gözlenmişlerdir. FB1 sfinganin / sfingozin oranının yükselmesi nedeniyle muhtemelen kardiyovasküler fonksiyonu indükler. Bu, lökoensefalomalaziye neden olan ana faktörlerden biri olabilir.[25]
Laboratuvar hayvanlarında toksisite
FB ile sıçan beslemenin etkileri1 90 güne kadar genellikle nefrotoksisite vardı. Farklı sıçan türleri arasında, FB'ye duyarlılık1 çeşitli. Böbreklerde ana etki apoptozdur. Ayrıca tübüler atrofi ve rejenerasyonun yanı sıra böbrek ağırlığında azalma da rapor edilmiştir.[7] Sıçan karaciğeri üzerindeki histopatolojik etkiler, hem kısa hem de uzun süreli maruziyetten sonra bildirilmiştir. Ana neden apoptozdu. Fareler, farelere kıyasla nefrotoksik etkilere karşı çok hassas görünmüyor. Fare böbreklerinde yüksek doz maruziyetinde küçük histolojik değişiklikler görülmüştür. Karaciğer ayrıca farelerde ana hedef organdı. Patoloji, apoptoz ve hepatoselüler hiperplazi ile sıçanlarda olduğu gibi benzerdir.[7]Fumonisin B1 doz maternal olarak toksik ise muhtemelen embriyotoksiktir. Genotoksisite ile ilgili bir dizi çalışma, mutajenetik etki göstermedi. Fumonisin, reaktif oksijen türleri üreterek DNA'ya doğrudan zarar verebilir.[7]Fare embriyoları FB'ye maruz bırakıldı1 ve engellenmiş sfingolipid sentezi ve büyümesi gösterdiler. Nöral tüp kusurlarına neden oldu. Folik asit alımı önemli ölçüde engellendi. Folik aside maruz kaldıktan sonra tedavi, nöral tüp kusurlarını% 50-65 oranında azaltmıştır.[7]
Tolere edilebilir günlük alım
Fumonisin B1'in riskleri, Dünya Sağlık Örgütü'nün Uluslararası Kimyasal Güvenlik Programı ve Avrupa Komisyonu Gıda Bilimsel Komitesi tarafından değerlendirilmiştir. FB1, FB2, FB3 için tek başına veya 2 µg / kg vücut ağırlığı kombinasyonu halinde tolere edilebilir bir günlük alım miktarı belirlediler.[16]
Detoksifikasyon
FB tarafından seramid sentaz inhibisyonu1 bağlanmanın kovalent olmayan etkileşimler tarafından oluşturulduğu için tersinir olduğu düşünülmektedir. Muhtemelen bu tersinirliği indükleyecek faktörler hücresel FB'nin azalmasıdır.1- seramid sentaz için substratların hücresel konsantrasyonlarının konsantrasyonu ve artması.[14] Ayrıca, biriken sfinganin ve sfingozinin atılma hızı detoksifikasyonu etkileyecektir. biyotransformasyon FB'nin1 çok seyrek. Bununla birlikte, metabolizma, kısmen hidrolize ve tamamen hidrolize olduğu için bağırsakta büyük olasılıkla meydana gelir.1 dışkıda bulunmuş ancak vervet maymunlarının safrasında görülmemiştir.[9]FB'nin biyoyararlanımı1 fumonisin ile kontamine olmuş mısırın Saccharomyces cerevisiae mayasının hücre duvarından ekstrakte edilen glukomannanlar ile muamele edilmesiyle indirgenebilir. Bu polisakkaritler, belirli mikotoksinleri bağlayabilir ve fumonisinler için% 67 bağlama kapasitesine sahiptir.[26]
Referanslar
- ^ Fumonisin B1 Arşivlendi 11 Şubat 2009, at Wayback Makinesi tarafından ürün spesifikasyonu Fermentek
- ^ Marasas WF, Nelson PE, Toussoun TA (1984). Toksijenik Fusarium Türleri. Kimlik ve Mikotoksikoloji. Pennsylvania Eyalet Üniversitesi Yayınları.
- ^ a b c Marasas WF. (Mayıs 2001). "Fumonisinlerin keşfi ve oluşumu: Tarihsel bir bakış açısı". Çevre Sağlığı Perspektifi. 109 ek 2: 239–43. doi:10.1289 / ehp.01109s2239. PMC 1240671. PMID 11359691.
- ^ Gelderblom WC, Jasklewicz K, Marasas WF, Thiel PG, Horak MJ, Vleggaar R, Kriek NP. "Fumonisinler - Fusarium moniliforme tarafından üretilen kanseri teşvik edici aktiviteye sahip yeni mikotoksinler". Appl Environ Microbiol. 54: 1806–1811 (1988).
- ^ Bezuidenhout SC, Gelderblom WC, Gorst-Allman CP, Horak RM, Marasas WF, Spiteller G, Vleggaar R (1988). "Fusarium moniliforme'den fumonisinlerin, mikotoksinlerin yapıdan arındırılması". J Chem Soc Chem Commun (11): 743–745. doi:10.1039 / c39880000743.
- ^ Tibor Bartok; Laszlo Tolgyesi; Andras Szekeres; Monika Varga; Richard Bartha; Arpad Szecsi; Mihaly Bartok; Akos Mesterhazy (2010). "Ters fazlı yüksek performanslı sıvı kromatografisi / elektrosprey iyonizasyon uçuş süresi ve iyon tuzağı kütle spektrometresi ile Fusarium verticillioides ile enfekte edilmiş katı bir pirinç kültüründe fumonisin B1 (FB1) mikotoksinin yirmi sekiz izomerinin tespiti ve karakterizasyonu". Hızlı İletişim Kütle Spektrometresi. 24 (1): 35–42. doi:10.1002 / rcm.4353.
- ^ a b c d e f g h ben j k l m n Ö p q r s H Stockmann-Juvalla; K Savolainen (2008). "Fumonisin B1'in toksik etkilerinin ve etki mekanizmalarının gözden geçirilmesi". İnsan ve Deneysel Toksikoloji. 27 (11): 799–809. doi:10.1177/0960327108099525. PMID 19244287.
- ^ Tibor Bartok; Arpad Szecsi; Andras Szekeres; Akos Mesterhazy; Mihaly Bartok (2006). "Ters fazlı yüksek performanslı sıvı kromatografisi / elektrosprey iyonizasyon iyon kapanı kütle spektrometresi ile yeni fumonisin mikotoksinlerinin ve fumonisin benzeri bileşiklerin tespiti". Hızlı İletişim Kütle Spektrometresi. 20 (16): 2447–62. doi:10.1002 / rcm.2607.
- ^ a b c d e Avrupa komisyonu (2000). "Fumonisin B1". Fusarium Toksinleri Üzerine Gıda Bilimsel Komitesinin Görüşü (27).
- ^ a b c MR Martinez-Larranaga (Aralık 1999). "Fumonisin B'nin toksikokinetiği ve oral biyoyararlanımı1". Veterinerlik ve İnsan Toksikolojisi. 41 (6): 357–62. PMID 10592940.
- ^ Boonen, Jente; Malysheva, Svetlana V .; Taevernier, Lien; Diana Di Mavungu, José; De Saeger, Sarah; De Spiegeleer, Bart (2012). "Seçilen model mikotoksinlerin insan derisine nüfuz etmesi". Toksikoloji. 301 (1–3): 21–32. doi:10.1016 / j.tox.2012.06.012. PMID 22749975.
- ^ a b Riley, R.T .; Voss, K.A. (2006). "Sıçan böbreğinin ve karaciğerinin fumonisin toksisitesine karşı farklı duyarlılığı: toksin birikimi ve sfingoid baz metabolizmasında organa özgü farklılıklar". Toxicol. Sci. 92 (1): 335–345. doi:10.1093 / toxsci / kfj198. PMID 16613836.
- ^ Voss ve diğerleri, 2007[tam alıntı gerekli ]
- ^ a b c d e Merrill Jr .; AH.; Sullards, M.C .; Wang, E .; Voss, K.A .; Riley, R.T. (2001). "Sfingolipid metabolizması: sinyal iletimindeki roller ve fumonisinlerin neden olduğu bozulma". Çevre Sağlığı Perspektifleri. 109: 283–289. doi:10.2307/3435020. JSTOR 3435020. PMC 1240677. PMID 11359697.
- ^ Riley RT, Enongen E, Voss KA, Norred WP, Meredith FI, Sharma RP, Williams D, Merrill AH (2001). "Fumonisin karsinojenez mekanizmaları olarak sfingolipid düzensizlikleri". Çevre Sağlığı Perspektifleri. 109: 301–308. doi:10.2307/3435022. JSTOR 3435022. PMC 1240679. PMID 11359699.
- ^ a b SCF. "Fumonisin B ile ilgili Gıda Bilimsel Komitesinin güncellenmiş görüşü1, B2 ve B3" (PDF). Alındı 1 Nisan 2011. Alıntı dergisi gerektirir
| günlük =(Yardım) - ^ "Nöral Tüp Kusurları (NTD)". Arşivlenen orijinal 2011-03-04 tarihinde. Alındı 1 Nisan 2011.
- ^ Blom HJ, Shaw GM, den Heijer M, Finnel RH (2006). "Nöral tüp kusurları ve folat: kapalı olmaktan uzak vaka". Nat Rev Neurosci. 7 (9): 724–731. doi:10.1038 / nrn1986. PMC 2970514. PMID 16924261.
- ^ "Sinir Tüpü Kusurları ve Teksas-Meksika Sınırı". Alındı 1 Nisan 2011.
- ^ Cornell J, Nelson MM, Beighton P (1975–1980). "Cape Town bölgesindeki sinir tüpü kusurları". Güney Afrika Tıp Dergisi. 64 (3): 83–84. PMID 6346521.
- ^ Wild CP, Gong YY (29 Ekim 2009). "Mikotoksinler ve insan hastalığı: büyük ölçüde göz ardı edilen bir küresel sağlık sorunu". Karsinojenez. 31 (1): 71–82. doi:10.1093 / carcin / bgp264. PMC 2802673. PMID 19875698.
- ^ Kimyasal güvenlik üzerine uluslararası program (2001). "WHO. Gıdadaki belirli mikotoksinlerin güvenlik değerlendirmesi (WHO gıda katkı maddeleri serisi 47)". Cenevre: Dünya Sağlık Örgütü: 103–279. Alıntı dergisi gerektirir
| günlük =(Yardım) - ^ Kimyasal güvenlik üzerine uluslararası program (2000). "WHO. Fumonisin B1 (Çevre sağlığı kriterleri 219) "Cenevre: Dünya Sağlık Örgütü. Alıntı dergisi gerektirir
| günlük =(Yardım) - ^ Uluslararası Kanser Araştırma Ajansı (IARC) (2002). "Özetler ve Değerlendirmeler, Fumonisin B1" (82): 301. Alıntı dergisi gerektirir
| günlük =(Yardım) - ^ Goel S; Schumacher J; Lenz SD; Kemppainen BW (1996). "Fusarium moniliforme izolatlarının atlarda doku ve serum sfingolipid konsantrasyonları üzerindeki etkileri". Vet Hum Toxicol. 38 (4): 265–70. PMID 8829343.
- ^ Yiannikouris A .; Jouany J. (2002). "Yemlerdeki mikotoksinler ve hayvanlardaki kaderi: bir inceleme". Hayvan Araştırması. 51 (2): 81–99. doi:10.1051 / animres: 2002012.
