Şarbon toksini - Anthrax toxin
| Şarbon toksini öldürücü faktör orta alan | |||||||||
|---|---|---|---|---|---|---|---|---|---|
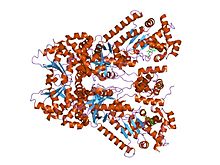 Şarbon öldürücü faktörün X-ışını kristal yapısı küçük bir molekül inhibitörüne bağlanmış, bi-mfm3, 3- {5- [5- (4-kloro-fenil) -furan-2-ilmetilen] -4-okso-2- tiyokso-tiyazolidin-3-il} -propiyonik asit. | |||||||||
| Tanımlayıcılar | |||||||||
| Sembol | Şarbon-tox_M | ||||||||
| Pfam | PF09156 | ||||||||
| InterPro | IPR015239 | ||||||||
| SCOP2 | 1j7n / Dürbün / SUPFAM | ||||||||
| OPM üst ailesi | 35 | ||||||||
| |||||||||
| Şarbon toksini öldürücü faktör N ve C terminal alanları | |||||||||
|---|---|---|---|---|---|---|---|---|---|
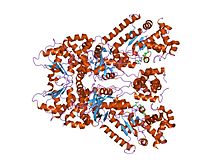 tioasetil-tyr-pro-met-amid ile kompleks oluşturulmuş şarbon ölümcül faktörün kristal yapısı, bir metal şelatlayıcı peptidil küçük molekül inhibitörü | |||||||||
| Tanımlayıcılar | |||||||||
| Sembol | ATLF | ||||||||
| Pfam | PF07737 | ||||||||
| InterPro | IPR014781 | ||||||||
| MEROPS | M34 | ||||||||
| SCOP2 | 1pwq / Dürbün / SUPFAM | ||||||||
| |||||||||
| Şarbon toksini LF alt birimi | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Tanımlayıcılar | |||||||||
| Sembol | Anthrax_toxA | ||||||||
| Pfam | PF03497 | ||||||||
| SCOP2 | 1jky / Dürbün / SUPFAM | ||||||||
| |||||||||

Şarbon toksini üçprotein ekzotoksin tarafından salgılanan öldürücü suşları bakteri, Bacillus anthracis - nedensel ajan şarbon. Toksin ilk olarak 1954'te Harry Smith tarafından keşfedildi.[1] Şarbon toksini, koruyucu olarak bilinen hücre bağlayıcı bir proteinden oluşur. antijen (PA) ve iki enzim bileşeni, ödem faktörü (EF) ve ölümcül faktör (LF). Bu üç protein bileşeni, fizyolojik etkilerini vermek için birlikte hareket eder. Toksin bileşenlerini içeren birleştirilmiş kompleksler endositozlu. İçinde endozom toksinin enzimatik bileşenleri yerini değiştirmek içine sitoplazma bir hedef hücrenin. Sitozole girdikten sonra, toksinin enzimatik bileşenleri çeşitli bağışıklık hücresi fonksiyonlarını, yani hücresel sinyallemeyi ve hücre göçünü bozar. Toksin, gözlendiği gibi hücre parçalanmasına bile neden olabilir. makrofaj hücreler. Şarbon toksini, bakterilerin bağışıklık sistemi çoğalır ve nihayetinde ev sahibi hayvanı öldürür.[2] Şarbon toksini üzerine yapılan araştırmalar, aynı zamanda makromoleküler düzenekler, ve üzerinde protein translokasyonu gözenek oluşumu endositoz, ve diğeri biyokimyasal süreçler.
Bacillus anthracis virülans faktörleri
Şarbon neden olduğu bir hastalıktır Bacillus anthracis, spor oluşturan, Gram pozitif, çubuk şeklindeki bakteri (Şekil 1). Hastalığın ölümcüllüğü, bakterinin iki temel virülans faktöründen kaynaklanır: (i) poliglutamik asit kapsül, anti-fagositik ve (ii) şarbon toksini adı verilen üçlü protein toksini. Şarbon toksini üçünün bir karışımıdır protein bileşenler: (i) koruyucu antijen (PA), (ii) ödem faktör (EF) ve (iii) ölümcül faktör (LF).
Şarbon toksini bir A / B toksin
Her bir şarbon toksin proteini toksik değildir. Bu proteinler laboratuar hayvanlarına ayrı ayrı enjekte edildiğinde toksik semptomlar gözlenmez. PA ve EF'nin birlikte enjeksiyonu neden olur ödem PA ve LF'nin birlikte enjeksiyonu ölümcüldür. İlk kombinasyona ödem toksini, ikinci kombinasyona ise ölümcül toksin denir. Bu nedenle, fizyolojik semptomların tezahürü her iki durumda da PA gerektirir.
Hayvan modeli deneylerinde gözlemlenen PA gereksinimi, bakteriyel toksinler için ortak bir paradigmayı gösterir. Bir / B paradigma. Bir bileşen enzimatik olarak aktiftir ve B bileşen, hücre bağlanma bileşenidir. Şarbon toksini formdadır Bir2B, nerede iki enzimler, EF ve LF, Bir bileşenler ve PA, B bileşen. Böylece, PA bir Truva atı, EF ve LF'yi hücre zarı daha sonra normal hücresel fizyolojiyi bozan reaksiyonları katalize edebilecekleri sitozole dönüşür.[kaynak belirtilmeli ]
Şarbon toksin montajı ve translokasyonu

Şarbon toksin protein bileşenleri, işlev görmesi için holotoksin kompleksleri halinde birleşmelidir. LF ve EF'nin bir hedef hücre içinde işlev görmesi için, hücreye yerleşmeleri ve sitoplazmasına girmeleri gerekir. PA, bir dizi adımla yerini değiştirmek Hücreye EF ve LF (Şekil 2). Bu işlem, PA83 adı verilen 83 kDa PA formu, bir şarbon toksin reseptörü. PA83'e bağlanan, tümör adı verilen bilinen iki homolog reseptör vardır. endotel işaretçi-8 (TEM8 ) ve kılcal damar morfogenez protein 2 (CMG2 ).[3] Daha sonra 20 kDa'lık bir fragman (PA20), furin ailesinden membran endoproteazları tarafından PA83'ün amino terminalinden ayrılır. PA20 ayrıştığında, PA'nın geri kalan reseptöre bağlı kısmı, PA63 olarak adlandırılır, bir heptamerik[4] veya oktamerik[5] halka şeklinde oligomer. Halka şeklindeki bu oligomer genellikle PA'nın ön gözenekli (veya ön kanal) formu olarak adlandırılır, çünkü yolda daha sonra bir translokaz gözeneği (veya kanalı) haline gelecektir. PA20 parçasının salınması üzerine açığa çıkan ön gözenekli oligomerin yüzeyi daha sonra LF ve EF'ye bağlanabilir.[6] PA oligomerinin heptamerik ve oktamerik formları daha sonra sırasıyla üç veya dörde kadar EF ve / veya LF molekülü ile bağlanabilir.[5][7] Hücre daha sonra bu birleşik kompleksleri endositozlar ve hücredeki asidik bölmeye taşır. Düşük pH endozomda karşılaşılan PA63 ön kanalının katyon seçici bir kanala dönüşmesine neden olur. EF ve LF, kanal boyunca bir pH gradyanı ile yönlendirilerek enzim faktörlerinin sitozol.[8]
LF ve EF'nin enzim işlevi
Sitozole girdikten sonra, EF ve LF daha sonra kendi hasara neden olan süreçlerini gerçekleştirir.[9]
- EF, bir Ca görevi görür2+ ve kalmodulin bağımlı adenilat siklaz seviyesini büyük ölçüde artıran kamp hücrede. CAMP'deki bu artış suyu bozar homeostaz, hücre içi ciddi dengesizlikler Sinyal yolları ve makrofaj işlevini bozarak bakterinin bağışıklık sisteminden daha da kaçmasına izin verir.
- LF ayrıca, makrofajları öldürerek bakterinin bağışıklık sisteminden kaçmasına yardımcı olur. Bu hücrelere girdikten sonra, LF bir Zn gibi davranır2+bağımlı endoproteaz N-terminalinden koparan mitojenle aktive olan protein kinaz kinazlar (MAPKK). Bu, alt tabakalarına verimli bir şekilde bağlanmalarına izin vermeyerek bu kinazları inhibe eder, bu da değişen sinyal yollarına ve nihayetinde apoptoz.
Bu nedenle, bu üç proteinin sinerjik etkisi, proteinlerin hücreye girmesine ve hücresel işlevi bozmasına izin veren olaylar dizisi yoluyla hücresel ölüme yol açar.
Hücre dışı toksin yapı-fonksiyon ilişkisi
Şarbon toksini etkisinin mekanizması, konakçı hücrenin biyomolekülleri ile kombinasyon halinde üç toksin proteininin moleküler yapılarının sonucudur. Moleküler etkileşimler, PA, EF, LF ve hücresel reseptörlerin yapılarının ayrıntılı bir analizi yapıldığında belirgindir (ANTXR1 ve ANTXR2 ). Toksin molekülleri (Şekil 3–5), reseptör ve molekül kompleksleri için yapılan yapıların tümü, bu proteinlerin sinerjik eylemleri hakkında fikir verdi. Bağlanma bölgeleri ve konformasyonel değişiklikler üzerine yapılan analizler, Tablo 1'de kısaca özetlendiği gibi, PA, LF ve EF'nin her bir alanının işlevlerini açıklığa kavuşturarak yapısal çalışmaları artırdı.
PA'nın yapısı belirlenecek ilk yapıydı (Şekil 3).[10] Bu yapı ve hücresel reseptörünün yapısı, tanıma ve bağlanmanın özgüllüğüne çok fazla ışık tuttu.[11] PA ve reseptör CMG2'nin bu özgüllüğü (tip I bütünleşmelerine benzer), bir metal iyona bağımlı yapışma bölgesi (MIDAS), hidrofobik bir oluk ve bir-firkete projeksiyonu aracılığıyla etkileşimlerden kaynaklanmaktadır. Bunların hepsi, CMG2 (ve TEM8) üzerindeki protein yüzey alanının büyük kısmının gömülü olduğu sıkı bir etkileşime katkıda bulunur.[12]

Petosa vd. PA63 heptamerinin yapısını 4,5 Å'da (0,45 nm) çözdü.[10] Çözdükleri yapı, membrana bağlı olmayan bir ön gözeneğe sahipti; kompleks, LF ve EF'yi sitozole taşımak için plazma membranından bir-varili uzatmadan önce heptamerin konformasyonu.
Heptamerizasyon ve gözenek oluşumu, PA20 fragmanı tarafından sterik olarak engellenir, ancak monomerin tepesinden çıkarıldığında, ön gözenek hızla oluşur. Heptamer oluşumu, her bir monomerin konformasyonunda büyük bir değişikliğe neden olmaz, ancak bir araya gelerek 15400 Ų'den (154 nm2) protein yüzeyi gömülüdür. Bu gömülü yüzey, çoğunlukla 1 ve 2 numaralı alanlardan kutuplu veya yüklü yan gruplardan oluşur.[10]
PA ayrıca bir oktamerik kanal öncesi yapı oluşturur.[5] Oktamerik formun, heptamerik formdan daha termostabil olduğu gösterilmiştir ve bu nedenle oktamerik oligomer, bir şarbon enfeksiyonu sırasında konağın plazmasında kalabilir.[5]

PA63'ün oligomerizasyonu sırasında, EF ve / veya LF molekülleri hızlı ve eş zamanlı olarak PA ön kanalına bağlanır. Bu bağlanma, PA20 alanı kaldırıldıktan sonra PA63'ün 1. alanı üzerinde büyük bir hidrofobik yüzeyin ortaya çıkması nedeniyle oluşur. Alan 1, EF ve LF'nin N-terminalleri ile etkileşime giren geniş bir yüzey sağlar,[13] bu, ilk ~ 36 kalıntı için neredeyse tamamen homolog ve ilk ~ 250 kalıntı için üçüncül yapı bakımından benzerdir.[14] LF ve EF'nin bağlanma bölgesi üzerine çalışmalar, büyük bir yüzey alanının, heptamer konformasyonundayken iki bitişik PA63 molekülünün 1. bölgesi ile temas ettiğini göstermiştir.[15] Bu geniş bağlanma alanı, önceki çalışmaların bir PA63 heptamerinde neden yalnızca üç molekülü bağlayabildiğini açıklıyor. PA oktamerinin N-terminal LF ile kompleks halinde ko-kristal yapısı, bağlanma etkileşiminin aslında iki kesintili bölge olduğunu ortaya koydu.[13] C-terminal alt bölgesi olarak adlandırılan bir bölge, tahmini tuz köprüleri ve elektrostatik etkileşimlerle klasik bir "sıcak noktaya" benzer. Alfa kelepçe alt bölgesi olarak adlandırılan diğer bölge, N-terminal alfa sarmalını ve LF'nin kısa beta ipliğini spesifik olmayan bir şekilde bağlayan ve substratın N-terminalini PA önkanal lümenine doğru yönlendiren derin bir yarıktır. Bu şekilde, alfa kelepçesi, protein translokasyonuna, spesifik olmayan bir şekilde bağlanmaya yardımcı olur ve daha sonra ikincil yapıyı, substrattan açılırken açar.[16] LF / EF bağlanma bölgesi şu anda terapötiklerin füzyon proteinleri yoluyla verilmesi için kullanılmaktadır.
Ön gözenek oluşumu ve LF ve / veya EF'nin bağlanması üzerine heptamer, hızla endositozlandığı bir lipit salına göç eder. Endositoz bir dizi olayın sonucu olarak ortaya çıkar. Bu, CMG2 veya TEM8 palmitoile edildiğinde başlar, bu da reseptörün lipid sallarıyla birleşmesini engeller. Bu, reseptörün PA83 bölünmeden ve LF veya EF'nin heptamer ile birleşmeden önce endositozlanmasını inhibe eder. Reseptör ile yeniden birleşme kolesterol ve glikosfigolipid açısından zengin mikro alanlar (lipit salları ) PA63 reseptöre bağlandığında ve heptamerize olduğunda ortaya çıkar. Reseptör ve PA lipid salına döndükten sonra, E3 ubikuitin ligaz Cb1 reseptörün sitoplazmik kuyruğunu ubikitine eder, reseptöre ve endositoz için ilişkili toksin proteinlerine sinyal gönderir. Dynamin ve Eps15, bu endositozun meydana gelmesi için gereklidir, bu da şarbon toksininin hücreye yolla girdiğini gösterir. klatrin bağımlı yol.[17]
Tartışıldığı gibi, her molekül, şarbon toksininin endositozunu indüklemek için diğerleriyle etkileşime girer. Kompleks, içeri girdikten sonra asidik bir bölmeye aktarılır, burada heptamer hala membrana yayılmayan ön gözenek yapısında olup EF ve LF'nin sitozole translokasyonu için hazırlanır.[18]
Vezikülden sitozole yapı-fonksiyon ilişkisi
Gözenek oluşumu
İlk bakışta, PA'nın birincil sekansı, membranı kapsayan bir proteininki gibi görünmüyor. Bir hidrofobiklik olası membran kapsayan alanlarda ortak olan herhangi bir modelden yoksun çizim. Diğer multimerik membran proteinlerinin yapıları (örneğin difteri toksini ) PA'nın zarı nasıl genişlettiğinin cevabını verin. PA'nın hem polar hem de polar olmayan uzantılardan yapılan β-varilleri oluşturan bu multimerik membran proteinleri gibi davrandığı düşünülmektedir. amino asitler her monomerden.[10]

Β-fıçı gözeneğinin oluşumu, pH'ta bir düşüşle kolaylaştırılır. PH düştüğünde varili oluşturmak için, PA63 alanı 2 en büyük konformasyon değişikliğine uğramalıdır. Alan 2'nin yapısı incelendiğinde (Şekil 7), bu alanın bir Yunanca anahtar motif (Şekil 7'deki altın kısım). Bir Yunan anahtar motifinin genel bir şeması Şekil 8'de gösterilmektedir. Alan 2'deki Yunan anahtarına, büyük bir düzensiz döngü eklenmiştir. Gözenek oluşumunda bu ilmeğin gerekliliği, özenin kimotripsin ile mutagenezi ve proteolizi kullanılarak gösterilmektedir. Ek sistein ikamelerinin elektrofizyolojik ölçümleri, bu ilmeğin amino asitlerini, zara yerleştirilen gözeneğin lümeninin içine yerleştirir. 2. alandaki düzensiz döngü ayrıca, porinlerin membranı kapsayan kısımlarında korunan bir model olan, alternatif hidrofobik ve hidrofilik amino asitlerin bir modeline sahiptir. Tek sorun, döngünün bir-varil içindeki bir zarı kaplayacak kadar büyük olmamasıdır. Bu membran girişi yalnızca ek konformasyonel değişikliklerle gerçekleşebilir. Ana Yunan motifinin açıldığı yerde büyük bir konformasyonel değişiklik meydana gelir, zara aşağı doğru çıkıntı yapan ve kompleksin diğer 6 monomeri ile bir β-namlu oluşturan bir β-saç tokası oluşturur (Şekil 9a ve 9b). Son gözenek, bu modelin teorik değerine uyan 12 Å (1,2 nm) çapa sahiptir.[10]
Bu model, Yunan anahtar motifi alanın merkezinden sıyrılırken, birçok hidrojen bağının kopmasıyla birlikte 2. etki alanında büyük konformasyonel değişiklikler gerektirecektir. Petosa vd. bunun nasıl gerçekleştiğine dair bir model önerdi.[10] PA Yunanca anahtar motiflerinin zara yerleştirilmesi, heptamer asitlendiğinde gerçekleşir. Yapay çift tabakalarda bu, pH 7.4'ten 6.5'e düştüğünde meydana gelir, bu da yerleştirme için tetikleyicinin histidin titrasyonunu içerdiğini düşündürür. Alan 2 bir dizi histidin içerdiğinden (şekil 9a'da yıldız işareti olarak gösterilmektedir) bu aslında PA dizisine uyar. Düzensiz döngüde üç histidin kalıntısı bulunur; bunlardan biri, bir polar amino asit kümesi içinde Yunan anahtarlı bir histidin ile bulunur. Bu küme (iki histidin, üç arginin ve bir glutamat dahil), Yunan anahtar motifinin tepesine gömülüdür, bu nedenle bu histidinlerin protonasyonunun kümeyi bozacağını görmek kolaydır. Ayrıca, bir dizi hidrofobik kalıntıyla birlikte (şekil 7 ve 9a'daki yeşil bölüm üzerinde) Yunan-anahtar motifinin tabanında başka bir histidin yer almaktadır. PH 7.4'te bu segment düzenlenir, ancak kristaller pH 6.0'da büyütüldüğünde düzensiz hale gelir. Bu düzensiz geçiş sırası, PA membran yerleştirmenin ilk adımıdır.
PA, kendi reseptörlerine bağlı çözünür bir heptamer olarak endositozlanır, LF veya EF, heptamere kargo olarak eklenir. Endositozdan sonraki ilk adım, endositotik vezikülün asitleştirilmesidir. Asitlenme, toksinin ömrü boyunca iki rol oynar. İlk olarak, CMG2 veya TEM8 reseptörünün PA üzerindeki sıkı tutuşunu gevşetmeye yardımcı olarak gözenek oluşumunu kolaylaştırır (farklı reseptörler biraz farklı bir pH'ta yerleştirmeye izin verir).[12] İkincisi, pH'daki düşüş, düzensiz bir öze ve 2 numaralı PA alanındaki bir Yunan anahtar motifinin, heptamer ön gözeneğinden katlanmasına ve asidik vezikül duvarından geçerek gözenek oluşumuna yol açmasına neden olur (Şekil 7-9) .
Santelli vd. PA / CMG2 kompleksinin kristal yapısını belirledikten sonra süreç hakkında daha fazla bilgi verdi.[12] Bu kompleksin yapısı, CMG2'nin PA'nın hem 2. hem de 4. alanı tarafından bağlanmasını gösterir. Bu etkileşim, Yunan anahtarını ortaya çıkarmak için daha az özgürlüğü gösterir. Daha fazla analiz, PA'daki dokuz histidinden yedisinin alan 2 / alan 4 arayüzünde olduğunu göstermektedir. Bu histidinlerin protonlanması, alanların, Yunan anahtarının düşmesine izin verecek ve yerleştirmede yer alan β firketesinin oluşturulmasına yardımcı olacak kadar ayrılmasına neden olur. Ek olarak, PA CMG2'ye bağlandığında, yapay bir membrana yerleştirildiğinde olduğu gibi, artık 6.5 pH'da ekleme gerçekleşmez. Bunun yerine, doğal hücrelere yerleştirilmesi için 5.0 pH gerektirir. Bu farkın CMG2'de MIDAS motifinin yanındaki cebin sonucu olduğu açıklandı. Bu cep, alan 2'nin eklendiği yere gömülü bir histidin içerir. Bu histidin, daha düşük bir pH'ta protonlanır ve PA'ya daha fazla stabilite katar. Bu ilave istikrar, Yunan anahtarının daha asidik koşullar karşılanana kadar hareket etmesini engelliyor. Bu histidinlerin tümü, heptamerin endositoz oluşmadan önce erken girmesini önlemek için birlikte çalışır.
Santelli ve meslektaşları (Şekil 10) ayrıca zara yerleştirilmiş PA / CMG2 yapısının varsayımsal bir yapısını oluşturdu. Bu model, β-varilinin yaklaşık 70 Å (7 nm) uzunluğunda, 30 Å (3 nm) zara yayıldığını ve 40 Å (4 nm) boşluğun aslında hücre dışı kısmının geri kalanıyla doldurulduğunu göstermektedir. CMG2 reseptörü (~ 100 kalıntı). CMG2, gözeneğe ek destek sağlar.
Protein translokasyonu

Son zamanlarda yapılan birkaç çalışma, PA63 gözeneğinin lümeni çok küçükken EF ve LF'nin sitoplazmaya nasıl izin verdiğini göstermektedir. PA63 gözeneğindeki lümen, LF veya EF çapından çok daha küçük olan yalnızca 15 Å (1.5 nm) çapındadır. Translokasyon, asitleşirken endozomda başlayan bir dizi olay yoluyla gerçekleşir. LF ve EF pH'a duyarlıdır ve pH düştükçe yapıları stabiliteyi kaybeder. 6.0 pH'ın altında (endozomdaki pH), hem LF hem de EF düzensiz hale gelir erimiş kürecikler. Bir molekül bu konformasyonda olduğunda, N-terminali serbest bırakılır ve proton gradyanı ve pozitif transmembran potansiyeli ile gözenek içine çekilir. Gözeneğin ağız endozom tarafındaki yedi fenilalanin halkası (fenilalanin kelepçe), LF veya EF'de bulunan hidrofobik kalıntılarla etkileşime girerek LF veya EF'nin açılmasına yardımcı olur. Proton gradyanı daha sonra proteini gözenek boyunca işlemeye başlar. Bağlama mekanizması gradyan tarafından yönlendirilir, ancak bir cırcır hareketi için fenilalanin kelepçesini gerektirir. EF ve LF'nin ilk 250 kalıntısı, düzensiz değişen bazik, asidik ve hidrofobik kalıntılar dizisine sahiptir. Fenilalanin kelepçesi ile protonasyon durumu arasındaki etkileşim, proteini, N-terminali yeniden şekillenirken geri kalanını gözenek boyunca sürüklemeye yetecek kadar sitoplazmaya geçene kadar süren bir cırcırlama etkisine neden olur (Şekil 11).
Referanslar
- ^ Smith H, Keppie J (1954). "Deneysel şarbon üzerine gözlemler: Bacillus anthracis tarafından in vivo üretilen belirli bir öldürücü faktörün gösterilmesi". Doğa. 173 (4410): 869–70. doi:10.1038 / 173869a0. PMID 13165673.
- ^ Maldonado-Arocho; et al. (2009). "Şarbon Toksini". Mikrobiyal Toksinler: Güncel Araştırma ve Gelecek Trendler. Caister Academic Press. ISBN 978-1-904455-44-8.
- ^ Sternbach, G. (2003). "Şarbonun tarihi". Acil Tıp Dergisi. 24 (4): 463–467. doi:10.1016 / S0736-4679 (03) 00079-9. PMID 12745053.
- ^ Green, B. D .; Battisti, L .; Koehler, T. M .; Thorne, C. B .; Ivins, B. E. (1985). "Bacillus anthracis'te bir kapsül plazmidinin gösterilmesi". Enfeksiyon ve Bağışıklık. 49 (2): 291–297. PMC 262013. PMID 3926644.
- ^ a b c d Kintzer, A. F .; Thoren, K. L .; Sterling, H. J .; Dong, K. C .; Feld, G.K .; Tang, I. I .; Zhang, T. T .; Williams, E. R .; Berger, J. M .; Krantz, B. A. (2009). "Şarbon Toksini Oluşturan Koruyucu Antijen Bileşeni Fonksiyonel Oktamerik Kompleksler". Moleküler Biyoloji Dergisi. 392 (3): 614–629. doi:10.1016 / j.jmb.2009.07.037. PMC 2742380. PMID 19627991.
- ^ Abrami L, Reig N, van der Goot FG (2005). "Şarbon toksini: ölüme götüren uzun ve dolambaçlı yol". Trend Mikrobiyol. 13 (2): 72–78. doi:10.1016 / j.tim.2004.12.004. PMID 15680766.
- ^ Grinberg LM, Abramova FA, Yampolskaya OV, Walker DH, Smith JH (2001). "İnhalasyon şarbonunun kantitatif patolojisi: kantitatif mikroskobik bulgular". Mod Pathol. 14 (5): 482–495. doi:10.1038 / modpathol.3880337. PMID 11353060.
- ^ Friedlander AM, Bhatnagar R, Leppla SH, Johnson L, Singh Y (1993). "Makrofaj duyarlılığının karakterizasyonu ve şarbon ölümcül toksine karşı direnç". Enfekte İmmün. 61 (1): 245–252. PMC 302711. PMID 8380282.
- ^ Singh Y, Leppla SH, Bhatnagar R, Friedlander AM (1989). "Bacillus anthracis öldürücü toksinin toksine duyarlı ve dirençli hücreler tarafından içselleştirilmesi ve işlenmesi". J Biol Kimya. 264 (19): 11099–11102. PMID 2500434.
- ^ a b c d e f Petosa, C .; Collier, R. J .; Klimpel, K. R .; Leppla, S. H .; Liddington, R.C. (1997). "Şarbon toksini koruyucu antijenin kristal yapısı". Doğa. 385 (6619): 833–838. doi:10.1038 / 385833a0. PMID 9039918.
- ^ Lacy, D. B .; Wigelsworth, D. J .; Scobie, H. M .; Young, J. A .; Collier, R.J. von Willebrand faktörünün kristal yapısı İnsan kılcal morfogenez proteini 2'nin bir alanı: bir şarbon toksin reseptörü. Proc. Natl. Acad. Sci. ABD 2004, 101, 6367–6372.
- ^ a b c Santelli, E .; Bankston, L. A .; Leppla, S. H .; Liddington, R.C. Şarbon toksini ve konak hücre reseptörü arasındaki bir kompleksin kristal yapısı. Doğa. 2004, 430, 905–908.
- ^ a b Feld GK, Thoren KL, Kintzer AF, Sterling HJ, Tang II, Greenberg SG, Williams ER, Krantz BA. Koruyucu antijen oligomerleri tarafından ortaya çıkan şarbon ölümcül faktörünün yapısal temeli. Nat Struct Mol Biol. 2010, 17 (11): 1383-80.
- ^ Pannifer, A. D .; Wong, T. Y .; Schwarzenbacher, R .; Renatus, M .; Petosa, C .; Bienkowska, J .; Lacy, D. B .; Collier, R. J .; Park, S .; Leppla, S. H .; Hanna, P .; Liddington, R.C. Şarbon öldürücü faktörün kristal yapısı. Doğa. 2001, 414, 230–233.
- ^ Melnyk, R. A .; Hewitt, K. M .; Lacy, D. B .; Lin, H.C .; Gessner, C. R .; Li, S .; Woods, V. L .; Collier, R.J. Şarbon Ölümcül Faktörünün Oligomerik Koruyucu Antijene Bağlanması için Yapısal Belirlemeler. J. Biol. Chem. 2006, 281, 1630–1635.
- ^ Feld GK, Kahverengi MJ, Krantz BA. Şarbon toksini ile protein translokasyonunu hızlandırmak. Prot Sci. 2012, 21 (5): 606-24.
- ^ Abrami, L .; Liu, S .; Cosson, P .; Leppla, S. H .; van der Goot, F.G. Şarbon toksini, lipid sal aracılı klatrine bağlı bir süreç yoluyla reseptörünün endositozunu tetikler. J. Cell Biol. 2003, 160, 321–328.
- ^ Mourez, M. Şarbon toksinleri. Rev. Physiol. Biochem. Pharmacol. 2004, 152, 135–164.
Dış bağlantılar
- "Ayın Molekülü" Nisan 2012
- Mevcut tüm yapısal bilgilere genel bakış PDB için UniProt: P15917 (Ölümcül faktör) PDBe-KB.
