Hordenin - Hordenine
 | |
 | |
| İsimler | |
|---|---|
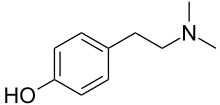
| IUPAC adı 4- (2-Dimetilaminoetil) fenol | |
| Diğer isimler N,N-Dimetiltiramin; Peyocactin; Anhalin | |
| Tanımlayıcılar | |
3 boyutlu model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA Bilgi Kartı | 100.007.920 |
| KEGG | |
PubChem Müşteri Kimliği | |
| UNII | |
CompTox Kontrol Paneli (EPA) | |
| |
| |
| Özellikleri | |
| C10H15NÖ | |
| Molar kütle | 165.236 g · mol−1 |
| Görünüm | renksiz katı |
| Erime noktası | 116 - 117 ° C (241 - 243 ° F; 389 - 390 K) |
| Kaynama noktası | 173 ° C (343 ° F; 446 K) 11 mm Hg'de; 140-150 ° C'de süblimleşir |
| yüksek: etanol; eter; kloroform | |
Aksi belirtilmedikçe, veriler kendi içlerindeki malzemeler için verilmiştir. standart durum (25 ° C'de [77 ° F], 100 kPa). | |
| Bilgi kutusu referansları | |
Hordenin (N,N-dimetiltiramin) bir alkaloit of fenetilamin Adını en yaygın olanlardan alan, çeşitli bitkilerde doğal olarak oluşan sınıf, arpa (Ordaum Türler). Kimyasal olarak hordenine, N-metil türev nın-nin N-metiltiramin, ve N,Niyi bilinen dimetil türevi biyojenik amin tiramin biyosentetik olarak türetildiği ve bazı farmakolojik özellikleri paylaştığı (aşağıya bakınız). Şu anda,[1] hordenin, merkezi sinir sistemi için bir uyarıcı olduğu ve metabolizmayı artırarak kilo vermeyi teşvik etme kabiliyetine sahip olduğu iddialarıyla, besin takviyelerinin bir bileşeni olarak yaygın olarak satılmaktadır. Yeterince yüksek dozlar verilen deney hayvanlarında, hordenin kan basıncında ve ayrıca kardiyovasküler, solunum ve sinir sistemlerinde diğer rahatsızlıklarda bir artışa neden olur. Bu etkiler genellikle ilacın test hayvanlarında ağızdan uygulanmasıyla yeniden üretilmez ve hordeninin insanlar üzerindeki etkilerine dair hemen hemen hiçbir bilimsel rapor yayınlanmamıştır.
Oluşum
Şimdi hordenin olarak bilinen bileşiğin doğal bir kaynağından izolasyonun ilk raporu tarafından yapılmıştır. Arthur Heffter 1894'te bu alkaloidi kaktüsten çıkaran Anhalonium fissuratus (şimdi olarak yeniden sınıflandırıldı Ariocarpus fissuratus ), "anhalin" olarak adlandırılır.[2] On iki yıl sonra, E. Léger, hordenine adını verdiği bir alkaloidi filizlenenlerden bağımsız olarak izole etti. arpa (Hordeum vulgare) tohumlar.[3] Ernst Späth daha sonra bu alkaloidlerin özdeş olduğunu gösterdi ve bu madde için "hordenin" adının nihayetinde korunduğu doğru moleküler yapıyı önerdi.[4]
Hordenine, oldukça geniş bir bitki yelpazesinde bulunur, özellikle kaktüsler arasında,[5] aynı zamanda bazı alg ve mantarlarda da tespit edilmiştir.[6][7][8] Otlarda bulunur ve tahıl fidelerinde önemli ölçüde yüksek konsantrasyonlarda bulunur. arpa (Hordeum vulgare ) (yaklaşık% 0,2 veya 2000 μg / g), proso darı (Panicum miliaceum ) (yaklaşık% 0,2) ve süpürge darısı (Sorgum vulgare ) (yaklaşık% 0.1).[7] Reti, 1953'te doğal olarak oluşan fenetilaminlerle ilgili incelemesinde, en zengin hordenin kaynağının kaktüs olduğunu belirtiyor. Trichocereus candicans (şimdi olarak yeniden sınıflandırıldı Echinopsis candicans ), alkaloidin% 0.5-5.0'ını içerdiği bulunmuştur.[9]
Arpadan beri, malt üretiminde yaygın olarak kullanılmaktadır bira bira ve malt, hordeninin varlığı açısından birkaç araştırmacı grubu tarafından incelenmiştir. McFarlane'nin 1965 tarihli bir çalışmasına atıfta bulunarak,[10] Poocharoen, biranın ~ 12–24 mg / L içerdiğini bildirdi. mayşe yaklaşık 11–13 mg / l ve malt yaklaşık 67 μg / g hordenin içeriyordu.[11]Çeşitli maltların ve malt fraksiyonlarının hordenin içeriği, 1983'e kadar ilgili literatürü iyi bir şekilde ele alan Poocharoen tarafından kapsamlı bir şekilde incelendi. Bu araştırmacı, ham arpada ortalama bir hordenin konsantrasyonu buldu.[12] yaklaşık 0,7 μg / g; yeşil maltlarda (yani 2 gün suda ıslatılmış ve 4 gün boyunca çimlendirilmiş arpa), ortalama konsantrasyon yaklaşık 21 μg / g ve fırınlanmış maltlarda (yani bir fırında 1–1 saat ısıtılmış yeşil maltlar) 2 gün), ortalama konsantrasyon yaklaşık 28 ug / g idi. Sadece yeşil malt kökleri incelendiğinde, ortalama hordenin içeriği yaklaşık 3363 μg / g iken, pişmiş malt köklerindeki ortalama seviye 4066 μg / g civarındaydı.[11]
Arpada hordenin seviyeleri çimlenmeden sonraki 5-11 gün içinde maksimuma ulaşır, ardından 1 ay sonra sadece iz kalana kadar yavaş yavaş azalır. Dahası, hordenin esas olarak köklerde lokalizedir.[13] "Arpa" veya arpa "maltı" içindeki hordenin konsantrasyonları için literatür değerlerini karşılaştırırken, analiz edilen bitkinin yaşı ve kısımları dikkate alınmalıdır: Smith tarafından yapılan incelemede belirtilen yaklaşık 2000 μg / g rakamı,[7] örneğin, Poocharoen'in [11] hordenine seviyeleri için rakamlar kökler maltlı arpa, ancak "tam" maltta değil, 21-28 μg / g rakamları McFarlane'nin yaklaşık 67 μg / g rakamıyla daha tutarlı.[10] Bununla birlikte, geniş bir değişkenlik yelpazesi görülmektedir; Lovett ve meslektaşlarının 43 farklı arpa hattında yaptıkları bir çalışmada köklerde 1 ila 2625 μg / g taze ağırlık arasında değişen hordenin konsantrasyonları bulundu. Bu işçiler, hordenin üretiminin önemli genetik kontrol altında olmadığı, ancak ışık süresi gibi çevresel faktörlere çok daha duyarlı olduğu sonucuna vardılar.[14]
Biyosentez
Hordenine adım adım biyosentezlenir N-metilasyon tiramin ilk dönüştürülen N-metiltiramin ve bu da hordenine metillenmiştir. Bu dizideki ilk adım enzim tarafından gerçekleştirilir. tiramin N-metiltransferaz (tiramin metilferaz), ancak aynı enzimin aslında hordenini üreten ikinci metilasyondan sorumlu olup olmadığı belirsizdir.[13][15]
Kimya
Temellik
Hordenin molekülü hem bazik (amin) hem de asidik (fenol) fonksiyonel grup içerdiğinden, amfoterik.
Görünen (tartışma için orijinal makaleye bakın) pKaProtonlanmış hordenin için s 9.78 (fenolik H) ve 10.02'dir (amonyum H).[16]
Yaygın tuzlar hordenin hidroklorürdür,[17] R-NH3+Cl−, m.p. 178 ° C ve horden sülfat,[18] (R-NH3+)2YANİ42−, m.p. 211 ° C.
"metil hordenin HCl "Bazı besin takviyelerinin etiketlerinde bir bileşen olarak listelenen" muhtemelen basit bir şekilde hordenin hidroklorürdür, çünkü bu maddenin hemen hemen tüm toptan tedarikçileri tarafından verilen "metil hordenin HCl" "açıklaması", hordenin hidroklorür (veya muhtemelen sadece hordenine).[19]Beş bölgesel izomerik kimyasal isimlendirme kurallarına göre yorumlanırsa bileşikler "metil hordenin HCl" ismine karşılık gelir: α-metil hordenin, β-metil hordenin, 2-metil hordenin, 3-metil hordenin, ve 4-O-metil hordenin - her biri kendi HCl tuzu formunda; N-metil hordenin daha çok doğal ürün olarak bilinir Candicine, ancak olasılıkların dışında tutulmuştur çünkü bir kuaterner amonyum tuzu protonlanamaz, dolayısıyla bir hidroklorür tuzu oluşturamaz.
Sentez
Hordeninin ilk sentezi Barger'den kaynaklanmaktadır: 2-feniletil alkol ilk olarak PCl kullanılarak 2-feniletil klorüre dönüştürüldü.5; bu klorür dimetilamin ile reaksiyona sokularak N, N-dimetil-feniletilamin oluşturuldu, bu daha sonra HNO kullanılarak nitratlandı3; N, N-dimetil-4-nitro-fenetilamin, Sn / HCl ile N, N-dimetil-4-amino-fenetilamine indirgenmiştir; bu amin nihayet NaNO kullanılarak diazotizasyon / hidroliz yoluyla hordenine dönüştürüldü2/ H2YANİ4/ H2Ö.[20]
Daha verimli bir sentetik yol, daha önceki sentezlere atıfta bulunan Chang ve arkadaşları tarafından tanımlandı. Bu sentez, p-metoksi-feniletil alkol, aynı anda Ö- metillenmiş ve HI ile ısıtılarak iyodüre dönüştürülmüştür; elde edilen p-hidroksi-feniletil iyodür daha sonra hordenini vermek üzere dimetilamin ile ısıtıldı.[21]
Radyo etiketli hordenin, hidrojenasyon 2- [karışımı14C] -tiramin ve% 40 formaldehit % 10 mangal kömürü üzerinde Pd katalizör varlığında. Dolayısıyla, hordenindeki C etiketli C, N'ye β- olan C'dir.[22]
Hordenine ile etiketlenmiş 14Α- ila N pozisyonundaki C de hazırlanmıştır,[23] hordenine ile olduğu gibi 14Her iki N-metil grubunda C-etiketi.[24]
Farmakoloji
Kaydedilecek ilk farmakolojik çalışma, aynı zamanda onu izole eden ilk kişi olan Heffter'e aittir. Sülfat tuzunu kullanarak (bkz. "Kimya") Heffter, 2.8 kg'lık bir kediye (yaklaşık 107 mg / kg) deri altı dozu 0.3 g verdi ve şiddetli kusmanın yanı sıra hiçbir etki gözlemlemedi; kedi 45 dakika içinde normal davrandı. Ayrıca, gözlemlenebilir herhangi bir etki yaşamadan, ağızdan 100 mg'lık bir doz aldı. Bununla birlikte, alkaloidin kurbağalarda sinir sisteminde felç oluşturduğu gözlemlendi.[2]
Camus, Léger'in ("Oluşum" bölümüne bakın) hordenin sülfat ile çalışarak köpek, tavşan, kobay ve sıçan için minimum öldürücü dozlar belirledi (bkz. "Toksikoloji"). Parenteral dozları takiben ilişkili toksisite semptomları şunlardı: uyarma, kusma, solunum güçlükleri, konvülsiyonlar ve solunum durması sonucu meydana gelen ölümle birlikte felç.[25] Daha sonraki bir makalede Camus, köpeklere veya tavşanlara intravenöz (IV) birkaç yüz mg horden sülfatın uygulanmasının kan basıncında bir artışa ve kalbin ritminde ve kasılma kuvvetinde değişikliklere neden olduğunu bildirdi. sözlü olarak aktif değildi.[26]
Hordeninin kardiyovasküler ve diğer etkileri, 1937'de yazan Reitschel tarafından ayrıntılı olarak gözden geçirildi.[27]
Frank ve arkadaşları, atlara 2 mg / kg hordenin IV uygulamasının önemli solunum sıkıntısı ürettiğini, solunum hızını% 250 artırdığını, kalp atış hızını iki katına çıkardığını ve herhangi bir değişiklik olmaksızın terlemeye neden olduğunu bildiren Frank ve arkadaşları tarafından daha modern çalışmalar yapılmıştır. bazal vücut ısısı veya davranışı. Tüm efektler 30 dakika içinde kayboldu. Ağızdan verilen aynı dozda hordenin, parenteral uygulamadan sonra görülen etkilerin hiçbirine neden olmamıştır.[28]
1995 yılında yapılan bir çalışmada Hapke ve Strathmann, köpeklerde ve sıçanlarda hordeninin kalp üzerinde pozitif bir inotropik etki yarattığını (yani kasılma kuvvetini arttırdığını), sistolik ve diyastolik kan basıncını artırdığını ve periferik kan akışının hacmini arttırdığını bildirdi. Bağırsak hareketleri engellendi. İzole doku üzerine yapılan ek deneyler, bu araştırmacıların hordeninin dolaylı olarak hareket eden bir adrenerjik depolanan salgılayarak farmakolojik etkilerini üreten ajan norepinefrin (NE).[29]
Hordeninin, aşağıdakiler için seçici bir substrat olduğu bulunmuştur. MAO-B, sıçan karaciğerinden, K ilem = 479 μM ve Vmax = 128 nM / mg protein / saat. Tarafından deamine edilmedi MAO-A sıçan bağırsak epitelinden.[30]
Kıyasla tiramin, hordenin izole edilmiş sıçanda kasılma oluşturmadı vas deferens, ancak ilacın 25 μM'lik bir konsantrasyonu, NE'nin submaksimal dozlarına tepkisini güçlendirdi ve tiramine tepkisini inhibe etti. Bununla birlikte, kronik olarak tedavi edilen sıçanlardan alınan izole edilmiş vas deferenslerin NE'ye tepkisi guanetidin hordeninden etkilenmedi. Araştırmacılar, hordeninin sıçan vas deferensinde NE geri alımının bir inhibitörü olarak hareket ettiği sonucuna varmışlardır.[30]
Hordeninin güçlü bir uyarıcı olduğu bulunmuştur. gastrin esasen eş güce sahip olan sıçanda salınım N-metiltramin: 83 nM / kg hordenin (yaklaşık 14 mg / kg serbest baza karşılık gelir), gastrin salımını kabaca% 60 arttırır.[31]
Çok sayıda bileşiğin sıçan üzerindeki etkilerine ilişkin bir çalışmada eser amin reseptörü (rTAR1) olarak ifade edilir HEK 293 1 μM konsantrasyondaki hücreler, hordenin, uyarılmada aynı β-fenetilamin konsantrasyonuyla hemen hemen aynı güce sahipti. kamp rTAR1 aracılığıyla üretim. Bu reseptör preparasyonundaki tiramin potansı, hordenininkinden biraz daha yüksekti.[32]
Toksikoloji
LD50 farelerde intraperitoneal (İP) uygulama ile: 299 mg / kg.[33] Diğer LD50 literatürde verilen değerler:> 100 mg / kg (fare; IP),[34] HCl tuzu olarak: 113,5 mg / kg (fare; uygulama yolu belirtilmemiş)[35] Minimum öldürücü doz (sülfat tuzu olarak): 300 mg / kg (köpek; IV); 2000 mg / kg (köpek; ağızdan); 250 mg / kg (tavşan; IV); 300 mg / kg (kobay; IV); 2000 mg / kg (kobay; deri altı); yaklaşık 1000 mg / kg (sıçan; deri altı).[25]
Çimlerde çiftlik hayvanlarının beslenmesinde periyodik olarak gözlemlenen lokomotor bozukluk ("sendeleyiciler") ve hızlı ölümcül kardiyak toksikoz ("ani ölüm") üretilmesinden sorumlu toksini belirlemeyi amaçlayan deneylerden Phalaris aquatica Avustralyalı araştırmacılar, koyunlarda "sendeleyici" semptomlara neden olacak en düşük hordenin dozlarının 20 mg / kg IV ve ağızdan 800 mg / kg olduğunu belirlediler. Bununla birlikte, "ani ölümün" kardiyak semptomları, hordenine ile ortaya çıkarılamaz.[36]
Hordenin, nitrozasyon maddeleriyle (örn. Nitrit iyonu, NO2−) oluşturmak için kanserojen N-nitrosodimetilamin (NDMA) ve birada bulunan önemli miktarlarda NDMA için olası bir öncü olarak araştırıldı,[11] sonunda, malttaki mevcut hordenin seviyelerinin, gözlemlenen NDMA seviyelerini açıklamak için çok düşük olduğu tespit edildi.[37]
Farmakokinetik
Hordeninin farmakokinetiği atlarda incelenmiştir. İlacın IV uygulanmasından sonra, α-fazı T1/2 yaklaşık 3 dakika ve fazı T1/2 yaklaşık 35 dakikaydı.[28]
Böcek etkileşimleri
Hordenine'nin çekirgeleri beslemek için caydırıcı olduğu görülmüştür (Melanoplus bivittatus),[38] ve tırtıllarına Heliothis virescens ve Heliothis subflexa; Beslenme süresini kontrolün% 50'sine düşüren tahmini hordenin konsantrasyonu, H. virescens ve 0.08M için H. subflexa.[39]
Bitki etkileşimleri
Hordenine, bazı bitki büyümesini engelleyici özelliklere sahiptir: Liu ve Lovett, 50 ppm'lik bir konsantrasyonda, beyaz hardal fidelerinde kök uzunluğunu azalttığını bildirdi (Sinapis alba) yaklaşık% 7; eşit miktarda karışım gramin sinerjistik bir şekilde bu inhibe edici etkiyi belirgin şekilde arttırdı.[40]
Ayrıca bakınız
- Tiramin
- N-Metiltiramin
- Candicine
- N, N-Dimetildopamin
- 4-Hidroksiamfetamin
- Pholedrine
- O-desmetilvenlafaksin
- Venlafaksin
Referanslar
- ^ Eylül 2012.
- ^ a b A. Heffter (1894). "Ueber Pellote." Arch. tecrübe. Yol. Pharmakol. 34 65-86.
- ^ E. Léger (1906). "Sur l'hordenine: alcaloide nouveau retiré des germes, dits touraillons, de l'orge." Compt. Rend. 142 108-110.
- ^ E. Späth (1919). "Über die Anhalonium-Alkaloide. I. Anhalin und Mezcalin." Monatschefte für Chemie 40 129-154.
- ^ www.erowid.org
- ^ T.A. Wheaton ve I. Stewart (1970) Lloydia 33 244-254.
- ^ a b c T.A. Smith (1977). "Bitkilerde fenetilamin ve ilgili bileşikler." Bitki kimyası 16 9-18.
- ^ J. Lundstrom (1989). "β-Fenetilaminler ve bitki kökenli efedrinler." İçinde The Alkaloids, Cilt. 35 "(A. Brossi, Ed.) S. 77-154.
- ^ L. Reti (1953). İçinde Alkaloidler, Cilt III, (R.H.F. Manske ve H.L. Holmes, Eds.), S. 313-338, New York: Academic Press.
- ^ a b W. D. McFarlane (1965) Proc. Europ. Demlemek. Dönş. 387.
- ^ a b c d B. Poocharoen (1983), Doktora Tezi, Oregon Eyalet Üniversitesi. http://ir.library.oregonstate.edu/xmlui/handle/1957/27227
- ^ Sonlandırılmamış arpadaki hordenin seviyesi ihmal edilebilir düzeydedir, ancak çimlenme ("maltlama" işleminin ilk bölümü) ilerledikçe yükselir.
- ^ a b J. D. Mann ve S.H. Mudd (1963) J. Biol. Chem. 238 381-385.
- ^ J. V. Lovett, A. H. C. Hoult ve O. Christen (1994). "Arpanın biyolojik olarak aktif ikincil metabolitleri. IV. Farklı arpa soyları ile horden üretimi." J. Chem. Ecol. 20 1945-1954.
- ^ Tirozin metabolizması - Referans yol, Kyoto Encyclopedia of Genes and Genomes (KEGG)
- ^ T. Kappe ve M.D. Armstrong (1965). "Bazı fenolik aminlerin ultraviyole soğurma spektrumları ve görünen asidik ayrışma sabitleri." J. Med. Chem. 8 368-374.
- ^ CAS No. 6027-23-2
- ^ CAS No. 622-64-0
- ^ Örneğin bakınız:http://www.alibaba.com/showroom/methyl-hordenine-hcl.html
- ^ G. Barger (1909). "Arpadan elde edilen alkaloid hordenin sentezi." J. Chem. Soc., Trans. 95 2193-2197.
- ^ C.-S. Chang vd. (1951). "Hordenin ve diğer p-dialkilaminoetilfenollerin ve bunların bazı türevlerinin yeni bir sentezi." J. Am Chem. Soc. " 73 4081-4084.
- ^ G.A. Digenis, J. W. Burkett ve V. Mihranian (1972). "Uygun bir sentez 2- [14C] -orden. " J. Etiketli Cmpds. 8 231-235.
- ^ C. A. Russo ve E. G. Gross (1981). "4- (2- (dimetilamino) etil-2- sentezi14C) fenol (hordenin-α-14C). " J. Etiketli Cmpds. ve Radiopharm. 18 1185.
- ^ C. A. Russo ve E. G. Gross (1983). "Metabolizma [metil-14C2] hordenine Hordeum vulgare bitkiler. " Bitki kimyası 22 1839-1840.
- ^ a b L. Camus (1906). "L'hordénine, oğul degré dexicité, symptômes de l'intoxication." Compt. Rend. 142 110-113.
- ^ L. Camus (1906), "Action de sulfate d'hordenine sur circulations." Compt. Rend. 142 237-239.
- ^ H. G. Reitschel (1937). "Zur Pharmakologie des Hordenins." Arch. tecrübe. Yol. Pharmakol. 186 387-408.
- ^ a b M. Frank vd. (1990). "Hordenin: atta farmakoloji, farmakokinetik ve davranışsal etkiler." Equine Vet. J. 22 437-441.
- ^ H. J. Hapke ve W. Strathmann (1995). "Hordeninin farmakolojik etkileri." Dtsch. Tierarztl. Wochenschr. 102 228-232.
- ^ a b C. J. Barwell vd. (1989). "Hordeninin monoamin oksidaz ile deaminasyonu ve sıçanın vasa deferentia üzerindeki etkisi." J. Pharm. Pharmacol. 41 421-423.
- ^ Y. Yokoo vd. (1999) Alkol ve Alkolizm 34 161-168. http://alcalc.oxfordjournals.org/content/34/2/161.full.pdf+html
- ^ JR Bunzow, MS Sonders, S. Arttamangkul, LM Harrison, G. Zhang, DI Quigley, T. Darland, KL Suchland, S. Pasumamula, JL Kennedy, SB Olson, RE Magenis, SG Amara ve DK Grandy (2001). "Amfetamin, 3,4-metilendioksimethamfetamin, liserjik asit dietilamid ve katekolamin nörotransmiterlerinin metabolitleri, bir sıçan eser amin reseptörünün agonistleridir." Mol. Pharmacol. 60 1181-1188.
- ^ M. Shinoda vd. (1977) Yakugaku Zasshi 97 1117-1124
- ^ L.M. Batista ve R.N. de Almeida (1997) Açta Çiftliği. Bonaerense 16 83-86.
- ^ Merck Index, 10th Ed. (1983), s. 687, Rahway: Merck & Co.
- ^ C.A. Bourke, M.J. Carrigan ve R.J. Dixon (1988) Aust. Veteriner. J. 65 218-220.
- ^ B. Poocharoen vd. (1992). "Maltlı arpada N-nitrosodimetilamin öncüleri. 1. Hordenin ve gramin tayini." J. Agric. Food Chem. 40 2216-2221.
- ^ K. L. S. Harley (1967). "Bitki kimyasallarının iki şeritli çekirgenin beslenme davranışı, gelişimi ve hayatta kalması üzerindeki etkisi, Melanoplus bivittatus (Sap), Aeridae: Orthoptera. " Can J. Zool. 45 305-319.
- ^ E. A. Bernays ve diğerleri. (2000). "Böcek otçullarının caydırıcılara karşı tat duyarlılığı uzmanlarda genelcilere göre daha fazladır: iki yakından ilişkili tırtıl ile hipotezin davranışsal testi." J. Chem. Ecol. 26 547-563.
- ^ D. L. Liu ve J. V. Lovett (1993). "Arpanın biyolojik olarak aktif ikincil metabolitleri. II. Arpa alelokimyasallarının fitotoksisitesi" J. Chem. Ecol. 19 2231-2244.
