Opioid - Opioid
| Opioid | |
|---|---|
| İlaç sınıfı | |
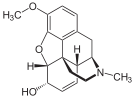
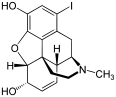
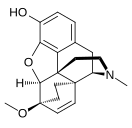
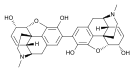
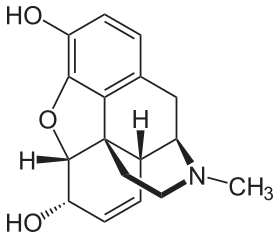 Morfinin kimyasal yapısı, prototip opioid.[1] | |
| Sınıf tanımlayıcıları | |
| Kullanım | Ağrı kesici |
| ATC kodu | N02A |
| Aksiyon modu | Opioid reseptörü |
| Dış bağlantılar | |
| MeSH | D000701 |
| Vikiveri'de | |
Opioidler ulaşan maddelerdir opioid reseptörleri, benzer etkilere sahip morfin.[2] Tıbbi olarak öncelikle ağrı kesici, dahil olmak üzere anestezi.[3] Diğer tıbbi kullanımlar şunları içerir: ishal yerine koyma tedavisi opioid kullanım bozukluğu, ters çevirme opioid doz aşımı, bastırıcı öksürük,[3] Hem de Amerika Birleşik Devletleri'nde infaz. Aşağıdakiler gibi son derece güçlü opioidler carfentanil sadece veterinerlik kullanımı için onaylanmıştır.[4][5][6] Opioidler sıklıkla tıbbi olmayan amaçlarla kullanılmaktadır. öforik etkiler veya önlemek için para çekme.[7]
Opioidlerin yan etkileri şunları içerebilir: kaşıntı, sedasyon, mide bulantısı, solunum depresyonu, kabızlık, ve öfori. Uzun süreli kullanım neden olabilir hata payı aynı etkiyi elde etmek için daha yüksek dozların gerekli olduğu anlamına gelir ve fiziksel bağımlılık bu, ilacın aniden kesilmesinin hoş olmayan yoksunluk semptomlarına yol açtığı anlamına gelir.[8] Coşku, eğlence amaçlı kullanımı çeker ve opioidlerin sık ve artan eğlence amaçlı kullanımı tipik olarak bağımlılıkla sonuçlanır. Bir aşırı doz veya diğerleriyle eşzamanlı kullanım depresan ilaçlar sevmek benzodiazepinler veya alkol genellikle solunum depresyonundan ölümle sonuçlanır.[9]
Opioidler, opioid reseptörlerine bağlanarak etki eder. Esas olarak şurada bulunurlar: merkezi ve Periferik sinir sistemi ve gastrointestinal sistem. Bu reseptörler, hem psikoaktif ve opioidlerin somatik etkileri. Opioid ilaçlar şunları içerir: kısmi agonistler ishal önleyici ilaç gibi loperamid ve antagonistler sevmek Naloxegol opioid kaynaklı kabızlık için. Geçmiyorlar Kan beyin bariyeri ancak diğer opioidlerin bu reseptörlere bağlanmasını engelleyebilir.[kaynak belirtilmeli ]
Her yıl dünya çapında 69.000 kişi aşırı dozda opioid yüzünden ölüyor ve 15 milyon insan opioid bağımlılığına sahip.[10]
Opioidler bağımlılık yaptığından ve ölümcül doz aşımına neden olabileceğinden, çoğu kontrollü maddeler. 2013 yılında 28 ila 38 milyon kişi yasadışı olarak opioid kullandı (15 ila 65 yaş arasındaki küresel nüfusun% 0,6 ila% 0,8'i).[11] 2011 yılında, Amerika Birleşik Devletleri'nde tahmini 4 milyon kişi opioidleri eğlence amaçlı kullandı veya onlara bağımlıydı.[12] 2015 itibariyle, artan eğlence amaçlı kullanım ve bağımlılık oranları, opioid ilaçların aşırı reçetelenmesine ve ucuz yasadışı eroin.[13][14][15] Tersine, aşırı reçete yazma korkusu, abartılı yan etkiler ve opioid bağımlılığı benzer şekilde ağrının yetersiz tedavisi için suçlanıyor.[16][17]
Terminoloji
Opioidler şunları içerir: opiatlar, bu tür ilaçlara atıfta bulunan eski bir terim afyon, dahil olmak üzere morfin kendisi.[18] Diğer opioidler yarı sentetik ve sentetik gibi ilaçlar hidrokodon, oksikodon ve fentanil; antagonist ilaçlar gibi nalokson; ve endojen peptitler benzeri endorfinler.[19] Şartlar afyon ve narkotik bazen opioid ile eşanlamlı olarak karşılaşılır. Afyon uygun şekilde doğal ile sınırlıdır alkaloidler reçinede bulundu Haşhaş bazıları yarı sentetik türevler içermesine rağmen.[18][20] NarkotikAmerikan yasal terimi olarak 'uyuşma' veya 'uyku' anlamına gelen kelimelerden türetilen kokain ve opioidler ve bunların kaynak malzemeleri. Ayrıca herhangi bir yasadışı veya kontrollü psikoaktif ilaca da gevşek bir şekilde uygulanır.[21][22] Bazı yetki alanlarında, tüm kontrollü ilaçlar yasal olarak şu şekilde sınıflandırılır: narkotik. Terim aşağılayıcı çağrışımlara sahip olabilir ve bu durumda kullanımı genellikle tavsiye edilmez.[23][24]
Tıbbi kullanımlar
Ağrı
Zayıf opioid kodein düşük dozlarda ve bir veya daha fazla başka ilaçla birlikte yaygın olarak bulunur reçetesiz[25] ve hafif ağrıyı tedavi etmek için kullanılabilir.[26] Diğer opioidler genellikle orta ila şiddetli ağrının giderilmesi için ayrılmıştır.[26]
Akut ağrı
Opioidler, akut hastalıkların tedavisinde etkilidir. Ağrı (ameliyat sonrası ağrı gibi).[27] Orta ila şiddetli akut ağrının derhal giderilmesi için opioidler sıklıkla tercih edilen tedavi yöntemidir. Bu, hızlı başlangıçları, etkinlikleri ve düşük bağımlılık risklerinden kaynaklanmaktadır. Bununla birlikte, yeni bir rapor, opioid kullanıldığında uzun süreli opioid kullanımının açık bir risk olduğunu göstermiştir. analjezikler ameliyat veya travmayı takiben akut ağrı tedavisi için başlatılır.[28] Bunların da önemli olduğu görülmüştür. palyatif bakım kanser gibi bazı ölümcül durumlarda ve dejeneratif durumlarda ortaya çıkabilecek şiddetli, kronik, sakatlayıcı ağrıya yardımcı olmak için romatizmal eklem iltihabı. Çoğu durumda, opioidler kronik hastalıklı kişiler için başarılı bir uzun vadeli bakım stratejisidir. kanser ağrısı.
ABD'deki tüm eyaletlerin yarısından biraz fazlası, akut ağrı için opioid reçetesi yazılmasını veya dağıtılmasını kısıtlayan bir yasa çıkardı.[29]
Kronik kanser dışı ağrı
Kılavuzlar, opioid riskinin, aşağıdakiler de dahil olmak üzere çoğu kanser dışı kronik durum için kullanıldığında faydalarından daha büyük olduğunu önermektedir baş ağrısı, sırt ağrısı, ve fibromiyalji.[30] Bu nedenle kronik kanser dışı ağrıda dikkatli kullanılmalıdır.[31] Kullanılırsa, yararları ve zararları en az üç ayda bir yeniden değerlendirilmelidir.[32]
Kronik ağrının tedavisinde opioidler, diğer daha az riskli ağrı kesiciler düşünüldükten sonra denenecek bir seçenektir. Bu içerir parasetamol / asetaminofen veya NSAID'ler gibi ibuprofen veya naproksen.[33] Neden olduğu ağrı dahil olmak üzere bazı kronik ağrı türleri fibromiyalji veya migren, tercihen opioidler dışındaki ilaçlarla tedavi edilir.[34][35] Kronik azaltmak için opioid kullanmanın etkinliği nöropatik ağrı belirsizdir.[36]
Opioidler, uyanıklığı bozdukları, bağımlılık riskini getirdikleri ve epizodik baş ağrılarının kronik hale gelme riskini artırdıkları için baş ağrısı için birinci basamak tedavi olarak kontrendikedir.[37] Opioidler ayrıca baş ağrısına duyarlılığın artmasına neden olabilir.[37] Diğer tedaviler başarısız olduğunda veya mevcut olmadığında, hasta kronik baş ağrısının gelişmesini önlemek için izlenebiliyorsa, opioidler baş ağrısını tedavi etmek için uygun olabilir.[37]
Opioidler, kötü huylu olmayanların tedavisinde daha sık kullanılmaktadır. kronik ağrı.[38][39][40] Bu uygulama şimdi opioidlerin bağımlılığı ve kötüye kullanılmasıyla ilgili yeni ve büyüyen bir soruna yol açmıştır.[31][41] Çeşitli olumsuz etkiler nedeniyle, daha az riskli diğer ağrı kesiciler etkisiz bulunmadıkça, opioidlerin kronik ağrının uzun vadeli tedavisinde kullanılması endike değildir. Sadece periyodik olarak ortaya çıkan kronik ağrı nöralji, migren, ve fibromiyalji opioidler dışındaki ilaçlarla sıklıkla daha iyi tedavi edilir.[34] Parasetamol ve steroid olmayan antienflamatuvar ilaçlar dahil olmak üzere ibuprofen ve naproksen daha güvenli alternatifler olarak kabul edilir.[42] Sıklıkla parasetamol gibi opioidlerle birlikte kullanılırlar. oksikodon (Percocet ) ve ibuprofen ile birlikte hidrokodon (Vicoprofen ), hangi ağrı kesiciyi artırır ama aynı zamanda eğlence amaçlı kullanımı caydırmayı da amaçlamaktadır.[43][44]
Diğer
Öksürük
Kodein bir zamanlar öksürük kesici ilaçlarda "altın standart" olarak görülüyordu, ancak bu pozisyon şimdi sorgulanmaktadır.[45] Bazı yeni plasebo kontrollü denemeler, çocuklarda akut öksürük dahil bazı nedenler için plasebodan daha iyi olmayabileceğini bulmuştur.[46][47] Bu nedenle çocuklar için tavsiye edilmez.[47] Ek olarak, hiçbir kanıt yok hidrokodon çocuklarda faydalıdır.[48] Benzer şekilde, akut öksürüğün tedavisine ilişkin 2012 Hollanda kılavuzu, bunun kullanımını önermemektedir.[49] (Opioid analoğu dekstrometorfan, uzun zamandır kodein kadar etkili bir öksürük kesici olduğu iddia edildi,[50] benzer şekilde son zamanlarda yapılan birkaç çalışmada çok az fayda olduğunu göstermiştir.[51])
Düşük doz morfin, kronik öksürüğe yardımcı olabilir, ancak kullanımı yan etkilerle sınırlıdır.[52]
İshal ve kabızlık
İshalin baskın olduğu durumlarda huzursuz bağırsak sendromu opioidler ishali bastırmak için kullanılabilir. Loperamide bir çevresel olarak seçici opioid mevcut reçetesiz ve ishali bastırmak için kullanılır.
İshali bastırma yeteneği, opioidler birkaç haftadan fazla kullanıldığında kabızlığa da neden olur.[53] Naloxegol opioidin neden olduğu kabızlığı tedavi etmek için periferik olarak seçici bir opioid antagonisti artık mevcuttur.[54]
Nefes darlığı
Opioidler yardımcı olabilir nefes darlığı özellikle kanser gibi ilerlemiş hastalıklarda ve KOAH diğerleri arasında.[55][56]
Yan etkiler
Diğer
- Bilişsel etkiler
- Opioid bağımlılığı
- Baş dönmesi
- İştah kaybı
- Gecikmiş mide boşalması
- Azalan cinsel dürtü
- Bozulmuş cinsel işlev
- Azalan testosteron seviyeleri
- Depresyon
- İmmün yetmezlik
- Artan ağrı hassasiyeti
- Düzensiz adet kanaması
- Artan risk düşme
- Yavaş nefes
- Koma
Yaşlı yetişkinlerde opioid kullanımı, "sedasyon, bulantı, kusma, kabızlık, üriner retansiyon ve düşme" gibi artan yan etkilerle ilişkilidir.[58] Sonuç olarak, opioid alan yaşlı yetişkinler yaralanma için daha büyük risk altındadır.[59] Opioidler, diğer birçok ilacın aksine, herhangi bir spesifik organ toksisitesine neden olmaz. aspirin ve parasetamol. Üst gastrointestinal kanama ve böbrek toksisitesi ile ilişkili değildirler.[60]
Akut bel ağrısı için opioid reçetesi ve osteoartrit tedavisi, uzun vadeli yan etkilere sahip gibi görünmektedir.[61][62]
Opioide bağımlı annelerden doğan çocuklar, özellikle de metadon reçetelenenler, nörogelişim bozukluğu riski altındadır, maruz kalmayan çocuklara göre daha düşük Zihinsel Gelişim İndeksi ve daha düşük Psikomotor Gelişim İndeksi puanlarına sahiptir.[63]
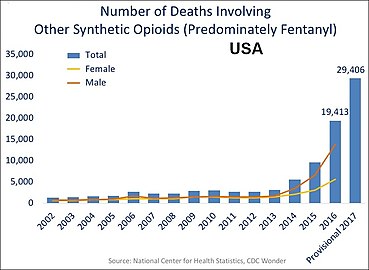
Araştırma gösteriyor ki, metadon uzun süreli kullanılırsa, vücutta tahmin edilemeyecek şekilde birikebilir ve potansiyel olarak ölümcül şekilde yavaşlamış nefes almaya yol açabilir.[64][65] Tıbben kullanıldığında, yaklaşan toksisite tanınmaz hale gelir çünkü Ağrı kesici etkisi, ilacın yarılanma ömründen çok önce sona erer.[66] Göre USCDC 1999-2010 yılları arasında ABD'de opioid ile ilgili ölümlerin% 31'inde metadon ve diğer opioidlerden çok daha yüksek bir oranda tek uyuşturucunun% 40'ında yer almıştır.[67] Uzun süreli opioid çalışmaları, olumsuz olayların bireylerin uzun vadede opioid almasını engelleyebileceğini bulmuştur.[68] Amerika Birleşik Devletleri'nde 2016 yılında aşırı opioid dozu 10.000 kişide 1,7'nin ölümüyle sonuçlandı.[69]
Birçok ölümün altındaki ABD çizelgelerinde birden fazla opioid var:

ABD'de eroin içeren yıllık aşırı doz ölümleri.[70]
Takviye bozuklukları
Hata payı
Hata payı ile karakterize edilen bir süreçtir nöroadaptasyonlar bu, ilaç etkilerinin azalmasına neden olur. Süre reseptör yukarı regülasyonu sıklıkla önemli bir rol oynayabilir, diğer mekanizmalar da bilinmektedir.[72] Tolerans bazı etkiler için diğerlerinden daha belirgindir; tolerans duygudurum, kaşıntı, üriner retansiyon ve solunum depresyonu üzerindeki etkilere yavaşça ortaya çıkar, ancak analjezi ve diğer fiziksel yan etkilere karşı daha hızlı gerçekleşir. Ancak tolerans kabızlığa veya miosis (göz bebeğinin iki milimetreye eşit veya daha az daralması). Bununla birlikte, bazı yazarlar hoşgörünün yapar miosis için gelişir.[73]
Opioidlere tolerans, aşağıdakiler dahil bir dizi madde tarafından zayıflatılır:
- Kalsiyum kanal blokerleri[74][75][76]
- intratekal magnezyum[77][78] ve çinko[79]
- NMDA antagonistleri, gibi dekstrometorfan, ketamin,[80] ve memantin.[81]
- kolesistokinin antagonistleri, gibi proglumid[82][83][84]
- Gibi daha yeni ajanlar fosfodiesteraz inhibitörü ibudilast bu uygulama için de araştırılmıştır.[85]
Tolerans, vücudun sıklıkla mevcut olan bir ilaca uyum sağladığı fizyolojik bir süreçtir. Aynı etkiyi elde etmek için genellikle aynı ilacın daha yüksek dozları zamanla gereklidir. Bireylerin uzun süreler boyunca yüksek dozda opioid alması yaygın bir durumdur. Ancak bu, herhangi bir kötüye kullanım veya bağımlılık ilişkisini öngörmez. Avustralya'da yapılan retrospektif bir kohort çalışması, ilk ayda dağıtımın sona ermemesi halinde, takip süresi boyunca daha fazla dağıtım yapma olasılığının çok yüksek kaldığını buldu. İlk aydaki dağıtım epizodlarının miktarı ve sayısı, sonraki dönemde toplam dağıtım süresinin önemli öngörücüleriydi.[86]
Fiziksel bağımlılık
Fiziksel bağımlılık vücudun bir maddenin, bu durumda opioid ilacının varlığına fizyolojik adaptasyonudur. Madde kesildiğinde, doz aniden azaldığında veya özellikle opioidler durumunda bir antagonist olduğunda yoksunluk semptomlarının gelişmesi ile tanımlanır.Örneğin., nalokson ) veya bir agonist-antagonist (Örneğin., pentazosin ) yönetilir. Fiziksel bağımlılık, bazı ilaçların normal ve beklenen bir yönüdür ve hastanın bağımlı olduğu anlamına gelmez.
Opiatlar için yoksunluk semptomları, şiddetli disfori, başka bir opiat dozu için özlem, sinirlilik, terlemek, mide bulantısı, Rinorrea, titreme, kusma ve kas ağrısı. Opioid alımını günler ve haftalar içinde yavaş yavaş azaltmak, yoksunluk semptomlarını azaltabilir veya ortadan kaldırabilir.[87] Geri çekmenin hızı ve ciddiyeti, opioidin yarı ömrüne bağlıdır; eroin ve morfin yoksunluğu, metadon para çekme. Akut yoksunluk aşamasını genellikle aylarca sürebilen uzun süreli depresyon ve uykusuzluk dönemi izler. Opioid yoksunluğunun semptomları, aşağıdakiler gibi diğer ilaçlarla tedavi edilebilir: klonidin.[88] Fiziksel bağımlılık, ilaç kötüye kullanımını veya gerçek bağımlılığı öngörmez ve toleransla aynı mekanizma ile yakından ilgilidir. Anekdotlara dayalı fayda iddiaları varken ibogain Madde bağımlılığında kullanımını destekleyen veriler yetersizdir.[89]
Düzenli dozlarda opioid alan kritik hastalar, sık görülen bir sendrom olarak iyatrojenik yoksunluk yaşarlar.[90]
Bağımlılık
Uyuşturucu bağımlılığı tipik olarak belirli ilaçların kötüye kullanımıyla ilişkili, zamanla ve daha yüksek ilaç dozajlarıyla gelişen karmaşık bir davranışlar dizisidir. Bağımlılık, muzdarip kişinin tehlikeli veya sağlıksız sonuçlara yol açan eylemlerde ısrar ettiği ölçüde, psikolojik zorlamayı içerir. Opioid bağımlılığı şunları içerir: üfleme veya tıbbi nedenlerle reçete edildiği gibi oral yoldan opioid almak yerine enjeksiyon.[87]
Avusturya, Bulgaristan ve Slovakya gibi Avrupa ülkelerinde, buprenorfin veya buprenorfinin yan etkilerini iyi tolere etmeyen hastalar için afyon ikame tedavisinde (OST) yavaş salınan oral morfin formülasyonları kullanılmaktadır. metadon. Buprenorfin ile birlikte de kullanılabilir nalokson bağımlılığın daha uzun tedavisi için. İngiltere de dahil olmak üzere diğer Avrupa ülkelerinde, bu, değişen bir kabul ölçeğinde olmasına rağmen yasal olarak OST için de kullanılmaktadır.
Yavaş salınan ilaç formülasyonları, ağrı hastalarına meşru ağrı kesici ve kullanım kolaylığı sağlamaya çalışırken kötüye kullanım ve bağımlılık oranlarını azaltmaya yöneliktir. Bununla birlikte, bu tür preparatların etkinliği ve güvenilirliği ile ilgili sorular devam etmektedir. Daha fazla kurcalamaya dayanıklı ilaç şu anda FDA tarafından pazar onayı için denemelerle değerlendirilmektedir.[91][92]
Mevcut kanıt miktarı yalnızca zayıf bir sonuca varılmasına izin verir, ancak bir doktorun öyküsü olmayan hastalarda opioid kullanımını düzgün bir şekilde yönettiğini göstermektedir. Madde bağımlılığı veya madde bağımlılığı bağımlılık, istismar veya diğer ciddi yan etkilere yakalanma riski çok az olan uzun süreli ağrı kesici verebilir.[68]
Opioidlerle ilgili sorunlar şunları içerir:
- Bazı insanlar opioidlerin tüm ağrılarını gidermediğini fark eder.[93]
- Bazı insanlar, opioidlerin yan etkilerinin, terapinin yararına ağır basan sorunlara neden olduğunu fark eder.[68]
- Bazı insanlar zamanla opioidlere tolerans geliştirir. Bu, faydayı sürdürmek için ilaç dozajlarını artırmalarını gerektirir ve bu da istenmeyen yan etkileri artırır.[68]
- Uzun süreli opioid kullanımı neden olabilir opioid kaynaklı hiperaljezi hastanın ağrıya duyarlılığının arttığı bir durumdur.[94]
Tüm opioidler yan etkilere neden olabilir.[57] Ağrıyı gidermek için opioid alan hastalarda yaygın görülen yan etkiler şunlardır: mide bulantısı ve kusma, uyuşukluk Kaşıntı, ağız kuruluğu baş dönmesi, ve kabızlık.[57][87]
Mide bulantısı ve kusma
Tolerans mide bulantısı antiemetiklerin çok etkili olduğu 7-10 gün içinde ortaya çıkar.[kaynak belirtilmeli ] Tardif diskinezi gibi ciddi yan etkiler nedeniyle haloperidol artık nadiren kullanılmaktadır. İlgili bir ilaç, proklorperazin benzer riskleri olmasına rağmen daha sık kullanılır. Gibi daha güçlü antiemetikler ondansetron veya tropisetron bazen mide bulantısı şiddetli veya sürekli ve rahatsız edici olduğunda, maliyeti daha yüksek olmasına rağmen kullanılır. Daha ucuz bir alternatif, domperidon ve metoklopramid gibi dopamin antagonistleridir. Domperidon geçmiyor Kan beyin bariyeri ve ters merkezi antidopaminerjik etkiler üretir, ancak opioid emetik etkisini bloke eder. kemoreseptör tetik bölgesi. (Bu ilaç ABD'de bulunmamaktadır) Antikolinerjik özelliklere sahip bazı antihistaminikler (Örneğin. orfenadrin veya difenhidramin) de etkili olabilir. Birinci nesil antihistamin hidroksizin, hareket bozukluklarına neden olmama ve ayrıca analjezik koruyucu özelliklere sahip olma avantajlarıyla çok yaygın olarak kullanılmaktadır. Δ9-tetrahidrokanabinol bulantı ve kusmayı hafifletir;[95][96] aynı zamanda, bulantı ve kusmanın azalmasıyla birlikte daha düşük opioid dozlarına izin verebilen analjezi üretir.[97][98]
- 5-HT3 antagonistler (Örneğin. ondansetron )
- Dopamin antagonistleri (Örneğin. domperidon )
- Anti-kolinerjik antihistaminikler (Örneğin. difenhidramin )
- Δ9-tetrahidrokanabinol (Örneğin. dronabinol )
Kusma nedeniyle mide durması (büyük hacimli kusma, kusma ile hafifletilen kısa bulantı, özofageal reflü, epigastrik dolgunluk, erken doygunluk), kemoreseptör tetik bölgesi of alan postrema, beynin kusma merkezi. Böylelikle kusma prokinetik ajanlarla önlenebilir (Örneğin. domperidon veya metoklopramid ). Kusma zaten başlamışsa, bu ilaçların oral olmayan bir yolla uygulanması gerekir (Örneğin. metoklopramid için deri altı, domperidon için rektal).
- Prokinetik ajanlar (Örneğin. domperidon )
- Anti-kolinerjik ajanlar (Örneğin. orfenadrin )
Kanıtlar, opioid içeren anestezinin postoperatif bulantı ve kusma ile ilişkili olduğunu göstermektedir.[99]
Opioid kullanan kronik ağrısı olan hastalarda ağrı ve fiziksel işlevlerde küçük gelişmeler ve artmış kusma riski vardı.[100]
Uyuşukluk
Tolerans uyuşukluk genellikle 5-7 günde gelişir, ancak sorun yaratıyorsa alternatif bir opioide geçmek çoğu zaman yardımcı olur. Gibi belirli opioidler fentanil, morfin ve diamorfin (eroin) özellikle yatıştırıcı olma eğilimindeyken, oksikodon, tilidin ve meperidin (petidin) nispeten daha az sedasyon üretme eğilimindedir, ancak bireysel hasta tepkileri belirgin şekilde değişebilir ve belirli bir hasta için en uygun ilacı bulmak için bir dereceye kadar deneme yanılma gerekebilir. Aksi takdirde, tedavi CNS uyarıcılar genellikle etkilidir.[101][102]
- Uyarıcılar (Örneğin. kafein, modafinil, amfetamin, metilfenidat )
Kaşıntı
Kaşıntı opioidler ağrı kesici olarak kullanıldığında ciddi bir problem olma eğilimindedir, ancak antihistaminikler ortaya çıktığında kaşıntıyı önlemek için faydalıdır. Feksofenadin gibi sedatif olmayan antihistaminikler, opioidin neden olduğu uyuşukluğu arttırmayı önledikleri için sıklıkla tercih edilir. Bununla birlikte, bazı sakinleştirici antihistaminikler orfenadrin daha küçük dozlarda opioid kullanımına izin veren sinerjik bir ağrı giderici etki yaratabilir. Sonuç olarak, birkaç opioid / antihistamin kombinasyon ürünü pazarlanmıştır. Meprozin (meperidin /prometazin ) ve Diconal (dipipanon /siklizin ) ve bunlar opioid kaynaklı mide bulantısını da azaltabilir.
- Antihistaminikler (Örneğin. feksofenadin )
Kabızlık
Opioid kaynaklı kabızlık (OIC) uzun süreli opioid kullanan kişilerin% 90 ila 95'inde gelişir.[103] Bu soruna tolerans genel olarak gelişmediğinden, uzun vadeli opioid kullanan çoğu kişinin ilaç alması gerekir. müshil veya lavman.[104]
İKT tedavisi ardışıktır ve ciddiyetine bağlıdır.[105] İlk tedavi şekli farmakolojik değildir ve artırma gibi yaşam tarzı değişikliklerini içerir. diyet lifi, sıvı alımı (günde yaklaşık 1,5 L (51 US fl oz)) ve fiziksel aktivite.[105] Farmakolojik olmayan önlemler etkisiz ise, müshiller, dahil olmak üzere dışkı yumuşatıcılar (Örneğin., polietilen glikol ), toplu oluşturan müshiller (Örneğin., lif takviyeleri ), uyarıcı müshiller (Örneğin., bizakodil, sinameki ) ve / veya lavman, Kullanılabilir.[105] OIC için yaygın bir müshil rejimi, docusate ve bizakodil kombinasyonudur.[105][106][107][güncellenmesi gerekiyor ] Ozmotik müshiller, dahil olmak üzere laktuloz, polietilen glikol, ve magnesianın sütü (magnezyum hidroksit) yanı sıra Mineral yağ (bir kayganlaştırıcı müshil ), aynı zamanda İKT için de yaygın olarak kullanılmaktadır.[106][107]
Periferik etkili u-opioid reseptör antagonistinin OIC'li hastalar için etkili ve dayanıklı olduğu gösterilmiştir.[108]
Müshil maddeler yeterince etkili değilse (bu genellikle böyledir),[109] periferik seçici içeren opioid formülasyonları veya rejimleri opioid antagonisti, gibi metilnaltrekson bromür, Naloxegol, alvimopan veya nalokson (de olduğu gibi oksikodon / nalokson ) denenebilir.[105][107][110] Bir 2018 Cochrane incelemesi, kanıtların alvimopan, nalokson veya metilnaltrekson bromür için geçici olduğunu buldu.[111] Ağız yoluyla Naloxone en etkili gibi görünmektedir.[112] Günlük 0.2 mg naldemedin dozunun OIC'li hastalarda semptomları önemli ölçüde iyileştirdiği gösterilmiştir.[113]
Opioid rotasyonu uzun süreli kullanıcılarda kabızlığın etkisini en aza indirmek için önerilen bir yöntemdir.[114] Tüm opioidler kabızlığa neden olurken, ilaçlar arasında bazı farklılıklar vardır. Tramadol, tapentadol, metadon ve fentanil nispeten daha az kabızlığa neden olabilir kodein, morfin, oksikodon veya hidromorfon kabızlık nispeten daha şiddetli olabilir.
Solunum depresyonu
Solunum depresyonu opioid kullanımı ile ilişkili en ciddi advers reaksiyondur, ancak genellikle opioid kullanmamış bir hastada tek bir intravenöz doz kullanımıyla görülür. Ağrıyı gidermek için düzenli olarak opioid alan hastalarda solunum depresyonuna tolerans hızla oluşur, bu nedenle klinik bir problem değildir. Solunum depresyonunu kısmen bloke edebilen birkaç ilaç geliştirilmiştir, ancak şu anda bu amaç için onaylanmış tek solunum uyarıcısı doksapram, bu uygulamada yalnızca sınırlı etkinliğe sahiptir.[115][116] Gibi daha yeni ilaçlar BIMU-8 ve CX-546 çok daha etkili olabilir.[117][118][119][birincil olmayan kaynak gerekli ]
- Solunum uyarıcıları: karotis kemoreseptör agonistleri (Örneğin. doksapram ), 5-HT4 agonistler (Örneğin. BIMU8 ), δ-opioid agonistleri (Örneğin. BW373U86 ) ve AMPAkines (Örneğin. CX717 ) hepsi analjeziyi etkilemeden opioidlerin neden olduğu solunum depresyonunu azaltabilir, ancak bu ilaçların çoğu sadece orta derecede etkilidir veya insanlarda kullanımı engelleyen yan etkilere sahiptir. 5-HT1 A agonistler gibi 8-OH-DPAT ve Repinotan aynı zamanda opioid kaynaklı solunum depresyonu ile mücadele eder, ancak aynı zamanda analjeziyi azaltır, bu da bu uygulama için yararlılıklarını sınırlar.
- Opioid antagonistleri (Örneğin. nalokson, Nalmefene, diprenorfin )
Opioid uygulamasından sonraki ilk 24 saat, yaşamı tehdit eden OIRD açısından en kritik dönem gibi görünmektedir, ancak opioid kullanımına daha ihtiyatlı bir yaklaşımla önlenebilir.[120]
Kalp, solunum hastalığı ve / veya obstrüktif uyku apnesi olan hastalar, OIRD için yüksek risk altındadır.[121]
Artan ağrı hassasiyeti
Opioid kaynaklı hiperaljezi - ağrıyı hafifletmek için opioid kullanan bireyler paradoksal bu ilaçların bir sonucu olarak daha fazla ağrı yaşarlar - bazı insanlarda gözlemlenmiştir. Bu fenomen, nadir olmasına rağmen, bazı insanlarda görülür. palyatif bakım, çoğunlukla doz hızla artırıldığında.[122][123] Karşılaşılırsa, birkaç farklı opioid ağrı kesici ilaç arasındaki rotasyon, artan ağrı.[124][125] Opioid kaynaklı hiperaljezi daha çok kronik kullanımda veya kısa yüksek dozlarda ortaya çıkar, ancak bazı araştırmalar bunun çok düşük dozlarda da olabileceğini öne sürmektedir.[126][127]
Hiperaljezi gibi yan etkiler ve allodini bazen kötüleşen nöropatik ağrı opioid analjeziklerle uzun süreli tedavinin sonuçları olabilir, özellikle toleransın arttırılması etkinlik kaybına ve bunun sonucunda zaman içinde artan doz artışına neden olduğunda. Bu, büyük ölçüde opioid ilaçların üç klasik opioid reseptörü dışındaki hedefler üzerindeki etkilerinin bir sonucu gibi görünmektedir. nosiseptin reseptörü, sigma reseptörü ve Toll benzeri reseptör 4 ve hayvan modellerinde bu hedeflerde antagonistler tarafından önlenebilir. J-113,397, BD-1047 veya (+) - nalokson sırasıyla.[128] Şu anda hiçbir ilaç, insanlarda opioid kaynaklı hiperaljeziye karşı koymak için özel olarak onaylanmamıştır ve ciddi vakalarda tek çözüm, opioid analjeziklerin kullanımına son vermek ve bunları opioid olmayan analjezik ilaçlarla değiştirmek olabilir. Bununla birlikte, bu yan etkinin gelişimine karşı bireysel duyarlılık büyük ölçüde doza bağımlı olduğundan ve hangi opioid analjeziğin kullanıldığına bağlı olarak değişebildiğinden, birçok hasta bu yan etkiden sadece opioid ilacının dozunun azaltılması yoluyla (genellikle bir ek opioid olmayan analjezik), farklı opioid ilaçlar arasında dönüşümlü veya özellikle nöropatik ağrıya karşı koyan karışık bir etki moduna sahip daha hafif bir opioide geçerek Tramadol veya tapentadol.[129][130][131]
- NMDA reseptör antagonistleri gibi ketamin
- SNRI'ler gibi Milnasipran
- Antikonvülsanlar gibi Gabapentin veya pregabalin
Diğer olumsuz etkiler
Düşük seks hormonu seviyeleri
Klinik çalışmalar, tıbbi ve eğlence amaçlı opioid kullanımını tutarlı bir şekilde hipogonadizm (düşük seks hormonu seviyeleri) farklı cinsiyetlerde. Etkisi doza bağlı. Çoğu çalışma, kronik opioid kullanıcılarının çoğunluğunun (belki de% 90 kadarının) hipogonadizmden muzdarip olduğunu göstermektedir. Opioidler ayrıca aşağıdakileri de etkileyebilir: adet kadınlarda üretimini sınırlandırarak lüteinleştirici hormon (LH). Opioid kaynaklı hipogonadizm muhtemelen opioid kullanımının osteoporoz ve kemik kırığı eksiklik nedeniyle estradiol. Aynı zamanda ağrıyı artırabilir ve böylece opioid tedavisinin amaçlanan klinik etkisine müdahale edebilir. Opioid ile indüklenen hipogonadizm, muhtemelen opioid reseptörlerinin agonizminden kaynaklanmaktadır. hipotalamus ve hipofiz bezi.[kaynak belirtilmeli ] Bir çalışma, depresif testosteron eroin bağımlılarının seviyeleri, yoksunluktan sonraki bir ay içinde normale döndü, bu da etkinin kolayca geri döndürülebilir ve kalıcı olmadığını düşündürüyor.[kaynak belirtilmeli ] 2013 itibarıyla[Güncelleme]düşük doz veya akut opioid kullanımının endokrin sistem dır-dir belirsiz.[132][133][134][135] Uzun süreli opioid kullanımı diğerini etkileyebilir hormonal sistemler yanı sıra.[132]
İşin aksaması
Opioid kullanımı işe dönmeme konusunda bir risk faktörü olabilir.[136][137]
Güvenliğe duyarlı herhangi bir görevi yerine getiren kişiler opioid kullanmamalıdır.[138] Sağlık hizmeti sağlayıcıları, sürücü veya kullan ağır ekipman dahil olmak üzere vinçler veya forkliftler kronik veya akut ağrıyı opioidlerle tedavi edin.[138] Güvenliğe duyarlı operasyonlar gerçekleştiren işçileri yöneten işyerleri, işçilere doktorları tarafından opioid tedavisi gördükleri sürece daha az hassas görevler vermelidir.[138]
Uzun süreli opioid alan kişilerin işsiz kalma olasılığı artmıştır.[139] Opioid almak hastanın yaşamını daha da bozabilir ve opioidlerin olumsuz etkileri hastaların aktif bir yaşam sürmesi, iş bulması ve bir kariyer sürdürmesi önünde önemli bir engel haline gelebilir.
Ek olarak, istihdam eksikliği, reçeteli opioidlerin anormal kullanımının bir göstergesi olabilir.[140]
Kazaya yatkınlığın artması
Opioid kullanımı artabilir kazaya meyilli olma. Opioidler trafik kazası riskini artırabilir[141][142] ve kazara düşme.[143]
Azaltılmış Dikkat
Opioidlerin, antidepresanlar ve / veya antikonvülsanlarla birlikte kullanıldığında daha çok dikkati azalttığı gösterilmiştir.[144]
Hiperaljezi
Opioid kaynaklı hiperaljezi (OIH), kronik opioid maruziyetinden sonra hastalarda belirgindir.[145][146]
yan etkiler
Ağrıyı gidermek için opioid alan hastalarda seyrek görülen advers reaksiyonlar şunları içerir: doza bağlı solunum depresyonu (özellikle güçlü opioidler), kafa karışıklığı, halüsinasyonlar, deliryum, ürtiker, hipotermi, bradikardi /taşikardi, ortostatik hipotansiyon baş dönmesi, baş ağrısı, idrar retansiyonu, üreter veya safra spazmı, kas sertliği, miyoklonus (yüksek dozlarda) ve kızarma (fentanil ve remifentanil dışında histamin salınımına bağlı).[87]Opioidlerin hem terapötik hem de kronik kullanımı, opioidlerin işlevini tehlikeye atabilir. bağışıklık sistemi. Opioidler, makrofaj progenitör hücreler ve lenfositler ve hücre farklılaşmasını etkiler (Roy & Loh, 1996). Opioidler ayrıca inhibe edebilir lökosit göç. Bununla birlikte, ağrının giderilmesi bağlamında bunun önemi bilinmemektedir.
Etkileşimler
Opioidleri diğer ilaçlarla kombinasyon halinde kullanan hastaları tedavi eden doktorlar, daha fazla tedavinin gerekli olduğuna dair sürekli dokümantasyon tutar ve hastanın durumu daha az riskli bir tedaviyi hak edecek şekilde değişirse tedaviyi ayarlama fırsatlarının farkındadır.[147]
Diğer depresan ilaçlarla

Opioidlerin diğer depresan ilaçlarla eşzamanlı kullanımı benzodiazepinler veya etanol, advers olay ve aşırı doz oranlarını artırır.[147] Opioidlerin benzodiazepinler veya etanol gibi diğer depresan ilaçlarla eşzamanlı kullanımı, yan etki ve aşırı doz oranlarını artırır. Yine de opioidler ve benzodiazepinler birçok ortamda aynı anda dağıtılır.[148][149] Tek başına aşırı dozda opioidde olduğu gibi, bir opioid ve başka bir depresanın kombinasyonu solunum depresyonunu hızlandırabilir ve sıklıkla ölüme neden olabilir.[150] Bu riskler, hasta davranışındaki ve tedaviye uyumdaki değişiklikler için sürekli tarama yapabilen bir doktor tarafından yakından izlenerek azaltılır.[147]
Opioid antagonisti
Opioid etkileri (olumsuz veya başka türlü), bir opioid antagonisti ile tersine çevrilebilir. nalokson veya naltrekson.[151] Bunlar rekabetçi antagonistler agonistlerden daha yüksek afinite ile opioid reseptörlerine bağlanır, ancak reseptörleri aktive etmez. Bu, agonist etkileri zayıflatarak veya tersine çevirerek agonistin yerini alır. Ancak eliminasyon yarı ömrü Naloksonun% 'si opioidin kendisinden daha kısa olabilir, bu nedenle tekrar dozlama veya sürekli infüzyon gerekebilir veya daha uzun etkili bir antagonist, örneğin Nalmefene Kullanılabilir. Düzenli olarak opioid alan hastalarda, şiddetli ve üzücü bir ağrıda uyanma reaksiyonundan kaçınmak için opioidin yalnızca kısmen tersine çevrilmesi önemlidir. Bu, tam doz vermeyip, solunum hızı düzelene kadar bunu küçük dozlarda vererek başarılır. Daha sonra ağrı kesmeyi sürdürürken tersine dönüşü bu seviyede tutmak için bir infüzyon başlatılır. Opioid antagonistleri, opioid doz aşımını takiben solunum depresyonu için standart tedavi olmaya devam etmektedir; nalokson en yaygın kullanılanı olmakla birlikte, daha uzun etkili antagonist nalmefen, metadon gibi uzun etkili opioidlerin aşırı dozlarının tedavisinde ve diprenorfin tersine çevirmek için kullanılmaktadır. etorfin ve carfentanil gibi veterinerlik tıbbında kullanılan son derece güçlü opioidlerin etkileri. Bununla birlikte, opioid antagonistleri, opioid analjeziklerin yararlı etkilerini de engelledikleri için, yan etkileri azaltmak için opioid analjeziklerin yanı sıra opioid antagonistlerinin kullanılmasıyla, genellikle yalnızca aşırı dozun tedavisinde faydalıdırlar, dikkatli doz titrasyonu gerektirirler ve çoğu zaman yeterince düşük dozlarda zayıf etkilidirler. analjezinin sürdürülmesine izin verin.
Naltrekson, oral naltreksonun güvenliğini doğrulayan ciddi advers olay riskini artırmıyor gibi görünmektedir.[152] Naloksonlu hastalarda rebound toksisiteye bağlı ölüm veya ciddi yan etkiler nadirdi.[153]
Farmakoloji
| Uyuşturucu madde | Akraba Potens [154] | Noniyonize Kesir | Protein Bağlayıcı | Lipid Çözünürlük [155][156][157] |
|---|---|---|---|---|
| Morfin | 1 | ++ | ++ | ++ |
| Petidin (meperidin) | 0.1 | + | +++ | +++ |
| Hidromorfon | 10 | + | +++ | |
| Alfentanil | 10–25 | ++++ | ++++ | +++ |
| Fentanil | 75–125 | + | +++ | ++++ |
| Remifentanil | 250 | +++ | +++ | ++ |
| Sufentanil | 500–1000 | ++ | ++++ | ++++ |
| Etorfin | 1000–3000 | |||
| Carfentanil | 10000 |
Opioidler belirli opioid reseptörleri içinde gergin sistem ve diğer dokular. Üç ana opioid reseptörü sınıfı vardır, μ, κ, δ (mu, kappa ve delta), on yediye kadar rapor edilmiş olmasına rağmen ve ε, ι, λ ve ζ (Epsilon, Iota, Lambda ve Zeta) reseptörlerini içerir. Tersine, σ (Sigma ) reseptörlerin artık opioid reseptörleri olduğu düşünülmemektedir çünkü bunların aktivasyonu opioid ters agonisti tarafından tersine çevrilmemiştir. nalokson klasik opioidler için yüksek afiniteli bağlanma göstermezler ve stereoselektiftirler. sağa döndüren izomerler diğer opioid reseptörleri stereo seçicidir. yatay dönüşlü izomerler. Ek olarak, üç alt türü vardır μ -reseptör: μ1 ve μ2ve yeni keşfedilen μ3. Klinik önemi olan diğer bir reseptör, ağrı tepkilerine dahil olan ve ayrıca analjezik olarak kullanılan μ-opioid agonistlerine tolerans geliştirilmesinde önemli bir role sahip olan opioid reseptör benzeri reseptör 1'dir (ORL1). Bunların hepsi G-protein bağlı reseptörler üzerinde hareket etmek GABAerjik nörotransmisyon.
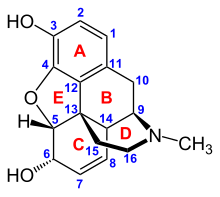
farmakodinamik bir opioide yanıt, bağlandığı reseptöre, bu reseptöre olan afinitesine ve opioidin bir opioid olup olmadığına bağlıdır. agonist veya bir rakip. Örneğin, supraspinal opioid agonistinin analjezik özellikleri morfin μ'nin aktivasyonu aracılık eder1 reseptör; solunum depresyonu ve fiziksel bağımlılık μ tarafından2 reseptör; ve κ reseptörü tarafından sedasyon ve spinal analjezi[kaynak belirtilmeli ]. Her opioid reseptörü grubu, reseptör alt tipleri (μ gibi) ile farklı bir nörolojik yanıt seti ortaya çıkarır.1 ve μ2 örneğin) daha [ölçülebilir] spesifik yanıtlar sağlamak. Her opioide özgü olan, çeşitli opioid reseptör sınıflarına farklı bağlanma afinitesidir (Örneğin. μ, κ ve δ opioid reseptörleri, opioidin spesifik reseptör bağlanma afinitelerine göre farklı büyüklüklerde aktive edilir). Örneğin, opiat alkaloid morfin μ-opioid reseptörüne yüksek afinite bağlanması sergilerken ketazosin p reseptörlerine yüksek afinite sergiler. Her biri kendi benzersiz etki profiline sahip olan bu kadar geniş bir opioid sınıfının ve moleküler tasarımın var olmasına izin veren bu birleşimsel mekanizmadır. Ayrı moleküler yapıları, farklı etki sürelerinden de sorumludur, bu nedenle metabolik bozulma (örn. N-dealkilasyon) opioid metabolizmasından sorumludur.
Fonksiyonel seçicilik
Yeni bir ilaç geliştirme stratejisi reseptörü alıyor sinyal iletimi dikkate almak. Bu strateji, istenmeyen yollar üzerindeki etkiyi azaltırken, istenen sinyal yollarının aktivasyonunu arttırmaya çabalar. Bu farklı stratejiye, aşağıdakiler de dahil olmak üzere birkaç isim verilmiştir: fonksiyonel seçicilik ve önyargılı agonizm. Önyargılı bir agonist olarak kasıtlı olarak tasarlanan ve içine yerleştirilen ilk opioid klinik değerlendirme ilaç mı oliceridin. Analjezik aktivite ve azaltılmış yan etkiler gösterir.[159]
Opioid karşılaştırması
Opioidlerin göreceli potansiyelini karşılaştıran eşdeğerlik oranlarını belirlemek için kapsamlı araştırmalar yapılmıştır. Bir opioid dozu verildiğinde, eşit analjezik tablo eşdeğer dozu bulmak için kullanılır. Bu tür tablolar, opioid rotasyon uygulamalarında ve bir opioidi, referans opioid olan morfin ile karşılaştırarak açıklamak için kullanılır. Eşit analjezik tabloları tipik olarak ilaç yarı ömürlerini ve bazen aynı ilacın eşit analjezik dozlarını morfin: oral ve intravenöz gibi uygulama yoluyla listeler.
Bağlama profilleri
Kullanım
| Madde | En iyi tahmin | Düşük tahmin | Yüksek tahmin |
|---|---|---|---|
| Amphetamine- type stimulants | 34.16 | 13.42 | 55.24 |
| Kenevir | 192.15 | 165.76 | 234.06 |
| Kokain | 18.20 | 13.87 | 22.85 |
| Ecstasy | 20.57 | 8.99 | 32.34 |
| Opiatlar | 19.38 | 13.80 | 26.15 |
| Opioidler | 34.26 | 27.01 | 44.54 |
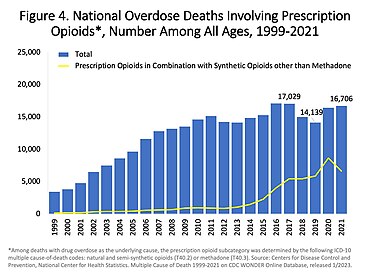
Opioid prescriptions in the US increased from 76 million in 1991 to 207 million in 2013.[176]
In the 1990s, opioid prescribing increased significantly. Once used almost exclusively for the treatment of acute pain or pain due to cancer, opioids are now prescribed liberally for people experiencing chronic pain. This has been accompanied by rising rates of accidental addiction and accidental overdoses leading to death. Göre Uluslararası Narkotik Kontrol Kurulu, the United States and Canada lead the per capita consumption of prescription opioids.[177] The number of opioid prescriptions per capita in the United States and Canada is double the consumption in the European Union, Australia, and New Zealand.[178] Certain populations have been affected by the opioid addiction crisis more than others, including İlk dünya topluluklar[179] and low-income populations.[180] Public health specialists say that this may result from the unavailability or high cost of alternative methods for addressing chronic pain.[181] Opioids have been described as a cost-effective treatment for chronic pain, but the impact of the opioid epidemic and deaths caused by opioid overdoses should be considered in assessing their cost-effectiveness.[182] Data from 2017 suggest that in the U.S. about 3.4 percent of the U.S. population are prescribed opioids for daily pain management.[183] Call for opioid deprescribing have led to broad scale opioid tapering practices with little scientific evidence to support the safety or benefit for patients with chronic pain.
Tarih
Naturally occurring opioids

Opioids are among the world's oldest known drugs.[184] The earliest known evidence of Gelincik somniferum in a human archaeological site dates to the Neolitik period around 5,700–5,500 BC. Its seeds have been found at Cueva de los Murciélagos içinde Iber Yarımadası ve La Marmotta içinde İtalyan Yarımadası.[185][186][187]
Use of the opium poppy for medical, recreational, and religious purposes can be traced to the 4th century BC, when ideograms on Sümerler clay tablets mention the use of "Hul Gil", a "plant of joy".[188][189][190]Opium was known to the Egyptians, and is mentioned in the Ebers Papirüs as an ingredient in a mixture for the soothing of children,[191][190] and for the treatment of breast abscesses.[192]
Opium was also known to the Greeks.[191]It was valued by Hipokrat (c. 460 – c. 370 BC) and his students for its sleep-inducing properties, and used for the treatment of pain.[193] The Latin saying "Sedare dolorem opus divinum est", trans. "Alleviating pain is the work of the divine", has been variously ascribed to Hippocrates and to Bergama Galeni.[194] The medical use of opium is later discussed by Pedanius Dioscorides (c. 40 – 90 AD), a Greek physician serving in the Roman army, in his five-volume work, De Materia Medica.[195]
Esnasında İslami Altın Çağı, the use of opium was discussed in detail by İbn Sina (c. 980 – June 1037 AD) in The Canon of Medicine. The book's five volumes include information on opium's preparation, an array of physical effects, its use to treat a variety of illness, contraindications for its use, its potential danger as a poison and its potential for addiction. Avicenna discouraged opium's use except as a last resort, preferring to address the causes of pain rather than trying to minimize it with analjezikler. Many of Avicenna's observations have been supported by modern medical research.[196][191]
Exactly when the world became aware of opium in India and China is uncertain, but opium was mentioned in the Chinese medical work K'ai-pao-pen-tsdo (973 AD)[190] By 1590 AD, opium poppies were a staple spring crop in the Subahs nın-nin Agra bölge.[197]
Fizikçi Paracelsus (ca.1493–1541) is often credited with reintroducing opium into medical use in Batı Avrupa, esnasında Alman Rönesansı. He extolled opium's benefits for medical use. He also claimed to have an "arcanum", a pill which he called Laudanum, that was superior to all others, particularly when death was to be cheated. ("Ich hab' ein Arcanum – heiss' ich Laudanum, ist über das Alles, wo es zum Tode reichen will.")[198] Later writers have asserted that Paracelsus' recipe for laudanum contained opium, but its composition remains unknown.[198]
Laudanum
The term laudanum was used generically for a useful medicine until the 17th century. Sonra Thomas Sydenham introduced the first liquid tincture of opium, "laudanum" came to mean a mixture of both opium and alcohol.[198]Sydenham's 1669 recipe for laudanum mixed opium with wine, saffron, clove and cinnamon.[199] Sydenham's laudanum was used widely in both Europe and the Americas until the 20th century.[191][199]Other popular medicines, based on opium, included Paregorik, a much milder liquid preparation for children; Black-drop, a stronger preparation; ve Dover'ın tozu.[199]
The opium trade
Opium became a major colonial commodity, moving legally and illegally through trade networks involving Hindistan, Portekizce, Flemenkçe, ingiliz ve Çin diğerleri arasında.[200]İngiliz Doğu Hindistan Şirketi saw the opium trade as an investment opportunity in 1683 AD.[197] In 1773 the Governor of Bengal established a monopoly on the production of Bengal opium, on behalf of the East India Company. The cultivation and manufacture of Indian opium was further centralized and controlled through a series of acts, between 1797 and 1949.[197][201] The British balanced an economic deficit from the importation of Çin çayı by selling Indian opium which was smuggled into China in defiance of Çin Hükumeti bans. Bu yol açtı İlk (1839–1842) ve İkinci Afyon Savaşları (1856–1860) between China and Britain.[202][201][200][203]
Morfin
In the 19th century, two major scientific advances were made that had far-reaching effects. Around 1804, German pharmacist Friedrich Sertürner yalıtılmış morfin from opium. He described its crystallization, structure, and pharmacological properties in a well-received paper in 1817.[202][204][199][205]Morphine was the first alkaloit to be isolated from any medicinal plant, the beginning of modern scientific drug discovery.[202][206]
The second advance, nearly fifty years later, was the refinement of the hipodermik iğne tarafından Alexander Wood ve diğerleri. Development of a glass syringe with a subcutaneous needle made it possible to easily administer controlled measurable doses of a primary active compound.[207][199][190][208][209]
Morphine was initially hailed as a wonder drug for its ability to ease pain.[210] It could help people sleep,[202] and had other useful side effects, including control of öksürme ve ishal.[211] It was widely prescribed by doctors, and dispensed without restriction by pharmacists. Esnasında Amerikan İç Savaşı, opium and laudanum were used extensively to treat soldiers.[212][210] It was also prescribed frequently for women, for menstrual pain and diseases of a "nervous character".[213]:85At first it was assumed (wrongly) that this new method of application would not be addictive.[202][213]
Kodein
Kodein was discovered in 1832 by Pierre Jean Robiquet. Robiquet was reviewing a method for morphine extraction, described by Scottish chemist William Gregory (1803–1858). Processing the residue left from Gregory's procedure, Robiquet isolated a crystalline substance from the other active components of opium. He wrote of his discovery: "Here is a new substance found in opium ... We know that morphine, which so far has been thought to be the only active principle of opium, does not account for all the effects and for a long time the physiologists are claiming that there is a gap that has to be filled."[214] His discovery of the alkaloid led to the development of a generation of antitussive and antidiarrheal medicines based on codeine.[215]
Semisynthetic and synthetic opioids
Synthetic opioids were invented, and biological mechanisms for their actions discovered, in the 20th century.[190] Scientists have searched for non-addictive forms of opioids, but have created stronger ones instead. İngiltere'de Charles Romley Alder Wright developed hundreds of opiate compounds in his search for a nonaddictive opium derivative. In 1874 he became the first person to synthesize diamorfin (heroin), using a process called asetilasyon which involved boiling morphine with asetik anhidrit Birkaç saatliğine.[202]
Heroin received little attention until it was independently synthesized by Felix Hoffmann (1868–1946), working for Heinrich Dreser (1860–1924) at Bayer Laboratuvarlar.[216] Dreser brought the new drug to market as an analjezik and a cough treatment for tüberküloz, bronşit, ve astım in 1898. Bayer ceased production in 1913, after heroin's addictive potential was recognized.[202][217][218]
Several semi-synthetic opioids were developed in Germany in the 1910s. İlk, oksimorfon, was synthesized from Thebaine, an opioid alkaloid in opium poppies, in 1914.[219]Next, Martin Freund and Edmund Speyer developed oksikodon, also from thebaine, at the University of Frankfurt in 1916.[220]1920'de, hidrokodon tarafından hazırlandı Carl Mannich ve Helene Löwenheim, deriving it from codeine. 1924'te, hidromorfon was synthesized by adding hydrogen to morphine. Etorfin was synthesized in 1960, from the Oripavine in opium poppy straw. Buprenorfin was discovered in 1972.[219]
The first fully synthetic opioid was meperidin (later demerol), found serendipitously by German chemist Otto Eisleb (or Eislib) at IG Farben 1932'de.[219] Meperidine was the first opiate to have a structure unrelated to morphine, but with opiate-like properties.[190] Its analgesis effects were discovered by Otto Schaumann in 1939.[219]Gustav Ehrhart ve Max Bockmühl, also at IG Farben,built on the work of Eisleb and Schaumann. They developed "Hoechst 10820" (later metadon ) around 1937.[221]In 1959 the Belgian physician Paul Janssen gelişmiş fentanil, a synthetic drug with 30 to 50 times the potency of heroin.[202][222]Nearly 150 synthetic opioids are now known.[219]
Criminalization and medical use
Non-clinical use of opium was criminalized in the United States by the Harrison Narkotik Vergi Yasası of 1914, and by many other laws.[223][224] The use of opioids was stigmatized, and it was seen as a dangerous substance, to be prescribed only as a last resort for dying patients.[202] Kontrollü Maddeler Yasası of 1970 eventually relaxed the harshness of the Harrison Act.[kaynak belirtilmeli ]
In the United Kingdom the 1926 report of the Departmental Committee on Morfin and Heroin Bağımlılık under the Chairmanship of the President of the Royal College of Physicians reasserted medical control and established the "British system" of control—which lasted until the 1960s.[225]
In the 1980s the World Health Organization published guidelines for prescribing drugs, including opioids, for different levels of pain. In the U.S., Kathleen Foley and Russell Portenoy became leading advocates for the liberal use of opioids as painkillers for cases of "intractable non-malignant pain".[226][227]With little or no scientific evidence to support their claims, industry scientists and advocates suggested that chronic pain sufferers would be resistant to addiction.[202][228][226]
Serbest bırakılması OxyContin in 1996 was accompanied by an aggressive marketing campaign promoting the use of opioids for pain relief. Increasing prescription of opioids fueled a growing black market for heroin. Between 2000 and 2014 there was an "alarming increase in heroin use across the country and an epidemic of drug overdose deaths".[228][202][229]
As a result, health care organizations and public health groups, such as Physicians for Responsible Opioid Prescribing, have called for decreases in the prescription of opioids.[228] In 2016, the Centers for Disease Control and Prevention (CDC) issued a new set of guidelines for the prescription of opioids "for chronic pain outside of active cancer treatment, palliative care, and end-of-life care" and the increase of opioid tapering.[230]
"Remove the Risk"
In April 2019 the U.S. Gıda ve İlaç İdaresi announced the launch of a new education campaign to help Americans understand the important role they play in removing and properly disposing of unused prescription opioids from their homes. This new initiative is part of the FDA's continued efforts to address the nationwide opioid krizi (see below) and aims to help decrease unnecessary exposure to opioids and prevent new addiction. “Remove the Risk” campaign is targeting women ages 35–64, who are most likely to oversee household health care decisions and often serve as the gatekeepers to opioids and other prescription medications in the home.[231]
Toplum ve kültür
Tanım
The term "opioid" originated in the 1950s.[232] It combines "opium" + "-oid" meaning "opiate-like" ("opiates" being morphine and similar drugs derived from afyon ). The first scientific publication to use it, in 1963, included a footnote stating, "In this paper, the term, 'opioid', is used in the sense originally proposed by George H. Acheson (personal communication) to refer to any chemical compound with morphine-like activities".[233] By the late 1960s, research found that opiate effects are mediated by activation of specific molecular receptors in the nervous system, which were termed "opioid receptors".[234] The definition of "opioid" was later refined to refer to substances that have morphine-like activities that are mediated by the activation of opioid receptors. One modern pharmacology textbook states: "the term opioid applies to all agonists and antagonists with morphine-like activity, and also the naturally occurring and synthetic opioid peptides".[235] Another pharmacology reference eliminates the morphine-like requirement: "Opioid, a more modern term, is used to designate all substances, both natural and synthetic, that bind to opioid receptors (including antagonists)".[2] Some sources define the term opioid dışlamak opiatlar, and others use afyon comprehensively instead of opioid, fakat opioid used inclusively is considered modern, preferred and is in wide use.[18]
Efforts to reduce abuse in the US
In 2011, the Obama administration released a white paper describing the administration's plan to deal with the opioid krizi. The administration's concerns about addiction and accidental overdosing have been echoed by numerous other medical and government advisory groups around the world.[181][236][237][238]
As of 2015, prescription drug monitoring programs exist in every state, except for Missouri.[239] These programs allow pharmacists and prescribers to access patients' prescription histories in order to identify suspicious use. However, a survey of US physicians published in 2015 found that only 53% of doctors used these programs, while 22% were not aware that the programs were available to them.[240] Hastalık Kontrol ve Önleme Merkezleri was tasked with establishing and publishing a new guideline, and was heavily lobbied.[241] In 2016, the United States Hastalık Kontrol ve Önleme Merkezleri published its Guideline for Prescribing Opioids for Chronic Pain, recommending that opioids only be used when benefits for pain and function are expected to outweigh risks, and then used at the lowest effective dosage, with avoidance of concurrent opioid and benzodiazepine use whenever possible.[32] Research suggests that the prescription of high doses of opioids related to chronic opioid therapy (COT) can at times be prevented through state legislative guidelines and efforts by health plans that devote resources and establish shared expectations for reducing higher doses.[242]
On 10 August 2017, Donald Trump declared the opioid crisis a (non-FEMA) national public health emergency.[243]
Global shortages
Morfin and other poppy-based medicines have been identified by the World Health Organization as essential in the treatment of severe pain. As of 2002, seven countries (USA, UK, Italy, Australia, France, Spain and Japan) use 77% of the world's morfin supplies, leaving many emerging countries lacking in pain relief medication.[244] The current system of supply of raw poppy materials to make poppy-based medicines is regulated by the Uluslararası Narkotik Kontrol Kurulu under the provision of the 1961 Narkotik İlaçlara İlişkin Tek Sözleşme. The amount of raw poppy materials that each country can demand annually based on these provisions must correspond to an estimate of the country's needs taken from the national consumption within the preceding two years. In many countries, underprescription of morphine is rampant because of the high prices and the lack of training in the prescription of poppy-based drugs. Dünya Sağlık Örgütü is now working with administrations from various countries to train healthworkers and to develop national regulations regarding drug prescription to facilitate a greater prescription of poppy-based medicines.[245]
Another idea to increase morphine availability is proposed by the Senlis Konseyi, who suggest, through their proposal for Afghan Morphine, bu Afganistan could provide cheap pain relief solutions to emerging countries as part of a second-tier system of supply that would complement the current INCB regulated system by maintaining the balance and closed system that it establishes while providing finished product morphine to those suffering from severe pain and unable to access poppy-based drugs under the current system.
Eğlence amaçlı kullanım
Opioids can produce strong feelings of öfori[246] and are frequently used recreationally. Traditionally associated with illicit opioids such as heroin, prescription opioids are misused recreationally.
Drug misuse and non-medical use include the use of drugs for reasons or at doses other than prescribed. Opioid misuse can also include providing medications to persons for whom it was not prescribed. Such diversion may be treated as crimes, punishable by imprisonment in many countries.[247][248] In 2014, almost 2 million Americans abused or were dependent on prescription opioids.[249]
Sınıflandırma
Bu bölüm için ek alıntılara ihtiyaç var doğrulama. (Ağustos 2011) (Bu şablon mesajını nasıl ve ne zaman kaldıracağınızı öğrenin) |
There are a number of broad classes of opioids:[kaynak belirtilmeli ]
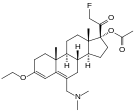
- Doğal opiatlar: alkaloidler contained in the resin of the Haşhaş, öncelikle morfin, kodein, ve Thebaine, Ama değil papaverin ve burun which have a different mechanism of action; The following could be considered natural opiates: The leaves from Mitragyna speciosa (Ayrıca şöyle bilinir Kratom ) contain a few naturally-occurring opioids, active via Mu- and Delta receptors. Salvinorin A, found naturally in the Salvia divinorum plant, is a kappa-opioid receptor agonist.[250]
- Esters of morphine opiates: slightly chemically altered but more natural than the semi-synthetics, as most are morphine prodrugs, diasetilmorfin (morphine diacetate; heroin), nicomorphine (morphine dinicotinate), dipropanoylmorphine (morphine dipropionate), desomorphine, acetylpropionylmorphine, dibenzoylmorphine, diacetyldihydromorphine;[251][252]
- Semi-synthetic opioids: created from either the natural opiates or morphine esters, such as hidromorfon, hidrokodon, oksikodon, oksimorfon, ethylmorphine ve buprenorfin;
- Fully synthetic opioids: gibi fentanil, petidin, levorfanol, metadon, Tramadol, tapentadol, ve dekstropropoksifen;
- Endojen opioid peptidler, produced naturally in the body, such as endorfinler, Enkefalinler, dinorfinler, ve endomorphins. Morphine, and some other opioids, which are produced in small amounts in the body, are included in this category.
Tramadol ve tapentadol, which act as monoamine uptake inhibitors also act as mild and potent agonistler (respectively) of the μ-opioid reseptörü.[253] Both drugs produce analjezi ne zaman nalokson, an opioid antagonist, is administered.[254]
Some minor opium alkaloidler and various substances with opioid action are also found elsewhere, including molecules present in Kratom, Corydalis, ve Salvia divinorum plants and some species of poppy aside from Gelincik somniferum. There are also strains which produce copious amounts of thebaine, an important raw material for making many semi-synthetic and synthetic opioids. Of all of the more than 120 poppy species, only two produce morphine.
Amongst analgesics there are a small number of agents which act on the central nervous system but not on the opioid receptor system and therefore have none of the other (narcotic) qualities of opioids although they may produce euphoria by relieving pain—a euphoria that, because of the way it is produced, does not form the basis of habituation, physical dependence, or addiction. Foremost amongst these are nefopam, orfenadrin ve belki feniltoloksamin veya bir başkası antihistaminikler. Trisiklik antidepresanlar have painkilling effect as well, but they're thought to do so by indirectly activating the endogenous opioid system. Paracetamol is predominantly a centrally acting analgesic (non-narcotic) which mediates its effect by action on descending serotoninergic (5-hydroxy triptaminergic) pathways, to increase 5-HT release (which inhibits release of pain mediators). It also decreases cyclo-oxygenase activity. It has recently been discovered that most or all of the therapeutic efficacy of paracetamol is due to a metabolite, AM404, which enhances the release of serotonin and inhibits the uptake of Anandamid.[kaynak belirtilmeli ]
Other analgesics work peripherally (yani, not on the brain or spinal cord). Research is starting to show that morphine and related drugs may indeed have peripheral effects as well, such as morphine gel working on burns. Recent investigations discovered opioid receptors on peripheral sensory neurons.[255] A significant fraction (up to 60%) of opioid analgesia can be mediated by such peripheral opioid receptors, particularly in inflammatory conditions such as arthritis, traumatic or surgical pain.[256] Inflammatory pain is also blunted by endogenous opioid peptides activating peripheral opioid receptors.[257]
It was discovered in 1953,[kaynak belirtilmeli ] that humans and some animals naturally produce minute amounts of morphine, codeine, and possibly some of their simpler derivatives like heroin and dihidromorfin, in addition to endogenous opioid peptides. Some bacteria are capable of producing some semi-synthetic opioids such as hidromorfon ve hidrokodon when living in a solution containing morphine or codeine respectively.
Birçok alkaloidler and other derivatives of the opium poppy are not opioids or narcotics; the best example is the smooth-muscle relaxant papaverin. Noscapine is a marginal case as it does have CNS effects but not necessarily similar to morphine, and it is probably in a category all its own.
Dekstrometorfan (the stereoisomer of Levometorfan, a semi-synthetic opioid agonist) and its metabolite dekstrorfan have no opioid analgesic effect at all despite their structural similarity to other opioids; instead they are potent NMDA antagonists ve sigma 1 and 2 -receptor agonists and are used in many tezgahın üzerinden cough suppressants.
Salvinorin A is a unique selective, powerful ĸ-opioid receptor agonist. It is not properly considered an opioid nevertheless, because:
- chemically, it is not an alkaloid; ve
- it has no typical opioid properties: absolutely no anxiolytic or cough-suppressant effects. It is instead a powerful halüsinojen.
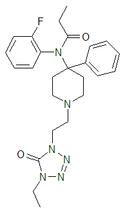
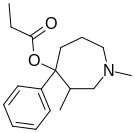
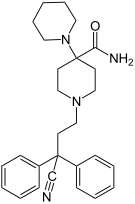
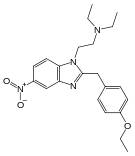
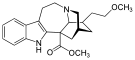
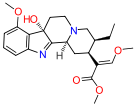
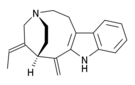
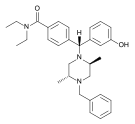
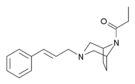
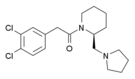
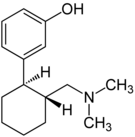
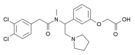
| Opioid peptitler | Skeletal molecular images |
|---|---|
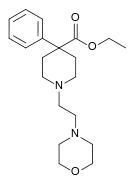
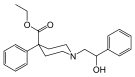
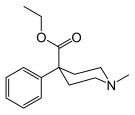
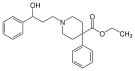
| Adrenorfin |  |
| Amidorfin |  |
| Casomorfin | |
| BABA | |
| DAMGO |  |
| Dermorfin | |
| Endomorfin |  |
| Morfikeptin |  |
| Nosiseptin |  |
| Oktreotid |  |
| Opiyorfin |  |
| TRIMU 5 |  |
Endojen opioidler
Opioid-peptidler that are produced in the body include:
β-endorphin olarak ifade edilir Pro-opiomelanokortin (POMC) cells in the kavisli çekirdek, içinde beyin sapı and in immune cells, and acts through μ-opioid reseptörleri. β-endorphin has many effects, including on cinsel davranış ve iştah. β-endorphin is also secreted into the circulation from pituitary kortikotroplar ve melanotropes. α-neo-endorfin is also expressed in POMC cells in the arcuate nucleus.
met-enkefalin is widely distributed in the CNS and in immune cells; [met]-enkephalin is a product of the proenkephalin gene, and acts through μ and δ-opioid reseptörleri. leu-enkephalin, also a product of the proenkephalin gene, acts through δ-opioid receptors.
Dinorfin acts through κ-opioid reseptörleri, and is widely distributed in the CNS, including in the omurilik ve hipotalamus, including in particular the kavisli çekirdek and in both oksitosin ve vazopressin nöronlar supraoptik çekirdek.
Endomorfin acts through μ-opioid receptors, and is more potent than other endogenous opioids at these receptors.
Opium alkaloids and derivatives
Afyon alkaloidleri
Fenantrenler naturally occurring in (afyon ):
Preparations of mixed opium alkaloidler, dahil olmak üzere papaveretum, are still occasionally used.
Esters of morphine
- Diasetilmorfin (morphine diacetate; heroin)
- Nikomorfin (morphine dinicotinate)
- Dipropanoilmorfin (morphine dipropionate)
- Diasetildihidromorfin
- Asetilpropionilmorfin
- Desomorfin
- Metildesorfin
- Dibenzoilmorfin
Ethers of morphine
Semi-synthetic alkaloid derivatives
- Buprenorfin
- Etorfin
- Hidrokodon
- Hidromorfon
- Oksikodon (sold as OxyContin)
- Oksimorfon
Synthetic opioids
Anilidopiperidinler
Phenylpiperidines
Diphenylpropylamine derivatives
- Propoksifen
- Dekstropropoksifen
- Dekstromoramid
- Bezitramid
- Piritramid
- Metadon
- Dipipanon
- Levomethadyl Acetate (LAAM)
- Difenoksin
- Difenoksilat
- Loperamide (does cross the blood-brain barrier but is quickly pumped into the non-central nervous system by P-Glycoprotein. Mild opiate withdrawal in animal models exhibits this action after sustained and prolonged use including rhesus monkeys, mice, and rats.)
Benzomorphan derivatives
- Dezosin —agonist/antagonist
- Pentazosin —agonist/antagonist
- Fenazosin
Oripavin türevleri
- Buprenorfin —partial agonist
- Dihidroetorfin
- Etorfin
Morphinan derivatives
- Butorfanol —agonist/antagonist
- Nalbuphine —agonist/antagonist
- Levorfanol
- Levomethorphan
- Racemethorphan
Diğerleri
Allosteric modulators
Sade allosterik modülatörler do not belong to the opioids, instead they are classified as opioiderjikler.
Opioid antagonistleri
- Nalmefene
- Nalokson
- Naltrekson
- Metilnaltrekson (Methylnaltrexone is only peripherally active as it does not cross the blood-brain barrier in sufficient quantities to be centrally active. As such, it can be considered the antithesis of loperamid.)
- Naloxegol (Naloxegol is only peripherally active as it does not cross the blood-brain barrier in sufficient quantities to be centrally active. As such, it can be considered the antitheses of loperamid.)
Tables of opioids
Table of morphinan opioids
| Table of morphinan opioids: click to | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Table of non-morphinan opioids
| Table of non-morphinan opioids: click to | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ayrıca bakınız
Referanslar
- ^ Ogura T, Egan TD (2013). "Bölüm 15 - Opioid Agonistleri ve Antagonistleri". Anestezi için farmakoloji ve fizyoloji: temeller ve klinik uygulama. Philadelphia, PA: Elsevier / Saunders. ISBN 978-1-4377-1679-5.
- ^ a b Hemmings HC, Egan TD (2013). Anestezi için Farmakoloji ve Fizyoloji: Temeller ve Klinik Uygulama: Uzman Danışman - Çevrimiçi ve Basılı. Elsevier Sağlık Bilimleri. s. 253. ISBN 978-1437716795.
Opiat, klasik olarak farmakolojide afyondan türetilen bir ilacı ifade etmek için kullanılan eski terimdir. Daha modern bir terim olan opioid, opioid reseptörlerine (antagonistler dahil) bağlanan hem doğal hem de sentetik tüm maddeleri belirtmek için kullanılır.
- ^ a b Stromgaard K, Krogsgaard-Larsen P, Madsen U (2009). İlaç Tasarımı ve Keşfi Ders Kitabı, Dördüncü Baskı. CRC Basın. ISBN 9781439882405.
- ^ Walzer C (2014). "52 Yerli Olmayan Eşitlik". West G, Heard D, Caulkett N (editörler). Hayvanat Bahçesi Hayvanları ve Yaban Hayatı Hareketsizleştirme ve Anestezi. Kanada Veteriner Dergisi. 51 (2. baskı). Ames, ABD: John Wiley & Sons. s. 723, 727. doi:10.1002/9781118792919. ISBN 9781118792919. PMC 2871358. Alındı 8 Temmuz 2019.
- ^ "Carfentanil". www.drugbank.ca. Alındı 8 Temmuz 2019.
- ^ Sterken J, Troubleyn J, Gasthuys F, Maes V, Diltoer M, Verborgh C (Ekim 2004). "Büyük Hayvan İmmobilon'unun kasıtlı aşırı doz". Avrupa Acil Tıp Dergisi. 11 (5): 298–301. doi:10.1097/00063110-200410000-00013. PMID 15359207.
- ^ Lembke A (2016). Uyuşturucu Satıcısı, MD: Doktorlar Nasıl Kandırıldı, Hastalar Bağlandı ve Durdurmak Neden Bu Kadar Zor?. Johns Hopkins Üniversitesi Yayınları. ISBN 978-1421421407.
- ^ "İlaç Gerçekleri: Reçeteyle Satılan Opioidler". NIDA. Haziran 2019. Arşivlendi 12 Haziran 2019 tarihinde orjinalinden. Alındı 5 Temmuz 2019.
- ^ "FDA, kombine kullanımdan kaynaklanan ciddi riskler ve ölümle ilgili opioid analjezikler, reçeteli opioid öksürük ürünleri ve benzodiazepin etiketlemesi için güçlü uyarılar gerektirir". FDA. 31 Ağustos 2016. Alındı 1 Eylül 2016.
- ^ Parthvi R, Agrawal A, Khanijo S, Tsegaye A, Talwar A (Mayıs-Haziran 2019). "Akut Afyon Aşırı Dozu: Acil Servis ve Yoğun Bakım Ünitesinde Yönetim Stratejileri Üzerine Bir Güncelleme". American Journal of Therapeutics. 26 (3): e380 – e387. doi:10.1097 / MJT.0000000000000681. PMID 28952972. S2CID 24720660.
- ^ "İllict Durum ve Trend Analizi [sic] İlaç Pazarları " (PDF). Dünya Uyuşturucu Raporu 2015. Alındı 26 Haziran 2015.
- ^ "Rapor III: Opiyat Bağımlılığının Tedavisine Yönelik FDA Onaylı İlaçlar: Etkililik ve Maliyet Etkinliği Üzerine Literatür İncelemeleri, Tedavi Araştırma Enstitüsü". Bağımlılık İlaçlarına Erişimi Geliştirme: Opioid Bağımlılığı Tedavisinin Etkileri. s. 41.
- ^ Tetrault JM, Butner JL (Eylül 2015). "Tıbbi Olmayan Reçeteli Opioid Kullanımı ve Reçeteli Opioid Kullanım Bozukluğu: Bir İnceleme". Yale Biyoloji ve Tıp Dergisi. 88 (3): 227–33. PMC 4553642. PMID 26339205.
- ^ Tarabar AF, Nelson LS (Nisan 2003). "Amerika Birleşik Devletleri'nde çocuklar tarafından eroinin yeniden dirilmesi ve kötüye kullanılması". Pediatride Güncel Görüş. 15 (2): 210–5. doi:10.1097/00008480-200304000-00013. PMID 12640281. S2CID 21900231.
- ^ Grey E (4 Şubat 2014). "ABD'ye Ucuz Doz Selü Verdikçe Eroin Popülerlik Kazanıyor". TIME.com. Alındı 12 Şubat 2016.
- ^ Maltoni M (Ocak 2008). "Opioidler, ağrı ve korku". Onkoloji Yıllıkları. 19 (1): 5–7. doi:10.1093 / annonc / mdm555. PMID 18073220.
[A] bir dizi çalışma, yine de hastaların% 40-70'inde yetersiz ağrı kontrolü bildirmiş ve bu da, engelleyen bir dizi engelin neden olduğu 'başarısız ağrı kontrolü' gibi yeni bir epidemiyoloji türünün ortaya çıkmasına neden olmuştur. yeterli kanser ağrısı yönetimi .... Kanser hastası, iki tür kullanıma (terapötik veya terapötik olmayan) ilişkin normlar açıkça farklı değilse, opioid kötüye kullanımı ve bağımlılığına karşı yürütülen bir savaşın masum kurbanı olma riskini taşır. Dahası, sağlık uzmanları düzenleyici incelemeler konusunda endişeli olabilir ve bu nedenle opioid tedavisini kullanmamayı tercih edebilir.
- ^ McCarberg BH (Mart 2011). "Birinci basamakta ağrı yönetimi: opioid kötüye kullanımını, kötüye kullanımını ve saptırmayı azaltmaya yönelik stratejiler". Lisansüstü Tıp. 123 (2): 119–30. doi:10.3810 / pgm.2011.03.2270. PMID 21474900. S2CID 25935364.
- ^ a b c Offermanns S (2008). Moleküler Farmakoloji Ansiklopedisi. 1 (2 ed.). Springer Science & Business Media. s. 903. ISBN 9783540389163.
Tam anlamıyla, opiatlar afyondan türetilen ilaçlardır ve morfin, kodein, tebain ve bunlardan türetilen birçok yarı sentetik türdeş doğal ürünleri içerir. Daha geniş anlamda, opiatlar, peptidik olmayan yapılara sahip morfin benzeri ilaçlardır. Daha eski olan opiatlar terimi, artık opioid reseptörleri üzerinde etki yoluyla morfin benzeri etkiler üreten, endojen veya sentetik, peptidik veya peptidik olmayan herhangi bir maddeye uygulanan opioidler terimi ile giderek daha fazla yer değiştirmektedir.
- ^ Freye E (2008). "Bölüm II. Opioidlerin etki mekanizması ve klinik etkileri". Tıpta Opioidler: Etki Moduna ve Farklı Klinik Ağrı Durumlarında Analjeziklerin Kullanımına Dair Kapsamlı Bir İnceleme. Springer Science & Business Media. s. 85. ISBN 9781402059476.
Afyon, haşhaş suyundan elde edilen ilaçları (doğal ve yarı sentetik) tanımlamak için kullanılan özel bir terimdir. Örneğin morfin bir afyondur, ancak metadon (tamamen sentetik bir ilaç) değildir. Opioid, doğal olarak oluşan, yarı sentetik ve sentetik ilaçları içeren, etkilerini opioid reseptörleri ile birleşerek üreten ve nalakson ile rekabetçi bir şekilde antagonize edilen genel bir terimdir. Bu bağlamda opioid terimi, opioid agonistleri, opioid antagonistleri, opioid peptidleri ve opioid reseptörlerini ifade eder.
- ^ Davies PS, D'Arcy YM (26 Eylül 2012). Kanser Ağrısı Yönetimi için Kompakt Klinik Kılavuz: Hemşireler için Kanıta Dayalı Bir Yaklaşım. Springer Yayıncılık Şirketi. ISBN 9780826109743.
- ^ "21 ABD Kodu § 802 - Tanımlar". LII / Yasal Bilgi Enstitüsü. Alındı 12 Şubat 2016.
- ^ "NARCOTIC Tanımı". www.merriam-webster.com. Alındı 12 Şubat 2016.
- ^ Satoskar RS, Rege N, Bhandarkar SD (2015). Farmakoloji ve Farmakoterapötikler. Elsevier Sağlık Bilimleri. ISBN 9788131243718.
- ^ Ebert MH, Kerns RD (2010). Davranışsal ve Psikofarmakolojik Ağrı Yönetimi. Cambridge University Press. ISBN 9781139493543.
- ^ Moore RA, Wiffen PJ, Derry S, Maguire T, Roy YM, Tyrrell L (Kasım 2015). "Akut ağrı için reçetesiz (OTC) oral analjezikler - Cochrane incelemelerine genel bakış". Sistematik İncelemelerin Cochrane Veritabanı. 11 (11): CD010794. doi:10.1002 / 14651858.CD010794.pub2. PMC 6485506. PMID 26544675.
- ^ a b Fleisher GR, Ludwig S (2010). Pediatrik Acil Tıp Ders Kitabı. Lippincott Williams ve Wilkins. s. 61. ISBN 9781605471594.
- ^ Alexander GC, Kruszewski SP, Webster DW (Kasım 2012). "Hasta güvenliğini ve halk sağlığını korumak için opioid reçetesini yeniden düşünmek". JAMA. 308 (18): 1865–6. doi:10.1001 / jama.2012.14282. PMID 23150006.
- ^ Muhammed A, Chan JJ, Lian J, Wright CL, Marin AM, Rodriguez EK, ve diğerleri. (Ağustos 2018). "Travma veya Cerrahiden Sonra Uzun Süreli Opioid Kullanımının Risk Faktörleri ve Havuzlanmış Oranı: Sistematik Bir İnceleme ve Meta (Regresyon) Analizi". Kemik ve Eklem Cerrahisi Dergisi. Amerikan Hacmi. 100 (15): 1332–1340. doi:10.2106 / JBJS.17.01239. PMID 30063596. S2CID 51891341.
- ^ Davis, Corey S .; Lieberman, Amy Judd; Hernandez-Delgado, Hector; Suba, Carli (1 Ocak 2019). "Amerika Birleşik Devletleri'nde akut ağrı için opioidlerin reçetelenmesini veya verilmesini sınırlayan yasalar: Ulusal sistematik yasal inceleme". Uyuşturucu ve Alkol Bağımlılığı. 194: 166–172. doi:10.1016 / j.drugalcdep.2018.09.022. ISSN 1879-0046. PMID 30445274.
- ^ Franklin GM (Eylül 2014). "Kronik kanser dışı ağrı için opioidler: Amerikan Nöroloji Akademisi'nin bir konum raporu". Nöroloji. 83 (14): 1277–84. doi:10.1212 / WNL.0000000000000839. PMID 25267983.
- ^ a b Okie S (Kasım 2010). "Opioid seli, yükselen ölüm dalgası". New England Tıp Dergisi. 363 (21): 1981–5. doi:10.1056 / NEJMp1011512. PMID 21083382. S2CID 7092234.
Okie'nin bakış açısına verilen yanıtlar: Rich JD, Green TC, McKenzie MS (Şubat 2011). "Opioidler ve ölümler". New England Tıp Dergisi. 364 (7): 686–687. doi:10.1056 / NEJMc1014490. PMID 21323559. - ^ a b Dowell D, Haegerich TM, Chou R (Nisan 2016). "Kronik Ağrı için Opioid Reçetelenmesine Yönelik CDC Rehberi - Amerika Birleşik Devletleri, 2016". JAMA. 315 (15): 1624–45. doi:10.1001 / jama.2016.1464. PMC 6390846. PMID 26977696.
- ^ McNicol E, Strassels SA, Goudas L, Lau J, Carr DB (Ocak 2005). McNicol ED (ed.). "NSAIDS veya parasetamol, tek başına veya opioidlerle birlikte kanser ağrısı için". Sistematik İncelemelerin Cochrane Veritabanı (1): CD005180. doi:10.1002 / 14651858.CD005180. PMID 15654708. (Geri çekilmiş, bakınız doi:10.1002 / 14651858.cd005180.pub2. Bu, geri çekilmiş bir makaleye kasıtlı bir alıntı ise, lütfen değiştirin
{{Geri çekildi}}ile{{Geri çekildi| kasıtlı = evet}}.) - ^ a b Opioidlerin migren tedavisinde kullanımı ve aşırı kullanımı hakkında bilgi için bkz. Amerikan Nöroloji Akademisi (Şubat 2013), "Hekimlerin ve Hastaların Sorgulaması Gereken Beş Şey", Akıllıca Seçmek: bir girişimi ABIM Vakfı, Amerikan Nöroloji Akademisi, alındı 1 Ağustos 2013, hangi alıntı
- Silberstein SD (Eylül 2000). "Uygulama parametresi: migren baş ağrısı için kanıta dayalı kılavuzlar (kanıta dayalı bir inceleme): Amerikan Nöroloji Akademisi Kalite Standartları Alt Komitesi raporu". Nöroloji. 55 (6): 754–62. doi:10.1212 / WNL.55.6.754. PMID 10993991.
- Evers S, Afra J, Frese A, Goadsby PJ, Linde M, Mayıs A, chessdor PS (Eylül 2009). "Migrenin ilaç tedavisi üzerine EFNS kılavuzu - bir EFNS görev gücünün gözden geçirilmiş raporu". Avrupa Nöroloji Dergisi. 16 (9): 968–81. doi:10.1111 / j.1468-1331.2009.02748.x. PMID 19708964.
- Klinik Sistem İyileştirme Enstitüsü (2011), Baş Ağrısı, Tanı ve Tedavisi, Klinik Sistem İyileştirme Enstitüsü, arşivlenen orijinal 29 Ekim 2013 tarihinde, alındı 18 Aralık 2013
- ^ Painter JT, Crofford LJ (Mart 2013). "Fibromiyalji sendromunda kronik opioid kullanımı: klinik bir inceleme". Klinik Romatoloji Dergisi. 19 (2): 72–7. doi:10.1097 / RHU.0b013e3182863447. PMID 23364665.
- ^ McNicol ED, Midbari A, Eisenberg E (Ağustos 2013). "Nöropatik ağrı için opioidler". Sistematik İncelemelerin Cochrane Veritabanı. 8 (8): CD006146. doi:10.1002 / 14651858.CD006146.pub2. PMC 6353125. PMID 23986501.
- ^ a b c Amerikan Baş Ağrısı Derneği (Eylül 2013), "Hekimlerin ve Hastaların Sorgulaması Gereken Beş Şey", Akıllıca Seçmek: bir girişimi ABIM Vakfı, Amerikan Baş Ağrısı Derneği, dan arşivlendi orijinal 3 Aralık 2013 tarihinde, alındı 10 Aralık 2013, hangi alıntı
- Bigal ME, Lipton RB (Nisan 2009). "Aşırı opioid kullanımı ve kronik migren gelişimi". Ağrı. 142 (3): 179–82. doi:10.1016 / j.pain.2009.01.013. PMID 19232469. S2CID 27949021.
- Bigal ME, Serrano D, Buse D, Scher A, Stewart WF, Lipton RB (Eylül 2008). "Akut migren ilaçları ve epizodikten kronik migrene evrim: uzunlamasına popülasyon tabanlı bir çalışma". Baş ağrısı. 48 (8): 1157–68. doi:10.1111 / j.1526-4610.2008.01217.x. PMID 18808500.
- Scher AI, Stewart WF, Ricci JA, Lipton RB (Kasım 2003). "Nüfusa dayalı bir çalışmada kronik günlük baş ağrısının başlangıcı ve gerilemesi ile ilişkili faktörler". Ağrı. 106 (1–2): 81–9. doi:10.1016 / S0304-3959 (03) 00293-8. PMID 14581114. S2CID 29000302.
- Katsarava Z, Schneeweiss S, Kurth T, Kroener U, Fritsche G, Eikermann A, ve diğerleri. (Mart 2004). "Epizodik migren hastalarında baş ağrısının kronikliği için insidans ve prediktörler". Nöroloji. 62 (5): 788–90. doi:10.1212 / 01.WNL.0000113747.18760.D2. PMID 15007133. S2CID 20759425.
- ^ Manchikanti L, Helm S, Fellows B, Janata JW, Pampati V, Grider JS, Boswell MV (Temmuz 2012). "Birleşik Devletler'de opioid salgını". Ağrı Hekimi. 15 (3 Ek): ES9-38. PMID 22786464.
- ^ Chou R, Ballantyne JC, Fanciullo GJ, Fine PG, Miaskowski C (Şubat 2009). "Kronik kanser dışı ağrı için opioid kullanımına ilişkin araştırma boşlukları: Amerikan Ağrı Derneği ve Amerikan Ağrı Tıp Akademisi klinik uygulama kılavuzuna ilişkin kanıtların gözden geçirilmesinden elde edilen bulgular". Acı Dergisi. 10 (2): 147–59. doi:10.1016 / j.jpain.2008.10.007. PMID 19187891.
- ^ "AĞRI". Painjournalonline.com. 1 Eylül 2015. Alındı 7 Ocak 2016.
- ^ Kissin I (28 Eylül 2015). "Kronik habis olmayan ağrının uzun vadeli opioid tedavisi: kanıtlanmamış etkinlik ve ihmal edilmiş güvenlik?". Ağrı Araştırmaları Dergisi. 6: 513–29. doi:10.2147 / JPR.S47182. PMC 3712997. PMID 23874119.
- ^ Dhalla IA, Gomes T, Mamdani MM, Juurlink DN (Ocak 2012). "Kanser dışı ağrıda opioidlere karşı nonsteroid antiinflamatuar ilaçlar". Kanadalı Aile Hekimi. 58 (1): 30. PMC 3264005. PMID 22267615.
- ^ Marret E, Beloeil H, Lejus C (Mart 2009). "[Opioid olmayan analjeziklerin postoperatif opioidlerle kombine edilmesinin yararları ve riskleri nelerdir?]". Annales Françaises d'Anesthésie et de Réanimation. 28 (3): e135-51. doi:10.1016 / j.annfar.2009.01.006. PMID 19304445.
- ^ Franceschi F, Iacomini P, Marsiliani D, Cordischi C, Antonini EF, Alesi A, ve diğerleri. (Ağustos 2013). "Farklı kaynaklı ağrıların tedavisinde asetaminofen-kodein kombinasyonunun güvenliği ve etkinliği" (PDF). Tıp ve Farmakolojik Bilimler için Avrupa İncelemesi. 17 (16): 2129–35. PMID 23893177.
- ^ Chung KF, Widdicombe J (2008). Öksürüğün farmakolojisi ve terapötikleri. Berlin: Springer. s. 248. ISBN 9783540798422.
- ^ Bolser DC, Davenport PW (Şubat 2007). "Kodein ve öksürük: etkisiz bir altın standart". Alerji ve Klinik İmmünolojide Güncel Görüş. 7 (1): 32–6. doi:10.1097 / ACI.0b013e3280115145. PMC 2921574. PMID 17218808.
- ^ a b Goldman RD (Aralık 2010). "Çocuklarda akut öksürük için kodein". Kanadalı Aile Hekimi. 56 (12): 1293–4. PMC 3001921. PMID 21156892.
- ^ Paul IM (Şubat 2012). "Çocuklarda üst solunum yolu enfeksiyonlarına bağlı akut öksürük için tedavi seçenekleri". Akciğer. 190 (1): 41–4. doi:10.1007 / s00408-011-9319-y. PMID 21892785. S2CID 23865647.
- ^ Verlee L, Verheij TJ, Hopstaken RM, Prins JM, Salomé PL, Bindels PJ (2012). "[NHG uygulama kılavuzunun özeti 'Akut öksürük']". Nederlands Tijdschrift voor Geneeskunde. 156: A4188. PMID 22917039.
- ^ Matthys H, Bleicher B, Bleicher U (1983). "Dekstrometorfan ve kodein: kronik öksürük hastalarında antitüsif aktivitenin objektif değerlendirmesi". Uluslararası Tıbbi Araştırmalar Dergisi. 11 (2): 92–100. doi:10.1177/030006058301100206. PMID 6852361. S2CID 30521239.
- ^ Van Amburgh JA. "Öksürük Çareleri İşe Yarar mı?". Medscape. Alındı 10 Nisan 2016.
- ^ Bolser DC (Şubat 2010). "Öksürüğün farmakolojik tedavisi". Kuzey Amerika Kulak Burun Boğaz Klinikleri. 43 (1): 147–55, xi. doi:10.1016 / j.otc.2009.11.008. PMC 2827356. PMID 20172264.
- ^ Webster LR (Ekim 2015). "Opioide Bağlı Kabızlık". Ağrı kesici ilaç. 16 Özel Sayı 1: S16-21. doi:10.1111 / pme.12911. PMID 26461071.
- ^ "Basın Duyuruları - FDA, Opioid kaynaklı kabızlık için Movantik'i onayladı". www.fda.gov. Alındı 18 Şubat 2016.
- ^ Gallagher R (Temmuz 2011). "İleri hastalıkta nefes darlığı için opioidlerin kullanımı". CMAJ. 183 (10): 1170. doi:10.1503 / cmaj.110024. PMC 3134725. PMID 21746829.
- ^ Wiseman R, Rowett D, Allcroft P, Abernethy A, Currow DC (Mart 2013). "Kronik refrakter dispne - kanıta dayalı yönetim". Avustralya Aile Hekimi. 42 (3): 137–40. PMID 23529525.
- ^ a b c d e f g h Furlan AD, Sandoval JA, Mailis-Gagnon A, Tunks E (Mayıs 2006). "Kronik kanser dışı ağrı için opioidler: etkinlik ve yan etkilerin bir meta-analizi". CMAJ. 174 (11): 1589–94. doi:10.1503 / cmaj.051528. PMC 1459894. PMID 16717269.
- ^ Baumann S (2009). "Yaşlı yetişkinlerde ağrıya hemşirelik yaklaşımı". Medsurg Hemşirelik. 18 (2): 77–82, test 83. PMID 19489204.
- ^ Buckeridge D, Huang A, Hanley J, Kelome A, Reidel K, Verma A, vd. (Eylül 2010). "Yaşlı yetişkinlerde opioid kullanımına bağlı yaralanma riski". Amerikan Geriatri Derneği Dergisi. 58 (9): 1664–70. doi:10.1111 / j.1532-5415.2010.03015.x. PMID 20863326.
- ^ Schneider JP (2010). "Kronik kas-iskelet sistemi ağrısında opioid analjeziklerin akılcı kullanımı". J Musculoskel Med. 27: 142–148.
- ^ Sanger N, Bhatt M, Singhal N, Ramsden K, Baptist-Mohseni N, Panesar B, vd. (Mart 2019). "Akut Bel Ağrısı için Reçeteli Opioidlerle İlişkili Olumsuz Sonuçlar: Sistematik Bir İnceleme ve Meta-Analiz". Ağrı Hekimi. 22 (2): 119–138. PMID 30921976.
- ^ Fuggle N, Curtis E, Shaw S, Spooner L, Bruyère O, Ntani G, vd. (Nisan 2019). "Osteoartritte Opioidlerin Güvenliği: Sistematik Bir İnceleme ve Meta-Analizin Sonuçları". İlaçlar ve Yaşlanma. 36 (Ek 1): 129–143. doi:10.1007 / s40266-019-00666-9. PMC 6509215. PMID 31073926.
- ^ Monnelly VJ, Hamilton R, Chappell FM, Mactier H, Boardman JP (Temmuz 2019). "Gebelikte opioid bağımlılığı için idame metadon reçetesi verildikten sonra çocuklukta nörogelişim: sistematik bir gözden geçirme ve meta-analiz". Gelişimsel Tıp ve Çocuk Nörolojisi. 61 (7): 750–760. doi:10.1111 / dmcn.14117. PMC 6617808. PMID 30511742.
- ^ Wolff K (Ağustos 2002). "Metadon doz aşımının karakterizasyonu: klinik değerlendirmeler ve bilimsel kanıtlar". Terapötik İlaç İzleme. 24 (4): 457–70. doi:10.1097/00007691-200208000-00001. PMID 12142628. S2CID 5652295.
- ^ Teichtahl H, Wang D (Kasım 2007). "Kronik opioid kullanımıyla birlikte uykuda düzensiz solunum". İlaç Güvenliği Konusunda Uzman Görüşü. 6 (6): 641–9. doi:10.1517/14740338.6.6.641. PMID 17967153. S2CID 24688704.
- ^ İlaç Değerlendirme ve Araştırma Merkezi (23 Ağustos 2013). "Hastalar ve Sağlayıcılar için Satış Sonrası İlaç Güvenliği Bilgileri - Sağlık Uzmanları için Bilgiler Metadon Hidroklorür". ABD Gıda ve İlaç İdaresi. Alındı 24 Şubat 2016.
Metadonun eliminasyon yarılanma ömrü (8-59 saat), analjezik etki süresinden (4-8 saat) daha uzundur.
- ^ Stephens E (23 Kasım 2015). "Opioid Toksisitesi". Medscape. Alındı 24 Şubat 2016.
CDC, metadonun Amerika Birleşik Devletleri'nde 1999-2010 yılları arasında opioide bağlı ölümlerin% 31.4'üne katkıda bulunduğunu bildirdi. Metadon ayrıca tüm tek ilaçlı opioidlere bağlı ölümlerin% 39,8'ini oluşturdu. Metadon ile ilişkili aşırı doz ölüm oranı, çoklu uyuşturucu ve tek uyuşturucu ölümleri arasındaki diğer opioid ile ilişkili ölümlerle ilişkili olandan önemli ölçüde daha yüksekti.
- ^ a b c d Noble M, Treadwell JR, Tregear SJ, Coates VH, Wiffen PJ, Akafomo C, Schoelles KM (Ocak 2010). Noble M (ed.). "Kronik kanser dışı ağrı için uzun vadeli opioid yönetimi". Sistematik İncelemelerin Cochrane Veritabanı (1): CD006605. doi:10.1002 / 14651858.CD006605.pub2. PMC 6494200. PMID 20091598.
- ^ "Amerika Birleşik Devletleri'nde aşırı dozda uyuşturucu ölümleri, 1999–2016" (PDF). HKM. Alındı 23 Aralık 2017.
- ^ a b c d e Aşırı Doz Ölüm Oranları. Tarafından Ulusal Uyuşturucu Bağımlılığı Enstitüsü (NIDA).
- ^ Fentanil. Resim 4 / 17. US DEA (Uyuşturucu ile Mücadele İdaresi ).
- ^ Pradhan AA, Walwyn W, Nozaki C, Filliol D, Erbs E, Matifas A, vd. (Aralık 2010). "Δ-opioid reseptörünün in vivo liganda yönelik ticareti: analjezik toleransa doğru iki yol". Nörobilim Dergisi. 30 (49): 16459–68. doi:10.1523 / JNEUROSCI.3748-10.2010. PMC 3086517. PMID 21147985.
- ^ Kollars JP, Larson MD (Mart 2005). "Opioidlerin miotik etkilerine tolerans". Anesteziyoloji. 102 (3): 701. doi:10.1097/00000542-200503000-00047. PMID 15731628.
- ^ Santillán R, Maestre JM, Hurlé MA, Flórez J (Temmuz 1994). "Kronik olarak morfin ile tedavi edilen kanser hastalarında nimodipin ile opiat analjezinin güçlendirilmesi: bir ön rapor". Ağrı. 58 (1): 129–32. doi:10.1016/0304-3959(94)90192-9. PMID 7970835. S2CID 35138704.
- ^ Santillán R, Hurlé MA, Armijo JA, de los Mozos R, Flórez J (Mayıs 1998). "Morfin dozunun artırılması gereken kanser hastalarında nimodipin ile güçlendirilmiş opiat analjezi: çift kör, plasebo kontrollü bir çalışma". Ağrı. 76 (1–2): 17–26. doi:10.1016 / S0304-3959 (98) 00019-0. PMID 9696455. S2CID 30963675.
- ^ Smith FL, Dombrowski DS, Dewey WL (Şubat 1999). "Farelerde morfin toleransında hücre içi kalsiyumun rolü". Farmakoloji, Biyokimya ve Davranış. 62 (2): 381–8. doi:10.1016 / S0091-3057 (98) 00168-3. PMID 9972707. S2CID 37434490.
- ^ McCarthy RJ, Kroin JS, Tuman KJ, Penn RD, Ivankovich AD (Nisan 1998). "Sıçanlarda magnezyum sülfat ve morfinin intratekal birlikte infüzyonu yoluyla antinosiseptif kuvvetlendirme ve toleransın zayıflatılması". Anestezi ve Analjezi. 86 (4): 830–6. doi:10.1097/00000539-199804000-00028. PMID 9539610.
- ^ Morrison AP, Hunter JM, Halpern SH, Banerjee A (Mayıs 2013). "Lipofilik opioidler içeren ve içermeyen lokal anestetik varlığında veya yokluğunda intratekal magnezyumun etkisi: sistematik bir inceleme ve meta-analiz". İngiliz Anestezi Dergisi. 110 (5): 702–12. doi:10.1093 / bja / aet064. PMID 23533255.
- ^ Larson AA, Kovács KJ, Spartz AK (Kasım 2000). "İntratekal Zn2 +, morfin antinosisepsiyonu ve akut tolerans gelişimini azaltır". Avrupa Farmakoloji Dergisi. 407 (3): 267–72. doi:10.1016 / S0014-2999 (00) 00715-9. PMID 11068022.
- ^ Wong CS, Cherng CH, Luk HN, Ho ST, Tung CS (Şubat 1996). "NMDA reseptör antagonistlerinin sıçanlarda morfin toleransının inhibisyonu üzerindeki etkileri: mu-opioid reseptörlerine bağlanma". Avrupa Farmakoloji Dergisi. 297 (1–2): 27–33. doi:10.1016/0014-2999(95)00728-8. PMID 8851162.
- ^ Malec D, Mandryk M, Fidecka S (Mart – Nisan 2008). "Farelerde morfin ve pentazosin kaynaklı antinosisepsiyonda memantin ve ketaminin etkileşimi" (PDF). Farmakolojik Raporlar. 60 (2): 149–55. PMID 18443375.
- ^ McCleane GJ (2003). "Kolesistokinin antagonisti proglumid, dihidrokodeinin analjezik etkisini arttırır". Klinik Ağrı Dergisi. 19 (3): 200–1. doi:10.1097/00002508-200305000-00008. PMID 12792559. S2CID 29229782.
- ^ Watkins LR, Kinscheck IB, Mayer DJ (Nisan 1984). "Opiat analjezisinin güçlendirilmesi ve proglumid ile morfin toleransının belirgin şekilde tersine çevrilmesi". Bilim. 224 (4647): 395–6. Bibcode:1984Sci ... 224..395W. doi:10.1126 / science.6546809. PMID 6546809.
- ^ Tang J, Chou J, Iadarola M, Yang HY, Costa E (Haziran 1984). "Proglumide, sıçanlarda morfine akut toleransı önler ve azaltır". Nörofarmakoloji. 23 (6): 715–8. doi:10.1016/0028-3908(84)90171-0. PMID 6462377. S2CID 33168040.
- ^ Ledeboer A, Hutchinson MR, Watkins LR, Johnson KW (Temmuz 2007). "Ibudilast (AV-411). Nöropatik ağrı ve opioid yoksunluğu sendromları için yeni bir sınıf terapötik aday". Araştırma İlaçları Hakkında Uzman Görüşü. 16 (7): 935–50. doi:10.1517/13543784.16.7.935. PMID 17594181. S2CID 22321634.
- ^ İslam MM (2019). "Avustralya'daki yeni kullanıcılar arasında reçeteli opioidlerin ve benzodiazepinlerin dağıtım şekli ve olasılığı: geriye dönük bir kohort çalışması". BMJ Açık. 9 (12): e030803. doi:10.1136 / bmjopen-2019-030803. PMC 6955558. PMID 31892646.
- ^ a b c d Doyle D, Hanks G, Cherney I, Calman K, eds. (2004). Oxford Palyatif Tıp Ders Kitabı (3. baskı). Oxford University Press. ISBN 978-0198566984.
- ^ Hermann D, Klages E, Welzel H, Mann K, Kruvasan B (Haziran 2005). "Opioid yoksunluğu semptomlarında opioid olmayan ilaçların düşük etkinliği". Bağımlılık Biyolojisi. 10 (2): 165–9. doi:10.1080/13556210500123514. PMID 16191669.
- ^ Brown TK (Mart 2013). "Madde bağımlılığının tedavisinde ibogain". Güncel Uyuşturucu Bağımlılığı İncelemeleri. 6 (1): 3–16. doi:10.2174/15672050113109990001. PMID 23627782.
- ^ Duceppe, Marc-Alexandre; Perreault, Marc M .; Frenette, Anne Julie; Burry, Lisa D .; Rico, Philippe; Lavoie, Annie; Gélinas, Céline; Mehta, Sangeeta; Dagenais, Maryse; Williamson, David R. (Nisan 2019). "Kritik derecede hasta yenidoğanlarda, çocuklarda ve yetişkinlerde opioidlerden ve benzodiazepinlerden iyatrojenik çekilme sıklığı, risk faktörleri ve semptomatolojisi: Klinik çalışmaların sistematik bir incelemesi". Klinik Eczacılık ve Terapötikler Dergisi. 44 (2): 148–156. doi:10.1111 / jcpt.12787. ISSN 1365-2710. PMID 30569508.
- ^ Bannwarth B (Eylül 2012). "Opioid analjeziklerin kötüye kullanım caydırıcı formülasyonları amaçlarına ulaşmada başarılı olacak mı?" İlaçlar. 72 (13): 1713–23. doi:10.2165/11635860-000000000-00000. PMID 22931520. S2CID 26082561.
- ^ Schneider JP, Matthews M, Jamison RN (Ekim 2010). "Kötüye kullanımı caydırıcı ve kurcalamaya dayanıklı opioid formülasyonları: reçeteli opioid kötüye kullanımının ele alınmasındaki rolü nedir?". CNS İlaçları. 24 (10): 805–10. doi:10.2165/11584260-000000000-00000. PMID 20839893. S2CID 17830622.
- ^ Xu Y Johnson A (2013). "Kanser dışı ağrı için opioid tedavisi farmakogenomiği: etkinlik, yan etkiler ve maliyetler". Ağrı Araştırması ve Tedavisi. 2013: 943014. doi:10.1155/2013/943014. PMC 3791560. PMID 24167729.
- ^ Brush DE (Aralık 2012). "Kronik ağrının yönetimi için uzun vadeli opioid tedavisinin komplikasyonları: opioid kaynaklı hiperaljezinin paradoksu". Tıbbi Toksikoloji Dergisi. 8 (4): 387–92. doi:10.1007 / s13181-012-0260-0. PMC 3550256. PMID 22983894.
- ^ Malik Z, Baik D, Schey R (Şubat 2015). "Kannabinoidlerin mide bulantısı ve kusma ve iç organ ağrısının düzenlenmesindeki rolü". Güncel Gastroenteroloji Raporları. 17 (2): 429. doi:10.1007 / s11894-015-0429-1. PMID 25715910. S2CID 32705478.
- ^ Abrams DI, Guzman M (Haziran 2015). "Kanser bakımında esrar". Klinik Farmakoloji ve Terapötikler. 97 (6): 575–86. doi:10.1002 / cpt.108. PMID 25777363.
- ^ "UCSF Çalışması Tıbbi Esrarın Hastaların Opiyatlarla Ağrıyı Azaltmasına Yardımcı Olabileceğini Buldu". UC San Francisco. Alındı 4 Mart 2016.
- ^ Abrams DI, Couey P, Shade SB, Kelly ME, Benowitz NL (Aralık 2011). "Kronik ağrıda kannabinoid-opioid etkileşimi". Klinik Farmakoloji ve Terapötikler. 90 (6): 844–51. doi:10.1038 / clpt.2011.188. PMID 22048225.
- ^ Frauenknecht J, Kirkham KR, Jacot-Guillarmod A, Albrecht E (Mayıs 2019). "İntraoperatif opioidlerin opioid içermeyen anesteziye karşı analjezik etkisi: sistematik bir inceleme ve meta-analiz". Anestezi. 74 (5): 651–662. doi:10.1111 / anae.14582. PMID 30802933. S2CID 73469631.
- ^ Busse, Jason W .; Wang, Li; Kamaleldin, Mostafa; Craigie, Samantha; Riva, John J .; Montoya, Luis; Mulla, Sohail M .; Lopes, Luciane C .; Vogel, Nicole; Chen, Eric; Kirmayr, Karin (18 Aralık 2018). "Kronik Kanser Dışı Ağrı için Opioidler: Sistematik Bir İnceleme ve Meta-analiz". JAMA. 320 (23): 2448–2460. doi:10.1001 / jama.2018.18472. ISSN 0098-7484. PMC 6583638. PMID 30561481.
- ^ Reissig JE, Rybarczyk AM (Nisan 2005). "Kronik ağrıda opioid kaynaklı sedasyonun farmakolojik tedavisi". Farmakoterapi Yıllıkları. 39 (4): 727–31. doi:10.1345 / aph.1E309. PMID 15755795. S2CID 39058371.
- ^ Corey PJ, Heck AM, Weathermon RA (Aralık 1999). "Opioid kaynaklı sedasyona karşı koymak için amfetaminler". Farmakoterapi Yıllıkları. 33 (12): 1362–6. doi:10.1345 / aph.19024. PMID 10630837. S2CID 23733242.
- ^ Kanada Sağlıkta İlaç ve Teknolojiler Ajansı (26 Haziran 2014). "Kabızlığın Önlenmesi veya Yönetimi için Dioktil Sülfosüksinat veya Docusate (Kalsiyum veya Sodyum): Klinik Etkililiğin Gözden Geçirilmesi". PMID 25520993.
- ^ McCarberg BH (Temmuz 2013). "Opioid kaynaklı kabızlığa genel bakış ve tedavi". Lisansüstü Tıp. 125 (4): 7–17. doi:10.3810 / pgm.2013.07.2651. PMID 23782897. S2CID 42872181.
- ^ a b c d e Kumar L, Barker C, Emmanuel A (2014). "Opioid kaynaklı kabızlık: patofizyoloji, klinik sonuçlar ve yönetim". Gastroenteroloji Araştırma ve Uygulama. 2014: 141737. doi:10.1155/2014/141737. PMC 4027019. PMID 24883055.
- ^ a b Alguire PC, Amerikan Doktorlar Koleji, İç Hastalıkları Stajyer Direktörleri (2009). Staj Öğrencileri için Dahili Tıp Temelleri 2. ACP Basın. s. 272–. ISBN 978-1-934465-13-4.
- ^ a b c Elliott JA, Smith HS (19 Nisan 2016). Akut Ağrı Tedavisi El Kitabı. CRC Basın. s. 89–. ISBN 978-1-4665-9635-1.
- ^ Nishie, Kenichi; Yamamoto, Shuhei; Yamaga, Takayoshi; Horigome, Naoto; Hanaoka, Masayuki (Mayıs 2019). "Opioid kaynaklı kabızlığın tedavisi için çevresel olarak etkili μ-opioid antagonisti: Sistematik inceleme ve meta-analiz". Gastroenteroloji ve Hepatoloji Dergisi. 34 (5): 818–829. doi:10.1111 / jgh.14586. ISSN 1440-1746. PMID 30597600.
- ^ Poulsen JL, Brock C, Olesen AE, Nilsson M, Drewes AM (Kasım 2015). "Opioid kaynaklı bağırsak disfonksiyonunun tedavisinde gelişen paradigmalar". Gastroenterolojide Terapötik Gelişmeler. 8 (6): 360–72. doi:10.1177 / 1756283X15589526. PMC 4622283. PMID 26557892.
- ^ Davis MP, Goforth HW (2016). "Bir opioid reseptör antagonisti ile oksikodon: Bir inceleme". Opioid Yönetimi Dergisi. 12 (1): 67–85. doi:10.5055 / jom.2016.0313. PMID 26908305.
- ^ Candy B, Jones L, Vickerstaff V, Larkin PJ, Stone P (Haziran 2018). "Kanserli kişilerde ve palyatif bakım alan kişilerde opioid kaynaklı bağırsak disfonksiyonu için mu-opioid antagonistleri". Sistematik İncelemelerin Cochrane Veritabanı. 6: CD006332. doi:10.1002 / 14651858.CD006332.pub3. PMC 6513061. PMID 29869799.
- ^ Luthra P, Burr NE, Brenner DM, Ford AC (Mayıs 2018). "Opioid kaynaklı kabızlığın tedavisi için farmakolojik tedavilerin etkinliği: sistematik inceleme ve ağ meta analizi" (PDF). Bağırsak. 68 (3): 434–444. doi:10.1136 / gutjnl-2018-316001. PMID 29730600. S2CID 13677764.
- ^ Esmadi M, Ahmad D, Hewlett A (Mart 2019). "Opioide bağlı kabızlığın tedavisi için naldemedinin etkinliği: Bir meta-analiz". Gastrointestinal ve Karaciğer Hastalıkları Dergisi. 28 (1): 41–46. doi:10.15403 / jgld.2014.1121.281.any. PMID 30851171.
- ^ Dorn S, Lembo A, Cremonini F (Eylül 2014). "Opioid kaynaklı bağırsak disfonksiyonu: epidemiyoloji, patofizyoloji, tanı ve ilk terapötik yaklaşım". Amerikan Gastroenteroloji Takviyeleri Dergisi. 2 (1): 31–7. doi:10.1038 / ajgsup.2014.7. PMID 25207610.
- ^ Yost CS (2006). "Solunum uyarıcı doksaprama yeni bir bakış". CNS İlaç İncelemeleri. 12 (3–4): 236–49. doi:10.1111 / j.1527-3458.2006.00236.x. PMC 6506195. PMID 17227289.
- ^ Tan ZM, Liu JH, Dong T, Li JX (Ağustos 2006). "[Ağrısız yapay kürtajda propofol ve doksapram ile birlikte hedef kontrollü remifentanil infüzyonunun klinik gözlemi]". Nan Fang Yi Ke da Xue Xue Bao = Güney Tıp Üniversitesi Dergisi. 26 (8): 1206–8. PMID 16939923.
- ^ Manzke T, Guenther U, Ponimaskin EG, Haller M, Dutschmann M, Schwarzacher S, Richter DW (Temmuz 2003). "5-HT4 (a) reseptörleri, analjezi kaybı olmaksızın opioid kaynaklı solunum depresyonunu önler". Bilim. 301 (5630): 226–9. Bibcode:2003Sci ... 301..226M. doi:10.1126 / bilim.1084674. PMID 12855812. S2CID 13641423.
- ^ Wang X, Dergacheva O, Kamendi H, Gorini C, Mendelowitz D (Ağustos 2007). "5-Hidroksitriptamin 1A / 7 ve 4alfa reseptörleri, opioid kaynaklı beyin sapı kardiyorespiratuar fonksiyonun inhibisyonunu farklı şekilde önler". Hipertansiyon. 50 (2): 368–76. doi:10.1161 / HİPERTANSİYONAHA.107.091033. PMID 17576856.
- ^ Ren J, Poon BY, Tang Y, Funk GD, Greer JJ (Aralık 2006). "Ampakinler, sıçanlarda solunum depresyonunu hafifletir". Amerikan Solunum ve Yoğun Bakım Tıbbı Dergisi. 174 (12): 1384–91. doi:10.1164 / rccm.200606-778OC. PMID 16973981.
- ^ Cozowicz, Crispiana; Chung, Frances; Doufas, Anthony G .; Nagappa, Mahesh; Memtsoudis, Stavros G. (Ekim 2018). "Obstrüktif Uyku Apneli Hastalarda Akut Ağrı Tedavisine Yönelik Opioidler: Sistematik Bir İnceleme". Anestezi ve Analjezi. 127 (4): 988–1001. doi:10.1213 / ANE.0000000000003549. ISSN 1526-7598. PMID 29958218.
- ^ Gupta, Kapil; Nagappa, Mahesh; Prasad, Arun; Abrahamyan, Lusine; Wong, Jean; Weingarten, Toby N .; Chung, Frances (14 Aralık 2018). "Cerrahi hastalarda opioid kaynaklı solunum depresyonu için risk faktörleri: sistematik bir inceleme ve meta-analizler". BMJ Açık. 8 (12): e024086. doi:10.1136 / bmjopen-2018-024086. ISSN 2044-6055. PMC 6303633. PMID 30552274.
- ^ Wilson GR, Reisfield GM (2003). "Morfin hiperaljezi: bir vaka sunumu". Amerikan Hospice ve Palyatif Bakım Dergisi. 20 (6): 459–61. doi:10.1177/104990910302000608. PMID 14649563. S2CID 22690630.
- ^ Vella-Brincat J, Macleod AD (2007). "Opioidlerin, palyatif bakım hastalarının merkezi sinir sistemleri üzerindeki yan etkileri". Journal of Pain & Palliative Care Pharmacotherapy. 21 (1): 15–25. doi:10.1080 / J354v21n01_05. PMID 17430825. S2CID 17757207.
- ^ Mercadante S, Arcuri E (2005). "Hiperaljezi ve opioid değişimi". Amerikan Hospice ve Palyatif Bakım Dergisi. 22 (4): 291–4. doi:10.1177/104990910502200411. PMID 16082916. S2CID 39647898.
- ^ Güzel PG (2004). "Opioid içgörüler: opioid kaynaklı hiperaljezi ve opioid rotasyonu". Journal of Pain & Palliative Care Pharmacotherapy. 18 (3): 75–9. doi:10.1080 / J354v18n03_08. PMID 15364634. S2CID 45555785.
- ^ Lee M, Silverman SM, Hansen H, Patel VB, Manchikanti L (2011). "Opioid kaynaklı hiperaljezinin kapsamlı bir incelemesi". Ağrı Hekimi. 14 (2): 145–61. PMID 21412369.
- ^ Tompkins DA, Campbell CM (Nisan 2011). "Opioid kaynaklı hiperaljezi: klinik olarak ilgili mi yoksa harici araştırma fenomeni mi?". Güncel Ağrı ve Baş Ağrısı Raporları. 15 (2): 129–36. doi:10.1007 / s11916-010-0171-1. PMC 3165032. PMID 21225380.
- ^ Díaz JL, Zamanillo D, Corbera J, Baeyens JM, Maldonado R, Pericàs MA, ve diğerleri. (Eylül 2009). "Seçici sigma-1 (sigma1) reseptör antagonistleri: nöropatik ağrının tedavisi için ortaya çıkan hedef". Tıbbi Kimyada Merkezi Sinir Sistemi Ajanları. 9 (3): 172–83. doi:10.2174/1871524910909030172. PMID 20021351.
- ^ Mitra S (2018). "Opioid kaynaklı hiperaljezi: patofizyoloji ve klinik çıkarımlar". Opioid Yönetimi Dergisi. 4 (3): 123–30. doi:10.5055 / jom.2008.0017. PMID 18717507.
- ^ Baron R (2009). "Nöropatik Ağrı: Klinik Bir Perspektif". Duyusal sinirler. Deneysel Farmakoloji El Kitabı. 194. sayfa 3–30. doi:10.1007/978-3-540-79090-7_1. ISBN 978-3-540-79089-1. PMID 19655103.
- ^ Candiotti KA, Gitlin MC (Temmuz 2010). "Orta ila şiddetli kronik kanser dışı ağrının yetersiz tedavisi üzerindeki opioid ile ilişkili yan etkilerin etkisinin gözden geçirilmesi: tapentadol, çözüme doğru bir adım mı?". Güncel Tıbbi Araştırma ve Görüş. 26 (7): 1677–84. doi:10.1185/03007995.2010.483941. PMID 20465361. S2CID 9713245.
- ^ a b Fountas A, Chai ST, Kourkouti C, Karavitaki N (Ekim 2018). "ENDOKRİNOLOJİ MEKANİZMALARI: Opioidlerin Endokrinolojisi". Avrupa Endokrinoloji Dergisi. 179 (4): R183 – R196. doi:10.1530 / EJE-18-0270. PMID 30299887.
- ^ Brennan MJ (Mart 2013). "Opioid tedavisinin endokrin işlevi üzerindeki etkisi". Amerikan Tıp Dergisi. 126 (3 Özel Sayı 1): S12-8. doi:10.1016 / j.amjmed.2012.12.001. PMID 23414717.
- ^ Colameco S, Coren JS (Ocak 2009). "Opioid kaynaklı endokrinopati". Amerikan Osteopati Derneği Dergisi. 109 (1): 20–5. PMID 19193821.
- ^ Smith HS, Elliott JA (Temmuz 2012). "Opioid kaynaklı androjen eksikliği (OPIAD)". Ağrı Hekimi. 15 (3 Ek): ES145-56. PMID 22786453.
- ^ Brede E, Mayer TG, Gatchel RJ (Şubat 2012). "Mesleki yaralanmalarda disiplinler arası fonksiyonel restorasyondan 1 yıl sonra işe devam etmeme tahmini". Fiziksel Tıp ve Rehabilitasyon Arşivleri. 93 (2): 268–74. doi:10.1016 / j.apmr.2011.08.029. PMID 22289236.
- ^ Volinn E, Fargo JD, Fine PG (Nisan 2009). "Spesifik olmayan bel ağrısı için opioid tedavisi ve kronik iş kaybının sonucu". Ağrı. 142 (3): 194–201. doi:10.1016 / j.pain.2008.12.017. PMID 19181448.
- ^ a b c Amerikan Mesleki ve Çevresel Tıp Koleji (Şubat 2014), "Hekimlerin ve Hastaların Sorgulaması Gereken Beş Şey", Akıllıca Seçmek: bir girişimi ABIM Vakfı, Amerikan Mesleki ve Çevresel Tıp Koleji, alındı 24 Şubat 2014, hangi alıntı
- Weiss MS, Bowden K, Branco F, ve diğerleri. (2011). "Opioidler Rehberi". Hegmann KT'de (ed.). İşyeri hekimliği uygulama kılavuzları: ortak sağlık sorunlarının değerlendirilmesi ve yönetimi ve işçilerde fonksiyonel iyileşme (çevrimiçi Mart 2014) (3. baskı). Elk Grove Village, IL: Amerikan Mesleki ve Çevresel Tıp Koleji. s. 11. ISBN 978-0615452272.
- ^ Cherubino P, Sarzi-Puttini P, Zuccaro SM, Labianca R (Şubat 2012). "Önemli hasta alt gruplarında kronik ağrının yönetimi". Klinik İlaç Araştırması. 32 Özel Sayı 1: 35–44. doi:10.2165/11630060-000000000-00000. PMID 23389874. S2CID 47576095.
- ^ White KT, Dillingham TR, González-Fernández M, Rothfield L (Aralık 2009). "Kronik habis olmayan ağrı sendromları için afyonlar: ayakta tedavi klinik yönetimi için uygun adaylar belirlenebilir mi?". Amerikan Fiziksel Tıp ve Rehabilitasyon Dergisi. 88 (12): 995–1001. doi:10.1097 / PHM.0b013e3181bc006e. PMID 19789432. S2CID 43241757.
- ^ Kaye AM, Kaye AD, Lofton EC (2013). "Opioid reçetelemesindeki temel kavramlar ve opioid aracılı etkilerin araç kullanma üzerindeki güncel kavramları". Ochsner Dergisi. 13 (4): 525–32. PMC 3865831. PMID 24358001.
- ^ Orriols L, Delorme B, Gadegbeku B, Tricotel A, Contrand B, Laumon B, vd. (Kasım 2010). Pirmohamed M (ed.). "Reçeteli ilaçlar ve karayolu trafik kazası riski: Fransız siciline dayalı bir çalışma". PLOS Tıp. 7 (11): e1000366. doi:10.1371 / journal.pmed.1000366. PMC 2981588. PMID 21125020.
- ^ Miller M, Stürmer T, Azrael D, Levin R, Solomon DH (Mart 2011). "Opioid analjezikler ve artritli yaşlı erişkinlerde kırık riski". Amerikan Geriatri Derneği Dergisi. 59 (3): 430–8. doi:10.1111 / j.1532-5415.2011.03318.x. PMC 3371661. PMID 21391934.
- ^ Allegri N, Mennuni S, Rulli E, Vanacore N, Corli O, Floriani I, vd. (Mart 2019). "Kronik Kanser Olmayan Ağrılı Hastalarda Uzun Süreli Opioid Kullanımının Nöropsikolojik Etkileri Üzerine Sistematik İnceleme ve Meta-Analiz". Ağrı Uygulaması. 19 (3): 328–343. doi:10.1111 / papr.12741. PMID 30354006. S2CID 53023743.
- ^ Higgins C, Smith BH, Matthews K (Haziran 2019). "Kronik opioid maruziyetinden sonra klinik popülasyonlarda opioid kaynaklı hiperaljezinin kanıtı: sistematik bir inceleme ve meta-analiz" (PDF). İngiliz Anestezi Dergisi. 122 (6): e114 – e126. doi:10.1016 / j.bja.2018.09.019. PMID 30915985.
- ^ Yang, David Z .; Sin, Billy; Beckhusen, Joshua; Xia, Dawei; Khaimova, Rebecca; Iliev, Ilia (Mayıs-Haziran 2019). "Ameliyatsız Ortamda Opioide Bağlı Hiperaljezi: Sistematik Bir İnceleme". American Journal of Therapeutics. 26 (3): e397 – e405. doi:10.1097 / MJT.0000000000000734. ISSN 1536-3686. PMID 29726847. S2CID 19181545.
- ^ a b c Gudin JA, Mogali S, Jones JD, Comer SD (Temmuz 2013). "Kombinasyon opioid, benzodiazepinler ve / veya alkol kullanımının riskleri, yönetimi ve izlenmesi". Lisansüstü Tıp. 125 (4): 115–30. doi:10.3810 / pgm.2013.07.2684. PMC 4057040. PMID 23933900.
- ^ İslam MM, Wollersheim D (2019). "Avustralya'da dağıtılan opioidler ve benzodiazepinlerin karşılaştırması". PLOS ONE. 14 (8): e0221438. doi:10.1371 / journal.pone.0221438. PMC 6699700. PMID 31425552.
- ^ İslam MM, Wollersheim D (2020). "Avustralya'da Reçeteli Opioidler ve Benzodiazepinlerin Eşzamanlı Dağıtımındaki Eğilimler ve Varyasyonlar: Geriye Dönük Bir Analiz". Çağdaş İlaç Sorunları. 47 (2): 136–148. doi:10.1177/0091450920919443. S2CID 218780209.
- ^ Stuth EA, Stucke AG, Zuperku EJ (2012). "Anestetikler, Sedatifler ve Opioidlerin Ventilasyon Kontrolü Üzerindeki Etkileri". Anesteziklerin, sedatiflerin ve opioidlerin ventilasyon kontrolü üzerindeki etkileri. Kapsamlı Fizyoloji. 2. s. 2281–2367. doi:10.1002 / cphy.c100061. ISBN 9780470650714. PMID 23720250.
- ^ Gowing L, Ali R, White JM (Mayıs 2017). "Opioid yoksunluğu için minimum sedasyonlu opioid antagonistleri". Sistematik İncelemelerin Cochrane Veritabanı. 5: CD002021. doi:10.1002 / 14651858.CD002021.pub4. PMC 6481395. PMID 28553701.
- ^ Bolton, Monica; Hodkinson, Alex; Boda, Shivani; Kalıp, Alan; Panagioti, Maria; Rhodes, Sarah; Riste, Lisa; van Marwijk, Harm (15 Ocak 2019). "Oral naltreksonun plasebo randomize kontrollü çalışmalarında bildirilen ciddi yan etkiler: sistematik bir inceleme ve meta-analiz". BMC Tıp. 17 (1): 10. doi:10.1186 / s12916-018-1242-0. ISSN 1741-7015. PMC 6332608. PMID 30642329.
- ^ Greene, Jennifer Anne; Deveau, Brent J .; Dol, Justine S .; Butler, Michael B. (Nisan 2019). "Hastane öncesi opioid aşırı doz bakımında 'tedavi et ve salım' uygulamalarından sonra geri tepme toksisitesine bağlı ölüm oranı: sistematik bir inceleme". Acil Tıp Dergisi: EMJ. 36 (4): 219–224. doi:10.1136 / emermed-2018-207534. ISSN 1472-0213. PMID 30580317. S2CID 58607479.
- ^ Miller RD (2010). Miller'ın Anestezi (7. baskı). Elsevier Sağlık Bilimleri. ISBN 978-0-443-06959-8.
- ^ Morgan GE, Mikhail MS, Murray MJ (2006). Klinik Anesteziyoloji (4. baskı). McGraw Hill. ISBN 978-0-07-110515-6.
- ^ Kestane DH, Wong CA, Tsen LC, Kee WD, Beilin Y, Mhyre J (2014). Kestane Obstetrik Anestezi: İlkeler ve Uygulama. Elsevier Sağlık Bilimleri. s. 468. ISBN 9780323113748.
Hidromorfonun lipid çözünürlüğü, morfin ve fentanil arasındadır, ancak morfininkine daha yakındır.
- ^ Musazzi UM, Matera C, Dallanoce C, Vacondio F, De Amici M, Vistoli G, et al. (Temmuz 2015). "Lokal cilt analjezisi için bir opioidin seçimi hakkında: Yapı-deri geçirgenliği ilişkileri". Uluslararası Eczacılık Dergisi. 489 (1–2): 177–85. doi:10.1016 / j.ijpharm.2015.04.071. PMID 25934430.
- ^ Le Naour M, Lunzer MM, Powers MD, Kalyuzhny AE, Benneyworth MA, Thomas MJ, Portoghese PS (Ağustos 2014). "Yan etkilerden arındırılmış analjeziklerin geliştirilmesi için hedef olarak varsayılan kappa opioid heteromerleri". Tıbbi Kimya Dergisi. 57 (15): 6383–92. doi:10.1021 / jm500159d. PMC 4136663. PMID 24978316.
- ^ DeWire SM, Yamashita DS, Rominger DH, Liu G, Cowan CL, Graczyk TM, ve diğerleri. (Mart 2013). "Μ-opioid reseptöründeki bir G protein taraflı ligand, morfine kıyasla azaltılmış gastrointestinal ve solunum fonksiyon bozukluğu ile güçlü bir şekilde analjeziktir". The Journal of Pharmacology and Experimental Therapeutics. 344 (3): 708–17. doi:10.1124 / jpet.112.201616. PMID 23300227. S2CID 8785003.
- ^ a b c Takayama H, Ishikawa H, Kurihara M, Kitajima M, Aimi N, Ponglux D, ve diğerleri. (Nisan 2002). "Mitraginin ile ilgili indol alkaloidlerin sentezi ve opioid agonistik aktiviteleri üzerine çalışmalar: diğer opioid ligandlarından yapısal olarak farklı opioid agonistlerinin keşfi". Tıbbi Kimya Dergisi. 45 (9): 1949–56. doi:10.1021 / jm010576e. PMID 11960505.
- ^ a b c d e f g h ben j k l m n Ö p q r s t sen v w x y z aa ab AC reklam ae af ag Ah ai aj ak al am bir Raynor K, Kong H, Chen Y, Yasuda K, Yu L, Bell GI, Reisine T (Şubat 1994). "Klonlanmış kappa-, delta- ve mu-opioid reseptörlerinin farmakolojik karakterizasyonu". Moleküler Farmakoloji. 45 (2): 330–4. PMID 8114680.
- ^ a b c d e f g Filizola M, Villar HO, Loew GH (Ocak 2001). "Delta, mu ve kappa opioid reseptörlerinin spesifik olmayan tanınmasının moleküler belirleyicileri". Biyorganik ve Tıbbi Kimya. 9 (1): 69–76. doi:10.1016 / S0968-0896 (00) 00223-6. PMID 11197347.
- ^ a b c d e f g h Tam SW (Şubat 1985). "(+) - [3H] SKF 10,047, (+) - [3H] etilketosiklazosin, mu, kappa, delta ve fensiklidin bağlanma bölgeleri kobay beyin zarlarında". Avrupa Farmakoloji Dergisi. 109 (1): 33–41. doi:10.1016/0014-2999(85)90536-9. PMID 2986989.
- ^ a b c d e f g h ben Corbett AD, Paterson SJ, Kosterlitz HW (1993). Opioidler. Handbuch der Experimentellen Pharmakologie Deneysel Farmakoloji El Kitabı Devamı. Deneysel Farmakoloji El Kitabı. 104 / 1. sayfa 645–679. doi:10.1007/978-3-642-77460-7_26. ISBN 978-3-642-77462-1. ISSN 0171-2004.
- ^ a b c d e f g h ben j k l m n Ö p q r s Codd EE, Shank RP, Schupsky JJ, Raffa RB (Eylül 1995). "Santral etkili analjeziklerin serotonin ve norepinefrin alımını inhibe etme aktivitesi: yapısal belirleyiciler ve antinosisepsiyondaki rol". The Journal of Pharmacology and Experimental Therapeutics. 274 (3): 1263–70. PMID 7562497.
- ^ Frink MC, Hennies HH, Englberger W, Haurand M, Wilffert B (Kasım 1996). "Tramadolün sıçan beyninin nörotransmiter sistemleri üzerindeki etkisi". Arzneimittel-Forschung. 46 (11): 1029–36. PMID 8955860.
- ^ Potschka H, Friderichs E, Löscher W (Eylül 2000). "Tramadolün, enantiyomerlerinin ve M1 metabolitinin epilepsinin sıçan tutuşma modelinde antikonvülsan ve prokonvülsan etkileri". İngiliz Farmakoloji Dergisi. 131 (2): 203–12. doi:10.1038 / sj.bjp.0703562. PMC 1572317. PMID 10991912.
- ^ Katsumata S, Minami M, Nakagawa T, Iwamura T, Satoh M (Kasım 1995). "Klonlanmış mu-, delta- ve kappa-opioid reseptörlerinde dihidroetorfinin farmakolojik çalışması". Avrupa Farmakoloji Dergisi. 291 (3): 367–73. doi:10.1016/0922-4106(95)90078-0. PMID 8719422.
- ^ Bart G, Schluger JH, Borg L, Ho A, Bidlack JM, Kreek MJ (Aralık 2005). "Normal insan gönüllülerde serum prolaktininde nalmefen indüklü yükselme: kısmi kappa opioid agonist aktivitesi?". Nöropsikofarmakoloji. 30 (12): 2254–62. doi:10.1038 / sj.npp.1300811. PMID 15988468.
- ^ Wentland MP, Lou R, Lu Q, Bu Y, VanAlstine MA, Cohen DJ, Bidlack JM (Ocak 2009). "Karboksamido ikameli opioidlerin sentezleri ve opioid reseptör bağlanma özellikleri". Biyorganik ve Tıbbi Kimya Mektupları. 19 (1): 203–8. doi:10.1016 / j.bmcl.2008.10.134. PMID 19027293.
- ^ a b Gharagozlou P, Demirci H, David Clark J, Lameh J (Ocak 2003). "Klonlanmış mu opioid reseptörlerini ifade eden hücrelerde opioid ligandlarının aktivitesi". BMC Farmakoloji. 3: 1. doi:10.1186/1471-2210-3-1. PMC 140036. PMID 12513698.Gharagozlou P, Demirci H, Clark JD, Lameh J (Kasım 2002). "Delta opioid reseptörlerini ifade eden HEK hücrelerindeki opioid ligandlarının aktivasyon profilleri". BMC Neuroscience. 3: 19. doi:10.1186/1471-2202-3-19. PMC 137588. PMID 12437765.Gharagozlou P, Hashemi E, DeLorey TM, Clark JD, Lameh J (Ocak 2006). "Kappa opioid reseptörlerinde opioid ligandlarının farmakolojik profilleri". BMC Farmakoloji. 6: 3. doi:10.1186/1471-2210-6-3. PMC 1403760. PMID 16433932.
- ^ Roth BL, Baner K, Westkaemper R, Siebert D, Rice KC, Steinberg S, vd. (Eylül 2002). "Salvinorin A: güçlü, doğal olarak oluşan nitrojen olmayan kappa opioid seçici agonisti". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 99 (18): 11934–9. Bibcode:2002PNAS ... 9911934R. doi:10.1073 / pnas.182234399. PMC 129372. PMID 12192085.
- ^ Wentland MP, Lou R, Lu Q, Bu Y, Denhardt C, Jin J, ve diğerleri. (Nisan 2009). "Opioid reseptörleri için yeni yüksek afiniteli ligandların sentezleri". Biyorganik ve Tıbbi Kimya Mektupları. 19 (8): 2289–94. doi:10.1016 / j.bmcl.2009.02.078. PMC 2791460. PMID 19282177.
- ^ Gassaway MM, Rives ML, Kruegel AC, Javitch JA, Sames D (Temmuz 2014). "Atipik antidepresan ve nörorestoratif ajan tianeptin, bir μ-opioid reseptör agonistidir". Çeviri Psikiyatrisi. 4 (7): e411. doi:10.1038 / tp.2014.30. PMC 4119213. PMID 25026323.
- ^ "Bölgelere göre ve küresel olarak uyuşturucu kullanımının yıllık yaygınlığı, 2016". Dünya Uyuşturucu Raporu 2018. Birleşmiş Milletler Uyuşturucu ve Suç Ofisi. 2018. Alındı 7 Temmuz 2018.
- ^ Volkow ND. "Amerika'nın Opioid Bağımlılığı: Eroin ve Reçeteli İlaç Suistimali". DrugAbuse.GOV. Ulusal Uyuşturucu Bağımlılığı Enstitüsü. Alındı 30 Nisan 2017.
- ^ "Narkotik İlaçlar Stupéfants Estupefacientes" (PDF). ULUSLARARASI UYUŞTURUCU KONTROL KURULU. 2012. Alındı 6 Mart 2017.
- ^ "Opioid Tüketim Verileri | Ağrı ve Politika Çalışmaları Grubu". Painpolicy.wisc.edu. Alındı 7 Ocak 2016.
- ^ Dell CA, Roberts G, Kilty J, Taylor K, Daschuk M, Hopkins C, Dell D (2012). "Kanada'daki İlk Milletler Arasında Reçeteyle Satılan İlaç Suistimalini Araştırma: Sağlığı Geliştirme Çerçevesinden Başlamak". Madde bağımlılığı. 6: 23–31. doi:10.4137 / SART.S9247. PMC 3411531. PMID 22879752.
- ^ "Sosyal açıdan dezavantajlı olan Ontaryalılara sürekli olarak ve Kanada yönergelerini aşan dozlarda opioid reçete ediliyor". Ices.on.ca. 25 Ocak 2011. Alındı 7 Ocak 2016.
- ^ a b "Kötüye Kullanımdan Kaçınmak, Bir Denge Sağlamak: Opioid Halk Sağlığı Kriziyle Mücadele" (PDF). Ontario Doktorlar ve Cerrahlar Koleji. 8 Eylül 2010. Arşivlenen orijinal (PDF) 7 Haziran 2016'da. Alındı 6 Mart 2017.
- ^ Backhaus I, Mannocci A, La Torre G (2019). "İlaca Dayalı Malign Olmayan Kronik Ağrı Tedavisinin Ekonomik Değerlendirme Çalışmalarının Sistematik Bir İncelemesi". Güncel Farmasötik Biyoteknoloji. 20 (11): 910–919. doi:10.2174/1389201020666190717095443. PMID 31322067.
- ^ Mojtabai R (Mayıs 2018). "Reçeteli opioidlerin uzun süreli kullanımındaki ulusal eğilimler". Farmakoepidemiyoloji ve İlaç Güvenliği. 27 (5): 526–534. doi:10.1002/pds.4278. PMID 28879660. S2CID 19047621.
- ^ Manglik A, Kruse AC, Kobilka TS, Thian FS, Mathiesen JM, Sunahara RK, et al. (Mart 2012). "Crystal structure of the µ-opioid receptor bound to a morphinan antagonist". Doğa. 485 (7398): 321–6. Bibcode:2012Natur.485..321M. doi:10.1038/nature10954. PMC 3523197. PMID 22437502.
Opium is one of the world’s oldest drugs, and its derivatives morphine and codeine are among the most used clinical drugs to relieve severe pain.
- ^ Colledge S, Conolly J (10 August 2007). The Origins and Spread of Domestic Plants in Southwest Asia and Europe. Walnut Creek, CA: Left Coast Press. s. 179–181. ISBN 978-1598749885. Alındı 28 Ağustos 2018.
- ^ Kunzig R, Tzar J (1 November 2002). "La Marmotta". Keşfedin. Alındı 28 Ağustos 2018.
- ^ Chevalier A, Marinova E, Pena-Chocarro L (1 April 2014). Plants and People: Choices and Diversity through Time. Oxbow Kitapları. s. 97–99. ISBN 978-1842175149. Alındı 28 Ağustos 2018.
- ^ Kritikos PG, Papadaki SP (1967). "The history of the poppy and of opium and their expansion in antiquity in the eastern Mediterranean area". Narkotik Bülten. XIX (4). Alındı 23 Ağustos 2018.
- ^ Sonnedecker G (1962). "Emergence of the Concept of Opiate Addiction". Journal Mondial de Pharmacie. 3: 275–290.
- ^ a b c d e f Brownstein MJ (June 1993). "A brief history of opiates, opioid peptides, and opioid receptors" (PDF). Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 90 (12): 5391–3. Bibcode:1993PNAS...90.5391B. doi:10.1073/pnas.90.12.5391. PMC 46725. PMID 8390660.
- ^ a b c d Duarte DF (February 2005). "Uma breve história do ópio e dos opióides" (PDF). Revista Brasileira de Anestesiologia. 55 (1). doi:10.1590/S0034-70942005000100015.
- ^ Rosso AM (2010). "Poppy and Opium in Ancient Times: Remedy or Narcotic?". Biomedicine International. 1: 81–87. CiteSeerX 10.1.1.846.221.
- ^ Astyrakaki E, Papaioannou A, Askitopoulou H (January 2010). "References to anesthesia, pain, and analgesia in the Hippocratic Collection". Anestezi ve Analjezi. 110 (1): 188–94. doi:10.1213/ane.0b013e3181b188c2. PMID 19861359. S2CID 25919738.
- ^ Türe H, Türe U, Gögüs FY, Valavanis A, Yasargil MG (September 2006). "987 The Art of Alleviating Pain in Greek Mythology". European Journal of Pain (Abstracts of Pain in Europe V 5th Congress of the European Federation of IASP Chapters (EFIC)). 10 (S1): S255b–S255. doi:10.1016/S1090-3801(06)60990-7.
Sedare dolorem opus divinum est – an old Latin inscription – means "alleviating pain is the work of the divine". This inscription is often attributed to either Hippocrates of Kos or Galen of Pergamum, but it is most likely an anonymous proverb
- ^ Osbaldeston TA (2000). Dioscorides (translation). Johannesburg, South Africa: Ibidis Press. pp. 607–611. ISBN 978-0-620-23435-1.
- ^ Heydari M, Hashempur MH, Zargaran A (2013). "Medicinal aspects of opium as described in Avicenna's Canon of Medicine". Acta Medico-Historica Adriatica. 11 (1): 101–12. PMID 23883087.
- ^ a b c Asthana SN (1954). "The Cultivation of the Opium Poppy in India". Narkotik Bülten (3). Alındı 5 Eylül 2018.
- ^ a b c Sigerist HE (1941). "Paracelsus'un Eserlerinde Laudanum" (PDF). Boğa. Geçmiş Orta. 9: 530–544. Alındı 5 Eylül 2018.
- ^ a b c d e Hamilton GR, Baskett TF (April 2000). "In the arms of Morpheus the development of morphine for postoperative pain relief". Kanada Anestezi Dergisi. 47 (4): 367–74. doi:10.1007/BF03020955. PMID 10764185.
- ^ a b Farooqui A (December 2016). "The Global Career of Indian Opium and Local Destinies" (PDF). Almanak (14): 52–73. doi:10.1590/2236-463320161404. Alındı 5 Eylül 2018.
- ^ a b Deming S (2011). "The Economic Importance of Indian Opium and Trade with China on Britain's Economy, 1843–1890" (PDF). Economic Working Papers. 25 (Bahar). Alındı 5 Eylül 2018.
- ^ a b c d e f g h ben j k Rinde M (2018). "Opioids' Devastating Return". Damıtmalar. 4 (2): 12–23. Alındı 23 Ağustos 2018.
- ^ Mills JH (2016). Review of 'Opium and Empire in Southeast Asia: Regulating Consumption in British Burma'. Geçmişteki İncelemeler. Cambridge imperial and post-colonial studies series. Palgrave Macmillan. doi:10.14296/RiH/2014/2010. ISBN 9780230296466. Alındı 5 Eylül 2018.
- ^ Krishnamurti C, Rao SC (November 2016). "The isolation of morphine by Serturner". Hint Anestezi Dergisi. 60 (11): 861–862. doi:10.4103/0019-5049.193696. PMC 5125194. PMID 27942064.
- ^ Courtwright DT (2009). Forces of habit drugs and the making of the modern world (1 ed.). Cambridge, Mass .: Harvard University Press. sayfa 36–37. ISBN 9780674029903.
- ^ Atanasov AG, Waltenberger B, Pferschy-Wenzig EM, Linder T, Wawrosch C, Uhrin P, et al. (Aralık 2015). "Discovery and resupply of pharmacologically active plant-derived natural products: A review". Biyoteknoloji Gelişmeleri. 33 (8): 1582–1614. doi:10.1016/j.biotechadv.2015.08.001. PMC 4748402. PMID 26281720.
- ^ Kotwal A (March 2005). "Innovation, diffusion and safety of a medical technology: a review of the literature on injection practices". Sosyal Bilimler ve Tıp. 60 (5): 1133–47. doi:10.1016/j.socscimed.2004.06.044. PMID 15589680.
- ^ Mosher CJ (2013). Drugs and Drug Policy: The Control of Consciousness Alteration. SAGE Yayınları. s. 123. ISBN 9781483321882.
- ^ Fisher GL (2009). Encyclopedia of substance abuse prevention, treatment, & recovery. Los Angeles: SAGE. s. 564. ISBN 9781452266015.
- ^ a b Trickey E (4 January 2018). "Inside the Story of America's 19th-Century Opiate Addiction". Smithsonian. Alındı 6 Eylül 2018.
- ^ Schechter NL (1993). Pain in Infants, Children, and Adolescents. Williams & Wilkins. ISBN 9780683075885. Alındı 6 Eylül 2018.
- ^ Hicks RD (2011). "Frontline Pharmacies". Chemical Heritage Dergisi. Kimyasal Miras Vakfı. Alındı 29 Ekim 2018.
- ^ a b Booth M (12 June 1999). Opium : a history (1. ABD baskısı). St. Martin's Press. ISBN 978-0312206673.
- ^ Wisniak J (March 2013). "Pierre-Jean Robiquet". Educación Química. 24: 139–149. doi:10.1016/S0187-893X(13)72507-2. Alındı 9 Kasım 2019.
- ^ Filan K (2011). The power of the poppy : harnessing nature's most dangerous plant ally. Park Street Press. s. 69. ISBN 9781594773990. Alındı 30 Ekim 2018.
- ^ "Felix Hoffmann". Bilim Tarihi Enstitüsü. 2016 Haziran. Alındı 21 Mart 2018.
- ^ Cooper R, Deakin JJ (22 February 2016). Botanical miracles : chemistry of plants that changed the world. CRC Basın. s. 137. ISBN 9781498704281.
- ^ Sneader W (November 1998). "The discovery of heroin" (PDF). Lancet. 352 (9141): 1697–9. doi:10.1016/S0140-6736(98)07115-3. PMID 9853457. S2CID 1819676.
Bayer registered the name heroin in June, 1898.
- ^ a b c d e Newton DE (2016). Youth substance abuse : a reference handbook. Santa Barbara, CA: ABC-CLIO. sayfa 41–60. ISBN 9781440839832. Alındı 30 Ekim 2018.
- ^ Crow JM (3 January 2017). "Addicted to the cure". Kimya Dünyası. Alındı 30 Ekim 2018.
- ^ Methadone Matters: Evolving Community Methadone Treatment of Opiate Addiction. CRC Basın. 2003. s. 13. ISBN 9780203633090. Arşivlendi 23 Aralık 2015 tarihinde orjinalinden.
- ^ "Fact Sheet: Fentanyl and Synthetic Opioids" (PDF). Uyuşturucu Politikası İttifakı. Eylül 2016. Alındı 30 Ekim 2018.
- ^ "Laws Learn about the laws concerning opioids from the 1800s until today". The National Alliance of Advocates for Buprenorphine Treatment. Alındı 30 Ekim 2018.
- ^ White WL. "The Early Criminalization of Narcotic Addiction" (PDF). William White Papers. Alındı 30 Ekim 2018.
- ^ Mars S (2003). "Peer pressure and imposed consensus: the making of the 1984 Guidelines of Good Clinical Practice in the Treatment of Drug Misuse". Clio Medica. 75 (2): 149–83. doi:10.1258/jrsm.96.2.99. PMC 539406. PMID 16212730.
- ^ a b Jacobs H (26 May 2016). "This one-paragraph letter may have launched the opioid epidemic". Business Insider. Alındı 30 Ekim 2018.
- ^ Portenoy RK, Foley KM (May 1986). "Chronic use of opioid analgesics in non-malignant pain: report of 38 cases". Ağrı. 25 (2): 171–86. doi:10.1016/0304-3959(86)90091-6. PMID 2873550. S2CID 23959703.
- ^ a b c Meldrum ML (August 2016). "The Ongoing Opioid Prescription Epidemic: Historical Context". Amerikan Halk Sağlığı Dergisi. 106 (8): 1365–6. doi:10.2105/AJPH.2016.303297. PMC 4940677. PMID 27400351.
- ^ Quinones S (2015). Dreamland : the true tale of America's opiate epidemic. Bloomsbury Press. ISBN 9781620402511.
- ^ Dowell D, Haegerich TM, Chou R (March 2016). "CDC Guideline for Prescribing Opioids for Chronic Pain - United States, 2016". MMWR. Recommendations and Reports. 65 (1): 1–49. doi:10.15585/mmwr.rr6501e1. PMID 26987082.
- ^ FDA launches public education campaign to encourage safe removal of unused opioid pain medicines from homes, PM FDA 25 April 2019, retrieved 10 May 2019
- ^ "opioid: definition of opioid in Oxford dictionary (American English) (US)". www.oxforddictionaries.com. Alındı 14 Şubat 2016.
Opioid: 1950s: from opium + -oid.
- ^ Wikler A, Martin WR, Pescor FT, Eades CG (October 1963). "Factors regulating oral consumption of an opioid (Etonitazene) by morphine-addicted rats". Psikofarmakoloji. 5: 55–76. doi:10.1007/bf00405575. PMID 14082382. S2CID 38073529.
In this paper, the term, 'opioid', is used in the sense originally proposed by DR. GEORGE H. ACHESON (personal communication) to refer to any chemical compound with morphine-like activities.
- ^ Martin WR (December 1967). "Opioid antagonists". Farmakolojik İncelemeler. 19 (4): 463–521. PMID 4867058.
- ^ Mehdi B (2008). "Opioid analgesics and antagonists". In Seth SD, Seth V (eds.). Textbook of Pharmacology. Elsevier Hindistan. s. III.137. ISBN 9788131211588.
- ^ "Epidemic: Responding to America's Prescription Drug Abuse Crisis" (PDF). Beyaz Saray. 2011. Arşivlenen orijinal (PDF) 3 Mart 2012.
- ^ "First Do No Harm: Responding to Canada's Prescription Drug Crisis" (PDF). Mart 2013. Alındı 8 Mart 2017.
- ^ "UK: Task Force offers ideas for opioid addiction solutions". Delhidailynews.com. 11 Haziran 2014. Arşivlenen orijinal 6 Haziran 2017'de. Alındı 7 Ocak 2016.
- ^ Kite A (29 April 2018). "Every state but Missouri has opioid drug tracking. Why are senators against it?". Kansas City Yıldızı. Alındı 5 Kasım 2018.
- ^ Rutkow L, Turner L, Lucas E, Hwang C, Alexander GC (March 2015). "Most primary care physicians are aware of prescription drug monitoring programs, but many find the data difficult to access". Sağlık işleri. 34 (3): 484–92. doi:10.1377/hlthaff.2014.1085. PMID 25732500.
- ^ Perrone M (20 December 2015). "Painkiller politics: Effort to curb prescribing under fire". İlişkili basın. Philly.com. Alındı 7 Ocak 2016.
- ^ Von Korff M, Dublin S, Walker RL, Parchman M, Shortreed SM, Hansen RN, Saunders K (January 2016). "The Impact of Opioid Risk Reduction Initiatives on High-Dose Opioid Prescribing for Patients on Chronic Opioid Therapy". Acı Dergisi. 17 (1): 101–10. doi:10.1016/j.jpain.2015.10.002. PMC 4698093. PMID 26476264.
- ^ Achenbach J, Wagner J, Bernstein L. "Trump says opioid crisis is a national emergency, pledges more money and attention". Washington Post. Alındı 11 Ağustos 2017.
- ^ "Feasibility Study on Opium Licensing in Afghanistan for the Production of Morphine and Other Essential Medicines". ICoS. September 2005.
- ^ "Assuring Availability of Opioid Analgesics" (PDF). Dünya Sağlık Örgütü. Arşivlenen orijinal (PDF) on 1 December 2009.
- ^ Ghelardini C, Di Cesare Mannelli L, Bianchi E (2015). "The pharmacological basis of opioids". Clinical Cases in Mineral and Bone Metabolism. 12 (3): 219–21. doi:10.11138/ccmbm/2015.12.3.219. PMC 4708964. PMID 26811699.
The opioid effects transcending analgesia include sedation, respiratory depression, constipation and a strong sense of euphoria.
- ^ Barrett SP, Meisner JR, Stewart SH (November 2008). "What constitutes prescription drug misuse? Problems and pitfalls of current conceptualizations" (PDF). Güncel Uyuşturucu Bağımlılığı İncelemeleri. 1 (3): 255–62. doi:10.2174/1874473710801030255. PMID 19630724. Arşivlenen orijinal (PDF) 15 Haziran 2010.
- ^ McCabe SE, Boyd CJ, Teter CJ (June 2009). "Subtypes of nonmedical prescription drug misuse". Uyuşturucu ve Alkol Bağımlılığı. 102 (1–3): 63–70. doi:10.1016/j.drugalcdep.2009.01.007. PMC 2975029. PMID 19278795.
- ^ "Prescription Opioid Overdose Data | Drug Overdose | CDC Injury Center". www.cdc.gov. 31 Ağustos 2018. Alındı 17 Ocak 2017.
- ^ Roth, Bryan L .; Baner, Karen; Westkaemper, Richard; Siebert, Daniel; Rice, Kenner C.; Steinberg, SeAnna; Ernsberger, Paul; Rothman, Richard B. (3 September 2002). "Salvinorin A: A potent naturally occurring nonnitrogenous κ opioid selective agonist". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 99 (18): 11934–11939. Bibcode:2002PNAS...9911934R. doi:10.1073/pnas.182234399. ISSN 0027-8424. PMC 129372. PMID 12192085.
- ^ "Esters of Morphine". Birleşmiş Milletler Uyuşturucu ve Suç Ofisi. 1953. Alındı 10 Mart 2012.
- ^ "Esters of Morphine Opioids". eOpiates. 28 Mayıs 2014. Alındı 12 Şubat 2016.[kalıcı ölü bağlantı ]
- ^ Raffa RB, Buschmann H, Christoph T, Eichenbaum G, Englberger W, Flores CM, et al. (Temmuz 2012). "Mechanistic and functional differentiation of tapentadol and tramadol". Farmakoterapi Üzerine Uzman Görüşü. 13 (10): 1437–49. doi:10.1517/14656566.2012.696097. PMID 22698264. S2CID 24226747.
- ^ Rojas-Corrales MO, Gibert-Rahola J, Micó JA (1998). "Tramadol induces antidepressant-type effects in mice". Yaşam Bilimleri. 63 (12): PL175-80. doi:10.1016/S0024-3205(98)00369-5. PMID 9749830.
- ^ Stein C, Schäfer M, Machelska H (August 2003). "Attacking pain at its source: new perspectives on opioids". Doğa Tıbbı. 9 (8): 1003–8. doi:10.1038/nm908. PMID 12894165. S2CID 25453057.
- ^ Stein C, Lang LJ (February 2009). "Peripheral mechanisms of opioid analgesia". Farmakolojide Güncel Görüş. 9 (1): 3–8. doi:10.1016/j.coph.2008.12.009. PMID 19157985.
- ^ Busch-Dienstfertig M, Stein C (July 2010). "Opioid receptors and opioid peptide-producing leukocytes in inflammatory pain--basic and therapeutic aspects". Beyin, Davranış ve Bağışıklık. 24 (5): 683–94. doi:10.1016/j.bbi.2009.10.013. PMID 19879349. S2CID 40205179.
- ^ Odell LR, Skopec J, McCluskey A (March 2008). "Isolation and identification of unique marker compounds from the Tasmanian poppy Papaver somniferum N. Implications for the identification of illicit heroin of Tasmanian origin". Adli Bilimler Uluslararası. 175 (2–3): 202–8. doi:10.1016/j.forsciint.2007.07.002. PMID 17765420.
Dış bağlantılar
- Opioid Withdrawal Symptoms —Information about Opioid and opiate withdrawal issues
- World Health Organization guidelines for the availability and accessibility of controlled substances
- CDC Guideline for Prescribing Opioids for Chronic Pain — United States, 2016
- Reference list to the previous publication
- Links to all language versions of the previous publication
- Video: Opioid side effects (Vimeo) (Youtube) —A short educational film about the practical management of opioid side effects.