Nikotinik agonist - Nicotinic agonist - Wikipedia
Bir nikotinik agonist eylemini taklit eden bir ilaçtır asetilkolin (ACh) nikotinik asetilkolin reseptörleri (nAChR'ler). NAChR, nikotin afinitesinden dolayı adlandırılmıştır.
Örnekler şunları içerir: nikotin (tanım olarak), asetilkolin ( endojen agonist NAChR sayısı), kolin, epibatidin, lobeline, vareniklin ve şistisine.
Tarih

Nikotin, sarhoş edici etkisiyle yüzyıllardır bilinmektedir. İlk olarak 1828'de tütün bitkisi Alman kimyagerler Posselt ve Reimann tarafından.[1]
Nikotinin hayvan hafızası üzerindeki olumlu etkilerinin keşfi, in vivo 1980'lerin ortalarında araştırmalar. Bu araştırmalar, nikotinik asetilkolin reseptörü (nAChR) ve bunların uyarılması çalışmalarında yeni bir döneme yol açtı, ancak o zamana kadar odak esas olarak nikotin bağımlılığındaydı.[2][3] NAChR agonistlerinin gelişimi, nikotinin olumlu etkilerinin keşfedilmesinden sonra 1990'ların başında başladı. Bazı araştırmalar, klinik öncesi araştırmalarda olası bir tedavi seçeneği gösterdi. ABT-418 bir dizi nAChR agonistinin ilklerinden biriydi ve Abbott Labs.[3] ABT-418, olgunlaşmış durumda numuneyle eşleştirme (DMTS) gecikmeli performansında önemli artış gösterdi. makak maymunları farklı tür ve cinsiyetten.[4] ABT-418 ayrıca Alzheimer hastalığı, Parkinson hastalığı ve dikkat eksikliği hiperaktivite bozukluğunun olası bir tedavisi olarak da incelendi: bu deneyler olumlu sonuçlar gösterdi.[3]
İlaç olarak pazarlanan nikotinin yanı sıra ilk nAChR aktif bileşiklerinden biri galantamin, Bir bitki alkaloit zayıf olarak çalışan kolinesteraz inhibitör (IC50 = 5uM) ve nAChR'ler için bir allosterik duyarlılaştırıcı (EC50 = 50 nM).[5]
Nikotinik asetilkolin reseptörleri ve sinyalleme sistemleri

Sinyal sistemi
İnsanda gergin sistem nikotinik kolinerjik sinyaller, nörotransmiter asetilkolinin (ACh) aktive edilmesinde önemli bir rol oynadığı sistem boyunca genişletilir. ligand kapılı iyon kanalları.[6] Kolinerjik sistem, kolinerjik nöronların nörotransmiter ACh'yi sentezlediği, depoladığı ve serbest bıraktığı hayati bir sinir yoludur. ACh mesajlarını dönüştüren ana reseptörler, kolinerjik muskarinik asetilkolin reseptörleri, nöronal ve kaslı nAChR'ler. Evrimsel geçmişe dönüp bakıldığında, ACh en eski verici molekül olarak kabul edilir ve sinir hücresinden önce ortaya çıktı. Sinir sisteminde, nAChR'lerin aracılık ettiği kolinerjik stimülasyon, uyku, anksiyete, ağrının işlenmesi ve bilişsel işlevler dahil olmak üzere fizyolojik aktiviteyi etkileyebilen, verici salınımı ve hücre hassasiyeti gibi yolları kontrol eder.[7]
Nikotinik asetilkolin reseptörleri
nAChR'ler kolinerjik merkezi sinir sisteminde (CNS), periferik sinir sistemlerinde (PNS) ve iskelet kaslarında bulunan reseptörler, bu reseptörler, asetilkolin ve diğer moleküller için bağlanma yerleri olan ligand kapılı iyon kanallarıdır. ACh veya diğer agonistler reseptörlere bağlandığında, potasyum, kalsiyum ve sodyum iyonları gibi katyonların akışına izin veren iyon kanalının açık durumunu stabilize eder. NAChR'ler, farklı alt birimlerden oluşur. Kuaterner yapı Reseptörün alt birimleri, a alt birimleri (α1 − α10), alt birimleri (β1 − β4), bir δ alt birimi, bir γ alt birimi ve bir ε alt birimidir. nAChR'ler, heteromerik veya homomerik. Merkezi sinir sisteminde bulunan heteromerik reseptörler, iki a alt birimi ve a ve bitişik alt birimin arayüzünde bağlanma yeri olan üç p alt biriminden oluşur. Bu reseptörler, reseptör başına iki bağlanma sahası içerir ve alt birimlerin bileşimine bağlı olarak kimyasallar için farklı afiniteye sahiptir. Her iki bağlanma bölgesi birlikte çalışır ve bu nedenle her iki bölgenin de bir nAChR agonisti ile işgal edilmesi gerekir, böylece kanal aktivasyonu gerçekleşebilir.[8] α2 − α6 ve β2 − β4 alt birimlerini içeren nAChR'lerin, ACh için diğer reseptörlere göre daha yüksek afiniteye sahip olduğu gösterilmiştir. Homomerik reseptörler 5 özdeş alt birim içerirler, iki bitişik alt birim arasındaki arayüzde bulunan 5 bağlanma yerine sahiptirler. 2000 yılında insanlarda α7 ve α8 reseptörleri olmak üzere iki homomerik reseptör tanımlanmıştır.[7][9][10][11]
Bağlayıcı site
Heteromerik nAChR'ler üzerinde iki bağlanma sahası vardır; nAChR'lerin açık formunu stabilize etmek için, her iki bağlanma bölgesinin nikotin veya ACh gibi agonist tarafından işgal edilmesi gerekir.[10]
NAChR'nin ACh bağlanma bölgesi, A – F olarak adlandırılan altı döngüden oluşur. Bağlanma sahasının A, B ve C ilmekleri, a alt biriminin bir parçasıdır ve bağlanma sahasının ana bileşenleridir. Α alt birimine (γ, δ, ε veya β) bitişik alt birim D, E ve F döngülerini içerir.[10]
Hareket mekanizması

α4β2 reseptör agonistleri
α4β2 nAChR'ler iki α4 alt birimi ve üç β2 alt birimi içerir, bu nedenle ACh için iki bağlanma bölgesi ve diğer agonistler. α4β2 nAChR'ler, insan beynindeki nAChR'lerin yaklaşık% 90'ını oluşturur ve kronik olarak nikotin veya diğer nikotin agonistlerine maruz kaldıklarında, α4β2 reseptörlerinin yoğunluğunda artışa yol açar; bu, diğer reseptörler kronik olarak agonistlerine maruz kaldıklarında genellikle olanın tam tersidir. Α4β2 reseptörü, Alzheimer hastalığının yanı sıra nikotin bağımlılığı açısından geniş çapta incelenmiştir ve 2009'da, spesifik olarak α4β2 nAChR'yi hedefleyen birkaç ilaç piyasada bulunmaktadır.[12][13]
α7 reseptör agonistleri
a7 reseptörleri, beş a7 alt biriminden oluşan ve beş ACh bağlanma yerine sahip homomerik nöronal asetilkolin reseptörleridir. Α7 reseptör ekspresyonundaki anormalliğin, Alzheimer hastalığı gibi hastalıkların ilerlemesini etkilediği bildirilmiştir. şizofreni. Α7'nin nikotin için heteromerik reseptör kadar afiniteye sahip olduğuna inanılmamakta, bunun yerine alfa bungarotoksin Bu, bazı yılanların zehirinde bulunan nikotinik bir antagonisttir. Bu nedenle a7 reseptörlerinin hedeflenmesinin Alzheimer hastalığı ve şizofreninin tedavisinde faydalı olduğu düşünülmektedir.[8][14]
Kas tipi reseptör agonistleri
nAChR şurada bulunur: nöromüsküler bağlantı iskelet kaslarında. Biri yetişkinlerde bulunan iki farklı reseptör bulundu, biri α1 alt birimi, biri 1, biri ε ve diğeri, diğeri fetüslerde bulundu ve ε alt birimi yerine γ alt birimi içeriyor. NAChR'ler, depolarizasyon iskelet kaslarının kasılmasına yol açan katyon geçirgenliğini artırarak kas uç plakasının[15] İskelet kası sisteminde bulunan nAChR'ler, biri a1 ve p alt birimleri arasındaki arayüzde bulunurken diğeri α1 ve γ veya ε alt birimleri arasındaki arayüzde bulunan iki ACh bağlama bölgesine sahiptir. Nöromüsküler sistem için özel olarak tasarlanmış nAChR antagonistleri arasında, sinir gazları ve insanları veya diğer hayvanları ve böcekleri hızla öldürmek için tasarlanmış diğer zehirler bulunur.[11]
Bağlayıcı
ACh, molekül ve reseptör yüzeyi arasındaki yük farkı nedeniyle nAChR'ye bağlanır. NAChR'ye bağlanırken ACh, a alt birimine ve bitişik alt birimine ait olan A, B ve C ilmekleri ile şekillendirilmiş bir bağlanma cebine oturur. ACh, bağlanma cebine yerleştirildiğinde, nAChR'nin ilmekleri, molekül ile reseptör arasındaki kimyasal bağları güçlendiren cepte ACh molekülünün koordinasyonuna yol açan harekete geçer. Α alt birimine ait ilmeklerin hareketinden sonra bazen ACh molekülünün bir bağ oluşturması mümkündür, örn. alıcı ve ACh arasındaki bağları daha da güçlendiren bitişik alt birime tuz köprüsü.[16]
İlaç tasarımı
NAChR'leri etkileyen ilaçlar agonistler, kısmi agonistler veya antagonistler. Agonistler, ör. Ancak nikotin, nAChR'lerle bir süre (konsantrasyona ve nAChR alt tipine bağlı olarak saniyeler veya dakikalar) karşılaşıldığında depolarize edici ajanlar olarak hareket edebilir, ayrıca agoniste kronik maruz kalma, hızlı ve kalıcı duyarsızlaştırma nedeniyle uzun süreli fonksiyonel deaktivasyona da yol açabilir. Kısmi nAChR agonistleri, sigarayı bırakmada yardımcı oldukları için incelenmiştir. Kısmi agonistlerin nAChR'lere bağlandıklarına ve salımını uyardıklarına inanılmaktadır. dopamin agonistlerden daha küçük porsiyonlarda ve bu nedenle nikotin yokluğunu telafi ediyor.[17]
Nikotinik agonistlerin bazıları arasındaki özgüllük eksikliği iyi bilinmektedir ve bunları belirli bir nAChR alt tipini hedeflemeyi gerektiren hastalıkları tedavi etmek için kullanırken potansiyel bir sorundur. Bu spesifik olmayan agonistler arasında örneğin ACh, nikotin ve epibatidin hepsi birden fazla nAChR alt türünü hedefliyor.[18]
Farmakofor

NAChR agonistinin gelişimi farmakofor 1970 yılında agonistlerin bir reseptöre bağlanmasının, pozitif yüklü bir nitrojen atomuna ve asetilkolindeki karbonil oksijen atomundan veya (S) -nikotin içindeki bir nitrojen atomundan oluşan bir hidrojen bağına bağlı olduğu öne sürüldüğünde başlamıştır. O zamandan beri, katyonik bir merkezin, elektronegatif olan ve (S) -nikotindeki piridin halkasının merkezi ile birlikte hidrojen bağları oluşturabilen atomların uygun olduğu gösterilmiştir. Stereokimya (S) - ve (R) - nikotin ile açıkça görüldüğü gibi farmakoforun bir parçasıdır, burada (S) -enantiyomer 10-100 kat daha güçlüdür. Epibatidinin azabisiklik halkası, reseptörlerle olumlu sterik etkileşimlerin bir başka örneğidir. Belirli bir internitrojen mesafesinin, N+-N, agonist afinite için önemlidir, ancak etkisi konusunda tartışmalar ortaya çıkmıştır. Daha yeni bir teori, protonlanmış nitrojen atomunu ve hidrojen bağı alıcısını tamamlayan noktalar arasındaki 7-8 distance'lik bir mesafenin gücü artıracağıdır. Düşük elektronik yoğunluk protonlanmış nitrojene yakın ve piridin halkasına yakın daha yüksek elektron yoğunluğu protonlanmış nikotinde tercih edilir ligandlar piridin halkası içeren. Daha sonraki yıllarda araştırmacılar, nikotin bağımlılığını ve Alzheimer gibi bilişsel bozuklukları tedavi etmek için ilaç geliştirmede α7 ve α4β2 alt tip reseptörlerine daha fazla ilgi gösterdiler.[19]
Yapı-aktivite ilişkileri
Yapı-aktivite ilişkileri: Kas nAChR agonistleri
Daha yüksek afinite için hayati önem taşıyan molekülleri, grupları ve sterik konformasyonu tanımlamaya yardımcı olmak için nAChR agonistlerinin reseptör alt tipine afinitesinin test edildiği çeşitli modeller yürütülmüştür. Bir nAChR kas reseptörü alt tipi (α1) kullanarak2β1δγ modeli aşağıdaki sonuçlar elde edilmiştir:
- anatoksin> epibatidin> asetilkolin> DMPP >> şistisine > pirantel > nikotin> koni > tubocurare > lobeline,
anatoksinin en yüksek aktivite etkinliğine sahip olduğu ve tubokürenin en düşük olduğu yer. Öte yandan asetilkolin, anatoksin daha güçlü olmasına rağmen reseptörün çok daha uzun bir açılma süresine neden oldu. Sonuçlar, anatoksin türevlerinin kas nAChR'leri için yapı-aktivite ilişkilerini (SAR) anlamada yardımcı olacağını düşündürmektedir.[20]
Süksinilkolin klorür Halihazırda piyasada bulunan bir ilaç olan, biskolin ester ve kısa etkili bir kas gevşetici maddedir. Biskolin esterleri, kas tipi nAChR'ler üzerinde rekabetçi bir agonist olarak hareket edebilen ve SAR çalışmalarında kullanılan bileşiklerdir. İçinde Torpido (α1)2β1δγ nAChR modeli, biskolin ester agonistlerinin potensinin, daha uzun zincirlerle potens arttıkça zincir uzunluğuna bağlı olduğu gösterilmiştir. Etkinlik, zincir uzunluğundan bağımsız görünmektedir çünkü en yüksek etkinlik biskolin esterlerde dört ila yedi CH
2 birimleri ve daha azı için daha düşük CH
2 birimler ve daha fazlası.[21]
Yapı-aktivite ilişkileri: α4β2 nAChR agonistleri

ACh ve nikotinin yapısal elemanlarının kombinasyonu ve ayrıca bir siklopropan halkası kullanılarak konformasyonel esnekliğin azaltılması, güçlü ve seçici a4β2 nAChR ligandlarının keşfedilmesine yol açmıştır. Üç yapısal elemanın modülasyonu, bağlayıcı, amino grubu üzerindeki ikame ve piridin halkası, ligandların gücü ve seçiciliği üzerindeki etkiyi belirlemek için kullanılabilir. Bağlanmayı azaltan faktörler, amino grubu ve doymuş / doymamış karbon zincirleri olan bağlayıcılar üzerindeki sterik engellerdir. Kısa zincirli eter bağlayıcılar tercih edilir. Bağlanma üzerindeki yararlı etkiler, diğer gruplar arasında hem tekli hem de ikili ikame piridin halkası üzerindeki ikame ile görülmektedir. Üç farklı amid ile amino grubu üzerinde ikame, en yüksek bağlanmaya metilamidin sahip olduğu bağlanma afinitesini arttırdı. Diğer ikame edilmiş amidlerde daha düşük bağlanma, sterik engelleme veya hidrofobik etkileşim kaybıyla sonuçlanan bir metil grubunun olmaması ile açıklandı. Piridin nitrojen ve / veya piridin halkasının stereokimyası ve bunun stereoelektronik etkileri, a4β2 nAChR'ye bağlanma üzerinde hafif bir faydalı etkiye sahiptir. Böylelikle piridin üzerinde bromo ikameli bir piridil eter ligandının ve amino grubu üzerinde metillenmişamidin en yüksek potansiyele sahip olduğu gösterilmiştir.[22]
Yapı-aktivite ilişkileri: α7 nAChR agonistleri

Seçici ve güçlü a7 nAChR agonistlerinin araştırılması, ilaç adayları olarak iyi potansiyele sahip bir dizi bileşik üretmiştir. Böyle bir arama yapıldı SEN12333 / WAY-317538, istenen diğer bileşikler arasında farmakokinetik profilleri ve α7 nAChR'lerin α1, α3 ve α4β2 nAChR'lere göre seçicidir. Bu bileşikler için yapı aktivite ilişkileri önerilmiştir.[14] A7 nAChR agonistinin optimal farmakoforu üç kısımdan oluşur. Bir aromatik kısma bir amid köprüsü ile bağlı bir karbon zincirine bağlı bir bazik kısım vardır. Amid köprüsü, agonistin gücünü etkilemeden tersine çevrilebilir. Biaril grubu, aromatik kısım ve sonraki aril grubu üzerindeki 2 konumundaki ikame gücü daha da artıracağından, bir monoaril grubundan daha fazla güç gösterir. H ile agonistler için potens daha yüksektir+ biaril grubu üzerindeki sonraki aril grubu üzerinde verici / alıcı. Yüksek sayıda hidrojen bağı alıcılar boyunca geçirgenliği azaltabilir Kan beyin bariyeri (BBB) polar yüzey alanı nedeniyle ve a7 nAChR'leri hedeflemek için agonistler tasarlanırken hesaba katılmalıdır.[14]
Çeşitli döngüsel amin gruplar temel parça olarak hareket edebilir ve etki gücü nispeten değişmeden kalır, örneğin aril piperazin, piperidin ve morfolin. Asiklik bir üçüncül amin, bazik kısım olarak tolere edilir, ancak daha büyük sterik gruplar daha az tolere edilir.[14]
Birçok türevi kinüklidin kinüklidin amid gibi, a7 nAChR agonistleri olduğu bilinmektedir. Kinüklidin amid için SAR çalışmaları, bu agonistlerin gücünü ve afinitesini etkileyen faktörleri belirlemiştir. Kinüklidin halkasında para ikamesi ve stereokimyada 3- (R) konfigürasyonu tercih edilir. 5 üyeli bir halka aromatik kısma kaynaştırıldığında artan aktivite gözlemlenir. Kaynaşmış halka, amid karbonile elektron rezonansı sağlayabildiğinde daha fazla gelişme görülür, oysa kaynaşmış halka bir hidrojen bağı veren atom içerdiğinde aktivite azalır. Kinüklidinin sertliği ve nitrojen köprüsünün amid karbonil grubuna ilişkin ortogonal oryantasyonunun optimal bağlanma için önemli olduğu varsayılır. Daha güçlü kinüklidin amid türevlerinin bazılarının sıçandaki stabilitesi laboratuvar ortamında modeller düşüktü, ancak kinüklidin halkası üzerindeki 2. konuma bir metil grubu ekleyerek stabilite büyük ölçüde arttı.[23]
İlaç geliştirme
Nikotinik asetilkolin reseptör agonistlerinin gelişimi, nikotinin hayvan hafızası üzerindeki olumlu etkilerinin keşfedilmesinden sonra 1990'ların başında başladı.[2][3] Nikotinik asetilkolin reseptör agonistlerinin gelişimi o zamandan beri uzun bir yol kat etti. Nikotinik asetilkolin reseptör agonistleri, aşağıdakiler gibi çoklu merkezi sinir sistemi bozuklukları için ilaç adayı olarak giderek artan bir ilgi kazanıyor. Alzheimer hastalığı, şizofreni, Dikkat eksikliği hiperaktivite bozukluğu (DEHB) ve nikotin bağımlılığı.[24][25] Nikotinik asetilkolin reseptörleri alıcılar bulunur mu Merkezi sinir sistemi, periferik sinir sistemleri ve iskelet kasları. Ligand kapılı iyon kanallarıdır. bağlayıcı siteler için asetilkolin yanı sıra diğerleri agonistler. Agonistler bir reseptör iyon kanalının açık durumunu stabilize ederek içeri girmesine izin verir katyonlar.[8]
2009'da piyasada nikotinik asetilkolin reseptörlerini etkileyen en az beş ilaç vardı.
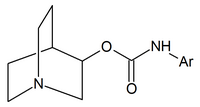 |  | 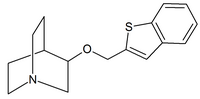 |
| Kinüklidin karbamatlar | Kinüklidin amidler | Kinüklidin eterler |
Nikotinik agonist ürünleri
| Aktif madde | Ürün adı | Kimyasal ad | Farmasötik form | Farmakodinamik özellikler | Terapötik kullanım | Yapısı |
|---|---|---|---|---|---|---|
| Vareniklin tartrat | Champix, Chantix | 7,8,9,10-tetrahidro-6,10-metano-6H-pirazino [2,3-h] [3] benzazepin[25] | Film kaplı tablet | Nikotinik asetilkolin reseptörünün kısmi agonisti, alt tip a4β2[26] | Tütün bağımlılığının tedavisi[26] |  |
| Galantamin hidrobromür | Reminyl, Nivalin, Razadyne ve Razadyn ER | 4a, 5,9,10,11,12-hekzahidro-3-metoksi-11-metil-6H-benzofuro [3a, 3,2-ef] [2] -benzazepin-6-ol[27] | Sürekli salım kapsülü, film kaplı tablet, oral çözelti | Kolinesteraz inhibitörü ve nikotinik asetilkolin reseptörünün rekabetçi olmayan bir agonisti[3] | Alzheimer hastalığının neden olduğu demans tedavisi[28] | 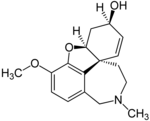 |
| Nikotin | Nicorette, Nicotinell, Niquitin, Boots NicAssist, Commit, Habitrol, Nicoderm CQ, Nicotrol, Thrive | 3 - [(2S) -1-metilpirolidin-2-il] piridin | Transdermal yama, sakız, inhaler, burun spreyi, pastil, mikrotab ve doğal olarak tütünde bulunur | Nikotinik reseptör agonisti,[29] her ikisi de Ganglion türü ve α4β2[30] | Tütün bağımlılığının tedavisi[31] | 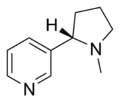 |
| Karbakol | Miostat | 2 - [(aminokarbonil) oksi] -N, N, N-trimetiletanaminyum | Göz içi çözüm | Kolinerjik agonist[32] | Glokom tedavisi | 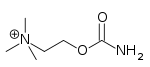 |
| Süksametonyum klorür (Süksinilkolin klorür) | Anektin, Quelicin Suxamethonium Klorür | 2,2 '- [(1,4-dioksobütan-1,4-diyil) bis (oksi)] bis (N, N, N-trimetiletanaminyum) | İntravenöz veya intramüsküler enjeksiyon | Depolarize edici nöromüsküler bloke edici ajan[33] | Kısa etkili kas gevşetici[34] | |
| Epibatidin | Listelenmemiş | 2- (6-kloropiridin-3-il) -7-azabisiklo [2.2.1] heptan | Listelenmemiş | Nikotinik asetilkolin reseptörünün agonisti[35] | İlaç olarak kullanılmaz | 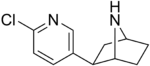 |
Genel olarak sınırlı klinik kullanıma sahip olsalar da diğer nikotinik agonistler şunları içerir:
- lobeline bir agonist Ganglion tipi nikotinik reseptörler ve ayrıca etkiler duyu siniri terminalleri[30]
- epibatidin bir agonist Ganglion türü, α4β2 ve α7 reseptörler[30]
- dekametonyum nedenleri depolarizasyon bloğu açık kas tipi reseptörler, süksametonyuma benzer[30]
Muskarinik aktiviteye karşı nikotinik aktivite
| Kolinerjik agonistlerin karşılaştırılması[36] | ||||
|---|---|---|---|---|
| Madde | Reseptör özgüllüğü | Tarafından hidroliz asetilkolinesteraz | Yorumlar | |
| Muskarinik | Nikotinik | |||
| Kolin | +++ | +++ | ++ | Temel besin |
| Asetilkolin | +++ | +++ | +++ | Endojen ligand |
| Karbakol | ++ | +++ | - | Tedavisinde kullanılır glokom |
| Metakolin | +++ | + | ++ | |
| Bethanechol | +++ | - | - | Mesanede kullanılır ve gastrointestinal hipotoni. |
| Muskarin | +++ | - | - | Doğal alkaloit bazı mantarlarda bulunur. Mantar zehirlenmesinin nedeni |
| Nikotin | - | +++ | - | Doğal alkaloid bulunan tütün bitkisi. |
| Pilokarpin | ++ | - | - | Glokomda kullanılır |
| Oxotremorine | ++ | - | - | |
Şu anki durum
Şu anda nikotin reseptörü agonisti araştırması ve ilaç tasarımı, MSS'nin birçok hastalığının ve bozukluğunun tedavisine yöneliktir.
Targacept'in içinde bulunan üç ilaç adayı var klinik denemeler; Şu anda faz II klinik deneylerde olan DEHB için AZD3480 (TC-1734), Alzheimer hastalığı için AZD1446 (TC-6683) ile işbirliği içinde AstraZeneca ve TC-5619 için bilişsel işlev bozuklukları şizofrenide.
Ortağı ile Memory Pharmaceuticals Roche bir ilaç adayına sahiptir, MEM 3454 (RG3487), kısmi bir agonisti nikotinik α7 reseptörü, Alzheimer hastalığı için.[37][38]
NeuroSearch ile ortaklaşa Abbott Laboratories'in klinik deneylerde iki ilaç adayı vardır, ABT-894 DEHB için seçici bir α4β2 nikotin reseptörü agonisti ve ABT-560 Abbott tarafından 2006 yılında bilişsel işlev bozuklukları için yeni bir gelişme adayı olarak seçilen bir nöronal nikotinik reseptör modülatörü.[39]
EnVivo farmasötiklerinin klinik deneylerde bir ilaç adayı, Alzheimer hastalığı ve şizofreni için seçici bir a7 nikotin reseptörü agonisti olan EVP-6124 ve başarıyla tamamlanmış bir takip bileşiği olan EVP-4473 vardır klinik öncesi geliştirme.[40]
Ayrıca bakınız
- Muskarinik asetilkolin reseptörü
- Muskarinik agonist
- Muskarinik antagonist
- Nikotinik asetilkolin reseptörü
- Nikotinik antagonist
- Parasempatomimetik ilaç
Referanslar
- ^ Henningfield, Jack E; Zeller, Mitch (2006), "Nikotin psikofarmakoloji araştırmasının Amerika Birleşik Devletleri ve küresel tütün düzenlemesine katkıları: geriye ve ileriye bakma", Psikofarmakoloji, 184 (3–4): 286–291, doi:10.1007 / s00213-006-0308-4, PMID 16463054
- ^ a b Harutyun, Vahram; Barnes, Edward; Davis, KL (1985), "Sıçanlarda belleğin kolinerjik modülasyonu", Psikofarmakoloji, 87 (3): 266–271, doi:10.1007 / BF00432705, PMID 3001803
- ^ a b c d e Buccafusco, J.J. (2004), "Nöronal nikotinik reseptör alt tipleri: terapötik hedefleri tanımlama" (PDF), Moleküler Müdahaleler, 4 (5): 285–295, doi:10,1124 / mi 4,5,8, PMID 15471911
- ^ Buccafusco, J. J .; Jackson, W. J .; Terry Jr, AV; Marsh, KC; Decker, MW; Arneric, SP (1995), "ABT-418'i izleyen maymunlar tarafından gecikmeli bir numune eşleştirme görevinin performansında gelişme: hafıza geliştirme için yeni bir kolinerjik kanal aktivatörü", Psikofarmakoloji, 120 (3): 256–266, doi:10.1007 / BF02311172, PMID 8524972
- ^ Ludwig, J .; Höffle-Maas, A. (2010), "α üzerinde bir galantamin bağlanma bölgesinin sahaya yönelik mutajeneziyle lokalizasyon7 nikotinik asetilkolin reseptörü hücre dışı alanı ", Reseptörler ve Sinyal İletimi Dergisi, 30 (6): 469–483, doi:10.3109/10799893.2010.505239, PMID 21062106
- ^ Liu, Zhaoping; Zhang, J; Berg, Darwin K. (2007), "Nöronal gelişimi yönlendirmede endojen nikotinik sinyallemenin rolü", Biyokimyasal farmakoloji, 74 (8): 1112–1119, doi:10.1016 / j.bcp.2007.05.022, PMC 2116993, PMID 17603025
- ^ a b Gotti, C .; Clementi, F. (2004), "Nöronal nikotinik reseptörler: yapıdan patolojiye", Nörobiyolojide İlerleme, 74 (6): 363–396, doi:10.1016 / j.pneurobio.2004.09.006, PMID 15649582
- ^ a b c Paterson, David; Nordberg, Agneta (2000), "İnsan beynindeki nöronal nikotinik reseptörler", Nörobiyolojide İlerleme, 61 (1): 75–111, doi:10.1016 / s0301-0082 (99) 00045-3, PMID 10759066
- ^ Sala, F .; Nistri, A .; Criado, M. (2008), "Adrenal kromafin hücrelerinin nikotinik asetilkolin reseptörleri", Acta Physiologica, 192 (2): 203–212, doi:10.1111 / j.1748-1716.2007.01804.x, PMID 18005395[ölü bağlantı ]
- ^ a b c Itier, Valérie; Bertrand, Daniel (2001), "Nöronal nikotinik reseptörler: protein yapısından işleve", FEBS Mektupları, 504 (3): 118–125, doi:10.1016 / S0014-5793 (01) 02702-8, PMID 11532443
- ^ a b Lindstrom, JM (2003), "Kasların ve sinirlerin nikotinik asetilkolin reseptörleri", New York Bilimler Akademisi Yıllıkları, 998: 41–52, doi:10.1196 / yıllık.1254.007, PMID 14592862[ölü bağlantı ]
- ^ Mihailescu, Stefan; Drucker-Colín, René (2000), "Nikotin, Beyin Nikotinik Reseptörleri ve Nöropsikiyatrik Bozukluklar", Tıbbi Araştırma Arşivleri, 31 (2): 131–144, doi:10.1016 / S0188-4409 (99) 00087-9, PMID 10880717
- ^ Arias, Hugo R. (1997), "Nikotinik asetilkolin reseptörü üzerindeki ligand bağlanma bölgelerinin topolojisi", Beyin Araştırma İncelemeleri, 25 (2): 133–191, doi:10.1016 / S0165-0173 (97) 00020-9, PMID 9403137
- ^ a b c d Haydar, Simon N .; Ghiron, Chiara; Bettinetti, Laura; Bothman, Hendrick; Comery, Thomas A .; Dunlop, John; La Rosa, Salvatore; Micco, Iolanda; Pollastrini, Martina; Quinn, Joanna; Roncarati, Renza; Scali, Carla; Valacchi, Michela; Varrone, Maurizio; Zanaletti, Riccardo (2009), "SEN12333 / WAY-317538'in SAR ve biyolojik değerlendirmesi: Yeni alfa 7 nikotinik asetilkolin reseptör agonisti", Biyorganik ve Tıbbi Kimya, 17 (14): 5247–5258, doi:10.1016 / j.bmc.2009.05.040, PMID 19515567
- ^ Brunton, Laurence L .; Lazo, John S .; Parker, Keith L., eds. (2006), Goodman & Gilman'ın Tedavinin Farmakolojik Temelleri (11 ed.), McGRAW HILL, ISBN 978-0-07-142280-2
- ^ Unwin, Nigel (2004), "Nikotinik Asetilkolin Reseptörünün 4 A ° Çözünürlükte Rafine Yapısı", Moleküler Biyoloji Dergisi, 346 (4): 967–989, doi:10.1016 / j.jmb.2004.12.031, PMID 15701510
- ^ Cassels, Bruce K .; Bermúdez, Isabel; Dajas, Federico; Abin-Carriquiry, J. Andrés; Wonnacott, Susan (2005), "Ligand tasarımından terapötik etkinliğe: nikotinik reseptör araştırması için zorluk", Bugün İlaç Keşfi, 10 (23–24): 1657–1665, doi:10.1016 / S1359-6446 (05) 03665-2, hdl:10533/176659, PMID 16376826
- ^ Gotti, C .; Fornasari, D .; Clementi, F. (1997), "İnsan Nöronal Nikotin Reseptörleri", Nörobiyolojide İlerleme, 53 (2): 199–237, doi:10.1016 / S0301-0082 (97) 00034-8, PMID 9364611
- ^ Tøndera, Janne E .; Olesena, Preben H .; Hansena, John Bondo; Begtrupb, Mikael; Petterssona, Ingrid (2001), "[3H] -N-metilkarbamilkolin ile etiketlenmiş merkezi nikotinik asetilkolin reseptörlerinde görev yapan nikotinik agonistler için geliştirilmiş bir nikotinik farmakofor ve stereoselektif bir CoMFA modeli", Bilgisayar Destekli Moleküler Tasarım Dergisi, 15 (3): 247–258, Bibcode:2001JCAMD..15..247T, doi:10.1023 / A: 1008140021426, PMID 11289078
- ^ Cooper, Julia C .; Gutbrod, Oliver; Witzemann, Veit; Methfessel, Christoph (1996), "Xenopus oositlerinde ifade edilen fetal sıçan kasından elde edilen nikotinik asetilkolin reseptörünün farmakolojisi", Avrupa Farmakoloji Dergisi, 309 (3): 287–298, doi:10.1016/0014-2999(96)00294-4, PMID 8874153
- ^ Carter, Chris R.J .; Cao, Liren; Kawai, Hideki; Smith, Peter A .; Dryden, William F .; Raftery, Michael A .; Dunn, Susan M.J. (2007), "Bisquaterner ligandların Torpido nikotinik asetilkolin reseptörü ile etkileşimlerinin zincir uzunluğu bağımlılığı", Biyokimyasal Farmakoloji, 73 (3): 417–426, doi:10.1016 / j.bcp.2006.10.011, PMID 17118342
- ^ Charton, Yves; Guillonneau, Claude .; Lockhart, Brian; Lestageb, Pierre; Goldsteina, Solo (2008), "Yeni nikotinik ligandların hazırlanması ve afinite profili", Biyorganik ve Tıbbi Kimya Mektupları, 18 (6): 2188–2193, doi:10.1016 / j.bmcl.2007.12.075, PMID 18262785
- ^ Walker, Daniel P .; Wishka, Donn G .; Piotrowski, David W .; Jia, Shaojuan; Reitz, Steven C .; Yates, Karen M .; Myers, Jason K .; Vetman, Tatiana N .; Margolis, Brandon J .; Jacobsen, E. Jon; Acker, Brad A .; Groppi, Vincent E .; Wolfe, Mark L .; Thornburgh, Bruce A .; Tinholt, Paula M .; Cortes-Burgos, Luz A .; Walters, Rodney R .; Hester, Matthew R .; Seest, Eric P .; Dolak, Lester A .; Han, Fusen; Olson, Barbara A .; Fitzgerald, Laura; Staton, Brian A .; Raub, Thomas J .; Hajos, Mihaly; Hoffmann, William E .; Li, Kai S .; Higdon, Nicole R .; et al. (2006), "Tasarım, sentez, yapı-aktivite ilişkisi ve in vivo a7 nikotinik asetilkolin reseptör agonistleri olarak azabisiklik aril amidlerin aktivitesi ", Biyorganik ve Tıbbi Kimya, 14 (24): 8219–8248, doi:10.1016 / j.bmc.2006.09.019, PMID 17011782
- ^ http://www.envivopharma.com - Nikotinik Alfa7 Asetilkolin Reseptör Agonist Programı Arşivlendi 2010-01-07 de Wayback Makinesi
- ^ a b Rollema, H .; Chambers, L.K; Coe, J.W .; Glowa, J .; Hurst, R.S .; Lebel, L.A; Lu, Y .; Mansbach, R.S .; Mather, R.J .; Rovetti, C.C .; Sands, S.B .; Schaeffer, E .; Schulz, D.W .; Tangley III, F.D .; Williams, K.E. (2007), "α'nın farmakolojik profili4β2 nikotinik asetilkolin reseptörü kısmi agonist vareniklin, etkili bir sigara bırakma yardımcısı ", Nörofarmakoloji, 52 (3): 985–994, doi:10.1016 / j.neuropharm.2006.10.016, PMID 17157884
- ^ a b "CHAMPIX 0,5 mg film kaplı tabletler; CHAMPIX 1 mg film kaplı tabletler - Ürün Özelliklerinin Özeti (SmPC) - (eMC)". emc.medicines.org.uk. Arşivlenen orijinal 2012-12-24 tarihinde.
- ^ Greenblatt, H.M .; Kryger, G .; Lewis, T .; Silman, I .; Sussman, J.L (1999), "2.3 angstrom çözünürlükte (-) - galanthamin ile komplekslenmiş asetilkolinesteraz yapısı", FEBS Mektupları, 463 (3): 321–326, doi:10.1016 / S0014-5793 (99) 01637-3, PMID 10606746
- ^ "Reminyl XL 8mg, 16mg ve 24mg uzatılmış salımlı kapsüller - Ürün Özelliklerinin Özeti (SmPC) - (eMC)". emc.medicines.org.uk. Arşivlenen orijinal 2012-12-24 tarihinde.
- ^ Dani, John A .; Biasi, Mariella De (2001), "Nikotin bağımlılığının hücresel mekanizmaları", Farmakoloji Biyokimyası ve Davranış, 70 (4): 439–446, doi:10.1016 / S0091-3057 (01) 00652-9, PMID 11796143
- ^ a b c d Rang, H.P. (2003), Farmakoloji, Edinburgh: Churchill Livingstone, ISBN 978-0-443-07145-4 Sayfa 149
- ^ XI, Zheng-xiong; Spiller, Krista; Gardner, Eliot L. (2009), "Nikotin bağımlılığının tedavisi için mekanizmaya dayalı ilaç geliştirme", Acta Pharmacol Sin, 30 (6): 723–739, doi:10.1038 / aps.2009.46, PMC 3713229, PMID 19434058, ProQuest 213027402
- ^ http://www.accessdata.fda.gov/drugsatfda_docs/label/2004/16968s022lbl.pdf
- ^ Tuba, Zoltan; Maho, Sandor; Vizi, E. Sylvester (2002), "Nöromüsküler Bloke Edici Ajanların Sentezi ve Yapı-Aktivite İlişkileri", Güncel Tıbbi Kimya, 9 (16): 1507–1536, doi:10.2174/0929867023369466, PMID 12171561, ProQuest 215095660
- ^ "Anektin Enjeksiyonu - Ürün Özelliklerinin Özeti (SmPC) - (eMC)". emc.medicines.org.uk. Arşivlenen orijinal 2012-12-24 tarihinde.
- ^ Carroll, F. Ivy (2004), "Epibatidin yapı-aktivite ilişkileri", Biyorganik ve Tıbbi Kimya Mektupları, 14 (8): 1889–1896, doi:10.1016 / j.bmcl.2004.02.007, PMID 15050621
- ^ Kutularda aksi belirtilmedikçe, referans şu şekildedir: Tablo 10-3: Çubuk Çiçeği; Humphrey P. Rang; Maureen M. Dale; Ritter, James M. (2007), Rang & Dale'in farmakolojisi, Edinburgh: Churchill Livingstone, ISBN 978-0-443-06911-6
- ^ "Arşivlenmiş kopya". Arşivlenen orijinal 2009-12-25 tarihinde. Alındı 2009-12-21.CS1 Maint: başlık olarak arşivlenmiş kopya (bağlantı)
- ^ "Hafıza İlaçları Şizofreni İle İlişkili Bilişsel Bozuklukta MEM 3454'ün 2. Aşama Çalışması İçin Kayıt Hedefine Ulaştı".
- ^ http://www.neurosearch.dk/Default.aspx?ID=30
- ^ "Arşivlenmiş kopya". Arşivlenen orijinal 2009-08-06 tarihinde. Alındı 2009-12-21.CS1 Maint: başlık olarak arşivlenmiş kopya (bağlantı)
Dış bağlantılar
![]() İle ilgili medya Nikotinik agonistler Wikimedia Commons'ta
İle ilgili medya Nikotinik agonistler Wikimedia Commons'ta
- nikotinik + agonistler ABD Ulusal Tıp Kütüphanesinde Tıbbi Konu Başlıkları (MeSH)
- MeSH ajan listesi 82018722
