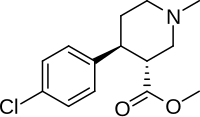
(+) - CPCA - (+)-CPCA
 | |
| Klinik veriler | |
|---|---|
| ATC kodu |
|
| Tanımlayıcılar | |
| |
| CAS numarası | |
| PubChem Müşteri Kimliği | |
| ChemSpider | |
| CompTox Kontrol Paneli (EPA) | |
| Kimyasal ve fiziksel veriler | |
| Formül | C14H18ClNÖ2 |
| Molar kütle | 267.75 g · mol−1 |
| 3 boyutlu model (JSmol ) | |
| |
| |
| | |
(+) - CPCA (kokain, 3α-karbometoksi-4β- (4-klorofenil) -N-metilpiperidin diğer adıyla CTDP 31.446[1]) bir uyarıcı yapı olarak benzer ilaç petidin (sahip bir opioid NDRI eylemler) ve RTI-31, ancak nocaine, RTI-31'lerin iki karbonlu köprüsünden yoksun Tropan iskelet.[2] Bu bileşik ilk olarak kokain için bir ikame maddesi olarak geliştirildi.
Bu zamandan beri birçok kişi değiştirildi fenilpiperidin temel nocaine yapısını diğer benzer moleküllerle melezleştiren türevler keşfedilmiştir. metilfenidat, meperidin ve modafinil çeşitli faaliyet profilleri ve potansiyel uygulamalarla geniş bir türev ailesi oluşturmak. Bu, devam eden birçok çalışma ile önemli bir araştırma alanıdır ve henüz hiçbiri piyasaya çıkmamış olmasına rağmen düzinelerce yeni bileşik geliştirilmiştir.
Kokain ailesi, çeşitli piperidin bazlı kokain taklitleri içerir. Ana bileşik nocaine, bir ikame ilacı geliştirme çabasıyla geliştirilmiştir. kokain bağımlılığın tedavisi için ve hayvan modellerinde kokainin yerine geçerken, kötüye kullanım potansiyeli önemli ölçüde daha az bulundu.
Arka fon
olmasına rağmen Kozikowski 1998'de klorlu bileşik bildirdi, düz fenil Plati tarafından bundan daha önce bildirildi.
Bu bileşiği üretmenin yeni yolları bulunmasına rağmen, arka plan Arecoline kimya. Örneğin. Paxil ve femoksetin ayrıca bu arenadan CNS kimyasallar. Bu serotonin bazlı antidepresanlar, Paxil N-normetil ayrıca bazıları asetilkolinerjik metinlere göre.[kaynak belirtilmeli ]
Farmakoloji
Kokain gibi, (-) - cis-CPCA ve (+) - CPCA, dopamin taşıyıcı ve engelle dopamin alımı, kemirgenlerde motor aktiviteyi uyarır ve ayırt etme testlerinde kokainin yerini tamamen alır. (-) - cis-CPCA veya (+) - CPCA ile ön muamele, sıçanlarda kokaini ayırt etme uyarısını artırır. Bununla birlikte, bir takım farklılıklar vardır; piperidin türevlerinin lokomotor uyarıcı etkileri, kokain tarafından indüklenenlerden çok daha azdır ve farelere (-) - cis-CPCA veya (+) - CPCA ile ön işlem yapılması kokain kaynaklı konvülsiyonları artırmaz ve aslında kokain kaynaklı lokomotor uyarımı azaltır. (-) - cis-CPCA izomeri, sıçanlarda sabit oranlı kendi kendine uygulama testlerinde gösterildiği gibi kokaine benzer pekiştirici etkilere sahiptir, ancak (+) - CPCA düz bir doz-yanıt eğrisine sahiptir ve benzer şekilde (-) - cis -CPCA ve kokain, "cezalandırılmış yanıt verme" (?) Kendi kendine uygulama testinde neredeyse aynı kırılma noktalarına sahipti, (+) - CPCA diğer uyuşturuculardan daha düşük kırılma noktasına sahipti.
| Monoamin Geri Alım Aktivitesi (nM) | |||
| Bileşik | [3H] NE | [3H] 5-HT | [3H] DA |
| Kokain | 119 | 177 | 275 |
| (-) - cis-CPCA | 98 | 390 | 67 |
| (+) - CPCA | 90 | 5900 | 276 |
Lokomotor ve metamfetamin ayırma testlerinde (+) - CPCA'nın genel olarak daha düşük etkinliği, SERT'ye göre DAT için iki izomerin farklı seçiciliğinden kaynaklanabilir. Yani, maksimum etkinlik için serotonin reseptör aktivasyonu gerekliyse, (-) - cis-CPCA ve (+) - CPCA arasındaki SERT afinitesi farkı, gözlemlenen farmakolojideki farklılıkların açıklanmasında katkı sağlayan bir rol oynayabilir. TMP (metilfenidat) gibi katekolamin seçici ilaçların iyi bir kötüye kullanım potansiyeline sahip olduğu bildirilmektedir, bu nedenle (+) - CPCA'nın güçlü bir kendi kendine uygulama eğilimini neden kandırmadığını ölçmek kolay değildir.
Muhtemel bir açıklama, nocaine'nin tercihli olarak ↓ DAT'a bağlanması olabilir, bu durumda kokainden biraz farklı davranması beklenir.[3] Bir çeşit kolinerjik etki de caydırıcı olabilir. Örneğin, benztropin analoglarının muskarinik aktivitesinin güçlendirme potansiyellerini sınırladığı bilinmektedir.[4] İyon kanalı aktivitesi, farmakolojideki belirli farklılıkları açıklamak için kullanılabilecek başka bir faktördür.
Bu mümkündür sigma reseptörü aktivite aynı zamanda kokain ve bu piperidin taklitleri arasındaki bazı farklılıkları da açıklayabilir (R.Matsumoto, et al.2001,[5][6][7][8] (Ping ve Teruo, 2003 rev).[9] Sigma reseptörleri, kokaine, metilfenidat, metamfetamin gibi diğer psikostimülanlara özgü değildir (E. Nguyen, et al. 2005),[10] ve fensiklidin de bu sinirsel hedefle bağlantılıdır. Bu reseptörün artan bir şekilde anlaşılması, son zamanlarda farmakolojisine dayanan yeni bir AD'nin rapor edilmesine yol açtı.[11]
Özetle, (+) - CPCA, kemirgenlerde lokomotor aktiviteyi artırmada kokainden daha düşük potens ve etkiye sahiptir. (+) - CPCA, kokainle eğitilmiş hayvanlarda tamamen kokain benzeri olmasına rağmen, yalnızca kısmi metamfetamin benzeri ayırt edici uyarıcı etkiler üretmeyi başarır. (+) - CPCA, rhesus maymunları tarafından onaylanan pekiştirici etkileri ile, sıçanlarda sabit ve ilerleyen oranlı IV kendi kendine uygulama testleri ile değerlendirildiği üzere kokainden daha düşük güçlendirme potansiyeline sahiptir. Ayrıca, (+) - CPCA dozu, bağımlı olarak kokain kaynaklı hareketliliği antagonize eder ve düşük doz kokainin ayırt edici uyarıcı etkilerini güçlendirir. (+) - CPCA, kokainden farklı olarak, kokain kaynaklı konvülsiyonları artırmaz. Bu sonuçlar, (+) - CPCA'nın kokainin belirli davranışsal eylemlerini tamamen taklit ettiğini, diğerlerinde ise kokainin neden olduğu hareket artışını hafifletme ve kemirgenlerde pozitif bir takviye edici ajan olarak hizmet etme yeteneği dahil olmak üzere diğerlerinde zayıf bir kısmi agonist gibi davrandığını göstermektedir. Bu nedenle, (+) - CPCA, kokain bağımlılığının tedavisinde potansiyel bir faydaya sahip olabilir ve ayrıca diğer ilgili DARI moleküllerinden temel farklılıklar sergilediği için kokainin etki mekanizmasını daha iyi anlamamızı sağlayan değerli farmakolojik bilgiler sunabilir.
Kimya
Sentez yolları
Feniltropanlardan herhangi birini yapmak için ya bir kokain kaynağı ya da temel ara ürüne enantiyoselektif yolların bulunmaması nedeniyle enantiyomerlerin kapsamlı ve tekrar tekrar ayrılması gerekir. metilecgonidin ve nihai ürünün farklı yapısal izomerleri arasındaki büyük güç farklılıkları.[12]
Laboratuvar sentezi tasarlandı [13] ancak anhidroekgonidinin istenen izomerine ek olarak, aynı zamanda istenmeyen enantiyomer ile birlikte taşınmaları gerçeği ile engellenmektedir.
Ester ve amin modifikasyonları
Bir dizi yeni N- ve 3α-modifiye nocaine analogları sentezlendi ve bunların SNDRI farelerde aktivite ve davranış özellikleri.[14]
Monoamin taşıyıcılar için önceden belirlenmiş bir potansiyele ve seçiciliğe sahip ligandların rasyonel tasarımı, bu hedeflerin 3 boyutlu yapısı hakkında bilgi eksikliği nedeniyle engellenmektedir. Bir hedef proteindeki bağlanma bölgesinin 3 boyutlu yapısının iyi tanımlanmadığı durumlarda, monoamin taşıyıcı proteinler oluşturmak için ligand bazlı tasarım yapılabilir. farmakofor. Yani, farmakolojik olarak benzer bir dizi bileşiğin konformasyonel özelliklerini inceleyerek, farmakoforla ilgili hipotezler oluşturulabilir.[15] Potent tropan bazlı inhibitörlerin çoğu, inc. koka, taşıyıcı bağlanma bölgesi ile en az 3 ana etkileşime sahip olduğuna inanılmaktadır: bazik nitrojende bir iyonik veya H-bağlama etkileşimi, ester grubunun bir dipol-dipol veya H-bağlama etkileşimi ve aril grubunun bir etkileşimi lipofilik bir bağlama cebi ile. Bu model, üretimi ekonomik olarak uygun olan yeni bir piperidin bazlı DAT inhibitörünün tasarımında başarıyla kullanıldı.[16]
(+) - CPCA'nın in vivo metabolizması da muhtemelen N-demetilasyon, karşılık gelen serbest aside metabolizma, tüm monoamin taşıyıcılarında inaktif bir bileşik vermek için, muhtemelen baskın yol olacaktır. in vivo. Esteraz etkisiyle metabolizmanın, ester grubunun metabolik bozunmaya daha kararlı bir biyoizosterik grupla değiştirilmesiyle önlenebileceği gerekçelendirildi. Önceki çalışmalarda, oksadiazolün, kokain benzeri aktivitede olmasına rağmen, daha yavaş metabolizma hızı nedeniyle önemli ölçüde daha uzun bir etki süresi sergilediği bulunmuştur. Genel olarak, karşılık gelen N-metil bileşiklerine göre norpiperidinler, SERT / NET'te artmış bir aktivite sergiledi ve DAT'ta sadece ılımlı değişiklikler gösterdi.
| Ki (nM) | |||
| R | NE | DA | 5HT |
| CO2Ben mi | 252 → 7.9 | 233 → 279 | 8490 → 434 |
| CH2OH | 198 → 69 | 497 → 836 | 1550 → 239 |
| Oksadiazol | 256 → 34 | 187 → 189 | 5960 → 373 |
Kokain ve ester arasında ilginç bir fark 1 A, alkol 2ave norester 1b son iki bileşiğin farelerde lokomotor aktivite testlerinde kokainden önemli ölçüde daha uzun süre etkili olmasıdır. Alkol gibi bileşiklerden uzun süreli etki beklenmesine rağmen 2a ve oksadiazol 3 A 3α ester grubundan yoksun olan ve dolayısıyla metabolize edilmesi daha zordur, bu norester için beklenmemektedir. 1b, çünkü 3α ester grubu, kokainin ester grubu kadar kolayca hidrolize edilmelidir ve 1 A. N-demetilasyonun bir başka sonucu, başlangıçta bir depresan etkisidir. 1b bunu GABA reseptörleri ile etkileşimden kaynaklanabilecek gecikmiş lokomotor stimülasyon veya mGlu5.[17]
3β-İkame edilmiş nokain ligand tasarımı
Daha önceki bir çalışmada, ester fonksiyonel gruba göre daha fazla stabiliteye sahip olan ve bu nedenle potansiyel tedaviler olarak daha çekici olan 3a-amido ve hacimli 3a-oksadiazolil nocaine ligandlarının inaktif olduğu bulunmuştur. Bu sonuç, piperidin halkasının 3α pozisyonuna yakın olan DAT ve NET'in bağlanma bölgesinin kompakt olduğu ve 3-ikame edilmiş 1,2,4-oksadiazolil gibi hacimli, sterik olarak tıkanmış ikame edicileri barındıramadığı hipotezine yol açtı gruplar. Bir metilen aralayıcının sokulmasının, ortaya çıkan moleküller üzerinde gelişmiş monoamin taşıyıcı bağlanma afinitesi sağlayacağı gerekçelendirildi.[18]

| R | [3H] DA | [3H] 5-HT | [3H] NE |
| CO2Ben mi | 233 | 8490 | 252 |
| CONMe2 | 2140 | 18900 | 569 |
| CH2OAc | 599 | 901 | 235 |
| CH2OCH2CH = CH2 | 60 | 231 | 20 |
| CH2CO2Et | 79 | 191 | 101 |
| CH2CONMe2 | 16 | 1994 | 46 |
| Heterocycle | 44 | 32 | 52 |
| CH2CH2CO2Ben mi | 68 | 255 | 31 |
| trans-CH = CHCO2Ben mi | 53 | 501 | 272 |
| Prn | 20 | 228 | 6.5 |
| (CH2)3OH | 16 | 2810 | 564 |
C2 – C3 bileşiklerinin C1 bileşiklerinden daha aktif olmasının olası nedenlerinden biri, C2 – C3 ligandlarının daha esnek 3α-uzantısında bulunan polar grubun, yakın mesafedeki bağlanma bölgesi ile istenmeyen etkileşimleri önleyebilmesidir. piperidin halkasına. Aynı nedenle, C2 – C3 serisindeki eklenti, daha aktif olanın bağlanma modunu daha yakından taklit edebilir, ancak tam olarak değil. SS bazlı ligandlar ve muhtemelen tropan bazlı bileşiklere aktarılır.
C1 ve C2 – C3 serisi arasındaki farkı daha iyi anlamak için, bileşikler enerji en aza indirildi ve esnek bir şekilde üst üste bindirildi. WIN-35.428. Ortaya çıkan kaplama, sadece C2-C3 ligandlarının, 3a-ikame edicinin polar grubunun, WIN35428'deki 2β-polar grubunkine yakın pozisyonu işgal ettiği bir konformasyonu benimseyebildiğini gösterir.
Nocaine: kükürt eki

Farmakofor
Genel olarak tanınan farmakofor kokain için model ve feniltropanlar C-2 ikame edicisinin bazik nitrojen ve ester grubunun iki elektrostatik etkileşimini ve C-3 aril grubunun bir hidrofobik etkileşimini içerir.[19] Bu model, bazı bileşiklerde yüksek bağlanma afinitesi ve MAR inhibisyonu için ne bazik N ne de ester grubunun gerekli olmadığı bulgusu nedeniyle tartışılmıştır. Bunun yerine, C-2 karbonunun yakınında hidrofobik bir cep olduğu önerildi. Carroll ve arkadaşları, daha sonraki bir çalışmada C-2β pozisyonunda elektrostatik etkileşim için daha fazla kanıt sağlamıştır.
DAT bağlanma bölgesi için önerilen diğer modeller, 3p-ikameli feniltropan analogları için doğrusal bir moda bağlanma cebi içerir,[20] ve 3α ikameli piperidin halkasından yaklaşık 5.5-10 Å uzaklıkta yasaklanmış bir konik bölge.[21] Dikkate değer bir şekilde, dimerik piperidin bazlı esterlerin ve amidlerin DAT'ındaki yüksek potens, iki piperidin ünitesini birleştiren esnek bağlayıcının oryantasyonunu ayarlayabildiğini ve bağlanma sahası ile istenmeyen etkileşimleri önleyebildiğini gösterdi.[22] Tüm bu kanıtlar, DAT bağlanma bölgesinin önerilen farmakofor modellerinden çok daha karmaşık olduğunu göstermektedir.
DAT bağlanma sahasının ayrıntılarını ortaya çıkarmak amacıyla bir dizi 3D-QSAR çalışması gerçekleştirildi. Feniltropanlara odaklanan birkaç QSAR / CoMFA çalışması, tropan halkasının 3β ikame edicisi etrafındaki bölgelerde artmış bir negatif elektrostatik potansiyelin ve fenil halkasının para pozisyonunun, MAT'leri inhibe etmede yüksek potensi desteklediği sonucuna varmıştır. Wright vd. DAT'a bağlanmada ve DA'nın yeniden alımını bloke etmede tropanların 3β-ikame edicisinin rolünü inceledi. CoMFA modelleri, 3p-ikame edici bağlanma sitesinin, namlu şeklindeki ve hidrofobik etkileşimler bağlanmaya baskın bir katkı sağlar,[20] Newman ve ark. tarafından bildirilen 3α-ikameli tropan analoglarının çalışmaları ile tutarlıdır. Newman ve ortak yazarlar ayrıca N-ikameli tropanlar üzerinde çalıştılar ve N-ikame edicisinin DAT ile sterik etkileşiminin bağlanma afinitesi için temel bir faktör olduğu sonucuna vardılar.

Ayrıca bakınız
- Kokain analoglarının listesi
- 1-Metil-3-propil-4- (p-klorofenil) piperidin
- N, O-Dimetil-4- (2-naftil) piperidin-3-karboksilat[25]
- JZ-IV-10 ve diğer modafinil hibritleri[26][27]
- 4-Floropetidin ve diğeri petidin (meperidin) analogları.[3]
- NET seçmeli.[28][29]
- Bilgisayar.[19][30]
Referanslar
- ^ Mobele, Bingidimi I .; Kinahan, Taryn; Ulysse, Luckner G .; Gagnier, Steven V .; Ironside, Michael D .; Knox, Graham S .; Mohammadi, Farahnaz (2006). "Piperidin Bazlı Kokain Analoğu ve Güçlü Dopamin ve Norepinefrin Geri Alım İnhibitörü CTDP 31,446'nın Pilot Ölçekli Sentezine Yönelik Süreç Geliştirme". Organik Süreç Araştırma ve Geliştirme. 10 (5): 914–920. doi:10.1021 / op060114g. ISSN 1083-6160.
- ^ Kozikowski AP, Araldi GL, Boja J, Meil WM, Johnson KM, Flippen-Anderson JL, vd. (Mayıs 1998). "Piperidin bazlı kokain analoglarının kimyası ve farmakolojisi. Tropan iskeleti olmayan güçlü DAT inhibitörlerinin tanımlanması". Tıbbi Kimya Dergisi. 41 (11): 1962–9. doi:10.1021 / jm980028 +. PMID 9599245.
- ^ a b Lomenzo SA, Rhoden JB, Izenwasser S, Wade D, Kopajtic T, Katz JL, Trudell ML (Mart 2005). "Monoamin taşıyıcılarında meperidin analoglarının sentezi ve biyolojik değerlendirmesi". Tıbbi Kimya Dergisi. 48 (5): 1336–43. doi:10.1021 / jm0401614. PMID 15743177.
- ^ Zou MF, Cao J, Kopajtic T, Desai RI, Katz JL, Newman AH (Ekim 2006). "In vivo araştırma için (S) -2beta-ikameli 3alfa- [bis (4-floro- veya 4-klorofenil) metoksi] tropan analoglarının yeni bir serisi üzerinde yapı-aktivite ilişkisi çalışmaları". Tıbbi Kimya Dergisi. 49 (21): 6391–9. doi:10.1021 / jm060762q. PMID 17034144.
- ^ Matsumoto RR, Hewett KL, Pouw B, Bowen WD, Husbands SM, Cao JJ, Newman AH (Aralık 2001). "Rimcazol analogları, kokainin sarsıcı etkilerini zayıflatır: dopamin taşıyıcılarından ziyade sigma reseptörlerine bağlanma ile korelasyon". Nörofarmakoloji. 41 (7): 878–86. doi:10.1016 / S0028-3908 (01) 00116-2. PMID 11684152. S2CID 44328858.
- ^ Matsumoto RR, McCracken KA, Friedman MJ, Pouw B, De Costa BR, Bowen WD (Mayıs 2001). "Konformasyonel olarak sınırlandırılmış BD1008 analogları ve sigma1 reseptörlerini hedefleyen bir antisens oligodeoksinükleotid, farelerde anti-kokain etkileri üretir". Avrupa Farmakoloji Dergisi. 419 (2–3): 163–74. doi:10.1016 / S0014-2999 (01) 00968-2. PMID 11426838.
- ^ Matsumoto RR, McCracken KA, Pouw B, Zhang Y, Bowen WD (Haziran 2002). "Kokainin davranışsal etkilerinde sigma reseptörlerinin rolü: yeni ligandlardan ve antisens oligodeoksinükleotidlerden kanıtlar". Nörofarmakoloji. 42 (8): 1043–55. doi:10.1016 / S0028-3908 (02) 00056-4. PMID 12128006. S2CID 34846910.
- ^ Matsumoto RR, Liu Y, Lerner M, Howard EW, Brackett DJ (Mayıs 2003). "Sigma reseptörleri: anti-kokain ajanları için potansiyel ilaç geliştirme hedefi". Avrupa Farmakoloji Dergisi. 469 (1–3): 1–12. doi:10.1016 / S0014-2999 (03) 01723-0. PMID 12782179.
- ^ Su TP, Hayashi T (Ekim 2003). "Sigma-1 reseptörlerinin moleküler mekanizmasını anlamak: sigma-1 reseptörlerinin sinyal iletimi için hücre içi amplifikatörler olduğu hipotezine doğru". Güncel Tıbbi Kimya. 10 (20): 2073–80. doi:10.2174/0929867033456783. PMID 12871086.
- ^ Nguyen EC, McCracken KA, Liu Y, Pouw B, Matsumoto RR (Ekim 2005). "Metamfetaminin akut etkilerinde sigma (sigma) reseptörlerinin rolü: reseptör bağlanması ve davranış çalışmaları". Nörofarmakoloji. 49 (5): 638–45. doi:10.1016 / j.neuropharm.2005.04.016. PMID 15939443. S2CID 41068558.
- ^ Wang J, Mack AL, Coop A, Matsumoto RR (Kasım 2007). "Yeni sigma (sigma) reseptör agonistleri, farelerde antidepresan benzeri etkiler üretir". Avrupa Nöropsikofarmakoloji. 17 (11): 708–16. doi:10.1016 / j.euroneuro.2007.02.007. PMC 4041597. PMID 17376658.
- ^ Clarke RL, Daum SJ, Gambino AJ, Aceto MD, Pearl J, Levitt M, ve diğerleri. (Kasım 1973). "Merkezi sinir sistemini etkileyen bileşikler. 4. 3 Beta-feniltropan-2-karboksilik esterler ve analogları". Tıbbi Kimya Dergisi. 16 (11): 1260–7. doi:10.1021 / jm00269a600. PMID 4747968.
- ^ ABD Patenti 5736556
- ^ Petukhov PA, Zhang J, Kozikowski AP, Wang CZ, Ye YP, Johnson KM, Tella SR (Temmuz 2002). "Piperidin bazlı kokain analoglarının SAR çalışmaları. 4. N-modifikasyonu ve ester değişiminin etkisi". Tıbbi Kimya Dergisi. 45 (15): 3161–70. doi:10.1021 / jm0200153. PMID 12109901.
- ^ Froimowitz M, Gu Y, Dakin LA, Nagafuji PM, Kelley CJ, Parrish D, ve diğerleri. (Ocak 2007). "Dopamin taşıyıcısı için geliştirilmiş seçiciliği olan, metilfenidatın yavaş başlangıçlı, uzun süreli alkil analogları". Tıbbi Kimya Dergisi. 50 (2): 219–32. doi:10.1021 / jm0608614. PMID 17228864.
- ^ Wang S, Sakamuri S, Enyedy IJ, Kozikowski AP, Deschaux O, Bandyopadhyay BC, ve diğerleri. (Şubat 2000). "Yeni bir dopamin taşıyıcı inhibitörü olan 4-hidroksi-1-metil-4- (4-metilfenil) -3-piperidil 4-metilfenil ketonun, 3D veritabanı farmakofor araştırması yoluyla potansiyel bir kokain antagonisti olarak keşfi. Moleküler modelleme, yapı- aktivite ilişkileri ve davranışsal farmakolojik çalışmalar ". Tıbbi Kimya Dergisi. 43 (3): 351–60. doi:10.1021 / jm990516x. PMID 10669562.
- ^ Chiamulera C, Epping-Jordan MP, Zocchi A, Marcon C, Cottiny C, Tacconi S, ve diğerleri. (Eylül 2001). "Kokainin güçlendirici ve lokomotor uyarıcı etkileri, mGluR5 boş mutant farelerde yoktur". Doğa Sinirbilim. 4 (9): 873–4. doi:10.1038 / nn0901-873. PMID 11528416. S2CID 1314227.
- ^ Petukhov PA, Zhang J, Wang CZ, Ye YP, Johnson KM, Kozikowski AP (Haziran 2004). "Yeni piperidin bazlı kokain analoglarının sentezi, moleküler modellemesi ve biyolojik çalışmaları: piperidin halkasının 3alfa pozisyonuna yakın istenmeyen etkileşimlerin kanıtı". Tıbbi Kimya Dergisi. 47 (12): 3009–18. doi:10.1021 / jm0303296. PMID 15163183.
- ^ a b Yuan H, Kozikowski AP, Petukhov PA (Aralık 2004). "Dopamin taşıyıcısında kokainin piperidin analoglarının CoMFA çalışması: farmakofor bazlı esnek hizalama kullanılarak piperidin halkasının 3 alfa ikame edicisinin bağlanma modunun araştırılması". Tıbbi Kimya Dergisi. 47 (25): 6137–43. doi:10.1021 / jm049544s. PMID 15566285.
- ^ a b Lieske SF, Yang B, Eldefrawi ME, MacKerell AD, Wright J (Mart 1998). "(-) - Kokain bağlanması ve dopamin alımı için inhibitörler olarak 3 beta-İkameli ekgonin metil esterler". Tıbbi Kimya Dergisi. 41 (6): 864–76. doi:10.1021 / jm970025h. PMID 9526561.
- ^ Petukhov PA, Zhang M, Johnson KJ, Tella SR, Kozikowski AP (Ağustos 2001). "Piperidin bazlı kokain analoglarının Sar çalışmaları. Bölüm 3: oksadiazoller". Biyorganik ve Tıbbi Kimya Mektupları. 11 (16): 2079–83. doi:10.1016 / S0960-894X (01) 00379-1. PMID 11514143.
- ^ Tamiz AP, Bandyopadhyay BC, Zhang J, Flippen-Anderson JL, Zhang M, Wang CZ, vd. (Mayıs 2001). "Bazı iki değerlikli ligand bazlı monoamin yeniden alım inhibitörlerinin etkilerinin farmakolojik ve davranışsal analizi". Tıbbi Kimya Dergisi. 44 (10): 1615–22. doi:10.1021 / jm000552s. PMID 11334571.
- ^ Amat M, Bosch J, Hidalgo J, Cantó M, Pérez M, Llor N, ve diğerleri. (Mayıs 2000). "Enantiopure trans-3,4-disübstitüe piperidinlerin sentezi. (+) - ve (-) - paroksetinin bir enantiyo-değişken sentezi". Organik Kimya Dergisi. 65 (10): 3074–84. doi:10.1021 / jo991816p. PMID 10814199.
- ^ Johnson TA, Jang DO, Slafer BW, Curtis MD, Beak P (Ekim 2002). "Lithiated N-Boc alilik ve benzilik aminlerin nitroalkenlere eşlenik ilavelerinde asimetrik karbon-karbon bağı oluşumları: ikame edilmiş piperidinlerin, pirrolidinlerin ve pirimidinonların enantiyoselektif sentezi". Amerikan Kimya Derneği Dergisi. 124 (39): 11689–98. doi:10.1021 / ja0271375. PMID 12296735.
- ^ Tamiz AP, Zhang J, Flippen-Anderson JL, Zhang M, Johnson KM, Deschaux O, ve diğerleri. (Mart 2000). "Piperidin bazlı kokain analogları için daha ileri SAR çalışmaları. 2. Güçlü dopamin ve serotonin geri alım inhibitörleri". Tıbbi Kimya Dergisi. 43 (6): 1215–22. doi:10.1021 / jm9905561. PMID 10737754.
- ^ Zhou J, He R, Johnson KM, Ye Y, Kozikowski AP (Kasım 2004). "Piperidin bazlı nocaine / modafinil hibrid ligandları, oldukça güçlü monoamin taşıyıcı inhibitörleri olarak: rasyonel kurşun hibridizasyonu ile verimli ilaç keşfi". Tıbbi Kimya Dergisi. 47 (24): 5821–4. doi:10.1021 / jm040117o. PMC 1395211. PMID 15537337.
- ^ He R, Kurome T, Giberson KM, Johnson KM, Kozikowski AP (Aralık 2005). "Piperidin bazlı monoamin taşıyıcı inhibitörlerinin diğer yapı-aktivite ilişkisi çalışmaları: piperidin halkası stereokimyasının potens üzerindeki etkileri. Norepinefrin taşıyıcı seçici ligandların ve geniş spektrumlu taşıyıcı inhibitörlerinin tanımlanması". Tıbbi Kimya Dergisi. 48 (25): 7970–9. doi:10.1021 / jm050694s. PMID 16335921.
- ^ Musachio JL, Hong J, Ichise M, Seneca N, Brown AK, Liow JS, ve diğerleri. (Haziran 2006). "Nocaine-modafinil hibrid monoamin taşıyıcı inhibitörlerine dayalı yeni beyin görüntüleme ajanlarının geliştirilmesi". Biyorganik ve Tıbbi Kimya Mektupları. 16 (12): 3101–4. doi:10.1016 / j.bmcl.2006.03.066. PMID 16621532.
- ^ Zhou J (Aralık 2004). "Norepinefrin taşıyıcı inhibitörleri ve terapötik potansiyelleri". Geleceğin İlaçları. 29 (12): 1235–1244. doi:10.1358 / dof.2004.029.12.855246. PMC 1518795. PMID 16871320.
- ^ Yuan H, Petukhov PA (Aralık 2006). "Genetik algoritma kullanılarak çoklu konformasyonlara sahip dopamin taşıyıcı blokerlerinin geliştirilmiş 3D-QSAR CoMFA". Biyorganik ve Tıbbi Kimya Mektupları. 16 (24): 6267–72. doi:10.1016 / j.bmcl.2006.09.037. PMID 17027270.
