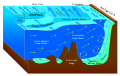
Soğuk sızıntı - Cold seep
| Deniz habitatları |
|---|
 Tüp kurtları Meksika Körfezi'ndeki dört soğuk sualtı topluluğu türünden birinde baskın türler arasındadır. |
Bir soğuk sızıntı (bazen a denir soğuk havalandırma) bir alanıdır okyanus tabanı nerede hidrojen sülfit, metan ve diğeri hidrokarbon -zengin sıvı sızıntısı, genellikle bir tuzlu su havuzu. Soğuk sızıntının sıcaklığının çevredeki deniz suyunun sıcaklığından daha düşük olduğu anlamına gelmez. Aksine, sıcaklığı genellikle biraz daha yüksektir.[1] "Soğuk", çok sıcak (en az 60 ° C veya 140 ° F) koşullara göredir. Hidrotermal havalandırma. Soğuk sızıntılar bir biyom birkaçını desteklemek endemik Türler.
Soğuk sızıntılar, metan ve deniz suyu arasındaki reaksiyonların oluştuğu zaman içinde benzersiz bir topografya geliştirir. karbonat kaya oluşumları ve resifleri. Bu reaksiyonlar ayrıca bakteriyel aktiviteye de bağlı olabilir. İkait Sulu bir kalsiyum karbonat, soğuk sularda oksitleyici metan ile ilişkilendirilebilir.
Türler

Sığ soğuk sular ve derin soğuk sızıntılar gibi soğuk su türleri derinliğe göre ayırt edilebilir.[2] Soğuk sızıntılar da aşağıdaki gibi ayrıntılı olarak ayırt edilebilir:
- sıvı yağ / gaz sızıyor[2]
- gaz sızıyor:[2] metan sızar
- gaz hidrat sızar[2]
- tuzlu su sızar[2] oluşur tuzlu su havuzları
- pockmarks[2]
- çamur volkanları[2]
Oluşum ve ekolojik ardıllık
Deniz tabanındaki çatlakların üzerinde soğuk sızıntılar meydana gelir. tektonik aktivite. Sıvı yağ ve metan Bu çatlaklardan "sızar", çökeltiyle yayılır ve birkaç yüz metre genişliğinde bir alanda ortaya çıkar.[3]
Metan (CH
4) genel olarak adlandırdığımız şeyin ana bileşenidir doğal gaz.[3] Ancak metan, insanlar için önemli bir enerji kaynağı olmasının yanı sıra soğuk su sızıntısının da temelini oluşturur. ekosistem.[3] Soğuk sızıntı biota 200 m'nin (660 ft) altında tipik olarak çok daha fazla sistematik uzmanlaşma ve kemoototrofi raf derinliklerindekilere göre.[4] Derin denizlerdeki sedimanlar oldukça heterojendir.[4] Farklı yaşıyorlar jeokimyasal ve bir uzman karışımının yaşadığı karmaşık bir habitatlar mozaiğine yansıyan mikrobiyal süreçler (heterotrofik ve symbiont-ilişkili) ve arka plan faunası.[4]
Kemosentetik topluluklar

Soğuk sular ve hidrotermal menfezlerdeki biyolojik araştırmalar çoğunlukla mikrobiyoloji ve önde gelen makro-omurgasızlar gelişiyor kemosentetik mikroorganizmalar.[2] Daha küçük üzerinde çok daha az araştırma yapıldı Bentik boyutunda kesir meiofauna (<1 mm).[2]
Topluluk kompozisyonunun bir tür kümesinden diğerine düzenli geçişi denir ekolojik başarı:[3]
Bu derin deniz enerji kaynağından yararlanan ilk organizma türü bakteri.[3] Toplanıyor bakteriyel paspaslar Soğuk sızıntılarda bu bakteriler metanı metabolize eder ve hidrojen sülfit (sızıntılardan çıkan başka bir gaz) enerji için.[3] Kimyasallardan enerji elde etme süreci, kemosentez.[3]

Bu ilk aşamada, metanın nispeten bol olduğu, yoğun midye yataklar ayrıca soğuk sızıntının yakınında oluşur.[3] Çoğunlukla cins içindeki türlerden oluşur Batimodiyol Bu midyeler doğrudan besin tüketmezler.[3] Bunun yerine, onlar tarafından beslenirler simbiyotik mat oluşturan akrabalarına benzer şekilde metandan enerji üreten bakteriler.[3] Kemosentetik çift kabuklular, soğuk suların faunasının önemli bileşenleridir ve bu ortamda beş aile tarafından temsil edilirler: Solemyidae, Lucinidae, Vesicomyidae, Thyasiridae ve Mytilidae.[5]
Bu mikrobiyal aktivite üretir kalsiyum karbonat üzerine yatırılan Deniz tabanı ve bir kaya tabakası oluşturur.[3] Birkaç on yıla kadar süren bir dönemde, bu kaya oluşumları siboglinid tüp kurtları midye ile birlikte yerleşip büyüyen.[3] Midyeler gibi, tüp kurtları da kemosentetik bakterilere (bu durumda ihtiyaç duyulan bir tür) dayanır. hidrojen sülfit metan yerine) hayatta kalmak için.[3] Herhangi bir simbiyotik ilişkiye sadık olarak, bir tüp kurdu aynı zamanda çevreden hidrojen sülfidi elden geçirerek bakterilerini de sağlar.[3] Sülfit yalnızca sudan gelmekle kalmaz, aynı zamanda sert, karbonat substratında bir tüp kurdu "burcu" oluşturan kapsamlı bir "kök" sistem aracılığıyla tortudan da çıkarılır.[3] Bir tüp kurdu çalısı, tortunun bir metre veya daha fazla üzerinde büyüyebilen yüzlerce ayrı solucan içerebilir.[3]
Soğuk sızıntılar sonsuza kadar sürmez. Gaz sızıntısı oranı yavaş yavaş azaldıkça, daha kısa ömürlü, metana aç midyeler (veya daha doğrusu, metana aç bakteri simbiyotları) ölmeye başlar.[3] Bu aşamada, tüp kurtları bir sızıntı topluluğunda baskın organizma haline gelir.[3] Tortu içinde bir miktar sülfit olduğu sürece, sülfit madenciliği tüp kurtları devam edebilir.[3] Bir tüp kurdu türünün bireyleri Lamellibrachia luyması bu koşullarda 250 yıldan fazla yaşadığı tahmin edilmektedir.[3]
 Tüp solucanlarının "kökleri" ayrıca tortudan bu tüp solucanlarının içindeki bakterilere bir hidrojen sülfit kaynağı sağlar. |  Simbiyotik vestimentifer tüp kurdu Lamellibrachia luyması Meksika Körfezi'ndeki 550 m derinlikte soğuk bir su sızıntısından. Bazın etrafındaki tortularda, sülfit oksitleyen bakterilerin turuncu bakteriyel matları bulunur. Beggiatoa spp. ve aynı zamanda suların ortak sakinleri olan çeşitli istiridye ve salyangozların boş kabukları.[6] |  Tubeworms, yumuşak mercanlar ve Florida Escarpment'in 3.000 m (9.800 ft) aşağısında bulunan bir sızıntıdaki kemosentetik midyeler. Eelpouts, bir Galatheid yengeç ve bir alvinokarit karides, bir örnekleme egzersizi sırasında zarar gören midyelerle beslenir. |
Diğer topluluklarla karşılaştırma

Soğuk sızıntılar ve hidrotermal menfezler derin okyanusların% 100'ü güvenmeyen topluluklardır. fotosentez gıda ve enerji üretimi için.[2] Bu sistemler büyük ölçüde kemosentetik türetilmiş enerji.[2] Her iki sistem de indirgenmiş kimyasal bileşiklerin varlığı gibi ortak özellikleri paylaşır (H2S ve hidrokarbonatlar ), yerel hipoksi ya da anoksi bakteri popülasyonlarının yüksek bolluk ve metabolik aktivitesi ve otokton, organik materyal kemoototrofik bakteri.[2] Hem hidrotermal menfezler hem de soğuk sızıntılar, düşük yerel çeşitlilikle birlikte düzenli olarak, oldukça yüksek metazoan biyokütle seviyeleri göstermektedir.[2] Bu, temel türlerin yoğun kümelenmelerinin varlığı ile açıklanır ve epizootik bu kümeler içinde yaşayan hayvanlar.[2] Topluluk düzeyinde karşılaştırmalar, birçok baskın durumu paylaşsalar da, menfez, sızıntı ve organik düşüş makrofaunasının aile düzeyinde kompozisyon açısından çok farklı olduğunu ortaya koymaktadır. takson yüksek sülfürlü habitatların arasında.[4]
Bununla birlikte, hidrotermal menfezler ve soğuk sızıntılar da birçok yönden farklılık gösterir. Daha kararlı soğuk sızıntılarla karşılaştırıldığında, menfezler, yerel olarak yüksek sıcaklıklar, güçlü dalgalanan sıcaklıklar, pH, sülfür ve oksijen konsantrasyonları, genellikle tortuların yokluğu, nispeten genç bir yaş ve genellikle ağdama ve havalandırmanın azalması gibi öngörülemeyen koşullarla karakterize edilir. sıvılar veya volkanik püskürmeler.[2] Uçucu olan hidrotermal menfezlerin aksine geçici ortamlarda, soğuk sızıntılar yavaş ve güvenilir bir hızda yayılır. Muhtemelen daha düşük sıcaklıklar ve stabilite nedeniyle, birçok soğuk su organizması hidrotermal menfezlerde yaşayanlardan çok daha uzun ömürlüdür.
Soğuk sızıntı topluluğunun sonu
Son olarak, soğuk sızıntılar etkisiz hale geldikçe, tüp kurtları da kaybolmaya başlayarak mercanlar şimdi maruz kalan karbonat substrat üzerine yerleşmek için.[3] Mercanlar, deniz tabanından sızan hidrokarbonlara güvenmiyor.[3] Üzerine çalışmalar Lophelia pertusa besinlerini öncelikle okyanus yüzeyinden aldıklarını öne sürüyorlar.[3] Kemosentez, yerleşimlerinde ve büyümelerinde, eğer varsa, çok küçük bir rol oynar.[3] Derin su mercanları kemosentez temelli organizmalar gibi görünmemekle birlikte, onlardan önce gelen kemosentetik organizmalar mercanların varlığını sağlar.[3] Kurulmasıyla ilgili bu hipotez derin su mercanı resiflere hidrolik teori denir.[7][8]
Dağıtım
1983'te Charles Paull ve meslektaşları tarafından Florida'daki Florida Escarpment'da keşfedildi. Meksika körfezi 3.200 metre (10.500 ft) derinlikte.[9] O zamandan beri, dünya okyanuslarının diğer birçok yerinde sızıntılar keşfedildi. Çoğu beş grupta toplandı biyocoğrafik iller: Meksika Körfezi, Atlantik, Akdeniz, Doğu Pasifik ve Batı Pasifik,[10] ancak soğuk su sızıntıları da buz rafı içinde Antarktika,[11] Kuzey Buz Denizi, Kuzey Denizi, Skagerrak, Kattegat, Kaliforniya Körfezi, Kızıl Deniz, Hint Okyanusu, kapalı güney Avustralya ve iç kesimlerde Hazar Denizi.[12] Yakın zamanda bir metan sızıntısının keşfi ile Güney okyanus,[13] Soğuk sızıntılar artık tüm büyük okyanuslarda bilinmektedir.[4] Soğuk sızıntılar, yüksek birincil üretkenlik ve tektonik aktivite alanlarında kıta kenarları boyunca yaygındır; burada kabuk deformasyonu ve sıkıştırma, metan bakımından zengin sıvının emisyonlarını tetikler.[4] Soğuk sızıntılar düzensiz dağıtılır ve en sık olarak denizden okyanus kenarlarının yakınında meydana gelir. gelgit arası -e Hadal derinlikler.[4] Şili'de gelgit bölgelerinden soğuk sızıntılar bilinmektedir,[14] Kattegat'ta metan sızıntıları "köpüren resifler" olarak bilinir ve tipik olarak 0-30 m (0-100 ft) derinliklerdedir,[15] ve Kuzey Kaliforniya açıklarında 35-55 m (115-180 ft) kadar sığ bulunabilirler.[12] Çoğu soğuk su sızıntısı, sıradanların ulaşamayacağı kadar derinlerde bulunur. tüplü dalış ve bilinen en derin su sızıntısı topluluğu Japonya Çukuru 7,326 m (24,035 ft) derinlikte.[16]
Günümüzde var olan soğuk sulara ek olarak, dünyanın çeşitli yerlerinde antik su sızıntı sistemlerinin fosil kalıntıları bulunmuştur. Bunlardan bazıları, daha önce kapsanan yerlerde çok iç kesimlerde bulunur. tarih öncesi okyanuslar.[12][17]
Meksika Körfezi'nde

Keşifler
Meksika Körfezi'nin kemosentetik toplulukları, 1990'lardan bu yana kapsamlı bir şekilde incelenmiştir ve ilk olarak üst yamaçta keşfedilen topluluklar, muhtemelen dünyadaki en iyi anlaşılan sızıntı topluluklarıdır. Bu olağanüstü hayvanların keşfinin tarihi, 1980'lerden beri meydana geldi. Dünyanın herhangi bir yerindeki ilk hidrotermal menfez topluluklarından Meksika Körfezi'ndeki ilk soğuk sızıntı topluluklarına kadar her büyük keşif beklenmedikti.[18]
İnsanlı denizaltı kullanılarak 1983'te Meksika'nın Doğu Körfezi'nde topluluklar keşfedildi. DSV Alvin geminin dibini araştıran bir seyir sırasında Florida Escarpment "soğuk" tuzlu su sızıntısı alanlarında, beklenmedik bir şekilde keşfedildikleri tüp kurtları ve midye (Paull ve diğerleri, 1984).[18] Kasım 1984'te Meksika Orta Körfezi'nde tesadüfen iki grup kemosentetik topluluklar keşfetti. Texas A&M Üniversitesi etkilerini belirlemek için petrol sızıntısı açık bentik ekoloji (bu araştırmaya kadar, petrol sızıntısının tüm etkilerinin zararlı olduğu varsayılıyordu), dip trolleri beklenmedik bir şekilde tüp solucanları ve istiridye gibi geniş kemosentetik organizma koleksiyonlarını geri kazandılar (Kennicutt ve diğerleri, 1985). Aynı zamanda, LGL Ekolojik Araştırma Ortakları çok yılın bir parçası olarak bir araştırma gezisi yürütüyordu MMS Kuzey Meksika Körfezi Kıta Eğimi Çalışması (Gallaway ve diğerleri, 1988). Alttan fotoğraflar (gemide işlendi), net görüntülerle sonuçlandı. vezikomid istiridye kemosentetik toplulukları tesadüfen, 1977'de Pasifik'te kamera kızağı tarafından yapılan ilk keşifle aynı şekilde. Aynı LGL / MMS gezisi sırasında fotoğrafçılık da Meksika'nın Orta Körfezi'ndeki tüp solucan topluluklarını ilk kez yerinde belgeledi (işlenmedi kruvaziyer sonrasına kadar; Boland, 1986) ilk dalgıç araştırmalarından önce ve ilk elden Bush Hill (27 ° 47′02 ″ K 91 ° 30'31″ B / 27.78389 ° K 91.50861 ° B) 1986'da (Rosman ve diğerleri, 1987a; MacDonald ve diğerleri, 1989b). Saha, akustik "silme" bölgeleri veya sızan hidrokarbonların neden olduğu substrat yapısının olmaması tarafından hedef alındı. Bu, R / V'de aynı seyir sırasında bir akustik pinger sistemi kullanılarak belirlendi. Edwin Bağlantısı (eski olan, yalnızca 113 ft (34 m)), Johnson Deniz Bağlantısı dalgıçlar. Saha, yoğun tüp kurdu ve midye birikimlerinin yanı sıra çok sayıda açıkta kalan karbonat çıkıntıları ile karakterizedir. gorgonca ve Lophelia mercan kolonileri. Bush Hill, dünyadaki en kapsamlı çalışılan kemosentetik bölgelerden biri haline geldi.[18]
Dağıtım
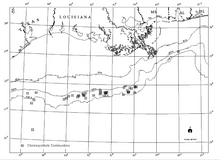
Körfez yamacında büyük derinliklerde bilinen hidrokarbon keşifleri ile kemosentetik topluluklar, hidrokarbon sızıntısı ve otojenik deniz tabanındaki karbonatları içeren mineraller (Sassen ve diğerleri, 1993a ve b). Hidrokarbon rezervuarları Körfez'in birkaç kilometre aşağısında geniş alanlar iken, kemosentetik topluluklar, yalnızca birkaç metre kalınlığında ince tortu kaplamalarıyla izole edilmiş alanlarda meydana gelir.[18]
Meksika Körfezi'nin kuzey yamacında bir stratigrafik 10 km'den (6 mil) daha kalın olan bölüm, tuz hareketinden derinden etkilenmiştir. Mesozoik Kaynak kayalar Üst Jura -e Üst Kretase Körfez yamacındaki alanların çoğunda petrol üretmektedir (Sassen ve diğerleri, 1993a ve b). Göç kanalları, yüzeye doğru 6-8 km'lik (4-5 mi) dikey bir ölçek aracılığıyla taze hidrokarbon malzemeleri sağlar. Hidrokarbon göçünün yüzey ifadeleri sızıntılar olarak adlandırılır. Jeolojik kanıtlar, hidrokarbon ve tuzlu su sızıntısının mekansal olarak ayrı alanlarda binlerce yıldır devam ettiğini göstermektedir.[18]
Kaynak sistemlerinden petrol ve gaz göçü için zaman ölçeği (kaldırma kuvveti ve basıncın birleşimi) milyonlarca yıl ölçeğindedir (Sassen, 1997). Yüzeye doğru faylar yoluyla hidrokarbon kaynaklarından sızıntı, üstteki tortu, karbonat çıkıntıları ve hidrat birikintiler, dolayısıyla karşılık gelen hidrokarbon sızıntısı toplulukları, suyun hidrotermal ağızları çevresinde bulunan kemosentetik topluluklardan daha büyük (birkaç yüz metre genişliğinde) olma eğilimindedir. Doğu Pasifik (MacDonald, 1992).[18] Sızıntı bölgelerinde hidrokarbon konsantrasyonlarında büyük farklılıklar vardır. Roberts (2001), çok yavaş sızıntıdan hızlı havalandırmaya kadar değişen çeşitli akı hızı koşulları altında beklenebilecek bir yanıt yelpazesi sundu.[18][19] Çok yavaş sızıntı siteleri, karmaşık kemosentetik toplulukları desteklemez; daha ziyade, genellikle yalnızca basit mikrobiyal paspaslar (Beggiatoa sp.).[18]
Üst eğim ortamında, karbonat çökelmesinden kaynaklanan sert alt tabakalar, çeşitli sapsızlar da dahil olmak üzere, kemosentetik olmayan hayvanların ilişkili topluluklarına sahip olabilir. cnidarians gibi mercanlar ve Deniz lalesi. Spektrumun hızlı akış ucunda, akışkanlaştırılmış tortu genellikle deniz tabanına gelen hidrokarbonlara ve oluşum akışkanlarına eşlik eder. Çamur volkanları ve çamur akar sonuç. Bu iki uç üye arasında bir yerlerde, yoğun nüfuslu ve çeşitli kemosentetik organizma topluluklarını (mikrobiyal matlar, siboglinid tüp kurtları, batimodiyolin Midye, lucinid ve vezikomid istiridye ve ilişkili organizmalar). Bu alanlar genellikle yüzey veya yüzeye yakın gaz hidrat mevduat. Ayrıca yerelleştirilmiş deniz tabanı alanlarına, genellikle otojenik karbonatlara, ancak bazen daha egzotik minerallere sahiptirler. barit mevcut.[18]
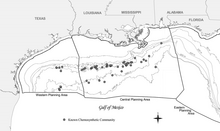
Meksika Körfezi kemosentetik topluluklarının yaygın doğası, ilk olarak Texas A&M Üniversitesi Jeolojik ve Çevresel Araştırma Grubu (GERG) tarafından sözleşmeli araştırmalar sırasında belgelendi. Offshore Operatörler Komitesi (Brooks ve diğerleri, 1986).[18] O zamandan beri çok sayıda ek topluluk belgelenmiş olmasına rağmen, bu anket en yaygın ve kapsamlı olmaya devam etmektedir.[18] İçin endüstri keşfi Meksika Körfezi'ndeki enerji rezervleri Meksika Orta Körfezi'nde bilinen en derin olay da dahil olmak üzere çok çeşitli derinliklerden sayısız yeni topluluğu belgelemiştir. Alaminos Kanyon Bloğu 2.750 m (9.022 ft) derinlikte 818.[18] Hidrokarbon sızıntısına bağlı kemosentetik organizmaların oluşumu, 290 m (951 ft) (Roberts ve diğerleri, 1990) kadar sığ ve 2.744 m (9.003 ft) kadar sığ su derinliklerinde belgelenmiştir.[18] Bu derinlik aralığı, spesifik olarak kemosentetik toplulukları, Meksika Körfezi'nin 305 m'den (1.000 ft) daha büyük su derinlikleri olarak tanımlanan derin su bölgesine yerleştirir.[18]
Kemosentetik topluluklar, kıta sahanlığı fosil kayıtlarında 200 m'den (656 ft) daha sığ suda görünseler de.[18] Bunu açıklayan bir teori şudur: yırtıcılık baskı, dahil olan zaman dilimi içinde önemli ölçüde değişmiştir (Callender ve Powell 1999).[18][20] 43'te 50'den fazla topluluğun var olduğu bilinmektedir. Dış Kıta Rafı (OCS) blokları.[18] Meksika Körfezi'ndeki tüm kemosentetik toplulukları belirlemek için sistematik bir araştırma yapılmamış olsa da, bu tür daha birçok topluluğun var olabileceğini gösteren kanıtlar vardır.[18] Keşiflerin derinlik sınırları muhtemelen araştırmanın sınırlarını yansıtır ( dalgıçlar 1.000 m (3.281 ft) üzerinde derinlik kapasitesine sahiptir.[18]
MacDonald vd. (1993 ve 1996) analiz etti uzaktan Algılama varlığını ortaya çıkaran uzaydan görüntüler petrol tabakaları Meksika'nın kuzey-orta Körfezi boyunca.[18][21][22] Sonuçlar, Meksika Körfezi'nde, özellikle 1.000 m'den (3.281 ft) daha büyük su derinliklerinde yoğun doğal petrol sızıntısını doğruladı.[18] Deniz tabanı kaynaklarının çok yıllık petrol tabakaları üretebildiği toplam 58 ilave potansiyel konum belgelenmiştir (MacDonald ve diğerleri, 1996).[18] Tahmini sızıntı oranları 4 varil / gün (0,64 m3/ d) 70 varil / gün'e (11 m3/ d) 0,1 varil / günden (0,016 m3/ d) gemi tahliyeleri için (her ikisi de 1.000 mi için normalize2 (640.000 ac)).[18] Bu kanıt, hidrokarbon sızıntısına bağlı kemosentetik toplulukların beklenebileceği alanı önemli ölçüde artırır.[18]
Kemosentetik organizmaların en yoğun kümelenmeleri, yaklaşık 500 m (1,640 ft) ve daha derin su derinliklerinde bulunmuştur.[18] Bu topluluklardan en iyi bilineni, onu ilk tanımlayan araştırmacılar tarafından Bush Hill olarak adlandırıldı (MacDonald ve diğerleri, 1989b).[18] Şaşırtıcı derecede büyük ve yoğun bir kemosentetik tüp solucanı ve midye topluluğudur. tuz diyapiri Yeşil Kanyon Blok 185'de yer almaktadır. Sızıntı alanı, yaklaşık 580 m (1,903 ft) su derinliğinde, çevredeki deniz tabanının yaklaşık 40 m (131 ft) üzerinde yükselen küçük bir tepeciktir.[18]
istikrar
Sassen'e (1997) göre hidratlar kemosentetik topluluklarda büyük ölçüde küçümsenmiştir.[18] Donmuşun biyolojik değişimi gaz hidratları ilk olarak sırasında keşfedildi MMS "Meksika Körfezi Kemosentetik Topluluklarında İstikrar ve Değişim" başlıklı çalışma.[23] Hidrat değişiminin dinamiklerinin biyojeokimyasal süreçleri beslemek için hidrokarbon gazlarının salınımını düzenleyen bir mekanizma olarak önemli bir rol oynayabileceği ve ayrıca topluluk istikrarında önemli bir rol oynayabileceği varsayılmaktadır (MacDonald, 1998b). Bush Hill bölgesi (4–5 ° C, 500 m (1,640 ft) derinlikte) gibi bazı bölgelerde kaydedilen dip su sıcaklığı gezintilerinin, hidratların ayrışmasına ve bunun da gaz akışlarında bir artışa neden olduğuna inanılmaktadır. (MacDonald ve diğerleri, 1994). Kadar yıkıcı olmasa da volkanizma havalandırma sitelerinde okyanus ortası sırtları sığ hidrat oluşumu ve hareketinin dinamikleri açıkça etkileyecektir. sapsız hayvanlar sızıntı bariyerinin bir parçasını oluşturur. Tüm bir sığ hidrat tabakasının dibinden kurtulabileceği ve yerel kemosentetik fauna topluluklarını önemli ölçüde etkileyebileceği felaket bir olay potansiyeli vardır.[18] Daha derin derinliklerde (> 1.000 m,> 3.281 ft), dip su sıcaklığı daha soğuktur (yaklaşık 3 ° C) ve daha az dalgalanmaya uğrar. Daha kararlı ve muhtemelen daha derin hidratların oluşumu, hafif hidrokarbon gazlarının tortu yüzeyine akışını etkiler, böylece yüzey morfolojisini ve kemosentetik toplulukların özelliklerini etkiler. Bush Hill gibi karmaşık topluluklarda, petrol önceden düşünülenden daha az önemli görünmektedir (MacDonald, 1998b).[18]
Vasıtasıyla tafonomik çalışmalar (kabukların ölüm toplulukları) ve çekirdeklerden sızıntı topluluğu bileşiminin yorumlanması, Powell et al. (1998), genel olarak, sızıntı topluluklarının 500-1.000 yıllık dönemler boyunca ve muhtemelen tüm Pleistosen (<- şüpheli. Holosen ?). Bazı siteler optimum düzeyde kaldı yetişme ortamı bitmiş jeolojik zaman ölçekleri. Powell midye ve deniz tarağı topluluklarının 500-4.000 yıl boyunca aynı bölgelerde devam ettiğine dair kanıtlar bildirdi. Powell ayrıca hem türlerin bileşiminin hem de trofik Hidrokarbon sızıntısı topluluklarının katmanlaşması, yalnızca sayısal bolluktaki zamansal değişimlerle, zaman içinde oldukça sabit olma eğilimindedir. Topluluk türünün değiştiği (örneğin midyeden midye topluluklarına) veya tamamen ortadan kalktığı birkaç vaka buldu. Faunal halefiyet gözlenmedi. Şaşırtıcı bir şekilde, geçmişteki yıkıcı bir olaydan sonra iyileşme gerçekleştiğinde, aynı kemosentetik türler bir alanı yeniden işgal etti. Katastrofik cenaze olaylarına dair çok az kanıt vardı, ancak Yeşil Kanyon Blok 234'teki midye topluluklarında iki örnek bulundu. Powell (1995) tarafından bildirilen en dikkate değer gözlem, her bir kemosentetik topluluk sitesinin benzersizliğiydi.[18]
Yağış otojenik karbonatlar ve diğer jeolojik olaylar şüphesiz uzun yıllar boyunca yüzey sızıntı modellerini değiştirecektir, ancak doğrudan gözlem yoluyla yedi ayrı çalışma alanında kemosentetik fauna dağılımında veya bileşiminde hiçbir değişiklik gözlenmemiştir (MacDonald ve diğerleri, 1995). Meksika'nın ilk Orta Körfezi topluluğu olan Bush Hill örneğinde biraz daha uzun bir süre (19 yıl) belirtilebilir. yerinde Bu bölgedeki 19 yıllık araştırma tarihi boyunca faunal kompozisyonda kitlesel ölümler veya büyük ölçekli değişimler (bilimsel amaçlı koleksiyonlar hariç) gözlemlenmemiştir.[18]
Tüm kemosentetik topluluklar, kasırgalar da dahil olmak üzere şiddetli fırtınaların etkisinin ötesinde su derinliklerinde bulunur ve bu topluluklarda yüzey fırtınalarından kaynaklanan hiçbir değişiklik olmazdı, kasırgalar.[18]
Biyoloji

MacDonald vd. (1990) dört genel topluluk türünü tanımlamıştır. Bunlar hakimiyet altındaki topluluklardır Vestimentiferan tüp kurtları (Lamellibrachia c.f. Barhami ve Escarpia spp.), mytilid midye (Seep Mytilid Ia, Ib ve III ve diğerleri), vezikomid istiridye (Vesicomya cordata ve Calyptogena ponderosa ) ve infaunal lucinid veya kekik istiridye (Lucinoma sp. veya Thyasira sp.). Bakteriyel paspaslar bugüne kadar ziyaret edilen tüm sitelerde mevcuttur. Bu fauna grupları, nasıl kümelendikleri, kümelenmelerin boyutları, oluştukları habitatların jeolojik ve kimyasal özellikleri ve bir dereceye kadar onlarla birlikte oluşan heterotrofik fauna açısından ayırt edici özellikler gösterme eğilimindedir. Meksika Körfezi'ndeki bu soğuk su topluluklarında bulunan türlerin çoğu bilimde yenidir ve kalır. tanımlanmamış.[18]
Bireysel lamellibranchid tüp kurtları, sızıntılarda bulunan iki taksonun daha uzun olanı 3 m (10 ft) uzunluğa ulaşabilir ve yüzlerce yıl yaşayabilir (Fisher ve diğerleri, 1997; Bergquist ve diğerleri, 2000). Büyüme oranları Geri kazanılan işaretli tüp solucanlarından tespit edilenler, bir yılda ölçülen 13 bireyde hiç büyüme olmamasından en fazla 9,6 cm / yıl (3,8 inç / yıl) büyüme Lamellibrachia bireysel (MacDonald, 2002). Ortalama büyüme oranı 2.19 cm / yıl (0.86 inç / yıl) Escarpia benzer türler ve lamellibrachids için 2,92 cm / yıl (1,15 inç / yıl). Bunlar, onlarınkinden daha yavaş büyüme oranlarıdır. Hidrotermal havalandırma akrabalar, ama Lamellibrachia bireyler, bilinen en büyük hidrotermal delik türlerinin 2-3 katı uzunluklara ulaşabilir.[18] Bireyleri Lamellibrachia sp. Muhtemel yaşların 400 yıldan fazla olduğunu temsil eden 3 metreden (10 ft) fazla çeşitli durumlarda toplanmıştır (Fisher, 1995). Vestimentiferan tüp kurdu yumurtlaması mevsimsel değildir ve işe alım epizodiktir.[18]
Tubeworms ya erkek ya da dişidir. Son zamanlarda yapılan bir keşif, dişi Lamellibrachia büyük çift kabuklu ile benzersiz bir ilişki oluşturmuş gibi görünüyor Acesta bullisi, tüp solucanının ön tüp açıklığına kalıcı olarak bağlı olarak yaşayan ve periyodik yumurta salınımı ile beslenen (Järnegren ve diğerleri, 2005). İki kabuklular ve tüp kurtları arasındaki bu yakın ilişki 1984'te keşfedildi (Boland, 1986), ancak tam olarak açıklanmadı. Neredeyse tamamı olgun Acesta bireyler erkek tüp solucanlarından ziyade dişilerde bulunur. Bu kanıt ve diğer deneyler Järnegren ve ark. (2005) bu gizemi çözmüş görünüyor.[18]
Soğuk sızıntı bölgelerinde metanotrofik midye için büyüme oranları bildirilmiştir (Fisher, 1995).[18] Genel büyüme oranları nispeten yüksek bulundu. Yetişkin midye büyüme oranları, benzer sıcaklıklarda kıyı ortamındaki midyelere benziyordu. Fisher ayrıca hidrokarbon sızıntılarındaki yavru midyelerin başlangıçta hızlı büyüdüğünü, ancak büyüme oranının yetişkinlerde önemli ölçüde düştüğünü buldu; çok hızlı bir şekilde üreme boyutuna büyürler. Hem bireyler hem de topluluklar çok uzun ömürlü görünüyor. Bunlar metan bağımlı midyelerin, onları Meksika Körfezi'ndeki en aktif sızıntı bölgelerine bağlayan katı kimyasal gereksinimleri vardır. Hızlı büyüme oranlarının bir sonucu olarak, bozuk bir sızıntı sahasında midye yeniden kolonizasyonu nispeten hızlı bir şekilde gerçekleşebilir. Midyelerin de bir miktar sert alt tabakaya ihtiyaç duyduğuna ve deniz tabanında uygun alt tabaka artırılırsa sayılarının artabileceğine dair bazı kanıtlar vardır (Fisher, 1995). Midye yataklarında her zaman ilişkili iki tür bulunur - gastropod Bathynerita naticoidea ve küçük Alvinocarid karides - bu endemik türlerin mükemmel olduğunu düşündürür dağılma yetenekleri ve çok çeşitli koşulları tolere edebilir (MacDonald, 2002).[18]
Midye yataklarından farklı olarak, kemosentetik istiridye yatakları, düşük çözünme oranları ve düşük sedimantasyon oranları nedeniyle yeni yaşayan bireylerin girişi olmadan uzun bir süre görsel bir yüzey fenomeni olarak varlığını sürdürebilir. Powell (1995) tarafından incelenen istiridye yataklarının çoğu aktif değildir. Yaşayan bireylere nadiren rastlandı. Powell, 50 yıllık bir zaman dilimi içinde, yerel yok oluşların ve kolonizasyonun aşamalı ve son derece nadir olması gerektiğini bildirdi. Bu hareketsiz yatakların aksine, Meksika Orta Körfezi'nde keşfedilen ilk topluluk, çok sayıda aktif olarak sürülen istiridyeden oluşuyordu. Bu topluluğun elde ettiği görüntüler, uzunluk / frekans ve canlı / ölü oranlarının yanı sıra uzamsal kalıpları geliştirmek için kullanıldı (Rosman ve diğerleri, 1987a).[18]
Kapsamlı bakteriyel paspaslar serbest yaşamın bakteri tüm hidrokarbon sızıntı bölgelerinde de belirgindir. Bu bakteriler ana fauna ile rekabet edebilir. sülfit ve metan enerji kaynaklarıdır ve ayrıca genel üretime önemli ölçüde katkıda bulunabilir (MacDonald, 1998b). Beyaz, pigmentsiz paspaslar, bir ototrofik kükürt bakterileri Beggiatoa türler ve turuncu matlar tanımlanamayan bir kimyasal sentetik olmayan metabolizmaya sahipti (MacDonald, 1998b).[18]
Sızıntı bölgelerindeki heterotrofik türler, sızıntılara özgü türlerin bir karışımıdır (özellikle yumuşakçalar ve kabuklu omurgasızlar) ve çevredeki ortamdan normal bir bileşen olanlar. Carney (1993) ilk olarak kronik bozulmanın bir sonucu olarak ortaya çıkabilecek potansiyel bir dengesizliği bildirdi. Düzensiz askere alma kalıpları nedeniyle, avcılar bir avantaj elde edebilir ve bu da yerel midye yatakları popülasyonlarının yok olmasına neden olabilir. Sızma sistemlerinin arka plan faunası ile etkileşime girdiği açıktır, ancak tüp solucanları gibi bazı belirli topluluk bileşenlerinde ne derece doğrudan avlanma meydana geldiğine dair çelişkili kanıtlar kalmaktadır (MacDonald, 2002). Bu son çalışmanın daha şaşırtıcı sonuçları, arka plandaki türlerin sızıntı üretimini göründüğünden daha fazla kullanmamasının nedenidir. Aslında, sızıntıyla ilişkili tüketiciler galatheid yengeçler ve nerit gastropodların izotopik imzaları vardı, bu da diyetlerinin sızıntı ve arka plan üretiminin bir karışımı olduğunu gösteriyordu. Bazı sitelerde, endemik Sızıntı üretiminden beslenmelerinin tamamı olmasa da, daha fazlasını elde etmeleri beklenebilecek olan omurgasızlar, gerçekte diyetlerinin yüzde 50'sini arka plandan tüketiyorlardı.[18]
Atlantik Okyanusunda
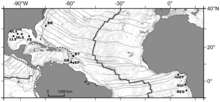
BR - Blake Ridge diyapir
BT - Barbados siper
VEYA - Orenok sektörler
EP - El Pilar sektörü
NIG - Nijerya eğimi
GUI - Guiness alanı
REG - Pockmark'ı yeniden yazın.
Batıdaki soğuk su toplulukları Atlantik Okyanusu Ayrıca, çamur volkanları ve diyapirlerde 1.000 ila 5.000 m (3.300-16.400 ft) derinlikteki birkaç dalıştan da tanımlanmıştır. Barbados ek prizma alanı ve Blake Ridge diyapir kapalı kuzey Carolina. Daha yakın zamanlarda, doğu Atlantik'te dev bir çukur kümesi üzerinde sızıntı toplulukları keşfedildi. Gine Körfezi yakınında Kongo derin kanal, ayrıca Kongo marjının diğer çukurlarında, Gabon marj ve Nijerya marj ve içinde Cádiz Körfezi.[10]
Kemosimbiyotik oluşumu Cádiz Körfezi'nin geniş çamur volkan alanlarında biota ilk olarak 2003 yılında rapor edildi.[24] Kemosimbiyotik çift kabuklular Cadiz Körfezi'nin çamur volkanlarından toplanan 2011 yılında incelendi.[5]
Kuzey Atlantik Okyanusu'ndan da soğuk su sızıntıları bilinmektedir.[2] hatta Arktik Okyanusu'na, Kanada açıklarına ve Norveç.[12]
Geniş faunal örnekleme, bölgedeki 400 ve 3.300 m'den (1.300-10.800 ft) gerçekleştirilmiştir. Atlantik Ekvator Kuşağı Meksika Körfezi'nden Gine Körfezi'ne, Barbados ek prizması, Blake Ridge diyapiri ve Kongo ve Gabon kenarlarından Doğu Atlantik'te ve son zamanlarda keşfedilen Nijerya Deniz Yaşamı Sayımı Satranç proje. Tür düzeyinde belirlenen 72 taksondan toplam 9 tür veya tür kompleksi amfi-Atlantik olarak tanımlanmıştır.[10]
Atlantik Ekvator Kuşağı deniz megafauna topluluk yapısı coğrafi uzaklıktan çok derinlikten etkilenir. Çift kabuklular Bathymodiolinae (içinde Mytilidae ) türler veya tür kompleksleri Atlantik'te en yaygın olanlardır. Bathymodiolus bumerang Kompleks, Florida tırmanma bölgesinde, Blake Ridge diyapiri, Barbados prizması ve Kongo'nun Regab bölgesinde bulunur. Bathymodiolus childressi Kompleks ayrıca, Regab veya Blake sırtı bölgelerinde olmasa da, Atlantik Ekvator Kuşağı boyunca Meksika Körfezi'nden Nijerya Kenarına kadar geniş çapta dağılmıştır. Komensal polinoid, Branchipolynoe seepensis Meksika Körfezi, Gine Körfezi ve Barbados'tan bilinmektedir. Doğudan batı Atlantik'e uzanan dağılımları olan diğer türler şunlardır: Cordesia provannoides, karides Alvinocaris muricola galateidler Munidopsis geyeri ve Munidopsis livida ve muhtemelen holothurid Chiridota heheva.[10]
Bölgede de soğuk sızıntılar bulundu. Amazon derin deniz hayranı. Raf kenarına yakın yüksek çözünürlüklü sismik profiller, yüzeye yakın çökmelerin ve yeraltında 20–50 m (66–164 ft) faylanma ve konsantrasyonlarda (yaklaşık 500 m2 veya 5,400 ft2) metan gazı. Birkaç çalışma (ör. Amazon Shelf Study—AMASEDS, LEPLAC, REMAC GLORIA, Okyanus Sondaj Programı ), dip simülasyonu yansımaları (BSR'ler), çamur volkanları, çamur izleri, tortulardaki gaz ve daha derin hidrokarbon oluşumlarının görülme sıklığına dayalı olarak Amazon fanının yamacında gaz sızıntısı olduğuna dair kanıtlar olduğunu gösterir. The existence of methane at relatively shallow depths and extensive areas of gas hydrates have been mapped in this region. Ayrıca, gas chimneys have been reported, and exploratory wells have discovered subcommercial gas accumulations and pock marks along fault planes. A sound geological and geophysical understanding of the Foz do Amazonas Basin is already available and used by the energy companies.[25]
Exploration of new areas, such as potential seep sites off of the east coast of the U.S. and the Laurentiyen fan where chemosynthetic communities are known deeper than 3,500 m (11,500 ft), and shallower sites in the Gulf of Guinea are need to study in the future.[10]
In the Mediterranean
The first biological evidence for reduced environments in the Akdeniz was the presence of Lucinidae ve Vesicomyidae bivalve shells cored on the top of the Napoli mud volcano (33°43′52″N 24°40′52″E / 33.73111°N 24.68111°E; "Napoli" is only a name of a seamount. It locates south of Crete), located at 1,900 m depth on the Mediterranean Ridge içinde subduction zone of African plate. This was followed by the description of a new Lucinidae bivalve species, Lucinoma kazani, associated with bacterial endosymbionts. In the southeastern Mediterranean, communities of poliketler and bivalves were also found associated with cold seeps and carbonates near Mısır ve Gazze Şeridi at depths of 500–800 m, but no living fauna was collected. İlk yerinde observations of extensive living chemosynthetic communities in the Eastern Mediterranean Sea prompted cooperation between biologists, geochemists, and geologists. Sırasında submersible dives, communities comprising large fields of small bivalves (dead and alive), large siboglinid tube worms, isolated or forming dense aggregations, large süngerler, and associated endemic fauna were observed in various cold seep habitats associated with carbonate crusts at 1,700–2,000 m depth. Two mud volcano fields were first explored, one along the Mediterranean Ridge, where most of them were partially (Napoli, Milano mud volcanoes) or totally (Urania, Maidstone mud volcanoes) affected by brines, and the other on the Anaximander mounds güneyi Türkiye. The latter area includes the large Amsterdam mud volcano, which is affected by recent mudflows, and the smaller Kazan or Kula mud volcanoes. Gas hydrates have been sampled at the Amsterdam and Kazan mud volcanoes, and high methane levels have been recorded above the seafloor. Several provinces of the Nil deep-sea fan have been explored recently. These include the very active brine seepage named the Menes Caldera in the eastern province between 2,500 m and 3,000 m, the pockmarks in the central area along mid- and lower slopes, and the mud volcanoes of the eastern province, as well as one in the central upper slope (North Alex area) at 500 m depth.[26]
During these first exploratory dives, symbiont-bearing taxa that are similar to those observed on the Olimpi and Anaximander mud fields were sampled and identified. This similarity is not surprising, as most of these taxa were originally described from dredging in the Nile fan.[26] Up to five species of bivalves harboring bacterial symbionts colonized these methane- and sulfide-rich environments. Yeni bir tür Siboglinidae polychaete, Lamellibrachia anaximandri, the tubeworm colonizing cold seeps from the Mediterranean ridge to the Nile deep-sea fan, has just been described in 2010.[26][27] Moreover, the study of symbioses revealed associations with chemoautotrophic Bacteria, sulfur oxidizers in Vesicomyidae and Lucinidae bivalves and Siboglinidae tubeworms, and highlighted the exceptional diversity of Bacteria living in symbiosis with small Mytilidae. The Mediterranean seeps appear to represent a rich habitat characterized by megafauna tür zenginliği (Örneğin., gastropodlar ) or the exceptional size of some species such as sponges (Rhizaxinella pyrifera ) and crabs (Chaceon mediterraneus ), compared with their background counterparts. This contrasts with the low macro- and mega-faunal abundance and diversity of the deep Doğu Akdeniz. Seep communities in the Mediterranean that include endemic chemosynthetic species and associated fauna differ from the other known seep communities in the world at the species level but also by the absence of the large size bivalve genera Calyptogena veya Bathymodiolus. The isolation of the Mediterranean seeps from the Atlantic Ocean after the Messinian crisis led to the development of unique communities, which are likely to differ in composition and structure from those in the Atlantic Ocean. Further expeditions involved quantitative sampling of habitats in different areas, from the Mediterranean Ridge to the eastern Nile deep-sea fan.[26] Cold seeps discovered in the Marmara Denizi 2008 yılında[28] have also revealed chemosynthesis-based communities that showed a considerable similarity to the symbiont-bearing fauna of eastern Mediterranean cold seeps.[26]
In the Indian Ocean
İçinde Makran Trench, a subduction zone along the northeastern margin of the Umman Körfezi adjacent to the southwestern coast of Pakistan and the southeastern coast of İran, compression of an accretionary wedge has resulted in the formation of cold seeps and mud volcanoes.[29]
In the West Pacific
Yerli alüminyum has been reported also in cold seeps in the northeastern continental slope of Güney Çin Denizi and Chen et al. (2011)[30] have proposed a theory of its origin as resulting by indirgeme itibaren tetrahydroxoaluminate Al(OH)4− to metallic aluminium by bakteri.[30]
Japonya
| Soğuk sızıntı | |
| Hidrotermal havalandırma | |
| Whale fall |
|
Deep sea communities around Japan are mainly researched by Japan Agency for Marine-Earth Science and Technology (JAMSTEC). DSV Shinkai 6500, Kaikō and other groups have discovered many sites.
Methane seep communities in Japonya are distributed along plate convergence areas because of the accompanying tektonik aktivite. Many seeps have been found in the Japan Trench, Nankai Teknesi, Ryukyu Trench, Sagami Körfezi ve Suruga Bay, ve Japon Denizi.[32]
Members of cold seep communities are similar to other regions in terms of family or genus, such as Polycheata; Lamellibrachia, Bivalavia; Solemyidae, Bathymodiolus in Mytilidae, Thyasiridae, Calyptogena in Vesicomyidae and so forth.[31] Many of species in cold seeps of Japan are endemik.[32]
In Kagoshima Bay, there are methane gas seepages called "tagiri" (boiling). Lamellibrachia satsuma live around there. The depth of this site is only 80 m, which is the shallowest point Siboglinidae living. L. satsuma may be kept in an aquarium for a long period in 1 atm. Two aquariums in Japan are keeping and displaying L. satsuma. An observation method to introduce it into a transparent vinyl tube is being developed.[33]
DSV Shinkai 6500 discovered vesicomyid clam communities in the Southern Mariana Forearc. They depend on methane which originates in serpentinite. Other chemosynthetic communities would depend on hydrocarbon origins organic substance in crust, but these communities depend on methane originating from inorganic substances from the mantle.[34][35]
In 2011, was performed around the Japan Trench which is epicenter of Tōhoku depremi. There are cracks, methane seepages and bacterial mats which were probably created by the earthquake.[36][37]
Yeni Zelanda
Off the mainland coast of Yeni Zelanda, shelf-edge instability is enhanced in some locations by cold seeps of methane-rich fluids that likewise support chemosynthetic faunas and carbonate concretions.[38][39][40][41] Dominant animals are tube worms of the family Siboglinidae and bivalves of families Vesicomyidae ve Mytilidae (Bathymodiolus ). Many of its species appear to be endemic. Derin bottom trawling vardır severely damaged cold seep communities and those ecosystems are threatened. Depths down to 2,000 m including cold seeps belongs among as-yet-unmapped topographic and chemical complexity of habitats. The scale of new-species discovery in these poorly studied or unexplored ecosystems is likely to be high.[41][38]
In the East Pacific

In the deep sea the COMARGE project has studied the biodiversity patterns along and across the Şili margin through a complexity of ecosystems such as methane seeps and oxygen minimum zones reporting that such habitat heterogeneity may influence the biodiversity patterns of the local fauna.[25][42][43][44] Seep fauna include bivalves of families Lucinidae, Thyasiridae, Solemyidae (Acharax sp.), and Vesicomyidae (Calyptogena gallardoi ) and polychaetes Lamellibrachia sp. and two other polychaete species.[43] Furthermore, in these soft reduced sedimanlar below the oxygen minimum zone off the Chilean margin, a diverse microbial community composed by a variety of large prokaryotlar (mainly large multi-cellular filamentous "mega bacteria" of the genera Thioploca ve Beggiatoa, and of "macrobacteria" including a diversity of phenotypes), protistler (ciliates, flagellates, and foraminifers), as well as small metazoans (mostly nematodes and polychaetes) has been found.[25][45] Gallardo et al. (2007)[45] argue that the likely chemolithotrophic metabolism of most of these mega- and macrobacteria offer an alternative explanation to fosil findings, in particular to those from obvious non-littoral origins, suggesting that traditional hypotheses on the cyanobacterial origin of some fossils may have to be revised.[25]
Cold seeps (pockmark ) are also known from depths of 130 m in the Hecate Strait, Britanya Kolumbiyası, Kanada.[46] Unobvious fauna (also unobvious for cold seeps) has been found there with these dominating species: sea snail Fusitriton oregonensis, anemone Metridium giganteum, encrusting sponges and bivalve Solemya reidi.[46]
Cold seeps with chemosynthetic communities along the USA Pacific coast occur in Monterey Canyon, just off Monterey Körfezi, California on a mud volcano.[47] There have been found, for example Calyptogena istiridye Calyptogena kilmeri ve Calyptogena pacifica[48] ve foraminiferan Spiroplectammina biformis.[49]
Additionally, seeps have been discovered offshore southern California in the inner California Borderlands along several fault systems including the San Clemente fault,[50] San Pedro fault,[51] and San Diego Trough fault.[52] Fluid flow at the seeps along the San Pedro and San Diego Trough faults appears controlled by localized restraining bends in the faults.[52]
In the Antarctic
The first cold seep was reported from Güney okyanus 2005 yılında.[13] The relatively few investigations to the Antarctic deep sea have shown the presence of deep-water habitats, including hidrotermal menfezler, cold seeps, and mud volcanoes.[53] Dan başka Antarctic Benthic Deep-Sea Biodiversity Project (ANDEEP) cruises, little work has been done in the deep sea.[53] There are more species waiting to be described.[53]
Detection
With continuing experience, particularly on the upper continental slope in the Gulf of Mexico, the successful prediction of the presence of tubeworm communities continues to improve, however chemosynthetic communities cannot be reliably detected directly using geophysical techniques. Hydrocarbon seeps that allow chemosynthetic communities to exist do modify the geological characteristics in ways that can be remotely detected, but the time scales of co-occurring active seepage and the presence of living communities is always uncertain. These known sediment modifications include (1) precipitation of authigenic carbonate in the form of micronodules, nodüller, or rock masses; (2) formation of gas hydrates; (3) modification of tortu composition through concentration of hard chemosynthetic organism remains (such as shell fragments and layers); (4) formation of interstitial gas bubbles or hydrocarbons; and (5) formation of depressions or pockmarks by gas expulsion. These features give rise to acoustic effects such as wipeout zones (no echoes), hard bottoms (strongly reflective echoes), bright spots (reflection enhanced layers), or reverberant layers (Behrens, 1988; Roberts and Neurauter, 1990). "Potential" locations for most types of communities can be determined by careful interpretation of these various geophysical modifications, but to date, the process remains imperfect and confirmation of living communities requires direct visual techniques.[18]
Fossilized records

Cold seep deposits are found throughout the Phanerozoic rock record, especially in the Late Mesozoik ve Senozoik (see for example Kaim et al., 2008; Conti et al., 2017).[54][55] Bunlar fosil cold seeps are characterized by mound-like topography (where preserved), coarsely crystalline carbonates, and abundant mollusks and Brakiyopodlar.
Environmental Impacts
Major threats that cold seep ecosystems and their communities face today are seafloor litter, chemical contaminants and climate change. Seafloor litter alters the habitat, by providing hard substrate where none was available before or by overlying the sediment, inhibiting gas exchange, and interfering with organisms on the bottom of the sea. Studies of marine litter in the Mediterranean include surveys of seabed debris on the continental shelf, slope, and bathyal plain.[56][57] In most studies, plastic items accounted for much of the debris, sometimes as much as 90% or more of the total, owing to their ubiquitous use and poor degradability.
Weapons and bombs have also been discarded at sea and their dumping in open waters contributes to seafloor contamination. Another major threat to the benthic fauna is the presence of lost fishing gear, such as nets and longlines, which contribute to ghost fishing and can damage fragile ecosystems such as cold-water corals.
Chemical contaminants such as persistent organic pollutants, toxic metals (e.g., Hg, Cd, Pb, Ni), radioactive compounds, pesticides, herbicides, and pharmaceuticals are also accumulating in deep-sea sediments.[58] Topography (e.g. presence of canyons) and hydrography (e.g., cascading events) play a major role in the transportation and accumulation of these chemicals from the coast and shelf to the deep basins, affecting the local fauna. Recent studies have detected the presence of significant levels of dioxins in the commercial shrimp Aristeus antennatus [59] and significant levels of persistent organic pollutants in mesopelagic and bathypelagic cephalopods[60]
Climate driven processes and climate change will affect the frequency and intensity of cascading, with unknown effects on the benthic fauna. Another potential effect of climate change is related to energy transport from surface waters to the seafloor.[61] Primary production will change in the surface layers according to sun exposure, water temperature, major stratification of water masses, for example and this will affect the food chain down to the deep seafloor, which will be subject to differences in quantity, quality, and timing of organic matter input. As commercial fisheries move into deeper waters, all of these effects will affect the communities and populations of organisms in cold seeps and the deep sea in general.
Ayrıca bakınız
Referanslar
This article incorporates a kamu malı work of the United States Government from references[3][18] and CC-BY-2.5 from references[2][4][6][10][25][26][32][38][53] and CC-BY-3.0 text from the reference[5]
- ^ Fujikura, Katsunori; Okutani, Takashi; Maruyama, Tadashi (2008). Sensui chōsasen ga mita shinkai seibutsu : shinkai seibutsu kenkyū no genzai [Deep-sea life: biological observations using research submersibles]. Tokai University Press. ISBN 978-4-486-01787-5. s. 20.
- ^ a b c d e f g h ben j k l m n Ö p q Vanreusel, A.; De Groote, A.; Gollner, S.; Bright, M. (2010). "Ecology and Biogeography of Free-Living Nematodes Associated with Chemosynthetic Environments in the Deep Sea: A Review". PLoS ONE. 5 (8): e12449. Bibcode:2010PLoSO...512449V. doi:10.1371/journal.pone.0012449. PMC 2929199. PMID 20805986.
- ^ a b c d e f g h ben j k l m n Ö p q r s t sen v w x y z Hsing P.-Y. (19 Ekim 2010). "Gas-powered Circle of Life – Succession in a Deep-sea Ecosystem". NOAA Ocean Explorer | Lophelia II 2010: Oil Seeps and Deep Reefs | 18 October Log. Retrieved 25 January 2011.
- ^ a b c d e f g h Bernardino, A. F.; Levin, L. A.; Thurber, A. R.; Smith, C. R. (2012). "Comparative Composition, Diversity and Trophic Ecology of Sediment Macrofauna at Vents, Seeps and Organic Falls". PLOS ONE. 7 (4): e33515. Bibcode:2012PLoSO...733515B. doi:10.1371/journal.pone.0033515. PMC 3319539. PMID 22496753.
- ^ a b c Oliver, G.; Rodrigues, C; Cunha, M. R. (2011). "Chemosymbiotic bivalves from the mud volcanoes of the Gulf of Cadiz, NE Atlantic, with descriptions of new species of Solemyidae, Lucinidae and Vesicomyidae". ZooKeys (113): 1–38. doi:10.3897/ZooKeys.113.1402. PMC 3187628. PMID 21976991.
- ^ a b Boetius, A (2005). "Microfauna–Macrofauna Interaction in the Seafloor: Lessons from the Tubeworm". PLOS Biyoloji. 3 (3): e102. doi:10.1371/journal.pbio.0030102. PMC 1065708. PMID 15760275.
- ^ Hovland, M.; Thomsen, E. (1997). "Cold-water corals—are they hydrocarbon seep related?". Marine Geology. 137 (1–2): 159–164. Bibcode:1997MGeol.137..159H. doi:10.1016/S0025-3227(96)00086-2.
- ^ Hovland M. (2008). Deep-water coral reefs: unique biodiversity hot-spots. 8.10 Summary and re-iteration of the hydraulic theory. Springer, 278 pp. ISBN 978-1-4020-8461-4. Sayfalar 204 -205.
- ^ Paull; Hecker; Commeau; et al. (1984). "Biological communities at the Florida escarpment resemble hydrothermal vent taxa". Bilim. 226 (4677): 965–967. Bibcode:1984Sci...226..965P. doi:10.1126/science.226.4677.965. PMID 17737352.
- ^ a b c d e f Olu, K.; Cordes, E. E.; Fisher, C. R.; Brooks, J. M.; Sibuet, M.; Desbruyères, D. (2010). "Biogeography and Potential Exchanges Among the Atlantic Equatorial Belt Cold-Seep Faunas". PLoS ONE. 5 (8): e11967. Bibcode:2010PLoSO...511967O. doi:10.1371/journal.pone.0011967. PMC 2916822. PMID 20700528.
- ^ "Demise of Antarctic Ice Shelf Reveals New Life". Ulusal Bilim Vakfı. 2007. Alındı 14 Şubat 2008.
- ^ a b c d Levin, L.A. (2005). "Ecology of cold seep sediments: Interactions if fauna with flow, chemistry and microbes". In Gibson, R.N.; R.J.A. Atkinson; J.D.M. Gordon (eds.). Oceanography and Marine Biology: An Annual Review. 43. pp. 1–46. ISBN 9780849335976.
- ^ a b Domack, E.; Ishman, S.; Leventer, A.; Sylva, S.; Willmott, V. (2005). "A chemotrophic ecosystem found beneath Antarctic Ice Shelf". Eos, Transactions American Geophysical Union. 86 (29): 269–276. Bibcode:2005EOSTr..86..269D. doi:10.1029/2005EO290001. S2CID 35944740.
- ^ Jessen; Pantoja; Gutierréz; et al. (2011). "Methane in shallow cold seeps at Mocha Island off central Chile". Continental Shelf Research. 31 (6): 574–581. Bibcode:2011CSR....31..574J. doi:10.1016/j.csr.2010.12.012.
- ^ "Red List – Submarine structures made by leaking gases" (PDF). HELCOM. 2013. Alındı 16 Haziran 2017.
- ^ Fujikura; Kojima; Tamaki; et al. (1999). "The deepest chemosynthesis-based community yet discovered from the hadal zone, 7326 m deep, in the Japan Trench". Deniz Ekolojisi İlerleme Serisi. 190: 17–26. Bibcode:1999MEPS..190...17F. doi:10.3354/meps190017.
- ^ Campbell, K.A.; J.D. Farmer; D. Des Marais (2002). "Ancient hydrocarbon seeps from the Mesozoic convergent margin of California: carbonate geochemistry, fluids and palaeoenvironments". Geoakışkanlar. 2 (2): 63–94. doi:10.1046/j.1468-8123.2002.00022.x.
- ^ a b c d e f g h ben j k l m n Ö p q r s t sen v w x y z aa ab AC reklam ae af ag Ah ai aj ak al am bir ao ap aq ar "Gulf of Mexico OCS Oil and Gas Lease Sales: 2007–2012. Western Planning Area Sales 204, 207, 210, 215, and 218. Central Planning Area Sales 205, 206, 208, 213, 216, and 222. Draft Environmental Impact Statement. Volume I: Chapters 1–8 and Appendices" (PDF). Minerals Management Service Gulf of Mexico OCS Region, New Orleans. ABD İçişleri Bakanlığı. November 2006. pp. 3–27, 3–31. Arşivlenen orijinal (PDF) on 26 March 2009.
- ^ Roberts, H. H. (2001). "Fluid and gas expulsion on the northern Gulf of Mexico continental slope: Mud-prone to mineral-prone responses". Natural Gas Hydrates. Geophysical Monograph Series. 124. Amerikan Jeofizik Birliği. pp. 145–161. Bibcode:2001GMS...124..145R. doi:10.1029/GM124p0145. ISBN 9781118668412. Arşivlenen orijinal on 28 October 2012. Alındı 26 Mart 2012.
- ^ Callender, W. Russell; E. N. Powell (1999). "Why did ancient chemosynthetic seep and vent assemblages occur in shallower water than they do today?". International Journal of Earth Sciences. 88 (3): 377–391. Bibcode:1999IJEaS..88..377C. doi:10.1007/s005310050273.
- ^ MacDonald, I. R.; Guinasso, N. L.; Ackleson, S. G.; Amos, J. F.; Duckworth, R.; Sassen, R.; Brooks, J. M. (1993). "Natural oil slicks in the Gulf of Mexico visible from space". Jeofizik Araştırmalar Dergisi. 98 (C9): 16351. Bibcode:1993JGR....9816351M. doi:10.1029/93JC01289.
- ^ MacDonald, I.R.; J.F. Reilly Jr.; BİZ. Best; R. Vnkataramaiah; R. Sassen; N.S. Guinasso Jr.; J. Amos (1996). Remote sensing inventory of active oil seeps and chemosynthetic communities in the northern. Gulf of Mexico. In: Schumacher, D. and M.A. Abrams, eds. Hydrocarbon migration and its nearsurface expression. American Association of Petroleum Geologists Memoir 6. Amer Association of Petroleum Geologists. pp. 27–37. ISBN 978-0-89181-345-3.
- ^ I. R. McDonald, ed. (1998). "Stability and Change in Gulf of Mexico Chemosynthetic Communities" (PDF). U.S. Department of the Interior: OCS Study MMS 98-0034: Prepared by the Geochemical and Environmental Research Group: Texas A&M University. Alındı 17 Temmuz 2016.
- ^ Pinheiro, L. M.; Ivanov, M. K.; Sautkin, A.; Akhamanov, G.; Magalhães, V. H.; Volkonskaya, A.; Monteiro, J. H.; Somoza, L.; Gardner, J.; Hamouni, N.; Cunha, M. R. (2003). "Mud volcanoes in the Gulf of Cadiz: results from the TTR-10 cruise". Marine Geology. 195 (1–4): 131–151. Bibcode:2003MGeol.195..131P. doi:10.1016/S0025-3227(02)00685-0.
- ^ a b c d e Miloslavich, P.; Klein, E.; Díaz, J. M.; Hernández, C. E.; Bigatti, G. (2011). "Marine Biodiversity in the Atlantic and Pacific Coasts of South America: Knowledge and Gaps". PLoS ONE. 6 (1): e14631. Bibcode:2011PLoSO...614631M. doi:10.1371/journal.pone.0014631. PMC 3031619. PMID 21304960.
- ^ a b c d e f Danovaro, R.; Company, J. B.; Corinaldesi, C.; D'Onghia, G.; Galil, B. (2010). "Deep-Sea Biodiversity in the Mediterranean Sea: The Known, the Unknown, and the Unknowable". PLoS ONE. 5 (8): e11832. Bibcode:2010PLoSO...511832D. doi:10.1371/journal.pone.0011832. PMC 2914020. PMID 20689848.
- ^ Southward E., Andersen A., Hourdez S. (submitted 2010). "Lamellibrachia anaximandri n.sp., a new vestimentiferan tubeworm from the Mediterranean (Annelida)". Zoosystema.
- ^ Zitter, T. A. C; Henry, P.; Aloisi, G.; Delaygue, G.; Çagatay, M. N. (2008). "Cold seeps along the main Marmara Fault in the Sea of Marmara (Turkey)" (PDF). Deep-Sea Research Part I: Oceanographic Research Papers. 55 (4): 552–570. Bibcode:2008DSRI...55..552Z. doi:10.1016/j.dsr.2008.01.002.
- ^ Fischer, D. ; Bohrmann, G. ; Zabel, M. ; Kasten, S. (April 2009): Geochemical zonation and characteristics of cold seeps along the Makran continental margin off Pakistan EGU General Assembly Conference Abstracts. Erişim tarihi: 19 Kasım 2020.
- ^ a b Chen, Z.; Huang, C.-Y.; Zhao, M.; Yan, W.; Chien, C.-W.; Chen, M.; Yang, H.; Machiyama, H.; Lin, S. (2011). "Characteristics and possible origin of native aluminum in cold seep sediments from the northeastern South China Sea". Journal of Asian Earth Sciences. 40 (1): 363–370. Bibcode:2011JAESc..40..363C. doi:10.1016/j.jseaes.2010.06.006.
- ^ a b Fujikura 2008, p.450
- ^ a b c Fujikura, K.; Lindsay, D.; Kitazato, H.; Nishida, S.; Shirayama, Y. (2010). "Marine Biodiversity in Japanese Waters". PLoS ONE. 5 (8): e11836. Bibcode:2010PLoSO...511836F. doi:10.1371/journal.pone.0011836. PMC 2914005. PMID 20689840.
- ^ Miyake, Hiroshi; Jun HASHIMOTO; Shinji TSUCHIDA (2010). "Observation method of behaviour of vestimentifean tube-worm (Lamellibrachia satsuma) in its tube" (PDF). JAMSTEC深海研究. (16-I.生物学編). Alındı 30 Mart 2012.
- ^ "マリアナ海溝、チャレンジャー海淵の近くにおいて、マントル物質から栄養を摂る生態系を発見~有人潜水調査船「しんかい6500」による成果~". 7 February 2012. Archived from orijinal 23 Eylül 2012 tarihinde. Alındı 29 Mart 2012.
- ^ Ohara, Yasuhiko; Mark K. Reaganc; Katsunori Fujikurab; Hiromi Watanabeb; Katsuyoshi Michibayashid; Teruaki Ishiie; Robert J. Sternf; Ignacio Pujanaf; Fernando Martinezg; Guillaume Girardc; Julia Ribeirof; Maryjo Brounceh; Naoaki Komorid; Masashi Kinod (21 February 2012). "A serpentinite-hosted ecosystem in the Southern Mariana Forearc". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 109 (8): 2831–2835. Bibcode:2012PNAS..109.2831O. doi:10.1073/pnas.1112005109. PMC 3286937. PMID 22323611.
- ^ "東北地方太平洋沖地震震源海域での有人潜水調査船「しんかい6500」による潜航調査で得られた画像について(速報)".海洋研究開発機構. 15 August 2011. Alındı 29 Mart 2012.
- ^ Kawagucci, Shinsuke; Yukari T. Yoshida; Takuroh Noguchi; Makio C. Honda; Hiroshi Uchida; Hidenori Ishibashi; Fumiko Nakagawa; Urumu Tsunogai; Kei Okamura; Yoshihiro Takaki; Takuro Nunoura; Junichi Miyazaki; Miho Hirai; Weiren Lin; Hiroshi Kitazato; Ken Takai (3 January 2012). "Disturbance of deep-sea environments induced by the M9.0 Tohoku Earthquake". Bilimsel Raporlar. 2: 270. Bibcode:2012NatSR...2E.270K. doi:10.1038/srep00270. PMC 3280601. PMID 22355782.
- ^ a b c Gordon, D. P.; Beaumont, J.; MacDiarmid, A.; Robertson, D. A.; Ahyong, S. T (2010). "Marine Biodiversity of Aotearoa New Zealand". PLoS ONE. 5 (8): e10905. Bibcode:2010PLoSO...510905G. doi:10.1371/journal.pone.0010905. PMC 2914018. PMID 20689846.
- ^ Lewis, K. B.; Marshall, B. A. (1996). "Seep faunas and other indicators of methane-rich dewatering on New Zealand convergent margins". Yeni Zelanda Jeoloji ve Jeofizik Dergisi. 39 (2): 181–200. doi:10.1080/00288306.1996.9514704.
- ^ Orpin, A. R. (1997). "Dolomite chimneys as possible evidence of coastal fluid expulsion, uppermost Otago continental slope, southern New Zealand". Marine Geology. 138 (1–2): 51–67. Bibcode:1997MGeol.138...51O. doi:10.1016/S0025-3227(96)00101-6.
- ^ a b Baco, A. R.; Rowden, A. A.; Levin, L. A.; Smith, C. R.; Bowden, D. (2009). "Initial characterization of cold seep faunal communities on the New Zealand margin". Marine Geology. 272 (1–4): 251–259. Bibcode:2010MGeol.272..251B. doi:10.1016/j.margeo.2009.06.015.
- ^ Sellanes, J.; Neira, C.; Quiroga, E.; Teixido, N. (2010). "Diversity patterns along and across the Chilean margin: a continental slope encompassing oxygen gradients and methane seep benthic habitats". Deniz Ekolojisi. 31 (1): 111–124. Bibcode:2010MarEc..31..111S. doi:10.1111/j.1439-0485.2009.00332.x. hdl:10261/56612.
- ^ a b Sellanes, J.; Quiroga, E.; Neira, C. (2008). "Megafauna community structure and trophic relationships at the recently discovered Concepción Methane Seep Area, Chile, ~36°S". ICES Deniz Bilimleri Dergisi. 65 (7): 1102–1111. doi:10.1093/icesjms/fsn099.
- ^ Sellanes, J.; Quiroga, E.; Gallardo, V. A. (2004). "First direct evidence of methane seepage and associated chemosynthetic communities in the bathyal zone off Chile". Journal of the Marine Biological Association of the UK. 84 (5): 1065–1066. doi:10.1017/S0025315404010422h.
- ^ a b Gallardo, V. A.; Espinoza, C. (2007). Hoover, Richard B; Levin, Gilbert V; Rozanov, Alexei Y; Davies, Paul C. W (eds.). "Large multicellular filamentous bacteria under the oxygen minimum zone of the eastern South Pacific: a forgotten biosphere". Proc. SPIE. Instruments, Methods, and Missions for Astrobiology X. 6694: 66941H–11. Bibcode:2007SPIE.6694E..1HG. doi:10.1117/12.782209.
- ^ a b Barrie, J. V.; Cook, S.; Conway, K. W. (2010). "Cold seeps and benthic habitat on the Pacific margin of Canada". Continental Shelf Research. 31 (2 Supplement 1): S85–S92. Bibcode:2011CSR....31S..85V. doi:10.1016/j.csr.2010.02.013.
- ^ Lorenson T. D., Kvenvolden K. A., Hostettler F. D., Rosenbauer R. J., Martin J. B. & Orange D. L. (1999). "Hydrocarbons Associated with Fluid Venting Process in Monterey Bay, California". USGS Pacific Coastal & Marine Science Center.
- ^ Goffredi S. K. & Barry J. P. (2000). "Factors regulating productivity in chemoautotrophic symbioses; with emphasis on Calyptogena kilmeri ve Calyptogena pacifica". Poster, Monterey Bay Aquarium Research Institute. accessed 3 February 2011. PDF.
- ^ Bernhard, J. M.; Buck, K. R.; Barry, J. P. (2001). "Monterey Bay cold-seep biota: Assemblages, abundance, and ultrastructure of living foraminifera". Deep-Sea Research Part I: Oceanographic Research Papers. 48 (10): 2233–2249. Bibcode:2001DSRI...48.2233B. doi:10.1016/S0967-0637(01)00017-6.
- ^ Lonsdale, P. (1979). "A deep-sea hydrothermal site on a strike-slip fault". Doğa. 281 (5732): 531–534. Bibcode:1979Natur.281..531L. doi:10.1038/281531a0.
- ^ Paull, C. K.; W. R. Normark; W. Ussler III; D. W. Caress & R. Keaten (2008). "Association among active seafloor deformation, mound formation, and gas hydrate growth and accumulation within the seafloor of the Santa Monica Basin, offshore California". Marine Geology. 250 (3–4): 258–275. Bibcode:2008MGeol.250..258P. doi:10.1016/j.margeo.2008.01.011.
- ^ a b Maloney, J.M.; Grupe, B.M.; Pasulka, A.L.; Dawson, K.S.; Case, D.H.; Frieder, C.A.; Levin, L.A.; Driscoll, N.W. (2015). "Transpressional segment boundaries in strike-slip fault systems offshore southern California: Implications for fluid expulsion and cold-seep habitats" (PDF). Jeofizik Araştırma Mektupları. 42 (10): 4080–4088. Bibcode:2015GeoRL..42.4080M. doi:10.1002/2015GL063778.
- ^ a b c d Griffiths, H. J. (2010). "Antarctic Marine Biodiversity – What Do We Know About the Distribution of Life in the Southern Ocean?". PLoS ONE. 5 (8): e11683. Bibcode:2010PLoSO...511683G. doi:10.1371/journal.pone.0011683. PMC 2914006. PMID 20689841.
- ^ Kaim, A.; Jenkins, R.; Warén, A. (2008). "Provannid and provannid-like gastropods from the Late Cretaceous cold seeps of Hokkaido (Japan) and the fossil record of the Provannidae (Gastropoda: Abyssochrysoidea)". Linnean Society'nin Zooloji Dergisi. 154 (3): 421–436. doi:10.1111/j.1096-3642.2008.00431.x.
- ^ Conti, S.; Fioroni, C.; Fontana, D. (2017). "Correlating shelf carbonate evolutive phases with fluid eexpulsion episodes in the foredeep Miocene, northern Apennines, Italy". Marine and Petroleum Geology. 79: 351–359. doi:10.1016/j.marpetgeo.2016.11.003. hdl:11380/1119044.
- ^ Galil, B.S.; Golik, A.; Turkay, M. (1995). "Litter at the bottom of the sea: A sea bed survey in the Eastern Mediterranean". Deniz Kirliliği Bülteni. 30 (1): 22–24. doi:10.1016/0025-326x(94)00103-g.
- ^ Galgani, F.; Jaunet, S.; Campillo, A.; Guenegan, X.; His, E. (1995). "Distribution and abundance of debris on the continental shelf of the northwestern Mediterranean Sea". Deniz Kirliliği Bülteni. 30 (11): 713–717. doi:10.1016/0025-326x(95)00055-r.
- ^ Richter, T.O.; de Stigter, H.C.; Boer, W.; Jesus, C.C.; van Weering, T.C.E. (2009). "Dispersal of natural and anthropogenic lead through submarine canyons in the Portuguese margin". Deep-Sea Research Part I. 56 (2): 267–282. Bibcode:2009DSRI...56..267R. doi:10.1016/j.dsr.2008.09.006.
- ^ Rotllant, G.; Holgado, A.E.; Sarda, F.; Abalos, M.; Company, J.B. (2006). "Dioxin compounds in the deep-sea rose shrimp Aristeus antennatus (Risso, 1816) throughout the Mediterranean Sea". Deep-Sea Research Part I. 53 (12): 1895–1906. Bibcode:2006DSRI...53.1895R. doi:10.1016/j.dsr.2006.09.004.
- ^ Unger, MA; Harvey, E.; Vadas, GG; Vecchione, M. (2008). "Persistent pollutants in nine species of deep-sea cephalopods". Deniz Kirliliği Bülteni. 56 (8): 1486–1512. doi:10.1016/j.marpolbul.2008.04.018. PMID 18501382.
- ^ Smith, K.L.; Ruhl, H.A.; Bett, B.J.; Billet, D.S.M.; Lampitt, R.S. (2009). "Climate, carbon cycling, and deep ocean ecosystems". PNAS. 106 (46): 19211–19218. Bibcode:2009PNAS..10619211S. doi:10.1073/pnas.0908322106. PMC 2780780. PMID 19901326.
daha fazla okuma
- Bright, M.; Plum, C.; Riavitz, L. A.; Nikolov, N.; Martínez Arbizu, P.; Cordes, E. E.; Gollner, S. (2010). "Epizooic metazoan meiobenthos associated with tubeworm and mussel aggregations from cold seeps of the Northern Gulf of Mexico". Deep-Sea Research Part II: Topical Studies in Oceanography. 57 (21–23): 1982–1989. Bibcode:2010DSRII..57.1982B. doi:10.1016 / j.dsr2.2010.05.003. PMC 2995211. PMID 21264038.
- German, C. R .; Ramirez-Llodra, E .; Baker, M. C .; Tyler, P. A .; Satranç Bilimsel Yönlendirme Komitesi (2011). "On Yıl ve Ötesi Deniz Yaşamı Sayımı Sırasında Derin Su Kemosentetik Ekosistem Araştırması: Önerilen Derin Okyanus Yol Haritası". PLoS ONE. 6 (8): e23259. Bibcode:2011PLoSO ... 623259G. doi:10.1371 / journal.pone.0023259. PMC 3150416. PMID 21829722.
- Lloyd, K. G .; Albert, D. B .; Biddle, J. F .; Chanton, J. P .; Pizarro, O .; Teske, A. (2010). "Sedimanter Mikrobiyal Toplulukların Mekansal Yapısı ve Aktivitesi Beggiatoa spp. Meksika Körfezi'ndeki Mat Hidrokarbon Sızıntısı ". PLoS ONE. 5 (1): e8738. Bibcode:2010PLoSO ... 5.8738L. doi:10.1371 / journal.pone.0008738. PMC 2806916. PMID 20090951.
- Metaxas, A .; Kelly, N. E. (2010). "Derin Denizin Kemosentetik Ortamları Arasında Larva Arzı ve İşe Alımı Farklı Mıdır?". PLoS ONE. 5 (7): e11646. Bibcode:2010PLoSO ... 511646M. doi:10.1371 / journal.pone.0011646. PMC 2906503. PMID 20657831.
- Rodríguez, E .; Daly, M. (2010). "Derin Deniz ve Kemosentetik Deniz Anemonları Arasındaki Filogenetik İlişkiler: Actinoscyphiidae ve Actinostolidae (Actiniaria: Mesomyaria)". PLoS ONE. 5 (6): e10958. Bibcode:2010PLoSO ... 510958R. doi:10.1371 / journal.pone.0010958. PMC 2881040. PMID 20532040.
- Sibuet, M .; Olu, K. (1998). "Aktif ve pasif sınırlardaki derin deniz soğuk su topluluklarının biyocoğrafyası, biyolojik çeşitliliği ve akışkan bağımlılığı". Derin Deniz Araştırmaları Bölüm II: Oşinografide Topikal Çalışmalar. 45 (1–3): 517–567. Bibcode:1998DSRII..45..517S. doi:10.1016 / S0967-0645 (97) 00074-X.
- Vinn, O .; Hryniewicz, K; Little, C.T.S .; Nakrem, H.A. (2014). "Volgian-Ryazanyan'dan (en son Jura-en erken Kretase) şelf tortulları ve Svalbard'dan hidrokarbon sızıntılarından bir Boreal serpulid faunası". Geodiversitas. 36 (4): 527–540. doi:10.5252 / g2014n4a2. Alındı 9 Ocak 2014.
- Vinn, O .; Kupriyanova, E.K .; Kiel, S. (2013). "Kretase'deki Serpulidlerden (Annelida, Polychaeta) modern hidrokarbon sızıntılarına: Ekolojik ve evrimsel modeller". Paleocoğrafya, Paleoklimatoloji, Paleoekoloji. 390: 35–41. Bibcode:2013PPP ... 390 ... 35V. doi:10.1016 / j.palaeo.2012.08.003. Alındı 9 Ocak 2014.