Deniz besin ağı - Marine food web - Wikipedia

| Bir dizi genel bakışın parçası |
| Deniz yaşamı |
|---|
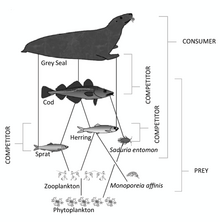
Karasal ortamlarla karşılaştırıldığında, deniz ortamları biyokütle piramitleri tabanda ters çevrilmiştir. Özellikle tüketicilerin biyokütlesi (kopepodlar, kriller, karidesler, yem balıkları) biyokütleden daha büyüktür. birincil üreticiler. Bunun nedeni, okyanusun birincil üreticilerinin küçük olması fitoplankton hızla büyüyen ve çoğalan, böylece küçük bir kütle hızlı bir birincil üretim. Buna karşılık, birçok önemli karasal birincil üretici, örneğin olgun ormanlar yavaş büyür ve çoğalır, bu nedenle aynı birincil üretim oranını elde etmek için çok daha büyük bir kütleye ihtiyaç vardır.
Bu ters çevirme nedeniyle, Zooplankton deniz hayvanlarının çoğunu oluşturan biyokütle. Gibi birincil tüketiciler zooplankton, birincil üreticiler (esas olarak fitoplankton) ile geri kalanı arasındaki önemli bağlantıdır. deniz besin ağı (ikincil tüketiciler ).[1]
Fitoplankton yenmeden önce ölürse, öfotik bölge bir parçası olarak deniz karı ve denizin derinliklerine yerleşir. Bu şekilde, fitoplankton her yıl okyanusa yaklaşık 2 milyar ton karbondioksit ayırır ve okyanusun, tutulan karbonun yaklaşık% 90'ını tutan bir karbondioksit yutağı haline gelmesine neden olur.[2] Okyanus, dünyadaki oksijenin yaklaşık yarısını üretir ve atmosferden 50 kat daha fazla karbondioksit depolar.[3]
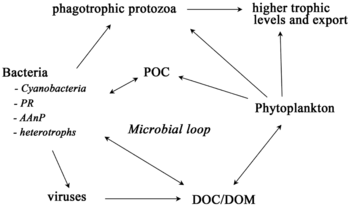
Bir ekosistem, besin ağının malzeme ve enerji akışını nasıl belirlediğini bilmeden anlaşılamaz. Fitoplankton, biyokütleyi ototrofik olarak dönüştürerek üretir. inorganik bileşikler içine organik olanlar. Bu şekilde fitoplankton, okyanustaki diğer tüm yaşamı destekleyerek deniz besin ağının temeli olarak işlev görür. Deniz besin ağındaki ikinci merkezi süreç, mikrobiyal döngü. Bu döngü bozulur deniz bakterileri ve Archaea, remineralize organik ve inorganik madde ve daha sonra ürünleri pelajik besin ağı içinde veya deniz tabanında tortu olarak biriktirerek geri dönüştürür.[4]
Besin zincirleri ve trofik seviyeler
| deniz besin zinciri (tipik) |
|---|
| ↓ |
| fitoplankton |
| ↓ |
| otçul Zooplankton |
| ↓ |
| etobur zooplankton |
| ↓ |
| ↓ |
Gıda ağları ... dan inşa edildi yemek zinciri. Denizdeki tüm yaşam biçimleri, başka bir yaşam biçimi için besin olma potansiyeline sahiptir. Okyanusta, bir besin zinciri tipik olarak güneş enerjisinden gelen enerjiyle başlar. fitoplankton ve aşağıdaki gibi bir yol izler:
fitoplankton → otçul zooplankton → etçil zooplankton → filtre besleyici → yırtıcı omurgalı
Fitoplankton yiyecek için başka organizmalara ihtiyaç duymazlar çünkü enerji kaynağı olarak güneş ışığını kullanarak kendi yiyeceklerini doğrudan inorganik karbondan üretme kabiliyetine sahiptirler. Bu sürece denir fotosentez ve fitoplanktonun doğal olarak oluşan karbonu protoplazma. Bu nedenle fitoplanktonun birincil üreticiler deniz besin zincirinin dibinde veya birinci seviyesinde. Birinci seviyede olduklarından, bir tropik seviye / 1 (itibaren Yunan kupa yemek anlamına gelir). Fitoplankton daha sonra besin zincirindeki bir sonraki trofik seviyede zooplankton adı verilen mikroskobik hayvanlar tarafından tüketilir.
Zooplankton besin zincirindeki ikinci trofik seviyeyi oluşturur ve mikroskobik tek hücreli organizmaları içerir. protozoa hem de küçük kabuklular, gibi kopepodlar ve kril, ve larva balık, kalamar, ıstakoz ve yengeç. Bu seviyedeki organizmalar şu şekilde düşünülebilir: birincil tüketiciler.
Buna karşılık, daha küçük otçul zooplanktonlar, daha büyük yırtıcı protozoa gibi daha büyük etobur zooplanktonlar tarafından tüketilir. kril ve tarafından yem balığı, küçük olan eğitim, filtre besleme balık. Bu, besin zincirindeki üçüncü trofik seviyeyi oluşturur.
Dördüncü trofik seviye şunlardan oluşur: yırtıcı balık, Deniz memelileri ve Deniz kuşları yem balıklarını tüketen. Örnekler Kılıçbalığı, mühürler ve gannets.
Apeks yırtıcıları, örneğin orcas, mühürleri tüketebilen ve shortfin mako köpekbalıkları Kılıçbalığı tüketebilen, beşinci bir trofik seviyeyi oluşturur. Balina balinaları doğrudan zooplankton ve kril tüketebilir, bu da sadece üç veya dört trofik seviyeli bir besin zincirine yol açar.
Uygulamada, trofik seviyeler genellikle basit tamsayılar değil çünkü aynı tüketici türü genellikle birden fazla trofik seviyede beslenir.[8][9] Örneğin büyük deniz omurgalı daha küçük yırtıcı balıkları yiyebilir ancak filtre besleyicileri de yiyebilir; vatoz yiyor kabuklular, ama çekiç başlı hem kabukluları hem de vatozları yer. Hayvanlar da birbirlerini yiyebilirler; Morina küçük morina balığı yanı sıra kerevit ve kerevitler morina larvalarını yer. Yavru bir hayvanın beslenme alışkanlıkları ve bunun sonucunda trofik seviyesi büyüdükçe değişebilir.
Balıkçılık bilim adamı Daniel Pauly trofik seviyelerin değerlerini birincil üreticilerde bire ayarlar ve döküntü, ikisi otçullarda ve detritivorlarda (birincil tüketiciler), üçü ikincil tüketicilerde vb. Herhangi bir tüketici türü için trofik seviyenin (TL) tanımı şöyledir:[10]
nerede avın fraksiyonel trofik seviyesi j, ve kesirini temsil eder j diyetinde ben. Deniz ekosistemleri söz konusu olduğunda, çoğu balığın ve diğer deniz tüketicilerinin trofik seviyesi 2.0 ile 5.0 arasında değer alır. Üst değer olan 5.0, büyük balıklar için bile olağandışıdır.[11] ancak kutup ayıları ve katil balinalar gibi deniz memelilerinin tepe yırtıcılarında meydana gelir.[12] Bunun aksine, insanların ortalama trofik seviyesi yaklaşık 2.21'dir, bu da bir domuz veya hamsiyle yaklaşık aynıdır.[13][14]
Taksona göre
Birincil üreticiler
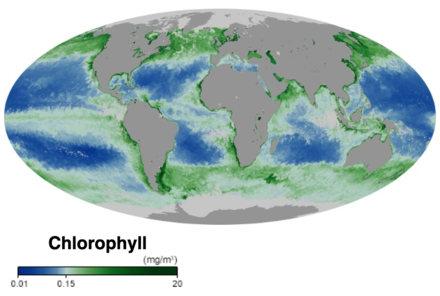
Okyanus besin ağının dibinde, tek hücreli algler ve diğer bitki benzeri organizmalar bulunur. fitoplankton. Karadaki bitkiler gibi fitoplankton kullanımı klorofil ve diğeri hafif hasat pigmentleri yürütmek fotosentez, yakıt için şeker üretmek için atmosferik karbondioksiti emer. Sudaki klorofil, suyun güneş ışığını yansıtma ve absorbe etme şeklini değiştirerek bilim adamlarının fitoplankton miktarını ve konumunu haritalamasına izin verir. Bu ölçümler, bilim insanlarına okyanus ortamının sağlığı hakkında değerli bilgiler verir ve bilim adamlarının okyanus karbon döngüsü.[15]
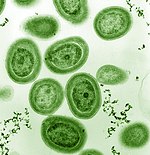
Fitoplanktonlar arasında, adı verilen bir bakteri filumunun üyeleri vardır. siyanobakteriler. Deniz siyanobakterileri, bilinen en küçük fotosentetik organizmaları içerir. Hepsinin en küçüğü, Proklorokok, sadece 0,5 ila 0,8 mikrometredir.[16] Bireysel sayılar açısından, Proklorokok Muhtemelen dünyadaki en bol türdür: tek bir mililitre yüzey deniz suyu 100.000 hücre veya daha fazlasını içerebilir. Dünya çapında birkaç tane olduğu tahmin ediliyor sekiz milyon (1027) bireyler.[17] Proklorokok 40 ° N ile 40 ° G arasında her yerde bulunur ve oligotrofik okyanusların (besin açısından fakir) bölgeleri.[18] Bakteri, Dünya atmosferindeki oksijenin yaklaşık% 20'sini oluşturur.[19]
- Fitoplankton, okyanus besin zincirinin temelini oluşturur

Fitoplankton

Dinoflagellat

Diyatomlar
Okyanuslarda çoğu birincil üretim tarafından gerçekleştirilir yosun. Bu, birincil üretimin çoğu tarafından gerçekleştirildiği arazideki ile bir tezat oluşturuyor. damarlı Bitkiler. Algler, tek yüzen hücrelerden bağlı hücrelere kadar değişir yosunlar vasküler bitkiler okyanusta şu gruplarla temsil edilirken Deniz çayırları ve mangrovlar. Deniz çayırı gibi daha büyük üreticiler ve yosunlar, çoğunlukla şununla sınırlıdır: kıyı bölge ve sığ sular eklemek alttaki alt tabakaya ve hala fotik bölge. Ancak alglerin birincil üretiminin çoğu fitoplankton tarafından gerçekleştirilir.
Bu nedenle, okyanus ortamlarında, ilk alt trofik seviye esas olarak fitoplankton, mikroskobik sürüklenen organizmalar, çoğunlukla tek hücreli yosun, denizde yüzen. Fitoplanktonların çoğu, tek tek görülemeyecek kadar küçüktür. yardımsız göz. Yeterince yüksek sayılarda bulunduklarında, suyun (genellikle yeşil) renk değişimi olarak görünebilirler. Biyokütlelerini çoğunlukla fotosentez yoluyla arttırdıkları için güneşin aydınlattığı yüzey tabakasında (öfotik bölge ) denizin.
En önemli fitoplankton grupları şunları içerir: diyatomlar ve Dinoflagellatlar. Diatomlar, bazı tahminlere göre toplam okyanusun birincil üretiminin% 45'ine kadar katkıda bulundukları okyanuslarda özellikle önemlidir.[20] Diatomlar genellikle mikroskobik bazı türlerin uzunluğu 2 milimetreye kadar ulaşabilse de.
Birincil tüketiciler
İkinci trofik seviye (birincil tüketiciler ) tarafından işgal edildi Zooplankton hangi beslenir fitoplankton. Fitoplankton ile birlikte, dünyanın en büyük balıkçılık alanlarının çoğunu destekleyen besin piramidinin temelini oluştururlar. Zooplankton, fitoplanktonla birlikte bulunan küçük hayvanlardır. okyanus yüzey suları ve küçücük kabuklular ve balık larvaları ve kızartmak (son zamanlarda yumurtadan çıkmış balık). Çoğu zooplankton Filtre besleyicileri ve sudaki fitoplanktonu zorlamak için ekler kullanırlar. Bazı büyük zooplanktonlar ayrıca daha küçük zooplanktonlarla beslenir. Bazı zooplanktonlar, avcılardan kaçınmak için biraz zıplayabilir, ancak gerçekten yüzemezler. Fitoplanktonlar gibi, bunun yerine akıntılar, gelgitler ve rüzgarlarla birlikte yüzerler. Zooplanktonlar hızla çoğalabilir, uygun koşullar altında popülasyonları günde yüzde otuza kadar artabilir. Birçoğu kısa ve üretken hayatlar yaşar ve hızla olgunluğa ulaşır.
- Zooplankton, okyanus besin zincirinde ikinci bir seviye oluşturur

Bölümlenmiş solucan

Küçük karides benzeri kabuklular
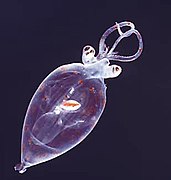
Juvenil planktonik kalamar
Özellikle önemli zooplankton grupları, kopepodlar ve kril. Kopepodlar küçük bir grup kabuklular okyanusta bulundu ve temiz su habitatlar. Denizdeki en büyük protein kaynağıdır.[21] yem balıkları için önemli bir avdır. Krill bir sonraki en büyük protein kaynağını oluşturur. Krill, daha küçük zooplanktonlarla beslenen özellikle büyük yırtıcı hayvan zooplanktonudur. Bu, yem balıklarıyla birlikte gerçekten üçüncü trofik seviyeye, ikincil tüketicilere ait oldukları anlamına gelir.

Birlikte, fitoplankton ve Zooplankton çoğunu yapmak plankton denizde. Plankton, herhangi bir küçük sürüklenmeye uygulanan terimdir. organizmalar denizde yüzen (Yunan planktos = gezgin veya serseri). Tanım gereği, plankton olarak sınıflandırılan organizmalar okyanus akıntılarına karşı yüzemezler; ortam akımına direnemez ve konumlarını kontrol edemezler. Okyanus ortamlarında, ilk iki trofik seviye esas olarak plankton. Plankton, üreticiler ve tüketiciler olarak ikiye ayrılır. Üreticiler fitoplanktonlardır (Yunanca Phyton = bitki) ve fitoplanktonu yiyen tüketiciler zooplanktonlardır (Yunanca Zoon = hayvan).
Deniz anası yavaş yüzücülerdir ve çoğu tür planktonun bir parçasını oluşturur. Geleneksel olarak denizanası, trofik çıkmazlar, deniz besin ağındaki küçük oyuncular, jelatinimsi organizmalar olarak görülmüştür. vücut planı büyük ölçüde, diğer organizmalar için az besin değeri veya ilgi sunan suya dayanır. okyanus güneş balığı ve deri sırtlı deniz kaplumbağası.[23][22] Bu görüş yakın zamanda sorgulanmıştır. Denizanası ve daha genel olarak jelatinimsi zooplankton içeren Salps ve ktenoforlar, çok çeşitli, sert parçaları olmayan kırılgan, görülmesi ve izlenmesi zor, hızlı nüfus dalgalanmalarına maruz kalıyor ve genellikle kıyıdan uzakta veya okyanusun derinliklerinde elverişsiz bir şekilde yaşıyorlar. Bilim adamlarının yırtıcı hayvanların bağırsaklarındaki denizanasını tespit etmesi ve analiz etmesi zordur, çünkü yenildiklerinde pelteye dönüşürler ve hızla sindirilirler.[23] Ancak denizanası çok sayıda çiçek açar ve diyetlerinde ana bileşenleri oluşturdukları gösterilmiştir. Tuna, spearfish ve Kılıçbalığı yanı sıra çeşitli kuşlar ve omurgasızlar gibi ahtapot, deniz hıyarı, Yengeçler ve amfipodlar.[24][22] "Düşük enerji yoğunluklarına rağmen, denizanasının avcıların enerji bütçelerine katkısı, hızlı sindirim, düşük yakalama maliyetleri, bulunabilirlik ve enerji açısından daha zengin bileşenlerin seçici beslenmesi nedeniyle tahmin edilenden çok daha fazla olabilir. Denizanasıyla beslenme plastik yutulmaya duyarlı deniz avcıları. "[22]
Daha yüksek sipariş tüketicileri

- Deniz omurgasızları
- Balık
- Yem balığı: Yem balıkları okyanusta merkezi konumlarda bulunur besin ağları. Yediği organizmalar daha düşük tropik seviye ve onu yiyen organizmalar daha yüksek bir trofik seviyededir. Yem balıkları, besin ağında orta seviyelerde bulunur ve daha yüksek seviyedeki balıklara, deniz kuşlarına ve memelilere baskın bir av olarak hizmet eder.[25]
- Yırtıcı balık
- Öğütülmüş balık
- Diğer deniz omurgalıları
2010'da araştırmacılar, balinaların okyanusun derinliklerindeki besin maddelerini, adı verilen bir işlemle yüzeye geri taşıdığını keşfetti. balina pompası.[26] Balinalar okyanusta daha derin seviyelerde beslenirler. kril bulunur, ancak nefes almak için düzenli olarak yüzeye dönün. Balinalar var bir sıvıyı dışkılamak nitrojen ve demir açısından zengindir. Sıvı batmak yerine yüzeyde kalır. fitoplankton tüketin. Maine Körfezi'nde balina pompası nehirlerden daha fazla nitrojen sağlar.[27]

Kambur balinalar aşağıdan hamle yem balıklarıyla beslenmek

Gannets dalma dalışı yem balıklarını yakalamak için yukarıdan
 Balina pompası besin döngüsü
Balina pompası besin döngüsü
Mikroorganizmalar

Son yıllarda artan bir kabul görmektedir. deniz mikroorganizmaları deniz ekosistemlerinde daha önce düşünüldüğünden çok daha büyük roller oynarlar. Gelişmeler metagenomik araştırmacılara, mikroskobik yaşamın daha önce gizli kalmış çeşitlerini ortaya çıkarma yeteneği verir, mikrobiyal dünyayı görüntülemek için güçlü bir mercek ve yaşayan dünya anlayışında devrim yaratma potansiyeli sunar.[29] Metabarkod diyet analizi Daha yüksek taksonomik çözünürlük seviyelerinde besin ağlarını yeniden inşa etmek için teknikler kullanılıyor ve etkileşimler ağında daha derin karmaşıklıkları ortaya çıkarıyor.[30]
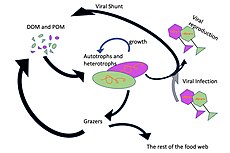
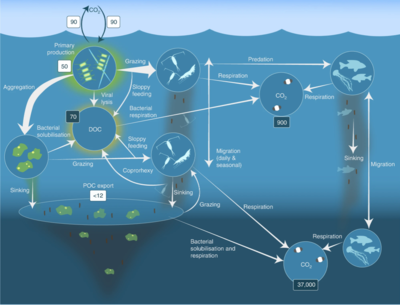
Mikroorganizmalar deniz besin ağlarında anahtar roller oynar. viral şant yol, deniz mikrobiyalini önleyen bir mekanizmadır. partikül organik madde (POM) yukarı geçişten trofik seviyeler onları geri dönüştürerek çözünmüş organik madde (DOM), mikroorganizmalar tarafından kolaylıkla alınabilir.[31] Viral şant, tek bir deniz mikrop türünün mikro çevreye hakim olmasını engelleyerek mikrobiyal ekosistem içindeki çeşitliliğin korunmasına yardımcı olur.[32] Viral şant yolu tarafından geri dönüştürülen DOM, diğer ana deniz DOM kaynakları tarafından üretilen miktarla karşılaştırılabilir.[33]
Genel olarak, çözünmüş organik karbon (DOC), okyanus ortamına bakteri lizizinden, sabit karbonun fitoplanktondan sızması veya eksüdasyonundan (örneğin, müsilajinöz ekzopolimer) diyatomlar ), ani hücre yaşlanması, zooplankton tarafından özensiz beslenme, atık ürünlerin suda yaşayan hayvanlar tarafından atılması veya organik parçacıkların karasal bitkilerden ve topraklardan parçalanması veya çözünmesi.[34] Bakteriler mikrobiyal döngü Büyüme için bu enerji açısından zengin maddeyi kullanmak için bu parçacık parçacıkları ayrıştırın. Deniz ekosistemlerindeki organik maddenin% 95'inden fazlası polimerik, yüksek moleküler ağırlık (HMW) bileşikleri (örneğin, protein, polisakkaritler, lipidler), toplamın sadece küçük bir kısmı çözünmüş organik madde (DOM), çoğu deniz organizması tarafından daha yüksek trofik seviyelerde kolaylıkla kullanılabilir. Bu, çözünmüş organik karbonun çoğu deniz organizması tarafından doğrudan elde edilemediği anlamına gelir; Deniz bakterileri bu organik karbonu besin ağına sokar ve bu da ek enerjinin daha yüksek trofik seviyelere ulaşmasına neden olur.
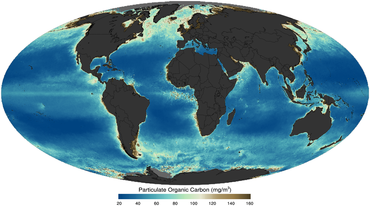
gibi bir uydu tarafından görüntülendi 2011 yılında

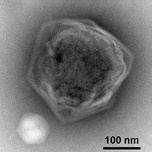
Dev bir deniz virüsü CroV enfekte eder ve ölüme neden olur liziz deniz zooflagellate Kafeterya roenbergensis.[38] Bu kıyı ekolojisini etkiler çünkü Kafeterya roenbergensis suda bulunan bakterilerle beslenir. Düşük sayılar olduğunda Kafeterya roenbergensis yaygın CroV enfeksiyonları nedeniyle, bakteri popülasyonları katlanarak artar.[39] Etkisi CroV doğal popülasyonları hakkında C. roenbergensis bilinmeyen kalır; bununla birlikte, virüsün çok konağa özgü olduğu ve diğer yakın ilişkili organizmaları enfekte etmediği bulunmuştur.[40] Kafeterya roenbergensis de ikinci bir virüsle enfekte olmuştur. Mavirüs virofajı, hangisi bir uydu virüsü yani yalnızca başka bir spesifik virüs varlığında, bu durumda CroV varlığında çoğalabilir.[41] Bu virüs, CroV replikasyonuna müdahale eder ve bu da C. roenbergensis hücreler. Mavirüs hücrelerin genomuna entegre olabilir C. roenbergensisve böylelikle nüfusa bağışıklık kazandırır.[42]
Mantarlar

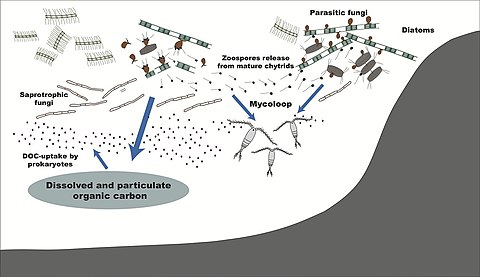
Habitat tarafından
Pelajik ağlar
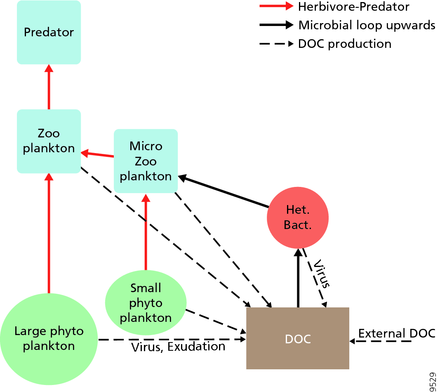
Pelajik ekosistemler için, Legendre ve Rassoulzadagan, 1995 yılında, otçul besin zinciri ile trofik yolların sürekliliğini önermiş ve mikrobiyal döngü yemek ağı uç üyeleri olarak.[47] Klasik doğrusal besin zinciri uç üyesi, daha büyük fitoplankton üzerinde zooplankton tarafından otlatmayı ve daha sonra zooplanktonda daha büyük zooplankton veya başka bir avcı tarafından avlanmayı içerir. Böyle doğrusal bir besin zincirinde, bir avcı ya yüksek fitoplanktonlara yol açabilir. biyokütle (fitoplankton, otobur ve avcı içeren bir sistemde) veya düşük fitoplankton biyokütlesi (dört seviyeli bir sistemde). Yırtıcı hayvanların bolluğundaki değişiklikler bu nedenle trofik kademeler.[48] Mikrobiyal döngü uç üyesi, bazal kaynak olarak sadece fitoplanktonu değil, aynı zamanda çözünmüş organik karbon.[49] Çözünmüş organik karbon, heterotrofik bakteriler tarafından büyüme için kullanılır ve daha büyük zooplanktonlar tarafından önceden belirlenir. Sonuç olarak, çözünmüş organik karbon, bir bakteriyel-mikrozooplankton döngüsü yoluyla zooplanktona dönüştürülür. Bu iki son üye karbon işleme yolu, birden çok seviyede birbirine bağlıdır. Küçük fitoplankton, doğrudan mikrozooplankton tarafından tüketilebilir.[46]
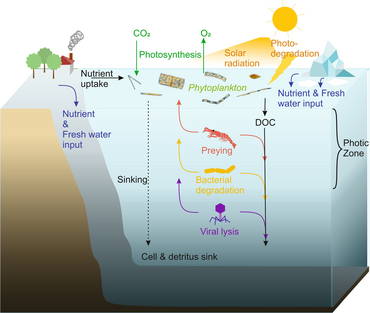
Sağdaki şemada gösterildiği gibi, çözünmüş organik karbon, hem organik karbonun birincil üreticileri hem de tüketicileri tarafından çeşitli yollarla ve çeşitli organizmalar tarafından üretilir. Birincil üreticiler tarafından DOC salınımı, sızıntı ile pasif olarak ve besin sınırlaması sırasında dengesiz büyüme sırasında aktif olarak gerçekleşir.[50][51] Fitoplanktondan çözünmüş organik havuza giden başka bir doğrudan yol, viral liziz.[52] Deniz virüsleri okyanusta, özellikle daha sıcak, düşük enlem sularında fitoplankton ölümlerinin başlıca nedenidir. Özensiz beslenme otçullar tarafından ve avın tüketiciler tarafından eksik sindirilmesi, diğer çözünmüş organik karbon kaynaklarıdır. Heterotrofik mikroplar, çözündürmek için hücre dışı enzimler kullanır partikül organik karbon ve bunu ve diğer çözünmüş organik karbon kaynaklarını büyüme ve bakım için kullanın. Mikrobiyal heterotrofik üretimin bir kısmı mikrozooplankton tarafından kullanılır; heterotrofik topluluğun başka bir kısmı yoğun viral parçalanmaya maruz kalır ve bu da çözünmüş organik karbonun yeniden salınmasına neden olur. Mikrobiyal döngünün etkinliği birçok faktöre bağlıdır, ancak özellikle avlanma ve viral parçalanmanın heterotrofik mikropların ölümlülüğüne göreceli önemine bağlıdır.[46]
- Pelajik besin ağı

Pelajik besin ağı ve biyolojik pompa. Okyanusun biyolojik pompası ve pelajik besin ağı arasındaki bağlantılar ve bu bileşenleri gemilerden, uydulardan ve otonom araçlardan uzaktan örnekleme yeteneği. Açık mavi sular öfotik bölge koyu mavi sular ise Alacakaranlık Bölgesi.[53]
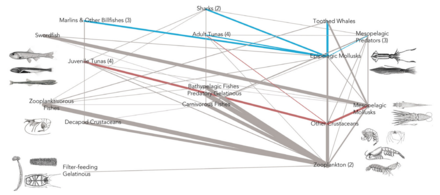
- Mezopelajik besin ağı

Mezopelajik türlerin küresel karbon bütçesi üzerindeki etkisi[54]
DVM = diel dikey göç NM = göç etmeme

Jelatinimsi yırtıcılar böyle Narkomedusan Mezopelajik avın en büyük çeşitliliğini tüketmek
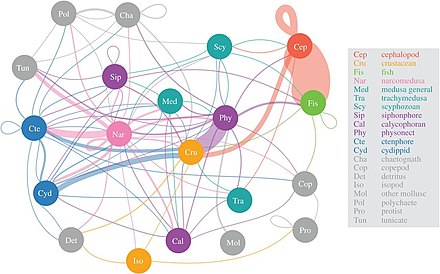
Bilim adamları, büyük ölçüde bilinmeyen alacakaranlık kuşağını daha ayrıntılı olarak keşfetmeye başlıyorlar. mezopelajik, 200 ila 1.000 metre derinliğinde. Bu katman, her yıl atmosferden yaklaşık 4 milyar ton karbondioksitin uzaklaştırılmasından sorumludur. Mezopelajik katman deniz balıklarının çoğunda yaşar. biyokütle.[55]
2017 araştırmasına göre, Narcomedusae mezopelajik avın en büyük çeşitliliğini tüketin, ardından physonect sifonoforlar, ktenoforlar ve kafadanbacaklılar. Sözde "jöle ağı" nın önemi daha yeni anlaşılmaya başlanmıştır, ancak medusa, ktenoforlar ve sifonoforlar, yırtıcı balıklara ve kalamara benzer ekolojik etkilere sahip derin pelajik besin ağlarında kilit avcılar olabilir. Geleneksel olarak jelatinimsi avcıların deniz trofik yollarının etkisiz sağlayıcıları olduğu düşünülüyordu, ancak derin pelajik besin ağlarında önemli ve bütünleyici rollere sahip oldukları görülüyor.[56] Diel dikey göç önemli bir aktif taşıma mekanizması, mezozooplankton karbondioksiti atmosferden ayırmak ve diğer mezopelajik organizmalar için karbon ihtiyaçlarını karşılamak.[57]
2020'de yapılan bir araştırma, 2050 yılına kadar küresel ısınmanın derin okyanusta şu anda olduğundan yedi kat daha hızlı yayılabileceğini bildirdi, sera gazı emisyonları kesilse bile. Isınma mezopelajik ve daha derin katmanların derin okyanus besin ağı için önemli sonuçları olabilir, çünkü okyanus türlerinin hayatta kalma sıcaklıklarında kalmak için hareket etmesi gerekecek.[58][59]
- Alacakaranlıktaki balık, okyanus ekosistemine yeni bir ışık tuttu Konuşma, 10 Şubat 2014.
- Trilyonlarda Bir Okyanus Gizemi New York Times, 29 Haziran 2015.
- Mezopelajik balıklar - Malaspina devrialem seferi 2010.[60][61]
Okyanus yüzeyinde
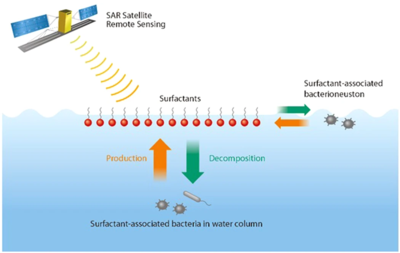
Okyanus yüzeyi habitatları, okyanus ile atmosfer arasındaki arayüzde bulunur. biyofilm benzeri Okyanus yüzeyindeki habitat, yüzeyde yaşayan mikroorganizmaları barındırır. Neuston. Bu geniş hava-su arayüzü, küresel yüzey alanının% 70'inden fazlasını kapsayan büyük hava-su değişim süreçlerinin kesişme noktasında bulunur. Okyanusun yüzey mikro tabakasındaki bakterilere denir. Bacterioneustonsera gazlarının hava-deniz gazı değişimi, iklim açısından aktif deniz aerosollerinin üretimi ve okyanusun uzaktan algılanması gibi pratik uygulamalar nedeniyle ilgi çekicidir.[63] Özellikle ilgi çekici olan, üretim ve bozulmadır. yüzey aktif maddeler (yüzey aktif maddeler) mikrobiyal biyokimyasal süreçler yoluyla. Açık okyanustaki başlıca yüzey aktif madde kaynakları arasında fitoplankton,[64] karasal akış ve atmosferden birikme.[63]
Renkli alg çiçeklerinden farklı olarak, yüzey aktif cismi ile ilişkili bakteriler okyanus rengi görüntülerinde görünmeyebilir. Bu "görünmez" sürfaktanla ilişkili bakterileri kullanarak tespit etme yeteneğine sahip olmak sentetik açıklık radarı bulut, sis veya gün ışığından bağımsız olarak tüm hava koşullarında muazzam faydalara sahiptir.[63] Bu özellikle çok yüksek rüzgarlarda önemlidir, çünkü bunlar en yoğun hava-deniz gaz değişimlerinin ve deniz aerosol üretiminin gerçekleştiği koşullardır. Bu nedenle, renkli uydu görüntülerine ek olarak, SAR uydu görüntüleri, okyanus ve atmosfer arasındaki sınırda biyofiziksel süreçlerin küresel bir resmine, hava-deniz sera gazı değişimlerine ve iklim-aktif deniz aerosollerinin üretimine ilişkin ek bilgiler sağlayabilir.[63]
Okyanus tabanında
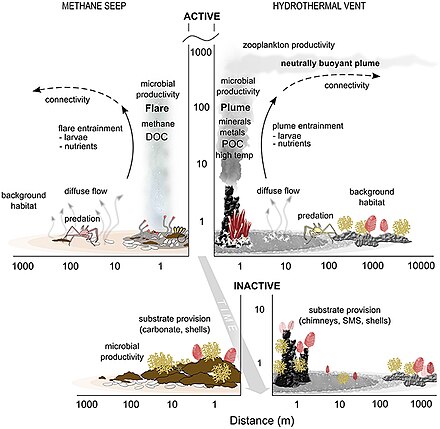
Okyanus tabanı (Bentik ) habitatlar, okyanus ile dünyanın içi arasındaki arayüzde bulunur.
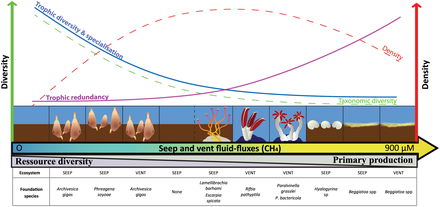
- Sızar ve havalandırma delikleri
Kıyı ağları

Kıyı suları, haliçler ve bitti kıta rafları. Toplam okyanus alanının yaklaşık yüzde 8'ini kaplarlar[70] ve tüm okyanus verimliliğinin yaklaşık yarısını oluşturur.
Belirleyen temel besinler ötrofikasyon kıyı sularında azot ve göllerde fosfordur. Her ikisi de yüksek konsantrasyonlarda bulunur guano (deniz kuşu dışkısı), çevredeki okyanus veya bitişik bir göl için gübre görevi görür. Ürik asit baskın nitrojen bileşiğidir ve mineralizasyonu sırasında farklı nitrojen formları üretilir. Sağdaki diyagramda: (1) amonifikasyon NH3 ve NH4 + üretir ve (2) nitrifikasyon, NH4 + oksidasyonu yoluyla NO3− üretir. Deniz kuşu dışkısının tipik özelliği olan alkali koşullar altında, NH3 hızla uçurulur (3) ve koloniden taşınan NH4 + 'e dönüştürülür ve ıslak biriktirme yoluyla ötrofize edilmiş uzak ekosistemlere ihraç edilir (4). Fosfor döngüsü daha basittir ve hareket kabiliyeti azalmıştır. Bu element, deniz kuşlarının dışkı materyalinde bir dizi kimyasal formda bulunur, ancak en hareketli ve biyolojik olarak kullanılabilir olanı ortofosfat, hangisi olabilir süzülmüş yeraltı veya yüzeysel sularla (5).[69]

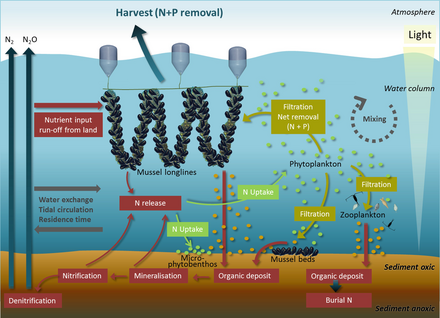
kıta sahanlığında
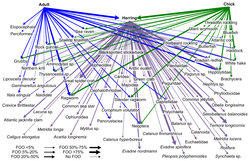
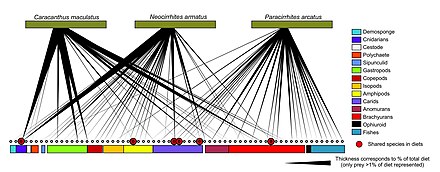
DNA barkodlama web düğümlerinde daha iyi taksonomik çözünürlüğe sahip gıda ağı yapıları oluşturmak için kullanılabilir. Bu, daha spesifik tür tanımlaması ve tam olarak kimin kimi yediğine dair daha fazla netlik sağlar. "DNA barkodları ve DNA bilgileri, daha büyük etkileşim ağlarının inşasına yeni yaklaşımlara izin verebilir ve yeterli örnek boyutuna ulaşmanın önündeki bazı engellerin üstesinden gelebilir".[30]
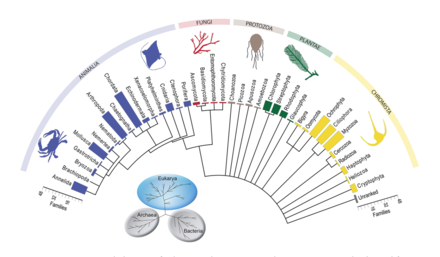
Tür tanımlama için yeni uygulanan bir yöntem, DNA metabarkodlamadır. Tür tanımlama morfoloji nispeten zordur ve çok zaman ve uzmanlık gerektirir.[79][80] Yüksek verimli sıralama DNA metabarkodlama, taksonomik atamayı ve dolayısıyla gruba özgü gruba ilişkin tam örnek için tanımlamayı sağlar primerler önceki DNA için seçilmiş amplifikasyon.

- Mikrobiyal DNA barkodlama
- Yosun DNA barkodlaması
- Balık DNA barkodlama
- Diyet değerlendirmesinde DNA barkodlaması
- Kelp ormanları
- Byrnes, J.E., Reynolds, P.L. ve Stachowicz, J.J. (2007) "İstilalar ve yok oluşlar kıyıdaki deniz besin ağlarını yeniden şekillendiriyor". PLOS ONE, 2(3): e295. doi:10.1371 / journal.pone.0000295
Kutup ağları
okyanuslarla çevrili
kara kütleleri ile çevrili
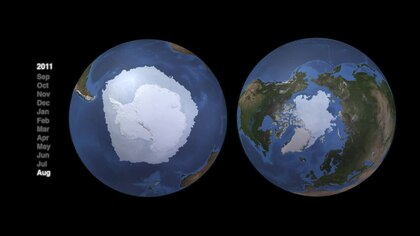
Arktik ve Antarktik deniz sistemleri çok farklı topografik yapılar ve sonuç olarak çok farklı besin ağı yapılarına sahiptir.[82] Hem Arktik hem de Antarktik pelajik besin ağları, büyük ölçüde birkaç anahtar tür tarafından kontrol edilen karakteristik enerji akışlarına sahiptir. Ancak ikisi için de tek bir genel ağ yok. Esneklik ve enerji akışlarını sürdürmek için alternatif yollar önemlidir. Bununla birlikte, bu daha karmaşık alternatifler, üst trofik seviyedeki türlere daha az enerji akışı sağlar. "Besin ağı yapısı farklı bölgelerde benzer olabilir, ancak orta trofik seviyelere hakim olan bireysel türler, kutup bölgelerine göre değişiklik gösterir".[83]



- Arktik
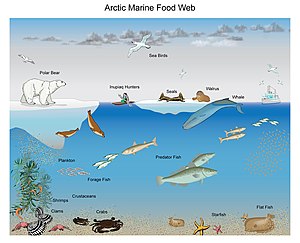
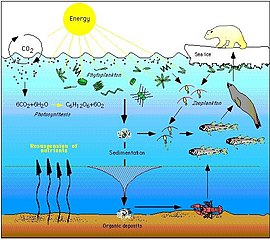
The Arctic food web is complex. The loss of sea ice can ultimately affect the entire food web, from algae and plankton to fish to mammals. The impact of climate change on a particular species can ripple through a food web and affect a wide range of other organisms... Not only is the decline of sea ice impairing polar bear populations by reducing the extent of their primary habitat, it is also negatively impacting them via food web effects. Declines in the duration and extent of sea ice in the Arctic leads to declines in the abundance of ice algae, which thrive in nutrient-rich pockets in the ice. These algae are eaten by zooplankton, which are in turn eaten by Arctic cod, an important food source for many marine mammals, including seals. Seals are eaten by polar bears. Hence, declines in ice algae can contribute to declines in polar bear populations.[84]
In 2020 researchers reported that measurements over the last two decades on primary production içinde Kuzey Buz Denizi show an increase of nearly 60% due to higher concentrations of fitoplankton. They hypothesize that new nutrients are flowing in from other oceans and suggest this means the Arctic ocean may be able to support higher trophic level production ve ek carbon fixation gelecekte.[85][86]


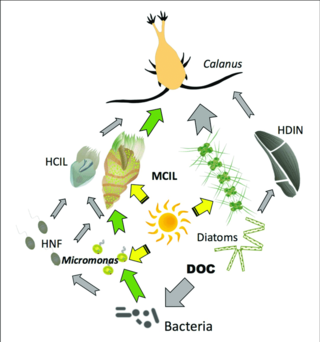
Gray arrows: flow of carbon to heterotrophs
Green arrows: major pathways of carbon flow to or from mixotrophs
HCIL: heterotrofik ciliates; MCIL: mixotrophic ciliates; HNF: heterotrophic nanoflagellates; DOC: dissolved organic carbon; HDIN: heterotrophic dinoflagellates[87]

- Antarktika

Antarctic jellyfish Diplulmaris antarctica under the ice
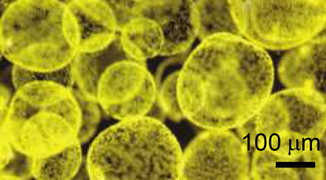
Colonies of the alga Phaeocystis antarctica, an important phytoplankter of the Ross Sea that dominates early season blooms after the sea ice retreats and exports significant carbon.[89]

pennate diyatom Fragilariopsis kerguelensis, found throughout the Antarctic Circumpolar Current, is a key driver of the global silicate pump.[90]

Bir grup Katil balinalar attempt to dislodge a crabeater seal bir buz parçası
and carbon masses (Gt C) in dark boxes

Foundation and keystone species


Foundation species are species that have a dominant role structuring an ekolojik topluluk, shaping its environment and defining its ecosystem. Such ecosystems are often named after the foundation species, such as seagrass meadows, oyster beds, coral reefs, kelp forests and mangrove forests.[97] Örneğin, red mangrove is a common foundation species in mangrove forests. The mangrove’s root provides nursery grounds for young fish, such as balığı.[98] A foundation species can occupy any trophic level in a food web but tend to be a producer.[99]
The term was coined in 1972 by Paul K. Dayton,[100] who applied it to certain members of marine omurgasız ve yosun topluluklar. It was clear from studies in several locations that there were a small handful of species whose activities had a disproportionate effect on the rest of the marine community and they were therefore key to the resilience of the community. Dayton’s view was that focusing on foundation species would allow for a simplified approach to more rapidly understand how a community as a whole would react to disturbances, such as pollution, instead of attempting the extremely difficult task of tracking the responses of all community members simultaneously.


Keystone türleri are species that have large effects, disproportionate to their numbers, within ecosystem food webs.[101] An ecosystem may experience a dramatic shift if a keystone species is removed, even though that species was a small part of the ecosystem by measures of biyokütle veya üretkenlik.[102]
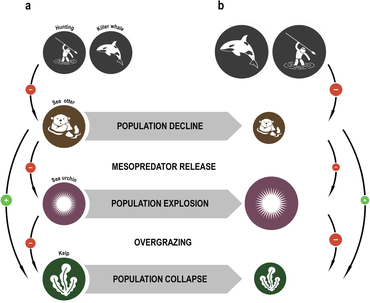
The concept of the keystone species was introduced in 1969 by the zoologist Robert T. Paine.[103][104] Paine developed the concept to explain his observations and experiments on the relationships between deniz omurgasızları of gelgit bölgesi (between the high and low tide lines), including denizyıldızı ve Midye. Biraz deniz yıldızları prey on Deniz kestaneleri, Midye, ve diğeri kabuklu deniz ürünleri that have no other natural predators. If the sea star is removed from the ecosystem, the mussel population explodes uncontrollably, driving out most other species.[105]
Deniz su samuru limit the damage sea urchins inflict on kelp forests. When the sea otters of the North American west coast were hunted commercially for their fur, their numbers fell to such low levels that they were unable to control the sea urchin population. The urchins in turn grazed the Holdfasts nın-nin yosun so heavily that the kelp forests largely disappeared, along with all the species that depended on them. Reintroducing the sea otters has enabled the kelp ecosystem to be restored.[106][107]
Cryptic interactions

Cryptic interactions, interactions which are "hidden in plain sight", occur throughout the marine planktonic foodweb but are currently largely overlooked by established methods, which mean large‐scale data collection for these interactions is limited. Despite this, current evidence suggests some of these interactions may have perceptible impacts on foodweb dynamics and model results. Incorporation of cryptic interactions into models is especially important for those interactions involving the transport of nutrients or energy.[108]
Simplifications such as “zooplankton consume phytoplankton,” “phytoplankton take up inorganic nutrients,” “gross primary production determines the amount of carbon available to the foodweb,” etc. have helped scientists explain and model general interactions in the aquatic environment. Traditional methods have focused on quantifying and qualifying these generalizations, but rapid advancements in genomics, sensor detection limits, experimental methods, and other technologies in recent years have shown that generalization of interactions within the plankton community may be too simple. These enhancements in technology have exposed a number of interactions which appear as cryptic because bulk sampling efforts and experimental methods are biased against them.[108]
Complexity and stability
Food webs provide a framework within which a complex network of predator–prey interactions can be organised. A food web model is a network of yemek zinciri. Each food chain starts with a primary producer veya ototrof, an organism, such as an alga or a plant, which is able to manufacture its own food. Next in the chain is an organism that feeds on the primary producer, and the chain continues in this way as a string of successive predators. The organisms in each chain are grouped into trofik seviyeler, based on how many links they are removed from the primary producers. The length of the chain, or trophic level, is a measure of the number of species encountered as energy or nutrients move from plants to top predators.[111] Gıda enerjisi flows from one organism to the next and to the next and so on, with some energy being lost at each level. At a given trophic level there may be one species or a group of species with the same predators and prey.[112]
1927'de, Charles Elton published an influential synthesis on the use of food webs, which resulted in them becoming a central concept in ecology.[113] In 1966, interest in food webs increased after Robert Paine's experimental and descriptive study of intertidal shores, suggesting that food web complexity was key to maintaining species diversity and ecological stability.[114] Many theoretical ecologists, including Robert May ve Stuart Pimm, were prompted by this discovery and others to examine the mathematical properties of food webs. According to their analyses, complex food webs should be less stable than simple food webs.[115]:75–77[116]:64 The apparent paradox between the complexity of food webs observed in nature and the mathematical fragility of food web models is currently an area of intensive study and debate. The paradox may be due partially to conceptual differences between persistence of a food web and equilibrial istikrar of a food web.[115][116]
Bir trophic cascade can occur in a food web if a trophic level in the web is suppressed.
For example, a top-down cascade can occur if predators are effective enough in predation to reduce the abundance, or alter the behavior, of their Av, thereby releasing the next lower trophic level from predation. A top-down cascade is a trophic cascade where the top consumer/predator controls the Birincil tüketici nüfus. Buna karşılık, birincil üretici nüfusu büyüyor. En üstteki yırtıcı hayvanın ortadan kaldırılması, besin ağı dinamiklerini değiştirebilir. Bu durumda, birincil tüketiciler, birincil üreticileri aşırı doldurur ve sömürür. Sonunda, tüketici nüfusunu sürdürmek için yeterli birincil üretici olmayacaktı. Yukarıdan aşağıya besin ağı stabilitesi, yüksek trofik seviyelerde rekabete ve avlanmaya bağlıdır. İstilacı türler de bu çağlayanı ortadan kaldırarak veya en iyi avcı haline gelerek değiştirebilir. Bu etkileşim her zaman olumsuz olmayabilir. Çalışmalar, bazı istilacı türlerin kademeleri değiştirmeye başladığını göstermiştir; ve sonuç olarak, ekosistem bozulması onarıldı.[117][118] Kuzeybatıda meydana gelen karmaşık, açık okyanus ekosistemindeki bir kaskad örneği Atlantik 1980'ler ve 1990'lar boyunca. Kaldırılması Atlantik cod (Gadus morhua) ve diğer yer balıkları aşırı avlanma özellikle daha küçük olan bu yer balıkları için av türlerinin bolluğunun artmasına neden oldu yem balıkları ve kuzey gibi omurgasızlar kar yengeci (Chionoecetes opilio) ve kuzey karides (Pandalus borealis). Bu av türlerinin artan bolluğu, topluluklarını değiştirdi. Zooplankton dolaylı bir etki olarak küçük balıklar ve omurgasızlar için besin görevi gören.[119] Top-down cascades can be important for understanding the knock-on effects of removing en iyi avcılar from food webs, as humans have done in many places through avcılık ve Balık tutma.
In a bottom-up cascade, the population of primary producers will always control the increase/decrease of the energy in the higher trophic levels. Birincil üreticiler fotosentez gerektiren bitkiler, fitoplankton ve zooplanktonlardır. Işık önemli olsa da, birincil üretici popülasyonları sistemdeki besin miktarı ile değiştirilir. Bu besin ağı, kaynakların mevcudiyetine ve sınırlandırılmasına dayanır. Başlangıçta büyük miktarda besin varsa, tüm popülasyonlar büyüme yaşayacaktır.[120][121]
Terrestrial comparisons

Compared to terrestrial biomass pyramids, aquatic pyramids are generally inverted at the base


Marine environments can have inversions in their biomass pyramids. In particular, the biomass of consumers (copepods, krill, shrimp, forage fish) is generally larger than the biomass of primary producers. This happens because the ocean's primary producers are mostly tiny phytoplankton which have r-strategist traits of growing and reproducing rapidly, so a small mass can have a fast rate of primary production. In contrast, many terrestrial primary producers, such as mature forests, have K-stratejist traits of growing and reproducing slowly, so a much larger mass is needed to achieve the same rate of primary production. The rate of production divided by the average amount of biomass that achieves it is known as an organism's Production/Biomass (P/B) ratio.[123] Production is measured in terms of the amount of movement of mass or energy per area per unit of time. In contrast, the biomass measurement is in units of mass per unit area or volume. The P/B ratio utilizes inverse time units (example: 1/month). This ratio allows for an estimate of the amount of energy flow compared to the amount of biomass at a given trophic level, allowing for demarcations to be made between trophic levels. The P/B ratio most commonly decreases as trophic level and organismal size increases, with small, ephemeral organisms containing a higher P/B ratio than large, long-lasting ones.
Examples: The Bristlecone çam can live for thousands of years, and has a very low production/biomass ratio. The cyanobacterium Prochlorococcus lives for about 24 hours, and has a very high production/biomass ratio.


In oceans, most primary production tarafından gerçekleştirilir yosun. This is a contrast to on land, where most primary production is performed by damarlı Bitkiler.
Aquatic producers, such as planktonic algae or aquatic plants, lack the large accumulation of ikincil büyüme that exists in the woody trees of terrestrial ecosystems. However, they are able to reproduce quickly enough to support a larger biomass of grazers. This inverts the pyramid. Primary consumers have longer lifespans and slower growth rates that accumulates more biomass than the producers they consume. Phytoplankton live just a few days, whereas the zooplankton eating the phytoplankton live for several weeks and the fish eating the zooplankton live for several consecutive years.[125] Aquatic predators also tend to have a lower death rate than the smaller consumers, which contributes to the inverted pyramidal pattern. Population structure, migration rates, and environmental refuge for prey are other possible causes for pyramids with biomass inverted. Energy pyramids, however, will always have an upright pyramid shape if all sources of food energy are included, since this is dictated by the termodinamiğin ikinci yasası."[126][127]
Comparison of productivity in marine and terrestrial ecosystems[128] | |||
|---|---|---|---|
| Ekosistem | Net primary productivity billion tonnes per year | Total plant biomass billion tonnes | Turnover time yıl |
Deniz | 45–55 | 1–2 | 0.02–0.06 |
Karasal | 55–70 | 600–1000 | 9–20 |
Anthropogenic effects
- Aşırı avlanma
- Acidification
Pteropods ve kırılgan yıldızlar together form the base of the Arctic besin ağları and both are seriously damaged by acidification. Pteropods shells dissolve with increasing acidification and brittle stars lose muscle mass when re-growing appendages.[130] Additionally the brittle star's eggs die within a few days when exposed to expected conditions resulting from Arctic acidification.[131] Acidification threatens to destroy Arctic food webs from the base up. Arctic waters are changing rapidly and are advanced in the process of becoming undersaturated with aragonite.[132] Arctic food webs are considered simple, meaning there are few steps in the food chain from small organisms to larger predators. For example, pteropods are "a key prey item of a number of higher predators – larger plankton, fish, seabirds, whales".[133]


- İklim değişikliği
"Our results show how future climate change can potentially weaken marine food webs through reduced energy flow to higher trophic levels and a shift towards a more detritus-based system, leading to food web simplification and altered producer–consumer dynamics, both of which have important implications for the structuring of benthic communities."[134][135]
"...increased temperatures reduce the vital flow of energy from the primary food producers at the bottom (e.g. algae), to intermediate consumers (herbivores), to predators at the top of marine food webs. Such disturbances in energy transfer can potentially lead to a decrease in food availability for top predators, which in turn, can lead to negative impacts for many marine species within these food webs... "Whilst climate change increased the productivity of plants, this was mainly due to an expansion of cyanobacteria (small blue-green algae)," said Mr Ullah. "This increased primary productivity does not support food webs, however, because these cyanobacteria are largely unpalatable and they are not consumed by herbivores. Understanding how ecosystems function under the effects of global warming is a challenge in ecological research. Most research on ocean warming involves simplified, short-term experiments based on only one or a few species."[135]
Ayrıca bakınız
Referanslar
- ^ U S Department of Energy (2008) Carbon Cycling and Biosequestration page 81, Workshop report DOE/SC-108, U.S. Department of Energy Office of Science.
- ^ Campbell, Mike (22 June 2011). "The role of marine plankton in sequestration of carbon". EarthTimes. Alındı 22 Ağustos 2014.
- ^ Why should we care about the ocean? NOAA: National Ocean Service. Updated: 7 January 2020. Retrieved 1 March 2020.
- ^ Heinrichs, M.E., Mori, C. and Dlugosch, L. (2020) "Complex Interactions Between Aquatic Organisms and Their Chemical Environment Elucidated from Different Perspectives". In: Jungblut S., Liebich V., Bode-Dalby M. (Eds) YOUMARES 9-The Oceans: Our Research, Our Future , pages 279–297. Springer. doi:10.1007/978-3-030-20389-4_15.
- ^ Dunne, J.A., Williams, R.J. and Martinez, N.D. (2002) "Food-web structure and network theory: the role of connectance and size". Ulusal Bilimler Akademisi Bildiriler Kitabı, 99(20): 12917–12922. doi:10.1073/pnas.192407699.
- ^ Dunne, J.A. (2006) "The network structure of food webs". In: M Pascual and J. A. Dunne (Eds.) Ecological networks: linking structure to dynamics in food webs, pages 27–86. ISBN 9780199775057.
- ^ Karlson, A.M., Gorokhova, E., Gårdmark, A., Pekcan-Hekim, Z., Casini, M., Albertsson, J., Sundelin, B., Karlsson, O. and Bergström, L. (2020). "Linking consumer physiological status to food-web structure and prey food value in the Baltic Sea". Ambio, 49(2): 391–406. doi:10.1007/s13280-019-01201-1
- ^ Odum, W. E.; Heald, E. J. (1975) "The detritus-based food web of an estuarine mangrove community". Pages 265–286 in L. E. Cronin, ed. Estuarine research. Cilt 1. Academic Press, New York.
- ^ Pimm, S. L.; Lawton, J. H. (1978). "On feeding on more than one trophic level". Doğa. 275 (5680): 542–544. doi:10.1038/275542a0. S2CID 4161183.
- ^ Pauly, D.; Palomares, M. L. (2005). "Fishing down marine food webs: it is far more pervasive than we thought" (PDF). Deniz Bilimleri Bülteni. 76 (2): 197–211. Arşivlenen orijinal (PDF) 2013-05-14 tarihinde.
- ^ Cortés, E. (1999). "Standardized diet compositions and trophic levels of sharks". ICES J. Mar. Sci. 56 (5): 707–717. doi:10.1006/jmsc.1999.0489.
- ^ Pauly, D.; Trites, A.; Capuli, E.; Christensen, V. (1998). "Diet composition and trophic levels of marine mammals". ICES J. Mar. Sci. 55 (3): 467–481. doi:10.1006/jmsc.1997.0280.
- ^ Researchers calculate human trophic level for first time Phys.org . 3 Aralık 2013.
- ^ Bonhommeau, S., Dubroca, L., Le Pape, O., Barde, J., Kaplan, D.M., Chassot, E. and Nieblas, A.E. (2013) "Eating up the world’s food web and the human trophic level". Ulusal Bilimler Akademisi Bildiriler Kitabı, 110(51): 20617–20620. doi:10.1073 / pnas.1305827110.
- ^ a b Klorofil NASA Dünya Gözlemevi. Accessed 30 November 2019.
- ^ Kettler GC, Martiny AC, Huang K, Zucker J, Coleman ML, Rodrigue S, Chen F, Lapidus A, Ferriera S, Johnson J, Steglich C, Church GM, Richardson P, Chisholm SW (Aralık 2007). "Prochlorococcus'un evriminde gen kazancı ve kaybının kalıpları ve etkileri". PLOS Genetiği. 3 (12): e231. doi:10.1371 / dergi.pgen.0030231. PMC 2151091. PMID 18159947.
- ^ Nemiroff, R .; Bonnell, J., editörler. (27 Eylül 2006). "Satürn'den Dünya". Günün Astronomi Resmi. NASA.
- ^ Partensky F, Hess WR, Vaulot D (Mart 1999). "Prochlorococcus, küresel önemi olan bir deniz fotosentetik prokaryotu". Mikrobiyoloji ve Moleküler Biyoloji İncelemeleri. 63 (1): 106–27. doi:10.1128 / MMBR.63.1.106-127.1999. PMC 98958. PMID 10066832.
- ^ "The Most Important Microbe You've Never Heard Of". npr.org.
- ^ Mann, D. G. (1999). "The species concept in diatoms". Fikoloji. 38 (6): 437–495. doi:10.2216/i0031-8884-38-6-437.1.
- ^ Kopepodların Biyolojisi Arşivlendi 2009-01-01 at the Wayback Makinesi -de Carl von Ossietzky Oldenburg Üniversitesi
- ^ a b c d Hays, G.C., Doyle, T.K. and Houghton, J.D. (2018) "A paradigm shift in the trophic importance of jellyfish?" Trends in ecology & evolution, 33(11): 874-884. doi:10.1016/j.tree.2018.09.001
- ^ a b Hamilton, G. (2016) "The secret lives of jellyfish: long regarded as minor players in ocean ecology, jellyfish are actually important parts of the marine food web". Doğa, 531(7595): 432-435. doi:10.1038/531432a
- ^ Cardona, L., De Quevedo, I.Á., Borrell, A. and Aguilar, A. (2012) "Massive consumption of gelatinous plankton by Mediterranean apex predators". PLOS ONE, 7(3): e31329. doi:10.1371/journal.pone.0031329
- ^ Tiny Forage Fish At Bottom Of Marine Food Web Get New Protections Ulusal Halk Radyosu, 7 Nisan 2016.
- ^ Roman, J. & McCarthy, J.J. (2010). "The Whale Pump: Marine Mammals Enhance Primary Productivity in a Coastal Basin". PLOS ONE. 5 (10): e13255. Bibcode:2010PLoSO...513255R. doi:10.1371/journal.pone.0013255. PMC 2952594. PMID 20949007. e13255.CS1 Maint: yazar parametresini kullanır (bağlantı)
- ^ Brown, Joshua E. (12 Oct 2010). "Whale poop pumps up ocean health". Günlük Bilim. Alındı 18 Ağustos 2014.
- ^ Raina, J.B. (2018) "The life aquatic at the microscale". mSystems, 3(2): e00150-17. doi:10.1128/mSystems.00150-17.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ Marco, D, ed. (2011). Metagenomics: Current Innovations and Future Trends. Caister Academic Press. ISBN 978-1-904455-87-5.
- ^ a b c Roslin, T. and Majaneva, S. (2016) "The use of DNA barcodes in food web construction—terrestrial and aquatic ecologists unite!". Genetik şifre, 59(9): 603–628. doi:10.1139/gen-2015-0229.
- ^ Wilhelm, Steven W .; Suttle, Curtis A. (1999). "Viruses and Nutrient Cycles in the Sea". BioScience. 49 (10): 781–788. doi:10.2307/1313569. ISSN 1525-3244. JSTOR 1313569.
- ^ Weinbauer, Markus G., et al. "Synergistic and antagonistic effects of viral lysis and protistan grazing on bacterial biomass, production and diversity." Çevresel Mikrobiyoloji 9.3 (2007): 777-788.
- ^ Robinson, Carol, and Nagappa Ramaiah. "Microbial heterotrophic metabolic rates constrain the microbial carbon pump." The American Association for the Advancement of Science, 2011.
- ^ Van den Meersche, K., Middelburg, J.J., Soetaert, K., Van Rijswijk, P., Boschker, H.T. and Heip, C.H. (2004) "Carbon‐nitrogen coupling and algal‐bacterial interactions during an experimental bloom: Modeling a 13C tracer experiment". Limnoloji ve Oşinografi, 49(3): 862–878. doi:10.4319/lo.2004.49.3.0862.
- ^ Käse L, Geuer JK. (2018) "Phytoplankton Responses to Marine Climate Change – An Introduction". In Jungblut S., Liebich V., Bode M. (Eds) YOUMARES 8–Oceans Across Boundaries: Learning from each other, pages 55–72, Springer. doi:10.1007/978-3-319-93284-2_5.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ Heinrichs, M.E., Mori, C. and Dlugosch, L. (2020) "Complex Interactions Between Aquatic Organisms and Their Chemical Environment Elucidated from Different Perspectives". İçinde: YOUMARES 9-The Oceans: Our Research, Our Future , pages 279–297. Springer. doi:10.1007/978-3-030-20389-4_15.
- ^ Duponchel, S. and Fischer, M.G. (2019) "Viva lavidaviruses! Five features of virophages that parasitize giant DNA viruses". PLoS pathogens, 15(3). doi:10.1371/journal.ppat.1007592.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ Fischer, M. G.; Allen, M. J .; Wilson, W. H.; Suttle, C. A. (2010). "Giant virus with a remarkable complement of genes infects marine zooplankton" (PDF). Ulusal Bilimler Akademisi Bildiriler Kitabı. 107 (45): 19508–19513. Bibcode:2010PNAS..10719508F. doi:10.1073/pnas.1007615107. PMC 2984142. PMID 20974979.
- ^ Matthias G. Fischer; Michael J. Allen; William H. Wilson; Curtis A. Suttle (2010). "Giant virus with a remarkable complement of genes infects marine zooplankton" (PDF). Ulusal Bilimler Akademisi Bildiriler Kitabı. 107 (45): 19508–19513. Bibcode:2010PNAS..10719508F. doi:10.1073/pnas.1007615107. PMC 2984142. PMID 20974979.
- ^ Massana, Ramon; Javier Del Campo; Christian Dinter; Ruben Sommaruga (2007). "Crash of a population of the marine heterotrophic flagellate Cafeteria roenbergensis by viral infection". Çevresel Mikrobiyoloji. 9 (11): 2660–2669. doi:10.1111/j.1462-2920.2007.01378.x. PMID 17922751. S2CID 30191542.
- ^ Fischer MG, Suttle CA (April 2011). "A virophage at the origin of large DNA transposons". Bilim. 332 (6026): 231–4. Bibcode:2011Sci...332..231F. doi:10.1126/science.1199412. PMID 21385722. S2CID 206530677.
- ^ Fischer MG, Hackl (December 2016). "Host genome integration and giant virus-induced reactivation of the virophage mavirus". Doğa. 540 (7632): 288–91. Bibcode:2016Natur.540..288F. doi:10.1038/nature20593. PMID 27929021. S2CID 4458402.
- ^ Kagami, M., Miki, T. and Takimoto, G. (2014) "Mycoloop: chytrids in aquatic food webs". Mikrobiyolojide sınırlar, 5: 166. doi:10.3389/fmicb.2014.00166.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 3.0 International License.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 3.0 International License. - ^ Amend, A., Burgaud, G., Cunliffe, M., Edgcomb, V.P., Ettinger, C.L., Gutiérrez, M.H., Heitman, J., Hom, E.F., Ianiri, G., Jones, A.C. and Kagami, M. (2019) "Fungi in the marine environment: Open questions and unsolved problems". MBio, 10(2): e01189-18. doi:10.1128/mBio.01189-18.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ Gutierrez MH, Jara AM, Pantoja S (2016) "Fungal parasites infect marine diatoms in the upwelling ecosystem of the Humboldt current system off central Chile". Environ Microbiol, 18(5): 1646–1653. doi:10.1111/1462-2920.13257.
- ^ a b c Middelburg J.J. (2019) "The Return from Organic to Inorganic Carbon". İçinde: Marine Carbon Biogeochemistry: A Primer for Earth System Scientists, pages 37–56, Springer. doi:10.1007/978-3-030-10822-9_3.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ Legendre L, Rassoulzadegan F (1995) "Plankton and nutrient dynamics in marine waters". Ophelia, 41:153–172.
- ^ Pace ML, Cole JJ, Carpenter SR, Kitchell JF (1999) "Trophic cascades revealed in diverse ecosystems". Trends Ecol Evol, 14: 483–488.
- ^ Azam F, Fenchel T, Field JG, Gray JS, Meyer-Reil LA, Thingstad F (1983) "The ecological role of water-column microbes in the sea". Mar Ecol-Prog Ser, 10: 257–263.
- ^ Anderson TR and LeB Williams PJ (1998) "Modelling the seasonal cycle of dissolved organic carbonat station E1 in the English channel". Estuar Coast Shelf Sci, 46: 93–109.
- ^ Van den Meersche K, Middelburg JJ, Soetaert K, van Rijswijk P, Boschker HTS, Heip CHR (2004) "Carbon–nitrogen coupling and algal–bacterial interactions during an experimental bloom: modeling a 13C tracer experiment". Limnol Oceanogr, 49: 862–878.
- ^ Suttle CA (2005) "Viruses in the sea". Doğa, 437: 356–361.
- ^ Siegel, David A.; Buesseler, Ken O .; Behrenfeld, Michael J.; Benitez-Nelson, Claudia R .; Boss, Emmanuel; Brzezinski, Mark A.; Burd, Adrian; Carlson, Craig A.; d'Asaro, Eric A.; Doney, Scott C .; Perry, Mary J.; Stanley, Rachel H. R.; Steinberg, Deborah K. (2016). "Prediction of the Export and Fate of Global Ocean Net Primary Production: The EXPORTS Science Plan". Deniz Bilimlerinde Sınırlar. 3. doi:10.3389/fmars.2016.00022.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ Wang, F., Wu, Y., Chen, Z., Zhang, G., Zhang, J., Zheng, S. and Kattner, G. (2019) "Trophic interactions of mesopelagic fishes in the South China Sea illustrated by stable isotopes and fatty acids". Deniz Bilimlerinde Sınırlar, 5: 522. doi:10.3389/fmars.2018.00522.
- ^ a b Tollefson, Jeff (27 February 2020) Enter the twilight zone: scientists dive into the oceans’ mysterious middle Doğa Haberleri. doi:10.1038/d41586-020-00520-8.
- ^ a b Choy, C.A., Haddock, S.H. and Robison, B.H. (2017) "Deep pelagic food web structure as revealed by yerinde feeding observations". Kraliyet Topluluğu B Bildirileri: Biyolojik Bilimler, 284(1868): 20172116. doi:10.1098/rspb.2017.2116.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ Kelly, T.B., Davison, P.C., Goericke, R., Landry, M.R., Ohman, M. and Stukel, M.R. (2019) "The importance of mesozooplankton diel vertical migration for sustaining a mesopelagic food web". Deniz Bilimlerinde Sınırlar, 6: 508. doi:10.3389/fmars.2019.00508.
- ^ Climate change in deep oceans could be seven times faster by middle of century, report says Gardiyan, 25 May 2020.
- ^ Brito-Morales, I., Schoeman, D.S., Molinos, J.G., Burrows, M.T., Klein, C.J., Arafeh-Dalmau, N., Kaschner, K., Garilao, C., Kesner-Reyes, K. and Richardson, A.J. (2020) "Climate velocity reveals increasing exposure of deep-ocean biodiversity to future warming". Doğa İklim Değişikliği, pp.1-6. doi:10.5281/zenodo.3596584.
- ^ Irigoien, X., Klevjer, T.A., Røstad, A., Martinez, U., Boyra, G., Acuña, J.L., Bode, A., Echevarria, F., Gonzalez-Gordillo, J.I., Hernandez-Leon, S. and Agusti, S. (2014) "Large mesopelagic fishes biomass and trophic efficiency in the open ocean". Nature communications, 5: 3271. doi:10.1038 / ncomms4271
- ^ Fish biomass in the ocean is 10 times higher than estimated EurekAlert, 7 February 2014.
- ^ Choy, C.A., Wabnitz, C.C., Weijerman, M., Woodworth-Jefcoats, P.A. and Polovina, J.J. (2016) "Finding the way to the top: how the composition of oceanic mid-trophic micronekton groups determines apex predator biomass in the central North Pacific". Deniz Ekolojisi İlerleme Serisi, 549: 9–25. doi:10.3354/meps11680.
- ^ a b c d e Kurata, N., Vella, K., Hamilton, B., Shivji, M., Soloviev, A., Matt, S., Tartar, A. and Perrie, W. (2016) "Surfactant-associated bacteria in the near-surface layer of the ocean". Nature: Scientific Reports, 6(1): 1–8. doi:10.1038/srep19123.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ Ẑutić, V., Ćosović, B., Marčenko, E., Bihari, N. and Kršinić, F. (1981) "Surfactant production by marine phytoplankton". Deniz Kimyası, 10(6): 505–520. doi:10.1016/0304-4203(81)90004-9.
- ^ Levin LA, Baco AR, Bowden DA, Colaco A, Cordes EE, Cunha MR, Demopoulos AWJ, Gobin J, Grupe BM, Le J, Metaxas A, Netburn AN, Rouse GW, Thurber AR, Tunnicliffe V, Van Dover CL, Vanreusel A and Watling L (2016). "Hydrothermal Vents and Methane Seeps: Rethinking the Sphere of Influence". Ön. Mar.Sci. 3:72. doi:10.3389/fmars.2016.00072
- ^ Portail, M., Olu, K., Dubois, S.F., Escobar-Briones, E., Gelinas, Y., Menot, L. and Sarrazin, J. (2016). "Food-web complexity in Guaymas Basin hydrothermal vents and cold seeps". PLOS ONE, 11(9): p.e0162263. doi:10.1371/journal.pone.0162263.
- ^ Bernardino AF, Levin LA, Thurber AR and Smith CR (2012). "Comparative Composition, Diversity and Trophic Ecology of Sediment Macrofauna at Vents, Seeps and Organic Falls". PLOS ONE, 7(4): e33515. pmid:22496753. doi:10.1371/journal.pone.0033515.
- ^ Portail M, Olu K, Escobar-Briones E, Caprais JC, Menot L, Waeles M, et al. (2015). "Comparative study of vent and seep macrofaunal communities in the Guaymas Basin". Biogeosciences. 12(18): 5455–79. doi:10.5194/bg-12-5455-2015.
- ^ a b Otero, X.L., De La Peña-Lastra, S., Pérez-Alberti, A., Ferreira, T.O. and Huerta-Diaz, M.A. (2018) "Seabird colonies as important global drivers in the nitrogen and phosphorus cycles". Nature communications, 9(1): 1–8. doi:10.1038/s41467-017-02446-8. Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
- ^ Harris, P.T.; Macmillan-Lawler, M.; Rupp, J.; Baker, E.K. (2014). "Geomorphology of the oceans". Deniz Jeolojisi. 352: 4–24. doi:10.1016/j.margeo.2014.01.011.
- ^ Heymans, J.J., Coll, M., Libralato, S., Morissette, L. and Christensen, V. (2014). "Global patterns in ecological indicators of marine food webs: a modelling approach". PLOS ONE, 9(4). doi:10.1371/journal.pone.0095845.
- ^ Pranovi, F., Libralato, S., Raicevich, S., Granzotto, A., Pastres, R. and Giovanardi, O. (2003). "Mechanical clam dredging in Venice lagoon: ecosystem effects evaluated with a trophic mass-balance model". Deniz Biyolojisi, 143(2): 393–403. doi:10.1007/s00227-003-1072-1.
- ^ Petersen, J.K., Holmer, M., Termansen, M. and Hasler, B. (2019) "Nutrient extraction through bivalves". In: Smaal A., Ferreira J., Grant J., Petersen J., Strand Ø. (eds) Goods and Services of Marine Bivalves, pages 179–208. Springer. doi:10.1007/978-3-319-96776-9_10. ISBN 9783319967769
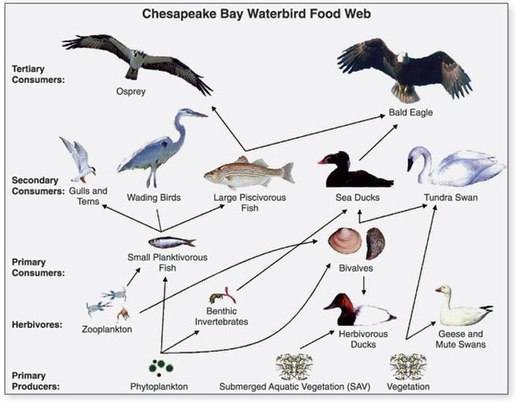
- ^ ABD Jeolojik Araştırması (USGS). "Chapter 14: Changes in Food and Habitats of Waterbirds." Figure 14.1. Synthesis of U.S. Geological Survey Science for the Chesapeake Bay Ecosystem and Implications for Environmental Management. USGS Circular 1316.
 Bu makale, bu kaynaktan alınan metni içermektedir. kamu malı.
Bu makale, bu kaynaktan alınan metni içermektedir. kamu malı. - ^ Perry, M.C., Osenton, P.C., Wells-Berlin, A.M., and Kidwell, D.M., 2005, Food selection among Atlantic Coast sea ducks in relation to historic food habits, [abs.] in Perry, M.C., Second North American Sea Duck Conference, November 7–11, 2005, Annapolis, Maryland, Program and Abstracts, USGS Patuxent Wildlife Research Center, Maryland, 123 p. (p. 105).
- ^ Bowser, A.K., Diamond, A.W. and Addison, J.A. (2013) "From puffins to plankton: a DNA-based analysis of a seabird food chain in the northern Gulf of Maine". PLOS ONE, 8(12): e83152. doi:10.1371/journal.pone.0083152
- ^ Leray M, Meyer CP, Mills SC. (2015) "Mercanlarda yaşayan yırtıcı balıkların meta-kodlama diyet analizi, mercan mutualistlerinin oldukça bölünmüş, genel diyetlerine küçük katkılarını göstermektedir". PeerJ, 3: e1047. doi:10.7717 / peerj.1047.
- ^ Stat, M., Huggett, M.J., Bernasconi, R., DiBattista, J.D., Berry, T.E., Newman, S.J., Harvey, E.S. ve Bunce, M. (2017) "eDNA ile ekosistem biyoizlemesi: tropikal bir deniz ortamında yaşam ağacı boyunca metabarkodlama". Bilimsel Raporlar, 7(1): 1–11. doi:10.1038 / s41598-017-12501-5.
- ^ Lobo, Eduardo A .; Heinrich, Carla Giselda; Schuch, Marilia; Wetzel, Carlos Eduardo; Ector, Luc (2016), Necchi JR, Orlando (ed.), "Nehirlerde Biyoindikatörler Olarak Diatomlar", Nehir Yosunu, Springer International Publishing, s. 245–271, doi:10.1007/978-3-319-31984-1_11, ISBN 9783319319834
- ^ Stevenson, R. Jan; Pan, Yangdong; van Dam, Herman (2010), Smol, John P .; Stoermer, Eugene F. (ed.), "Nehirler ve akarsulardaki çevre koşullarının diatomlarla değerlendirilmesi", Diatomlar (2. baskı), Cambridge University Press, s. 57–85, doi:10.1017 / cbo9780511763175.005, ISBN 9780511763175
- ^ Coll, M., Schmidt, A., Romanuk, T. ve Lotze, H.K. (2011). "Deniz çayırı topluluklarının farklı mekansal ölçeklerde ve insan etkisinde besin ağı yapısı". PLOS ONE, 6(7): e22591. doi:10.1371 / journal.pone.0022591.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ McCarthy, J.J., Canziani, O.F., Leary, N.A., Dokken, D.J. ve Beyaz, K.S. (Ed.) (2001) İklim Değişikliği 2001: Etkiler, Uyum ve Hassasiyet: Çalışma Grubu II'nin Hükümetlerarası İklim Değişikliği Paneli Üçüncü Değerlendirme Raporuna Katkısı Sayfa 807, Cambridge University Press. ISBN 9780521015004
- ^ Murphy, EJ, Cavanagh, RD, Drinkwater, KF, Grant, SM, Heymans, JJ, Hofmann, EE, Hunt Jr, GL ve Johnston, NM (2016) "Polar pelajik ekosistemlerin yapısını ve işleyişini anlamak için etkileri tahmin etmek için değişiklik". Kraliyet Topluluğu B Bildirileri: Biyolojik Bilimler, 283(1844): 20161646. doi:10.1098 / rspb.2016.1646.
- ^ Ekosistemler Üzerindeki İklim Etkileri: Gıda Ağı Bozulması EPA. 11 Şubat 2020'de erişildi.
 Bu makale, bu kaynaktan alınan metni içermektedir. kamu malı.
Bu makale, bu kaynaktan alınan metni içermektedir. kamu malı. - ^ "Bilim adamları, Arktik Okyanusu'nda bir 'rejim değişikliği' oluyor diyor". phys.org. Alındı 16 Ağustos 2020.
- ^ Lewis, K. M .; Dijken, G. L. van; Arrigo, K. R. (10 Temmuz 2020). "Fitoplankton konsantrasyonundaki değişiklikler artık Arktik Okyanusu birincil üretiminin artmasına neden oluyor". Bilim. 369 (6500): 198–202. doi:10.1126 / science.aay8380. ISSN 0036-8075. PMID 32647002. S2CID 220433818. Alındı 16 Ağustos 2020.
- ^ Stoecker, D.K. ve Lavrentyev, P.J. (2018). "Kutup denizlerinde miksotrofik plankton: bir pan-arktik inceleme". Deniz Bilimlerinde Sınırlar, 5: 292. doi:10.3389 / fmars.2018.00292
- ^ Kilias, Estelle S .; Junges, Leandro; Šupraha, Luka; Leonard, Guy; Metfies, Katja; Richards Thomas A. (2020). "Chytrid mantarlarının dağılımı ve diatomlarla birlikte görülmesi, Arktik Okyanusu'ndaki deniz buzu erimesi ile ilişkilidir". İletişim Biyolojisi. 3 (1): 183. doi:10.1038 / s42003-020-0891-7. PMC 7174370. PMID 32317738. S2CID 216033140.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ Bender, S.J., Moran, D.M., McIlvin, M.R., Zheng, H., McCrow, J.P., Badger, J., DiTullio, G.R., Allen, A.E. ve Saito, M.A. (2018) "Koloni oluşumu Phaeocystis antarctica: moleküler mekanizmaları demir biyojeokimyayla birleştirmek " Biyojeoloji, 15(16): 4923–4942. doi:10.5194 / bg-15-4923-2018.
- ^ Pinkernell, S. ve Beszteri, B. (2014) "İklim değişikliğinin Güney Okyanusu'nun ana silikat platininin dağılım aralığı üzerindeki potansiyel etkileri". Ekoloji ve evrim, 4(16): 3147–3161. doi:10.1002 / ece3.1138
- ^ Cavan, EL, Belcher, A., Atkinson, A., Hill, SL, Kawaguchi, S., McCormack, S., Meyer, B., Nicol, S., Ratnarajah, L., Schmidt, K. ve Steinberg, DK (2019) "Antarktika krilinin biyojeokimyasal döngülerde önemi". Doğa iletişimi, 10(1): 1–13. doi:10.1038 / s41467-019-12668-7.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ a b Cordone, G., Marina, T.I., Salinas, V., Doyle, S.R., Saravia, L.A. ve Momo, F.R. (2018). "Antarktika deniz besin ağındaki makroalg kaybının etkileri: gıda ağı çalışmalarına yok olma eşiklerinin uygulanması". PeerJ, 6: e5531. doi:10.7717 / eş. 5531
- ^ Marina, T.I., Salinas, V., Cordone, G., Campana, G., Moreira, E., Deregibus, D., Torre, L., Sahade, R., Tatian, M., Oro, E.B. ve De Troch, M. (2018). "Potter Koyu'nun (Antarktika) besin ağı: karmaşıklık, yapı ve işlev". Nehir Ağzı, Kıyı ve Raf Bilimi, 200: 141–151. doi: 10.1016 / j.ecss.2017.10.015.
- ^ Koh, E.Y., Martin, A.R., McMinn, A. ve Ryan, K.G. (2012) "Antarktika deniz buzundaki mikrobiyal fototrofide son gelişmeler ve gelecekteki perspektifler". Biyoloji, 1(3): 542-556. doi:10.3390 / biology1030542.
- ^ Buradaki mikrobiyal döngü yeniden çizilir ve şunlardan kısaltılır:
- Azam, F., Fenchel, T., Field, J.G., Gray, J.S., Meyer-Reil, L.A. ve Thingstad, F. (1983) "Denizdeki su sütunu mikroplarının ekolojik rolü". Deniz ekolojisi ilerleme serisi, 10(3): 257–263.
- Fenchel, T. (2008) "Mikrobiyal döngü - 25 yıl sonra". Deneysel Deniz Biyolojisi ve Ekoloji Dergisi, 366(1-2): 99-103. doi:10.1016 / j.jembe.2008.07.013.
- ^ Lamy, T., Koenigs, C., Holbrook, S.J., Miller, R.J., Stier, A.C. ve Reed, D.C. (2020) "Vakıf türleri, dev bir yosun ormanında çeşitliliği artırarak topluluk istikrarını destekler". Ekoloji, e02987. doi:10.1002 / ecy.2987.
- ^ Dev yosun, Güney Kaliforniya deniz ekosistemlerine güçlü bir temel sağlıyor, Ulusal Bilim Vakfı, 4 Şubat 2020.
- ^ Angelini, Christine; Altieri, Andrew H .; et al. (Ekim 2011). "Temel Türler Arasındaki Etkileşimler ve Bunların Topluluk Organizasyonu, Biyoçeşitlilik ve Koruma Açısından Sonuçları". BioScience. 61 (10): 782–789. doi:10.1525 / biyo.2011.61.10.8.
- ^ Ellison, Aaron M .; Banka, Michael S .; et al. (Kasım 2005). "Temel türlerin kaybı: ormanlık ekosistemlerin yapısı ve dinamikleri için sonuçlar". Ekoloji ve Çevrede Sınırlar. 3 (9): 479–486. doi:10.1890 / 1540-9295 (2005) 003 [0479: LOFSCF] 2.0.CO; 2.
- ^ Dayton, P. K. 1972. Topluluk direncini ve zenginleştirmenin Antarktika'daki McMurdo Sound'daki benthos üzerindeki potansiyel etkilerini anlamaya doğru. s. 81–96 Koruma Sorunları Kolokyumu Bildirileri Allen Press, Lawrence, Kansas.
- ^ Paine, R.T. (1995). "Keystone Türleri Kavramının İyileştirilmesi Üzerine Bir Söyleşi". Koruma Biyolojisi. 9 (4): 962–964. doi:10.1046 / j.1523-1739.1995.09040962.x.
- ^ Davic, Robert D. (2003). "Kilit Taşı Türlerini ve İşlevsel Grupları Bağlamak: Kilit Taşı Türleri Kavramının Yeni Bir İşlemsel Tanımı". Koruma Ekolojisi. Alındı 2011-02-03.
- ^ Paine, R.T. (1969). "Trofik Karmaşıklık ve Topluluk İstikrarı Üzerine Bir Not". Amerikan Doğa Uzmanı. 103 (929): 91–93. doi:10.1086/282586. JSTOR 2459472. S2CID 83780992.
- ^ "Keystone Tür Hipotezi". Washington Üniversitesi. Arşivlenen orijinal 2011-01-10 tarihinde. Alındı 2011-02-03.
- ^ Paine, R.T. (1966). "Gıda ağı karmaşıklığı ve tür çeşitliliği". Amerikan doğa bilimci. 100 (910): 65–75. doi:10.1086/282400. JSTOR 2459379. S2CID 85265656.
- ^ Szpak, Paul; Orchard, Trevor J .; Salomon, Anne K .; Gröcke, Darren R. (2013). "Bölgesel ekolojik değişkenlik ve deniz kürk ticaretinin güney Haida Gwaii'deki (Britanya Kolombiyası, Kanada) kıyıya yakın ekosistemler üzerindeki etkisi: kaya balığı (Sebastes spp.) Kemik kolajeninin kararlı izotop analizinden kanıt". Arkeolojik ve Antropolojik Bilimler. 5 (2): 159–182. doi:10.1007 / s12520-013-0122-y. S2CID 84866250.
- ^ Cohn, J. P. (1998). "Deniz Su Samurlarını Anlamak". BioScience. 48 (3): 151–155. doi:10.2307/1313259. JSTOR 1313259.
- ^ a b c Millette, N.C., Grosse, J., Johnson, W.M., Jungbluth, M.J. ve Suter, E.A. (2018). "Görünürde saklı: Deniz planktonunda şifreli etkileşimlerin önemi". Limnoloji ve Oşinografi Mektupları, 3(4): 341–356. doi:10.1002 / lol2.10084.
 Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı.
Materyal, bir altında bulunan bu kaynaktan kopyalandı. Creative Commons Attribution 4.0 Uluslararası Lisansı. - ^ a b c Luypaert, T., Hagan, J.G., McCarthy, M.L. ve Poti, M. (2020) "Antroposen'de Deniz Biyolojik Çeşitliliğinin Durumu". İçinde: YOUMARES 9-The Oceans: Bizim Araştırmamız, Geleceğimiz, sayfalar 57-82, Springer. doi:10.1007/978-3-030-20389-4_4.
- ^ Estes JA, Tinker MT, Williams TM ve diğerleri (1998) "Okyanus ve kıyı ekosistemlerini birbirine bağlayan su samurlarında katil balina avlanması". Bilim, 282: 473–476. doi:10.1126 / science.282.5388.473.
- ^ Post, D. M. (1993). "Besin zinciri uzunluğunun uzun ve kısası". Ekoloji ve Evrimdeki Eğilimler. 17 (6): 269–277. doi:10.1016 / S0169-5347 (02) 02455-2.
- ^ Jerry Bobrow, Ph.D .; Stephen Fisher (2009). CliffsNotes CSET: Birden Çok Konu (2. baskı). John Wiley and Sons. s. 283. ISBN 978-0-470-45546-3.
- ^ Elton CS (1927) Hayvan Ekolojisi. 2001'de yeniden yayınlandı. University of Chicago Press.
- ^ Paine RT (1966). "Gıda ağı karmaşıklığı ve tür çeşitliliği". Amerikan Doğa Uzmanı. 100 (910): 65–75. doi:10.1086/282400. S2CID 85265656.
- ^ a b RM Mayıs (2001) Model Ekosistemlerde Kararlılık ve Karmaşıklık Princeton University Press, 1973 baskısının yeni önsözle yeniden basımı. ISBN 978-0-691-08861-7.
- ^ a b Pimm SL (2002) Yiyecek Ağları University of Chicago Press, 1982 baskısının yeni önsözle yeniden basımı. ISBN 978-0-226-66832-1.
- ^ Kotta, J .; Wernberg, T .; Jänes, H .; Kotta, I .; Nurkse, K .; Pärnoja, M .; Orav-Kotta, H. (2018). "Yeni yengeç avcısı, deniz ekosistemi rejim değişikliğine neden oluyor". Bilimsel Raporlar. 8 (1): 4956. doi:10.1038 / s41598-018-23282-w. PMC 5897427. PMID 29651152.
- ^ Megrey, Bernard ve Werner, Francisco. "Yukarıdan Aşağıya, Aşağıdan Yukarıya Ekosistem Düzenlemesinin Rolünü Modelleme Perspektifinden Değerlendirmek" (PDF).CS1 bakım: birden çok isim: yazarlar listesi (bağlantı)
- ^ Frank, K. T .; Petrie, B .; Choi, J. S .; Leggett, W. C. (2005). "Eski Cod-Dominated Ecosystem içinde Trophic Cascades". Bilim. 308 (5728): 1621–1623. doi:10.1126 / science.1113075. ISSN 0036-8075. PMID 15947186. S2CID 45088691.
- ^ Matsuzaki, Shin-Ichiro S .; Suzuki, Kenta; Kadoya, Taku; Nakagawa, Megumi; Takamura, Noriko (2018). "Sığ, hipereutrofik bir gölde birincil üretim, zooplankton ve balıklar arasındaki aşağıdan yukarıya bağlantılar". Ekoloji. 99 (9): 2025–2036. doi:10.1002 / ecy.2414. PMID 29884987.
- ^ Lynam, Christopher Philip; Llope, Marcos; Möllmann, Christian; Helaouët, Pierre; Bayliss-Brown, Georgia Anne; Stenseth, Nils C. (Şubat 2017). "Kuzey Denizi'nde trofik ve çevresel kontrol". Ulusal Bilimler Akademisi Bildiriler Kitabı. 114 (8): 1952–1957. doi:10.1073 / pnas.1621037114. PMC 5338359. PMID 28167770.
- ^ "Eski liste". Rocky Mountain Tree Ring Araştırması. Alındı 8 Ocak 2013.
- ^ Wetzel, Robert (2001). Limnoloji: Göl ve nehir ekosistemleri. San Diego: Akademik Basın. ISBN 9780127447605.
- ^ Bar-On, Y.M., Phillips, R. ve Milo, R. (2018) "Dünyadaki biyokütle dağılımı". Ulusal Bilimler Akademisi Bildiriler Kitabı, 115(25): 6506–6511. doi:10.1073 / pnas.1711842115.
- ^ Büyücü, Frank R. (2008). Su Bilimi: Kavramlar ve Uygulamalar. CRC Basın. s. 167. ISBN 978-1-4200-5544-3.
- ^ Odum, E. P .; Barrett, G.W. (2005). Ekolojinin Temelleri (5. baskı). Brooks / Cole, Cengage Learning'in bir parçası. ISBN 978-0-534-42066-6. Arşivlenen orijinal 2011-08-20 tarihinde.
- ^ Wang, H .; Morrison, W .; Singh, A .; Weiss, H. (2009). "Ekosistemlerdeki ters çevrilmiş biyokütle piramitlerinin ve sığınaklarının modellenmesi" (PDF). Ekolojik Modelleme. 220 (11): 1376–1382. doi:10.1016 / j.ecolmodel.2009.03.005. Arşivlenen orijinal (PDF) 2011-10-07 tarihinde.
- ^ Alan, C.B., Behrenfeld, M.J., Randerson, J.T. ve Falkowski, P. (1998) "Biyosferin birincil üretimi: karasal ve okyanus bileşenlerinin entegre edilmesi". Bilim, 281(5374): 237–240. doi:10.1126 / science.281.5374.237.
- ^ Maureaud, A., Gascuel, D., Colléter, M., Palomares, M.L., Du Pontavice, H., Pauly, D. ve Cheung, W.W. (2017) "Deniz besin ağlarının trofik işleyişindeki küresel değişim". PLOS ONE, 12(8): e0182826. doi:10.1371 / journal.pone.0182826
- ^ "Okyanus Asitleşmesinin Deniz Türleri ve Ekosistemler Üzerindeki Etkileri". Bildiri. OCEANA. Alındı 13 Ekim 2013.
- ^ "Arktik Okyanusu asitleşmesinin kapsamlı çalışması". Ders çalışma. ÇİÇERO. Arşivlenen orijinal 10 Aralık 2013 tarihinde. Alındı 14 Kasım 2013.
- ^ Lischka, S .; Büdenbender J .; Boxhammer T .; Riebesell U. (15 Nisan 2011). "Okyanus asitleşmesinin ve yüksek sıcaklıkların, kutup kabuklu pteropod Limacina helicina'nın erken yavruları üzerindeki etkisi: ölüm oranı, kabuk bozulması ve kabuk büyümesi" (PDF). Bildiri. Biyojeoloji. s. 919–932. Alındı 14 Kasım 2013.
- ^ "Antarktika deniz yaban hayatı tehdit altında, araştırma bulguları". BBC Doğa. Alındı 13 Ekim 2013.
- ^ Ullah, H., Nagelkerken, I., Goldenberg, S.U. ve Fordham, D.A. (2018) "İklim değişikliği, değişen trofik akışlar ve siyanobakteriyel proliferasyon yoluyla denizdeki gıda ağının çökmesine neden olabilir". PLoS biyolojisi, 16(1): e2003446. doi:10.1371 / journal.pbio.2003446
- ^ a b İklim değişikliği, deniz besin ağlarında çöküşü tetikliyor Günlük Bilim. 9 Ocak 2018.
- ^ IUCN (2018) Tehdit Altındaki Türlerin IUCN Kırmızı Listesi: Sürüm 2018-1